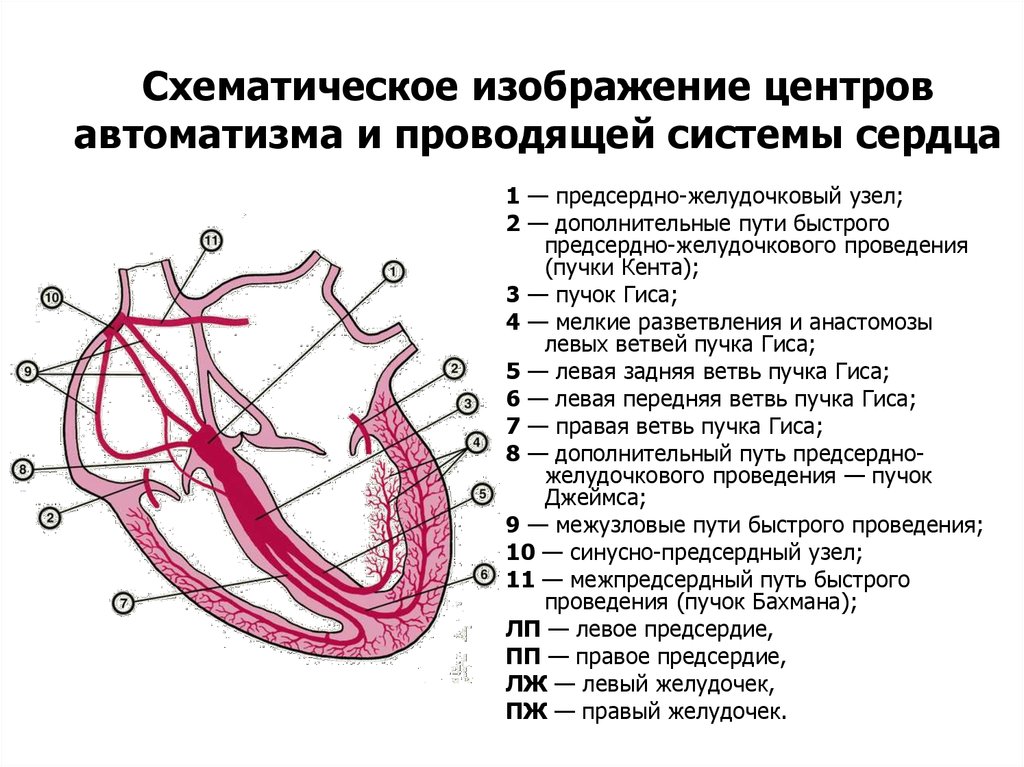
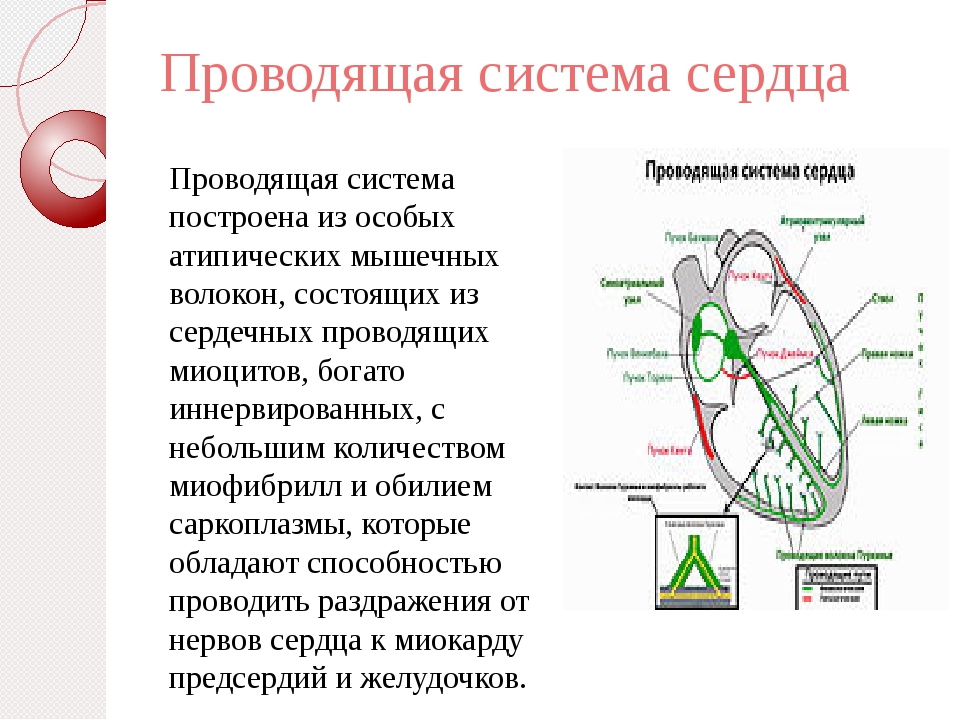
Что такое проводящая система сердца: Проводящая система сердца — это… Что такое Проводящая система сердца?
Анонсированы искусственные волокна проводящей системы сердца
Нарушения проводимости сердца впервые предложено лечить с помощью имплантации в зону поражения (например, некроза миокарда) искусственных электропроводящих волокон. Статья об этом опубликована 12 августа в журнале «Circulation: Arrhythmia and Electrophysiology». В ней коллектив исследователей из Техасского института сердца показал, как применение новой технологии может соединить поврежденный миокард и восстановить нормальную передачу электрических сигналов, необходимых для поддержания ритма сердца. Хотя в настоящее время существует множество эффективных антиаритмических препаратов, многие из них противопоказаны в конкретных клинических случаях или приводят к развитию побочных эффектов.
Электрофизиологи воспользовались разработкой Университета Райса (Хьюстон, штат Техас), в котором в 2013 году смогли разработать и произвести достаточно гибкие и тонкие углеродные нанотрубки, из которых сформировали нитевидные электропроводящие пучки.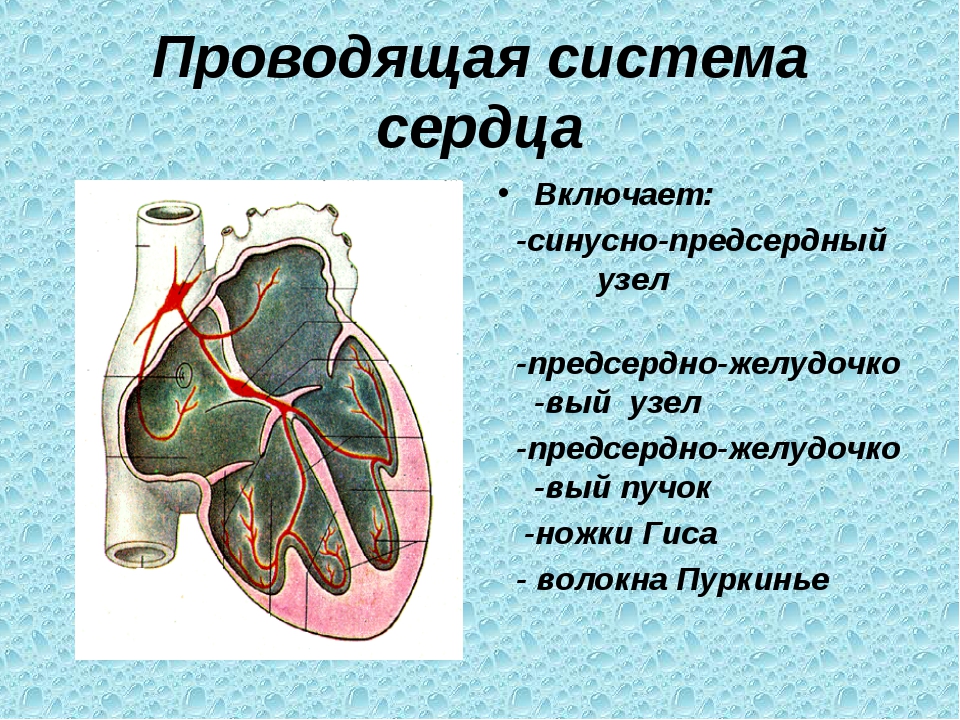
Применение такого метода лечения должно предотвратить развитие тяжелых, потенциально опасных желудочковых аритмий, у пациентов с инфарктом миокарда, хронической сердечной недостаточностью или дилатационной кардиомиопатией. Благодаря отсутствию токсичности, волокна с полимерным покрытием эффективно восстанавливают функции проводящей системы сердца на доклинических моделях, а также на грызунах. Сообщается, что будет возможна их успешная работа как при имплантированном кардиостимуляторе, так и без него.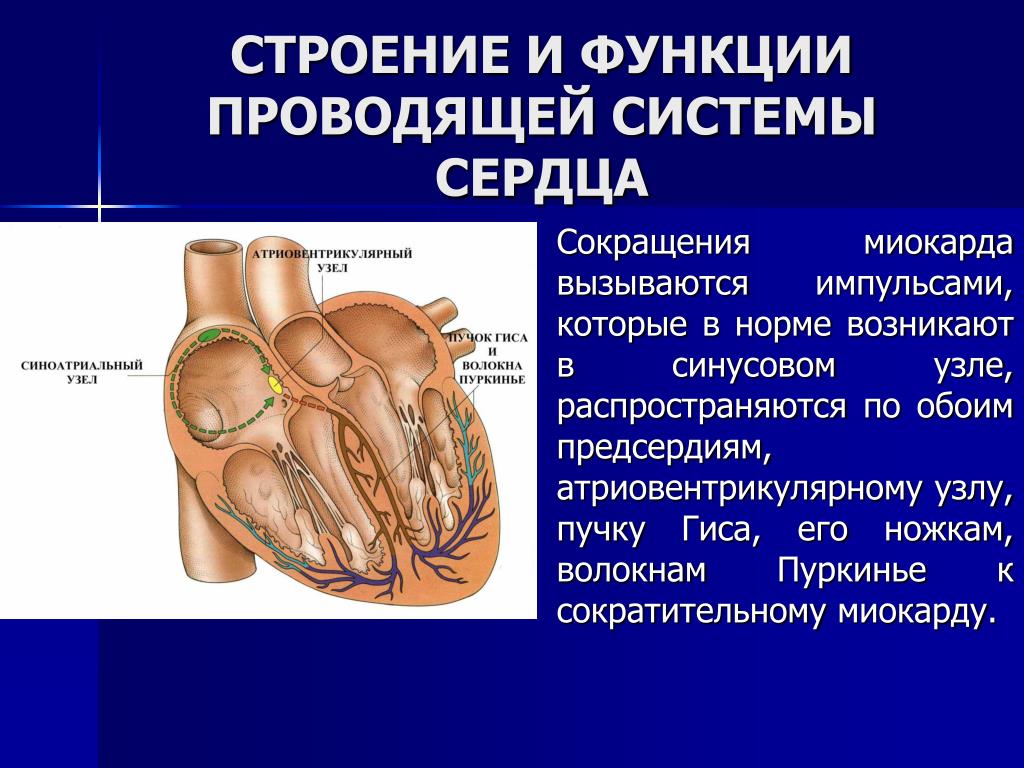
Независимые эксперты, составившие отзыв на статью, считают, что восстановление проводимости сердца с помощью углеродных волокон может совершить революцию в лечении нарушений ритма и проводимости сердца, одной из наиболее распространенных причин смерти. Отмечается, что это первый успешный эксперимент по лечению этих заболеваний с помощью протезирования проводящей системы синтетическими материалами. Однако процедура должна пройти множество проверок, прежде чем будут начаты испытания на людях: необходимо разработать способ сшивания волокон в миокарде с использованием минимально инвазивного катетера и убедиться, что волокна достаточно прочные и гибкие, чтобы выполнять свою функцию в бьющемся сердце долгое временя, а также определить оптимальные размеры, толщину и число волокон в пучке.
Источники:
https://www.sciencedaily.com/releases/2019/08/190813112207.htm
https://www.ahajournals.org/doi/10.1161/CIRCEP.119.007256
Текст подготовил: к.м.н. Круглый Л.Б.
Строение и функционирование проводящей системы сердца
Проводящая система сердца образована двумя видами специализированных клеток.
Один вид клеток (Р-клетки) обладает автоматизмом, т.е. способностью спонтанно вырабатывать электрические импульсы. Частота возникновения ипульсов зависит от места расположения Р-клеток — чем ближе находятся Р-клетки к началу проводящей системы, тем чаще возникают в них импульсы и, наоборот, чем дальше находятся Р-клетки от начала проводящей системы, тем реже могут возникать в них электрические импульсы.
Второй вид (Т-клетки) обладает проводимостью, т.е. способностью проведения возникающих импульсов к сократительному миокарду.
Проводящая система сердца начинается синусовым узлом, который расположен в верхней части правого предсердия. Его длина 10-20 мм, ширина 3-5 мм. Именно в нем возникают импульсы, которые вызывают возбуждение и сокращение всего сердца. Нормальный автоматизм синусового узла составляет 50-80 импульсов в минуту. Синусовый узел является автоматическим центром I порядка.
Нормальный автоматизм синусового узла составляет 50-80 импульсов в минуту. Синусовый узел является автоматическим центром I порядка.
Импульс, возникший в синусовом узле мгновенно распространяется по предсердиям, заставляя их сократиться. Но распространиться дальше и сразу же возбудить желудочки сердца эта волна не может, так как миокард предсердий и желудочков разделен фиброзной тканью, которая не пропускает электрические импульсы. И только в одном месте этой преграды не существует. Туда и устремляется волна возбуждения. Но именно в этом месте находится следующий узел проводящей системы, который называется
Далее нижняя часть узла, утончаясь, переходит в пучок Гиса (длина 20 мм). В последующем пучок Гиса разделяется на две ножки — правую и левую. Правая ножка проходит по правой стороне межжелудочковой перегородки и разветвляясь ее волокна (волокна Пуркинье) пронзают миокард правого желудочка. Левая ножка проходит по левой половине межжелудочковой перегородки и делится на переднюю и заднюю ветви, которые снабжают волокнами Пуркинье миокард левого желудочка. После задержки в результате прохождения атриовентрикулярного узла волна возбуждения, распространяясь по ножкам пучка Гиса и волокнам Пуркинье, мгновенно охватывает всю толщу миокарда желудочков, вызывая их сокращение. Задержка импульса имеет огромное значение и не дает сократиться предсердиям и желудочкам одновременно — сперва сокращаются предсердия, и только вслед за этим — желудочки сердца.
Левая ножка проходит по левой половине межжелудочковой перегородки и делится на переднюю и заднюю ветви, которые снабжают волокнами Пуркинье миокард левого желудочка. После задержки в результате прохождения атриовентрикулярного узла волна возбуждения, распространяясь по ножкам пучка Гиса и волокнам Пуркинье, мгновенно охватывает всю толщу миокарда желудочков, вызывая их сокращение. Задержка импульса имеет огромное значение и не дает сократиться предсердиям и желудочкам одновременно — сперва сокращаются предсердия, и только вслед за этим — желудочки сердца.
В атриовентрикулярном узле, так же как и в синусовом узле, имеются два вида клеток — Р и Т. Атриовентрикулярный узел вместе с начальной частью пучка Гиса является автоматическим центром II порядка, который может самостоятельно вырабатывать импульсы с частотой 35-50 в минуту.
Конечная часть пучка Гиса, его ножки и волокна Пуркинье также обладают автоматизмом, однако могут вырабатывать импульсы лишь с частотой 15-35 в минуту и являются автоматическим центром III порядка.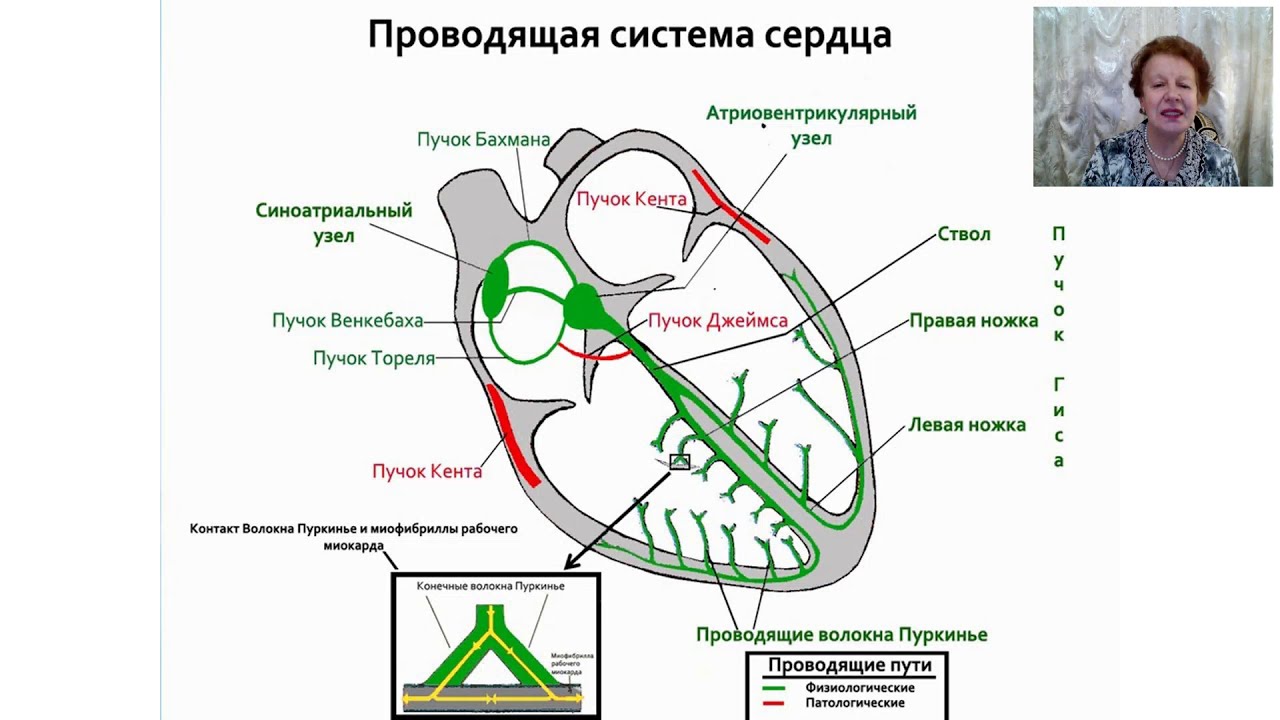
Между автоматическими центрами I, II и III порядков возникают следующие взаимодействия. В норме импульс, возникающий в синусовом узле, распространяется на предсердия и желудочки, вызывая их сокращения. Проходя на своем пути автоматические центры II и III порядков импульс каждый раз вызывает разрядку этих центров. После этого в автоматических центрах II и III порядков снова начинается подготовка очередного импульса, которая каждый раз вновь прерывается после прохождения возбуждения из синусового узла. По сути дела, в норме автоматический центр I порядка подавляет активность автоматических узлов II и III порядков. И только в случае отказа синусового узла или нарушения проведения его импульсов на нижележащие отделы включается автоматический узел II порядка, а при его отказе — автоматический узел III порядка.
Проводящая система сердца | opace.ru
Проводящая система сердца
Расположение водителей ритма(пейсмекеров) и проводящей системы сердца на фронтальном разрезе
Мускулатура предсердий и желудочков связаны проводящей системой сердца.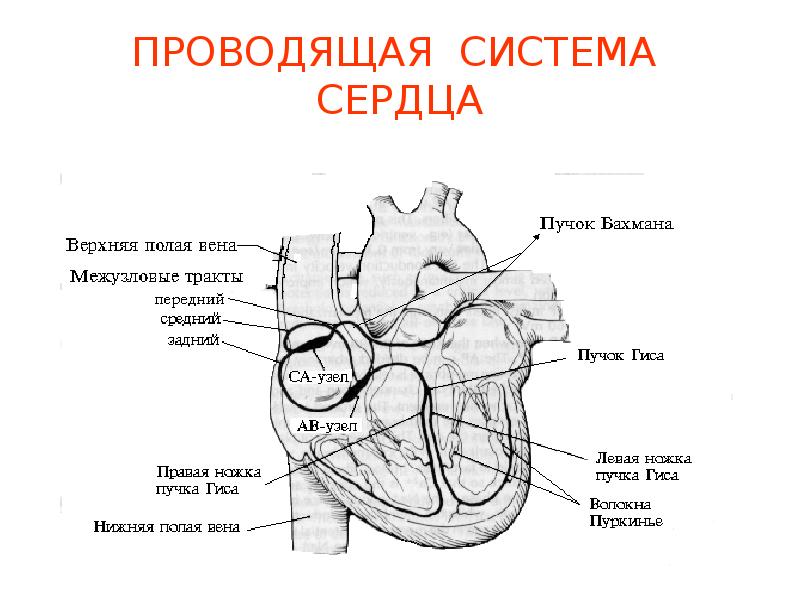

Эпикард – это висцеральный листок серозной оболочки сердца, который плотно срастается с миокардом. Основу его составляет соединительная ткань. В области основания сердца, у начала крупных сосудов. Эпикард заворачивается и переходит в пристеночный листок серозной оболочки, который входит в состав перикарда, околосердечной сумки. Между этими двумя листками образуется полость, содержащая небольшое количество жидкости, которая увлажняет поверхность сердца, уменьшая трение при его сокращениях.
Перикард – это замкнутый мешок, в котором расположено сердце, состоящий их двух пластинок: наружной – фиброзной и внутренней – серозной.
Кровоснабжение сердца осуществляется ветвями правой и левой венечных, или коронарных артерий, которые отходят от восходящей аорты сразу над полулунными клапанами.
 Ветви венечной артерии имеют очень большое количество анастомозов. Вены сердца многочисленны. Крупные вены собираются в венечный синус, а мелкие впадают непосредственно в правое предсердие.
Ветви венечной артерии имеют очень большое количество анастомозов. Вены сердца многочисленны. Крупные вены собираются в венечный синус, а мелкие впадают непосредственно в правое предсердие.Лимфатические сосуды сердца делятся на поверхностные и глубокие, широко анастомозирующие между собой. Поверхностные сосуды располагаются под эпикардом, а глубокие образуют сеть под эндокардом и в толще миокарда. Они впадают в передние и задние лимфатические узлы средостения.
Нарушения внутрисердечной проводимости, сердечные блокады
01.11.2021
Статья проверена врачом-кардиологом высшей категории Курбатовой И.В., носит общий информационный характер, не заменяет консультацию специалиста.
Для рекомендаций по диагностике и лечению необходима консультация врача.
В Клиническом госпитале на Яузе осуществляется выявлениеблокад сердца и устанавливаются их причины (ЭКГ, ЭХО-КГ, биохимия крови, консультации кардиолога, кардиохирурга — аритмолога, смежных специалистов). Проводится подбор лекарственной терапии, при необходимости — современные кардиохирургические операции, имплантация двухкамерных кардиостимуляторов.
Сердечный ритм формируют клетки, генерирующие электрический импульс. Они собраны в синусовый узел. К различным участкам миокарда импульс «доставляется» особыми клетками, собранными в пучки, формирующие проводящую систему сердца. Ее ветви, ведущие к желудочкам сердца, называются правой и левой ножками пучка Гиса.
В зависимости от степени нарушения прохождения импульса по проводящей системе, говорят о полной блокаде, неполной блокаде или о преходящей блокаде сердца.
В зависимости от уровня поражения выделяют атриовентрикулярную — АВ блокаду, когда нарушено прохождение импульса между предсердиями и желудочками сердца, и блокады ножек пучка Гиса, когда затруднено распространение сигнала по желудочкам сердца.
Записаться к кардиологу
Причины сердечных блокад
- Повышение тонуса парасимпатической нервной системы.
- Изменения в миокарде — кардиосклероз, ИБС, в том числе перенесенный инфаркт миокарда, эндо- и миокардиты и пр.
- Медикаментозные.
Симптомы нарушения внутрисердечной проводимости
- Блокадымогут не чувствоваться вообще и фиксироваться только на ЭКГ при обследовании (бессимптомное течение).
- Может возникать аритмия (нарушение ритма сердца) с соответствующими симптомами — перебоями в работе сердца, его замиранием, головокружениями, внезапной слабостью, вплоть до обморока, проявлениями недостаточности кровообращения (одышка, боль за грудиной).

Диагностика сердечных блокад
- Электрокадиография и холтеровскоемониторирование выявляет нарушения сердечной проводимости.
- Велоэргометрия уточняет условия возникновения блокад.
- Эхокардиография, КТ-коронарография устанавливают степень и причину поражения миокарда.
- Исследование биохимических показателей крови позволяет уточнить характер процесса, приводящего к поражению сердечной мышцы.
Лечение нарушений внутрисердечной проводимости
Эффективное лечение блокад сердца включает:
- Лечение основного заболевания, явившегося причиной нарушения проводимости.
- Тщательно подобранную консервативную лекарственную терапию.
- Хирургическое лечение. Имплантация водителя ритма, который в нужный момент восстанавливает нормальную частоту сердечных сокращений.
В Клиническом госпитале на Яузе фармакотерапия нарушений проводимости и других аритмий проводится под наблюдением опытных врачей-кардиологов, а вопрос о хирургическом лечении, выборе типа ЭКС, решается в ходе консультации ведущего кардиохирурга — аритмолога профессора А. В. Ардашева.
В. Ардашева.
Стоимость услуг
Записаться на прием
Цены на услуги Вы можете посмотреть в прайсе или уточнить по телефону, указанному на сайте.
Литература:
Гуревич М.А. Блокада сердца // Большая российская энциклопедия. 2004.
Бокерия Л.А., Ревишвили А.Ш. Катетерная абляция тахиаритмий: современное состояние проблемы и перспективы развития // Вестник аритмологии. 1988..
Строение сердца человека и особенности его работы. Пройдите обследование своего сердца в МЕДСИ
Сердце человека располагается в грудной клетке, ориентировочно в центре с небольшим смещением влево.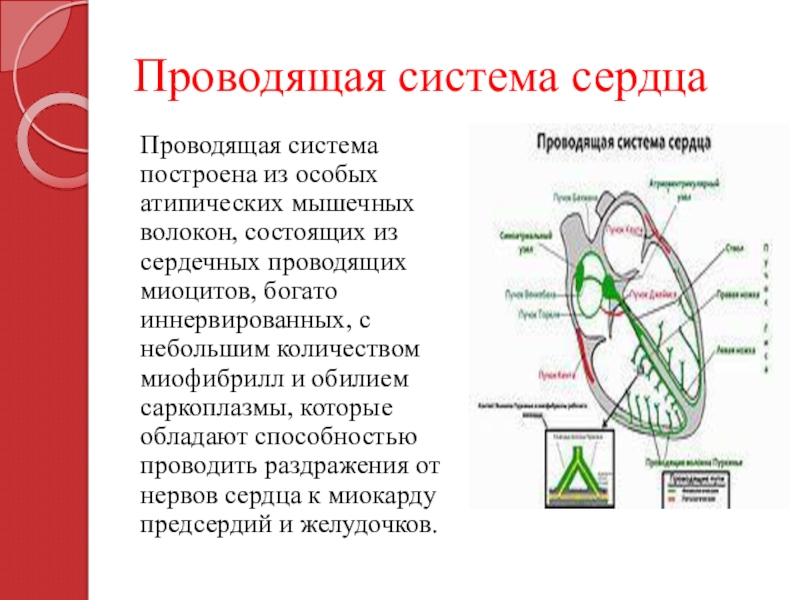 Представляет собой полый мышечный орган. Снаружи окружено оболочкой – перикардом (околосердечной сумкой). Между сердцем и околосердечной сумкой находится жидкость, увлажняющая сердце и уменьшающая трение при его сокращениях.
Представляет собой полый мышечный орган. Снаружи окружено оболочкой – перикардом (околосердечной сумкой). Между сердцем и околосердечной сумкой находится жидкость, увлажняющая сердце и уменьшающая трение при его сокращениях.
Сердце разделено на четыре камеры: две правые – правое предсердие и правый желудочек, и две левые – левое предсердие и левый желудочек. В норме правая и левая половины сердца между собой не сообщаются. При врожденных пороках в межпредсердной и межжелудочковой перегородках могут сохраняться отверстия, через которые кровь попадает из одной половины сердца в другую. Предсердия и желудочки соединяются между собой отверстиями.
По краям отверстий располагаются створчатые клапаны сердца: справа – трехстворчатый, слева – двустворчатый, или митральный. Двустворчатый и трехстворчатый клапаны обеспечивают ток крови в одном направлении – из предсердий в желудочки. Между левым желудочком и отходящей от него аортой, а также между правым желудочком и отходящей от него легочной артерией тоже имеются клапаны. Из-за формы створок они названы полулунными. Каждый полулунный клапан состоит из трех листков, напоминающих кармашки. Свободным краем кармашки обращены в просвет сосудов. Полулунные клапаны обеспечивают ток крови только в одном направлении – из желудочков в аорту и легочную артерию.
Из-за формы створок они названы полулунными. Каждый полулунный клапан состоит из трех листков, напоминающих кармашки. Свободным краем кармашки обращены в просвет сосудов. Полулунные клапаны обеспечивают ток крови только в одном направлении – из желудочков в аорту и легочную артерию.
Работа сердца включает две фазы: сокращение (систола) и расслабление (диастола). Сердечный цикл состоит из сокращения предсердий, сокращения желудочков и последующего расслабления предсердий и желудочков. Сокращение предсердий длится 0,1 сек, сокращение желудочков – 0,3 сек.
-
Во время диастолы: левое предсердие наполняется кровью, через митральное отверстие кровь перетекает в левый желудочек, во время сокращения левого желудочка кровь выталкивается через аортальный клапан, попадает в аорту и разноситься по всем органам. В органах происходит передача кислорода тканям организма, для их питания. Далее кровь по венам собирается в правое предсердие, через трикуспидальный клапан попадает в правый желудочек.

-
Во время систолы желудочков: венозная кровь выталкивается в легочную артерию и попадает в сосуды легких. В легких кровь оксигенируется, то есть насыщается кислородом. Насыщенная кислородом кровь через легочные вены собирается в левое предсердие.
Ритмичное, постоянное чередование фаз систолы и диастолы, необходимое для нормальной работы, обеспечивается возникновением и проведением электрического импульса по системе особых клеток – по узлам и волокнам проводящей системы сердца. Импульсы возникают вначале в самом верхнем, так называемом, синусовом узле, который располагается в правом предсердии, далее проходят ко второму, атрио-вентрикулярному узлу, а от него – по более тонким волокнам (ножкам пучка Гиса) – к мышце правого и левого желудочков, вызывая сокращение всей их мускулатуры.
Самому сердцу, как и любому другому органу для питания и нормальной деятельности требуется кислород.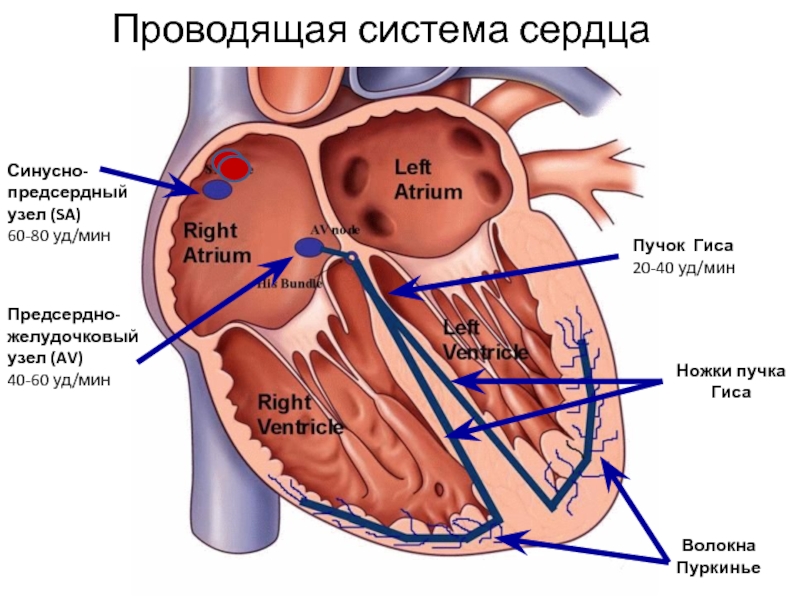 К сердечной мышце он доставляется по собственным сосудам сердца – коронарным. Иногда эти артерии называют венечными.
К сердечной мышце он доставляется по собственным сосудам сердца – коронарным. Иногда эти артерии называют венечными.
Коронарные сосуды отходят от основания аорты. Делятся на правую коронарную артерию и левую коронарную артерию. Левая коронарная артерия в свою очередь разделяется на переднюю межжелудочковую и огибающую артерии. Правая коронарная артерия кровоснабжает стенки правого предсердия и желудочка, заднюю часть межжелудочковой перегородки и заднюю стенку левого желудочка, синусовый и атриовентрикулярный узел. Левая коронарная артерия снабжает кровью переднюю часть межжелудочковой перегородки, переднюю и боковую стенки левого желудочка, левое предсердие.
Нормальная частота сердечных сокращений колеблется от 55 до 85 в мин. При нагрузке частота закономерно увеличивается. Определить частоту сердечных сокращений можно по пульсу.
Пульс – это колебания артериальной стенки, возникающие при каждом сокращении сердца.
Движение крови по сосудам зависит от создаваемого сердцем давления в момент выброса крови и сопротивления стенок сосудов току крови. Давление в аорте в момент сокращения желудочков сердца является максимальным, и называется систолическим. Во время расслабления в левом желудочке сохраняется остаточное давление, которое называется диастолическим. На величину кровяного давления влияют просвет кровеносных сосудов, вязкость крови, количество циркулирующей в сосудах крови. По мере удаления от сердца давление крови уменьшается и становится наименьшим в венах. Разность между высоким давлением крови в аорте и низким давлением в полых венах обеспечивает непрерывный ток крови по сосудам.
Проводящая система сердца — презентация онлайн
ЗАПАДНО-КАЗАХСТАНСКИЙ ВЫСШИЙ МЕДИЦИНСКИЙ КОЛЛЕДЖПроводящая система
сердца это сложное
нервно-мышечное
образование,
обеспечивающее его
ритмическую работу.
Клетки проводящей
системы производят и
передают ритмические
импульсы возбуждения на
мышцы предсердий и
желудочков, вызывая их
сокращение.
Синуснопредсердный
узел
Волокна
Пуркинье
Компонен
ты
Пучок Гиса
Предсердножелудочковы
й узел
Синусно-предсердный узел (
синусовый или синоатриальный ) —
источник возникновения
электрических импульсов. Слово
дословно означает “синус” (пазуха или
полость) Узел эллипсовидной формы,
длиной 10-15, толщиной 1,5 мм. Узел
расположен в верхней части правого
предсердия, между местом впадения
верхней и нижней полой вены.
Именно здесь импульсы возникают и
отсюда распространяются по сердцу
(рисунок с анимацией).
Предсердно-желудочковый узел (атриовентрикулярный) является “фильтром” для импульсов
из предсердий. Он расположен в толще межжелудочковой перегородки на границе предсердий и
желудочков.
Он состоит из двух типов клеток — Р и Т. В нем можно выделить три части:
-AN (antrum-nodus) — зона перехода от предсердных кардиомиоцитов к
атриовентрикулярному узлу;
-N (nodus) — собственно атриовентрикулярный узел;
-NH (nodus-his) — переход от узла к общему стволу пучка Гиса.
В узле самая низкая скорость распространения электрических импульсов во всей проводящей
системе сердца. Задержка импульса необходима, чтобы предсердия успели сократиться
раньше и перекачать кровь в желудочки.
Пучок Гиса ( предсердно-желудочковый пучок) не
имеет четкой границы с атриовентрикулярным
узлом, проходит в межжелудочковой перегородке
(пенетрирующая часть), разделяется на две
ножки, идущие к левому и правому желудочками.
Их волокна (волокна Пуркинье) непосредственно
контактируют с клетками сократимого
миокарда. Пенетрирующая часть не имеет
контактов с волокнами миокарда.
Поскольку левый желудочек работает
интенсивнее и больше по размерам, то левой
ножке приходится разделиться на две ветви —
переднюю и заднюю.
Первый тип проводящих миоцитов — это P-клетки, или пейсмейкерные миоциты — водители
ритма. Они светлые, мелкие. Они главный источник электрических импульсов,
обеспечивающих ритмическое сокращение сердца. Высокое содержание свободного Ca в
цитоплазме этих клеток обусловливает способность клеток генерировать импульсы к
сокращению. Поступление необходимой энергии обеспечивается преимущественно
процессами анаэробного гликолиза.
Основную часть составляет
второй тип – переходные
клетки ( Т–клетки). Это
тонкие, вытянутые клетки.
Миофибриллы более развиты.
Переходные клетки
сообщаются между собой с
помощью простых контактов
и вставочных дисков.
Переходные клетки передают
возбуждение от Р-клеток к
клеткам пучка и рабочего
миокарда.
Волокна Пуркинье- третий тип клеток,они связывают конечные разветвления ножек и ветвей
пучка Гиса с сократительным миокардом желудочков. Содержат длинные миофибриллы,
имеющие спиралевидный ход. Являются передатчиками возбуждения от переходных клеток к
клеткам рабочего миокарда желудочков. Имеют крупные размеры, имеют тонкие миофибриллы.
Основным узлом, подавляющим и контролирующим функцию остальных элементов
проводящей системы, является синусовый узел. Генерируемые в нем через равные
промежутки времени электрические импульсы распространяются по сердечной мышце
предсердий и к следующему узлу, называемому предсердно-желудочковым, или
атриовентрикулярным.
От атриовентрикулярного узла импульс распространяется по ножкам к пучкам Гиса и
волокнам Пуркинье к миокарду правого и левого желудочков, соответственно. Работа
проводящей системы сердца построена таким образом, что вначале происходит
сокращение предсердий, а потом желудочков сердца. Из-за очень высокой скорости
распространения импульсов происходит одновременное возбуждение и последующее
сокращение всех мышечных волокон.
Раздражение нервных волокон, окружающих проводящую систему,
а также нервов, подходящих к сердцу, вызывает изменение ритма
сердечных сокращений.
решающую роль нервной системы в ритме сердечной
деятельности, а следовательно, и в передаче импульсов по
проводящей системе.
Сердце обладает хорошо развитой многоступенчатой системой
регуляции, приспосабливающей его деятельность к постоянно
меняющимся условиям функционирования системы
кровообращения и потребностям организма. Внутрисердечная
регуляция сердца — импульсы возбуждения возникают в сердце под
влиянием протекающих в нем самом процессов. Это явление
получило название автоматии. Регуляция и координация
сократительной функции сердца осуществляются его проводящей
системой, центрами которой являются два узла: синуснопредсердный узел (узел Киса-Флека) и предсердно-желудочковый
узел (узел Ашоффа-Тавары).
1. Проводящая система сердца:
Выполните тестовые задания
А. автоматически вызывает сокращение сердца
Б. Кровоснабжает миокард
В. Регулирует последовательность сокращений предсердий и желудочков
2.К проводящей системе сердца относится:
А. симпатический нерв
Б. синусный и предсердножелудочковый узел
В. Полулунный клапан
3.Выберите верный порядок расположения частей ведущей системы сердца
А. Кардиальные волокна – предсердно-желудочковый пучок-пазухо-предсердный узел-предсердно-желудочковый
узел
Б. пазухо-предсердный узел-предсердно-желудочковый пучок-кардиальные волокна-предсердно-желудочковый узел
В. пазухо-предсердный узел-предсердно-желудочковый-предсердно-желудочковый пучок-кардиальные волокна
4. Назовите часть проводящей системы что называется *водителем* сердечного ритма в норме
А. кардиальные волокна
Б. предсердно-желудочковый пучок
В. пазухо-предсердный узел
5.Назовите часть миокарда, где расположен пазухо-предсердный узел
А. В стенке правого предсердия
Б. под эндокардом в нижней части межпредсердной перегородки
В. Рабочий миокард желудочков, сосочкообразные мышцы
6. Назовите часть миокарда где расположен предсердно-желудочковый узел
А. в стенке правого предсердия
Б. под эндокардом в нижней части межпредсердной перегородки
В. Межжелудочковая перегородка
7. Часть проводящей системы сердца, называемая узлом Ашофф-Тавара
А. кардиальные волокна
Б. предсердно-желудочковый пучок
В. предсердно-желудочковый узел
8. Часть проводящей системы сердца, называемая узлом Киса-Флака
А. кардиальные волокна
Б. предсердно-желудочковый пучок
В. Пазухо-предсердный узел
9.Назовите ученого в честь которого названы пидендокардиальные волокна
проводящей системы сердца
А. Вильгельм Гис
Б. Ян Пуркинье
В. Гарвей
10. 9.Назовите ученого в честь которого названы предсердно желудочковый
пучок проводящей системы сердца
А. Вильгельм Гис
Б. Ян Пуркинье
В. Гарвей
Спасибо за внимание !
Проводящая система сердца: строение и функции
Кроме насосной функции, обеспечивающей беспрестанное движение крови по сосудам, сердце обладает другими важными функциями, которые делают его уникальным органом.
Сам себе хозяин или функция автоматизма
СА-узел
Сердечные клетки способны сами вырабатывать или генерировать электрические импульсы. Эта функция наделяет сердце некой степенью свободы или автономности: мышечные клетки сердца независимо от прочих органов и систем человеческого тела способны сокращаться с определённой частотой. Напомним, что частота сокращений в норме от 60 до 90 ударов в минуту. Но все ли сердечные клетки наделены данной функцией?
Нет, в сердце существует особая система, которая включает специальные клетки, узлы, пучки и волокна — это проводящая система. Клетки проводящей системы — это клетки сердечной мышцы, кардиомиоциты, но только необычные или атипичные, называются они так, поскольку способны вырабатывать и проводить импульс к другим клеткам.
1. СА-узел. Синоатриальный узел или центр автоматизма первого порядка еще могут называть синусовым, синусно-предсердным, либо узлом Киса-Флека. Расположен в верхней части правого предсердия в синусе полых вен. Это важнейший центр проводящей системы сердца, потому что в нем есть клетки-пейсмекеры (pacemaker или P-клетки), которые и генерируют электрический импульс. Возникающий импульс обеспечивает формирование между кардиомиоцитами потенциала действия, формируется возбуждение и сердечное сокращение. Синоатриальный узел, как и другие отделы проводящей системы, обладает автоматизмом. Но именно СА-узел обладает автоматизмом в большей степени, и в норме он подавляет все другие очаги возникающего возбуждения. Т.е Помимо Р-клеток, в узле есть ещё Т-клетки, которые проводят возникший импульс к предсердиям.
Межузловые тракты
2. Проводящие пути. От синусового узла возникшее возбуждение передаётся по межпредсердному пучку и межузловым трактам. 3 межузловых тракта — передний, средний, задний могут еще сокращённо обозначать латинскими буквами по первой букве фамилии учёных, описавших эти структуры. Передний обозначают буквой B (описал данный тракт немецкий учёный Bachman), средний — W (в честь патологоанатома Wenckebach, задний — T (по первой букве изучавшего задний пучок учёного Thorel). Межпредсердный пучок соединяет правое предсердие с левым при передаче возбуждения, межузловые тракты несут возбуждение от синусового узла к следующему звену проводящей системы сердца со скоростью около 1 м/с.
3. АВ-узел. Атриовентрикулярный узел (по автору узел Ашофа-Тавара) находится внизу правого предсердия у межпредсердной перегородки, причём располагается он чуть вдаваясь в перегородку между верхними и нижними сердечными камерами. Этот элемент проводящей системы имеет относительно немаленькие размеры 2×5 мм. В АВ-узле проводимость возбуждения затормаживается примерно на 0,02-0,08 сек. И природа эту задержку предусмотрела не зря: замедление импульсации необходимо сердцу для того, чтобы верхние сердечные камеры успели сократиться и переместить кровь в желудочки. Время проведения импульса по атриовентрикулярному узлу равно 2-6 см/c. — это самая низкая скорость распространения импульсации. Представлен узел Р- и Т-клетками, причём Р-клеток значительно меньше, чем Т-клеток.
Проводящая система сердца. Пучок Гиса
4. Пучок Гиса. Он располагается ниже АВ-узла (чёткой грани между ними провести не удаётся) и анатомически делится на две ветви или ножки. Правая ножка является продолжением пучка, а левая отдаёт заднюю и переднюю ветви. Каждая из вышеописанных ветвей отдаёт маленькие, тонкие, ветвящиеся волокна, которые называются волокнами Пуркинье. Скорость импульсации пучка — 1 м/c., ножек — 3-5м/с.
5. Волокна Пуркинье — заключительный элемент проводящей системы сердца.
В клинической врачебной практике часто встречаются случаи нарушения в работе проводящей системы в области передней веточки левой ножки и правой ножки тракта Гиса, также нередко встречаются нарушения работы синусного узла сердечной мышцы. При «поломке» синусового узла, АВ-узла развиваются различные блокады. Нарушение работы проводящей системы может приводить к возникновению аритмий.
Такова физиология и анатомическое строение проводящей нервной системы. Также можно обособить конкретные функции проводящей системы. Когда ясны функции, становится очевидным важность данной системы.
Функции автономной сердечной системы
Центры автоматизма работы сердца
1) Генерация импульсов. Синусный узел является центром автоматизма 1 порядка. В здоровом сердце синоатриальный узел — лидер по выработке электрических импульсов, обеспечивающий частоту и ритмичность сердечных толчков. Основная его функция — выработка импульсов с нормальной частотой. Синусный узел задаёт тон частоте сердечных толчков. Импульсы он вырабатывает с ритмом 60-90 ударов в минуту. Именно такая ЧСС для человека является нормой.
Атриовентрикулярный узел является центром автоматизма 2 порядка, он производит импульсы 40-50 в минуту. Если синусный узел по той или иной причине выключается из работы и не может главенствовать в работе проводящей системы сердца, его функцию берет на себя АВ-узел. Он становится «главным» источником автоматизма. Пучок Гиса и волокна Пуркинье — центры 3-го порядка, в них происходит импульсация с частотой 20 в минуту. Если 1 и 2 центры выходят из строя, центр 3-го порядка берёт на себя главенствующую роль.
2) Подавление возникающей импульсации из других патологических источников. Проводящая система сердца «фильтрует и выключает» патологическую импульсацию из других очагов, добавочных узлов, которые в норме не должны быть активны. Так поддерживается нормальная физиологическая сердечная деятельность.
3) Проведение возбуждения от вышележащих отделов к нижележащим или нисходящее проведение импульсов. В норме возбуждение охватывает сначала верхние сердечные камеры, а затем желудочки, за это также ответственны центры автоматизма и проводящие тракты. Восходящее проведение импульсов в здоровом сердце невозможно.
Самозванцы проводящей системы
Дополнительные пучки проводящей системы
Нормальную сердечную деятельность обеспечивают вышеописанные элементы проводящей системы сердца, но при патологических процессах в сердце могут активироваться дополнительные пучки проводящей системы и примерять на себя роль основных. Дополнительные пучки в здоровом сердце не активны. При некоторых заболеваниях сердца они активизируются, что вызывает нарушения сердечной деятельности, проводимости. К таким «самозванцам», нарушающим нормальную сердечную возбудимость, относят пучок Кента (правый и левый), Джеймса.
Пучок Кента связывает верхние и нижние сердечные камеры. Пучок Джеймса связывает центр автоматизма 1 порядка с нижележащими отделами также в обход АВ-центра. Если эти пучки активны, они как бы «выключают» АВ-узел из работы, и возбуждение идет через них на желудочки намного быстрее, чем это положено в норме. Формируется так называемый обходной путь, по которому импульсация приходит в нижние сердечные камеры.
А поскольку путь прохождения импульса через добавочные пучки короче, чем в норме, желудочки возбуждаются раньше, чем должны — процесс возбуждения сердечной мышцы нарушается. Чаще такие нарушения фиксируются у мужчин (но женщины также могут их иметь) в виде синдрома WPW, либо при других сердечных проблемах — аномалии Эбштейна, пролапсе двустворчатого клапана. Активность таких «самозванцев» не всегда клинически выражена, особенно в молодом возрасте, может стать случайной ЭКГ-находкой.
Пучок Кента
А если клинические проявления патологической активации дополнительных трактов проводящей системы сердца присутствуют, то они проявляют себя в виде учащённого, неритмичного сердцебиения, ощущения провалов в области сердца, головокружения. Диагностируют такое состояние при помощи ЭКГ, холтеровского мониторирования. Бывает, что могут функционировать как нормальный центр проводящей системы — АВ-узел, так и дополнительный. В этом случае на ЭКГ-приборе будет регистрироваться оба пути импульсации: нормальный и патологический.
Тактика лечения пациентов с нарушениями проводящей системы сердца в виде активных дополнительных трактов индивидуальна в зависимости от клинических проявлений, тяжести заболевания. Лечение может быть как медикаментозным, так и хирургическим. Из хирургических методов на сегодняшний день популярен и наиболее эффективен метод разрушения зон патологической импульсации электрическим током при помощи специального катетера — радиочастотная абляция. Этот метод еще и щадящий, поскольку позволяет избежать операции на открытом сердце.
Проводящая система сердца — связка его — узел SA
Сердечная проводящая система представляет собой совокупность узлов и специализированных проводящих клеток, которые инициируют и координируют сокращение сердечной мышцы. Он состоит из:
- Синоатриальный узел
- Атриовентрикулярный узел
- Предсердно-желудочковый пучок (пучок Гиса)
- Волокна Пуркинье
В этой статье мы рассмотрим анатомию проводящей системы сердца — ее структуру, функции и клинические взаимосвязи.
Обзор сердечной проводимости
Рис. 1. Анимация распространения проводимости через сердце [/ caption]Последовательность электрических событий во время одного полного сокращения сердечной мышцы:
- Сигнал возбуждения (потенциал действия) создается синоатриальным (SA) узлом .
- Волна возбуждения распространяется по предсердиям, заставляя их сокращаться.
- При достижении атриовентрикулярного (АВ) узла сигнал задерживается.
- Затем он проводится в пучок His по межжелудочковой перегородке.
- Пучок His и волокон Пуркинье распространяют волновые импульсы по желудочкам, заставляя их сокращаться.
Теперь мы обсудим анатомию отдельных компонентов, участвующих в проводящей системе.
Компоненты системы проводимости сердца
Синоатриальный узел
Синоатриальный (SA) узел представляет собой совокупность специализированных клеток (пейсмекерных клеток) и расположен в верхней стенке правого предсердия, в месте соединения верхней полой вены.
Эти кардиостимуляторы могут спонтанно генерировать электрических импульсов . Волна возбуждения, создаваемая узлом SA, распространяется через щелевые соединения через оба предсердия, в результате чего происходит сокращение предсердий (систола предсердий) — кровь движется из предсердий в желудочки.
Скорость, с которой узел SA генерирует импульсы, зависит от вегетативной нервной системы:
- Симпатическая нервная система — увеличивает частоту возбуждения СА-узла и, таким образом, увеличивает частоту сердечных сокращений.
- Парасимпатическая нервная система — снижает частоту возбуждения СА-узла и, таким образом, снижает частоту сердечных сокращений.
Атриовентрикулярный узел
После того, как электрические импульсы распространяются по предсердиям, они сходятся в атриовентрикулярном узле — расположенном внутри предсердно-желудочковой перегородки, рядом с отверстием коронарного синуса.
Атриовентрикулярный узел задерживает импульсы примерно на 120 мс , чтобы у предсердий было достаточно времени для полного выброса крови в желудочки до систолы желудочков.
Затем волна возбуждения переходит от атриовентрикулярного узла в атриовентрикулярный пучок.
Атриовентрикулярный пучок
Атриовентрикулярный пучок (пучок Гиса) является продолжением специализированной ткани АВ-узла и служит для передачи электрического импульса от АВ-узла к волокнам Пуркинье желудочков.
Он спускается вниз по перепончатой части межжелудочковой перегородки, прежде чем разделиться на два основных пучка:
- Правая ножка пучка Гиса — проводит импульс к волокнам Пуркинье правого желудочка
- Левая ножка пучка Гиса — проводит импульс к волокнам Пуркинье левого желудочка.
Волокна Пуркинье
Волокна Пуркинье (субэндокардиальное сплетение проводящих клеток) представляют собой сеть специализированных клеток. Они богаты гликогеном и имеют обширные щелевые контакты.
Эти клетки расположены на субэндокардиальной поверхности стенок желудочков и способны быстро передавать сердечные потенциалы действия от предсердно-желудочкового пучка к миокарду желудочков.
Такое быстрое проведение обеспечивает координированных сокращений желудочков (систола желудочков), и кровь перемещается из правого и левого желудочков в легочную артерию и аорту соответственно.
[старт-клиника]
Клиническая значимость: искусственный кардиостимулятор
Искусственный кардиостимулятор — это небольшое электрическое устройство, обычно используемое для отслеживания и коррекции частоты сердечных сокращений и ритма. Он вводится в грудную клетку под левой ключицей с помощью проводов, соединенных с сердцем через венозную систему.
Наиболее частым показанием для кардиостимулятора является брадикардия . После установки кардиостимулятор контролирует частоту сердечных сокращений и срабатывает только в том случае, если частота становится слишком низкой. Кардиостимуляторы также могут использоваться для лечения некоторых видов тахикардии, определенных типов сердечной блокады и других нарушений ритма.
Рис. 3. Существуют различные типы кардиостимуляторов; наиболее распространены двухкамерные и однокамерные. [/ caption][окончание клинической]
Проводящая система сердца — обзор
Морфология и иммуногистохимия иннервации синоатриального узла у людей и других млекопитающих
Все области CCS обладают значительно более высокой плотностью нервных волокон, чем прилегающий рабочий миокард. 3,20,38,39 SAN определяется как наиболее плотно иннервируемая область CCS человека. 3 Самая высокая плотность нервных волокон, иммунореактивных для продукта гена общего нейронального маркера белка (PGP) 9,5, также наблюдалась в SAN морской свинки по сравнению со значительно более низкой плотностью нервных волокон в окружающем правом предсердии. 8 Более чем в три раза более высокая плотность иммунореактивной иннервации PGP 9.5 по сравнению с окружающим миокардом предсердий подтверждена в сердце свиньи. 20
Флуоресцентная иммуногистохимия показала, что SAN CM мыши, положительные по HCN4, сопровождаются плотной мелкой сеткой нервных волокон. Тонкие и узкие HCN4-иммунореактивные миоциты из основной массы SAN простираются в сторону правого предсердия, корня правой ЛВ и корня хвостовой вены (рис. 37.3). По сравнению с областями правого предсердия, прилегающими к корню правой черепной вены (правая черепная вена, преобладающая у многих видов млекопитающих, соответствует ВПВ у человека), плотность нервных волокон среди клеток кардиостимулятора, положительных по HCN4, составляет от трех до трех. в четыре раза выше. 9
Плотность нервных волокон и их фенотипы различаются между зонами SAN, и такая изменчивость зависит от вида. 8,20,21,38 Значительно больше нервных волокон распределено в центральной зоне человеческого SAN, окружающей узловую артерию, по сравнению с узловой периферией, включая периваскулярную иннервацию мелких артерий и артериол в миокарде предсердий. 3 Однако не было обнаружено значительных различий в общей процентной доле окрашенной области нервов, иммунореактивных в отношении PGP 9.5 между центральной и периферической узловыми областями сердца свиньи. 20
Данные электронной микроскопии убедительно демонстрируют, что все нервные волокна, идентифицированные в SAN мыши, состоят исключительно из немиелинизированных нервных волокон и включают аксоны с холинергическими и адренергическими нейротрансмиттерами. 9 Аксоны в немиелинизированных нервных волокнах имеют варикозное расширение вен с большим количеством круглых, маленьких, прозрачных и нескольких пузырьков с плотным ядром. У ряда немиелинизированных нервных волокон есть аксоны, которые не полностью покрыты шванновскими клетками, а фрагмент их плазматической мембраны находится в прямом контакте с базальной пластинкой, окружающей все немиелинизированное нервное волокно (рис.37,4). Эти немиелинизированные нервные волокна имеют варикозное расширение вен и регулярно распространяются в непосредственной близости от кардиостимуляторов. 9 Плотность нервных волокон в отдельных зонах корня правой черепной вены (SVC, у человека) значительно выше, чем в соседних зонах предсердий, что хорошо коррелирует между соответствующими данными флуоресцентной и электронной микроскопии. Немиелинизированные нервные волокна с многочисленными варикозными узлами аксонов расположены преимущественно вблизи кардиостимуляторов.Ближайшие немиелинизированные нервные волокна расположены на расстоянии 0,06 мкм от кардиостимуляторов, но иногда некоторые были на расстоянии 2 мкм или более от таких клеток. В SAN мыши среднее расстояние между клетками водителя ритма и немиелинизированными нервными волокнами составляет менее 0,5 мкм, 9 , тогда как в SAN морской свинки оно составляет всего около 80 нм. 40 Клетки SAN тесно связаны по крайней мере с одним немиелинизированным нервным волокном или аксоном, но большинство этих клеток обычно находятся в непосредственной близости от двух-трех немиелинизированных нервных волокон. 9
Нервные волокна, иммунореактивные по отношению к тирозингидроксилазе (TH), наблюдаются в крупных нервах, идущих рядом с AChE-положительными нервами, расположенными в узловой ткани, но близко к границе с мускулатурой предсердия, а также на узловых поверхностях, прилегающих к обеим SVC и конечный гребень. 20 TH иммунореактивность обнаруживается в значительно меньшей доле нервов и нервных волокон, чем для активности AChE, что составляет примерно 30% от общей узловой иннервации в сердцах свиней.Аксональные профили иммунореактивности TH распределяются по нервам, которые также обладают AChE-положительными волокнами. 20 TH-иммунореактивные нервы составляли 40–45% от общей иннервации SAN, как показывает иммунореактивность PGP 9.5 в сердце морской свинки; однако, в отличие от AChE-положительных нервов, большое количество TH-иммунореактивных нервов связано с периваскулярными сплетениями как внутри, так и вокруг SAN. 8 Сеть, богатая как холинергическими, так и адренергическими нервными волокнами и обладающая аксонами с большим количеством варикозных расширений, заполняет область SAN мыши.Холинацетилтрансфераза (ChAT) -иммунореактивные и TH-иммунореактивные нервные волокна одинаково распространены в SAN мыши. 9
Нейропептид Y (NPY) — иммунореактивные нервы распределены аналогично и занимают ту же площадь, что и TH-иммунореактивные нервы. NPY-иммунореактивные нервные волокна представляют собой преобладающую пептидсодержащую субпопуляцию нервов в SAN и значительно выше, чем NPY-содержащие нервы в окружающем правом предсердии свиньи 20 и сердца морской свинки. 8 Исследования Steele and Choate 41 сердца морской свинки определили, что весь SAN плотно иннервируется симпатическими аксонами, большинство из которых иммунореактивны к NPY. Однако только несколько аксонов оказались иммунореактивными по отношению к TH. В сердце человека относительная плотность симпатических нервных волокон, иммунореактивных к NPY и TH, значительно выше в центральной области SAN по сравнению с периферийной областью SAN. 3
После NPY другие преобладающие субпопуляции пептидергических нервов иммунореактивны по отношению к сенсорному пептидному веществу P (SP) и пептиду, связанному с геном кальцитонина (CGRP). 8,41 Иммунореактивные нервы соматостатина (SOM) менее многочисленны, чем SP- и CGRP-содержащие нервы, и обладают четким характером распределения по сравнению с другими популяциями нервов. Вазоактивный кишечный пептид (VIP) — иммунореактивные нервы очень редки как в SAN, так и в окружающем правом предсердии. Нервные волокна, демонстрирующие иммунореактивность в отношении VIP, в зоне SAN свиней встречаются редко. При обнаружении эти волокна тесно связаны с мелкими кровеносными сосудами, в основном артериолами, в узловой ткани, а также, в меньшей степени, в миокарде предсердий. 20 В целом, эти нервы, по-видимому, представляют собой относительно незначительный компонент иннервации узлов синуса, демонстрируя процент окрашенной области в 10-40 раз меньше, чем у NPY- и TH-иммунореактивных нервов, соответственно. 3,8 Отдельные VIP- и SOM-иммунореактивные нервные волокна разбросаны по клеткам SAN, тогда как SP- и CGRP-иммунореактивные нервные волокна встречаются в основном в эпикардиальных нервах, а также окружают тела клеток в сердечных ганглиях. Разницы между областями нервов, окрашенных SP- и CGRP, не обнаружено. 3 Подавляющее большинство CGRP-иммунореактивной нервной ткани в сердце собаки находится рядом с SAN, где варикозные нервные процессы протекают в многочисленных крупных нервных пучках. 42 Иммунореактивность к CGRP локализована в изолированных нервных волокнах внутри AChE-положительных нервов. CGRP-положительные нервные волокна занимают значительно меньший процент окрашенной площади, чем субпопуляция нервов, иммунореактивных к NPY, и составляют примерно 8% от общей нервной популяции. SOM-иммунореактивные нервы относительно редки по сравнению с NPY- или CGRP-иммунореактивными нервами, составляя менее 4% от общей иннервации.
В исследовании Стила и Чоата, 41 внутренних парасимпатических нейронов из сердца морской свинки были внешне денервированы путем помещения их в органотипическую культуру, чтобы позволить дегенерацию внешних аксонов. Эти эксперименты продемонстрировали несколько различных популяций парасимпатических нервов, иннервирующих только небольшую дискретную часть SAN. Такие популяции были иммунореактивны только в отношении NPY, SOM или VIP или в отношении SOM в сочетании с NPY, SOM с динорфином B и SOM с SP.Эти результаты подчеркнули заметную разницу в паттерне иннервации SAN симпатической и парасимпатической нервными системами.
Учебное пособие по проводящей системе
Введение
Внутренняя проводящая система сердца состоит из нескольких специализированных субпопуляций: клетки, которые либо спонтанно генерируют электрическую активность (клетки водителя ритма), либо предпочтительно скоординированно проведите это возбуждение по четырем камерам сердца.Этот в руководстве будут обсуждаться детали этой анатомии, а также физиологические свойства системы. В потенциал сердечного действия лежит в основе передачи сигналов в сердце и различных сердечных клетках (миоцитах) совокупности выявляют характерные формы волны. Активное обнаружение (или запись) этих действий потенциал важен как в научных, так и в клинических исследованиях.
Хотя каждый миоцит в сердце обладает способностью проводить электрический сердечный импульс (быть возбудимый), существуют определенные миоциты, которые генерируют сердечные потенциалы действия и / или предпочтительно проводят их от предсердий к камерам желудочков.Эта сотовая сеть стала известна как «проводящая система» [1]. Упорядоченные сокращения предсердий и желудочков регулируется организованной передачей электрических импульсов, проходящих через эти модифицированные клетки сердечной мышцы; эти специализированные клетки расположены внутри сократительного миокарда. Более в частности, эта система собственной проводимости, как полагают, состоит из следующих субпопуляции клеток: 1) пейсмекерные клетки, спонтанно генерирующие электрическую активность; и 2) проводящие волокна (в желудочках, волокна Пуркинье) те, которые преимущественно проводят эту активность всего сердца: i.е. состоит из ячейки большего диаметра с быстрой проводимостью скорости. Обычно после инициирующей активации (или деполяризации) в пейсмекерной клетке это электрическое возбуждение быстро и скоординированно распространяется по сердцу. Эта система функционально контролирует синхронизацию активности предсердий и желудочков. камеры, позволяющие оптимизировать гемодинамические показатели.Интересно, что общая глобальная архитектура этой проводящей системы присутствует у млекопитающих: но существуют значительные межвидовые различия, в первую очередь на гистологическом уровне [2,3].
История, связанная с идентификацией системы поведения
Открытия, связанные с существованием внутренней проводящей системы сердца, относительно недавние в истории болезни и в настоящее время являются базовыми для знания сердечной функции и анатомии.В 1845 г. Йоханнес фон Пуркинье первым описал желудочковую проводящую систему, а в 1882 г. электрофизиолог придумал словосочетание «блокада сердца». Кроме того, Гаскелл также идентифицировал наличие медленной скорости активации желудочков до диссоциации с активацией предсердий [4]. В первое описание синоатриального узла у млекопитающих было сообщено сэром Артуром Кейтом и Мартином Флэком. в 1907 г. в Журнале анатомии и физиологии.Тем не менее следует отметить, что и сегодня новые открытия о функциональности этого узла выявляются.
Выяснение электрической связи от атриовентрикулярного узла через сердечную скелет желудочковой части проводящей системы, известной как пучок Гиса, приписывается Вильгельму Хису младшему [6]. Важно отметить, что позже Тавара подтвердил существование этого пакета в 1906 [7].Из-за сложности отличить атриовентрикулярную узловую ткань от окружающей ткани, он также определил начало пучка Гиса как точку, в которой эти специализированные атриовентрикулярные узловые клетки входят в центральное фиброзное тело (которое отделяет предсердия от желудочки). Тавара также считается первым человеком, четко определившим специализированный проводящие ткани (модифицированные миоциты), которые простираются от межпредсердной перегородки до верхушки желудочка, включая правую и левую ветви пучка и волокна Пуркинье.
Вальтер Карл Кох (1880-1962), выдающийся немецкий хирург, обнаружил треугольную форму область в правом предсердии сердца, которая отмечает относительное расположение атриовентрикулярного узла (известный сегодня как треугольник Коха). Далее на основании подробных анатомических и гистологических исследований сердца животных и мертворожденных человеческих плодов, Кох также заметил, что последняя часть Сердце, теряющее активность, когда умирает весь орган, — это область водителя ритма (ultimum moriens).Он постулировал, что область сердца рядом с отверстием стенки коронарного синуса была, таким образом, истинный кардиостимулятор сердца [8,9]; обратите внимание, что атриовентрикулярный узел вызовет ускользающий ритм при выходе из строя синоатриального узла в правом предсердии.
Нарушения сердечной проводимости | Американская кардиологическая ассоциация
Ритм в зависимости от проводимости
Ваш сердечный ритм — это то, как ваше сердце бьется.Проводимость — это то, как электрические импульсы проходят через ваше сердце, заставляя его биться. Некоторые нарушения проводимости могут вызывать аритмию или нерегулярное сердцебиение.
Три распространенных нарушения проводимости:
Блок ветвления пучка
Объяснение проблемы
Обычно электрические импульсы проходят по правой и левой ветвям желудочков с одинаковой скоростью. Это позволяет обоим желудочкам сокращаться одновременно.
Но когда в одной из ветвей возникает «блокировка», электрические сигналы должны проходить через желудочек другим путем.Этот обход означает, что один желудочек сокращается на долю секунды медленнее, чем другой, что вызывает аритмию.
Симптомы и диагностика
Человек с блокадой ножки пучка Гиса может не испытывать никаких симптомов, особенно при отсутствии других проблем.
В таких случаях блокировка ветвления пучка обычно сначала определяется путем тестирования по какой-либо другой причине, например, при обычном физическом обследовании. Электрокардиограмма (ЭКГ или ЭКГ) выявляет блокаду ножки пучка Гиса при измерении электрических импульсов сердца.
Лечение
Часто лечение блокады ножки пучка Гиса не требуется.
Но по-прежнему важно проходить регулярные осмотры. Ваш врач захочет следить за вашим состоянием, чтобы убедиться, что никаких других изменений не происходит.
Блок сердца
Объяснение проблемы
В случае блокады сердца электрические сигналы, которые передаются от верхних камер сердца (предсердий) к его нижним камерам (желудочкам), нарушаются. Когда эти сигналы не передаются должным образом, сердце бьется нерегулярно.
Есть несколько степеней блокады сердца.
Посмотрите анимацию сердечной блокады.
Блокада сердца первой степени
Блокада сердца первой степени возникает, когда электрический импульс проходит через атриовентрикулярный узел сердца медленнее, чем обычно. Обычно это приводит к замедлению сердечного ритма. Состояние может вызывать головокружение или дурноту или может не вызывать никаких симптомов. Блокада сердца первой степени может не требовать специального лечения.
Некоторые лекарства могут вызывать блокаду сердца первой степени как побочный эффект:
- Digitalis : это лекарство обычно используется для замедления сердечного ритма.Если его принимать в больших дозах или в течение длительного периода, дигиталис может вызвать блокаду сердца первой степени.
- Бета-блокаторы : Эти препараты подавляют часть нервной системы, которая ускоряет работу сердца. Это может иметь побочный эффект задержки электропроводности в сердце, что может вызвать блокаду сердца первой степени.
- Блокаторы кальциевых каналов : Помимо других эффектов, блокаторы кальциевых каналов могут замедлять проводимость внутри атриовентрикулярного узла сердца, что приводит к блокаде сердца первой степени.
Если у вас блокада сердца первой степени, важно регулярно консультироваться с врачом, чтобы контролировать состояние. Между визитами к врачу вам следует регулярно измерять пульс и следить за тем, чтобы пульс не был ниже обычного.
Блок сердца второй степени
Блокада сердца второй степени возникает, когда электрические сигналы от верхних камер (предсердий) сердца не достигают нижних камер (желудочков). Это может привести к «пропаданию ударов».
Симптомы блокады сердца второй степени включают:
- Грудная боль
- Обморок (обморок)
- Учащенное сердцебиение
- Затруднение дыхания, например одышка (при физической нагрузке)
- учащенное дыхание
- тошнота
- Чрезмерная утомляемость
Блокада сердца второй степени может быть классифицирована двумя способами:
- Mobitz Type 1 : Обычно называемый блоком Венкебаха, Mobitz Type 1 может не вызывать заметных симптомов.Тем не менее, это может быть предвестником более серьезного типа блокады сердца второй степени, Mobitz Type 2. По этой причине ваш врач должен тщательно контролировать Mobitz Type 1. Также можно посоветовать ежедневную проверку пульса самостоятельно.
- Mobitz Тип 2 : При этом типе сердечной блокады второй степени сердце не бьется эффективно. Это влияет на способность сердца перекачивать кровь по всему телу. Часто требуется кардиостимулятор, чтобы сердце продолжало биться регулярно и эффективно.
Блокада сердца третьей степени
Третья степень или полная блокада сердца означает, что электрические сигналы вообще не могут проходить из верхних камер сердца (предсердий) в его нижние камеры (желудочки). В отсутствие электрических импульсов от синоатриального узла желудочки по-прежнему будут сокращаться и перекачивать кровь, но с меньшей скоростью, чем обычно.
При блокаде сердца третьей степени сердце не сокращается должным образом и не может эффективно перекачивать кровь в организм.
Симптомы блокады сердца третьей степени включают:
- Грудная боль
- Обморок (обморок)
- Головокружение
- Чрезмерная утомляемость
- Одышка
Сердечная блокада может вызвать сердечную блокаду третьей степени, как и некоторые лекарства в крайних случаях. Повреждение системы электропроводности сердца во время операции также может вызвать блокаду сердца третьей степени.
Людям с блокадой сердца третьей степени требуется немедленная медицинская помощь.Их нерегулярное и ненадежное сердцебиение повышает риск остановки сердца.
Временный или постоянный кардиостимулятор используется для лечения блокады сердца третьей степени, подающей в сердечную мышцу точно рассчитанный по времени электрический импульс.
Синдром удлиненного интервала QT (LQTS)
Объяснение проблемы
Синдром удлиненного интервала QT, также называемый LQTS, представляет собой нарушение электрической системы сердца, как и другие аритмии.
В LQTS нижним камерам сердца (желудочкам) требуется слишком много времени для сокращения и высвобождения.Промежуток времени, необходимый для завершения цикла, можно измерить и сравнить со средними показателями.
Название состояния происходит от букв, связанных с формой волны, создаваемой электрическими сигналами сердца. Интервал между буквами Q и T определяет работу желудочков. Следовательно, синдром удлиненного интервала QT означает, что период времени слишком длинный, даже если он составляет доли секунды.
Случайное удлинение интервала QT может быть вызвано повседневными обстоятельствами, в том числе:
- Когда пугаешься шума
- Физическая активность или упражнения
- Сильные эмоции (например, испуг, гнев или боль)
В этих случаях сердцебиение обычно быстро восстанавливает свой нормальный ритм сокращения.
Как наследственные, так и приобретенные
LQTS могут передаваться по наследству и появляться у здоровых людей. (Хотя это случается нечасто.) Когда это происходит, обычно поражаются дети или молодые люди.
Другие люди приобретают LQTS, иногда как побочный эффект лекарств. Также возможно наличие как наследственной, так и приобретенной формы LQTS.
Лекарства, вызывающие LQTS
Несколько типов лекарств могут вызывать LQTS, в том числе:
- Антигистаминные и противоотечные средства
- Диуретики (такие как калий или натрий)
- Некоторые антибиотики
- Антиаритмические препараты (лекарства, регулирующие сердцебиение)
- Антидепрессанты и нейролептики
- Лекарства, снижающие холестерин
- Некоторые лекарства от диабета
Признаки LQTS
Люди с LQTS могут не иметь никаких симптомов.Те, кто знает, могут испытать:
- Обморок (обморок)
- Дрожание в груди
- Аномальная частота сердечных сокращений или ритм (аритмия)
Диагностика LQTS
Если есть подозрение на LQTS, ваш врач захочет задать вопросы о вашей истории болезни, а также истории вашей семьи.
Например, исследования здоровых людей с LQTS показывают, что у них был хотя бы один эпизод обморока к 10 годам. У большинства из них также был член семьи с LQTS.
Необъяснимые эпизоды обморока или семейный анамнез сердечной смерти могут потребовать проведения электрокардиограммы (ЭКГ или ЭКГ) для вас и ваших близких родственников. Ваш врач может также порекомендовать пройти тест с физической нагрузкой.
Последствия LQTS
Некоторые аритмии, связанные с LQTS, потенциально смертельны и могут вызвать внезапную остановку сердца. Глухота также может возникать при одном типе унаследованного LQTS.
Если вам поставили диагноз LQTS, поговорите со своим врачом об уровне упражнений, в котором вы можете безопасно участвовать.В некоторых случаях упражнения могут вызвать фатальную аритмию у людей с LQTS.
Лечение LQTS
Варианты лечения LQTS включают:
В дополнение к этим подходам рекомендуется избегать приема лекарств и других факторов риска (например, электролитного дисбаланса), которые, как известно, удлиняют интервал QT вашего сердца.
Спецификация системы сердечной проводимости по факторам транскрипции
Abstract
Заболевания сердечно-сосудистой системы, вызывающие внезапную сердечную смерть, часто возникают из-за летальных аритмий, которые возникают из-за дефектов в системе сердечной проводимости.Развитие проводящей системы сердца — сложный биологический процесс, который может вызывать проблемы. Хотя было идентифицировано несколько генов, участвующих в функции зрелой проводящей системы, их связь с развитием специфических субкомпонентов сердечной проводящей системы остается сложной задачей. Некоторые факторы транскрипции, включая белки гомеодомена и белки Т-бокса, важны для морфогенеза сердечной проводящей системы и активации или репрессии ключевых регуляторных генов.Кроме того, несколько факторов транскрипции модифицируют экспрессию генов, кодирующих белки ионных каналов, которые вносят вклад в электрофизиологические свойства проводящей системы и регулируют сокращение окружающего миокарда. Нарушение регуляции транскрипции во время развития сердца пагубно сказывается на кардиогенезе, что может привести к аритмиям. Были идентифицированы генетические мутации человека в некоторых из этих факторов транскрипции, которые, как известно, вызывают врожденные пороки сердца, в том числе пороки развития системы сердечной проводимости.В этом обзоре мы суммируем вклад нескольких ключевых факторов транскрипции в спецификацию, формирование паттерна, созревание и функцию сердечной проводящей системы. Дальнейший анализ молекулярных программ, участвующих в этом процессе, должен привести к улучшению диагностики и терапии заболеваний проводящей системы.
Ключевые слова: развитие сердца, проводящая система сердца, факторы транскрипции, аритмия
Сердечно-сосудистые заболевания являются ведущей причиной смертности и внезапной сердечной смерти (ВСС) в США.ВСС преждевременно уносит жизни более 300 000 американцев и около 7 миллионов во всем мире 1 и обычно вызывается началом тахиаритмий, таких как желудочковая тахикардия и фибрилляция желудочков. Подмножество летальных аритмий может быть вызвано аномалиями, связанными с системой сердечной проводимости. Эти аномалии могут быть результатом травмы, сердечного или нервно-мышечного заболевания или врожденных дефектов в развитии системы сердечной проводимости. Хотя основные механизмы развития системы сердечной проводимости не совсем понятны, молекулярные механизмы, лежащие в основе этих дефектов, в настоящее время исследуются.
Сердечная мышца по своей гистологической структуре занимает промежуточное положение между внутренне ритмичной гладкой мышцей и произвольной скелетной мышцей. Все клетки сердечной мышцы могут ритмично биться без внешнего раздражителя. Однако клетки синоатриального узла (SAN) имеют самую высокую скорость внутреннего возбуждения, и они устанавливают ритмические сокращения миокарда. 2 Электрические импульсы, возникающие в SAN, возникают из-за наличия специализированного подмножества пейсмекерных клеток, которые дифференцируются от кардиомиоцитов.Эти импульсы кардиостимуляции ответственны за запуск и регулирование сердцебиения. SAN, которая представляет собой гетерогенную область ткани, встроенную в стенку правого предсердия, является одним из компонентов проводящей системы сердца (). Передача импульсов кардиостимуляции, генерируемых в SAN, идет от предсердия к миокарду желудочков через сеть клеток, составляющих проводящую систему сердца. В сердце эмбриона и плода проводящая система делится на два основных компонента: (1) центральная проводящая система, состоящая из SAN, атриовентрикулярного соединения, включая атриовентрикулярный узел (AVN) и межжелудочковое кольцо с его производными [ретроаортальная корневая ветвь, пучок правого предсердно-желудочкового кольца, предсердно-желудочковый пучок (АВБ) и проксимальные ветви пучка Гиса]; и (2) периферическая проводящая система, состоящая из дистальных ветвей пучка Гиса и проводящей сети периферических желудочков. 3 , 4 Все компоненты проводящей системы сердца имеют различные электрофизиологические, морфологические и транскрипционные профили, которые отличаются от окружающего рабочего миокарда. 3 , 5 Механизм индукции и дифференцировки кардиомиоцитов в пейсмекерные клетки во время кардиогенеза четко не определен. Однако предполагается, что этот процесс включает экспрессию специфических факторов транскрипции, которые будут дополнительно обсуждаться в этом обзоре, а также активируемые гиперполяризацией циклические нуклеотид-управляемые (HCN) каналы, необходимые для I f , тока пейсмекера. 6
Факторы транскрипции, необходимые для развития проводящей системы сердца. Показано схематическое изображение компонентов, составляющих проводящую систему сердца млекопитающих, включая положение первичного эмбрионального атриовентрикулярного кольца (серый эллипс). Факторы транскрипции, которые, как известно, регулируют спецификацию, формирование паттерна, созревание и функцию этих компонентов, указаны курсивом. К ним относятся: Nkx2.5, Shox2, Hop, Irx4, Irx5, Tbx2, Tbx3, Tbx18, Tbx5 и Id2.(Адаптировано из Moskowitz et al. 29 с разрешения).
После того, как электрические импульсы инициируются кардиостимуляторами SAN, эти импульсы распространяются по миокарду предсердной камеры, инициируя сокращение предсердий (). Импульсы задерживаются в атриовентрикулярном (АВ) соединении через специализированные кардиомиоциты медленного проводящего узла АВН. Эта задержка необходима для того, чтобы дать время предсердным камерам полностью сократиться и прокачать кровь через AV-клапаны до возникновения сокращения желудочков.Прямая передача электрических импульсов от миокарда предсердий к миокарду желудочков предотвращается наличием фиброза фиброзного кольца, изолирующей плоскости фибро-жировой соединительной ткани, которая разделяет предсердную и желудочковую камеры сердца. После AV-задержки электрический импульс быстро распространяется к ветвям пучка желудочков через пучок AV (His). Ветви желудочкового пучка делятся на левый и правый сегменты по обе стороны от межжелудочковой перегородки и заканчиваются сетью волокон Пуркинье.Передача электрических импульсов от волоконной сети Пуркинье к миокарду рабочего желудочка для стимуляции сокращения желудочков происходит одновременно от верхушки сердца к основанию скоординированным образом. Это сокращение от вершины к основанию обеспечивает эффективный выброс крови из желудочков в тракт оттока у основания сердца.
Идентифицировано несколько генов, участвующих в функции зрелой проводящей системы, но известно несколько генов, необходимых для формирования паттерна или спецификации дифференцированных клеток этой эволюционно консервативной структуры.Паттерн сердечной проводимости претерпевает драматические изменения при нормальном развитии четырехкамерного сердца. Миокард эмбрионального трубчатого сердца первоначально бьется нерегулярно и нескоординированно, но вскоре достигает гомогенной медленной активации 7 и сокращения 8 последовательности. Паттен и Крамер 8 определили, что первые неритмичные сокращения эмбрионального куриного сердца происходят на стадии 10 сомитов. Ритмичная электрическая активация от основания к верхушке, которая сохраняется непосредственно перед желудочковой перегородкой, очевидна перед 31 стадией кардиогенеза цыплят по Гамбургеру-Гамильтону. 9 Эти сокращения позволяют крови продвигаться от каудального к краниальному направлению в первичном сердце с помощью эндокардиальных подушек, служащих примитивными клапанами. 10 На этой стадии развития очевидно, что группа специализированных кардиомиоцитов в синоатриальной области примитивной сердечной трубки инициирует сердцебиение. Во время заключительных стадий перегородки оттока у эмбрионального цыпленка 9 и непосредственно перед завершением желудочковой перегородки во время кардиогенеза мыши 11 последовательность активации обращена к паттерну от вершины к основанию зрелого сердца.Не совсем ясно, что отличает эти клетки-водителя ритма от окружающего миокарда, но известно, что этот процесс дифференцировки кардиомиоцитов включает факторы транскрипции. Эти клетки могут биться независимо и с разной скоростью, когда они отделены от сердечной ткани, но они функционируют синхронно со скоростью, с которой один кардиомиоцит перекрывает другой, когда они взаимосвязаны. Это свойство было продемонстрировано и в других диссоциированных сердечных тканях, выращенных в культуре, но синусовые ткани всегда преобладали в частоте пульса. 12
Несмотря на наши обширные анатомические и физиологические знания о проводящей системе сердца позвоночных, молекулярные события, управляющие развитием этой специализированной ткани, остаются неясными. Исследования по отслеживанию клонов на курином эмбрионе показывают, что проводящая система сердца происходит от предшественников кардиомиоцитов. Сердечная проводящая система развивается путем рекрутирования мультипотентных эмбриональных миоцитов в узел или волокно на определенных эмбриональных стадиях, начиная с центральной проводящей системы и заканчивая периферической сетью волокон Пуркинье. 4 , 13 Эти клетки выходят из клеточного цикла после рекрутирования. Система сердечной проводимости определяется факторами транскрипции. Нарушение регуляции транскрипции во время кардиогенеза оказывает сильное влияние на развитие сердца и может в конечном итоге привести к формированию аритмий. В этом обзоре мы обсудим вклад нескольких ключевых факторов транскрипции в спецификацию, формирование паттерна и созревание системы сердечной проводимости. Мы также опишем факторы транскрипции, которые регулируют экспрессию генов ионных каналов.Хотя существует несколько ионных каналов, которые обеспечивают важную функцию, внося вклад в электрофизиологические свойства развивающейся проводящей системы, они выходят за рамки этого обзора. Обсуждаемые факторы транскрипции включают: Nkx2.5, Shox2, HOP, Irx4, Irx5, Tbx2, Tbx3, Tbx5, Tbx18 и Id2 (). Были идентифицированы генетические мутации человека в некоторых из этих факторов транскрипции, которые, как известно, вызывают врожденные пороки сердца, в том числе пороки развития системы сердечной проводимости.Хотя в этом обзоре мы сосредоточены на этих факторах транскрипции, ясно, что будет идентифицировано гораздо больше, и наше текущее понимание развития системы сердечной проводимости — это только верхушка айсберга.
Белки гомеобокса
Белки гомеодомена представляют собой семейство факторов транскрипции, определяемых наличием домена из 60 аминокислот (гомеодомена). Этот эволюционно консервативный гомеодомен кодируется последовательностью ДНК из 180 пар оснований, или гомеобоксом, и является ДНК-связывающей областью этого белка.Гены, содержащие гомеобокс, играют важную роль в регуляции тканеспецифической экспрессии генов, которая необходима для дифференцировки. Эти гомеодоменные белки широко охарактеризованы как регуляторы транскрипции, контролирующие различные клеточные судьбы как у беспозвоночных, так и у позвоночных. Мутации в генах гомеобокса связаны с рядом генетических заболеваний человека.
Nkx2.5
По крайней мере, пять членов семейства гена Nkx2 , которые экспрессируются во время развития сердца позвоночных. 14 A Drosophila , гомолог NKX2.5, tinman , экспрессируется в спинном сосуде, аналоге сердца мухи. Мутации в tinman приводят к отсутствию спинного сосуда. Следовательно, tinman необходим для кардиогенеза Drosophila . 15 Schott et al. использовали анализ сцепления и позиционное клонирование, чтобы показать, что мутации в человеческом NKX2.5 вызывают менделевский синдром семейных дефектов межпредсердной перегородки с ассоциированной прогрессирующей АВ-блокадой. 16 Фактически, последующий генетический скрининг пациентов с другими сердечными аномалиями показал, что мутации NKX2.5 вызывают множество структурных сердечных аномалий, связанных с заболеванием проводящей системы, особенно конотрункальными расстройствами. 16 — 18
Nkx2.5 экспрессируется уже в эмбриональный день (E) 7.5 в прекардиальной мезодерме и прилегающей энтодерме 19 развивающейся мыши, и экспрессия продолжается во взрослом возрасте. 20 Исследование Nkx2.5 -гаплоинедостаточных или нулевых мышей помогло понять его роль в развитии сердца и, в частности, сердечной проводящей системы. Lyons et al. обнаружили, что целенаправленное разрушение мышиного Nkx2.5 приводит к ранней эмбриональной летальности; развитие сердца останавливается на стадии линейной сердечной трубки до образования петли. 21 В дополнение к поддержанию линейной конформации сердца мышей Nkx2.5 — / — не образуют надлежащей границы между предсердной и желудочковой камерами, а предсердно-желудочковый канал не может сужаться и удлиняться.Таким образом, это потенциально влияет на развитие структур проводящей системы сердца, происходящих из этой области. Во время образования проводящих волокон экспрессия мРНК и белка Nkx2.5 повышается по сравнению с окружающим миокардом в развивающихся сердцах цыплят, мышей и человека. 22 У мышей с нокаутом Nkx2.5 , Jay et al. продемонстрировали, что количество клеток в проводящей системе сердца напрямую связано с дозировкой гена Nkx2.5 . 23 Nkx2.У 5 -нулевых эмбрионов отсутствуют минимальные калиевые каналы ( minK ), экспрессирующие клетки, дающие начало зачатку АВН. Эмбриональные и взрослые мыши Nkx2.5 +/- образуют более мелкие центральные и периферические проводящие системы, которые связаны с половиной нормального количества клеток, присутствующих во время развития. 23
Во время нормального кардиогенеза у мышей узловая область AV содержит две популяции клеток: проксимальный задний отсек и дистальный передний отсек, который соединяется с пучком Гиса.Проксимальный компартмент содержит клетки, которые экспрессируют белок щелевого соединения коннексин (Сх) 45, но не Сх40. Дистальный передний компартмент содержит небольшую смешанную популяцию Cx40 + / Cx45 + и Cx40- / C45 + клеток. Дефицит Nkx2.5- вызывает гипоплазию центральной проводящей системы, а у Nkx2.5 +/- мышей не хватает всей проксимальной популяции Cx40- / Cx45 + клеток в AVN. 23 Неожиданно, клеточная экспрессия Сх40 и время проведения через сеть Гиса-Пуркинье в норме.Эти исследования подтверждают ограниченную роль Nkx2.5 в регуляции спецификации клеточной популяции, необходимой для нормального развития центральной проводящей системы. Ограниченные желудочком мыши с дефицитом Nkx2.5 жизнеспособны, и при гистологическом исследовании сердца кажутся структурно нормальными. 24 Однако у новорожденных мышей наблюдается АВ-блокада первой степени, которая к позднему взрослому возрасту переходит в АВ-блокаду высокой степени или полную блокаду сердца. Прогрессирующая атриовентрикулярная блокада, вероятно, связана с гипопластической атриовентрикулярной нервной системой при рождении, за которой следует выборочная дегенерация центральной проводящей системы.Эта дегенерация подтверждается наличием выпадения кардиомиоцитов и фиброза. Напротив, окружающий миокард кажется незатронутым. 24
Хотя прогрессирующая дегенерация АВН не всегда наблюдается у всех людей с мутациями NKX2.5 , исследователи наблюдали прогрессирующую АВ-блокаду у пациентов, гетерозиготных по мутациям NKX2.5 , которые потребовали имплантации кардиостимулятора. 17 , 24 , 25 Исследование посмертных срезов сердца двух пациентов, гетерозиготных по Gln198ter NKX2.Мутации 5 с прогрессирующей атриовентрикулярной блокадой выявляют выраженную преимущественную дегенерацию проводящей системы на уровне АВН и пучка Гиса, в то время как окружающий миокард выглядит нормальным. Кроме того, Pashmforoush et al. продемонстрировали, что обнаруживается аберрантная экспрессия нескольких генов, преимущественно экспрессируемых в проводящей системе, включая Cx40 , minK , Hcn1 и гомеодоменный белок ( Hop) . Эти данные идентифицируют Nkx2.5 как часть пути в клонах желудочковых миоцитов, которые, вероятно, действуют согласованно с др. Молекулярными сигналами для спецификации клонов клеток AVN в центральной проводящей системе. 24
Кроме того, исследователи также продемонстрировали роль Nkx.2.5 в спецификации периферической проводящей системы в зависимости от времени и дозы. 26 , 27 Nkx2.5 гаплонедостаточность вызывает гипоцеллюлярность периферической проводящей системы. Meysen et al. продемонстрировали, что нарушения желудочковой проводимости у мышей Nkx2.5 +/- обусловлены гипопластической сетью волокон Пуркинье, которая возникает в результате клеточно-автономного дефекта постнатальной дифференцировки кардиомиоцитов и формирования периферической сети волокон Пуркинье. 27 Тамоксифен-индуцированная потеря Nkx2,5 у мышей продемонстрировала перинатальную потребность в Nkx2,5 для формирования системы сердечной проводимости. 28
Nkx2.5 синергетически действует с транскрипционным фактором T-box, Tbx5, чтобы регулировать экспрессию генов во время сердечного развития. Хотя детали этого синергетического отношения будут описаны позже, важно отметить, что экспрессия транскрипционного репрессора Id2 кооперативно регулируется с помощью Nkx2.5 и Tbx5. 29 Составная гаплонедостаточность Tbx5 и Nkx2,5 или Tbx5 и Id2 предотвращает эмбриональную спецификацию желудочковой проводящей системы. Следовательно, Tbx5, Nkx2.5 и Id2 координируют спецификацию миоцитов желудочков в клонах системы проводимости желудочков.
Shox2
Семейство низкорослых гомеобоксов ( SHOX ) генов псевдоавтосомных гомеобоксов человека кодирует специфические для клеточного типа факторы транскрипции, участвующие в клеточном цикле и регуляции роста. 30 , 31 мРНК SHOX2 экспрессируется в сердце и других тканях развивающихся эмбрионов человека. 32 Во время кардиогенеза у мышей Shox2 экспрессируется уже на E8.5 в задней области примитивной сердечной трубки. На E10.5 экспрессия Shox2 обнаруживается в венозных клапанах венозного синуса, происходящих из миокарда. К E11.5 экспрессия мРНК Shox2 расширяется, включая область SAN, а также два параллельных пучка, охватывающих продольную ось предсердий, венозных клапанов, которые, как полагают, составляют неотъемлемую часть развивающейся проводящей системы. 11 , 33 На сегодняшний день исследователи не идентифицировали человеческие мутации SHOX2 , связанные с заболеванием.
Blaschke et al. показали, что мыши Shox2 +/- не обнаруживают каких-либо явных структурных дефектов, измененной частоты сердечных сокращений или существенных электрокардиографических аномалий. 34 Однако Shox2 — / — мыши умирают между E11.5 и E13.5 с несколькими признаками сердечной недостаточности, а также сосудистыми дефектами.Во время кардиогенеза у мышей U-образная полоса миокарда формируется из стенки венозного синуса, прилегающей к миокарду предсердия у мышей дикого типа E11.5. Эта область миокарда, включающая зачаток SAN, отличается экспрессией легкой цепи миозина (MLC) 2a и отсутствием экспрессии Nkx2.5. Shox2 мРНК также экспрессируется в этой области 34 , а миокард венозного синуса, как известно, связан с развитием системы сердечной проводимости. 35 Недавно Gittenberger-de Groot et al.показали, что миокард венозного синуса также разграничен экспрессией подпланина, муцин-подобного трансмембранного гликопротеина, который экспрессируется в клетках, выстилающих плевральную и перикардиальную полости. 36 Во время кардиогенеза у мышей экспрессия Shox2 дополнительно ограничивается областью венозного синуса и, в конечном итоге, SAN и синусовыми (венозными) клапанами. 37 У эмбрионов E11.5 Shox2 — / — область SAN заметно уменьшена по сравнению с эмбрионами дикого типа.В отличие от однопометников дикого типа, эта гипопластическая область SAN у мышей Shox2 — / — обнаруживает экспрессию Nkx2.5 и аберрантную экспрессию Cx40 и Cx43. U-образная MLC-2a-положительная / Nkx2.5-отрицательная область практически отсутствует у мышей Shox2 — / — . Антисмысловой морфолино-опосредованный нокдаун Shox2 у развивающихся рыбок данио приводит к тяжелой сердечной дисфункции 36 , характеризующейся выраженной синусовой брадикардией и периодической блокадой выхода из синуса.Эти данные демонстрируют важную роль Shox2 в рекрутировании миокарда венозного синуса, включающего область SAN.
Сердца, изолированные от мышей Shox2 — / — и поддерживаемые в культуре, демонстрируют заметно сниженную скорость сокращения. Гипоплазия SAN возникает у этих мышей из-за уменьшения пролиферации клеток, но не из-за апоптоза. 37 Сопутствующие изменения в экспрессии генов отмечены в области SAN этих мышей. В области SAN Shox2 — / — мышей отсутствует экспрессия Tbx3 и Hcn4 .Однако в этой области наблюдается эктопическая экспрессия Nppa , Cx40 и Nkx2.5 . Эти данные указывают на неспособность SAN правильно различать в ответ на потерю Shox2 . 37
В совокупности эти находки Shox2 связывают этот транскрипционный путь с Nkx2.5 , который также, как было показано, играет роль в развитии и созревании области SAN. 36 Дефицит Shox2 не только вызывает эктопию Nkx2.5 , но по крайней мере у эмбрионов Xenopus сверхэкспрессия Shox2 подавляет экспрессию Nkx2.5 . 37 Espinoza-Lewis et al. продемонстрировали, что Shox2 репрессирует активность промотора Nkx2.5 в зависимости от концентрации. Промотор Nkx2.5 включает несколько сайтов связывания гомеобоксной ДНК Shox, и мутагенез этих сайтов отменяет способность Shox2 репрессировать транскрипцию Nkx2.5 . 37 Таким образом, было высказано предположение, что Shox2 работает выше Nkx2.5 , Tbx3 и Hcn4 для регулирования генетической программы SAN.
Хмель
Гомеодоменный белок, хмель, является наименьшим известным гомеодоменным белком. Этот гомеодоменный белок из 73 аминокислот состоит из дивергентного гомеодомена, который, в отличие от других белков гомеодомена, неспособен к последовательному связыванию ДНК. 38 Он экспрессируется в сердце эмбриона и играет важную роль в развитии проводящей системы сердца взрослого человека. Хмель выражен уже в E8.0 в предшественниках мезодермы сердечной мышцы во время развития мышей. 39 , 40 На ранних и средних сроках беременности Hop экспрессируется по всему миокарду, и его экспрессия сохраняется в зрелом возрасте. В зрелом возрасте хмель наиболее сильно выражается в проводящей системе сердца. Экспрессия Hop высока в AVN, пучке His, а также в левой и правой ветвях пучка.
Примерно половина эмбрионов мышей с дефицитом Hop погибает между E10.5 и E12.5. 39 Мыши Hop — / — , которые доживают до взрослого возраста, по-видимому, имеют анатомически нормальную систему сердечной проводимости 41 (по данным гистохимического окрашивания на активность ацетилхолинэстеразы 42 ), которые демонстрируют электрофизиологический дефицит, свидетельствующий о нарушении электрофизиологии. система сердечной проводимости. Однако поверхностная электрокардиография этих мышей ненормальна и показывает отклонение оси вправо, удлиненный интервал P-R, расширенный интервал QRS и удлиненный интервал QT, указывающие на инфраузельную патологию.Инвазивным электрофизиологическим исследованием у мышей Hop — / — обнаружен дефект инфраузальной проводимости и увеличение гистиовентрикулярного интервала на 30–50%. Таким образом, высокие уровни белка Hop, экспрессируемого в пучке His, а также в левой и правой ветвях пучка, по-видимому, необходимы для нормальной функции инфранодальной системы проводимости сердца. 41 Hop — / — мыши также демонстрируют минимальное, хотя и физиологически незначимое, увеличение предсердного интервала, которое может отражать некоторую физиологическую важность высокой постнатальной экспрессии Hop в предсердиях и AVN.
Учитывая его неспособность связывать ДНК, как хмель регулирует экспрессию генов и развитие сердца? Один из возможных механизмов может отражать взаимодействие между Hop и Nkx2.5. Во время раннего кардиогенеза Nkx2.5 непосредственно активирует экспрессию Hop, а Hop заметно подавляется в Nkx2.5 -нулевых эмбрионах. 28 Активность сывороточного фактора ответа (SRF), который является ключевым кардиогенным кофактором Nkx2.5, 43 противодействует Hop. 40 Следовательно, Hop может регулировать экспрессию генов во время сердечного развития, косвенно модулируя активность Nkx2.5.
Экспрессия сердечных коннексинов зависит от правильной сердечной экспрессии Nkx2.5 и Hop. Исмат и др. 41 продемонстрировали, что экспрессия мРНК Cx40 , но не Cx43 значительно снижена во всех сердцах мышей Hop — / — . У мышей Hop +/- белок Cx40 экспрессируется по всей проводящей системе сердца. Однако экспрессия Cx40 снижена до меньшей области у мышей Hop — / — , которая не распространяется за пределы проксимального AVN и пучка His.Сх40 является преобладающей изоформой коннексина в предсердии и проводящей системе сердца грызунов, которая способствует образованию щелевых контактов между кардиомиоцитами. 44 Следовательно, кажется вероятным, что потеря Hop в системе сердечной проводимости модифицирует экспрессию Cx40, а снижение Cx40 может частично объяснять электрофизиологический фенотип, наблюдаемый у мышей Hop — / — .
Хотя Hop является транскрипционной мишенью Nkx2.5, их функции не полностью перекрываются во время развития системы сердечной проводимости.Nkx2.5, который высоко экспрессируется в проводящей системе сердца, необходим для спецификации проводящих клеток во время развития проводящей системы, а также для поддержания проводящей системы сердца взрослых. Напротив, Hop, по-видимому, не нужен для поддержания проводящей ткани, потому что грубые анатомические структуры сердечной проводящей системы кажутся нормальными у мышей Hop — / — . Вместо этого хмель регулирует генетический профиль проводящей системы сердца.Потеря экспрессии Cx40 может быть основным механизмом, лежащим в основе дефектов сердечной проводимости, связанных с дефицитом Hop-, но вполне вероятно, что другие белки участвуют в опосредовании болезни сердечной проводимости в отсутствие Hop. Клинически значимые нарушения проводящей системы человека, связанные с подавлением или потерей функции Hop , не были идентифицированы. Однако недавно наблюдали снижение экспрессии хмеля на модели дилатационной кардиомиопатии у свиней. 44
Irx4 и Irx5
Гены гомеобокса ирокезов ( Irx ) кодируют консервативное семейство факторов транскрипции у многоклеточных животных. Факторы Irx определяют идентичность различных территорий тела, устанавливая соответствующие пространственно-временные паттерны генов-мишеней во время развития. 45 Члены семейства Irx характеризуются высококонсервативным гомеодоменом суперкласса TALE (удлинение петли из трех аминокислот), а также двумя консервативными доменами с неизвестными функциями: доменом IRO A из четырнадцати аминокислот и боксом IRO из тринадцати аминокислот. . 46 — 49 У млекопитающих выделено шесть генов Irx . Гены Irx играют ключевую роль в развитии, включая нейрогенез и формирование паттерна сердца. 45 , 49
Irx4 является самым ранним маркером предшественников желудочков и экспрессируется в миокарде желудочков на всех стадиях эмбрионального развития до взрослого возраста. 50 , 51 Он регулирует идентичность камер, активируя экспрессию тяжелой цепи-1 миозина желудочков и подавляя экспрессию тяжелой цепи-1 миозина предсердий. 52 Bruneau et al. показали, что экспрессия Irx4 регулируется Nkx2.5 и dHand. 51 Irx4 может не иметь существенного значения для формирования камеры желудочка, но он необходим для установления некоторых компонентов программы экспрессии генов, специфичных для желудочков. Irx4 -дефицитные мыши демонстрируют нормальную морфологию сердца на эмбриональной и постнатальной стадиях роста, но у взрослых развивается кардиомиопатия, которая характеризуется гипертрофией сердца и нарушением сократительной функции. 50
Irx5 экспрессируется уже в E9 во время кардиогенеза у мышей. Он обнаруживается в слизистой оболочке эндокарда первичных предсердных и желудочковых камер 53 Морфология и гемодинамика сердца у взрослых мышей Irx5 — / — кажутся нормальными, но эти мыши восприимчивы к тахиаритмиям и проявляют признаки аномальной реполяризации желудочков. 54 Константини и др. наблюдали увеличение быстро инактивирующегося переходного выходного тока ( I до ) эндокардиальных миоцитов Irx5 — / — из-за повышенной экспрессии гена Kcnd2 , кодирующего потенциал-зависимый калиевый канал, K v 4.2. 54 I От до обычно больше в эпикардиальных миоцитах, чем в эндокардиальных миоцитах нормального сердца, и это создает трансмуральный градиент I от до через желудочек. Увеличенный эндокардиальный миоцит I – мышей Irx5 — / — эффективно устраняет желудочковый трансмуральный градиент I – и придает свойства эпикардиального миокарда эндокардиальному миокарду.Irx5 задействует сердечный корепрессор mBop для репрессии транскрипции Kcnd2 в кардиомиоцитах новорожденных, и, таким образом, дефицит Irx5 приводит к повышенной экспрессии K v 4.2 и нарушению градиента I от до . 54
Фактически, как Irx4, так и Irx5 регулируют транскрипцию Kcnd2 , гена, кодирующего K v 4.2. 55 Irx4 подавляет Irx5-индуцированную регуляцию промотора Kcnd2 дозозависимым образом.С-концевой участок Irx5 отвечает за опосредование регуляции промотора Kcnd2 , а N-концевой участок Irx4 отвечает за подавление Irx5-индуцированной регуляции Kcnd2 . Таким образом, поддержание стехиометрии Irx4: Irx5 необходимо для регулирования экспрессии канальных белков. 55
Эти наблюдения предполагают, что комбинаторные взаимодействия между несколькими факторами транскрипции ирокезов уточняют пространственное распределение K v 4.2. Хотя Irx4 и Irx5 могут не отвечать за спецификацию клеточных клонов во время развития сердечной проводящей системы, они играют существенную роль в установлении регионально-специфической экспрессии белков ионных каналов, которые вносят вклад в электрофизиологические свойства проводящей системы. Мутации IRX4 и IRX5 у человека еще не идентифицированы.
T-box белки
T-box (Tbx) факторы транскрипции играют критическую роль во время эмбриогенеза и характеризуются своим высококонсервативным T-box ДНК-связывающим доменом.Члены подсемейств Tbx1 и Tbx2 играют определенные роли в развитии сердца. 56 Эти гены Т-бокса в совокупности вносят вклад в определение происхождения сердца, спецификацию камеры, развитие эпикарда и специализацию проводящей системы. Множественные факторы транскрипции Т-бокса являются важными регуляторами спецификации, дифференцировки и формирования паттерна проводящей системы, а также вносят вклад во многие другие аспекты созревания и морфогенеза сердечных клеток.
Tbx2
Семейство генов Т-бокса можно разделить на подсемейства на основе сохранения структуры и функции белка. Подсемейство Tbx2 включает Tbx2 и Tbx3. Множественные факторы транскрипции Т-бокса разных подсемейств часто экспрессируются совместно и могут модулировать экспрессию друг друга. Tbx2 и Tbx3 коэкспрессируются в зачатках сердца, примитивном миокарде и AV-канале эмбрионов кур и мышей и являются сильными репрессорами транскрипции. 57 — 59 Хотя экспрессия Tbx2 в этих областях намного сильнее и шире, чем Tbx3 , существует значительное перекрытие. Tbx2 подавляет экспрессию камер-специфичных генов Nppa , Cx40 и Chisel, и подавляет дифференцировку и формирование камер сердца. 60 Сотрудничество с Nkx2.5 позволяет Tbx2 репрессировать активность промотора Nppa in vitro . 59 Подобно Tbx2, Tbx3 способен репрессировать активность промотора Nppa и Cx40 . 61 Tbx2 и Tbx3 необходимы для контроля пролиферации клеток в AV-канале во время кардиогенеза рыбок данио. 62 Вместе Tbx2 и Tbx3 репрессируют транскрипцию в AV-канале Bmp10 , 62 гена, специфичного для камеры сердца, необходимого для роста и созревания камеры. 63
Tbx2 и Tbx3 также способствуют развитию системы сердечной проводимости.Они по-разному экспрессируются в периферической и центральной проводящей системе, где они ингибируют пролиферацию клеток и регулируют экспрессию генов, специфичных для клонов. 64 , 65 Aanhaanen et al. продемонстрировали, что экспрессирующие Tbx2 клетки миокарда вносят вклад в созревание первичного АВ канала миокарда. 66 Миокард Tbx2 + AVC вносит вклад в кольцевой пучок AVN и AV. Несмотря на структурную непрерывность формирующегося проводящего миокарда на протяжении всего развития, миокард Tbx2 + AVC не вносит вклад в AV-пучок или проксимальные левые и правые ветви пучка. 67 Эти данные предполагают, что предшественники компонентов системы AV-проводимости становятся специфическими в раннем кардиогенезе посредством сегрегации и воздействия отличительных молекулярных сигналов.
При синдроме Вольфа-Паркинсона-Уайта (WPW) 68 пациенты имеют симптоматические тахиаритмии. Фенокопия WPW вызвана мутацией в гене, кодирующем γ2-регуляторную субъединицу AMP-активированной протеинкиназы ( PRKAG2 ). 69 У этих пациентов может быть периодическое преждевременное возбуждение, потому что передача электрических импульсов через проводящую систему происходит ретроградным образом от желудочков к предсердиям из-за дополнительного возбуждающего пути, который, по-видимому, является следствием либо ненормального расширения AV-кольца 70 или неспособность поддерживать изолирующее AV-кольцо 3 .Однако генетическая этиология классического WPW остается неуловимой, и Tbx2-зависимые пути, которые регулируют созревание AV кольца, могут быть зрелым источником генов-кандидатов в WPW.
Tbx3
Во время эмбриогенеза Tbx3 участвует в нескольких ключевых процессах развития, включая регуляцию клеточной пролиферации, старения, апоптоза, выхода из клеточного цикла и формирования паттерна развития. 56 , 71 Мутации в TBX3 вызывают ульнарно-молочный синдром, генетическое заболевание человека, отличающееся дефектами верхних конечностей, гипоплазией молочных желез, а также зубными и генитальными аномалиями. 72 , 73 Дефекты сердца и заболевание проводящей системы не являются частыми проявлениями ульнарно-молочного синдрома, хотя сообщалось о дефекте межжелудочковой перегородки, гипертрофии правого желудочка и стенозе легочной артерии. 72 , 73 Tbx3 экспрессируется в SAN, AVN, AV-пучке и проксимальных ветвях пучка во время сердечного развития, 61 и Tbx3 регулирует формирование, созревание и функцию SAN. 64 Hoogaars et al. 64 наблюдали сегрегацию клонов Tbx3 -отрицательных предсердных клеток и Tbx3 -положительных клеток-предшественников SAN, как только сердечные клетки включают программу экспрессии предсердных генов. Эти находки предполагают, что SAN формируется за счет пролиферации Tbx3 -положительных клеток-предшественников, а не за счет рекрутирования соседних миоцитов, предназначенных для программы предсердных генов. Кроме того, репрессия Cx40 и активация канала водителя ритма, Hcn4 , происходит, когда TBX3 эктопически экспрессируется в кардиомиоцитах предсердий. 64 Гены рабочего миокарда предсердий, включая Cx40 , Cx43 , Nppa и Smpx (Chisel), экспрессируются в домене SAN Tbx3 — / — мышей. Таким образом, Tbx3 необходим для индукции и поддержания отдельной генетической программы SAN, одновременно предотвращая распространение экспрессии предсердных генов в домен SAN. Более того, сверхэкспрессии Tbx3 достаточно для изменения паттернов экспрессии генов в предсердных клетках, чтобы способствовать индукции функциональных пейсмекерных клеток, которые проявляют генетическую сигнатуру SAN.Экспрессия Tbx3, таким образом, служит основным фактором в определении того, дифференцируются ли эмбриональные клетки предсердий в клетки-пейсмекеры или рабочий миокард. 64
Баккер и др. 65 показали, что Tbx3 необходим для спецификации проводящей ткани AV и проксимальных ветвей пучка во время формирования проводящей системы. Tbx3 предотвращает дифференцировку кардиомиоцитов в проводящей системе желудочков в рабочий миокард. Он подавляет экспрессию генов миокарда как предсердий, так и желудочков в проводящей системе, подавляя транскрипцию генов, специфичных для миокарда камеры, Cx40 , Cx43 и Nppa , а также путем ингибирования пролиферации в этой популяции клеток. 61 Белки гомеобокса мышечного сегмента, Msx1 и Msx2, кооперируются с Tbx3, подавляя активность промотора Cx43 и регулируя его экспрессию в проводящей системе. 74 Кооперативное взаимодействие между Tbx3 и Tbx18, как подробно обсуждается позже, также важно для регуляции развития SAN. На сегодняшний день мутации TBX3 не связаны с изолированными нарушениями проводимости или аритмией у людей.
Tbx18
Множественные факторы транскрипции T-box из разных подсемейств часто коэкспрессируются во время развития и могут модулировать экспрессию друг друга.Важным примером этого является взаимосвязь между экспрессией Tbx18 и Tbx3 во время образования SAN. Биологическая роль Tbx18 в примитивном проэпикардиальном органе 75 широко изучена. Хотя продолжаются дискуссии о том, происходят ли клоны кардиомиоцитов от Tbx18-положительных эпикардиальных предшественников 76 , 77 , гораздо меньше известно о роли Tbx18 в развитии проводящей системы сердца. Wiese et al. показали, что Tbx18 и Tbx3 контролируют разные программы в образовании SAN, которые приводят к регионализации экспрессии генов в SAN во время нормального кардиогенеза. 78 SAN млекопитающих неоднородна по составу, функциям и форме клеток. Хотя морфологические исследования показывают, что SAN состоит из трех различных типов клеток (узловых, промежуточных и удлиненных), считается, что узловые клетки управляют функцией стимуляции ритма SAN. Головная и хвостовая области SAN придают структуре уникальную форму запятой, и все клетки SAN экспрессируют Hcn4, ген канала пейсмекера. 79 Однако паттерны экспрессии Tbx3 и Tbx18 в развивающихся головах и хвостах SAN различаются.В сердце мыши E14.5 головка SAN экспрессирует Tbx3 , Tbx18 и Hcn4 , но не имеет экспрессии Nkx2.5 . 78 Напротив, хвост SAN экспрессирует высокие уровни Tbx3 и Hcn4 , но слабо экспрессирует Nkx2.5 и не имеет экспрессии Tbx18 . Таким образом, Tbx18 является критическим маркером компартментализации SAN. В Tbx18 -дефицитных сердцах эмбрионов мышей хвост SAN виден уже на E10.5 — E12.5 и Tbx3 и Hcn4 обнаруживаются. Однако Tbx18 -дефицитные эмбрионы обнаруживают нарушение формирования головы SAN. К ст. E14.5 начинается отсроченное формирование головной структуры SAN, но она значительно укорачивается вдоль продольной оси правой верхней полой вены. Исследователи предполагают, что у мышей дикого типа мезенхимальные предшественники Tbx18 + в этой области верхней полой вены расширяются и дифференцируются, образуя миокард будущей головы SAN. 78 Аналогичное требование Tbx18 для формирования головы SAN было неоднократно продемонстрировано на мышах Tbx18 — / — / Tbx3 — / — , которые также не могут сформировать голову SAN, несмотря на формирование хвоста SAN. Эти данные дополнительно демонстрируют потребность в Tbx18 для образования головки SAN из мезенхимальных предшественников. Хотя Tbx3 не требуется для образования SAN, он налагает программу и функцию пейсмекерного гена в миокарде предсердий. 78 Генетические мутации в TBX18 у людей еще не идентифицированы.
Tbx5
Как член высококонсервативного семейства транскрипционных факторов T-box, Tbx5 вносит вклад во многие аспекты сердечно-сосудистого развития. Мутации TBX5 у человека вызывают синдром Холта-Орама 80 , аутосомно-доминантное заболевание, характеризующееся сердечными дефектами на фоне деформаций верхних конечностей. 81 , 82 Около 75% всех пораженных людей имеют структурные пороки сердца, которые обычно включают дефекты межпредсердной и / или межжелудочковой перегородки с изомерией.Нарушения сердечного ритма часто возникают у людей с синдромом Холта-Орама, включая синусовую брадикардию и различные степени AV-блокады и фибрилляции предсердий. 81 , 83 Часто этим людям требуется имплантация постоянных кардиостимуляторов. Хотя такие аритмии могут возникать на фоне структурных сердечных аномалий, пациенты с синдромом Холта-Орама могут демонстрировать изолированное заболевание проводимости без каких-либо признаков структурного заболевания сердца.
Во время кардиогенеза ТВХ5 экспрессируется во всех камерах сердца, а более высокие уровни белка экспрессируются в камерах предсердий. 84 Экспрессия TBX5 в АВН обеспечивает молекулярную основу для прогрессирующей блокады АВ-проводимости, наблюдаемой у людей с синдромом Холта-Орама. Направленный мутагенез Tbx5 у мышей приводит к сильно гипоморфному развитию примитивной сердечной трубки у нулевых эмбрионов, которые не выживают после E10.5. 85 Взрослые мыши Tbx5 — / — демонстрируют различные степени электрофизиологического дефицита, включая атриовентрикулярную блокаду и дисфункцию синусового узла, и у 50% этих животных наблюдается атриовентрикулярная блокада 2 °. 85 Moskowitz et al. продемонстрировали, что Tbx5 экспрессируется во всей центральной проводящей системе, включая AVN, AV-пучок и ветви пучка в сердце новорожденных мышей. 29 Более того, Tbx5 выполняет специфические роли в АВ канале в постнатальном морфологическом и функциональном созревании АВ узла и АВ пучка. Пучковые ветви определяются широким слоем специализированных проводящих клеток, которые постнатально формируются в дискретные пучки в зрелых левой и правой ветвях пучка Гиса во время нормального кардиогенеза у мышей. Tbx5 Уровни экспрессии проводящей системы сердца обычно поддерживаются при рождении, а постнатальные уровни в структурах проводящей системы мыши выше, чем в окружающем миокарде. При рождении на развивающуюся левую ножку пучка Гиса изначально не влияет дефицит Tbx5 . Однако у мышей Tbx5 +/- левая ветвь пучка Гиса не может созреть в узкий пучок к зрелому возрасту, а незрелая ветвь сохраняет вид широкой полосы специализированных проводящих клеток без дискретного АВ пучка.Тяжелые дефекты формирования паттерна видны в правой ножке пучка Гиса как у новорожденных, так и у взрослых Tbx5 +/- мышей. В правом желудочке мышей Tbx5 +/- недостаток клеток приводит к сокращению или полному отсутствию дискретной правой ножки пучка Гиса. Это приводит к функциональным последствиям электрокардиографических нарушений, включая блокаду правой ножки пучка Гиса. Cx40 мРНК экспрессируется в незрелом AV пучке и левой ножке пучка у мышей Tbx5 +/- , но отсутствует в области, прилегающей к перепончатой перегородке, где обычно находится правый пучок.Эти находки демонстрируют потребность в Tbx5 в постнатальном созревании AV пучка и левой ножки пучка, а также существенную потребность в Tbx5 в формировании паттерна и функции правой ножки пучка. 29
Развитие желудочковой проводящей системы также требует взаимодействия между Tbx5 и Nkx2.5. Их активность, по крайней мере частично, опосредуется Id2 86 , членом семейства генов, кодирующих репрессоры транскрипции, содержащие спираль-петля-спираль. 87 Экспрессия мРНК Id2 обнаруживается в формирующемся AV-пучке, начинающемся на E12.5 мышиного кардиогенеза, и в ветвях пучка, начинающемся на E16.5. 86 Id2 Нулевые сердца новорожденных и взрослых мышей демонстрируют различные задержки межжелудочковой проводимости, включая блокаду левой ножки пучка Гиса. Московиц и др. сообщили, что дискретный AV-пучок, который физически отделяет AVN от левой ножки пучка у взрослых мышей дикого типа, отсутствует у взрослых мышей Id2 — / — .Вместо этого левая ветвь пучка Гиса необычно широкая, и морфология АВ пучка и ветви пучка кажется сходной с наблюдаемой у взрослых мышей Tbx5 +/- . 86 Несмотря на морфологическое сходство левой ножки пучка Гиса у мышей Id2 — / — и Tbx5 +/- мышей, Id2 — / — у мышей развивают блокировку левой ножки пучка Гиса по сравнению с мышами о блокаде правой ножки пучка Гиса сообщалось у Tbx5 +/- мышей.Объяснение этого несоответствия неясно и может отражать неполное перекрытие экспрессии и функции Tbx5 и Id2. Id2 Экспрессия лишь частично зависит от Tbx5, и Moskowitz с коллегами продемонстрировали, что Nkx2.5 и Tbx5 кооперативно взаимодействуют с промотором Id2 , чтобы регулировать экспрессию Id2, специфичную для системы проводимости. 86 Исследование соединения Tbx5 +/- /Nkx2.5 +/- мышей и Tbx5 +/- / Id2 +/- мышей выявляют генетические взаимодействия Tbx5 , Nkx2.5 и Id2 во время развития и функционирования желудочковой проводящей системы. Пучок AV и проксимальные ветви пучка присутствуют и хорошо сформированы у дикого типа / minK lacZ / + , а также Tbx5 +/- / minK lacZ / + , Nkx2.5 +/- / minK lacZ / + и Id2 +/- / minK lacZ / + сердца мутантов.Однако экспрессия MinK: lacZ полностью отсутствует в AV-пучке и ветвях пучка в Tbx5 +/− /Nkx2.5 +/− / minK lacZ / + и Tbx5 +/− / Id2 +/- / minK lacZ / + мутантные сердца. Несмотря на эти данные, хорошо сформированная AVN присутствует как у мышей Tbx5 +/- /Nkx2.5 +/- / minK lacZ / + мышей и Tbx5 +/- / Id2 +/- / минK lacZ / + мышей.Дефицит синергизма между этими факторами, по-видимому, не нарушает спецификации или дифференциации АВН.
Cx40 экспрессия отсутствует в области AV пучка и ветвей пучка Tbx5 +/- /Nkx2.5 +/- мышей, и эти сложные гетерозиготные мыши демонстрируют задержки в системе желудочковой проводимости. . Исследования по отслеживанию клеточных клонов показывают, что прекурсивные клетки-предшественники желудочковой проводящей системы присутствуют, но не способны принять судьбу проводящей системы у мышей, гаплонедостаточных как для Tbx5, , так и для Nkx2.5 . 86 Задержки желудочковой проводимости наблюдаются в соединении Tbx5 +/− / Id2 +/− мышей, которые аналогичны задержкам, наблюдаемым у Tbx5 +/− /Nkx2,5 +/- мыши. Следовательно, гаплонедостаточность Tbx5 и Nkx2.5 или Tbx5 и Id2 отменяет развитие и функцию желудочковой проводящей системы. Вместе эти данные определяют необходимый молекулярный путь с участием Nkx2.5, Tbx5 и Id2 для развития желудочковой проводящей системы.
Электрическая система сердца
Обзор темы
Что контролирует время вашего сердцебиения?
Электрическая система вашего сердца контролирует время вашего сердцебиения, регулируя вашу:
- Частоту сердечных сокращений, то есть количество ударов вашего сердца в минуту.
- Сердечный ритм, который представляет собой синхронизированное насосное действие ваших четырех камер сердца.
Электрическая система вашего сердца должна поддерживать:
- Постоянную частоту сердечных сокращений от 60 до 100 ударов в минуту в состоянии покоя.Электрическая система сердца также увеличивает эту скорость, чтобы удовлетворить потребности вашего организма во время физической активности, и снижает ее во время сна.
- Упорядоченное сокращение предсердий и желудочков (это называется синусовым ритмом).
Посмотрите изображение сердца и его электрической системы.
Как работает электрическая система сердца?
Ваша сердечная мышца состоит из крошечных клеток. Электрическая система вашего сердца контролирует время вашего сердцебиения, посылая электрический сигнал через эти клетки.
Два разных типа клеток в вашем сердце позволяют электрическому сигналу контролировать ваше сердцебиение:
- Проводящие клетки передают электрический сигнал вашего сердца.
- Мышечные клетки позволяют камерам вашего сердца сокращаться, действие, запускаемое электрическим сигналом вашего сердца.
Электрический сигнал проходит через сеть проводящих клеток «путей», которые стимулируют ваши верхние камеры (предсердия) и нижние камеры (желудочки) сокращаться.Сигнал может распространяться по этим путям посредством сложной реакции, которая позволяет каждой клетке активировать соседнюю клетку, стимулируя ее «передавать» электрический сигнал упорядоченным образом. Поскольку клетка за клеткой быстро передает электрический заряд, все сердце сокращается одним скоординированным движением, вызывая сердцебиение.
Электрический сигнал исходит из группы клеток в верхней части сердца, называемой синоатриальным (SA) узлом. Затем сигнал проходит через ваше сердце, вызывая сначала два ваших предсердия, а затем два желудочка.В здоровом сердце сигнал очень быстро проходит через сердце, позволяя камерам сокращаться плавно и упорядоченно.
Сердцебиение происходит следующим образом:
- Узел SA (так называемый кардиостимулятор сердца) посылает электрический импульс.
- Верхние камеры сердца (предсердия) сокращаются.
- Атриовентрикулярный узел посылает импульс в желудочки.
- Нижние камеры сердца (желудочки) сокращаются или накачиваются.
- Узел SA посылает еще один сигнал предсердиям на сокращение, что снова запускает цикл.
Этот цикл электрического сигнала, за которым следует сокращение, составляет одно сердцебиение.
Узел SA и предсердия
Когда узел SA посылает электрический импульс, он запускает следующий процесс:
- Электрический сигнал проходит от узла SA через мышечные клетки в правом и левом предсердиях.
- Сигнал запускает мышечные клетки, которые заставляют ваши предсердия сокращаться.
- Предсердия сокращаются, перекачивая кровь в левый и правый желудочки.
АВ-узел и желудочки
После того, как электрический сигнал заставил ваши предсердия сокращаться и перекачивать кровь в желудочки, электрический сигнал поступает в группу клеток в нижней части правого предсердия, называемую атриовентрикулярным узлом или АВ-узлом. Узел AV ненадолго замедляет электрический сигнал, давая желудочкам время принять кровь из предсердий.Затем электрический сигнал запускает ваши желудочки.
Когда электрический сигнал покидает АВ-узел, он запускает следующий процесс:
- Сигнал проходит вниз по пучку проводящих клеток, называемому пучком Гиса, который делит сигнал на две ветви: одна ветвь идет к левому желудочку. , другой правый желудочек.
- Эти две основные ветви далее разделяются на систему проводящих волокон, которые распространяют сигнал через левый и правый желудочки, заставляя желудочки сокращаться.
- Когда желудочки сокращаются, ваш правый желудочек перекачивает кровь к вашим легким, а левый желудочек перекачивает кровь к остальной части вашего тела.
После сокращения предсердий и желудочков каждая часть системы электрически перезагружается.
Как электрическая система сердца регулирует частоту сердечных сокращений?
Клетки узла SA в верхней части сердца известны как кардиостимулятор сердца, потому что частота, с которой эти клетки посылают электрические сигналы, определяет частоту ударов всего сердца (частоту сердечных сокращений).
Нормальная частота пульса в состоянии покоя колеблется от 60 до 100 ударов в минуту. Ваша частота пульса может повышаться или понижаться в зависимости от потребностей вашего тела.
Что заставляет ваш пульс учащаться или замедляться?
Ваш мозг и другие части вашего тела посылают сигналы, побуждающие ваше сердце биться быстрее или медленнее. Хотя способ взаимодействия всех химических сигналов, влияющих на частоту сердечных сокращений, сложен, в конечном итоге эти сигналы говорят узлу SA запускать заряды в более быстром или более медленном темпе, что приводит к более быстрому или более медленному сердцебиению.
Например, во время тренировок, когда организму требуется больше кислорода для функционирования, сигналы от вашего тела заставляют ваш пульс значительно увеличиваться, чтобы доставить больше крови (и, следовательно, больше кислорода) в тело. Ваша частота сердечных сокращений может превышать 100 ударов в минуту, чтобы удовлетворить повышенные потребности вашего организма во время физических нагрузок.
Точно так же в периоды отдыха или сна, когда организму требуется меньше кислорода, частота сердечных сокращений уменьшается. У некоторых спортсменов нормальная частота сердечных сокращений значительно ниже 60, потому что их сердца очень эффективны и им не нужно биться так быстро.Таким образом, изменения частоты сердечных сокращений — это нормальная часть усилий вашего сердца по удовлетворению потребностей вашего тела.
Как ваше тело контролирует частоту сердечных сокращений?
Ваше тело контролирует ваше сердце с помощью:
- Симпатической и парасимпатической нервных систем, нервные окончания которых находятся в сердце.
- Гормоны, такие как адреналин и норадреналин (катехоламины), циркулирующие в кровотоке.
Симпатическая и парасимпатическая нервные системы
Симпатическая и парасимпатическая нервные системы представляют собой противодействующие силы, влияющие на частоту сердечных сокращений.Обе системы состоят из очень крошечных нервов, идущих от головного или спинного мозга к сердцу. Симпатическая нервная система срабатывает во время стресса или потребности в увеличении сердечного выброса и посылает сигналы сердцу, чтобы увеличить его частоту. Парасимпатическая система активна в периоды покоя и посылает сигналы сердцу, чтобы снизить его частоту.
Катехоламины
Во время стресса или потребности в увеличении сердечного выброса надпочечники выделяют в кровоток гормон, называемый норадреналином, в то же время, когда симпатическая нервная система также запускается, чтобы увеличить частоту сердечных сокращений.Этот гормон заставляет сердце биться быстрее, и, в отличие от симпатической нервной системы, которая посылает мгновенный и кратковременный сигнал, норэпинефрин, попадающий в кровоток, увеличивает частоту сердечных сокращений на несколько минут и более.
Система электропроводности сердца [Видео]
В этом видео мы рассмотрим, как ритм сердца управляется электрическими импульсами. Насосное действие сердца регулируется системой электропроводности, которая координирует сокращение четырех камер сердца.
Помните, что 4 камеры включают правое предсердие, правый желудочек, левое предсердие и левый желудочек.
Сердечная проводящая система — это группа специализированных клеток сердечной мышцы и проводящих волокон, которые запускают нормальный сердечный цикл и координируют сокращение сердечной мышцы.
Способность сердца биться начинается с синоатриального (SA) узла , который представляет собой небольшую массу специализированной ткани, расположенной в предсердиях. Деполяризация (активация сердечной мышцы) инициируется импульсом от узла SA.Импульс распространяется через правое предсердие и пучок Бахмана, чтобы активировать левое предсердие. Электрический стимул, генерируемый узлом SA, возникает 60-100 раз в минуту при нормальных условиях. Поэтому узел SA часто называют «естественным водителем ритма» сердца, а нормальный сердечный ритм называют «синусовым ритмом».
После активации предсердий импульс перемещается по межузловым путям к предсердно-желудочковым (AV). ) узел . AV-узел функционирует как критическая задержка в проводящей системе.Эта задержка предотвращает одновременное сокращение предсердий и желудочков, что может вызвать неэффективный поток крови через сердце.
Импульс затем входит в пучок His и передается по ветвям пучка. Пучок Гиса разделяется на две ветви в межжелудочковой перегородке (которая является просто разделением между двумя желудочками) — левая ветвь пучка активирует левый желудочек, а правая ветвь пучка активирует правый желудочек.
Правая и левая ветви пучка сужаются, образуя множество волокон Пуркинье , почти одновременно активируя стенки желудочков. Активация желудочков продолжается от верхушки к основанию сердца, чтобы завершить процесс сокращения желудочков.
Помните деполяризация относится к активации сердечной мышцы или сокращению и реполяризации относится к мышечным клеткам, возвращающимся в состояние покоя .
Электрический импульс сердца за 5 простых шагов:
1. Импульс покидает SA-узел, сигнализируя предсердиям о сокращении
2. Идет вниз по межузловым путям к AV-узлу
3. Затем к пучку His
4 Где он разделяется на правую и левую ветви пучка
5. Далее к волокнам Пуркинье, вызывая сокращение желудочков.
ЧТО СЛЕДУЕТ ЗАПОМНИТЬ
Узел SA (синоатриальный)
- «Кардиостимулятор» сердца
- Инициирует сокращение (деполяризацию) предсердий
- Вызывает стимул 60-100 раз в минуту
- Сокращение сердца предсердия - представлены зубцом P на ЭКГ
(см. более подробную информацию в видео «Интерпретация ЭКГ»)
AV (предсердно-желудочковый) узел
- «привратник» сердца - функционирует как небольшая задержка, чтобы позволить всем
кровь из предсердий спускается в желудочки и предотвращает обратный ток.