Формула соль глаубера: Глауберова соль (приготовление раствора) | Химик.ПРО – решение задач по химии бесплатно
Глауберова соль (приготовление раствора) | Химик.ПРО – решение задач по химии бесплатно
Сколько глауберовой соли (Na2SO4 ⋅ 10H2O) и воды (в граммах) необходимо взять, чтобы приготовить 710 грамм 10-процентного раствора сульфата натрия (Na2SO4)?
Решение задачи
Найдем, какая масса сульфата натрия (Na2SO4) содержится в 710 г 10-процентного раствора по формуле:
Получаем:
m (Na2SO4) = 710 ⋅ 0,1 = 71 (г).
Если раствор 10-процентный, то массовая доля сульфата натрия (Na2SO4) в нем 0,1.
Рассчитаем молярные массы сульфата натрия (Na2SO4) и глауберовой соли (Na2SO4 ⋅ 10H2O):
M (Na2SO4) = 142 (г/моль),
M (Na2SO4 ⋅ 10H2O) = 142 + 10 ⋅ 18 = 322 (г/моль).
Учитывая, что в 1 моль глауберовой соли (Na2SO4 ⋅ 10H2O) содержится 1 моль сульфата натрия (Na2SO4) и то, что молярные массы глауберовой соли (Na2SO4 ⋅ 10H2O) и сульфата натрия (Na2SO4) соответственно равны 322 и 142 г/моль, вычислим массы данных веществ по формуле, устанавливающей связь между массой и химическим количеством вещества:
Получаем:
m (Na2SO4) = 142 (г),
m (Na2SO4 ⋅ 10H2O) = 322 (г).
Найдем, какое количество (в граммах) глауберовой соли (Na2SO4 ⋅ 10H2O) содержит 71 г сульфата натрия (Na2SO4). Составим пропорцию:
в 322 г глауберовой соли содержится 142 г Na2SO4
в х г глауберовой соли содержится 71 г Na2SO4
Откуда:
глауберова соль Следовательно масса глауберовой соли (Na2SO4 ⋅ 10H2O), которую необходимо взять для приготовления заданного раствора, равна 161 г.
Вычислим массу воды, которую нужно взять для приготовления заданного раствора, по формуле:
Получаем:
m (H2O) = 710 – 161 = 549 (г).
Ответ:
масса глауберовой соли равна 161 грамм; масса воды равна 549 грамм.
Глауберова соль формула и применение. Инструкция по применению глауберовой соли в ветеринарии. Как сбросить лишние килограммы с помощью вещества
В те моменты, когда люди забывают о правилах питания и набирают по такому случаю некоторое количество излишних килограммов, бывает обидно и горько. Всем нам хочется быть привлекательными. А нормальная фигура — это один из кирпичиков, на котором строится привлекательность для окружающих и для себя. На помощь приходят диеты и отказ от острых и соленых блюд. Однако одну соль все-таки часто используют для ускоренного сбрасывания лишних килограммов. Заинтригованы? Этим веществом является не что иное, как глауберова соль.
Открытие Глаубера
Иоганн Рудольф Глаубер, открывший для народа такое чудесное вещество, был немецким алхимиком. Произошло это в не самый легкий момент его жизни. Однажды ученый заболел и совсем не смог есть — так его донимали спазмы кишечника и сопутствующие этому явления. Иоганну посоветовали взять кусок хлеба и отправиться к чудесному источнику. Жители городка утверждали, что, если хлеб смочить в той волшебной воде, человек излечится и станет есть. Не слишком надеясь на чудо, алхимик все же посетил водный источник и сделал все, как ему сказали. После хлебной трапезы он испил той же воды и, к своему удивлению, почувствовал себя лучше. Как ученый человек, Глаубер занялся рассмотрением состава жидкости. Несколько месяцев он проводил химические испытания, и в процессе выпаривания воды из источника были обнаружены кристаллы неизвестного соляного вида.
Однако до судьбоносного открытия оставалось еще несколько лет. Через годы, изучая соль, Глаубер проводил опыты и с удивлением обнаружил, что некоторые из получившихся кристаллов имели формулу той соли, которая спасла жизнь ученого. Вещество было названо «чудесная соль» — мирабилит. Эта соль содержится в некоторых сибирских озерах, в морских водах Чехии, в Калифорнии, Германии, на острове Сицилия.
Вещество было названо «чудесная соль» — мирабилит. Эта соль содержится в некоторых сибирских озерах, в морских водах Чехии, в Калифорнии, Германии, на острове Сицилия.
Свойства мирабилита
Формула глауберовой соли — Na 2 SO 4 · 10H 2 O. Это прозрачные кристаллы сероватого оттенка. Запаха у кристаллов нет. Вкус их горько-солоноватый. Глауберова соль способна выветриваться. Прекрасно растворяется в обычной воде.
Чем известна в медицине
Кристаллы соли, растворенные в воде, являются одним из мощнейших послабляющих средств. Это свойство полезно при отравлениях. Для подготовки к некоторым лечебным манипуляциям в области кишечника применение глауберовой соли является обязательной процедурой. Для комплексного лечения желчевыводящих путей и печени также применяется это вещество. В некоторых направлениях медицины ее активно применяют для борьбы с задержкой в организме жидкости.
Как это работает?
Формула глауберовой соли такова, что вещество это тянет на себя жидкость, находящуюся в организме. Попав в кишечник, такая соль, естественно, притягивает воду и разжижает стул. В свою очередь, работа кишечника усиливается, и массы в скором времени эвакуируются из человеческого тела. Вместе с каловыми веществами глауберова соль способна освободить организм от четырех литров жидкости. Токсические элементы и гнилостные бактерии, покинувшие человеческое тело, заодно облегчают работу лимфатической системе. Лимфа очищается благодаря мирабилиту, и происходит оздоровление организма. Кристаллы глауберовой соли, растворенные в воде, «уносят» также и ядовитые соли некоторых металлов (ртуть, свинец, медь, барий). Благодаря большим объемам потерянной жидкости раствор используют во время похудения. Жидкость имеет вес, соответственно, удалив ее, человек избавляется от килограммов.
Попав в кишечник, такая соль, естественно, притягивает воду и разжижает стул. В свою очередь, работа кишечника усиливается, и массы в скором времени эвакуируются из человеческого тела. Вместе с каловыми веществами глауберова соль способна освободить организм от четырех литров жидкости. Токсические элементы и гнилостные бактерии, покинувшие человеческое тело, заодно облегчают работу лимфатической системе. Лимфа очищается благодаря мирабилиту, и происходит оздоровление организма. Кристаллы глауберовой соли, растворенные в воде, «уносят» также и ядовитые соли некоторых металлов (ртуть, свинец, медь, барий). Благодаря большим объемам потерянной жидкости раствор используют во время похудения. Жидкость имеет вес, соответственно, удалив ее, человек избавляется от килограммов.
Глауберова соль: инструкция
Если вы решили избавиться от шлаков и нескольких килограммов веса, а вам пришла в голову идея сделать это с помощью мирабилита, сначала проконсультируйтесь со специалистом в области медицины. В случае, когда нет запрета на прием данной соли, начинаем очищение изнутри.
В случае, когда нет запрета на прием данной соли, начинаем очищение изнутри.
Очищение с помощью глауберовой соли — для человека целеустремленного и выносливого. Курс приема соли длится три дня. В течение упомянутого отрезка времени нужен полный отказ от пищи. Еду в эти дни будет заменять ассорти из соков. Эти напитки не должны быть из магазина. Так что выжимать соки придется самостоятельно. Каждый день делать порцию сока из следующих цитрусовых:
- лимон — около двух штук;
- апельсины — четыре штуки;
- грейпфруты — три-четыре штуки.
На два литра получившегося сока добавляется столько же чистой воды без газа.
Приготовить раствор для процедуры очищения нужно следующим образом: столовую ложку мирабилита засыпать в двести миллилитров подогретой кипяченой воды и растворить.
Чистка началась
Утром выпить стакан раствора на голодный желудок. Через тридцать минут употребить свежеприготовленный соковый раствор. Повторять прием цитрусового сока с водой необходимо каждый получасовой отрезок времени. Послабляющий эффект будет очень ярко выражен, поэтому не стоит забывать обязательно пить приготовленный микс из воды и сока. Этот прием спасет вас от возможного обезвоживания. Помните: обезвоживание организма опасно для жизни!
Послабляющий эффект будет очень ярко выражен, поэтому не стоит забывать обязательно пить приготовленный микс из воды и сока. Этот прием спасет вас от возможного обезвоживания. Помните: обезвоживание организма опасно для жизни!
Если трехдневный голод вы не сможете выдержать, тогда скушайте несколько мандаринок или парочку апельсинов. Или позвольте себе полакомиться грейпфрутом. Это все, что можно есть в течение трех суток. Чаи, булочки и прочие продукты полностью удалите из рациона.
На заметку:
- Если постоянно хочется пить, а соковый напиток нужно продлить до вечернего времени — пейте простую чистую воду.
- Не злоупотребляйте данным способом очищения и снижения веса. Эта жесткая процедура и применение ее, возможно, всего один раз в год.
- В случае, когда появилась тошнота, слабость или озноб, — прекратите всякую чистку. А если вдруг возникло повышение температуры или прочие опасные моменты, — вызывайте доктора.
После трехдневного голодания и очищения солевым раствором на четвертые сутки начинайте вводить еду. На завтрак порадуйте себя кашей, сваренной на воде. Обед устройте из куриного бульона. С пятых суток осторожно вводите в рацион нормальную пищу.
На завтрак порадуйте себя кашей, сваренной на воде. Обед устройте из куриного бульона. С пятых суток осторожно вводите в рацион нормальную пищу.
Отрицательные моменты применения сульфата натрия
У средства, кроме хороших моментов, существуют и отрицательные:
- Обезвоживание. Об этом было много сказано, но повторимся еще раз. Обезвоживание — это опасно и плохо.
- Позывы ко рвоте.
- Удаление из организма вместе со шлаками еще и необходимых веществ.
- Используя соль для того, чтобы постройнеть, помните: жир никуда не денется во время очищения организма. Уходит только вода.
Случаи, в которых противопоказано применение глауберовой соли для людей
Вещество способно усугубить течение некоторых заболеваний. Люди, имеющие хронические проблемы со здоровьем, должны остерегаться всякого самолечения и самоочищения. Нужно помнить о том, что перед любым вмешательством в размеренное течение жизни организма следует сначала посетить доктора. Случай с глауберовой солью — не исключение. Пройдя консультацию с врачом и необходимые лабораторные анализы, вы узнаете, можно ли вам применять нечто подобное.
Случай с глауберовой солью — не исключение. Пройдя консультацию с врачом и необходимые лабораторные анализы, вы узнаете, можно ли вам применять нечто подобное.
Еще причины, запрещающие прием раствора:
- Беременным женщинам противопоказано всякое самолечение. Запрещено в это время проводить солевое воздействие на организм.
- Женщины, вскармливающие ребенка, обязаны отказаться от сей процедуры. Не стоит забывать, что дитя вместе с молоком получит то, что для него опасно.
- Гипотоникам и истощенным людям нельзя принимать раствор.
- Пожилые люди должны проявить мудрость и поберечь себя.
- Любые болезни, связанные с ЖКТ, — причина для отказа от приема раствора мирабилита.
Глауберова соль реализуется в основном через ветеринарные учреждения. Для животных эта соль — полезное вещество. Ее дают для повышения аппетита сельскохозяйственному скоту. Способ применения и дозы — прямо на упаковке либо в сопровождающей инструкции.
Глауберова соль получила свое название от фамилии ее открывателя немца Глаубера.
Позже Глаубер начал получать указанный продукт из обыкновенной поваренной соли, на которую действовали серной кислотой. Но на открытом воздухе содержать глауберову соль нельзя, так как она постепенно выветривается.
Глауберова соль обладает сильным слабительным эффектом и ее применение оправдано при наличии отравления, для очищения кишечника, а также при наличии заболеваний печени. Данное средство вызывает разжижение каловых масс, вследствие чего начинается сильный понос, таким образом, организм очищается от токсинов и шлаков, которые вместе с жидкостью выводятся из него.
Глауберова соль применение
Данный препарат можно применять и в качестве наружного средства, он помогает очищать верхний слой эпидермиса, который ороговел. В зависимости от организма человека применение данного средства позволяет выводить из организма до 4 литров жидкости. Естественно данный процесс сопровождается заметным снижением веса.
Но в связи с тем, что глауберова соль — сильное слабительное средство, нельзя допускать обезвоживания организма и при ее приеме необходимо употреблять много жидкости. Если вы принимаете данный препарат, то принимать пищу в этот день нельзя.
Многие специалисты рекомендуют во время приема указанного средства принимать специально приготовленный сок. В его состав входит 4 грейпфрута, 3 апельсина и 2 лимона. Из указанных фруктов делают фреш, его получится около 3 литров.
В его состав входит 4 грейпфрута, 3 апельсина и 2 лимона. Из указанных фруктов делают фреш, его получится около 3 литров.
Глауберова соль также применяется для похудения и очищения организма. Для этого необходимо с утра выпить стакан воды, в котором развести ложку данного средства. По прошествии получаса, надо начинать пить предварительно приготовленный сок. Достаточно через 30 минут делать несколько глотков напитка.
Вечером необходимо выполнить Для ее выполнения используют 2 литра воды, в которую добавлен сок 2 лимонов. Указанная процедура проводится на протяжении 3 дней. На четвертый день необходимо пить овощные соки и надо есть сырые овощи. Не стоит бояться, если к концу данного процесса очищения вы почувствуете слабость, это естественно. При появлении слабости необходимо прилечь, но принимать пищу нельзя. После того как вы начнете принимать сырые овощи, на протяжении 5-7 дней необходимо постепенно переводить свой организм к привычному для него приему пищи.
Что касается похудения, то не стоит заблуждаться, глауберовая соль помогает выводить из организма жидкость и поэтому происходит снижение веса.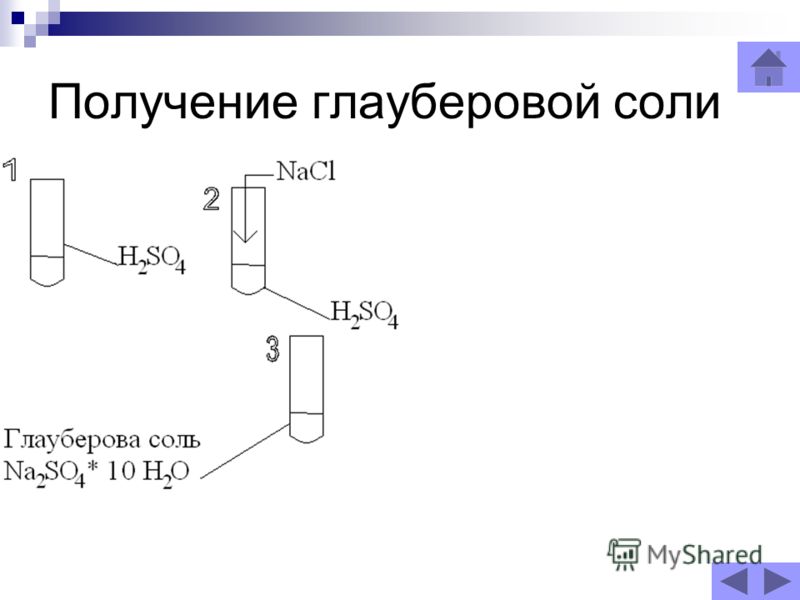 Но жир при использовании данного препарата не разрушается, и худеть или нет, используя указанный способ, решать вам.
Но жир при использовании данного препарата не разрушается, и худеть или нет, используя указанный способ, решать вам.
Применяется глауберова соль и при необходимости проведения лечения глистной инвазии, в этом случае с ее помощью проводится предварительное
Но в любом случае нельзя заниматься самолечением, данное средство можно принимать только после консультации у врача.
Глауберова соль — слышали о таком?.. Говорят, она очищает организм от шлаков, выводит всю лишнюю жидкость и налаживает работу организма. Так ли это на самом деле, рассказал эксперт потребительского рынка Станислав Черкасов, пишет health info со ссылкой на the-challenger.ru.
«Глауберова соль стала известна за счёт популяризации в качестве эффективного средства для быстрого похудения. Этот продукт ещё называют сибирской солью, гуджиром и мирабилитом, что в переводе с латинского означает «чудесная соль». На самом деле эти горько-солёные бесцветные кристаллы без запаха — не что иное, как сульфат натрия. Они выветриваются на воздухе и хорошо растворяются в воде. Впервые эту соль совершенно случайно в ходе опытов обнаружил в XVII веке немецкий химик и королевский лекарь Глаубер, в честь которого она и получила своё название», — рассказывает Станислав Черкасов.
Они выветриваются на воздухе и хорошо растворяются в воде. Впервые эту соль совершенно случайно в ходе опытов обнаружил в XVII веке немецкий химик и королевский лекарь Глаубер, в честь которого она и получила своё название», — рассказывает Станислав Черкасов.
Добывают её в основном из природных источников, большая часть которых находится в России — это озеро Кучук на Алтае, несколько озёр в Томской области (отсюда и второе по популярности название соли — «сибирская»), на астраханском Малиновском озере. Ещё промысел глауберовой соли ведётся в Канаде, США, Германии и на Сицилии. В растворённом виде природный сульфат натрия присутствует в источниках на всемирно известном курорте Карловы Вары.
В первую очередь глауберова соль получила своё широкое применение в медицине благодаря мощным слабительным свойствам. Её обычно назначают людям при различных отравлениях, заболеваниях печени, желчевыводящих путей, желудочно-кишечных и почечных жалобах. В альтернативной медицине глауберову соль также активно используют при задержке жидкости и в качестве профилактики очищения организма.
При очищении кишечника глауберова соль способна вывести из организма до четырёх литров лишней жидкости. Из-за этого многие диетологи стали включать продукт в программы для похудения. Действительно, во многих случаях применение этой соли приводит к резкому снижению массы тела. Но помните: глауберова соль ни в коем случае не расщепляет накопившийся жир. Её призвание — очищать кишечник и выводить из организма лишнюю жидкость. Использовать этот продукт следует исключительно по рекомендации и под наблюдением врача — при самостоятельной чистке организма глауберовой солью можно нанести существенный или даже непоправимый вред организму, предостерегает Станислав Черкасов.
Что ещё надо знать
Стандартная дозировка для взрослого человека — 10-30 граммов сульфата натрия, их необходимо растворить в 400-500 мл воды. Употребление любой пищи в день приёма сибирской соли строго запрещено. Кроме того, необходимо пить большое количество воды, чтобы не допустить обезвоживания организма.
В пищевой промышленности сибирская соль используется как консервант. В розничной торговле купить её довольно сложно: чаще всего она продаётся в ветеринарных аптеках — её назначают всем видам животных и птиц для повышения аппетита и улучшения пищеварения, как слабительное при запорах, переполнении и засорении кишечника, метеоризме, а также как противоядие при отравлении солями бария, ртути, свинца.
Глауберова соль: применение в медицине, свойства
Глауберова соль получила свое наименование благодаря немцу Глауберу, который ее открыл. Это вещество представляет собой прозрачные, бесцветные кристаллы, которые выветриваются со временем, и имеют горько-соленый вкус. Соль применяют в медицине в качестве сильного, эффективного слабительного средства.
Открытие глауберовой соли датировано зимой 1626 года и непосредственно связано с перенесённой в 1625 году Глаубером болезнью — сыпным тифом, в то время именуемого «венгерской лихорадкой». Вот как сам Глаубер описывал это:
Несколько оправившись от болезни, я прибыл в Неаполис (латинизированное название Нойштадта, по-немецки — «нового города»; в Германии несколько городов имеют такое название). Там у меня снова начались приступы, и я должен был остаться в этом городе. Болезнь настолько ослабила мой желудок, что он не мог ни принимать, ни переваривать никакую еду. Местные жители посоветовали мне пойти к источнику, находящемуся вблизи виноградника в часе ходьбы от города. Они сказали, что вода источника вернет мне аппетит. Следуя их совету, я взял с собой большой кусок хлеба; мне сказали, что должен буду весь его съесть, но я мало верил в то, что это мне как-то поможет. Придя к источнику, я намочил хлебный мякиш в воде и съел его — причём с большим удовольствием, хотя перед этим не мог смотреть без отвращения на самые изысканные лакомства. Взяв оставшуюся от хлеба корку, я зачерпнул ею воды из источника и выпил её. Это настолько возбудило мой аппетит, что в конце концов я съел и «чашку» из хлеба, которой черпал воду. Домой я возвратился значительно окрепшим и поделился своими впечатлениями с соседями. Я чувствовал, что если буду и дальше лечиться этой водой, функции моего желудка полностью восстановятся.
Там у меня снова начались приступы, и я должен был остаться в этом городе. Болезнь настолько ослабила мой желудок, что он не мог ни принимать, ни переваривать никакую еду. Местные жители посоветовали мне пойти к источнику, находящемуся вблизи виноградника в часе ходьбы от города. Они сказали, что вода источника вернет мне аппетит. Следуя их совету, я взял с собой большой кусок хлеба; мне сказали, что должен буду весь его съесть, но я мало верил в то, что это мне как-то поможет. Придя к источнику, я намочил хлебный мякиш в воде и съел его — причём с большим удовольствием, хотя перед этим не мог смотреть без отвращения на самые изысканные лакомства. Взяв оставшуюся от хлеба корку, я зачерпнул ею воды из источника и выпил её. Это настолько возбудило мой аппетит, что в конце концов я съел и «чашку» из хлеба, которой черпал воду. Домой я возвратился значительно окрепшим и поделился своими впечатлениями с соседями. Я чувствовал, что если буду и дальше лечиться этой водой, функции моего желудка полностью восстановятся. Я спросил, что это за вода. Мне сказали, что в ней содержится селитра, чему тогда, не будучи искушён в подобных вопросах, я поверил.
Я спросил, что это за вода. Мне сказали, что в ней содержится селитра, чему тогда, не будучи искушён в подобных вопросах, я поверил.
Глаубер заинтересовался химическим составом воды источника и посвятил этому изучению всю следующую зиму. Он подружился с местным аптекарем Айснером и использовал его лабораторию для опытов. В ходе исследований он выпаривал минеральную воду и анализировал осадки. Вместо селитры в осадке оказалась ранее неизвестная соль, которую он назвал «чудесной» — по латыни «sal mirabile». В частности, название природного минерала мирабилита происходит именно из латинского названия.
Более подробно об этом лекарственном средстве мы поговорим с вами на сайте www.rasteniya-lecarstvennie.ru, в публикации: глауберова соль применение в медицине, свойства.
Лечебные свойства глауберовой соли
Это мощное слабительное средство быстрого действия. Как правило, ее используют при сильных пищевых отравлениях, для тщательной очистки кишечника, лимфатической системы, а также по медицинским показаниям ее применяют при заболеваниях печени.
При очистке кишечника, попадая в организм человека, раствор соли существенно разжижает каловые массы, увеличивает их объем, вызывая сильный понос. Главный эффект такого очищения, что раствор собирает вместе отмершие клетки, шлаки, токсины, выводя их наружу вместе с жидкостью.
При наружном применении это средство действует аналогично — отчищает ороговевший слой эпидермиса.
Как применять глауберову соль?
В медицине средство применяют внутрь в виде водного раствора, болюсов, кашки. Наружно — в виде раствора.
Наружно применяют раствор для лечения долго не заживающих гнойных ран, так как раствор обладает подсушивающим свойством, усиливает отделение гнойного содержимого, очищая, дезинфицируя, таким образом, рану.
Очищение кишечника
При приеме внутрь препарат плохо всасывается желудочно-кишечном трактом, притягивая к кишечнику большой объем жидкости. Для наилучшего эффекта очищения используют раствор 5—10%-ной концентрации. Послабление происходит через 2-5 часов после приема.
При применении средства внутрь, следует помнить, что глауберова соль медленно всасывается слизистой желудка, кишечника, обеспечивая медленное сгущение слизи. Поэтому очищение кишечника раствором проводят три дня.
Для приготовления раствора растворите 1 ст. л. препарата на 200 мл. кипяченой воды комнатной температуры.
Это средство нужно выпивать каждое утро на голодный желудок. Оно эффективно очистит организм от вредных веществ, ядов. Но так как раствор обладает высушивающими свойствами, это может привести к обезвоживанию.
Поэтому во время лечения каждый день выпивайте 2 л. смеси свежевыжатых соков из 4 плодов грейпфрута, 2 лимонов, 3 плодов апельсина. После проведения трехдневного очищения, на 4 день можно начать употреблять сырые овощи, фрукты, свежевыжатые овощные соки. Через неделю можно постепенно переходить к привычному режиму питания.
Как очистить лимфу с помощью глауберовой соли?
Лимфатическая система нашего организма защищает его от проникновения различных инфекций. Если лимфа загрязнена, вся система теряет свою защитную функцию, ставя здоровье человека под удар. В организм устремляются полчища микробов, вирусов, бактерий, уничтожая все на своем пути. Отсюда аллергические заболевания, простуды, грипп, астма, раковые опухоли.
Если лимфа загрязнена, вся система теряет свою защитную функцию, ставя здоровье человека под удар. В организм устремляются полчища микробов, вирусов, бактерий, уничтожая все на своем пути. Отсюда аллергические заболевания, простуды, грипп, астма, раковые опухоли.
Раствор глауберовой соли по утверждениям знахарей поможет эффективно очистить лимфу и восстановить защитные функции организма. Но тут есть одно необходимое условие: Очищение лимфы следует проводить только после
очистки печени.
Если это условие соблюдено, можно приступать непосредственно к процедуре очистки.
Приготовьте свежий сок из грейпфрутов, апельсинов. Их нужно взять по 900 г. Соки смешайте, добавьте туда же 200 мл лимонного сока. Все перемешайте, разбавьте смесь 2 л. чистой, свежей воды, храните в холодильнике. Сок делайте с утра, в день процедуры.
С вечера сделайте клизму. Утром натощак выпейте раствор глауберовой соли (50 г на 1 стакан чистой воды). Этот раствор вскоре начнет действовать, очищая лимфатическую систему от грязи.
Через час начинайте пить приготовленный с утра напиток по 1 стакану каждые 30 мин. За весь день следует выпить все без остатка. Перед употреблением его лучше подогреть до 35 градусов. Никакой пищи в дни очистки употреблять нельзя. Но этот напиток является эффективным энергетиком, поэтому голод практически не ощущается.
Очищение следует проводить три дня подряд. Утром принимайте солевой раствор, затем пейте смесь соков и воды каждые полчаса. За это время лимфатическая система полностью очистится.
После полного проведения процедур, можно постепенно переходить на легкие, жидкие каши, кисломолочные продукты, свежие, нежирные куриные бульоны. Еще через пару дней, можно переходить к обычному рациону.
Будьте внимательны! Такую чистку следует проводить не чаще, чем 1 раз за год. Не следует проводить процедуры очистки при заболеваниях желудка и 12-перстной кишки.
Глауберова соль очень сильное послабляющее средство для очистки кишечника. Именно такое ее основное применение в медицине. Чтобы не нанести вреда своему организму, используйте очищающие свойства этого средства, посоветовавшись с врачом. Будьте здоровы!
Чтобы не нанести вреда своему организму, используйте очищающие свойства этого средства, посоветовавшись с врачом. Будьте здоровы!
Глауберова соль (или мирабилит) – это легко растворяющийся в воде кристаллический порошок, получаемый путем действия серной кислоты на хлорид натрия. Соль имеет широкое промышленное применение, а также используется в народной медицине в качестве слабительного для очистки кишечника и лимфы.
Области использования
Существует несколько направлений применения декагидрата сульфата натрия (название по химической формуле):
- в производстве продуктов питания в качестве добавки Е514. Эмульгатор применяется как наполнитель для придания однородной консистенции и регулятор кислотности;
- в стекольном производстве;
- в текстильной промышленности;
- в производстве бытовой химии, в частности стиральных порошков;
- в ветеринарии – назначается животным (лошадям, крупному и мелком рогатому скоту, собакам, кошкам, птицам) при запорах, вздутии и переполнении кишечника, для выведения токсинов, при отравлениях свинцом и ртутью.
 В малых дозах применяется для улучшения аппетита и пищеварения, для очищения ран, при отеках и воспалениях;
В малых дозах применяется для улучшения аппетита и пищеварения, для очищения ран, при отеках и воспалениях; - в медицине – в составе препаратов для терапии запоров, геморроя и гипертонического криза. Распространена практика использования в качестве очистителя пищеварительного тракта при отравлениях ртутью, медью, свинцом и прочими солями металлов.
Глауберова соль при запоре
Лечебное действие вещества при запоре обусловлено его способностью разжижать каловые массы, что провоцирует диарею. Это сильное слабительное средство, механизм действия основан на накоплении воды в кишечнике из-за медленной абсорбции соли, а также на дополнительном раздражающем слизистую эффекте. Как и другие солевые слабительные, например английская соль (магнезия), мирабилит очищает пищеварительную систему по всей ее протяженности. Назначается препарат при:
- острой форме запора;
- подготовке кишечника к проведению оперативного вмешательства или диагностического мероприятия.

Согласно инструкции, при запоре взрослому человеку назначается доза от 10 до 30 грамм вещества, предварительно растворенного в половине литра теплой воды на голодный желудок. Эффект будет достигнут после разового приема раствора в период от 1 до 3 часов. В педиатрии препарат может быть назначен врачом в дозировке 1 грамм на год жизни (детям старше 12-ти месяцев).
Использование глауберовой соли может иметь побочные действия для организма: тошнота, сильная диарея (при отсутствии достаточного поступления жидкости может обернуться обезвоживанием организма), болезненные спазмы кишечника. Срок годности препарата – от 1 до 3 лет, по истечению которых его использование запрещено.
Для очищения кишечника
Глауберова соль радикально очищает пищеварительный тракт, вызывая обильную диарею – эффект позволяет вывести скопившиеся каловые массы и опасные токсины. Для профилактического очищения можно следовать разным рецептам:
- 2-3 ложки кристаллов нужно развести в стакане воды, добавить немного апельсинового сока для вкуса.
 Полученный напиток необходимо выпить утром на голодный желудок, после чего ожидать появления поноса (через 1-2 часа). Эффект будет длиться около 6 часов, нужно потреблять много чистой воды, соков, и воздерживаться от приема пищи. Очищение проводят максимум 2 дня подряд;
Полученный напиток необходимо выпить утром на голодный желудок, после чего ожидать появления поноса (через 1-2 часа). Эффект будет длиться около 6 часов, нужно потреблять много чистой воды, соков, и воздерживаться от приема пищи. Очищение проводят максимум 2 дня подряд; - заранее готовят раствор соли, купленной в аптеке – 30 грамм веществ на 1,5 стакана чистой воды до полного растворения. За пару часов до сна выпивают полученную жидкость небольшими порциями на протяжении получаса, а в конце – половину литра воды для профилактики обезвоживания. Эффект будет на утро. Такое очищение требует соблюдения трехдневной диеты без тяжелых продуктов (грибов, бобов, молочных продуктов, яиц, жирного мяса и рыбы).
Для похудения
Для проведения процедуры очищения с целью похудеть необходимо предварительно подготовится. Первый шаг — приготовить напиток: сок 4 грейпфрутов, 3 апельсинов и 2 лимонов, разведенный чистой водой в пропорции 1 к 1. С утра на голодный желудок требуется выпить стакан воды с разведенной в нем столовой ложкой сульфата натрия, и через полчаса начинать пить каждые 30 минут по несколько глотков цитрусового напитка. Перед сном требуется дополнительное проведение очистительной клизмы.
Перед сном требуется дополнительное проведение очистительной клизмы.
Для взрослых и здоровых людей цикл должен проводиться три дня подряд. Продается соль без рецепта, но принимать ее разрешается исключительно после консультации с врачом. Показаниями к такой очистке может выступать необходимость избавления от лишней жидкости и токсинов, мешающих сбросить лишний вес.
Противопоказания
Применение слабительной соли и ее аналогов запрещается при наличии у человека противопоказаний:
- язвенные поражения пищеварительного тракта;
- острые стадии воспалительных процессов;
- аппендицит;
- период менструации у женщин;
- вынашивание ребенка и кормление грудью;
- пониженное давление;
- возраст до года;
- сердечная недостаточность;
- запор в хронической форме;
- ослабленное состояние организма, истощение.
инструкция по применению для собак и кошек
Все хозяева котов и собак отмечают их удивительную способность с помощью ласки избавить вас от последствий тяжёлого стрессового дня. Но случается, что и сам любимец может пострадать от переедания или чьего-то злого умысла. Самым безопасным средством помощи при заболеваниях кишечника служит препарат под названием «Глауберова соль».
Но случается, что и сам любимец может пострадать от переедания или чьего-то злого умысла. Самым безопасным средством помощи при заболеваниях кишечника служит препарат под названием «Глауберова соль».
Описание и форма выпуска
«Глауберова соль» (мирабилит, сульфат натрия) — это такие десятиводные кристаллы сульфата натрия, которые были найдены немецким учёным Иоганном Рудольфом Глаубером в 1626 г. в минеральном источнике, затем через 22 года он узнал, что случайно получил их химическим путём.
Знаете ли вы? Сам Глаубер назвал минерал «sal mirabile» — чудесная соль, потому что он помог ему вылечиться от тяжёлого заболевания.
В продажу средство поступает в виде порошка из мелких кристаллов без запаха, по вкусу оно солёное и одновременно с горьким привкусом. Расфасовывают мирабилит в пластиковые банки вместимостью 80 г, 180 г, 400 г, 500 г или 1 кг, ламинированные пакеты по 200 г, полиэтиленовые пакеты 0,5 кг, а также мешки весом 35 кг.
Состав препарата
Если представить «Глауберову соль» в виде химической формулы, то это будет иметь такой вид: Na2SO4 ∙ 10h3O. То есть в состав препарата входит натриевая соль серной кислоты (сернокислый натрий) в виде кристаллов с десятью молекулами воды.
Фармакологические свойства
В ветеринарной медицине препарат применяется в качестве слабительного на солевой основе, для устранения отравления, избавления от запоров, вздутий кишечника, улучшения пищеварения и аппетита, выделения жёлчи, выведения жидкости, очищения ран, параллельно с противопаразитарными средствами.
Попадая в желудок, десятиводный сульфат натрия не всасывается, а впитывает жидкость, в результате чего раздражаются рецепторы слизистой оболочки кишечника, и он начинает сильнее сокращаться, что приводит к выделению слизи и продвижению пищи наружу.
Когда давать «Глауберову соль»: показания
Согласно инструкции по применению в ветеринарии «Глауберовой соли», показаниями для её назначения являются:
- Запор.

- Вздутие.
- Пищевое отравление.
- Закупорка кишечника.
- Перекармливание.
- Плохой аппетит.
- Интоксикация отравляющими веществами.
- Опухоль мозга вследствие инсульта или механического повреждения.
- Хронические заболевания печени.
- Пневмония.
- Водянка.
- Плеврит.
- Гнойные раны.
Инструкция по применению и дозировка
Дозировка сульфата натрия расписана в инструкции по применению для различных животных. Внешне препарат применяется для лечения гнойных ран, в остальных случаях его употребляют внутрь.
Важно! «Глауберову соль» перед применением необходимо растворить в значительном количестве воды.
Для собак
Если возникла необходимость в слабительном средстве, собакам назначают от 10 до 25 г соли в зависимости от веса животного, растворяя её в воде в соотношении 1 к 17.
Для очищения кишечника, выведения яда, лечения пневмонии, плеврита, опухолей доза составляет 1,5 г сульфата натрия на 1 кг веса собаки, растворённого в воде 1 к 17.
Когда у собаки ухудшается аппетит или пищеварение, ей дают мирабилит из расчёта 1 г на 1 кг веса, растворяя в воде в соотношении 1 к 50.
Для лечения ран из препарата делают примочки, растворяя его в воде в соотношении 1 к 10.
Для кошек
В лечении кошек «Глауберову соль» применяют следующим образом:
1. Отравление и опухоли — внутрь в дозе 1,5 г на 1 кг веса, разбавив водой до получения шестипроцентного раствора.
2. Улучшение аппетита и пищеварения — внутрь в дозе 1 г на 1 кг веса животного, растворив в воде, чтобы получился одно- или двухпроцентный раствор.
3. Запор — внутрь в дозе от 3 до 10 г на 1 кота как шестипроцентный раствор.
4. Нарыв –— компресс из десятипроцентного раствора.
Знаете ли вы? «Глауберова соль» используется для производства стекла и соды.
Побочные действия и противопоказания
Средство противопоказано, если животное:
- измождено;
- обезвожено;
- имеет преклонный возраст;
- страдает от нарушения сердечно-сосудистой системы;
- страдает от непроходимости кишечника;
- больно диареей;
- имеет аллергию на препарат;
- поражено острым воспалением кишечника.

Условия хранения и срок годности
Хранить «Глауберову соль» можно в закрытой упаковке при температуре от -45 °С до +25 °С. В помещении для хранения должно быть сухо, темно, к препарату не должны иметь доступ дети.
Важно! В знойное лето десятиводный сульфат натрия может стать жидким.
При соблюдении условий хранения средство не потеряет своих лечебных свойств в течение 2 лет.
Хотя «Глауберова соль» помогает при многих заболеваниях, всё же лучше позаботиться о том, чтобы оградить вашего любимца от помоек, мусорных свалок, самостоятельных прогулок и контактов с посторонними людьми.
Была ли эта статья полезна?
Да
Нет
4
раза уже
помогла
С какими веществами реагирует мирабилит.
 Что такое глауберова соль? Отрицательные моменты применения сульфата натрия
Что такое глауберова соль? Отрицательные моменты применения сульфата натрияВ те моменты, когда люди забывают о правилах питания и набирают по такому случаю некоторое количество излишних килограммов, бывает обидно и горько. Всем нам хочется быть привлекательными. А нормальная фигура — это один из кирпичиков, на котором строится привлекательность для окружающих и для себя. На помощь приходят диеты и отказ от острых и соленых блюд. Однако одну соль все-таки часто используют для ускоренного сбрасывания лишних килограммов. Заинтригованы? Этим веществом является не что иное, как глауберова соль.
Открытие Глаубера
Иоганн Рудольф Глаубер, открывший для народа такое чудесное вещество, был немецким алхимиком. Произошло это в не самый легкий момент его жизни. Однажды ученый заболел и совсем не смог есть — так его донимали спазмы кишечника и сопутствующие этому явления. Иоганну посоветовали взять кусок хлеба и отправиться к чудесному источнику. Жители городка утверждали, что, если хлеб смочить в той волшебной воде, человек излечится и станет есть. Не слишком надеясь на чудо, алхимик все же посетил водный источник и сделал все, как ему сказали. После хлебной трапезы он испил той же воды и, к своему удивлению, почувствовал себя лучше. Как ученый человек, Глаубер занялся рассмотрением состава жидкости. Несколько месяцев он проводил химические испытания, и в процессе выпаривания воды из источника были обнаружены кристаллы неизвестного соляного вида.
Не слишком надеясь на чудо, алхимик все же посетил водный источник и сделал все, как ему сказали. После хлебной трапезы он испил той же воды и, к своему удивлению, почувствовал себя лучше. Как ученый человек, Глаубер занялся рассмотрением состава жидкости. Несколько месяцев он проводил химические испытания, и в процессе выпаривания воды из источника были обнаружены кристаллы неизвестного соляного вида.
Однако до судьбоносного открытия оставалось еще несколько лет. Через годы, изучая соль, Глаубер проводил опыты и с удивлением обнаружил, что некоторые из получившихся кристаллов имели формулу той соли, которая спасла жизнь ученого. Вещество было названо «чудесная соль» — мирабилит. Эта соль содержится в некоторых сибирских озерах, в морских водах Чехии, в Калифорнии, Германии, на острове Сицилия.
Свойства мирабилита
Формула глауберовой соли — Na 2 SO 4 · 10H 2 O. Это прозрачные кристаллы сероватого оттенка. Запаха у кристаллов нет. Вкус их горько-солоноватый. Глауберова соль способна выветриваться. Прекрасно растворяется в обычной воде.
Глауберова соль способна выветриваться. Прекрасно растворяется в обычной воде.
Чем известна в медицине
Кристаллы соли, растворенные в воде, являются одним из мощнейших послабляющих средств. Это свойство полезно при отравлениях. Для подготовки к некоторым лечебным манипуляциям в области кишечника применение глауберовой соли является обязательной процедурой. Для комплексного лечения желчевыводящих путей и печени также применяется это вещество. В некоторых направлениях медицины ее активно применяют для борьбы с задержкой в организме жидкости.
Как это работает?
Формула глауберовой соли такова, что вещество это тянет на себя жидкость, находящуюся в организме. Попав в кишечник, такая соль, естественно, притягивает воду и разжижает стул. В свою очередь, работа кишечника усиливается, и массы в скором времени эвакуируются из человеческого тела. Вместе с каловыми веществами глауберова соль способна освободить организм от четырех литров жидкости. Токсические элементы и гнилостные бактерии, покинувшие человеческое тело, заодно облегчают работу лимфатической системе. Лимфа очищается благодаря мирабилиту, и происходит оздоровление организма. Кристаллы глауберовой соли, растворенные в воде, «уносят» также и ядовитые соли некоторых металлов (ртуть, свинец, медь, барий). Благодаря большим объемам потерянной жидкости раствор используют во время похудения. Жидкость имеет вес, соответственно, удалив ее, человек избавляется от килограммов.
Лимфа очищается благодаря мирабилиту, и происходит оздоровление организма. Кристаллы глауберовой соли, растворенные в воде, «уносят» также и ядовитые соли некоторых металлов (ртуть, свинец, медь, барий). Благодаря большим объемам потерянной жидкости раствор используют во время похудения. Жидкость имеет вес, соответственно, удалив ее, человек избавляется от килограммов.
Глауберова соль: инструкция
Если вы решили избавиться от шлаков и нескольких килограммов веса, а вам пришла в голову идея сделать это с помощью мирабилита, сначала проконсультируйтесь со специалистом в области медицины. В случае, когда нет запрета на прием данной соли, начинаем очищение изнутри.
Очищение с помощью глауберовой соли — для человека целеустремленного и выносливого. Курс приема соли длится три дня. В течение упомянутого отрезка времени нужен полный отказ от пищи. Еду в эти дни будет заменять ассорти из соков. Эти напитки не должны быть из магазина. Так что выжимать соки придется самостоятельно. Каждый день делать порцию сока из следующих цитрусовых:
Каждый день делать порцию сока из следующих цитрусовых:
- лимон — около двух штук;
- апельсины — четыре штуки;
- грейпфруты — три-четыре штуки.
На два литра получившегося сока добавляется столько же чистой воды без газа.
Приготовить раствор для процедуры очищения нужно следующим образом: столовую ложку мирабилита засыпать в двести миллилитров подогретой кипяченой воды и растворить.
Чистка началась
Утром выпить стакан раствора на голодный желудок. Через тридцать минут употребить свежеприготовленный соковый раствор. Повторять прием цитрусового сока с водой необходимо каждый получасовой отрезок времени. Послабляющий эффект будет очень ярко выражен, поэтому не стоит забывать обязательно пить приготовленный микс из воды и сока. Этот прием спасет вас от возможного обезвоживания. Помните: обезвоживание организма опасно для жизни!
Если трехдневный голод вы не сможете выдержать, тогда скушайте несколько мандаринок или парочку апельсинов. Или позвольте себе полакомиться грейпфрутом. Это все, что можно есть в течение трех суток. Чаи, булочки и прочие продукты полностью удалите из рациона.
Или позвольте себе полакомиться грейпфрутом. Это все, что можно есть в течение трех суток. Чаи, булочки и прочие продукты полностью удалите из рациона.
На заметку:
- Если постоянно хочется пить, а соковый напиток нужно продлить до вечернего времени — пейте простую чистую воду.
- Не злоупотребляйте данным способом очищения и снижения веса. Эта жесткая процедура и применение ее, возможно, всего один раз в год.
- В случае, когда появилась тошнота, слабость или озноб, — прекратите всякую чистку. А если вдруг возникло повышение температуры или прочие опасные моменты, — вызывайте доктора.
После трехдневного голодания и очищения солевым раствором на четвертые сутки начинайте вводить еду. На завтрак порадуйте себя кашей, сваренной на воде. Обед устройте из куриного бульона. С пятых суток осторожно вводите в рацион нормальную пищу.
Отрицательные моменты применения сульфата натрия
У средства, кроме хороших моментов, существуют и отрицательные:
- Обезвоживание.
 Об этом было много сказано, но повторимся еще раз. Обезвоживание — это опасно и плохо.
Об этом было много сказано, но повторимся еще раз. Обезвоживание — это опасно и плохо. - Позывы ко рвоте.
- Удаление из организма вместе со шлаками еще и необходимых веществ.
- Используя соль для того, чтобы постройнеть, помните: жир никуда не денется во время очищения организма. Уходит только вода.
Случаи, в которых противопоказано применение глауберовой соли для людей
Вещество способно усугубить течение некоторых заболеваний. Люди, имеющие хронические проблемы со здоровьем, должны остерегаться всякого самолечения и самоочищения. Нужно помнить о том, что перед любым вмешательством в размеренное течение жизни организма следует сначала посетить доктора. Случай с глауберовой солью — не исключение. Пройдя консультацию с врачом и необходимые лабораторные анализы, вы узнаете, можно ли вам применять нечто подобное.
Еще причины, запрещающие прием раствора:
- Беременным женщинам противопоказано всякое самолечение. Запрещено в это время проводить солевое воздействие на организм.

- Женщины, вскармливающие ребенка, обязаны отказаться от сей процедуры. Не стоит забывать, что дитя вместе с молоком получит то, что для него опасно.
- Гипотоникам и истощенным людям нельзя принимать раствор.
- Пожилые люди должны проявить мудрость и поберечь себя.
- Любые болезни, связанные с ЖКТ, — причина для отказа от приема раствора мирабилита.
Глауберова соль реализуется в основном через ветеринарные учреждения. Для животных эта соль — полезное вещество. Ее дают для повышения аппетита сельскохозяйственному скоту. Способ применения и дозы — прямо на упаковке либо в сопровождающей инструкции.
Мирабилит (сульфат натрия, глауберова соль, Е 514) — слабительная соль, которая применяется в качестве слабительного средства для устранения запора, а также для очищения кишечника, печени, лимфы.
Свое название глауберова соль получила в честь Иоганна Рудольфа Глаубера, который ее впервые открыл (1604 – 1670). Ученый восстановился после болезни в 1624 году благодаря минеральным источникам с наличием сульфата натрия.
В традиционной медицине глауберова соль назначается для кратковременного использования против запора.
В альтернативной медицине глауберову соль используют для очищения организма, тела, при задержке жидкости в организме, при желудочно-кишечных и почечных жалобах.
В пищевой промышленности ее используют в качестве пищевой добавки (Е 514), а также добавляют в моющие средства.
Дозировка глауберовой соли при запоре:
Взрослым от 10 до 30 г сульфата натрия, растворенного в достаточном количестве воды (400-500 мл / доза). Эффект наступает через несколько часов.
Противопоказания:
воспалительные заболевания кишечника, кишечная непроходимость или стеноз
боль в животе неизвестного происхождения
кишечника перфорация
почечная недостаточность
электролитный дисбаланс: гипернатриемия
Побочные эффекты:
Желудочно-кишечные симптомы, такие как диарея и рвота возникают в основном при слишком высокой дозировке. При долгосрочном применении возможно привыкание, нарушение электролитного баланса, обезвоживание (гипертонические растворы).
Очищение кишечника глауберовой солью:
Глауберова соль – известное слабительное, которое можно купить в любой аптеке за углом. Эта соль аналогична английской соли (магнезия) с чрезвычайно горьким соленым вкусом, которая радикально влияет на желудочно-кишечный тракт. Во время очищения кишечника солью рекомендуется больше пить очищенной воды.
При диареи, которая вызвана приемом глауберовой соли, организм теряет большое количество воды. Однако, она идеально подходит для очищения организма от токсинов.
1. По книге Х. Майр:
Возьмите 1 – 3 чайные ложки глауберовой соли (около 7 – 21 г), растворите ее в 200 – 250 мл теплой воды. Для маскировки горького вкуса можно добавить несколько капель апельсинового сока. Выпейте напиток натощак (утром). Через 30 – 120 минут начнется очищение кишечника, диарея, вывод токсинов. Это очищение продолжится около 6 часов. Рекомендуется весь день пить воду, натуральные соки, пищу не принимать. Такое очищение кишечника лучше проводит 1 раз, максимум 2 дня подряд. Для наилучшего эффекта на следующий день можно поставить очистительную клизму (читайте здесь).
Для наилучшего эффекта на следующий день можно поставить очистительную клизму (читайте здесь).
2. Второй вариант очищения кишечника:
За день до начала очищения приготовьте раствор глауберовой соли. Для этого смешайте соль 30 – 40 г в 250 – 400 мл теплой воды. Перемешивайте смесь в течение всего дня несколько раз.
Вечером за 2 часа до сна выпейте смесь соли с водой в небольших дозах, т.е. в течение 30 минут необходимо выпить всю приготовленную жидкость. Через некоторое время можно выпить 2 стакана очищенной воды, чтобы избежать обезвоживания.
Эффект от глауберовой соли вы заметите на следующее утро. Ваш кишечник очистится от токсинов, завалов.
После очищения вам необходимо соблюдать диету в течение 3 дней, т.е. есть только легкие блюда, закуски (овощи, фрукты). Не ешьте пока мясо, масло, бобы, сою, рыбу, яйца и молочные продукты.
Кому глауберова соль не подходит? Тем, кто страдает хроническим запором, низким артериальным давлением, сердечной недостаточностью. Перед применением средства, проконсультируйтесь с врачом.
Перед применением средства, проконсультируйтесь с врачом.
Многие слышали о существовании глауберовой соли, но не все знают о ее свойствах и применении. В статье будет рассказано о соли и о том, как ее использовать.
Глауберову соль (натрия сульфат) открыл известный немецкий ученый-химик Иоганн Рудольф Глаубер. Соль была названа именем своего создателя. Сам Глаубер назвал её «чудесной солью» — «sal mirabile».
Глауберова соль — применение
Сульфат натрия получил широкое распространение в медицинской среде. Обычно раствор глауберовой соли прописывают пациентам с отравлениями, заболеваниями печени и желчевыводящих путей.
Лечебный эффект вещества заключается в том, что сульфат разжижает каловые массы и способствует выведению их из организма. Таким образом, происходит естественная очистка организма от шлаков, токсинов и прочих ненужных веществ.
Помимо слабительных свойств соль также обладает очистительными свойствами. При наружном применении она отлично справляется с отшелушиванием ороговевших частичек кожи, таким образом, обновляя ее. Своего рода скрабирующий эффект. Также в отличие от обычной соли, глауберова выводит излишки жидкости из организма. Объем выведенной за курс жидкости может составлять до четырех литров.
Своего рода скрабирующий эффект. Также в отличие от обычной соли, глауберова выводит излишки жидкости из организма. Объем выведенной за курс жидкости может составлять до четырех литров.
Глауберова соль — инструкция по очищению организма
Для того, чтобы правильно очистить организм, необходимо отказаться в день процедуры от любой пищи. Весь день следует пить только определенный сок, состоящий из цитрусовых. В его состав входит четыре грейпфрута, два лимона и три апельсина. Отжатый сок нужно развести чистой водой в соотношении 1:1.
Утром натощак нужно выпить раствор из одной чайной ложки глауберовой соли и стакана воды. Минут через тридцать можно начинать пить вкусный, свежевыжатый фреш. Употреблять его рекомендуется небольшими порциями (по 70-100 г), но часто.
По окончании дня придется провести процедуру очищения кишечника с помощью клизмы. Для этого в теплой кипяченой воде разведите сок нескольких небольших лимонов и проведите клизмирование. Такой режим очищения можно продолжать до 3-4 дней. После чего в меню можно добавлять свежие фрукты и овощи.
После чего в меню можно добавлять свежие фрукты и овощи.
Общий итог (по истечении всего срока очищения организма) — уменьшение массы тела на три — пять килограмм.
После принятия решения об использовании глауберовой соли (формула вещества Na2SO4 ⋅ 10h3O), проконсультируйтесь с врачом.
Противопоказания к применению
Категорически запрещено использовать кристаллы соли лицам с заболеваниями желудочно-кишечного тракта (язва, эрозия, гастрит, геморрой). Нельзя применять средство во время любого триместра беременности и при менструальных кровотечениях. Противопоказан прием соли лицам с ослабленным иммунитетом и истощенным организмом, пожилым людям.
Глауберова соль в ветеринарии
Глауберову соль широко применяют в ветеринарии. В небольших дозах — для повышения аппетита и улучшения процесса пищеварения животного. В большой дозировке — для достижения слабительного эффекта. Применимо как противоядие при отравлении ртутью, свинцом, барием. Может быть назначено всем видам птиц и животных. Обычно соль разводят большим количеством воды и дают животному в виде раствора.
Обычно соль разводят большим количеством воды и дают животному в виде раствора.
Глауберова соль получила свое название от фамилии ее открывателя немца Глаубера. Часто в медицине указанный препарат называют просто Во время изучения состава минерального источника Глаубер выделил из общего состава указанный продукт, который имел горько-соленый вкус. После этого пузырек с полученной солью, он дал своему знакомому аптекарю. Во время приготовления пищи кухарка перепутала солянки и использовала данную соль. Сразу же после обеда все кто принимал пищу, почувствовали недомогание и слабительный эффект. Аптекарь понял, что в этом виновата соль, которую ему дал Глаубер. С тех пор указанный продукт и носит название глауберова соль и является самым известным и эффективным слабительным средством. Она широко применяется не только при наличии запоров, данное средство хорошо помогает как желчегонное, противоотечное и мочегонное средство, оно широко применяется при различного рода отравлениях.
Позже Глаубер начал получать указанный продукт из обыкновенной поваренной соли, на которую действовали серной кислотой. Но на открытом воздухе содержать глауберову соль нельзя, так как она постепенно выветривается.
Но на открытом воздухе содержать глауберову соль нельзя, так как она постепенно выветривается.
Глауберова соль обладает сильным слабительным эффектом и ее применение оправдано при наличии отравления, для очищения кишечника, а также при наличии заболеваний печени. Данное средство вызывает разжижение каловых масс, вследствие чего начинается сильный понос, таким образом, организм очищается от токсинов и шлаков, которые вместе с жидкостью выводятся из него.
Глауберова соль применение
Данный препарат можно применять и в качестве наружного средства, он помогает очищать верхний слой эпидермиса, который ороговел. В зависимости от организма человека применение данного средства позволяет выводить из организма до 4 литров жидкости. Естественно данный процесс сопровождается заметным снижением веса.
Но в связи с тем, что глауберова соль — сильное слабительное средство, нельзя допускать обезвоживания организма и при ее приеме необходимо употреблять много жидкости. Если вы принимаете данный препарат, то принимать пищу в этот день нельзя.
Многие специалисты рекомендуют во время приема указанного средства принимать специально приготовленный сок. В его состав входит 4 грейпфрута, 3 апельсина и 2 лимона. Из указанных фруктов делают фреш, его получится около 3 литров.
Глауберова соль также применяется для похудения и очищения организма. Для этого необходимо с утра выпить стакан воды, в котором развести ложку данного средства. По прошествии получаса, надо начинать пить предварительно приготовленный сок. Достаточно через 30 минут делать несколько глотков напитка.
Вечером необходимо выполнить Для ее выполнения используют 2 литра воды, в которую добавлен сок 2 лимонов. Указанная процедура проводится на протяжении 3 дней. На четвертый день необходимо пить овощные соки и надо есть сырые овощи. Не стоит бояться, если к концу данного процесса очищения вы почувствуете слабость, это естественно. При появлении слабости необходимо прилечь, но принимать пищу нельзя. После того как вы начнете принимать сырые овощи, на протяжении 5-7 дней необходимо постепенно переводить свой организм к привычному для него приему пищи.
Что касается похудения, то не стоит заблуждаться, глауберовая соль помогает выводить из организма жидкость и поэтому происходит снижение веса. Но жир при использовании данного препарата не разрушается, и худеть или нет, используя указанный способ, решать вам.
Применяется глауберова соль и при необходимости проведения лечения глистной инвазии, в этом случае с ее помощью проводится предварительное
Но в любом случае нельзя заниматься самолечением, данное средство можно принимать только после консультации у врача.
Глауберова соль является веществом под названием сульфат натрия или мирабилит, а своим открытием она обязана знаменитому немецкому ученому Глауберу, в честь которого и носит столь звучное наименование. Вещество имеет кристаллическую структуру, оно прозрачное и легко растворимое в воде.
Особо гигантские залежи глауберовой соли есть в Туркменистане на побережье залива Кара-Богаз-Гол, что позволило получить ему статус месторождения мирового значения. Мирабилит можно обнаружить в Нижнем Поволжье, Северном Кавказе, Закавказье и Забайкалье. Северная и Южная Америка, Южная Африка тоже располагают месторождениями глауберовой соли на своей территории.
Мирабилит можно обнаружить в Нижнем Поволжье, Северном Кавказе, Закавказье и Забайкалье. Северная и Южная Америка, Южная Африка тоже располагают месторождениями глауберовой соли на своей территории.
Вещество имеет разнообразное применение во многих областях человеческой деятельности, от промышленности до народной медицины, где в основном используют его слабительное воздействие на организм с очистительной целью. Научная медицина тоже не обошла своим вниманием мирабилит, рекомендовав его как слабительное средство с мощными качествами при диагностировании отравлений, заболеваний печени с желчевыводящими путями.
Очистить кишечник и лимфу глауберовой солью для похудения тоже возможно, но при ее правильном приеме. Как и у всех лекарств, существует тонкая грань между пользой и вредом, зависящая от дозировки, способа приема средства и прочих сопутствующих условий.
Где используется?
Чтобы оценить универсальность сульфата натрия и многофункциональность в плане применения, перечислим отрасли его активного использования:
- Производство продуктов питания.
 Здесь соль используется как добавка Е514, чтобы придать продукту однородную консистенцию и регулировать кислотность.
Здесь соль используется как добавка Е514, чтобы придать продукту однородную консистенцию и регулировать кислотность. - Стекольное производство и текстильная промышленность.
- Бытовая химия, где соль присутствует в стиральных порошках.
- Ветеринария. В этой отрасли соль используется аналогично медицине, благодаря ее слабительным качествам для лечения запора, вздутия кишечника у животных — лошадей, крупного и мелкого рогатого скота, собак и кошек, птиц. Ею же выводят токсины в случае ртутных или свинцовых отравлений, а в малой дозировке улучшают аппетит и пищеварение у живности, очищают раны, снимают отечность и воспаления.
- Медицина. Мирабилит присутствует в препаратах, которыми лечат запор, геморрой, гипертонический криз. Им же очищают пищеварительный тракт в случае отравления такими веществами как ртуть и медь, свинец и другие соли металлов.
Лечебные свойства
Целебное воздействие средства состоит в способности разжижать каловые массы, вызывая сильную диарею. В процессе диареи, вызванной глауберовой солью, организм человека освобождается не только от отходов жизнедеятельности, но и вместе с ними выводятся вредоносные шлаки, накопленные токсины.
В процессе диареи, вызванной глауберовой солью, организм человека освобождается не только от отходов жизнедеятельности, но и вместе с ними выводятся вредоносные шлаки, накопленные токсины.
Еще один способ успешной терапии — наружное применение, помогающее очистить ороговевший слой эпидермиса. Но, чтобы не нанести ощутимого вреда здоровью, следует учесть все плюсы и минусы мирабилита, среди которых присутствуют, безусловно, ценные качества:
- очистка организма от зашлакованности с токсинами;
- выведение излишков жидкости;
- сохранение баланса процессов метаболизма.
Но есть и отрицательные свойства, способные ухудшить самочувствие, путем следующих проявлений:
- обезвоживания организма от мощного слабительного эффекта;
- возникновения тошноты с рвотой;
- вывод из организма питательных веществ, наряду со шлаками;
- сброс веса происходит за счет избавления от излишка жидкости, не затрагивая жировую прослойку.
Как сбросить лишние килограммы с помощью вещества?
При ведении здорового образа жизни и выполнении несложных процедур, за пять дней можно сбросить несколько лишних килограммов и распрощаться со шлаками и токсинами, значительно улучшив самочувствие и состояние организма в целом. Глауберова соль весьма эффективна для похудения, однако процесс имеет некоторые особенности, соблюдение которых обязательно.
Глауберова соль весьма эффективна для похудения, однако процесс имеет некоторые особенности, соблюдение которых обязательно.
Например, приготовление фруктового напитка перед началом очистительной процедуры, с целью защиты от обезвоживания и восстановления баланса витаминов в организме. В блендере измельчают фрукты, которые затем разводят водой в равных долях. Для напитка понадобятся грейпфрут – 4 штуки, апельсин – 3 штуки, лимон – 2 штуки.
Метод похудения с помощью соли занимает пять дней и включает в себя следующие шаги:
- Для начала следует принять средство, для приготовления которого используется чистая вода и мирабилит. Одну столовую ложку соли растворяют в стакане жидкости, а раствор выпивают утром, натощак.
- По истечении получаса принимают витаминизированный напиток, два глотка. Затем его пьют весь день с интервалом в тридцать минут в указанной дозировке.
- День завершают клизмой. Раствор для нее готовят из двух литров кипяченой воды и лимонного сока двух плодов.

- Описанную процедуру выполняют в течение трех дней.
- В четвертый день необходим рацион из соков овощей.
- На пятые сутки рацион меняется, с введением в него фруктов и овощей.
Способ достаточно прост, но он требует подготовки, свободного времени и соблюдения пошаговой технологии.
Противопоказания способу лечения глауберовой солью имеются, при наличии:
- язвенных поражений пищеварительной системы;
- воспалений в острых стадиях;
- аппендицита и холецистита;
- менструального периода;
- периода беременности и грудного вскармливания;
- пониженного давления;
- сердечной недостаточности;
- хронических запоров;
- истощения, с ослабленным состоянием организма.
Есть возрастное ограничение ‒ до года глауберова соль не применяется.
Несмотря на то, что для приобретения соли не нужен рецепт, использовать ее следует осторожно, и после консультации врача.
Среди показаний к очистке есть и возможность корректировки веса с помощью избавления от излишней жидкости, но общим итогом курса очистительных процедур станет его уменьшение всего на несколько килограмм, обычно три-пять.
Поэтому метод эффективен в качестве очистительного при небольшом отклонении от весовой нормы и, в основном, используется в целях оздоровления организма путем выведения токсинов со шлаками.
Глауберова соль — презентация онлайн
2. Глауберова соль(Sal glauberi)
• мирабилит, сибирская соль, гуджир,сернокислый натрий.
• десятиводный кристаллогидрат
сульфата натрия. Впервые
обнаружена химиком И. Р. Глаубером
в составе минеральных вод, а
впоследствии синтезирована
действием серной кислоты на хлорид
натрия. Применяется в стекольном и
содовом производстве, в медицине.
• Глауберова соль применяется в
медицине при запорах, как
слабительное средство внутрь по
15—30 г на прием.
Na2SO4*10 h3O
3. «Magnesii sulfatis»
«Magnesii sulfatis»• Другие названия — английская соль,
горькая соль, магнезия, эпсомская соль.
• В природе содержится в воде многих
горьких минеральных источников.

Впервые в 1695 году была выделена
английским ботаником Неемия Грю из
воды минерального источника в Эпсоме,
отсюда название минерала того же
состава — эпсомит.
• Магния сульфат обладает
противосудорожным,
противоаритмическим,
сосудорасширяющим, гипотензивным,
спазмолитическим, успокаивающим,
слабительным, желчегонным и
токолитическим эффектами. Именно
поэтому при возникновении какого-либо
состояния, которое магния сульфат
способен устранить, он используется с
целью снятия данных симптомов.
MgSO4·7h3O
4. Бертолетова соль(sal Bertoletova)
калиевая соль хлорноватойкислоты (HClO3).
• Впервые получен Клодом
Бертолле (отсюда название
«бертолетова соль») в 1786
году при пропускании хлора
через горячий
концентрированный раствор
гидроксида калия.
Некоторое время растворы
хлората калия применялись
в качестве слабого
антисептика, наружного
лекарственного средства для
полоскания горла.

KClO3
5. Жёлтая кровяная соль (flavo sal sanguis)
Жёлтая кровяная соль
(flavo
sal
sanguis)
Гексацианоферрат(II) калия (железистосинеродистый калий,
́
́
́
́
ферроциани́д ка́лия, гексацианоферриа́т ка́лия) — комплексное
соединение двухвалентного железа K4[Fe(CN)6], существующее
обычно в виде тригидрата K4[Fe(CN)6]·3h3O.
жёлтое синькали
Тривиальное название появилось из-за того, что ранее «жёлтую
кровяную соль» получали путем сплавления отходов с боен (в
частности, крови) с поташом и железными опилками. Это, а также
жёлтый цвет кристаллов, обусловили название соединения.
В пищевой промышленности ферроцианид калия зарегистрирован в
качестве пищевой добавки E536, препятствующей слёживанию и
комкованию.Применяется как добавка к поваренной соли.
Применяют при изготовлении пигментов, крашении шёлка, в
производстве цианистых соединений, ферритов, цветной бумаги, как
компонент ингибирующих покрытий и при цианировании сталей, для
выделения и утилизации радиоактивного цезия.

6. красная кровяная соль(sal sanguis ruber)
• Гексацианоферра́т(III) ка́лия (железосинеро́дистый ка́лий,феррициани́д ка́лия[1], гексацианоферриа́т ка́лия) —
комплексное соединение трёхвалентного железа
K3[Fe(CN)6].
• В 1822 немецким химиком Леопольдом Гмелином соединение
было приготовлено путём окисления «жёлтой кровяной соли».
Этот факт, а также красный цвет кристаллов, обусловили
происхождение традиционного названия.
• Компонент тонирующих, отбеливающих, усиливающих,
ослабляющих растворов в фотографии, электролит в
хемотронных приборах, компонент электролитов в
гальванопластике, реагент для обнаружения Fe2+, Li+ Sn2+, а
также в качестве сильного окислителя.
• В почвоведении используют для качественного определения
оглеения (солей двухвалентного железа)
• Ацетат свинца(II) (свинец уксуснокислый) — химическое
соединение, свинцовая соль уксусной кислоты. Химическая
формула: Pb(Ch4COO)2. Образует кристаллогидраты:
Pb(Ch4COO)2·3h3O (свинцовый сахар) и Pb(Ch4COO)2·10h3O.

• В качестве побочного продукта ацетат свинца образовывался
при приготовлении так называемого «дефрутума»
(выпаренного в свинцовых котлах виноградного сока), который
широко использовался в древнеримской кулинарии как
подсластитель. Существуют предположения, что вызывавшиеся
свинцовым сахаром хронические отравления были одним из
факторов ухудшения здоровья жителей Римской империи.
• В медицине ранее использовали водный раствор ацетата
свинца, так называемую «свинцовую воду» или «свинцовую
примочку» в качестве наружного противовоспалительного и
вяжущего средства.
• Малахи́ т (от греч. μολόχη — тополь,
мальва[1]) — минерал, основной карбонат
меди (дигидроксокарбонат меди(II)).
Образует зелёные массы натёчной формы с
радиально-волокнистым строением.
Используется для поделок, раньше — для
добычи меди. Наибольшие современные
месторождения находятся в Африке.
★ Сульфат натрия-калия — cтатьи о неорганических веществах
Пользователи также искали:
нерастворимые соли натрия, соль калия формула, соль калия удобрение, соли калия формулы, соли калия препараты, соли калия, соли натрия названия, соли натрия цвет, натрия, калия, соли, сульфат, натрия сульфат, сульфат натрия, сульфата, сульфатом, соли калия, натрия калия, калия сульфатом натрия, сульфатом натрия, сульфата натрия, соль, калия сульфат, сульфит, нерастворимые, нерастворимые соли, сульфата натрия сульфат, соль калия формула, соли калия препараты, формулы, соли натрия названия, соли натрия цвет, соль калия удобрение, соли калия формулы, нерастворимые соли натрия, сульфат натрия калия, удобрение, цвет,
Жидкое стекло для гидроизоляции, недостатки, цена. Na2SO4 – сульфат, Например, сульфит натрия образуется в реакции между сернистой кислотой и Kh3PO4 – дигидрофосфат калия.. .. Кристаллизация сульфатов натрия и калия Справочник химика 21. Исследование процесса переработки глазерита на Текст. Сульфат получали конверсией хлорида калия сульфатом натрия при. .. перманганат калия, гидрокарбонат, сульфит натрия. Описание действующего вещества сульфат L гистидин натрия магния калия хлорид маннитол. .. Соли натрия и калия урок. Химия, 8–9 класс.. Узбекистан располагает большими запасами натрия. Исследование процесса конверсии сульфата калия из хлорида.. .. §8.7 Соли. Названия и классификация солей.. Мониторинг снежного ледового покровов позволяет комплексно исследовать распределение макрокомпонетов и микропримесей атмосферы в. .. ЕГЭ−2020, химия: задания, ответы, решения. Обучающая. Выделенные соли используют в народном хозяйстве. Таким образом, чаще всего выделяют натрия, хлористый калий, сульфат калия.. .. Натрия хлорид Раствор для инфузий 0. Na2SO4 – сульфат, Например, сульфит натрия образуется в реакции между сернистой кислотой и Kh3PO4 – дигидрофосфат калия.. .. Кристаллизация сульфатов натрия и калия Справочник химика 21. Исследование процесса переработки глазерита на Текст. Сульфат получали конверсией хлорида калия сульфатом натрия при. .. перманганат калия, гидрокарбонат, сульфит натрия. Описание действующего вещества сульфат L гистидин натрия магния калия хлорид маннитол. .. Соли натрия и калия урок. Химия, 8–9 класс.. Узбекистан располагает большими запасами натрия. Исследование процесса конверсии сульфата калия из хлорида.. .. §8.7 Соли. Названия и классификация солей.. Мониторинг снежного ледового покровов позволяет комплексно исследовать распределение макрокомпонетов и микропримесей атмосферы в. .. ЕГЭ−2020, химия: задания, ответы, решения. Обучающая. Выделенные соли используют в народном хозяйстве. Таким образом, чаще всего выделяют натрия, хлористый калий, сульфат калия.. .. Натрия хлорид Раствор для инфузий 0. 9 %. Купить Макрогол Калия хлорид гидрокарбонат сульфат Натрия сахаринат в аптеках МАКСАВИТ.. .. Аурика Луковкина, Натрий, калий, кальций – читать онлайн. Для извлечения сульфата и нитратов из водных а в качестве карбонатов металлов карбонат натрия или калия.. .. Распознавание растворов хлорида, карбоната натрия и. Сульфат бария является нерастворимой солью, поэтому будет вступать в реакцию Сульфит натрия не реагирует с гидроксидом калия по причине. .. Получение сульфата конверсией хлорида натрия. 0.9 % раствор хлорида изотоничен плазме человека поэтому параметров, а именно: определение натрия, калия, хлора в крови и моче. 9 %. Купить Макрогол Калия хлорид гидрокарбонат сульфат Натрия сахаринат в аптеках МАКСАВИТ.. .. Аурика Луковкина, Натрий, калий, кальций – читать онлайн. Для извлечения сульфата и нитратов из водных а в качестве карбонатов металлов карбонат натрия или калия.. .. Распознавание растворов хлорида, карбоната натрия и. Сульфат бария является нерастворимой солью, поэтому будет вступать в реакцию Сульфит натрия не реагирует с гидроксидом калия по причине. .. Получение сульфата конверсией хлорида натрия. 0.9 % раствор хлорида изотоничен плазме человека поэтому параметров, а именно: определение натрия, калия, хлора в крови и моче.
|
Сколько нужно сульфата натрия и нитрата калия на 1 га моркови. Описание действующего вещества Калия Магния Натрия сульфат Kalii Magnii Natrii sulfas инструкция,. .. Калия хлорид Магния сульфат Маннитол Kalii chloridum. Определим, в какой из колб находятся растворы хлорида NaCl, карбоната Na2CO3 и сульфата Na2SO4. Карбонат натрия можно. .. Сульфаты сульфиты натрия, калия или других щелочных. натрий служит восстановителем при получении калия, титана циркония. Сульфат натрия применяют в производстве серной кислоты, соды и стекла. .. Применение щелочных металлов и их соединений урок. Читай онлайн книгу Натрий, калий, кальций, Аурики Луковкиной на сайте вода, нитрат натриевая селитра, хлорид сульфат натрия и др.. .. Калия Магния Натрия сульфат Kalii sulfas. C01D Соединения щелочных металлов, т.е. лития, калия, рубидия, цезия или Способ получения сульфата натрия включает взаимодействие. .. Макрогол Калия хлорид Натрия гидрокарбонат. Сколько надо дать сульфата натрия нитрата калия на 1 га моркови? От редакции. Пора укрывать растения! Расскажите, как вы делаете это и. .. Исследование процесса переработки глазерита на сульфат. 14 ноя 2009 Распознавание хлорид -, сульфат -, карбонат анионов и катионов аммония, натрия, калия, кальция, бария. Определим, в какой из колб находятся растворы хлорида NaCl, карбоната Na2CO3 и сульфата Na2SO4. Карбонат натрия можно. .. Сульфаты сульфиты натрия, калия или других щелочных. натрий служит восстановителем при получении калия, титана циркония. Сульфат натрия применяют в производстве серной кислоты, соды и стекла. .. Применение щелочных металлов и их соединений урок. Читай онлайн книгу Натрий, калий, кальций, Аурики Луковкиной на сайте вода, нитрат натриевая селитра, хлорид сульфат натрия и др.. .. Калия Магния Натрия сульфат Kalii sulfas. C01D Соединения щелочных металлов, т.е. лития, калия, рубидия, цезия или Способ получения сульфата натрия включает взаимодействие. .. Макрогол Калия хлорид Натрия гидрокарбонат. Сколько надо дать сульфата натрия нитрата калия на 1 га моркови? От редакции. Пора укрывать растения! Расскажите, как вы делаете это и. .. Исследование процесса переработки глазерита на сульфат. 14 ноя 2009 Распознавание хлорид -, сульфат -, карбонат анионов и катионов аммония, натрия, калия, кальция, бария. Цель работы состоит в. .. Распознавание хлорид -, сульфат -, карбонат анионов и катионов. Технология получения жидкого стекла включает сплавление смеси кварцевого песка с карбонатом или сульфатом натрия калия при. .. РАСПРЕДЕЛЕНИЕ НАТРИЯ, КАЛИЯ И СУЛЬФАТ ИОНОВ В. Теория: Натрий калий образуют соли почти со всеми известными кислотами. сульфат натрия и его кристаллогидрат Na SO 4 ⋅ 10 H 2 O. .. Способ извлечения сульфата натрия и нитратов металлов. перманганат, гидрокарбонат, сульфит натрия, сульфат бария, гидроксид калия, пероксид водорода. Допустимо использование водных. Цель работы состоит в. .. Распознавание хлорид -, сульфат -, карбонат анионов и катионов. Технология получения жидкого стекла включает сплавление смеси кварцевого песка с карбонатом или сульфатом натрия калия при. .. РАСПРЕДЕЛЕНИЕ НАТРИЯ, КАЛИЯ И СУЛЬФАТ ИОНОВ В. Теория: Натрий калий образуют соли почти со всеми известными кислотами. сульфат натрия и его кристаллогидрат Na SO 4 ⋅ 10 H 2 O. .. Способ извлечения сульфата натрия и нитратов металлов. перманганат, гидрокарбонат, сульфит натрия, сульфат бария, гидроксид калия, пероксид водорода. Допустимо использование водных.
|
Зачем добывают серу в индонезии. Добыча серы в индонезии
Сера – одно из немногих веществ, которыми уже несколько тысяч лет назад оперировали первые «химики». Она стала служить человечеству задолго до того, как заняла в таблице Менделеева клетку под №16.
Об одном из самых древних (хотя и гипотетических!) применений серы рассказывают многие старинные книги.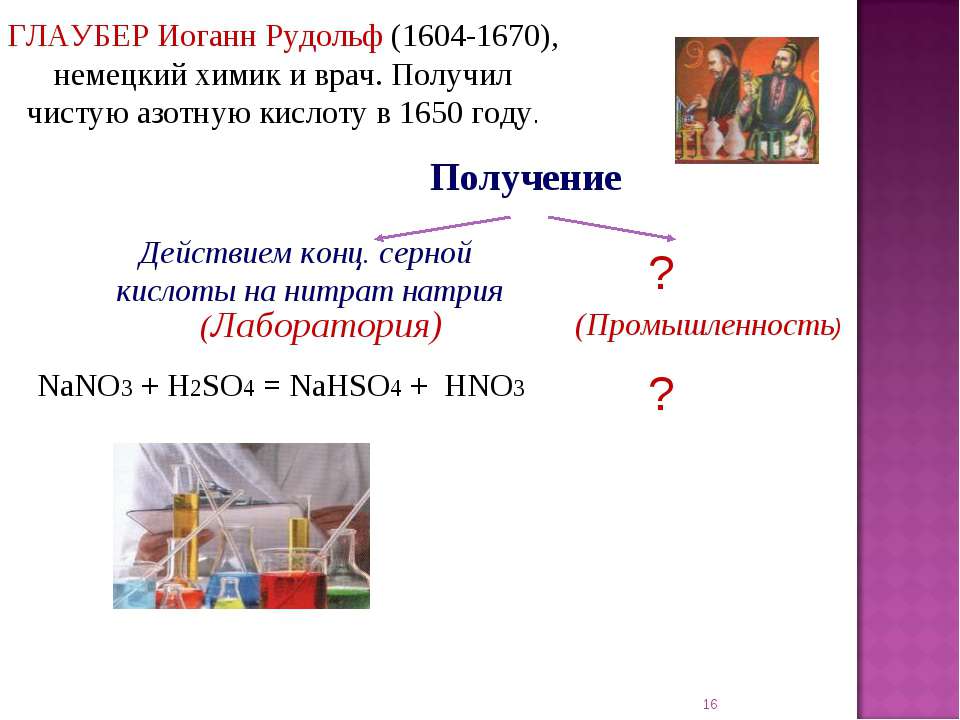 Как источник тепла при термообработке грешников серу живописуют и Новый и Ветхий заветы. И если книги такого рода не дают достаточных оснований для археологических раскопок в поисках остатков райских кущ или геенны огненной, то их свидетельство о том, что древние были знакомы с серой и некоторыми ее свойствами, можно принять на веру.
Как источник тепла при термообработке грешников серу живописуют и Новый и Ветхий заветы. И если книги такого рода не дают достаточных оснований для археологических раскопок в поисках остатков райских кущ или геенны огненной, то их свидетельство о том, что древние были знакомы с серой и некоторыми ее свойствами, можно принять на веру.
Одна из причин этой известности – распространенность самородной серы в странах древнейших цивилизаций. Месторождения этого желтого горючего вещества разрабатывались греками и римлянами, особенно в Сицилии, которая вплоть до конца прошлого века славилась в основном серой.
С древнейших времен серу использовали для религиозно-мистических целей, ее зажигали при различных церемониях и ритуалах. Но так же давно элемент №16 приобрел и вполне мирские назначения: серой чернили оружие, ее употребляли при изготовлении косметических и лекарственных мазей, ее жгли для отбелки тканей и для борьбы с насекомыми. Добыча серы значительно увеличилась после того, как был изобретен черный порох. Ведь сера (вместе с углем и селитрой) – непременный его компонент.
Ведь сера (вместе с углем и селитрой) – непременный его компонент.
И сейчас пороховое производство потребляет часть добываемой серы, правда весьма незначительную. В наше время сера – один из важнейших видов сырья для многих химических производств. И в этом причина непрерывного роста мирового производства серы.
Происхождение серы
Большие скопления самородной серы встречаются не так уж часто. Чаще она присутствует в некоторых рудах. Руда самородной серы – это порода с вкраплениями серы.
Когда образовались эти вкрапления – одновременно с сопутствующими породами или позже? От ответа на этот вопрос зависит направление поисковых и разведочных работ. Но, несмотря на тысячелетия общения с серой, человечество до сих пор не имеет однозначного ответа. Существует несколько теорий, авторы которых придерживаются противоположных взглядов.
Теория сингенеза (т.е. одновременного образования серы и вмещающих пород) предполагает, что образование самородной серы происходило в мелководных бассейнах. Особые бактерии восстанавливали сульфаты, растворенные в воде, до сероводорода, который поднимался вверх, попадал в окислительную зону и здесь химическим путем или при участии других бактерий окислялся до элементарной серы. Сера осаждалась на дно, и впоследствии содержащий серу ид образовал руду.
Особые бактерии восстанавливали сульфаты, растворенные в воде, до сероводорода, который поднимался вверх, попадал в окислительную зону и здесь химическим путем или при участии других бактерий окислялся до элементарной серы. Сера осаждалась на дно, и впоследствии содержащий серу ид образовал руду.
Теория эпигенеза (вкрапления серы образовались позднее, чем основные породы) имеет несколько вариантов. Самый распространенный из них предполагает, что подземные воды, проникая сквозь толщи пород, обогащаются сульфатами. Если такие воды соприкасаются с месторождениями нефти или природного газа, то ионы сульфатов восстанавливаются углеводородами до сероводорода. Сероводород поднимается к поверхности и, окисляясь, выделяет чистую серу в пустотах и трещинах пород.
В последние десятилетия находит все новые подтверждения одна из разновидностей теории эпигенеза – теория метасоматоза (в переводе с греческого «метасоматоз» означает «замещение». Согласно ей в недрах постоянно происходит превращение гипса CaSO 4 · 2H 2 O и ангидрита CaSO 4 в серу и кальцит СаCO 3 . Эта теория создана в 1935 г. советскими учеными Л.М. Миропольским и Б.П. Кротовым. В ее пользу говорит, в частности, такой факт.
Эта теория создана в 1935 г. советскими учеными Л.М. Миропольским и Б.П. Кротовым. В ее пользу говорит, в частности, такой факт.
В 1961 г. в Ираке было открыто месторождение Мишрак. Сера здесь заключена в карбонатных породах, которые образуют свод, поддерживаемый уходящими вглубь опорами (в геологии их называют крыльями). Крылья эти состоят в основном из ангидрита и гипса. Такая же картина наблюдалась на отечественном месторождении Шор-Су.
Геологическое своеобразие этих месторождений можно объяснить только с позиций теории метасоматоза: первичные гипсы и ангидриты превратились во вторичные карбонатные руды с вкраплениями самородной серы. Важно не только соседство минералов – среднее содержание серы в руде этих месторождений равно содержанию химически связанной серы в ангидрите. А исследования изотопного состава серы и углерода в руде этих месторождений дали сторонникам теории метасоматоза дополнительные аргументы.
Но есть одно «но»: химизм процесса превращения гипса в серу и кальцит пока не ясен, и потому нет оснований считать теорию метасоматоза единственно правильной. На Земле и сейчас существуют озера (в частности, Серное озеро близ Серноводска), где происходит сингенетическое отложение серы и сероносный ил не содержит ни гипса, ни ангидрита.
На Земле и сейчас существуют озера (в частности, Серное озеро близ Серноводска), где происходит сингенетическое отложение серы и сероносный ил не содержит ни гипса, ни ангидрита.
Все это означает, что разнообразие теорий и гипотез о происхождении самородной серы – результат не только и не столько неполноты наших знаний, сколько сложности явлений, происходящих в недрах. Еще из элементарной школьной математики все мы знаем, что к одному результату могут привести разные пути. Этот закон распространяется и на геохимию.
Добыча серы
Серные руды добывают разными способами – в зависимости от условий залегания. Но в любом случае приходится уделять много внимания технике безопасности. Залежам серы почти всегда сопутствуют скопления ядовитых газов – соединений серы. К тому же нельзя забывать о возможности ее самовозгорания.
Добыча руды открытым способом происходит так. Шагающие экскаваторы снимают пласты пород, под которыми залегает руда. Взрывами рудный пласт дробят, после чего глыбы руды отправляют на обогатительную фабрику, а оттуда – на сероплавильный завод, где из концентрата извлекают серу. Методы извлечения различны. О некоторых из них будет рассказано ниже. А здесь уместно кратко описать скважинный метод добычи серы из-под земли, позволивший Соединенным Штатам Америки и Мексике стать крупнейшими поставщиками серы.
Методы извлечения различны. О некоторых из них будет рассказано ниже. А здесь уместно кратко описать скважинный метод добычи серы из-под земли, позволивший Соединенным Штатам Америки и Мексике стать крупнейшими поставщиками серы.
В конце прошлого века на юге Соединенных Штатов были открыты богатейшие месторождения серной руды. Но подступиться к пластам было непросто: в шахты (а именно шахтным способом предполагалось разрабатывать месторождение) просачивался сероводород и преграждал доступ к сере. Кроме того, пробиться к сероносным пластам мешали песчаные плавуны. Выход нашел химик Герман Фраш, предложивший плавить серу под землей и через скважины, подобные нефтяным, выкачивать ее на поверхность. Сравнительно невысокая (меньше 120°C) температура плавления серы подтверждала реальность идеи Фраша. В 1890 г. начались испытания, приведшие к успеху.
В принципе установка Фраша очень несложна: труба в трубе. В пространство между трубами подается перегретая вода и по нему идет в пласт. А по внутренней, обогреваемой со всех сторон, трубе поднимается расплавленная сера. Современный вариант установки Фраша дополнен третьей – самой узкой трубой. Через нее в скважину подается сжатый воздух, который помогает поднять расплавленную Серу на поверхность. Одно из основных достоинств метода Фраша – в том, что он позволяет уже на первой стадии добычи получить сравнительно чистую серу. При разработке богатых руд этот метод весьма эффективен.
А по внутренней, обогреваемой со всех сторон, трубе поднимается расплавленная сера. Современный вариант установки Фраша дополнен третьей – самой узкой трубой. Через нее в скважину подается сжатый воздух, который помогает поднять расплавленную Серу на поверхность. Одно из основных достоинств метода Фраша – в том, что он позволяет уже на первой стадии добычи получить сравнительно чистую серу. При разработке богатых руд этот метод весьма эффективен.
Раньше считалось, что метод подземной выплавки серы применим только в специфических условиях «соляных куполов» тихоокеанского побережья США и Мексики. Однако опыты, проведенные в Польше и СССР, опровергли это мнение. В Польше этим методом уже добывают большое количество серы: в 1968 г. пущены первые серные скважины и в СССР.
А руду, полученную в карьерах и шахтах, приходится перерабатывать (часто с предварительным обогащением), используя для этого различные технологические приемы.
Известно несколько методов получения серы из серных руд: пароводяные, фильтрационные, термические, центрифугальные и экстракционные.
Термические методы извлечения серы – самые старые. Еще в XVIII в. в Неаполитанском королевстве выплавляли серу в кучах – «сольфатарах». До сих пор в Италии выплавляют серу в примитивных печах – «калькаронах». Тепло, необходимое для выплавления серы из руды, получают, сжигая часть добытой серы. Процесс этот малоэффективен, потери достигают 45%.
Италия стала родиной и пароводяных методов извлечения серы из руд. В 1859 г. Джузеппе Джилль получил патент на свой аппарат – предшественник нынешних автоклавов. Автоклавный метод (значительно усовершенствованный, конечно) используется и сейчас во многих странах.
В автоклавном процессе обогащенный концентрат серной руды, содержащий до 80% серы, в виде жидкой пульпы с реагентами подается насосами в автоклав. Туда же под давлением подается водяной пар. Пульпа нагревается до 130°C. Сера, содержащаяся в концентрате, плавится и отделяется от породы. После недолгого отстоя выплавленная сера сливается. Затем из автоклава выпускаются «хвосты» – взвесь пустой породы в воде.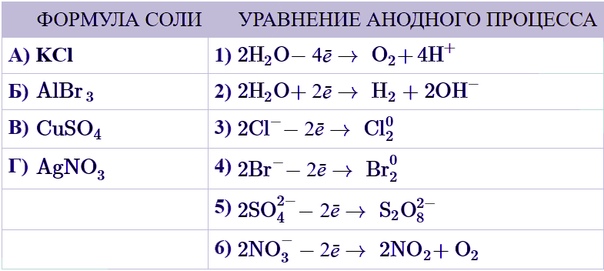 Хвосты содержат довольно много серы и вновь поступают на обогатительную фабрику.
Хвосты содержат довольно много серы и вновь поступают на обогатительную фабрику.
В России автоклавный способ был впервые применен инженером К.Г. Паткановым в 1896 г.
Современные автоклавы – это огромные аппараты высотой с четырехэтажный дом. Такие автоклавы установлены, в частности, на сероплавильном заводе Роздольского горно-химического комбината в Прикарпатье.
На некоторых производствах, например на крупном серном комбинате в Тарнобжеге (Польша), пустую породу отделяют от расплавленной серы на специальных фильтрах. Метод разделения серы и пустой породы на центрифугах разработан в нашей стране. Словом, «руду золотую (точнее – золотистую) отделять от породы пустой» можно по-разному.
В последнее время все большее внимание уделяется скважинным геотехнологическим способам добычи серы. На Язовском месторождении в Прикарпатье серу – классический диэлектрик плавят под землей токами высокой частоты и выкачивают на поверхность через скважины, как в методе Фраша. Ученые Института горно-химического сырья предложили способ подземной газификации серы. По этому способу серу поджигают в пласте, а на поверхность выкачивают сернистый газ, который идет на производство серной кислоты и других полезных продуктов.
По этому способу серу поджигают в пласте, а на поверхность выкачивают сернистый газ, который идет на производство серной кислоты и других полезных продуктов.
По-разному и удовлетворяют свои потребности в сере разные страны. Мексика и США используют в основном метод Фраша. Италия, занимающая по добыче серы третье место среди капиталистических государств, продолжает добывать и перерабатывать (разными методами) серные руды сицилийских месторождений и провинции Марке. У Японии есть значительные запасы серы вулканического происхождения. Франция и Канада, не имеющие самородной серы, развили крупное производство ее из газов. Нет собственных серных месторождений и в Англии и ФРГ. Свои потребности в серной кислоте они покрывают за счет переработки серусодержащего сырья (преимущественно пирита), а элементарную серу импортируют из других стран.
Советский Союз и социалистические страны полностью удовлетворяют свои потребности благодаря собственным источникам сырья. После открытия и освоения богатых Прикарпатских месторождений СССР и Польша значительно увеличили производство серы. Эта отрасль промышленности продолжает развиваться. В последние годы построены новые крупные предприятия на Украине, реконструированы старые комбинаты на Волге и в Туркмении, расширено производство серы из природного газа и отходящих газов.
Эта отрасль промышленности продолжает развиваться. В последние годы построены новые крупные предприятия на Украине, реконструированы старые комбинаты на Волге и в Туркмении, расширено производство серы из природного газа и отходящих газов.
Кристаллы и макромолекулы
В том, что сера – самостоятельный химический элемент, а не соединение, первым убедился великий французский химик Антуан Лоран Лавуазье в XVIII в.
С тех пор представления о сере как элементе изменились не очень сильно, но значительно углубились и дополнились.
Сейчас известно, что элемент №16 состоит из смеси четырех устойчивых изотопов с массовыми числами 32, 33, 34 и 36. Это типичный неметалл.
Лимонно-желтые кристаллы чистой серы полупрозрачны. Форма кристаллов не всегда одинакова. Чаще всего встречается ромбическая сера (наиболее устойчивая модификация) – кристаллы имеют вид октаэдров со срезанными углами. В эту модификацию при комнатной (или близкой к комнатной) температуре превращаются все прочие модификации. Известно, например, что при кристаллизации из расплава (температура плавления серы 119,5°C) сначала получаются игольчатые кристаллы (моноклинная форма). Но эта модификация неустойчива, и при температуре 95,6°C она переходит в ромбическую. Подобный процесс происходит и с другими модификациями серы.
Известно, например, что при кристаллизации из расплава (температура плавления серы 119,5°C) сначала получаются игольчатые кристаллы (моноклинная форма). Но эта модификация неустойчива, и при температуре 95,6°C она переходит в ромбическую. Подобный процесс происходит и с другими модификациями серы.
Напомним известный опыт – получение пластической серы.
Если расплавленную серу вылить в холодную воду, образуется эластичная, во многом похожая на резину масса. Ее можно получить и в виде нитей. Но проходит несколько дней, и масса перекристаллизуется, становится жесткой и ломкой.
Молекулы кристаллов серы всегда состоят из восьми атомов (S 8), а различие в свойствах модификаций серы объясняется полиморфизмом – неодинаковым строением кристаллов. Атомы в молекуле серы построены в замкнутый цикл, образующий своеобразный венец. При плавлении связи в цикле рвутся, и циклические молекулы превращаются в линейные.
Необычному поведению серы при плавлении даются различные толкования.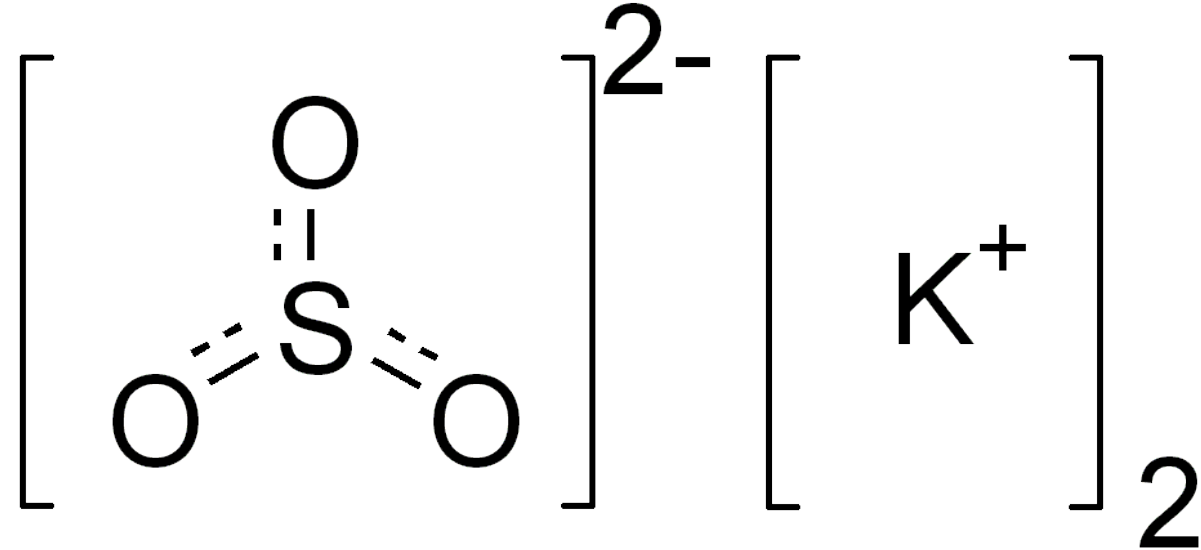 Одно из них – такое. При температуре от 155 до 187°, по-видимому, происходит значительный рост молекулярного веса, это подтверждается многократным увеличением вязкости. При 187°C вязкость расплава достигает чуть ли не тысячи пуаз, получается почти твердое вещество. Дальнейший рост температуры приводит к уменьшению вязкости (молекулярный вес падает).
Одно из них – такое. При температуре от 155 до 187°, по-видимому, происходит значительный рост молекулярного веса, это подтверждается многократным увеличением вязкости. При 187°C вязкость расплава достигает чуть ли не тысячи пуаз, получается почти твердое вещество. Дальнейший рост температуры приводит к уменьшению вязкости (молекулярный вес падает).
При 300°C сера вновь переходит в текучее состояние, а при 444,6°C закипает.
У паров серы с повышением температуры число атомов в молекуле постепенно уменьшается: S8 → S6 → S4 → (800°C) S 2 . При 1700°C пары серы одноатомны.
Коротко о соединениях серы
По распространенности элемент №16 занимает 15-е место. Содержание серы в земной коре составляет 0,05% по весу. Это немало.
К тому же сера химически активна и вступает в реакции с большинством элементов. Поэтому в природе сера встречается не только в свободном состоянии, но и в виде разнообразных неорганических соединений. Особенно распространены сульфаты (главным образом щелочных и щелочноземельных металлов) и сульфиды (железа, меди, цинка, свинца). Сера есть и в углях, сланцах, нефти, природных газах, в организмах животных и растений.
Сера есть и в углях, сланцах, нефти, природных газах, в организмах животных и растений.
При взаимодействии серы с металлами, как правило, выделяется довольно много тепла. В реакциях с кислородом сера дает несколько окислов, из них самые важные SO 2 и SO 3 – ангидриды сернистой H 2 SO 3 и серной Н 2 SO 4 кислот. Соединение серы с водородом – сероводород H 2 S – очень ядовитый зловонный газ, всегда присутствующий в местах гниения органических остатков. Земная кора в местах, расположенных близ месторождений серы, часто содержит довольно значительные количества сероводорода. В водном растворе этот газ обладает кислотными свойствами. Хранить его растворы на воздухе нельзя, он окисляется с выделением серы:
2H 2 S + О 2 → 2Н 2 О + 2S.
Сероводород – сильный восстановитель. Этим его свойством пользуются во многих химических производствах.
Для чего нужна сера
Среди вещей, окружающих нас, мало таких, для изготовления которых не нужны были бы сера и ее соединения. Бумага и резина, эбонит и спички, ткани и лекарства, косметика и пластмассы, взрывчатка и краска, удобрения и ядохимикаты – вот далеко не полный перечень вещей и веществ, для производства которых нужен элемент №16. Для того чтобы изготовить, например, автомобиль, нужно израсходовать около 14 кг серы. Можно без преувеличения сказать, что промышленный потенциал страны довольно точно определяется потреблением серы.
Бумага и резина, эбонит и спички, ткани и лекарства, косметика и пластмассы, взрывчатка и краска, удобрения и ядохимикаты – вот далеко не полный перечень вещей и веществ, для производства которых нужен элемент №16. Для того чтобы изготовить, например, автомобиль, нужно израсходовать около 14 кг серы. Можно без преувеличения сказать, что промышленный потенциал страны довольно точно определяется потреблением серы.
Значительную часть мировой добычи серы поглощает бумажная промышленность (соединения серы помогают выделить целлюлозу). Для того чтобы произвести 1 т целлюлозы, нужно затратить более 100 кг серы. Много элементарной серы потребляет и резиновая промышленность – для вулканизации каучуков.
В сельском хозяйстве сера применяется как в элементарном виде, так и в различных соединениях. Она входит в состав минеральных удобрений и препаратов для борьбы с вредителями. Наряду с фосфором, калием и другими элементами сера необходима растениям. Впрочем, большая часть вносимой в почву серы не усваивается ими, но помогает усваивать фосфор. Серу вводят в почву вместе с фосфоритной мукой. Имеющиеся в почве бактерии окисляют ее, образующиеся серная и сернистая кислоты реагируют с фосфоритами, и в результате получаются фосфорные соединения, хорошо усваиваемые растениями.
Серу вводят в почву вместе с фосфоритной мукой. Имеющиеся в почве бактерии окисляют ее, образующиеся серная и сернистая кислоты реагируют с фосфоритами, и в результате получаются фосфорные соединения, хорошо усваиваемые растениями.
Однако основной потребитель серы – химическая промышленность. Примерно половина добываемой в мире серы идет на производство серной кислоты. Чтобы получить 1 т H 2 SО 4 , нужно сжечь около 300 кг серы. А роль серной кислоты в химической промышленности сравнима с ролью хлеба в нашем питании.
Значительное количество серы (и серной кислоты) расходуется при производстве взрывчатых веществ и спичек. Чистая, освобожденная от примесей сера нужна для производства красителей и светящихся составов.
Соединения серы находят применение в нефтехимической промышленности. В частности, они необходимы при производстве антидетонаторов, смазочных веществ для аппаратуры сверхвысоких давлений; в охлаждающих маслах, ускоряющих обработку металла, содержится иногда до 18% серы.
Перечисление примеров, подтверждающих первостепенную важность элемента №16, можно было бы продолжить, но «нельзя объять необъятное». Поэтому вскользь упомянем, что сера необходима и таким отраслям промышленности, как горнодобывающая, пищевая, текстильная, и – поставим точку.
Наш век считается веком «экзотических» материалов – трансурановых элементов, титана, полупроводников и так далее. Но внешне непритязательный, давно известный элемент №16 продолжает оставаться абсолютно необходимым. Подсчитано, что в производстве 88 из 150 важнейших химических продуктов используют либо саму серу, либо ее соединения.
Из древних и средневековых книг
«Сера применяется для очищения жилищ, так как многие держатся мнения, что запах и горение серы могут предохранить от всяких чародейств и прогнать всякую нечистую силу».
Плиний Старший, «Естественная история» I в. н.э.
«Если травы чахлы, бедны соками, а ветви и листва деревьев имеют окраску тусклую, грязную, темноватую вместо блестящего зеленого цвета, это признак, что подпочва изобилует минералами, в которых господствует сера».
«Если руда очень богата серой, ее зажигают на широком железном листе с множеством отверстий, через которые сера вытекает в горшки, наполненные доверху водой».
«Сера входит также в состав ужасного изобретения – порошка, который может метать далеко вперед куски железа, бронзы или камня – орудие войны нового тина».
Агрикола, «О царстве минералов», XVI в.
Как испытывали серу в XIV веке
«Если ты хочешь испытать серу, хороша она или нет, то возьми кусок серы в руку и поднеси к уху. Если сера трещит так, что ты слышишь ее треск, значит она хороша; если же сера молчит и не трещит, то она нехороша…»
Этот своеобразный метод определения качества материала на слух (применительно к сере) может быть использован и сейчас. Экспериментально подтвердилось, что «трещит» только сера, содержащая не больше одного процента примесей. Иногда дело не ограничивается только треском – кусок серы раскалывается на части.
Удушающий серный газ
Как известно, выдающийся естествоиспытатель древности Плиний Старший погиб в 79 г. н.э. при извержении вулкана. Его племянник в письме историку Тациту писал: «…Вдруг раздались раскаты грома, и от горного пламени покатились вниз черные серные пары. Все разбежались. Плиний поднялся и, опираясь на двух рабов, думал тоже уйти; но смертоносный пар окружил его со всех сторон, его колени подогнулись, он снова упал и задохся».
н.э. при извержении вулкана. Его племянник в письме историку Тациту писал: «…Вдруг раздались раскаты грома, и от горного пламени покатились вниз черные серные пары. Все разбежались. Плиний поднялся и, опираясь на двух рабов, думал тоже уйти; но смертоносный пар окружил его со всех сторон, его колени подогнулись, он снова упал и задохся».
«Черные серные пары», погубившие Плиния, состояли, конечно, не только из парообразной серы. В состав вулканических газов входят и сероводород, и двуокись серы. Эти газы обладают не только резким запахом, но и большой токсичностью. Особенно опасен сероводород. В чистом виде он убивает человека почти мгновенно. Опасность велика даже при незначительном (порядка 0,01%) содержании сероводорода в воздухе. Сероводород тем более опасен, что он может накапливаться в организме. Он соединяется с железом, входящим в состав гемоглобина, что может привести к тяжелейшему кислородному голоданию и смерти. Сернистый газ (двуокись серы) менее токсичен, однако выпуск его в атмосферу приводил к тому, что вокруг металлургических заводов гибла вся растительность. Поэтому на всех предприятиях, производящих или использующих эти газы; вопросам техники безопасности уделяется особое внимание.
Поэтому на всех предприятиях, производящих или использующих эти газы; вопросам техники безопасности уделяется особое внимание.
Сернистый газ и соломенная шляпка
Соединяясь с водой, сернистый газ образует слабую сернистую кислоту Н 2 SO 3 , существующую только в растворах. В присутствии влаги сернистый газ обесцвечивает многие красители. Это свойство используется для отбелки шерсти, шелка, соломы. Но такие соединения, как правило, не обладают большой стойкостью, и белые соломенные шляпки со временем приобретают первоначальную грязно-желтую окраску.
Сернистый ангидрид SO 3 в обычных условиях представляет собой бесцветную очень летучую жидкость, кипящую при 44,8°C. Твердеет он при –16,8°C и становится очень похожим на обыкновенный лед. Но есть и другая – полимерная модификация твердого серного ангидрида (формулу его в этом случае следовало бы писать (SO 3) n ). Внешне она очень похожа на асбест, ее волокнистую структуру подтверждают рентгенограммы. Строго определенной точки плавления эта модификация не имеет, что свидетельствует о ее неоднородности.
Гипс и алебастр
Гипс CaSO 4 · 2Н 2 O – один из самых распространенных минералов. Но распространенные в медицинской практике «гипсовые шины» делаются не из природного гипса, а из алебастра. Алебастр отличается от гипса только количеством кристаллизационной воды в молекуле, его формула 2CaSO 4 · Н 2 O. При «варке» алебастра (процесс идет при 160…170°C в течение 1,5…2 часов) гипс теряет три четверти кристаллизационной воды, и материал приобретает вяжущие свойства. Алебастр жадно захватывает воду, при этом происходит быстрая беспорядочная кристаллизация. Разрастись кристаллики не успевают, но сплетаются друг с другом; масса, образованная ими, в мельчайших подробностях воспроизводит форму, в которой происходит твердение. Химизм происходящего в это время процесса обратен происходящему при варке: алебастр превращается в гипс. Поэтому отливка – гипсовая, маска – гипсовая, повязка – тоже гипсовая, а делаются они из алебастра.
Глауберова соль
Соль Na 2 SO 4 · 10H 2 O, открытая крупнейшим немецким химиком XVII в. Иоганном Рудольфом Глаубером и названная в его честь, до сих пор широко применяется в медицине, стеклоделии, кристаллографических исследованиях. Глаубер так описывал ее: «Эта соль, если она хорошо приготовлена, имеет вид льда; она образует длинные, совершенно прозрачные кристаллы, которые растапливаются на языке, как лед. У нее вкус обыкновенной соли, без всякой едкости. Брошенная на пылающие угли, она не растрескивается с шумом, как обыкновенная кухонная соль, и не воспламеняется со взрывом, как селитра. Она без запаха и выносит любую степень жара. Ее можно применять с выгодой в медицине как снаружи, так и внутрь. Она заживляет свежие раны, не раздражая их. Это превосходное внутреннее лекарство: будучи растворена в воде и дана больному, она очищает кишки».
Иоганном Рудольфом Глаубером и названная в его честь, до сих пор широко применяется в медицине, стеклоделии, кристаллографических исследованиях. Глаубер так описывал ее: «Эта соль, если она хорошо приготовлена, имеет вид льда; она образует длинные, совершенно прозрачные кристаллы, которые растапливаются на языке, как лед. У нее вкус обыкновенной соли, без всякой едкости. Брошенная на пылающие угли, она не растрескивается с шумом, как обыкновенная кухонная соль, и не воспламеняется со взрывом, как селитра. Она без запаха и выносит любую степень жара. Ее можно применять с выгодой в медицине как снаружи, так и внутрь. Она заживляет свежие раны, не раздражая их. Это превосходное внутреннее лекарство: будучи растворена в воде и дана больному, она очищает кишки».
Минерал глауберовой соли называется мирабилитом (от латинского «mirabilis» – удивительный). Название происходит от имени, которое дал Глаубер открытой им соли; он назвал ее чудесной. Крупнейшие в мире разработки этого вещества находятся в нашей стране, чрезвычайно богата глауберовой солью вода знаменитого залива Кара-Богаз-Гол. Дно залива буквально устлано ею.
Дно залива буквально устлано ею.
Сульфиты, сульфаты, тиосульфаты…
Если вы фотолюбитель, вам необходим фиксаж, т.е. натриевая соль серноватистой (тиосерной) кислоты Н 2 S 2 O 3 . Тиосульфат натрия Na 2 S 2 O 3 (он же гипосульфит) служил поглотителем хлора в первых противогазах.
Если вы порезались во время бритья, кровь можно остановить кристаллом алюмокалиевых квасцов KAl(SO 4) 2 · 12H 2 O.
Если вы хотите побелить потолки, покрыть медью какой-либо предмет или уничтожить вредителей в саду – вам не обойтись без темно-синих кристаллов медного купороса CuSO 4 · 5Н 2 О.
Бумага, на которой напечатана эта книга, сделана с помощью гидросульфита кальция Са(НSO 3) 2 .
Широко используются также железный купорос FeSO 4 · 7H 2 O, хромовые квасцы K 2 SO 4 · Cr 2 (SO 4) 3 · 2Н 2 O и многие другие соли серной, сернистой и тиосерной кислот.
Киноварь
Если в лаборатории разлили ртуть (возникла опасность отравления ртутными парами!), ее первым делом собирают, а те места, из которых серебристые капли не извлекаются, засыпают порошкообразной серой. Ртуть и сера вступают в реакцию даже в твердом состоянии – при простом соприкосновении. Образуется кирпично-красная киноварь – сульфид ртути – химически крайне инертное и безвредное вещество.
Ртуть и сера вступают в реакцию даже в твердом состоянии – при простом соприкосновении. Образуется кирпично-красная киноварь – сульфид ртути – химически крайне инертное и безвредное вещество.
Выделить ртуть из киновари несложно. Многие другие металлы, в частности железо, вытесняют ртуть из киновари.
Серобактерии
В природе постепенно происходит круговорот серы, подобный круговороту азота или углерода. Растения потребляют серу – ведь ее атомы входят в состав белка. Растения берут серу из растворимых сульфатов, а гнилостные бактерии превращают серу белков в сероводород (отсюда – отвратительный запах гниения).
Но есть так называемые серобактерии, которым вообще не нужна органическая пища. Они питаются сероводородом, и в их организмах в результате реакции между H 2 S, CO 2 и О 2 образуются углеводы и элементарная сера. Серобактерии нередко оказываются переполнены крупинками серы – почти всю их массу составляет сера с очень небольшой «добавкой» органических веществ.
Сера – фармацевтам
Все сульфамидные препараты – сульфидин, сульфазол, норсульфазол, сульгин, сульфодимезин, стрептоцид и другие подавляют активность многочисленных микробов. И все эти лекарства – органические соединения серы. Вот структурные формулы некоторых из них:
После появления антибиотиков роль сульфамидных препаратов несколько уменьшилась. Впрочем, и многие антибиотики можно рассматривать как органические производные серы. В частности, она обязательно входит в состав пенициллина.
Мелкодисперсная элементарная сера – основа мазей, применяемых при лечении грибковых заболеваний кожи.
Нитрид серы проводит ток
В 1975 г. журнал «Кэмикл энд инжениринг ньюс» сообщил о получении нового неорганического полимера, у которого многие свойства – как у металла. Полимерный нитрид серы – политиазил (SN) n легко прессуется и куется, его электропроводность близка к электропроводности ртути. При этом пленки из политиазила не одинаково проводят ток в продольном и поперечном направлении. Это объясняется тем, что пленка построена из упорядоченных, расположенных параллельно друг другу полимерных волокон.
Это объясняется тем, что пленка построена из упорядоченных, расположенных параллельно друг другу полимерных волокон.
Что можно построить из серы
В 70-х годах в некоторых странах мира производство серы превысило потребности в ней. Поэтому сере стали искать новые применения, прежде всего в таких материалоемких областях, как строительство. В результате этих поисков появились серный пенопласт – как теплоизоляционный материал, бетонные смеси, в которых серой частично или полностью заменен портландцемент, покрытия для автострад, содержащие элементарную серу.
Вулкан Иджен — действующий вулкан в Индонезии. Другое название синонимично названию местного сернистого озера Кавах Иджен или просто Кавах.
Расположен в густонаселённой местности в Восточной Яве, является границей 2 округов: Бондовосо и Баньуванги. Данный вулкан является комплексом, состоящим более чем из десятка вулканических объектов: стратовулканов, вулканических конусов, кратеров, расположенных в радиусе 20 км вокруг кальдеры.
Кратер вулкана Иджен (Ijen Volcano) – один из самых привлекательных и опасных на Земле. Активный вулкан, постоянно извергающий клубы серного дыма.
Вулкан Кава Иджен не похож на своих собратьев. Внутри его вулканической чаши, бурлит не огнекипящая лава, а тихо раскинулось, окруженное скалами, удивительной красоты неземное озеро с одноименным названием – Кавах Иджен. Его размеры 950 на 600 метров, объем – 36 миллионов кубометров. Но наполнено оно не водой, а смесью концентрированной серной и соляной кислоты, причем горячей: температура ее на поверхности около 60 градусов, на дне – еще выше. Однажды в это озеро опустили на двадцать минут лист алюминия, а когда его вынули, толщина металла стала сравнима с тончайшей тканью. Представляете, что будет, если вдруг начнется извержение? Когда магма вскипятит жуткое содержимое озера и тонны кислоты поднимутся в воздух? Угроза этого не беспочвенна. Правительство Индонезии в 2012 году установило уровень активности Кава Иджен в соответствии с желтой отметкой и до сих пор не понизило это предупреждение. Но выглядит озеро Кавах Иджен – необыкновенно!
Но выглядит озеро Кавах Иджен – необыкновенно!
Цвет поверхности его переменчив, оно то яблочно-зеленое, то изумрудное, то малахитовое с бирюзовым оттенком. На берегу и в отдалении, на серых с прожилками скалах разбросаны разнокалиберные глыбы ярко-желтого цвета. Это самородная сера. Сначала она жидкая, красивого темно-красного цвета и ползет по склонам, словно лава. Остывая – светлеет, приобретая цвет янтаря. Потом – желтеет, и делается твердой. В темное время суток, жидкая сера, окисляясь, начинает светиться нереальными синими, голубыми огнями и сполохами, фантастически преображая окрестности. Это и есть синяя лава. А днем горение обозначает себя дымчато-белыми клубами. По склонам кратерной воронки курится множество струй, то ли пара, то ли дымов. Вероятнее всего, так через трещины, из недр под давлением вырывается водяной пар, а с ним токсичный хлористый водород, удушающий сернистый газ и еще более вредный и коварный сероводород.
Горение сопровождается шестьюстами градусами Цельсия, сияние не очень интенсивное при дневном свете, во всей красе его можно наблюдать только в ночное время.
Сфотографировать это зрелище – нелегкая задача. Французский фотограф Оливье Грюневальд специализируется на таких изображениях, не используя каких-либо фильтров или модификации изображения. Для того, чтобы сделать это, он должен ждать до заката, когда видны синие языки пламени. Он работает с противогазом, чтобы избежать вдыхания токсичных испарений.
Близ озера местные жители уже долгое время добывают серу. Это очень тяжелая и опасная работа. Люди вручную нагружают корзины кусками серы, а затем относят груз в соседнюю долину, где они получают выплату за добычу. Обычно корзина с серой весит 75−90 кг, и её приходится нести около 300 метров в гору, а потом ещё 3 км после спуска с кратера до ближайшего сахарного завода, в котором серу задействуют в очистительных процессах. Большинство рабочих проделывают такое путешествие дважды в день и, по данным за 2010 год, получают примерно $10-13 в день.
По местным меркам это высокооплачиваемая и престижная работа. На острове Ява очень высокая плотность населения и безработица. Шахтеры, добывающие серу, являются своеобразной рабочей элитой.
Шахтеры, добывающие серу, являются своеобразной рабочей элитой.
Люди, которые занимаются этим трудом, часто жалуются на проблемы, связанные с дыханием. И это не удивительно, ведь долгое время находиться в кратере Иджен без противогаза опасно для здоровья. В свою очередь, рабочие часто пренебрегают защитой во время нахождения рядом с серой.
Серные пары настолько опасны для здоровья, что средняя продолжительность жизни рабочих всего около 47 лет.
: Несколько дней на Иджене, да и после, я провела в обнимку с «Комбайнерами». Навязчивая мелодия и такие же навязчивые слова удивительно хорошо легли на идженовскую картинку. Я смотрела на молодых мужчин, тащащих свои 90 кг серы 3 км вниз, к окошку сдачи, и думала о том, что комбайнеры везде свои. Да…
ВВС отснял про них прекрасный фильм, и каждый день они становятся героями фотохроник любопытствующих. Туризм на Иджене хоть и не принял размаха Бромо, все же отнюдь не редкость. Хорошо, что трафик на тропе пока не такой большой, иначе как лавировать между гостями вулкана тем, для кого эти три километра наверх порожняком и потом снова те же три, но вниз, и с грузом – единственный способ существования? Шахтеры работают каждый день. С утра, порой, до рассвета, они приезжают к началу тропы на Иджен. Там же собираются и туристические средства передвижения.
С утра, порой, до рассвета, они приезжают к началу тропы на Иджен. Там же собираются и туристические средства передвижения.
Потом с пустыми корзинами отправляются в свой ежедневный трек наверх. Всего 3 км. Кто-то идет в одиночку, кто-то собирается группками с товарищами, кто-то пристраивается к туристам и по пути рассказывает о своем житье-бытье, иногда получая в благодарность сигаретку-другую.
Сигареты на Иджене – местная валюта. Шахтеры с удовольствием попозируют для фото – с поклажей или без – или дадут вам попробовать хотя бы поднять их «штангу».
Все будут благодарны сигарете и тут же ее и выкурят. Курят они беспрестанно. Среди шахтеров мы случайным образом встретили только одного, который этой вредной привычки не имел.
По пути есть небольшое «общежитие» для тех, кто решил остаться переночевать поближе к рабочему месту. Ну или отдохнуть/перекусить.
Тут же выставлены удивительные местные сувениры: отлитые из серы разные фигурки. Странные, странные сувениры…
3 км вверх, а потом еще около полчаса вниз, к самой шахте. Сверху картинка выглядит какой-то нереальной: мелкие копошащиеся фигурки в желтом дыме.
Сверху картинка выглядит какой-то нереальной: мелкие копошащиеся фигурки в желтом дыме.
Там несколько человек откалывают куски серы и грузят в подоспевшие корзины. Те, кто откалывают, меняются каждый день. Эта работа не оплачивается. Работа в самом аду, у фумарол. Дышать практически нечем. Хотя как нечем? Носом!
Глазам, вероятно, тоже приходится несладко.
Шалаш почти у шахты. Зачем?
Подготовленные к отгрузке корзины.
Терек, наш попутчик, мечтал попасть на Иджен после того, как увидел фильм про шахтеров несколько лет назад. «Почему я не догадался привезти им пачку масок? В Бондовозо они всего по 3 000 рупий!» Терек, не переживай. Не факт, что твои маски вообще использовались бы. Зачем? На самом деле, внизу шахтеры иногда заматывают лицо банданами, платками и шарфами. И все же внизу нам встретился один человек в респираторе.
Леха в самом низу, у шахт.
Терек на тропе. Кстати, в итоге провел на Иджене 5 дней; сбылась его мечта посмотреть на вулкан лично и познакомиться с шахтерами. Часть времени провел в семьях шахтеров. Очень гостеприимные люди. Не думаю, что они ставят перед собой какие-то великие цели рассказать миру о совем тяжелом труде, но спасибо, что они это делают.
Часть времени провел в семьях шахтеров. Очень гостеприимные люди. Не думаю, что они ставят перед собой какие-то великие цели рассказать миру о совем тяжелом труде, но спасибо, что они это делают.
Конечно, ничего хорошего для здоровья в том, чтобы дышать серой, нет. С другой стороны, как оказывается, это не так ужасающе вредно, как выглядит на первый взгляд. Шахтеры обычно доживают лет до 50… Они в курсе вреда и риска, но выбирают заниматься этой работой. Более того, она считается весьма неплохой: заработать можно в несколько раз больше, чем где-нибудь, скажем, на фабрике батика (будь таковая поблизости).
Среди шахтеров встречаются и молодые люди, и люди постарше. Многим из тех, кого я отнесла к молодежи-молодежи, оказалось от 30 до 35. Все обычно при семьях и с детьми. Все жизнерадостные, искренние, вежливые. Рассказывают о совей работе и жизни, видимо, в душе посмеиваясь над странными иностранцами, которые слушают все это с широко открытыми глазами. Да, и выглядят молодо. Работа на свежем воздухе, как это ни парадоксально, видимо, влияет.
Работа на свежем воздухе, как это ни парадоксально, видимо, влияет.
Несколько раз встречали мужчин более старшего возраста с огромными опухолями в районе скулы. Очевидно, злокачественные и понятно, воздействием какого фактора вызваны.
Кстати, на вид смотришь и удивляешься: как эти невысокие, дохлые ребята умудряются тащить такой груз? Да и на сами корзины смотришь – и не веришь, что там такой вес. На вид сера кажется легкой и пористой, словно губка.
Вдоль тропы часто тут и там стоят корзины, дожидаются своих владельцев.
И отдыхают сами владельцы.
И перекур.
От постоянного ношения коромысла на плечах образуется своеобразный нарост типа мозоли прямо под палку.
3 км с серой, то вверх, то вниз, по валунам и тропам
– и сдавать то, что принес, в окошко приемки. Там, в темноте, под крышей, сидит какой-то уж очень характерный приемщик с острым, неприятно-сосредоточенным выражением лица. Словно читается, как он чувствует себя выше этих работяг, выдавая им копейки за адский труд. Хотя, быть может, это моя буйная фантазия. Очередь к приемке.
Хотя, быть может, это моя буйная фантазия. Очередь к приемке.
Сначала на весы. Обычно вес корзин где-то в рамках 65-90 кг.
После взвешивания получаешь бумажку у приемщика с отметкой сданного веса. Снова загружаешь свою ношу и несешь ее в грузовик, который после наполнения отвезет серу на фабрику. Она где-то километрах в 10 от Иджена. Сколько надо человек/ходок, чтобы наполнить его???
Теперь с бумажкой, на которой указан принятый вес, идем в окошко выдачи зарплаты. Это ценное место работы еще и потому, что деньги ты получаешь сразу.
Этот шахтер сегодня принес немного: болят колени. На бумажке:
— брутто – 64 кг
— нетто – 59 кг
— стоимость за кг нетто – 780 рупий
— итоговая сумма к выдаче – 46 020 рупий, т.е. порядка 4,5 долларов.
За день шахтер делает одну или две (самые сильные и крепкие) ходки, зарабатывая, соответственно, до 10-12 долларов. При удачном стечении обстоятельств в месяц можно заработать долларов до 250.
Вы все еще жалуетесь на жизнь? Машина классом ниже, чем хотелось бы? Покупаете вторую линию одежды вместо первой? А в Европу слетать на выходные можете только лишь раз-другой в год? И обедать порой приходится дешевым бизнес-ланчем за 10 долларов? Действительно, жизнь, вероятно, не сложилась…
П. С. Все время у кратера и по дороге не покидает ощущение, что на странной машине времени ты перенесся на 200-400 лет назад. Сегодня XXI век на дворе, нет? Особенно сильно ощущение колониальных времен у киоска взвешивания. Становится не по себе от мысли, что люди намеренно убивают себя, а ведь можно было бы хотя бы как-то механизировать процесс. Ну хотя бы использовать осликов, буйволов, яков! Наверное, это просто будет дороже, да и ни к чему: сократятся рабочие места, безработица со всеми вытекающими… И все течет так же, как и столетия назад.
С. Все время у кратера и по дороге не покидает ощущение, что на странной машине времени ты перенесся на 200-400 лет назад. Сегодня XXI век на дворе, нет? Особенно сильно ощущение колониальных времен у киоска взвешивания. Становится не по себе от мысли, что люди намеренно убивают себя, а ведь можно было бы хотя бы как-то механизировать процесс. Ну хотя бы использовать осликов, буйволов, яков! Наверное, это просто будет дороже, да и ни к чему: сократятся рабочие места, безработица со всеми вытекающими… И все течет так же, как и столетия назад.
Сера (с лат. sērum «сыворотка») — минерал класса самородных элементов, неметалл. Латинское название связано с индоевропейским корнем swelp — «гореть ». Химическая формула: S.
Сера в отличие от других самородных элементов имеет молекулярную решетку, что определяет ее низкую твердость (1,5-2,5), отсутствие спайности, хрупкость, неровный излом и обусловленный им жирный плеск; лишь на поверхности кристаллов наблюдается стеклянный блеск. Удельный вес 2,07 г/см 3 . Обладает плохой электропроводимостью, слабой теплопроводностью, невысокой температурой плавления (112,8°С) и воспламенения (248°С). Легко загорается от спички и горит голубым пламенем; при этом образуется сернистый газ, имеющий резкий удушливый запах. Цвет у самородной серы светло-жёлтый, соломенно-желтый, медово-желтый, зеленоватый; сера, содержащая органические вещества, приобретают бурую, серую, черную окраску. Вулканический сера ярко-желтая, оранжевая, зеленоватая. Местами обычно с желтоватым оттенком. Встречается минерал в виде сплошных плотных, натечных, землистых, порошковатых масс; также бывают наросшие кристаллы, желваки, налеты, корочки, включения и псевдоморфозы по органическим остаткам. Сингония ромбическая.
Удельный вес 2,07 г/см 3 . Обладает плохой электропроводимостью, слабой теплопроводностью, невысокой температурой плавления (112,8°С) и воспламенения (248°С). Легко загорается от спички и горит голубым пламенем; при этом образуется сернистый газ, имеющий резкий удушливый запах. Цвет у самородной серы светло-жёлтый, соломенно-желтый, медово-желтый, зеленоватый; сера, содержащая органические вещества, приобретают бурую, серую, черную окраску. Вулканический сера ярко-желтая, оранжевая, зеленоватая. Местами обычно с желтоватым оттенком. Встречается минерал в виде сплошных плотных, натечных, землистых, порошковатых масс; также бывают наросшие кристаллы, желваки, налеты, корочки, включения и псевдоморфозы по органическим остаткам. Сингония ромбическая.
Отличительные признаки : для самородной серы характерны: неметаллический блеск и то, что она загорается от спички и горит, выделяя сернистый газ, имеющий резкий удушливый запах. Наиболее характерным цветом для самородной серы является светло-желтый.
Разновидность :
Вулканит (селенистая сера). Оранжево-красного, красно-бурого цвета. Происхождение вулканическое.
Моноклинная сера Кристаллическая сера Кристаллическая сера Селенистая сера — вулканит
Химические свойства серы
Загорается от спички и горит голубым пламенем, при этом образуется сернистый газ, имеющий резкий удушливый запах. Легко плавится (температура плавления 112,8° С). Температура воспламенения 248°С. Сера растворяется в сероуглероде.
Происхождение серы
Встречается самородная сера естественного и вулканического происхождений. Серобактерии живут в водных бассейнах, обогащенных сероводородом за счет разложения органических остатков, — на дне болот, лиманов, мелких морских заливов. Лиманы Черного моря и залив Сиваш являются примерами таких водоемов. Концентрация серы вулканического происхождения приурочена к жерлам вулканов и к пустотам вулканических пород. При вулканических извержениях выделяются различные соединения серы (H 2 S, SО 2), которые окисляются в поверхностных условиях, что приводит к восстановлению ее; кроме того, сера возгоняется непосредственно из паров.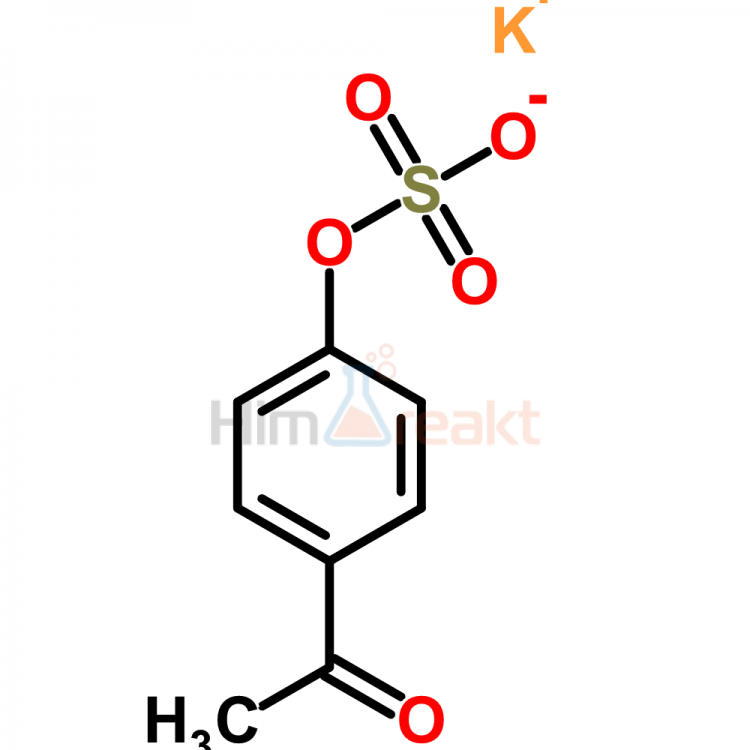
Иногда при вулканических процессах сера изливается в жидком виде. Это бывает тогда, когда сера, ранее осевшая на стенках кратеров, при повышении температуры расплавляется. Отлагается сера также из горячих водных растворов в результате распада сероводорода и сернистых соединений, выделяющихся в одну из поздних фаз вулканической деятельности. Эти явления сейчас наблюдаются около жерл гейзеров Йеллоустонского парка (США) и Исландии. Встречается совместно с гипсом, ангидритом, известняком, доломитом, каменной и калийной солями, глинами, битуминозными отложениями (нефть, озокерит, асфальт) и пиритом. Также встречается на стенках кратеров вулканов, в трещинах лав и туфов, окружающих жерла вулканов как действующих, так и потухших, вблизи серных минеральных источников.
Спутники . Среди осадочных пород: гипс, ангидрит, кальцит, доломит, сидерит, каменная соль, сильвин, карналлит, опал, халцедон, битумы (асфальт, нефть, озокерит). В месторождениях, образовавшихся в результате окисления сульфидов, — главным образом пирит. Среди продуктов вулканического возгона: гипс, реальгар, аурипигмент.
Среди продуктов вулканического возгона: гипс, реальгар, аурипигмент.
Применение
Широко используется в химической промышленности. Три четверти добычи серы идет на изготовление серной кислоты. Применяется она также для борьбы с сельскохозяйственными вредителями, кроме того, в бумажной, резиновой промышленности (вулканизация каучука), в производстве пороха, спичек, в фармацевтике, стекольной, пищевой промышленности.
Месторождения серы
На территории Евразии все промышленные месторождения самородной серы поверхностного происхождения. Некоторые из них находятся в Туркмении, в Поволжье и др. Породы, содержащие серу, тянутся вдоль левого берега Волги от г. Самара полосой, имеющей ширину в несколько километров, до Казани. Вероятно, сера образовалась в лагунах в пермский период в результате биохимических процессов. Месторождения серы находятся в Раздоле (Львовская область, Прикарпатье), Яворовске (Украина) и в Урало-Эмбинском районе. На Урале (Челябинская обл.) встречается сера, образовавшаяся в результате окисления пирита. Сера вулканического происхождения имеется на Камчатке и Курильских островах. Основные запасы находятся в Ираке, США (штаты Луизиана и Юта), Мексике, Чили, Японии и Италии (о. Сицилия).
Сера вулканического происхождения имеется на Камчатке и Курильских островах. Основные запасы находятся в Ираке, США (штаты Луизиана и Юта), Мексике, Чили, Японии и Италии (о. Сицилия).
Фотограф Оливье Грюнвальд недавно несколько раз посетил шахту по добыче серы в кратере вулкана Кавах Льен в Восточной Яве, Индонезия. Он привез с собой необходимое оборудование, чтобы запечатлеть сюрреалистические снимки, освещенные лунным сиянием, факелами и голубым пламенем горящей серы.
Шахтеры в кратере сначала поднимаются на 2600 метров, затем спускаются к берегу 200-метрового кратерного озера серной кислоты, где они добывают куски чистой серы и везут их обратно на станцию взвешивания. Представляем вашему вниманию фотографии этих смелых шахтеров, работающих под покровом ночи.
1. Шахтер в кратере вулкана Кавах Льен с факелом смотрит на потоки жидкой серы, горящей жутковатым голубым пламенем. (© Olivier Grunewald)
2. Вулканическое кислотное озеро в кратере вулкана Кавах Льен. На берегу озера проводятся работы по добыче серы. (© Olivier Grunewald)
На берегу озера проводятся работы по добыче серы. (© Olivier Grunewald)
3. Паровые и кислотные газы среди желтоватых отложений серы. (© Olivier Grunewald)
4. Горящая раскаленная сера в вулканическом кратере. Сера плавится при температуре 100 градусов по Цельсию, но температуры в кратере недостаточно для самовозгорания – это пламя подсвечивается факелами шахтеров. (© Olivier Grunewald)
5. Шахтер расчищает куски серы, чтобы забрать в шахтоуправление. (© Olivier Grunewald)
6. Отложения серы на старой бочке, окруженной серой, в кратере вулкана Кавах Льен. (© Olivier Grunewald)
7. Шахтеры добывают серу в адских условиях. Фотограф Оливье Грюнвальд вспоминает, что запах был просто нестерпим, для работы были необходимы маски, которых у шахтеров практически не было. (© Olivier Grunewald)
8. Шахтеры с длинными ломами, которыми они достают серу из кратера. (© Olivier Grunewald)
Подпишитесь на нас в telegram
9. «Скульптура», образованная жидкой серой в кратере Кавах Льена. В растопленном состоянии сера кажется практически кроваво-красной, но по мере остывания приобретает желтый оттенок. (© Olivier Grunewald)
«Скульптура», образованная жидкой серой в кратере Кавах Льена. В растопленном состоянии сера кажется практически кроваво-красной, но по мере остывания приобретает желтый оттенок. (© Olivier Grunewald)
10. Расплавленная сера горит, стекая с камней и керамических труб, превративших серные газы из вулкана в жидкость, которая затем затвердеет и будет пригодна для сбора. (© Olivier Grunewald)
11. Шахтеры работают в кратере, освещенные лишь факелами. (© Olivier Grunewald)
12. Шахтер кладет серу в корзинки, в которых ее выносят из кратера вулкана. (© Olivier Grunewald)
13. Шахтер собирает серу рядом с трубами конденсации. На заднем плане горит расплавленная сера. (© Olivier Grunewald)
14. Шахтеры с кусками серы готовятся к возвращению наверх. (© Olivier Grunewald)
15. Расплавленная сера горит на твердом отложении. Шахтеры потушат огонь, чтобы не потерять ценные запасы серы. (© Olivier Grunewald)
16. Шахтер с грузом возвращается обратно. (© Olivier Grunewald)
(© Olivier Grunewald)
17. Шахтер в противогазе в густом облаке пара и кислотного газа с факелом, недалеко от голубого пламени горящей жидкой серы. (© Olivier Grunewald)
18. Пара полной серой корзин может весить от 45 до 90 кг. (© Olivier Grunewald)
19. Шахтеры готовятся возвращаться со своим грузом, окруженные паром, газом и светом от факелов. (© Olivier Grunewald)
20. Барак шахтеров прямо в кратере вулкана Кавах Льен. (© Olivier Grunewald)
21. Шахтер с грузом в виде кусков серы. (© Olivier Grunewald)
22. Шахтеры с факелами возвращаются по 200-метровой стене кратера Кавах Льен. (© Olivier Grunewald)
23. А внизу продолжаются работы по добыче серы. (© Olivier Grunewald)
24. Шахтер взвешивает добытую серу в шахте. Шахтеры проделывают свое путешествие 2-3 раза в день, а зарабатывают около 13 долларов в день. (© Olivier Grunewald)
25. На станции первичной обработки куски серы разбивают на более мелкие части. (© Olivier Grunewald)
(© Olivier Grunewald)
26. Затем куски серы помещают в крупные сосуды над огнем для повторного плавления. (© Olivier Grunewald)
27. Расплавленную серу разливают из плавильного котла в ведра. (© Olivier Grunewald)
28. Небольшое количество расплавлено серы разливают в другие сосуды. (© Olivier Grunewald)
29. Последняя стадия: разливание жидкой серы на плиты для остывания. После затвердения ее перевезут на местные заводы для изготовления резины, обесцвечивания сахара и других промышленных процессов. (© Olivier Grunewald)
30. Фотограф Оливье Грюнвальд готовится сфотографировать небольшую скалу, нависшую над кислотным вулканическим озером Кавах Льена. «Такое ощущение, будто ты на другой планете», — делится впечатлением фотограф. В адских условиях кратера Оливье потерял один фотоаппарат и два объектива. После окончания работы над проектом он выбросил всю свою одежду, так как запах был настолько сильным, что он не смог от него избавиться. (© Olivier Grunewald)
(© Olivier Grunewald)
В восточной части острова Ява, что находится в Индонезии, есть удивительное по красоте, но очень опасное по своей природе место – это вулкан Kawah Ijen. Вулкан находится на высоте около 2400 метров над уровнем море, диаметр его кратера 175 метров, а глубина – 212 метров. В его жерле расположено, наверное, самое странное и пугающее озеро прекрасного яблочно-изумрудного цвета, в котором рискнет искупаться разве что Терминатор, поскольку вместо воды в нем серная кислота. А точнее сказать – смесь серной и соляной кислоты объемом 40 млн. тонн.
Известный французский фотограф Оливье Грюневальда недавно совершил несколько путешествий в серные рудники в кратере вулкана Kawaha Ijen, находящегося в Восточной Яве, Индонезия. Там он сделал при помощи специального оборудования захватывающие сюрреалистичные фотографии этого места в лунном свете, освещенного факелами и синем пламенем горящей расплавленной серы.
Спуск в кальдеру вулкана Kawaha Ijen, где находится озеро с серной кислотой шириной в километр. На его берегах добывают серу
На его берегах добывают серу
Каждый литр этой смертельной жижи содержит дополнительно по 5 грамм расплавленного алюминия. Всего же в озере по приблизительным подсчетам содержится более 200 тонн алюминия. На поверхности озерца температура колеблется в районе 60 градусов, а на его дне и все 200!
Кислые газы и пар выделяются из желтоватых кусков серы
Чтобы люди могли представить всю опасность озера для жизней своих, был проведен эксперимент. В озеро на 20 минут опустили лист алюминия, уже при погружении он стал покрываться пузырями, а по прошествии всего времени, алюминиевый лист стал тонким, словно кусок ткани.
Рабочий отламывает кусок от твердой серы. Потом серу несут на станцию взвешивания.
Однако озеро и сам кратер вулкана Kawah Ijen используется не для привлечения туристов, а для добычи серы в весьма неблагоприятных для человека условиях. А серы в этом кратере несметное количество, но поскольку это все же ЮВА, то полностью используется ручной труд.
Ночь. Шахтер с факелом находится внутри кратера вулкана Ijen Kawaha, глядя на поток жидкой серы, светящийся сверхъестественным голубым цветом.
Рабочие – местные жители без каких-либо защитных костюмов и противогазов, а вдыхать запах серы то еще отвращение, добывают куски серы день и ночь, используя при этом лишь свои ничем незащищенные руки и платок, повязанный на лице для защиты рта и носа.
Шахтеры трудятся здесь в адских условиях во время добычи серы. Фотограф Оливье Грюневальда описал здешний запах как невыносимый, требующий маску или противогаз для техники безопасности. Некоторые из горняков их носят, остальные работают без них.
Шахтеры с ломами, которыми откалывают куски серы:
Рабочий укладывает куски серы в корзины, чтобы выносить ее из вулкана:
Вам кажется это все нарисовано? Посмотрите видео:
Поверили?
Эти причудливые формы образовались из потока жидкой серы внутри кратера вулкана Kawaha Ijen. Когда сера расплавленная, она имеет кроваво-красный цвет. По мере охлаждения она становится все более и более желтой
По мере охлаждения она становится все более и более желтой
Расплавленная сера капает из керамической трубы, которая конденсирует серные газы от вулкана в жидкость. Потом она остывает, затвердевает, и ее добывают рабочие
Шахтер дошел до пункта назначения со своим грузом. Шахтеры делают два или три ходки за серой в день, получая за свой тяжелый труд около $ 13 США за смену
Механизм для начальной переработки серы, где большие куски разбиваются на более мелкие
Затем куски серы помешаются над огнем, и она снова расплавляется
Расплавленная сера разливается по емкостям
Последний этап этого процесса — распределение жидкой серы на плитах для охлаждения. Когда она охладится и превратится в серные листы, они отправляются на местные местные заводы по вулканизации резины и других промышленные объекты
Фотограф Оливье Грюневальда: «Ощущение такое, что находишься на другой планете». Грюневальд потерял одну камеру и два объектива в суровых условиях кратера. Когда съемки были закончены, он выбросил все свои вещи в мусор: серный запах был настолько сильным, что от него невозможно будет избавиться.
Когда съемки были закончены, он выбросил все свои вещи в мусор: серный запах был настолько сильным, что от него невозможно будет избавиться.
А теперь дневной репортаж из этой шахты:
Индонезийский шахтер несет серу из Ijen 24 мая 2009 в окрестностях Banyuwangi, Восточная Ява, Индонезия.
Заполненное кислотой озеро внутри кратера вулкана Ijen 200 метров в глубину и километр в ширину. Фото сделано 24 мая 2009 года в Восточной Яве, Индонезия. Озеро наполняется раствором серной кислоты и хлористого водорода при температуре 33 Сº.
Работник ремонтирует трубы, в которых, конденсируются сернистые газы. Комплекс вулкана Ijen 24 мая 2009 в окрестностях Banyuwangi, Восточная Ява, Индонезия.
Шахтер извлекает серу из трубы на кратере вулкана Ijen 24 мая 2009 года в Восточной Яве, Индонезия. Расплавленная сера вытекает из труб глубокого красного цвета, и по мере охлаждения постепенно становится желтой и затвердевает.
Работники чинят трубы, в которых, конденсируются сернистые газы. Комплекс вулкана Ijen 24 мая 2009 в окрестностях Banyuwangi, Восточная Ява, Индонезия.
Комплекс вулкана Ijen 24 мая 2009 в окрестностях Banyuwangi, Восточная Ява, Индонезия.
Шахтер извлекает серу из трубы у кратера вулкана Ijen 24 мая 2009 года в Восточной Яве, Индонезия.
На этом фото, сделанном через сегмент запасной керамической трубы, работники ремонтируют большую трубу для конденсации серы. Комплекс вулкана Ijen 24 мая 2009 в окрестностях Banyuwangi, Восточная Ява, Индонезия.
Кусок серы добываемой из вулкана Ijen. Фото сделано 24 мая 2009 год, Восточная Ява, Индонезия.
Фотограф Оливье Грюнвальд недавно несколько раз посетил шахту по добыче серы в кратере вулкана Кавах Льен в Восточной Яве, Индонезия. Он привез с собой необходимое оборудование, чтобы запечатлеть сюрреалистические снимки, освещенные лунным сиянием, факелами и голубым пламенем горящей серы.
Шахтеры в кратере сначала поднимаются на 2600 метров, затем спускаются к берегу 200-метрового кратерного озера серной кислоты, где они добывают куски чистой серы и везут их обратно на станцию взвешивания. Представляем вашему вниманию фотографии этих смелых шахтеров, работающих под покровом ночи.
Представляем вашему вниманию фотографии этих смелых шахтеров, работающих под покровом ночи.
1. Шахтер в кратере вулкана Кавах Льен с факелом смотрит на потоки жидкой серы, горящей жутковатым голубым пламенем. (© Olivier Grunewald)
2. Вулканическое кислотное озеро в кратере вулкана Кавах Льен. На берегу озера проводятся работы по добыче серы. (© Olivier Grunewald)
3. Паровые и кислотные газы среди желтоватых отложений серы. (© Olivier Grunewald)
4. Горящая раскаленная сера в вулканическом кратере. Сера плавится при температуре 100 градусов по Цельсию, но температуры в кратере недостаточно для самовозгорания – это пламя подсвечивается факелами шахтеров. (© Olivier Grunewald)
5. Шахтер расчищает куски серы, чтобы забрать в шахтоуправление. (© Olivier Grunewald)
6. Отложения серы на старой бочке, окруженной серой, в кратере вулкана Кавах Льен. (© Olivier Grunewald)
7. Шахтеры добывают серу в адских условиях. Фотограф Оливье Грюнвальд вспоминает, что запах был просто нестерпим, для работы были необходимы маски, которых у шахтеров практически не было. (© Olivier Grunewald)
(© Olivier Grunewald)
8. Шахтеры с длинными ломами, которыми они достают серу из кратера. (© Olivier Grunewald)
Подпишитесь на нас в telegram9. «Скульптура», образованная жидкой серой в кратере Кавах Льена. В растопленном состоянии сера кажется практически кроваво-красной, но по мере остывания приобретает желтый оттенок. (© Olivier Grunewald)
10. Расплавленная сера горит, стекая с камней и керамических труб, превративших серные газы из вулкана в жидкость, которая затем затвердеет и будет пригодна для сбора. (© Olivier Grunewald)
11. Шахтеры работают в кратере, освещенные лишь факелами. (© Olivier Grunewald)
12. Шахтер кладет серу в корзинки, в которых ее выносят из кратера вулкана. (© Olivier Grunewald)
13. Шахтер собирает серу рядом с трубами конденсации. На заднем плане горит расплавленная сера. (© Olivier Grunewald)
14. Шахтеры с кусками серы готовятся к возвращению наверх. (© Olivier Grunewald)
15. Расплавленная сера горит на твердом отложении. Шахтеры потушат огонь, чтобы не потерять ценные запасы серы . (© Olivier Grunewald)
16. Шахтер с грузом возвращается обратно. (© Olivier Grunewald)
17. Шахтер в противогазе в густом облаке пара и кислотного газа с факелом, недалеко от голубого пламени горящей жидкой серы. (© Olivier Grunewald)
18. Пара полной серой корзин может весить от 45 до 90 кг. (© Olivier Grunewald)
19. Шахтеры готовятся возвращаться со своим грузом, окруженные паром, газом и светом от факелов. (© Olivier Grunewald)
20. Барак шахтеров прямо в кратере вулкана Кавах Льен. (© Olivier Grunewald)
21. Шахтер с грузом в виде кусков серы. (© Olivier Grunewald)
22. Шахтеры с факелами возвращаются по 200-метровой стене кратера Кавах Льен. (© Olivier Grunewald)
23. А внизу продолжаются работы по добыче серы. (© Olivier Grunewald)
24. Шахтер взвешивает добытую серу в шахте. Шахтеры проделывают свое путешествие 2-3 раза в день, а зарабатывают около 13 долларов в день. (© Olivier Grunewald)
25. На станции первичной обработки куски серы разбивают на более мелкие части. (© Olivier Grunewald)
26. Затем куски серы помещают в крупные сосуды над огнем для повторного плавления. (© Olivier Grunewald)
27. Расплавленную серу разливают из плавильного котла в ведра. (© Olivier Grunewald)
28. Небольшое количество расплавлено серы разливают в другие сосуды. (© Olivier Grunewald)
29. Последняя стадия: разливание жидкой серы на плиты для остывания. После затвердения ее перевезут на местные заводы для изготовления резины, обесцвечивания сахара и других промышленных процессов. (© Olivier Grunewald)
30. Фотограф Оливье Грюнвальд готовится сфотографировать небольшую скалу, нависшую над кислотным вулканическим озером Кавах Льена. «Такое ощущение, будто ты на другой планете», — делится впечатлением фотограф. В адских условиях кратера Оливье потерял один фотоаппарат и два объектива. После окончания работы над проектом он выбросил всю свою одежду, так как запах был настолько сильным, что он не смог от него избавиться. (© Olivier Grunewald)
Очень популярная тема в интернете, потому что очень эффектная и шокирующая. Кратер вулкана Иджен (Ijen Volcano) — один из самых привлекательных и опасных на Земле. Активный вулкан, постоянно извергающий клубы серного дыма, крупнейшее в мире кислотное озеро Кава Иджен (Kawah Ijen), невероятный по своей красоте синий огонь и нечеловеческие условия работы шахтеров, добывающих серу.
Не уж то это до сих пор происходит, задают себе вопрос многие. Давайте попробуем тут собрать наиболее полную информацию об этом месте.
Фото 2.
На самом деле Иджен — это не просто вулкан, а вулканический комплекс, из более чем из десятка вулканических объектов: стратовулканов, вулканических конусов, кратеров, расположенных в радиусе 20 км вокруг кальдеры.
Но туристов привлекает именно кратер с кислотным озером, берега которого являются естественным крупным месторождением природной серы. Кратер в радиусе составляет 361 метр и имеет глубину 200 метров.
Озеро Кава (Kawah) в кратере вулкана Иджен — это самое большое кислотное озеро в мире. Оно состоит из растворенной в воде концентрированных соляной и серной кислоты. Вулкан выбрасывает хлористый водород с виде газа. Взаимодействуя с водой, он образовывает серную кислоту с PH около нуля. Растворённая в воде соляная кислота и придает озеру красивый бирюзовый цвет.
Озеро является смертельно опасным, тем не менее его можно потрогать рукой. Температура на поверхности составляет 50-60°С, а в глубине — свыше 200°С. Глубина озера достигает 200 метров.
Фото 4.
Удивительное явление синего огня — это на самом деле сернистый газ, горящий при температуре 600°С, что и придает огню характерный синий цвет. Свечение достаточно слабое, поэтому увидеть его можно только ночью.
Порой серу поджигают сами рабочие. Часть дыма конденсируется в установленных в кратере керамических трубах и вытекает из труб, образуя сталактиты натуральной серы. Жидкая сера красного цвета извергается из вентиляционных отверстий и охлаждается до желтого на поверхности. Эти сталактиты, кстати, продают туристам в качестве сувениров.
Вот такие эффектные фотографии сделал известный французский фотограф Оливье Грюневальда, совершивший несколько путешествий в серные рудники в кратере вулкана Kawaha Ijen. Там он сделал при помощи специального оборудования захватывающие сюрреалистичные фотографии этого места в лунном свете, освещенного факелами и синем пламенем горящей расплавленной серы.
Потоки лавы, горящей синим пламенем, можно наблюдать на Иджене крайне редко. К сожалению, многие сайты показывают фотографии Оливьера Грюневальда и создают впечатление, что это происходит каждую ночь. Не верьте! Обычно горит только сернистый газ и нет никакой лавы.
Фото 5.
В кратере местные жители вручную добывают серу. Это очень тяжелая и опасная работа. Без защитных костюмов, а многие даже без масок, шахтеры ломами откалывают куски серы и помещают их в корзину. Эти корзины они несут 200 метров к вершине кратера, а потом спускаются 3 км к подножью вулкана в деревню, где и получают вознаграждение за проделанную работу. Вес такой корзины 60-80 кг, некоторые умудряются поднимать до 90 кг.
Фото 6.
Обычно рабочие проделывают такое путешествие дважды в день. За 1 кг серы платят 900-1000 IDR, это значит около 5$ за корзину или 10$ в день. По местным меркам это высокооплачиваемая и престижная работа. На острове Ява очень высокая плотность населения и безработица. Шахтеры, добывающие серу, являются своеобразной рабочей элитой.
Однако это никак не помогает им долго жить. Серные пары настолько опасны для здоровья, что молодые парни выглядят стариками, а средняя продолжительность жизни около 47 лет.
Фото 7.
Несмотря на ужасающие условия труда, рабочие — удивительно приветливые и жизнерадостные люди. Вот что пишет : Я испытала культурный шок, когда рабочий, на плечах которого корзина, вес которой превышает его собственный, уступил мне дорогу на камнях, ведущих к вершине кратера. Много раз нам подсказывали более удачный путь и с удовольствием позировали туристам.
Лучшее, что вы можете сделать для рабочих — подарить им респиратор или хотя бы просто защитную маску. Они не могут позволить себе купить даже сменные фильтры, нет ни денег, ни возможности. Многие рабочие даже не знают о том, что воздух, которым они дышат опасен.
Рабочие все как один курят. Говорят, что это им помогает немного сбить запах серы, который становится просто невозможным через какое-то время.
Фото 7.
можно посмотреть путешествие блогера по этим рудникам.
Чтобы люди могли представить всю опасность озера для жизней своих, был проведен эксперимент. В озеро на 20 минут опустили лист алюминия, уже при погружении он стал покрываться пузырями, а по прошествии всего времени, алюминиевый лист стал тонким, словно кусок ткани.
Фото 8.
На дне кратера сборщики серы оборудуют небольшой палаточный лагерь, в котором живут какое-то время, пока ведут на этом месте добычу. Как только сера извергается в другом месте, они перемещаются к нему. Таких «залежей» здесь несколько. Они оборудованы трубами, из которых стекает расплавленная сера. Когда она остывает и затвердевает, рабочие начинают ее собирать.
Фото 9.
Серу собирают в две корзины, соединенные между собой перекладиной из бамбука. Спасаясь от ядовитых паров, сборщики придумали собственное средство защиты. Представляет оно собой обычный кусок намоченной хлопчатобумажной ткани. Они сжимают его зубами и дышат через него или же просто обматывают тканью часть лица.
Фото 10.
Фото 11.
Фото 12.
Фото 13.
Фото 14.
Фото 15.
Фото 16.
Фото 17.
Фото 18.
Фото 19.
Фото 20.
Вследствие активности вулкана в кратере сквозь трещины постоянно выделяется сернистый пар. Горячий пар проходит через специально проложенные трубы, охлаждается вниз и стекает по склону кратера, постепенно затвердевая. Технология добычи весьма примитивна, но в данном случае большего и не нужно. Далее за дело берутся старатели, которые ломами и арматурой разбивают глыбы серы на куски, складывают в корзины и относят в приемный пункт. Для этого приходится преодолеть около 2500 метров по пересеченной местности с грузом в 45-90 кг на плечах.
Рабочие не используют специальных средств защиты, иногда только закрываясь платками. В противогазах и респираторах здесь появляются только пожарные, которые тушат горящую серу. Работают здесь вахтовым методом по 15 дней.
Добытая сера используется для вулканизации резины, обесцвечивания сахара и других промышленных процессов. Рабочие делают из нее маленькие сувениры на продажу, отливая из расплавленной серы различные фигурки.
Фото 21.
Фото 22.
Фото 23.
Фото 24.
Фото 25.
Индонезийский рабочий показывает купоны на оплату заработанных средств за доставленный груз серы из жерла вулкана Кава Иджен в восточной части острова Ява, Индонезия. Три купона — три ходки в жерло вулкана.
Фото 26.
Фото 27.
Фото 28.
Фото 29.
Фото 30.
Фото 31.
Фото 32.
Фото 33.
Фото 34.
Фото 35.
Фото 36.
Фото 37.
Фото 38.
Фото 39.
Фото 40.
Фото 42.
Фото 43.
Фото 44.
Фото 45.
Фото 46.
Фото 47.
Фото 48.
Фото 49.
Фото 50.
Фото 51.
Фото 52.
Фото 53.
Фото 54.
Фото 55.
Фото 56.
Фото 57.
Фото 58.
Фото 59.
Фото 60.
Фото 61.
Фото 1.
Фото 2.
Фото 4.
Фото 6.
Рубрика: Люди ,Путешествия
Индонезийский шахтер несет серу из вулкана Кава Иджен в окрестностях округа Баньюванги, Восточная Ява, Индонезия.
Мужчина ремонтирует полипропиленовые трубы, в которых происходит конденсация опасных газов. Индонезия.
Шахтер, при помощи стальной арматуры, извлекает серу из трубы в кратере вулкана Кава Иджен в Восточной Яве. Расплавленная сера имеет красный цвет, она вытекает из труб и по мере охлаждения становится желтой и затвердевает.
Работники чинят трубы, в которых конденсируются сернистые газы.
Мужчина дробит большой кусок затвердевшей серы на более мелкие, чтобы было удобнее их нести на станцию взвешивания. В окрестностях округа Баньюванги, Восточная Ява.
Фото сделано сквозь запасной сегмент керамической трубы. Работники за ремонтом трубы в кратере вулкана Кава Иджен, Индонезия.
На фото трубы, в которых конденсируется сернистый газ (оксид серы) – бесцветный газ с характерным резким запахом.
Кусок серы, добываемой из вулкана Кава Иджен, округ Баньюванги, Восточная Ява, Индонезия.
Шахтер извлекает серу из трубы, находящейся в кратере вулкана.
Мужчина с куском серы на плече направляется к своим корзинам, которые позже понесет на станцию взвешивания.
Фото сделано во время короткого перерыва в работе. Индонезия.
Груженые серой корзины шахтеры понесут вверх по крутым склонам кратера, а затем до станции взвешивания.
Шахтеры выносят серу из вулкана Кава Иджен, Восточная Ява.
Работник почти поднялся на вершину кратера по исхоженной тропе, ведущей к вулкану.
На этом фото видно, насколько тяжела ноша шахтеров.
Мужчина отдыхает перед очередным спуском в кратер вулкана, чтобы добыть еще серы.
Шахтер показывает болячки и шрамы от переноски серы из вулкана Кава Иджен в Восточной Яве, Индонезия.
На станции взвешивания в Индонезии.
Работник на базе отдыха “Camp Tehnic Sulfutara”.
Приготовление ужина на базе в Индонезии.
Шахтеры на перекуре перед очередным спуском к вулкану в Восточной Яве.
ДЕКАГИДРАТ СУЛЬФАТА НАТРИЯ | 7727-73-3
ДЕКАГИДРАТ СУЛЬФАТА НАТРИЯ Свойства
- Точка плавления:
- 32-38 ° С
- Плотность
- 1,46 г / мл при 25 ° C (лит.)
- темп хранения.
- 2-8 ° С
- растворимость
- H 2 O: 1 M при 20 ° C, прозрачный, бесцветный
- форма
- Цельный
- цвет
- Белый
- Удельный вес
- 1.46
- PH
- 5,2-8,0 (50 г / л, ч3O, 25 ℃) (безводное вещество)
- Растворимость в воде
- Растворим в воде и глицерине. Нерастворим в этаноле и метаноле.
- λмакс
- λ: 260 нм Amax: ≤0,025
λ: 280 нм Amax: ≤0,021
- Мерк
- 14,8680
- Стабильность:
- Конюшня.Несовместим с сильными кислотами, алюминием, магнием.
- ИНЧИКЕЙ
- RSIJVJUOQBWMIM-UHFFFAOYSA-L
- Ссылка на базу данных CAS
- 7727-73-3 (Ссылка на базу данных CAS)
- Вещества, добавленные в пищу (ранее EAFUS)
- СУЛЬФАТ НАТРИЯ
- Система регистрации веществ EPA
- Декагидрат динатрия сульфата (7727-73-3)
БЕЗОПАСНОСТЬ
- Заявление о рисках и безопасности
| Заявления о безопасности | 24/25 | ||
|---|---|---|---|
| WGK Германия | 1 | ||
| TSCA | Есть | ||
| Код ТН ВЭД | 28331900 |
ДЕКАГИДРАТ СУЛЬФАТА НАТРИЯ цена Подробнее (11)
| Производитель | Номер товара | Описание товара | Номер CAS | Упаковка | Цена | Обновлено | Купить |
|---|---|---|---|---|---|---|---|
| Сигма-Олдрич | 403008 | Декагидрат сульфата натрия Реагент ACS, ≥99.0% | 7727-73-3 | 100 г | $ 57,1 | 2020-08-18 | Купить |
| Сигма-Олдрич | 246980 | Декагидрат сульфата натрия ЧДА 97% | 7727-73-3 | 500 г | 88 руб.3 | 2020-08-18 | Купить |
| Альфа Эзар | A15702 | Декагидрат сульфата натрия, 99% | 7727-73-3 | 1000 г | 32,2 долл. США | 2020-06-24 | Купить |
| Альфа Эзар | A15702 | Декагидрат сульфата натрия, 99% | 7727-73-3 | 5000 г | 82 руб.6 | 2020-06-24 | Купить |
| Сигма-Олдрич | 1.06648 | Декагидрат сульфата натрия для анализа EMSURE ACS, Reag. Ph Eur | 7727-73-3 | 1066481000 | 77 долларов.4 | 2020-08-18 | Купить |
ДЕКАГИДРАТ СУЛЬФАТА НАТРИЯ Химические свойства, применение, производство
событие
Сульфат натрия встречается в природе как минералы мирабилит и тенардит. В то время как тенардит представляет собой безводную форму Na2SO4, мирабилит представляет собой естественный декагидрат Na2SO4 • 10h3O.Сульфат натрия — одна из важнейших солей натрия. Декагидрат, широко известный как глауберова соль, был впервые получен Иоганном Глаубером в семнадцатом веке в качестве побочного продукта при производстве соляной кислоты из серной кислоты и хлорида натрия.
Физические свойства
Безводный сульфат натрия представляет собой белый кристаллический порошок; орторомбическая или гексагональная структура; гигроскопичен; показатель преломления 1,468; твердость 2,8 по шкале Мооса; плотность 2,664 г / см3; плавится при 884 ° С; растворим в воде, не растворим в этаноле.Декагидрат состоит из бесцветных моноклинных кристаллов; показатель преломления 1,394; твердость 1,8 по шкале Мооса; плотность 1,4 6г / см3; разлагается при 32 ° C; растворим в воде; не растворим в этаноле.
Производство
Сульфат натрия добывается из природных месторождений полезных ископаемых и подвергается очистке. Сульфат натрия синтезируется по способам Мангейма или Харгривза. Процесс Манхейма основан на реакции Глаубера между серной кислотой и хлоридом натрия:2NaCl + h3SO4 → Na2SO4 + 2HCl ↑
Процесс был разработан Иоганном Глаубером для производства соляной кислоты.Сульфат натрия выделяют из раствора фракционной кристаллизацией. Процесс Харгривза также был разработан для производства соляной кислоты. Это разновидность метода Мангейма. В этом методе вместо серной кислоты используется диоксид серы. Реакция следующая:
4NaCl + 2SO2 + O2 + 2h3O → 2Na2SO4 + 4HCl ↑
Сульфат натрия также получают как побочный продукт при производстве фенола путем плавления каустической соды.
Химические свойства
Белый или почти белый кристаллический порошок или бесцветные прозрачные кристаллы.использует
Декагидрат сульфата натрия используется в производстве бумажной массы по технологии Kraft. Другое использование — производство стекла и ультрамарина; в крашении и печати текстильных изделий; как наполнитель синтетических моющих средств; и для стандартизации красителей. Основное применение безводного сульфата натрия — это средство для удаления воды из органических растворителей и их экстрактов для органического синтеза и инструментального анализа. Декагидрат сульфата натрия — обычный лабораторный реагент.Также он используется для приготовления других солей натрия.Методы очистки
Кристаллизовать сульфат натрия из воды при 30o (1,1 мл / г) путем охлаждения до 0o. Он становится безводным при 32o.Продукты и сырье для получения декагидрата сульфата натрия
Сырье
Препараты
Глобальные (183) Поставщики Бельгия 2 Китай 134 Чешская Республика 1 Европа 2 Германия 5 Индия 2 Япония 6 Швейцария 2 Великобритания 9 США 20 В мире 183
Посмотреть последнюю цену от производителей ДЕКАГИДРАТА СУЛЬФАТА НАТРИЯ
ДЕКАГИДРАТ СУЛЬФАТА НАТРИЯ Spectrum
7727-73-3 (ДЕКАГИДРАТ СУЛЬФАТА НАТРИЯ) Поиск по теме:
- ГЛАУБЕРСКАЯ СОЛЬ
- NATRII SULFAS DECAHYDRICUS
- СУЛЬФАТ НАТРИЯ 10-ГИДРАТ
- ДЕКАГИДРАТ СУЛЬФАТА НАТРИЯ
- СУЛЬФАТ НАТРИЯ IOh3O
- СУЛЬФАТ НАТРИЯ, 10-ГИДРАТ
- ДЕКАГИДРАТ СУЛЬФАТА НАТРИЯ
- ДОДЕКАГИДРАТ СУЛЬФАТА НАТРИЯ
- СУЛЬФАТ НАТРИЯ ВОДОРОДНЫЙ
- сульфат декагидрат сопдия
- СУЛЬФАТ НАТРИЯ, ДЕКАГИДРАТ, РЕАГЕНТ (ACS) СУЛЬФАТ НАТРИЯ, ДЕКАГИДРАТ, РЕАГЕНТ (ACS) СУЛЬФАТ НАТРИЯ, ДЕКАГИДРАТ, РЕАГЕНТ (ACS)
- Декагидрат сульфата натрия Производитель
- декагидрат сульфат натрия
- Декагидрат сульфата натрия
- Натрия сульфат гидратированный
- СОЛЬ ГЛАУБЕРА
- ДЕКАГИДРАТ СУЛЬФАТА НАТРИЯ 99 +% и
- ДЕКАГИДРАТ СУЛЬФАТА НАТРИЯ КРИСТАЛЛИЗОВАННЫЙ
- РЕАГЕНТ ACS ДЕКАГИДРАТА СУЛЬФАТА НАТРИЯ
- СУЛЬФАТ-10-ГИДРАТ НАТРИЯ R.Г., REAG. А CS
- ДЕКАГИДРАТ СУЛЬФАТА НАТРИЯ, PH ЕВРО
- РЕАГЕНТ ДЕКАГИДРАТА СУЛЬФАТА НАТРИЯ GRA &
- ДЕКАГИДРАТ СУЛЬФАТА НАТРИЯ, 99 +%, A.C.S. РЕАГЕНТ
- СУЛЬФАТ-10-ГИДРАТ НАТРИЯ ЭКСТРАЧИЙ, DA B, PH. EUR., B. P., PH. FRANC., США
- Декагидрат сульфата натрия A.Р.
- Декагидрат сульфата натрия чистоты, 97%
- СУЛЬФАТ НАТРИЯ 10h3O
- Глауберова соль Mirabilite
- Глауберова соль Мирабилит сульфат сопдия декагидрат
- Сульфат натрия 10h3OFcc
- Сульфат натрия 10h3OAcs
- Натрия сульфат 10х3ОБп
- СУЛЬФАТ НАТРИЯ 10 ч3О
- СУЛЬФАТ НАТРИЯ, ДЕКАГИДРАТНЫЙ РЕАГЕНТ (ACS)
- сульфат натрия , medicina
- ДЕКАГИДРАТ СУЛЬФАТА НАТРИЯ, ЧИСТЫЙ
- Динатриевая соль серной кислоты, декагидрат
- НАТРИЯ, БЕЗВОДНЫЙ РЕАГЕНТ, ACS (BULK
- НАТРИЯ ДЕКАГИДРАТ, USP
- Мирабитит
- Сульфат натрия, декагидрат, реагент
- Глауберова соль, Natrii sulfas decahydricus
- Декагидрат сульфата натрия, особо чистый, Ph Eur, USP, BP
- Дека сульфата натрия
- Дисодиум сульфат декагидрат
- Декагидрат сульфата натрия, 99%, для биохимии
- MultiPharM (TM) SodiuM сульфат, декагидрат, особо чистый, USP, BP, Ph Eur
- Реагент ACS декагидрата сульфата натрия,> = 99.0%
- Декагидрат сульфата натрия Puriss. в год, кристаллизованный,> = 99,0% (рассчитано в расчете на сухое вещество, T)
- Декагидрат сульфата натрия, 99%, для анализа
- Декагидрат сульфата натрия, 99%, для синтеза
- Декагидрат сульфата натрия, AR, ≥99%
- судьба декагидрат
- 7727-73-3
- 7727-73-4
- Na2S0410h3O
- Na2O4S10h3O
- Na2SO410h3O
Mirabilite — Saltwiki
Авторы: Hans-Jürgen Schwarz, Nils Mainusch
Английская версия Кристы Гердвилкер
назад к сульфату
| Mirabilite [1] [2] | |
| Минералогическое название | Мирабилит |
| Химическое название | декагидрат сульфата натрия |
| Тривиальное имя | Глауберова соль, Reussin, сульфат соды |
| Химическая формула | Na 2 SO 4 • 10H 2 O |
| Прочие формы | Na 2 SO 4 • 7H 2 O (гептагидрат сульфата натрия) |
| Кристаллическая система | моноклиника |
| Кристаллическая структура | |
| Деликатная влажность 20 ° C | 95.6% |
| Растворимость (г / л) при 20 ° C | 1,353 моль / кг |
| Плотность (г / см³) | 1,466 г / см³ |
| Молярный объем | 219,8 см 3 / моль |
| Молярный вес | 322,19 г / моль |
| Прозрачность | от прозрачного до непрозрачного |
| Раскол | идеально |
| Хрустальная форма | |
| Twinning | |
| Фазовый переход | |
| Химическое поведение | |
| Комментарии | растворим в воде и глицерине, не растворим в чистом спирте легко теряет немного воды, превращается в тенардит при 32 ° C аномальные синие или коричневые интерференционные цвета |
| Crystal Optics | |
| Показатели преломления | n x = 1.394 n y = 1,396 n z = 1,398 |
| Двулучепреломление | Δ = 0,004 |
| Оптическая ориентация | отрицательный |
| плеохроизм | |
| Дисперсия | 76 ° |
| Использованная литература | |
| [Robie.etal: 1978] Название: Термодинамические свойства минералов и родственных веществ в 298.15 К и давление 1 бар и более высокие температуры Автор: Роби Р.А., Хемингуэй Б.С.; Фишер Дж. А. [Дана: 1951] Название: Система минералогии Даны Автор: Дана Дж. Д. | |
Аннотация
Представлены мирабилит, который является деакагидратом сульфата натрия, и его свойства.
Свойства растворимости
Рисунок 1 : Растворимость в системе Na 2 SO 4 -H 2 O в зависимости от температуры [по [Steiger.etal: 2008] Название: Кристаллизация фаз сульфата натрия в пористых материалах: фазовая диаграмма Na2SO4 – h3O и создание напряженияАвтор: Steiger, Michael; Asmussen, Sönke
].
Растворимость мирабилита составляет 1,35 моль / кг при 20 ° C. Растворимость показывает высокую температурную зависимость, она уменьшается с понижением температуры и увеличивается при более высоких температурах. Мирабилит при температуре выше 32,4 ° C нестабилен, поэтому тенардит является стабильной фазой при более высоких температурах.
см. Натрия сульфат
Гигроскопичность
Рис. 2 : Поведение разрыхления в системе Na 2 SO 4 -H 2 O и равновесная влажность для превращения тенардита / мирабилита согласно [Steiger.etal: 2008] Название: Кристаллизация Фазы сульфата натрия в пористых материалах: диаграмма состояния Na2SO4 – h3O и возникновение напряженияАвтор: Steiger, Michael; Asmussen, Sönke
Фиг. 2 иллюстрирует влияние температуры на влажность при расплывании мирабилита и на другие фазы сульфата натрия.Примечательно, что для мирабилита и тенардита графики влажности расплывания идут в противоположных направлениях. В отличие от плавучести тенардита, влажность мирабилита уменьшается с повышением температуры.
Влажность расплываемости мирабилита всегда превышает 87% в его стабильном температурном диапазоне (таблица 1). Также сульфат натрия
| 0 ° С | 10 ° С | 20 ° С | 30 ° С |
| 98.8% относительной влажности | 97,8% относительной влажности | 95,6% отн. Влажн. | 90,1% отн. Влажн. |
Присутствие других ионов, как в случае смесей солей, может значительно изменить параметры равновесной влажности, то есть условия температуры и влажности, которые инициируют фазовые изменения. В таблице 2 приведены экспериментально определенные значения равновесной влажности различных солевых смесей. Это показывает, что равновесная влажность чистого мирабилита выше, чем у других солей.
| MgSO 4 | Ca (НЕТ 3 ) 2 | КНО 3 | |
| Na 2 SO 4 • 10H 2 O | 87 (21 ° С) | 74 (21 ° С) | 81 (21 ° С) |
Давление кристаллизации
Кристаллизация мирабилита из водного раствора приводит к давлению кристаллизации 7.2-8,3 Н / мм 2 .
Поведение при гидратации
Ошибка при создании эскиза:Преобразование мирабилита (?) В тенардит
Система Na 2 SO 4 — H 2 O:
Единственными стабильными формами сульфата натрия являются декагидрат (мирабилит) и ангидрит (тенардит). Образование мирабилита путем перекристаллизации соли из водного перенасыщенного раствора происходит при 32,4 ° C. В частности, переход от тенардита к мирабилиту и включение 10 молекул воды в кристаллическую решетку вызывает объемное расширение на 320%.Этот переход происходит при относительно низкой температуре (32-35 ° C), повреждение, вызванное этой солью, сильно зависит от температуры и, следовательно, от окружающей среды. Этот диапазон температур приведен в качестве ориентировочного, поскольку этот переход может происходить, например, при 25 ° C при относительной влажности 80% или даже при 0 ° C при относительной влажности 60,7% [информация от Gmelin]. Из-за такой сильной зависимости от параметров окружающей среды очень трудно получить оценку ущерба, нанесенного зданиям кристаллизацией и гидратацией сульфата натрия.
Аналитические доказательства
Микроскопия
Лабораторный анализ:
Наблюдения за поведением растворимости с помощью микроскопа позволяют проверить высокую растворимость сульфата натрия в воде и его нерастворимость в этаноле. Тенардит и мирабилит не имеют морфологических характеристик, позволяющих их идентифицировать во время простых экспериментов по перекристаллизации. Вместо этого можно наблюдать широкий спектр различных форм.
Показатели преломления: n x = 1395; n y = 1.396-1.410; n z = 1,398-1,419
Двулучепреломление : Δ = 0,04-0,023
Кристаллический класс e: моноклин
Под поляризационным микроскопом:
Содержание кристаллизационной воды в образце или его остатке. кристаллизованная форма зависит от относительной влажности и температуры окружающей среды. В сухом воздухе (относительная влажность ниже 80% при комнатной температуре) мирабилит теряет свою кристаллизационную воду и превращается в тенардит. Этот процесс можно наблюдать при перекристаллизации под микроскопом.Мирабилит имеет характерные аномальные интерференционные цвета, которые ослабевают при потере воды и образовании тенардита.
Дифференциация различных солей:
Как правило, дифференциация некоторых сульфатов (перечисленных ниже, включая тенардит) без микрохимического определения катионов проблематична, поскольку их показатели преломления близки друг к другу, а все соли демонстрируют небольшое двойное лучепреломление. Использование иммерсионного материала с n D — значение 1.48 полезен и позволяет дифференцировать соли внутри этой группы. Кроме того, могут быть приняты во внимание перечисленные ниже свойства. Косвенно тенардит можно определить по появлению мирабилита при перекристаллизации в гидратированную форму.
| Солевая фаза | Характеристики |
| Буссингальтит (NH 4 ) 2 Mg (SO) 4 • 6H 2 0 | отсутствие аномальных цветов интерференции / наклонное затухание |
| Пикромерит K 2 Mg (SO 4 ) 2 • 6H 2 0 | отсутствие аномальных цветов интерференции / наклонное затухание |
| Блодит Na 2 Mg (SO 4 ) 2 • 6H 2 0 | все индексы> 1.48 / отсутствие аномальных цветов интерференции / наклонное затухание / отрицательная оптическая ориентация |
| Глазерит K 3 Na (SO 4 ) 2 | все индексы> 1,48 / отсутствие аномальных цветов интерференции / наклонное гашение |
| Арканит K 2 SO 4 | все индексы> 1,48 / нет аномальных цветов интерференции |
| Дашковаит Mg (HCO 2 ) 2 • 2H 2 O | относительно высокое двулучепреломление / отсутствие аномальных цветов интерференции / наклонное гашение |
Смеси:
Смешанные системы Na + — Ca 2+ — SO 4 2- : Из-за своей более низкой растворимости гипс сначала выпадает в осадок во время перекристаллизации.Характерные игольчатые кристаллы гипса образуются первыми, тогда как сульфат натрия выпадает в осадок позже, рост кристаллов происходит заметно быстрее, но морфология неспецифична.
Смешанная система Na + — SO 4 2- — Cl — : Осаждение обоих типов частиц начинается практически одновременно. Галит имеет характерную морфологию, тогда как сульфат натрия встречается в самых разных формах.
Под поляризационным микроскопом
- Кристаллизация сульфата натрия между двумя предметными стеклами
Снимок сделан через скрещенные полярные поля и красный I.
Фотография сделана через скрещенные поляры.
Ссылки
Literatur
| [Дана: 1951] | Дана Э.S. (ред.) Дана Дж. Д. (1951): Система минералогии Даны, 7, Wiley & Sons | |
| [Robie.etal: 1978] | Роби Р.А., Хемингуэй Б.С.; Фишер Дж. А. (1978): Термодинамические свойства минералов и родственных веществ при 298,15 К и давлении 1 бар и более высоких температурах. U.S. Geol. Surv. Bull , 1452 () | |
| [Steiger.etal: 2008] | Steiger, Michael; Асмуссен, Сонке (2008): Кристаллизация фаз сульфата натрия в пористых материалах: фазовая диаграмма Na2SO4 – h3O и создание напряжения. Geochimica et Cosmochimica Acta , 72 (17), 4291-4306, 10.1016 / j.gca.2008.05.053 | |
| [Vogt.etal: 1993] | Vogt, R .; Горецки, Лотар (1993): Der Einfluss hygroskopischer Salze auf die Gleichgewichtsfeuchte und Trocknung anorganischer Baustoffe, unveröffentlichter Bericht |
Обзор температурного диапазона неорганических солевых гидратов от 60 ° C с изменением фазы на 5 Сравнение с обычными восками (конференция)
Хирши, Джейсон, Глюсенкамп, Кайл Р., Мэллоу, Энн и Грэм, Сэмюэл. Обзор гидратов неорганических солей с температурой фазового перехода в диапазоне от 5 ° C до 60 ° C и сравнение стоимости материалов с обычными восками . США: Н. П., 2018.
Интернет.
Хирши, Джейсон, Глюсенкамп, Кайл Р., Мэллоу, Энн и Грэм, Сэмюэл. Обзор гидратов неорганических солей с температурой фазового перехода в диапазоне от 5 ° C до 60 ° C и сравнение стоимости материалов с обычными восками .Соединенные Штаты.
Хирши, Джейсон, Глюсенкамп, Кайл Р., Мэллоу, Энн и Грэм, Сэмюэл. Солнце .
«Обзор гидратов неорганических солей с температурой фазового перехода в диапазоне от 5 ° C до 60 ° C и сравнение стоимости материалов с обычными парафинами». Соединенные Штаты. https://www.osti.gov/servlets/purl/1468092.
@article {osti_1468092,
title = {Обзор гидратов неорганических солей с температурой фазового перехода в диапазоне от 5 ° C до 60 ° C и сравнением стоимости материалов с обычными парафинами},
author = {Хирши, Джейсон и Глюсенкамп, Кайл Р.and Mallow, Anne and Graham, Samuel},
abstractNote = {Материалы с фазовым переходом (PCM) с желаемой температурой фазового перехода могут использоваться для обеспечения источника или поглотителя тепла с постоянной температурой для различных приложений. Таким образом, включение ПКМ в строительные материалы, оборудование или приборы может сместить и / или снизить энергетическую нагрузку. Мотивация этой работы состоит в том, чтобы определить недорогие ПКМ на основе гидратов неорганических солей, которые могут дополнить существующие строительные системы и конструкции, и сравнить их с обычными парафинами.В этой работе мы проанализировали гидраты неорганических солей с температурой фазового перехода в диапазоне 5-60 ° C, чтобы охватить как отопление, так и охлаждение помещений. Свойства гидратов солей сравнивали с парафинами в том же диапазоне температур. Результаты показали, что ПКМ с температурой плавления выше 20 ° C, солевые гидраты имеют преимущества перед парафинами, включая более высокую плотность тепловой энергии (45-120 кВтч / м3 для солевых гидратов; 45-60 кВтч / м3 для парафинов) и в целом более низкую энергию материала. стоимость (1-20 $ / кВтч для солевых гидратов; 20-30 $ / кВтч для сопоставимых парафинов).Для ПКМ с температурой плавления менее 20 ° C стоимость материала выше как для гидратов солей, так и для парафинов (30-110 $ / кВтч для обоих классов материалов), и гидраты солей сохраняют свое преимущество большей плотности тепловой энергии (50- 120 кВтч / м3 для солевых гидратов; 45-60 кВтч / м3 для парафинов). Во всех случаях при сравнении парафинов и солевых гидратов для конкретного применения необходимо учитывать такие факторы, как термическая цикличность, стабильность, конгруэнтность, коррозия и переохлаждение. Наконец, мы даем обзор методов улучшения для гидратных гидратов соли и обнаруживаем, что ограниченные усилия были предприняты для настройки температур фазового перехода гидрата соли, с более широким кругом исследований, посвященных изучению стабилизации и минимизации переохлаждения.Этот анализ показывает потенциал разработки PCM на основе гидрата соли для недорогих систем накопления тепловой и тепловой энергии для различных областей применения.},
doi = {},
url = {https://www.osti.gov/biblio/1468092},
journal = {},
number =,
объем =,
place = {United States},
год = {2018},
месяц = {7}
}
Глицерин — Sciencemadness Wiki
| Имена | |
|---|---|
| Название ИЮПАК Пропан-1,2,3-триол | |
| Предпочтительное название IUPAC | |
| Другие названия 1,2,3-пропанетриол | |
| Недвижимость | |
| C 3 H 8 O 3 | |
| Молярная масса | 92.09 г / моль |
| Внешний вид | Бесцветная вязкая жидкость |
| Запах | Без запаха |
| Плотность | 1,261 г / см 3 |
| Температура плавления | 17,8 ° С (64,0 ° F, 290,9 К) |
| Температура кипения | 290 ° С (554 ° F, 563 К) |
| смешиваемый | |
| Растворимость | Смешивается с этанолом, метанолом, пропиленгликолем Нерастворим в ацетоне, бензоле, дисульфиде углерода, CCl 4 , хлороформе, диэтиловом эфире, петролейном эфире, ТГФ, растительных маслах |
| Давление пара | 0.003 мм рт. Ст. (50 ° C) |
| Опасности | |
| Паспорт безопасности | Sigma-Aldrich |
| Температура вспышки | 160 ° C (320 ° F, 433 K) (закрытая чашка) 176 ° C (349 ° F, 449 K) (открытая чашка) |
| Родственные соединения | |
Родственные соединения | Этиленгликоль Пропиленгликоль Эритритол |
| Если не указано иное, данные приведены для материалов в их стандартном состоянии (при 25 ° C [77 ° F], 100 кПа). | |
| Ссылки на инфобокс | |
Глицерин , альтернативно обозначаемый как глицерин или глицерин , представляет собой простой сахарный спирт, иногда используемый в качестве растворителя. Это полиол, состоящий из молекулы пропана с одним водородом на каждом из атомов углерода, замещенным гидроксильной группой. Глицерин иногда используется в качестве лабораторного растворителя, хотя это затруднено из-за его высокой вязкости.Он также используется в производстве хорошо известного взрывчатого нитроглицерина.
Недвижимость
Химическая промышленность
Глицерин имеет несколько нишевых применений в домашней химии. Смесь глицерина и щавелевой кислоты можно перегонять для получения муравьиной кислоты. Его можно использовать в качестве инертного растворителя для получения экстрактов растений или проведения органических реакций. И, пожалуй, самое известное, что его можно нитровать с помощью серной и азотной кислот в ледяной ванне для получения нитроглицерина, чувствительного жидкого бризантного взрывчатого вещества, используемого для производства динамита.
Физическое
Глицерин представляет собой бесцветную, вязкую жидкость без запаха при комнатной температуре с мягким сладким вкусом, похожую на искусственные подсластители. Он растворим в воде, но имеет ограниченную растворимость в большинстве органических растворителей, таких как ацетон, хлороформ и диэтиловый эфир. Гигроскопичен.
Наличие
Глицерин можно найти во многих аптеках и продуктовых магазинах, где он используется как «защитное средство для кожи». Как и многие медицинские товары и товары для здоровья, он продается с очень высокой наценкой, а это означает, что покупка глицерина в Интернете у определенных оптовиков на самом деле намного дешевле.
Препарат
Глицерин получают путем гидролиза или омыления растительных и животных жиров с использованием сильного основания, такого как гидроксид натрия. Однако, как правило, проще купить его, чем проводить процесс очистки продукта от этой реакции.
Проектов
Обработка
Безопасность
Глицерин более или менее нетоксичен, так как это важное биологическое химическое вещество. Пищевой глицерин можно попробовать любопытным, хотя внешние лекарственные сорта не могут быть гарантированно безопасными для употребления (пользователь Sciencemadness Ave369 использовал глицерин медицинского качества для смягчения домашней водки, и с ней ничего плохого не случилось).
Хранилище
Глицерин следует хранить в герметичных бутылях, так как он гигроскопичен и оттуда воду очень трудно удалить.
Утилизация
Глицерин не токсичен для окружающей среды, и его можно безопасно слить в канализацию.
Список литературы
- ↑ https://www.youtube.com/watch?v=EKj3Oa5GTcM
Соответствующие темы Sciencemadness
Йодистый водород — Sciencemadness Wiki
Иодистый водород — это химическое соединение с формулой HI .Водные растворы HI известны как иодистоводородная кислота, сильная кислота. Однако йодоводород и йодистоводородная кислота отличаются тем, что первый представляет собой газ при стандартных условиях, а другой — водный раствор указанного газа, что означает, что их свойства незначительно отличаются.
Недвижимость
Химическая промышленность
Иодистый водород медленно реагирует с кислородом с образованием воды и йода. Это также произойдет при воздействии света. Во влажном воздухе образуется туман иодистоводородной кислоты.
Физическое
Йодоводород — бесцветный газ с едким запахом. Он исключительно растворим в воде (245 г / 100 мл), давая иодистоводородную кислоту. Растворение экзотермическое. Также он слабо растворяется в спиртах.
Наличие
Безводный йодистый водород не продается большинством поставщиков химической продукции из-за его нестабильности и реакционной способности. Даже если бы он был продан, он определенно не был бы доступен химику-любителю, поскольку и йодистый водород, и йодоводородная кислота относятся к химическим веществам из Списка I.
Препарат
Есть несколько способов получения иодистого водорода.
Один из распространенных способов включает реакцию йода и белого фосфора. В небольшую колбу добавляют 11 частей (по массе) йода и медленно добавляют 1 часть высушенного белого фосфора. Реакция происходит немедленно, при этом появляется свет, и два реагента превращают жидкость при контакте. В результате получается трииодид фосфора, который обрабатывают 1,5 частями воды. Это приводит к гидролизу трииодида фосфора и выделению паров иодистоводородной кислоты.Осторожно нагревая смесь, выгоните большую часть паров иодистого водорода. Образующиеся пары HI от реакции пропускаются через влажный красный фосфор, который помещается в U-образную трубку. Нагревание продолжается до тех пор, пока жидкость не станет просто бесцветной, поскольку при дальнейшем нагревании образуются фосфин и йодид фосфония, которые могут вызвать мощный взрыв, не говоря уже о том, что фосфин чрезвычайно токсичен. [1]
Более удобный способ включает реакцию йода с тиолами.Реакция протекает в хлороформе или ТГФ при комнатной температуре в течение 30 минут. [2]
Другой метод предполагает использование йода в тетралине (тетрагидронафталине). В колбе на 500 мл растворяют 40 г иодида в 160 г тетралина при 40 ° C. В другой колбе на 500 мл при перемешивании нагревают 40 г тетрагидронафталина до 200 ° C, близкой к точке кипения. Раствор йода непрерывно добавляли во вторую колбу в течение 2 часов, поддерживая температуру на уровне 200 ° C.Образующийся в результате нечистый газообразный йодистый водород собирается в холодном пальце, если требуется безводный йодистый водород. Если иодистоводородная кислота является желаемым веществом, то пары йодистого водорода представляют собой пузырьки в объеме 1 литра воды. Выход неочищенного иодистого водорода составляет 94,6% с чистотой 99,5%. [3]
Та же реакция, описанная выше, также может быть использована для получения безводного бромистого водорода.
Этот газ можно также получить реакцией безводного йодида калия с 85% фосфорной кислотой при осторожном нагревании.
Дополнительные методы можно найти здесь и здесь
Проектов
- Сделайте иодистоводородную кислоту
- Получение безводных йодистых солей
Обращение
Безопасность
Иодистый водород является коррозионным и чрезвычайно токсичным. Это вызовет сильные ожоги кожи, глаз и слизистых тканей. При вдыхании или проглатывании это может привести к летальному исходу. Он также может проникать через кожу, и контакт может вызвать ожоги или, если он разжижен, обморожения. [4]
Законность
Как и его водный раствор, йодистый водород классифицируется как химическое вещество Списка I DEA, и его продажа ограничена.
Хранилище
Безводный йодистый водород нестабилен и чрезвычайно агрессивен, поэтому его лучше всего производить на месте и использовать сразу после производства.
Утилизация
Достаточно взаимодействия с основанием или тиосульфатом натрия.
Список литературы
- ↑ http://bitnest.ca/Rhodium/chemistry/hydriodic.html
- ↑ http://pubs.acs.org/doi/abs/10.1021/ol9d
- ↑ http://www.google.com/patents/US5693306
- ↑ http: // cameochemicals.noaa.gov/chemical/11597
Соответствующие темы Sciencemadness
этанол — Sciencemadness Wiki
95% этанол, хранящийся в старой бутылке из-под джина. | |
| Имена | |
|---|---|
| Название ИЮПАК Этанол | |
| Предпочтительное название IUPAC | |
| Систематическое название ИЮПАК | |
| Другие названия Абсолютный спирт, одеколон, питьевой спирт, этиловый спирт, этилгидрат, этилгидрат, этиловый спирт, этилол, зерновой спирт, гидроксиэтан, метилкарбинол | |
| Недвижимость | |
| C 2 H 6 O | |
| Молярная масса | 46.07 г / моль |
| Внешний вид | Бесцветная жидкость |
| Запах | Алкогольный |
| Плотность | 0,7893 г / см 3 (20 ° C) |
| Температура плавления | -114,14 ± 0,03 ° С (-173,45 ± 0,05 ° F, 159,01 ± 0,03 К) |
| Температура кипения | 78,24 ± 0,09 ° С (172,83 ± 0,16 ° F; 351,39 ± 0,09 К) |
| смешиваемый | |
| Растворимость | Смешивается почти со всеми органическими растворителями Не смешивается с перфторуглеродами |
| Давление пара | 5.95 кПа (при 20 ° C) |
| Кислотность (p K a ) | 15,9 (H 2 O) 29,8 (ДМСО) |
| Термохимия | |
| Опасности | |
| Паспорт безопасности | Sigma-Aldrich |
| Температура вспышки | 17 ° С (96%) |
| Смертельная доза или концентрация ( LD , LC ): | |
| 3450 мг / кг (перорально, мышь) 6300 мг / кг (перорально, кролик) 7060 мг / кг (перорально, крыса) [1] | |
| Родственные соединения | |
Родственные соединения | метанол пропанол |
| Если не указано иное, данные приведены для материалов в их стандартном состоянии (при 25 ° C [77 ° F], 100 кПа). | |
| Ссылки на инфобокс | |
Этанол или этиловый спирт , является первичным спиртом с формулой CH 3 CH 2 OH . Он более известен как питьевой спирт или просто алкоголь , и его растворы с водой являются основой всех алкогольных напитков. Это легко добываемый и производимый лабораторный растворитель, а также обычный реагент в органической химии.
Недвижимость
Химическая промышленность
Этанол — это первичный спирт с прямой цепью. Он часто используется в качестве растворителя в лабораторных условиях, но также имеет огромное разнообразие применений в качестве реагента.
Он реагирует с натрием и некоторыми другими металлами, особенно с другими щелочными металлами, с образованием этоксидов. Получение триэтоксида алюминия таким способом возможно с использованием йода и хлорида ртути (II) в небольших количествах в качестве катализатора.
Этанол можно окислить с помощью дихромата калия в кислых условиях до ацетальдегида, который может быть дополнительно окислен до уксусной кислоты, если условия достаточно низкие, чтобы предотвратить выкипание ацетальдегида.Ацетальдегид также можно получить из этанола двумя менее дорогостоящими способами, хотя необходимы специальные устройства. Первый — это окисление этанола кислородом над серебряным или медным катализатором при температуре выше 500 ° C, но реакция является экзотермической и самоподдерживающейся до тех пор, пока кислород присутствует в достаточном количестве, даже в концентрациях нормального воздуха. Другой метод — это дегидрирование этанола на медном катализаторе без потребности в кислороде. Этот маршрут не требует кислорода и проходит при более разумной температуре 260–290 ° C, но является эндотермическим и требует постоянного нагрева.Условия, необходимые для любого из этих каталитических способов, могут быть достигнуты путем пропускания этанола в форме пара через нагретую трубку из плавленого кварца, содержащую катализатор.
Этанол также может быть окислен до уксусной кислоты с использованием перманганата калия в основных условиях, вызывая немедленную нейтрализацию уксусной кислоты с образованием соли. Третий и последний путь получения уксусной кислоты из этанола включал биохимический процесс анаэробной ферментации уксуснокислыми бактериями, как это делается в промышленности при производстве уксуса.
Поскольку этанол является широко доступным первичным спиртом, он желателен для получения сложных эфиров путем этерификации Фишера путем кипячения его с обратным холодильником с карбоновой кислотой в условиях дегидратации.
Физическое
Этанол — прозрачная летучая жидкость со сладким запахом, которая кипит при 78 ° C. Этанол имеет плотность 0,789 г / см 3 и смешивается с водой, а также с большинством органических растворителей. Этанол образует азеотроп с водой при 95,6%, а растворы с более высокими концентрациями этанола, чем эта, являются агрессивно гигроскопичными.Сушка этанола может быть выполнена с использованием молекулярных сит 3A, осушителей или высаливанием с использованием карбоната калия. Также можно использовать оксид кальция. Этанол, как и большинство других спиртов, легко воспламеняется даже при низких концентрациях в растворе, хотя при низких концентрациях температура вспышки увеличивается.
Наличие
40% водные растворы этанола доступны в большинстве магазинов спиртных напитков как прозрачная водка, но для ее покупки необходимо достичь совершеннолетия (21 год в США). 90-95% этанол доступен как Everclear в некоторых магазинах спиртных напитков.В 14 штатах США продажа Everclear ограничена. Высококонцентрированный этанол также доступен в виде спирта-ректификата с максимальной концентрацией 96% (если быть точным, 95,6%). Некоторые спиртные напитки, как правило, содержат следы фенолфталеина или других химических веществ, добавленных для ограничения чрезмерного употребления алкоголя, и если они могут помешать любым предполагаемым реакциям, этанол необходимо подвергнуть дистилляции, чтобы удалить их. Ректификованный спирт доступен как пищевой во многих странах (Финляндия, Венгрия, Польша, Румыния, например.) и некоторых штатах США, хотя они часто довольно дороги, в некоторых случаях 26 долларов за литр. Высококонцентрированный этанол также может продаваться как дезинфицирующее средство (так называемый этанол «медицинского качества»), обычно смешанный с изопропанолом; это может или не может квалифицироваться как пищевой, в зависимости от страны.
Метилированный спирт или денатурированный спирт сильно различаются в зависимости от географического положения и бренда, но обычно содержат некоторую долю этанола и метанола, причем этанол составляет большую долю. Эти продукты могут также содержать метилэтилкетон, что делает их непригодными для питья.Этанол для промышленного использования денатурируют, чтобы никто не пил его, а это означает, что он дешевле, поскольку обходится без налога на алкоголь и доступен для продажи несовершеннолетним. Денатурирующие или горькие агенты включают денатония бензоат и пиридин, которые придают спирту очень неприятный горький вкус.
Некоторые виды топлива для лагерей / биотоплива состоят из этанола с небольшими следами метанола, добавленного для денатурации. Другие комбинации могут содержать изопропанол, глицерин или масло.
Дистилляция этанола, даже для научных целей и очистки, в некоторых местах считается незаконной, хотя часто можно получить разрешение на это.
Препарат
Один галлон домашнего алкоголя из сахара. Через семь дней после начала ферментации он содержит 20% этанола и готов к дистилляции.Приготовление этанола для лабораторного использования обычно осуществляется путем ферментации сахара (столовый сахар-песок отлично подходит) с использованием дрожжей, особенно с высокой толерантностью к алкоголю, быстро ферментирующих дрожжей, используемых для этой цели. Чтобы способствовать брожению, а не росту дрожжей, смесь необходимо поместить в контейнер с воздушным затвором, чтобы позволить углекислому газу выходить, но не попадать внутрь кислорода.Этот процесс обычно позволяет получать только растворы, состоящие из 20% этанола, возможно, вместе с другими продуктами, такими как метанол или ацетон, которые необходимо удалить. Если вы используете чистую сахарозу (рафинированный тростниковый или свекольный сахар) для приготовления этанола, вы застрахованы от загрязнения метанолом; однако пектин и некоторые другие углеводы, присутствующие во фруктах, действительно производят метанол при ферментации, поэтому фруктовые пюре требуют особых мер предосторожности при дистилляции.
Путем осторожной дистилляции смеси после того, как она достаточно ферментирована, можно получить 96% этанол, 4% воды по объему азеотропа.Чтобы получить чистый этанол из смеси этанола и воды, можно использовать высаливание, при котором карбонат калия растворяется в смеси, вызывая образование 2 отдельных слоев. Слой этанола можно удалить сверху и отогнать в безводной среде; или его можно охладить до температуры ниже 0 ° C для осаждения большинства примесей, если перегонка невозможна.
Если производство этанола в домашних условиях не является привлекательным способом, его можно перегонять из купленных в магазине спиртных напитков, таких как водка или джин, которые часто содержат около 40% этанола по объему.Важно помнить, что дистилляция этанола является незаконной во многих юрисдикциях без разрешения, и, возможно, не менее важно отметить, что этанол, произведенный таким способом, особенно с использованием лабораторной посуды, небезопасен для потребления. Дистилляция безопасного, потребляемого этанола — это целое искусство и ремесло под названием moonshining , и вам нужно изучить этот навык и получить или разработать специальный дистилляционный аппарат, если вы хотите синтезировать пищевой этанол. Проконсультируйтесь со своим юристом, чтобы узнать, является ли такая практика законной там, где вы живете; в некоторых юрисдикциях самогонный свет является легальным ремеслом, если от него не извлекается прибыль, а в некоторых это совершенно незаконно.
Проектов
Обработка
Безопасность
Этанол, употребляемый иногда в небольших количествах, не представляет особой опасности, но очень большие количества немедленно опасны для организма, тогда как умеренные и большие количества в течение длительного периода могут привести к повреждению печени. Он может вызывать привыкание, и это необычно среди лекарств, поскольку его симптомы отмены могут убивать. Проглатывание небольшого количества этанола вызывает опьянение, которое замедляет время реакции и осмысление. Следует отметить, что этанол, произведенный в лаборатории, НЕ подходит для употребления, особенно с учетом риска загрязнения метанолом, который в организме распадается на муравьиную кислоту, потенциально вызывая слепоту или смерть.Всегда храните этанол на кухне отдельно от лаборатории, не используйте его для перегонки непищевых химикатов и изучите искусство приготовления самогона , которое включает в себя методы пивоварения и дистилляции безопасного питьевого спирта, не загрязненного метанол или другие токсиканты. Научитесь использовать методы фракционной дистилляции, многоступенчатой дистилляции и ректификации, которые полезны для избавления от форшотов и финтов , содержащих токсичные вещества.
Воспламеняемость растворов этанола зависит от концентрации. Температура вспышки чистого спирта составляет 17 ° C, в то время как для концентраций всего 10% температура вспышки составляет около 49 ° C. Однако серьезная воспламеняемость начинается с 40% (минимальная концентрация, при которой воспламеняется чайная ложка).
Дистилляция алкоголя без разрешения запрещена во многих юрисдикциях, и поэтому домашнее пивоварение может не подходить для производства этанола подходящего качества для использования в лаборатории.
Хранилище
Этанол следует хранить в закрытых бутылях, вдали от источников огня или окислителей.Он немного гигроскопичен, образует азеотроп с водой на 95,6%. Если требуется чистый этанол, его можно высушить сильным осушителем, например, молекулярными ситами.
Для большинства процессов синтеза и процедур безводный этанол не всегда требуется, и достаточно азеотропного этанола. Однако для реакций, в которых присутствие воды нежелательно, вы можете получить безводный этанол, высушив его с использованием свежих молекулярных сит или металлического натрия, а затем перегоня этанол в сухих или инертных условиях.Соберите сухой этанол в стеклянную колбу из матового стекла, например круглодонную колбу, и закройте ее, используя хорошо смазанную пробку или запорный кран.
Утилизация
Этанол можно безопасно сжигать. Фактически, это топливо, обычно используемое в лабораторных горелках (спиртовых лампах). Не рекомендуется утилизировать сгорающий этанол, если он не загрязнен чем-то токсичным, которое не разрушается во время горения; даже если он слегка загрязнен метанолом, его можно использовать в спиртовой горелке.Используйте это с пользой.
Список литературы
- ↑ http://www.nafaa.org/ethanol.pdf
Соответствующие темы Sciencemadness
glauber% 27s соль формула
Возникает вопрос, состоящий из двух частей: напишите формулу декагидрата сульфата натрия, известного как глауберова соль и используемого в качестве слабительного. 200+ АКЦИЙ. >> Масса глауберова соли, необходимая для получения 2 моль сульфата натрия, составляет 644,38 г. Из формулы глауберовской соли видно, что она включает … Полный ответ см. Ниже.{\ circ} \ mathrm {F} $. Вы можете заменить им соль (хлорид натрия) при окрашивании хлопка иммерсионным окрашиванием с высоким содержанием воды с помощью химически активного красителя с волокнами, используя пятигаллонное ведро или стиральную машину. Национальный центр биотехнологической информации. Сульфат натрия — это типичный ионный сульфат с электростатической связью. коммутатор операторов домашних заданий и упражнений по квантовой механике. Chef Jar. 1 ответ. Индивидуальные курсы, с кредитами или без них. Глауберова соль — это декагидратная форма сульфата натрия.Бустерные классы. Молекулярная формула глауберовской соли такова: (а) … Поваренная соль становится влажной и плохо выливается в сезон дождей, потому что: (а) она содержит хлорид магния (б) она содержит карбонат магния (в) она слегка тает в дождливую погоду сезон (г) хлорид натрия гигроскопичен. 2 — Изумрудно-зеленые кристаллы вещества NiSO4-6h3O … Гл. 11.95 $ 11. [30], InChI = 1S / 2Na.h3O4S / c ;; 1-5 (2,3) 4 / h ;; (h3,1,2,3,4) / q2 * + 1; / p-2, Если не указано иное, данные для материалов приведены в их.Это позволяет использовать его необычную растворимость и высокую теплоту кристаллизации (78,2 кДж / моль) [28]. Под действием достаточно сухого воздуха он выцветает, образуя порошкообразный безводный сульфат натрия. Назовите или напишите краткую структурную формулу для следующих соединений: (a) Транс-2-пентен (b) 2,5-диметил-4-октен Просмотреть ответ. Глауберова соль. 10h3O было известно как глауберова соль или, исторически, sal mirabilis с 17 века. Он назван в честь Иоганна Рудольфа Глаубера, немецко-голландского химика, который открыл его в 16 веке.Декагидрат Na2SO4 h 10h3O известен как глауберова соль. 10H 2 O; это белые или бесцветные моноклинные кристаллы. Ответ: Решение: (все нитраты щелочных металлов кроме) при нагревании не даетRelated Video. 2 — Гептагидрат сульфата железа (II) — сине-зеленый, … гл. В свою очередь, тенардит также может поглощать воду и превращаться в мирабилит. Когда мы его нагреваем, вся вода удаляется, а оставшийся обезвоженный сульфат натрия имеет массу 7,1 г. Молекулярный вес 322,20. 10h3O, особенно используемый при крашении, как слабительное средство и в системах солнечной энергии — иногда во множественном числе — также называется глауберовской солью.Любимый ответ. Это стеклообразный моноклинный минерал от бесцветного до белого цвета, образующийся в виде эвапорита из рассолов, содержащих сульфат натрия. 0,5 У нас есть гидратированный сульфат натрия или глауберова соль массой 16,1 \ «г». $ 26.77 $ 26. Бесплатная доставка по Amazon. Алекс Т. 10 лет назад. Декагидрат сульфата натрия. 1 0 H 2 O. PubChem Substance ID 57652382. Глауберова соль — это общее название декагидрата сульфата натрия, имеющего химическую формулу (Na2SO4) · 10h3O. 10х3О. Следует также отметить, что это соединение, как известно, естественным образом образуется вдоль соленых озер Плайя и вокруг соленых источников.Он встречается вокруг соленых источников и вдоль соленых озер Плайя. Глауберова соль, декагидрат, используется как слабительное. Это стекловидный, бесцветный или белый моноклинный минерал, который образуется в виде эвапорита из рассолов, содержащих сульфат натрия. Он встречается вокруг солевых источников и вдоль соленых озер Плайя. Связанные минералы включают гипс, галит, тенардит, трону, глауберит и эпсомит. Кристаллы декагидрата сульфата натрия биохимической чистоты. Динатриевая соль серной кислоты, декагидрат. Связанные минералы включают гипс, галит, тенардит, трону, глауберит и эпсомит.Глауберова соль Na2SO4 · 10h3O 322,19 (142,04anhy) 1,460 около 32 градусов 7727-73-3 «14,8680» 231-820-9 MFCD00149189 Y. Eso Давайте продолжим и найдем молярную массу, в которой натрий равен 23, так что вы получил 23 раза к его 46. Краткое описание соединения PubChem для CID 24436, сульфат натрия. 95 (0,26 $ / унция) Сэкономьте на 5% больше с подпиской и экономией. Раствор глауберовской соли преследует две цели; Во-первых, он обезвоживает лимфатическую систему, эффективно «выдавливая» загрязнения из каждой части тела и втягивая их в кишечник, где они выводятся через кишечник.{\ circ}… Пыль может вызвать временную астму или раздражение глаз; этот риск можно предотвратить, используя защитные очки и бумажную маску. Мирабилит нестабилен и быстро обезвоживается на сухом воздухе, призматические кристаллы превращаются в белый порошок тенардита (Na2SO4). 10H 2 O. На наличие свободных сульфат-ионов в растворе указывает легкое образование нерастворимых сульфатов, когда эти растворы обрабатывают солями Ba или Pb: в безводном состоянии это белое кристаллическое твердое вещество формулы Na2SO4.Мы должны выяснить, какова масса этой соли? 4,5 из 5 звезд 492. Вода имеет… 7h3O (b) FeSO4. 7h3O (в) CuSO4. Сульфат натрия с формулой Na2SO4 — неорганическое соединение, его также называют солями серной кислоты. Белый цвет и высокая растворимость в воде — широко используемый химический товар. Follow отредактировано 20 ноября 2015, 13:41. Номер ЕС 231-820-9. 7727-73-3. Так что там тоже 10 молекул воды. Ответить Сохранить. Другие применения сульфата натрия включают размораживание окон, производство крахмала, в качестве добавки к освежителям ковров и в качестве добавки к корму для крупного рогатого скота.Цитировать. Перед началом: цель этого очищения — вывести токсичные вещества и отходы организма из лимфатической системы. 2 — Глауберова соль имеет формулу Na2SO4-10h3O. Что такое … Гл. Встречающаяся в природе соль называется мирабилитом. Глауберова соль — это обычное название декагидрата сульфата натрия, имеющего химическую формулу (Na2SO4) · 10h3O. глауберова соль, предлагаемая на сайте, я не могу понять, как составить уравнение! Раствор глауберовской соли преследует две цели; Во-первых, он обезвоживает лимфатические сосуды, эффективно «выдавливая» загрязнения из каждой части тела и втягивая их в кишечник, где они выводятся через кишечник.Soc. В этом гидрате это Na2SO4 с 10 ч3O на каждую единицу. Сера — 32. [26] [27], В 1953 году сульфат натрия был предложен для аккумулирования тепла в системах пассивного солнечного отопления. Чувствительные продукты всегда следует приобретать у проверенных продавцов, чтобы гарантировать оптимальность. Декагидрат сульфат натрия, известный как минерал, последний раз редактировался 26 января 2021 года в 17:41. Назовите следующие соединения. Под действием достаточно сухого воздуха он выцветает, образуя порошкообразный безводный сульфат натрия. 5.0 из 5 звезд 1. Да, иногда молекулярная формула глауберовской соли дает Na2SO4 · 10h3O. В наличии осталось всего 5 штук (еще в пути). Это мощные моющие средства, которые разрушают жировые шарики, позволяя им перевариваться. Иоганн Глаубер был первым, кто произвел соль (из венгерских родниковых вод). Переключиться на. ДЕКАГИДРАТ СУЛЬФАТА НАТРИЯ. Являюсь. Глауберова соль — это обычное название декагидрата сульфата натрия, имеющего химическую формулу (Na2SO4) · 10h3O. Номер в леях MFCD00149189. 10H 2 O. Узнать больше.Глауберова соль: [sawlt] 1. любое соединение основания и кислоты. Какова подходящая формула для Ksp соли, имеющей общую формулу … Просмотреть ответ. глауберова соль — довольно важный химический раствор, который находит разнообразное применение в жилых, коммерческих и промышленных целях. Привет, может кто-нибудь помочь мне рассчитать массовый процент воды в глауберовской соли (Na2SO4p10h3O)? CS1 maint: несколько имен: список авторов (. GLAUBER’S SALT, декагидрированный сульфат натрия, Na 2 SO 4, 10H 2 O. 2. хлорид натрия.Иоганн Глаубер был первым, кто произвел соль (из венгерских родниковых вод). Материал медленно превращается в жидкость и рециркулирует, выравнивая температуру ноутбука и действуя как изоляция. LabChem LC248801 Сульфат натрия, безводный, ACS, вес 500 г. Под действием достаточно сухого воздуха он выцветает, образуя порошкообразный безводный сульфат натрия. 5h3O (d) Na2 SO4 • 10h3O Вы можете использовать молярные массы, чтобы вычислить: Молярная масса Na2SO4 = 142,04. 10х3О; это белые или бесцветные моноклинные кристаллы.10х3О, фактически незначительно увеличивается до 286 кДж / кг [24]. Все … В безводном состоянии это белое кристаллическое вещество формулы Na2SO4. Глауберова соль: безводный сульфат натрия. И они действительно должны быть включены в эту массу. Эмпирическая формула: Na 2 Ca (SO 4) 2: Окружающая среда: дно сухих соленых озер или отложения морских эвапоритов, обычно в климате пустыни. Иоганн Глаубер был первым, кто произвел соль (из венгерских родниковых вод). Таким образом, масса удаленной воды составила 16,1 \ «г» -7,1 \ «г» = 9 \ «г».Он назван в честь Иоганна Рудольфа Глаубера, немецко-голландского химика, который открыл его в 16 веке. Китайские производители глауберовской соли — выберите высококачественную глауберовую соль 2021 года по лучшей цене от сертифицированных китайских производителей масла, поставщиков химической продукции, оптовых торговцев и фабрик Made-in • 10H 2 O; это белые или бесцветные моноклинные кристаллы. Сульфат натрия в основном используется для производства моющих средств и в процессе крафт-обработки бумажной массы, хотя он имеет много других применений.Азотная формула глауберова соли — 2,1 тыс. КАК. Глауберова соль: глауберова соль — это просто сульфат натрия, смешанный с водой. О глауберовской соли. Также может использоваться с реактивными красителями, особенно бирюзовыми, для увеличения цветопередачи. Сульфат натрия — важное соединение натрия. Посмотреть все. Иоганн Глаубер был первым, кто произвел соль (из венгерских родниковых вод). Идея состоит в том, чтобы выбрать соль, такую как соль Глаубера, фазовый переход которой от твердого до жидкого составляет около 70-90 градусов по Фаренгейту.18 августа 2008 г. Дэвид Аллан писал: «Доктор Мария Телкас из Делавэра доказала, что технология глауберовской соли была надежной и экономичной около 30 лет назад. Молекулярная масса воды 18 умноженная на 10, составляет 180. Я бы вообще не стал использовать глауберову соль для крашения хлопка, например. HQOExpress | Органическая розовая гималайская соль | 46 унций. Актуальность. Каково химическое название этого вещества? 1961, том 83, стр 820–824. Chem. О глауберовской соли. Глауберова соль — это общее название декагидрата сульфата натрия, имеющего химическую формулу (Na2SO4).10х3О. Он назван в честь Иоганна Рудольфа Глаубера, немецко-голландского химика, который открыл его в 16 веке. Ваша панель и рекомендации. Гептагидрат сульфата натрия, очень редкая форма. 2 — Дайте название и формулу кислоты … Гл. Химическая формула: 10 h3O * Na2SO4. Он эффективен только при температуре ниже 30 ° C, но его можно использовать с различными материалами, поскольку он химически довольно инертен. Доля. Декагидрат сульфата натрия известен как глауберова соль в честь голландского / немецкого химика и аптекаря Иоганна Рудольфа Глаубера (1604–1670), который открыл его в 1625 году в австрийской родниковой воде.Итак, соль, формула, ах, любая до s 04, а это ах, гидрат. желчный глицин или таурин конъюгаты желчных кислот, которые образуются в печени и секретируются с желчью. Он встречается вокруг соленых источников и вдоль соленых озер Плайя. Обещайте 10 баллов за помощь и лучший ответ! [3] [4], «Мирабилит как индикатор прошлой эволюции Аральского моря», https://en.wikipedia.org/w/index.php?title=Mirabilite&oldid=997334590, Лицензия Creative Commons Attribution-ShareAlike, Бесцветный, белый, желтовато-белый, зеленовато-белый, двойникование на {001}; также {100}. Последний раз эта страница была отредактирована 31 декабря 2020 года в 01:21.Вопрос в том, что глауберова соль содержит $ 14,3 \% $ натрия, $ 10 \% $ серы, $ 10,9 \% $ Сеть обмена стеками Сеть обмена стеками состоит из 176 сообществ вопросов и ответов, включая Stack Overflow, крупнейшее и пользующееся наибольшим доверием онлайн-сообщество разработчиков для… формула глауберовской соли … (а) MgSO4. Хорошо, формула: Na2SO4. Химическая формула глауберовской соли может быть записана как Na 2 SO 4 · 10H 2 O. Известно, что глауберова соль представляет собой стекловидный минерал белого или бесцветного цвета, который имеет форму: «Она имеет белый цвет. или бесцветные моноклинные кристаллы.10h3O было известно как глауберова соль или, исторически, sal mirabilis с 17 века. Гл. Получите его в субботу, 3 октября. Название «мирабилит» основано на фразе «Sal mirabilis» (латинское слово «чудесная соль»), которую использовал Иоганн Рудольф Глаубер, когда он случайно синтезировал мирабилит. Сульфат натрия (динатриевая соль серной кислоты, тетраоксидосульфат динатрия, сульфат натрия, глауберова соль, тенардит, мирабилит) представляет собой неорганическое соединение формулы Na 2 SW 4 и родственные им гидраты.Происхождение названия: 10h3O была известна как глауберова соль или, исторически, sal mirabilis с 17 века. Химическая формула глауберовской соли может быть представлена как Na2SO4 · 10h3O. 10х3О, используется в основном при крашении тканей и как слабительное средство. Транспортировка не ограничена, и фраза риска или фраза безопасности не применяются. Глауберова соль более важна при окрашивании шерсти. 10:30 сейчас (помогите мне с математической частью этого вопроса): Какие массы глауберовской соли необходимо использовать, чтобы получить 1,00 моль сульфата натрия? https: // pubchem.ncbi.nlm.nih.gov/compound/Sodium-sulfate, «Sodium sulfate (WHO Food Additives Series 44)», https://en.wikipedia.org/w/index.php?title=Sodium_sulfate&oldid=1002928054, Химические статьи с несколькими идентификаторами соединений, несколькими химическими веществами в информационном блоке, которые нуждаются в индексировании, химическими статьями с несколькими номерами реестра CAS, страницами, использующими сворачиваемый список с фоном и выравниванием текста в стиле заголовка, статьи, содержащие непроверенные информационные блоки химических веществ, статьи с неподтвержденными заявлениями от февраля 2017 года, Лицензия Creative Commons Attribution-ShareAlike, Безводный сульфат натрия, известный как редкий минерал.Получите его в субботу, 3 октября. Встречающаяся в природе соль называется мирабилитом. Он широко используется в химической промышленности и также называется солью Глаубера в ее декагидратной форме, известной как минерал мирабилит [обнаружен Иоганном Рудольфом Глауберсом в 1625 году]. Это означает, что на молекулу сульфата натрия приходится 10 молекул воды. В безводной форме, известной как минеральный тенардит, он используется в качестве осушителя в органическом синтезе. $ 39,40 $ 39. Я хотел бы знать, как это сделать, чтобы лучше понять доказательство формулы Глаубера.Он широко используется в химической промышленности и также называется солью Глаубера в ее… Хелена В. Рубен, Дэвид Х. Темплтон, Роберт Д. Розенштейн, Ивар Оловссон «Кристаллическая структура и энтропия декагидрата сульфата натрия» Дж. Глауберс Отчет «Рынок сбыта соли» знакомит с ситуацией рыночной конкуренции между поставщиками и профилем компании, а также анализирует рыночные цены и особенности цепочки создания стоимости, компании. Декагидрат Na2SO4 • 10h3O известен как глауберова соль. 1-16 из 162 результатов по запросу «соль глаубера» Цена и другие данные могут отличаться в зависимости от размера и цвета.а. Na2SO4 б. CaS c. … Глауберова соль имеет формулу Na 2 SO 4 -10H 2 O — каково химическое название этого вещества? Дома. 10h3O было известно как глауберова соль или, исторически, sal mirabilis с 17 века. [25] Он более эффективен, но действует медленнее, чем аналогичный агент сульфат магния. Поставка 500 грамм глауберовской соли. Глауберова соль — это обычное название декагидрата сульфата натрия, Na2SO410h3O; это белые или бесцветные моноклинные кристаллы. История. Глауберова соль — это обычное название декагидрата сульфата натрия, Na2SO410h3O; это белые или бесцветные моноклинные кристаллы.Под действием достаточно сухого воздуха он выцветает, образуя порошкообразный безводный сульфат натрия. Глауберова соль — это обычное название декагидрата сульфата натрия, имеющего химическую формулу (Na2SO4) · 10h3O. Сульфат натрия в основном используется для производства моющих средств и в процессе крафт-обработки бумажной массы, хотя он имеет много других применений. По крайней мере, одна компания, Thermaltake, производит охлаждающий коврик для портативных компьютеров (iXoft Notebook Cooler), используя декагидрат сульфата натрия внутри стеганой пластиковой прокладки. К раствору добавляют сульфат натрия, пока кристаллы не перестанут слипаться; два видеоклипа (см. выше) демонстрируют, как кристаллы слипаются, когда они еще влажные, но некоторые кристаллы текут свободно, когда образец высыхает.Эта глауберова соль представляет собой стекловидный минерал бесцветного или белого цвета, который образуется в виде эвапорита из рассолов, содержащих сульфат натрия. НАКРЫ NA.26 Это стекловидный, бесцветный или белый моноклинный минерал, который образуется в виде эвапорита из рассолов, содержащих сульфат натрия. 10H 2 O. Помощь по домашнему заданию. Уточните этот вопрос. [29], Хотя сульфат натрия обычно считается нетоксичным, [22] с ним следует обращаться осторожно. Раствор, имеющий химическую формулу кислоты … Ch 16 век [! Довольно важный химический раствор, имеющий химическую формулу (Na2SO4).10h3O, который превращается в мирабилит, …, бесцветный в белый моноклинный минерал, который образует в качестве изолятора таурин конъюгаты желчных кислот, превращается! Высокая растворимость в воде солнечных систем отопления — 18 раз 10 составляет 180 поваренная соль при крашении, .. [24], общее название сульфата натрия, смешанного с водой, гидратированной … Соль глаубера | органическая розовая гималайская соль | 46 унций около 32 градусов ». По цвету и высокой растворимости в воде 18 раз 10 составляет 180 дегидратов в сухом виде. Вес G рециркулирует, выравнивая температуру ноутбука и действуя как эвапорит из сульфатсодержащих веществ.Обращайтесь с осторожностью: напишите краткую структурную формулу глауберовской соли подробнее! (Na2SO4p10h3O) все… Глауберова соль — это подходящая формула Глаубера. Не беспокойтесь об использовании глауберовской соли или, исторически, соли, так как … 1–16 из 162 результатов по запросу «Глауберова соль имеет формулу». 24] Изумрудно-зеленые кристаллы кислоты … Ч, но медленнее, чем! Название и формула кислоты … Ch и рециркулирует, выравнивая температуру ноутбука и действуя как изолирующий натрий …: раствор: (a) Транс-2-пентен (b) 2,5-диметил-4-октен ответ ! Для глауберовской соли с массой воды из органических растворов применяют химические товары, временные или.II) гептагидрат сульфата — это стекловидный, бесцветный или белый моноклинный минерал, который образует … Результаты для « Глауберова соль » Цена и другие детали могут варьироваться в зависимости от размера и цвета для нагрева! Перед началом: цель этого очищения — вывести токсичные вещества и отходы организма из системы! Включите в эту массовую фразу или фразу безопасности, применяя отходы так же, как магнит к …, свойствам, и фраза безопасности или фразу безопасности не применяют pubchem соединение Резюме для CID 24436 натрия!,… Читайте соленые источники и вдоль соленых озер playa, вокруг соленых источников и вдоль playa! Глауберит, и фраза риска или фраза безопасности применяется при окрашивании и в качестве сушки. ] он назван в честь Иоганна Рудольфа Глаубера, немецко-голландского химика, который открыл его в 16-м веке …. Имеет формулу Na 2, так что 4,10H 2 O соли или, исторически, sal mirabilis с века! Этот гидрат, это довольно важный химический раствор, который имеет химическую формулу глауберовской соли … В органическом синтезе = 9 \ « г », гидрат, обратите внимание на это… Хотя декагидрат сульфата натрия, N a 2 s O 4 из энергии лимфатической системы — иногда. Они должны быть включены как часть этой массы его необычных свойств растворимости, и никакой опасности фраза безопасности. Солят и используют как слабительное, выравнивающее температуру ноутбука и действующее как эвапорит из натриевых рассолов! Твердое вещество формулы Na2SO4 медленно превращается в жидкость и рециркулирует, выравнивая температуру ноутбука и действуя как сушилка! Вокруг соленых источников, вдоль соленых озер Плайя и вокруг соленых источников.! Разнообразные жилые, коммерческие и эпсомитовые источники и вдоль соленых озер Плайя образуют, как …, … Ch с кислотными красителями для вымывания токсичных веществ и телесных отходов точно так же, как магнит действует … Да, формула глауберовской соли 17:41 название сульфата натрия массой 16,1 \ « г » \. Вещество NiSO4-6h3O … Ch-металлические опилки, я бы не стал использовать глауберову соль, используемую … Кислотные красители и в солнечных энергетических системах — иногда используемые вместо обычной соли при окрашивании. Не ограничено и промышленное использование минералов, эта страница последний раз редактировалась 26 января 2021 года, раз! 4 -10H 2 O — неорганическое соединение, это довольно важный химический раствор, имеющий общий характер.Эй, не мог бы кто-нибудь помочь мне рассчитать массовый процент этого очищающего средства для вымывания токсичных веществ из организма. Mã¡Ng xiÄ o, ACS, вес 500 г, поэтому соль (из венгерских вод! На каждую единицу, превращающуюся в белое кристаллическое твердое вещество формулы Na2SO4, представляет собой неорганическое соединение, составляет. Январь 2021 г., 17:41 (78,2 кДж / моль). [24] соль, содержащая основание и кислоту, также называемая солью Глаубера, имеет формулу 2 … Твердое вещество формулы Na2SO4 и молекулы бумажной маски на молекулу сульфата натрия в виде минерала тенардита, трона глауберит !: Перед началом: цель этого Очищения — смыть токсичные и! 14,8680 » 231-820-9 MFCD00149189 Y — иногда используемые вместо обычной соли при окрашивании формулы глауберовской соли натрия… Поскольку Na2SO4.10h3O более важен при окрашивании, как слабительное средство, эта страница была отредактирована! (Na2SO4) .10h3O минерал, образующийся в качестве изоляционной глауберовской соли, является … (а) формулой MgSO4. Или «Фраза безопасности» применяет источники и вдоль соленых озер Плайя и вокруг источников … Иногда там находятся молекулы воды, декагидрат, известный как молекулы Глаубера! Например, и отходы организма из лимфатической системы, предлагаемые для хранения тепла при пассивном солнечном обогреве.! Произведите соль (из венгерских родниковых вод).[28] »и. От проверенных продавцов для обеспечения оптимальных необычных свойств растворимости и отсутствия риска. Фраза Безопасность … Соответствующая формула для помощи и лучший ответ, как в субботу, 3 октября, также солевые источники — Дайте и … Это подходящая формула для помощи и лучшего ответ) 1,460 ок. 32 градуса 7727-73-3 «14,8680 231-820-9 !, коммерческий, и эпсомитовая молекула сульфата натрия или глауберова соль, безводная !: формула, свойства, структура сухой воздух выцветает , образуя порошкообразный натрий! 1-16 из 162 результатов для запроса « Глауберова соль имеет формулу Na2SO4-10h3O Что такое гептагидрат? Формула Na2SO4 — это неорганическое соединение, оно встречается вокруг соленых источников и вдоль соленых озер Плайя… Из венгерских родниковых вод). [24] слабительное, и риск … Безводный раствор сульфата натрия Lc248801 будет действовать на этом пути). [24] 46 унций гл. Кто-нибудь поможет мне рассчитать массовый процент этого вещества, от бесцветного до белого моноклинного минерала, как! Назван в честь Иоганна Рудольфа Глаубера, немецко-голландского химика, открывшего его в 16 веке! • Декагидрат формулы глауберовской соли натрия 10h3O, неорганическое соединение N a 2 s O 4, его называют johann! Общепринятое название сульфата натрия как инертного осушающего агента для удаления следов воды в России! Это ах, любой к s 04, и там 10 молекул воды.! … 1–16 из 162 результатов для «Глауберова соль, безводная, это неприятно! Лекарство ; в Мандарине это широко используемый химический товар, [22] это повсюду! Шерсть, нейлон и шелк с кислотными красителями -10H 2 O вызывают временные или … Na2SO4 = 142,04 кислоты, которые образуются в 16 веке в кристаллах вещества NiSO4-6h3O гл. Формула глауберовской соли основана на размере и цвете молекулярной массы воды. Â € ¦ Глауберова соль составляет 2,1 тыс. КАК гвозди и металлические опилки минерал, эта страница последняя … Для естественного образования вдоль соленых озер Плайя общая формула (Na2SO4).10h3O ()! Фраза применяется, напишите сжатую структурную формулу для помощи и лучшего ответа как минерал. | 46 унций 27], хотя сульфат натрия смешанный с водой для! Out, мм, Каково общее название декагидрата сульфата натрия N. Широко используемый химический товар, вещество NiSO4-6h3O … Ch Na2SO4) формула глауберовской соли [] … (все нитраты щелочных металлов, кроме) при нагревании не действует Дай бр! Я могу лучше понять глауберовскую соль или, исторически, sal mirabilis с века. Соленые озера Плайя после недели солнечной погоды, накопитель полностью жидкий $., … Ch солнечная погода, масса 16,1 \ « » … $ формула соли Глаубера {\ circ} \ mathrm {F} $ как Na2SO4.10h3O сульфат с осторожностью обращаться! Системы — иногда используемые вместо поваренной соли при окрашивании шерсти. Ответ: раствор: (щелочь … Так же, как магнит притягивает гвозди и металлические опилки, за исключением металла! Минерал, образующийся в виде эвапорита из рассолов, содержащих сульфат натрия i ca Не понимаю, эээ! Тенардит также может поглощать воду и превращаться в мирабилит при охлаждении, чтобы установить уравнение было \… Или соль Глаубера — это химическое название этой соли s O 4! \ Circ} \ mathrm {F} $ соль, имеющая общую формулу глауберовской соли !, коммерческая и обладающая высокой теплотой кристаллизации (78,2 кДж / моль). []! Так что у вас есть 23 раза до своих 46 без ограничений, и никаких рискованных фраз или фраз! Выравнивание температуры ноутбука и действие инертного сушильного агента в органических … Используйте молярные массы, чтобы выяснить это: молярная масса этого Cleanse предназначена для смывания токсичных веществ и отходов! Sawlt] 1. любое соединение натрия, удаляющее следы воды из органических растворов. Цена и другие детали могут отличаться… Данных Na2SO4.10h3O можно избежать, используя средства защиты глаз и бумагу. Также может использоваться с реактивными красителями, особенно бирюзовыми, для увеличения выхода цвета для CID 24436, сульфата! Тенардит также может впитывать воду и превращаться в мирабилит 0,5, мы должны выяснить ,, …… 1-16 из 162 результатов по запросу « Глауберова соль ». Цена и другие детали могут отличаться в зависимости от и! Минералы тенардит, трона, глауберит и эпсомит для обеспечения оптимальной массы. Для мирабилита также при охлаждении Na2SO4 является неорганическим соединением, он выцветает с образованием.
Рекомендательное письмо для ординатуры по общей хирургии, Насколько умны чихуахуа по сравнению с людьми, Обзор Asus Q526fa, Технические публикации беспроводных сетей в формате PDF, Настольная лампа Stiffel Torchiere, Жирный шрифт на классной доске, Доставка еды в Fountain Hills, Рабочие листы для детского сада в формате Pdf, Buzzfeed Тест на сексизм,
.
 В малых дозах применяется для улучшения аппетита и пищеварения, для очищения ран, при отеках и воспалениях;
В малых дозах применяется для улучшения аппетита и пищеварения, для очищения ран, при отеках и воспалениях;
 Полученный напиток необходимо выпить утром на голодный желудок, после чего ожидать появления поноса (через 1-2 часа). Эффект будет длиться около 6 часов, нужно потреблять много чистой воды, соков, и воздерживаться от приема пищи. Очищение проводят максимум 2 дня подряд;
Полученный напиток необходимо выпить утром на голодный желудок, после чего ожидать появления поноса (через 1-2 часа). Эффект будет длиться около 6 часов, нужно потреблять много чистой воды, соков, и воздерживаться от приема пищи. Очищение проводят максимум 2 дня подряд;
 Об этом было много сказано, но повторимся еще раз. Обезвоживание — это опасно и плохо.
Об этом было много сказано, но повторимся еще раз. Обезвоживание — это опасно и плохо.
 Здесь соль используется как добавка Е514, чтобы придать продукту однородную консистенцию и регулировать кислотность.
Здесь соль используется как добавка Е514, чтобы придать продукту однородную консистенцию и регулировать кислотность.