Глауберова соль что это: Глауберова соль — это… Что такое Глауберова соль?
Глауберова соль — это… Что такое Глауберова соль?
Глауберова соль (Мирабилит) — Na2SO4 · 10H2O, десятиводный кристаллогидрат (декагидрат) сульфата натрия. Впервые обнаружена химиком И. Р. Глаубером в составе минеральных вод, а впоследствии синтезирована действием серной кислоты на хлорид натрия. Применяется в стекольном и содовом производстве, в медицине.
Другие названия: Sal glauberi, мирабилит, сибирская соль, гуджир, сернокислый натрий.
Физические свойства
Представляет собой большие прозрачные кристаллы в форме призм. Имеет горький солёный вкус и тает на языке. Не имеет запаха. Хорошо растворима в воде. Не горит, в огне не трещит. При длительном нахождении на воздухе или нагревании выветривается (выпаривается) и теряет массу. При полном выветривании становится обычным сульфатом натрия — порошком белого цвета. Кроме самой десятиводной глауберовой соли известны ромбические кристаллы семиводного кристаллогидрата Na2SO4 · 7H2O и одноводная соль Na
Нахождение в природе
Природный минерал глауберовой соли называется мирабилит. Его плотность составляет всего 1,49 г/см³, что делает его одним из самых лёгких минералов.
Залежи порядка 100 млн тонн мирабилита обнаружены близ провинции Саскачеван в центральной части Канады.
В Грузии в XIX веке мирабилит был обнаружен в 30 км от г. Тбилиси. Эти залежи представляли собой высохшее солёное озеро площадью около 55 тыс. м². Пласт мирабилита толщиной порядка 5 метров был сверху покрыт пластом песчаной глины толщиной от 30 см до 4,5 м.
В зимнее время, в период примерно с 20 ноября по 15 марта, когда температура воды Каспийского моря опускается до 5,5−6 °C, мирабилит выпадает в больших количествах из вод залива Кара-Богаз-Гол в Туркмении, оседая бесцветными кристаллами на дне и берегах залива. Также содержится в озере Кучук в Западной Сибири, в соляных озёрах Томской области.
В других месторождениях, например, в Калифорнии (США), Сицилии, Германии, в Большом Малиновском озере (Астраханская область), мирабилит встречается с примесями других минералов — астраханита Na2Mg(SO4)2 · 4H2O, левеита Na2Mg(SO4)2 · 2,5H2O, вантгоффита Na6Mg(SO4)4, глауберита Na2Ca(SO4)2, глазерита Na2K6(SO4)4.
В растворённом виде глауберова соль в значительном количестве присутствует в морской воде и во многих минеральных водах, например, курортов Карловы Вары. Мариенбад в Чехии. Карловарская соль, получаемая из минеральных вод Карловых Вар на 44 % состоит из сульфата натрия (глауберовой соли), на 36 % из гидрокарбоната натрия (пищевой соды), на 18 % из хлорида натрия (поваренной соли) и на 2 % из сульфата калия.
Также мирабилит встречается в виде налёта и корок на залежах гипса и каменной соли.
Очень редко в природе встречается безводный сульфат натрия — минерал тенардит, названный в честь французского химика Л. Ж. Тенара. Для его сохранения в безводном виде необходимы засушливые пустынные зоны. Поэтому такие залежи обнаружены в Чили, в Центральной Азии, в штате Аризона (США), а также в Испании в долине реки Эбро.
История открытия
Открытие глауберовой соли датировано зимой 1626 года и непосредственно связано с перенесённой в 1625 году Глаубером болезнью — сыпным тифом, в то время именуемого «венгерской лихорадкой». Вот как сам Глаубер описывал это:
Вот как сам Глаубер описывал это:
Несколько оправившись от болезни, я прибыл в Неаполис (латинизированное название Нейштадта, по-немецки — «нового города»; он расположен на реке Вид в 25 км юго-восточнее Бонна). Там у меня снова начались приступы, и я должен был остаться в этом городе. Болезнь настолько ослабила мой желудок, что он не мог ни принимать, ни переваривать никакую еду. Местные жители посоветовали мне пойти к источнику, находящемуся вблизи виноградника в часе ходьбы от города. Они сказали, что вода источника вернет мне аппетит. Следуя их совету, я взял с собой большой кусок хлеба; мне сказали, что должен буду весь его съесть, но я мало верил в то, что это мне как-то поможет. Придя к источнику, я намочил хлебный мякиш в воде и съел его — причем с большим удовольствием, хотя перед этим не мог смотреть без отвращения на самые изысканные лакомства. Взяв оставшуюся от хлеба корку, я зачерпнул ею воды из источника и выпил её. Это настолько возбудило мой аппетит, что в конце концов я съел и «чашку» из хлеба, которой черпал воду.
Домой я возвратился значительно окрепшим и поделился своими впечатлениями с соседями. Я чувствовал, что если буду и дальше лечиться этой водой, функции моего желудка полностью восстановятся. Я спросил, что это за вода. Мне сказали, что в ней содержится селитра, чему тогда, не будучи искушен в подобных вопросах, я поверил.
Глаубер заинтересовался химическим составом воды источника и посвятил этому изучению всю следующую зиму. Он подружился с местным аптекарем Айснером и использовал его лабораторию для опытов. В ходе исследований он выпаривал минеральную воду и анализировал осадки. Вместо селитры в осадке оказалась ранее неизвестная соль, которую он назвал «чудесной» — по латыни «sal mirabile». В частности, название природного минерала мирабилита происходит именно из латинского названия.
Спустя много лет, в 1648 году, Глаубер проводил опыты с кислотами, а точнее получал соляную кислоту путем нагревания обычной каменной соли с серной кислотой. При слабом нагревании шла реакция образования гидросульфата натрия: NaCl + H 2SO4 = NaHSO4 + HCl, а при сильном — сульфата натрия: 2NaCl + H2SO4 = Na2SO4 + 2HCl. Каково же было удивление Глаубера, когда он обнаружил, что большие прозрачные кристаллы, выпавшие в осадок, оказались той самой «чудесной солью», с которой он познакомился в молодости. В результате одной реакцией Глаубер открыл и способ получения соляной кислоты, и синтеза сульфата натрия.
Каково же было удивление Глаубера, когда он обнаружил, что большие прозрачные кристаллы, выпавшие в осадок, оказались той самой «чудесной солью», с которой он познакомился в молодости. В результате одной реакцией Глаубер открыл и способ получения соляной кислоты, и синтеза сульфата натрия.
Химические свойства и применение
Литература
- Химический словарь школьника / Б. Н. Кочергин, Л. Я. Горностаева, В. М. Макаревский, О. С. Аранская. — Мн.: Народная асвета, 1990. — 255 с. — 75 000 экз. — ISBN 5-341-00127-3
Ссылки
Информация об идее — Инновационный портал Ростовской Области
Название идеи: Высокоэффективный аккумулятор теплоты
Краткое описание: В индивидуальных тепловых пунктах в подавляющем большинстве случаев используются устройства накопления тепла. В системе отопления это делается чтобы котел работал в номинальном наиболее экономичном режиме: котел при номинальной мощности нагревает накопитель (буферную емкость) из которой разбирается тепло системой в том количестве в котором оно требуется, а котел периодически включается для подогрева емкости.
 Люди, отапливающиеся электричеством, накапливают тепловую энергию в аккумулирующих емкостях ночью, когда она дешевле, и используют днем для отопления, однако существующие водяные аккумуляторы теплоты не способны накопить столько, чтобы полностью покрыть дневное потребление на отопление из-за своей громоздкости. Наша разработка позволит при том же объеме аккумулятора теплоты накапливать в 4,5 раза больше тепловой энергии, что позволит больше экономить на отоплении электричеством используя дешевый ночной тариф. Последнее время стала широко развиваться возобновляемая энергетика, в том числе гелиосистемы, использующие солнечную энергию для нагрева воды и использования ее в дальнейшем для отопления и горячего водоснабжения. Наш высокоэффективный аккумулятор теплоты позволит накапливать в светлое время энергию солнца в составе гелиоустановки и выдавать ее в систему отопления и горячего водоснабжения, когда необходимо и в том числе и ночью. На сегодняшний день известны аккумуляторы тепла, работающие на эффекте теплоемкости разных веществ: щебень, камни, вода и др.
Люди, отапливающиеся электричеством, накапливают тепловую энергию в аккумулирующих емкостях ночью, когда она дешевле, и используют днем для отопления, однако существующие водяные аккумуляторы теплоты не способны накопить столько, чтобы полностью покрыть дневное потребление на отопление из-за своей громоздкости. Наша разработка позволит при том же объеме аккумулятора теплоты накапливать в 4,5 раза больше тепловой энергии, что позволит больше экономить на отоплении электричеством используя дешевый ночной тариф. Последнее время стала широко развиваться возобновляемая энергетика, в том числе гелиосистемы, использующие солнечную энергию для нагрева воды и использования ее в дальнейшем для отопления и горячего водоснабжения. Наш высокоэффективный аккумулятор теплоты позволит накапливать в светлое время энергию солнца в составе гелиоустановки и выдавать ее в систему отопления и горячего водоснабжения, когда необходимо и в том числе и ночью. На сегодняшний день известны аккумуляторы тепла, работающие на эффекте теплоемкости разных веществ: щебень, камни, вода и др.

 Впервые предлагается конструкция аккумулятора теплоты работающего на эффекте фазового перехода, где высокотемпературная зона предназначенная для подогрева горячего водоснабжения отделена от низкотемпературной зоны, предназначенной для отопления, что позволяет для низкотемпературной зоны использовать дешевую и энергоемкую глауберову соль, а только часть энергии нужной для горячего водоснабжения хранить в менее энергетически эффективном, но в более высокотемпературном веществе. Впервые предлагается разработать высокоэффективный компактный аккумулятор теплоты, габариты которого, как минимум в 4,5 раза, меньше наиболее распространенного на рынке водяного аккумулятора теплоты. СТАДИЯ РАЗРАБОТКИ: В рамках программы СТАРТ был проведен НИР, получена конструкторская документация и собран опытный образец аккумулятора. Состояние проекта на данный момент (что уже сделано по проекту) : Был выполнен и сдан 1-й этап по программе СТАРТ по теме «Разработка и изготовление опытного образца компактного аккумулятора теплоты» Отчет 1 этапа о НИОКР по теме «Разработка и изготовление опытного образца компактного аккумулятора теплоты» в рамках договора № 608ГС1/15774 (код 0015774) от 04 августа 2015 г.
Впервые предлагается конструкция аккумулятора теплоты работающего на эффекте фазового перехода, где высокотемпературная зона предназначенная для подогрева горячего водоснабжения отделена от низкотемпературной зоны, предназначенной для отопления, что позволяет для низкотемпературной зоны использовать дешевую и энергоемкую глауберову соль, а только часть энергии нужной для горячего водоснабжения хранить в менее энергетически эффективном, но в более высокотемпературном веществе. Впервые предлагается разработать высокоэффективный компактный аккумулятор теплоты, габариты которого, как минимум в 4,5 раза, меньше наиболее распространенного на рынке водяного аккумулятора теплоты. СТАДИЯ РАЗРАБОТКИ: В рамках программы СТАРТ был проведен НИР, получена конструкторская документация и собран опытный образец аккумулятора. Состояние проекта на данный момент (что уже сделано по проекту) : Был выполнен и сдан 1-й этап по программе СТАРТ по теме «Разработка и изготовление опытного образца компактного аккумулятора теплоты» Отчет 1 этапа о НИОКР по теме «Разработка и изготовление опытного образца компактного аккумулятора теплоты» в рамках договора № 608ГС1/15774 (код 0015774) от 04 августа 2015 г. , заявка № 2014-1-02395, конкурс Старт-15-1 включает: -предварительные расчеты оптимальной тепловой мощности аккумулятора теплоты для различных потребителей; -математическая модель работы высокоэффективного аккумулятора теплоты; -эскизный проект высокоэффективного аккумулятора теплоты. В рамках эскизного проектирования высокоэффективного аккумулятора теплоты было выполнено: — сформулированы исходные данные для проектирования; — разработана принципиальная тепловая схема аккумулятора тепла; — описаны физические процессы, происходящие в аккумуляторе тепла; — определены объемы накопленной энергии; — определены массы и объемы теплоаккумулирующих веществ; — определены габариты аккумулятора тепла; — рассчитана площадь теплообмена зон аккумулятора тепла; — приведены результаты расчета аккумулятора тепла; — выполнены чертежи высокоэффективного аккумулятора тепла: схема энергетическая принципиальная и габаритный чертеж. По заявленной тематике был выигран конкурс на право получения стипендии Президента Российской Федерации молодым ученым и аспирантам, осуществляющим перспективные научные исследования и разработки по приоритетным направлениям российской экономики на 2015-2017 годы № СП-2340.
, заявка № 2014-1-02395, конкурс Старт-15-1 включает: -предварительные расчеты оптимальной тепловой мощности аккумулятора теплоты для различных потребителей; -математическая модель работы высокоэффективного аккумулятора теплоты; -эскизный проект высокоэффективного аккумулятора теплоты. В рамках эскизного проектирования высокоэффективного аккумулятора теплоты было выполнено: — сформулированы исходные данные для проектирования; — разработана принципиальная тепловая схема аккумулятора тепла; — описаны физические процессы, происходящие в аккумуляторе тепла; — определены объемы накопленной энергии; — определены массы и объемы теплоаккумулирующих веществ; — определены габариты аккумулятора тепла; — рассчитана площадь теплообмена зон аккумулятора тепла; — приведены результаты расчета аккумулятора тепла; — выполнены чертежи высокоэффективного аккумулятора тепла: схема энергетическая принципиальная и габаритный чертеж. По заявленной тематике был выигран конкурс на право получения стипендии Президента Российской Федерации молодым ученым и аспирантам, осуществляющим перспективные научные исследования и разработки по приоритетным направлениям российской экономики на 2015-2017 годы № СП-2340. 2015.1. В рамках выполнения исследований по стипендии был сдан первый этап отчетности: Отчет 1 этапа о НИР «Использование разности среднесезонных температур для автономного теплоснабжения, электроснабжения и кондиционирования». В рамках данного этапа рассматривались вопросы о высокоэффективном аккумулировании тепла, в частности было получено: — был проведен анализ тепловых потенциалов теплового времени года различных регионов Российской федерации; — проанализированы способы улавливания теплового потенциала; — оценена возможность и разработаны способы аккумулирования теплового потенциала в виде теплоты фазового перехода различных солей, углеводородов и других веществ; — оценена возможность и разработаны способы аккумулирования теплового потенциала в виде химических связей; — выбраны наиболее оптимальные теплоаккумулирующие вещества, проведен расчет необходимого их количества для обеспечения потребностей индивидуального жилого дома; — разработана эскизная конструкторская документация на прототип высокоэффективного аккумулятора тепла; — разработана программа и методика проведения испытаний высокоэффективного аккумулятора тепла; — изготовлен прототип высокоэффективного аккумулятора тепла; — проведены испытания высокоэффективного аккумулятора тепла.
2015.1. В рамках выполнения исследований по стипендии был сдан первый этап отчетности: Отчет 1 этапа о НИР «Использование разности среднесезонных температур для автономного теплоснабжения, электроснабжения и кондиционирования». В рамках данного этапа рассматривались вопросы о высокоэффективном аккумулировании тепла, в частности было получено: — был проведен анализ тепловых потенциалов теплового времени года различных регионов Российской федерации; — проанализированы способы улавливания теплового потенциала; — оценена возможность и разработаны способы аккумулирования теплового потенциала в виде теплоты фазового перехода различных солей, углеводородов и других веществ; — оценена возможность и разработаны способы аккумулирования теплового потенциала в виде химических связей; — выбраны наиболее оптимальные теплоаккумулирующие вещества, проведен расчет необходимого их количества для обеспечения потребностей индивидуального жилого дома; — разработана эскизная конструкторская документация на прототип высокоэффективного аккумулятора тепла; — разработана программа и методика проведения испытаний высокоэффективного аккумулятора тепла; — изготовлен прототип высокоэффективного аккумулятора тепла; — проведены испытания высокоэффективного аккумулятора тепла. Описание продукта, который будет продаваться на рынке:
В первый год проекта получен экспериментальный образец высокоэффективного аккумулятора теплоты, с тепловой емкостью 26 кВт*ч, с температурой подачи на горячее водоснабжение 55 С, с температурой на отопление 30 С, объемом рабочего тела 112 л (аналог бойлера 500 л, температурой нагрева с 10 С до 55 С). Планируется производство аккумуляторов теплоты, тепловой емкостью соответствующим водяным аналогам на 100 л., 300 л., 500 л., 1000 л. Данные аккумуляторы будут иметь объем 23л., 67 л., 112 л., 223 л. соответственно. Контакты разработчика:
Папин Владимир Владимирович
8-904-441-06-48
[email protected]
Описание продукта, который будет продаваться на рынке:
В первый год проекта получен экспериментальный образец высокоэффективного аккумулятора теплоты, с тепловой емкостью 26 кВт*ч, с температурой подачи на горячее водоснабжение 55 С, с температурой на отопление 30 С, объемом рабочего тела 112 л (аналог бойлера 500 л, температурой нагрева с 10 С до 55 С). Планируется производство аккумуляторов теплоты, тепловой емкостью соответствующим водяным аналогам на 100 л., 300 л., 500 л., 1000 л. Данные аккумуляторы будут иметь объем 23л., 67 л., 112 л., 223 л. соответственно. Контакты разработчика:
Папин Владимир Владимирович
8-904-441-06-48
[email protected]Отрасль: Строительство
Возможности реализации идеи: Поэтапная реализация
Риски для внедрения: Средние риски
Тематика: Строительство
Получение глауберовой соли и сульфата натрия из природного сырья
DOI: 10. 32743/UniTech.2021.83.2-3.19-22
32743/UniTech.2021.83.2-3.19-22
АННОТАЦИЯ
Получение товарного сульфата натрия из основных сырьевых источников мирабилита. Для исследований применяли измельченный до размера 5-6 мм природный мирабилит Тумрюкского месторождения.
Была изучена растворимость в системе Na2SO4 – H2O. Для насыщенных водных растворов стабильной фазой при температуре от -1,2 до +32,4 °С является Na2SO4·10H2O, а выше 32,4 °С – Na2SO4. При +32,4 °С Na2SO4·10H2O инконгруэнтно плавится, образуя безводный сульфат натрия и его насыщенный раствор. Насыщенный раствор сульфата натрия при атмосферном давлении кипит при температуре 102,9 °С. Определена продолжительность охлаждения до 20 °С и изменение концентрации сульфата натрия при охлаждении получен
ABSTRACT
Obtaining commercial sodium sulfate from the main raw material sources of mirabilite. Natural mirabilite of the Tumryuk deposit, crushed to a size of 5-6 mm, was used for research.
Natural mirabilite of the Tumryuk deposit, crushed to a size of 5-6 mm, was used for research.
The solubility in the Na2SO4 — h3O system was studied. For saturated aqueous solutions, the stable phase at temperatures from -1.2 to +32.4 °С is Na2SO4 · 10h3O, and above 32.4 °С — Na2SO4. At +32.4 °C, Na2SO4 · 10h3O melts incongruently, forming anhydrous sodium sulfate and its saturated solution. A saturated sodium sulfate solution at atmospheric pressure boils at a temperature of 102.9 °C. The duration of cooling to 20 °C and the change in the concentration of sodium sulfate during cooling of the resulting solution were determined.ного раствора.
Ключевые слова: мирабилит, солей галита, эпсомита, гипса, выщелачивание, насыщенный раствор, инконгруэнтно, глауберовой соль.
Keywords: mirabilite, halite, epsomite, gypsum, leaching, saturated solution, incongruent, Glauber’s salt.
Химическая промышленность является базовой отраслью, которая находится в тесной взаимосвязи со всеми отраслями экономики, играет ключевую роль в агрохимическом комплексе. Производство отрасли основано на высоких технологиях и выпускаемая продукция по номеклатуре соответствует мировым стандартам, поэтому развитие химической промышленности является приоритетной задачей современного развития экономики Республики Узбекистан [1].
Производство отрасли основано на высоких технологиях и выпускаемая продукция по номеклатуре соответствует мировым стандартам, поэтому развитие химической промышленности является приоритетной задачей современного развития экономики Республики Узбекистан [1].
В настоящее время перед наукой Узбекистана стоит целый ряд стратегических задач. Это разработка высоких технологий, в том числе био- и нанотехнологий для развития отечественного производства, развитие ядерной энергетики, создание недорогостоящих мини — технологий, ориентированных на местное сырье и выпуск качественной продукции для субъектов малого и среднего бизнеса, разработка единой концепции использования водных ресурсов, улучшение экологической обстановки, прогнозирование и долгосрочное планирование фундаментальных научных исследований во всех областях науки, упрочение взаимосвязи образования, науки и производства.
Узбекистан располагает большими запасами сульфата натрия (мирабилита, тенардита, астраханита), обнаруженными в соляных отложениях Приаралья: месторождения Аккалы, Кушканатау и Тумрюк в Республике Каракалпакстан. Тумрюкское месторождение мирабилита является одним из основных сырьевых источников сульфата натрия, характеризующимся минимальным содержанием примесных солей галита, эпсомита и гипса. Каждое месторождение сырьевых материалов является по своему уникальным и требует отдельных исследований для получение продукта.
Тумрюкское месторождение мирабилита является одним из основных сырьевых источников сульфата натрия, характеризующимся минимальным содержанием примесных солей галита, эпсомита и гипса. Каждое месторождение сырьевых материалов является по своему уникальным и требует отдельных исследований для получение продукта.
Получение товарного сульфата натрия из мирабилита Тумрюкского месторождения целесообразно проводить по схеме, предусматривающей растворение соли, удаление нерастворимого остатка, кристаллизацию декагидрата сульфата натрия из осветленного раствора и выделение продукта из раствора, получаемого при плавлении декагидрата сульфата натрия, выпариванием. При этом важным является установление кинетических параметров выщелачивания природной соли.
С этой целью предварительно была изучена растворимость в системе Na2SO4 – H2O. Полученные данные показали, что для насыщенных водных растворов стабильной фазой при температуре от -1,2 до +32,4 °С является Na2SO4·10H2O, а выше 32,4 °С – Na2SO4. При +32,4 °С Na2SO4·10H2O инконгруэнтно плавится, образуя безводный сульфат натрия и его насыщенный раствор. При -1,2 °С и 4,0 %-ной концентрации Na2SO4 в равновесии с жидкой фазой находится лед с Na2SO4·10H2O. В пределах температур от -1,2 до +32,4 °С и 4,0 %-ной концентрации раствора Na2SO4 равновесной твердой фазой системы Na2SO4 – H2O является Na2SO4·10H2O. Растворимость сульфата натрия в этом температурном интервале возрастает с повышением температуры. Насыщенный раствор сульфата натрия при атмосферном давлении кипит при температуре 102,9°С.
При +32,4 °С Na2SO4·10H2O инконгруэнтно плавится, образуя безводный сульфат натрия и его насыщенный раствор. При -1,2 °С и 4,0 %-ной концентрации Na2SO4 в равновесии с жидкой фазой находится лед с Na2SO4·10H2O. В пределах температур от -1,2 до +32,4 °С и 4,0 %-ной концентрации раствора Na2SO4 равновесной твердой фазой системы Na2SO4 – H2O является Na2SO4·10H2O. Растворимость сульфата натрия в этом температурном интервале возрастает с повышением температуры. Насыщенный раствор сульфата натрия при атмосферном давлении кипит при температуре 102,9°С.
В интервале температур от 32,4 °С до температуры кипения насыщенных растворов зависимость растворимости сульфата натрия от температуры носит обратный характер, т.е. уменьшается с повышением температуры.
Кинетику выщелачивания природного мирабилита изучали в чистой воде и насыщенном при 20 °С оборотном щелоке, содержащем 16,1 % сульфата натрия [2].
Опыты проводили при температурах, для которых в качестве стабильной фазы существует Na2SO4·10H2O (32,4 °С) и Na2SO4 (50 и 70 °С). Для исследований применяли измельченный до размера 5-6 мм природный мирабилит Тумрюкского месторождения, содержащий в среднем 90,53 % основного вещества. Выщелачивание осуществлялось при массовых соотношениях Т:Ж, вызывающих образование 33,25; 33,80 и 30,60 %-ных растворов сульфата натрия, насыщенных соответственно при 32,4; 50 и 70 °С. На основе полученных экспериментальных данных была построена графическая зависимость в координатах Сτ–τ (рис. 1).
Рисунок 1. Кинетика выщелачивания природного мирабилита Тумрюкского месторождения водой (а) и 16,1 %-ным раствором сульфата натрия (б)
при 32,4 (1), 50 (2) и 70 °С (3).
Данные показывают, что температура существенно влияет на скорость выщелачивания мирабилита водой и 16,1 %-ным раствором сульфата натрия. С повышением температуры образование насыщенных растворов завершается за короткий промежуток времени. При выщелачивании природной соли водой образование 31,85 %-ного раствора сульфата натрия при 32,4 °С происходит в течение 14 минут. При 50 и 70 °С образование растворов с концентрацией 31,70 и 30,40 % Na2SO4 достигается соответственно в течение 6 и 4 минут. На начальной стадии процесса благодаря высокому значению величины недонасыщенности раствора (Сн-Сτ) скорость выщелачивания велика, а затем, по мере повышения концентрации сульфата натрия в жидкой фазе, скорость выщелачивания уменьшается. Аналогичная картина наблюдается и в процессах выщелачивания мирабилита 16,1 %-ным раствором сульфата натрия с тем отличием, что для образования концентрированных растворов требуется чуть больше времени. Для количественной характеристики процесса выщелачивания водой и раствором сульфата натрия производился расчет константы скорости выщелачивания. Найденные значения констант скоростей выщелачивания при всех изученных температурах за определенный промежуток времени оставались постоянной величиной.
С повышением температуры образование насыщенных растворов завершается за короткий промежуток времени. При выщелачивании природной соли водой образование 31,85 %-ного раствора сульфата натрия при 32,4 °С происходит в течение 14 минут. При 50 и 70 °С образование растворов с концентрацией 31,70 и 30,40 % Na2SO4 достигается соответственно в течение 6 и 4 минут. На начальной стадии процесса благодаря высокому значению величины недонасыщенности раствора (Сн-Сτ) скорость выщелачивания велика, а затем, по мере повышения концентрации сульфата натрия в жидкой фазе, скорость выщелачивания уменьшается. Аналогичная картина наблюдается и в процессах выщелачивания мирабилита 16,1 %-ным раствором сульфата натрия с тем отличием, что для образования концентрированных растворов требуется чуть больше времени. Для количественной характеристики процесса выщелачивания водой и раствором сульфата натрия производился расчет константы скорости выщелачивания. Найденные значения констант скоростей выщелачивания при всех изученных температурах за определенный промежуток времени оставались постоянной величиной.
С повышением температуры значения констант скорости выщелачивания повышаются. Температурный коэффициент скорости выщелачивания водой при повышении температуры от 32,4 до 50 и от 50 до 70 °С равен соответственно 1,74 и 1,80. При выщелачивании 16,1 %-ным раствором сульфата натрия этих показатели составляют 2,56 и 3,39.
Сравнение значений констант скоростей выщелачивания мирабилита водой и 16,1 %-ным раствором сульфата натрия показывает, что в последнем случае скорость выщелачивания по сравнению с водой для температур 32,4; 50 и 70 °С уменьшается соответственно в 5,33; 3,61 и 1,91 раза.
Одним из главных факторов, определяющим качество сульфата натрия, является содержание гипса в продукте. Содержание его в растворах сульфата натрия, полученных после выщелачивания сырья, не должно превышать 0,4 %. В противном случае из него невозможно получить качественный продукт.
Анализ литературных данных по физико-химическим свойствам системы Na2SO4 – СaSO4 – H2O показывает, что растворимость сульфата кальция в присутствии сульфата натрия меняется различно в зависимости от температуры и концентрации сульфата натрия в растворе. Ниже 29 °С в системе в качестве твердых фаз существуют CaSO4·2H2O и Na2SO4·10H2O. Содержание сульфата кальция в эвтоническом растворе достигает 0,33 %. Повышение температуры приводит к образованию малорастворимого глауберита Na2SO4·СaSO4, а также двойных солей СaSO4·2Na2SO4·2H2O и 5СaSO4·Na2SO4·3H2O и уменьшению растворимости сульфата кальция в эвтонических растворах. При 35 и 50 °С в равновесных эвтонических растворах, отвечающих кристаллизации сульфата натрия с глауберитом, содержание сульфата кальция составляет 0,05 и 0,04 %, а при 80 °С – 0,03 %.
Ниже 29 °С в системе в качестве твердых фаз существуют CaSO4·2H2O и Na2SO4·10H2O. Содержание сульфата кальция в эвтоническом растворе достигает 0,33 %. Повышение температуры приводит к образованию малорастворимого глауберита Na2SO4·СaSO4, а также двойных солей СaSO4·2Na2SO4·2H2O и 5СaSO4·Na2SO4·3H2O и уменьшению растворимости сульфата кальция в эвтонических растворах. При 35 и 50 °С в равновесных эвтонических растворах, отвечающих кристаллизации сульфата натрия с глауберитом, содержание сульфата кальция составляет 0,05 и 0,04 %, а при 80 °С – 0,03 %.
В этой области системы образуется раствор с высоким содержанием сульфата натрия.
Вышеизложенное указывает на целесообразность проведения процесса выщелачивания природного мирабилита Тумрюкского месторождения водой при температуре не ниже 50 °С. В этих температурных условиях по сравнению с интервалом 25-35 °С, с одной стороны, скорость растворения сульфата натрия будет высокой, а с другой стороны, из-за низкой растворимости и скорости растворения сульфат кальция полностью не успевает перейти в раствор за короткий промежуток времени.
Результаты исследования процесса выщелачивания мирабилита Тумрюкского месторождения при 50 °С водой при соотношении Т:Ж=1,0:0,37 в течение 5-6 минут показали, что при этом образуется раствор, содержащий 30,96 % Na2SO4, 0,27 % MgSO4, 0,02 % СaSO4, 0,15 % NaCl и 68,60 % H2O.
Изучена продолжительность охлаждения до 20 °С и изменение концентрации сульфата натрия при охлаждении полученного раствора. Продолжительность охлаждения раствора с выделением глауберовой соли в твердую фазу и образованием раствора, содержащего 15,92 % Na2SO4, 0,59 % MgSO4, 0,05 % CaSO4, 0,33 % NaCl и 83,11 % Н2О, составляет 65-66 минут. При этом образуется пульпа с осадком глауберовой соли c соотношением Т:Ж = 1,0:0,87. После фильтрации влажный осадок глауберовой соли содержит примеси эпсомита, гипса и галита, содержавшихся в твердой фазе. Для получения чистой глауберовой соли ее осадок на фильтре промывали двукратно холодной водой сначала при соотношении Т:Ж=1,0:0,05, а затем при 1,0:0,025. Получена глауберова соль, содержащая 4,7·10-3 % эпсомита, 6·10-4 % гипса и 1,9·10-3 % галита при влажности 12,65 %.
Получена глауберова соль, содержащая 4,7·10-3 % эпсомита, 6·10-4 % гипса и 1,9·10-3 % галита при влажности 12,65 %.
Высушивание влажного продукта позволило получить декагидрат сульфата натрия, содержащий 99,98 % Na2SO4·10Н2О; 0,05 % MgSO4·7H2O; 6,8·10-3 % СaSO4·2H2O и 0,02 % NaCl. Качество продукта соответствует натрию сернокислому медицинскому – глауберовой соли.
Изучена зависимость изменения состава жидкой фазы и количества выделяющегося в твердую фазу сульфата натрия от степени удаления воды из раствора. Установлено, что с увеличением степени удаления воды количество примесных солей хлорида натрия, сульфата магния и кальция в растворе увеличивается, а содержание сульфата натрия незначительно понижается. После разделения пульпы с осадком сульфата натрия, однократной промывки твердой фазы водой с температурой ниже 35 °С при соотношении Т:Н2О=1,0:0,05 и сушки влажного осадка при 200 °С получен продукт с содержанием Na2SO4 не ниже 99,6 % и не более 0,01 % MgSO4, 4,1·10-3 % СaSO4, 0,03 % NaCl и 0,24 % влаги. По ГОСТу 6318 полученный продукт соответствует марке «А» – высшему сорту сульфата натрия.
По ГОСТу 6318 полученный продукт соответствует марке «А» – высшему сорту сульфата натрия.
После первой ступени выпарки и кристаллизации сульфата натрия образуется раствор, который содержит около 47 % сульфата натрия от имевшегося в первоначальном растворе, взятом для выпарки. Переработка этого раствора на продукт высшего качества невозможна из-за повышенного содержания в нем примесных солей натрия, кальция и магния. Целесообразным является получение из него технического сульфата натрия путем полного высушивания. Исследования показали, что при этом образуется продукт, содержащий 95,79 % Na2SO4, 1,65 % MgSO4, 0,26 % СaSO4, 1,37 % NaCl и 0,93 % влаги. Качество данного продукта по требованию ГОСТа 6318 соответствует марке «Б» – техническому сульфату натрия.
Полученные образцы глауберовой соли и сульфата натрия изучали рентгенофазовым, ИК-спектроскопическим и термогравиметрическим анализами, которые подтвердили результаты химических анализов.
Исследование процессов фильтрации пульп, образующихся при выпарке и охлаждении раствора сульфата натрия, проводили на лабораторной установке, состоящей из узлов накопителя, термостата и фильтрации. В качестве фильтровальной ткани использовался бельтинг.
Согласно полученным данным фильтруемость и скорость фильтрации обеих пульп, содержащих глауберову соль и сульфат натрия, с повышением соотношения Ж:Т увеличиваются. Производительность фильтрации пульпы с осадком глауберовой соли выше по сравнению с пульпой, содержащей сульфат натрия. Скорость фильтрации по твердой и жидкой фазам сильно зависит от толщины слоя твердого остатка на фильтрах. Чем меньше толщина этого остатка, тем больше производительность фильтрации по пульпе, твердой и жидкой фазам. Изучен процесс выщелачивания природного мирабилита Тумрюкского месторождения водой и оборотным раствором сульфата натрия. Показано, что выщелачивание сырья необходимо проводить при температуре не ниже 50 °С, чтобы уменьшить переход примеси гипса в раствор.
Исследованиями фильтруемости растворов и суспензий глауберовой соли и сульфата натрия, процесса выпарки, охлаждения растворов и кристаллизации солей установлены оптимальные условия получения глауберовой соли и сульфата натрия. Проведенные токсикологические исследования глауберовой соли показали, что она безвредна и относится к малоопасным веществам (IV класс опасности).
Проведенные исследования явились научной основой для получения глауберовой соли медицинского назначения, и сульфата натрия из местного сырья – природного мирабилита Тумрюкского месторождения.
Список литературы:
- Каримов И.А. Узбекистан по пути углубления экономических реформ. – Москва: Дом Дрофа. 1994. – 321 с.
- Мирзакулов Х.Ч., Джураева Г.Х., Якубов Р.Я., Эркаев А.У., Бардин С.В., Реймов А.М. Кинетика выщелачивания природного мирабилита Тумрюкского месторождения. / Узб. хим. журн. 2005. № 2. С. 29-32.
- Джураева Г.Х., Мирзакулов Х.
 Ч., Эркаев А.У., Якубов Р.Я., Растворимость в системе 2Na+, 2NH4+ // 2Сl—, SО42-–Н2О при 100 °С. / Узб. хим. журн. 2005. № 1. С. 16-20.
Ч., Эркаев А.У., Якубов Р.Я., Растворимость в системе 2Na+, 2NH4+ // 2Сl—, SО42-–Н2О при 100 °С. / Узб. хим. журн. 2005. № 1. С. 16-20. - Джураева Г.Х., Мирзакулов Х.Ч., Мамиров И.Г. Получение сульфата натрия из местного природного сырья. // Кимё ва кимёвий технологиянинг замонавий муаммолари: Сб. трудов I Респ. научно-техн. конф. Ферганского политехнического института. 23-24 апреля 2004. – Фергана, 2004. С. 14-15.
Сульфат натрия глауберова соль — Справочник химика 21
Содержащий воду кристаллический сульфат натрия (глауберова соль) растворяется в воде с сильным охлаждением (—18,76 ккал моль). Его применяют иногда для охлаждения в медицине его используют как слабительное. В промышленности Na2S04 применяют при крашении и в аппретурах хлопчатобумажных тканей. [c.225]Сульфат натрия (глауберова соль) [c.137]
Профилактика и лечение заболеваний животных и борьба с вредными насекомыми. Ветеринария издавна пользуется химическими веществами для лечения животных и предохранения их от заболеваний, для дезинфекции посуды и помещений, для борьбы с оводом, гнусом и другими насекомыми. Кроме таких хорошо известных веществ, как иод, сульфат натрия (глауберова соль), кислоты, креолин и др., химическая промышленность дает животноводству много новых хороших средств. Применение фармакологических препаратов, зооцидов, репеллентов сильно снижает потери животноводства от болезней животных и от вредных насекомых. [c.334]
Ветеринария издавна пользуется химическими веществами для лечения животных и предохранения их от заболеваний, для дезинфекции посуды и помещений, для борьбы с оводом, гнусом и другими насекомыми. Кроме таких хорошо известных веществ, как иод, сульфат натрия (глауберова соль), кислоты, креолин и др., химическая промышленность дает животноводству много новых хороших средств. Применение фармакологических препаратов, зооцидов, репеллентов сильно снижает потери животноводства от болезней животных и от вредных насекомых. [c.334]
Месторождения СССР, Советский Союз обладает богатейшими месторождениями природных рассолов. Сульфат-хлоридные и хлоридные месторождения эксплуатируют с целью удовлетворения потребностей народного хозяйства и населения в поваренной соли, сульфате натрия, глауберовой соли, эпсомите, бишофите [c.169]
Сульфат натрия (глауберова соль), водны [c.306]
Соблюдение температурного режима. Это условие имеет большое значение, так как, например, кристаллический сульфат натрия (глауберова соль) плавится в собственной кристаллизационной воде уже при 32°, а при более высоких температурах растворимость его снижается. Особенно зависит от температуры вязкость компонентов, причем следует принимать во внимание аномальную вязкость алкилбензол сульфатов, у которых она достигает максимальных значений с повышением температуры. [c.387]
Это условие имеет большое значение, так как, например, кристаллический сульфат натрия (глауберова соль) плавится в собственной кристаллизационной воде уже при 32°, а при более высоких температурах растворимость его снижается. Особенно зависит от температуры вязкость компонентов, причем следует принимать во внимание аномальную вязкость алкилбензол сульфатов, у которых она достигает максимальных значений с повышением температуры. [c.387]
Очень гигроскопичный сульфат натрия, входящий в состав моющих средств, теоретически должен вследствие присоединения воды кристаллизоваться при температуре ниже 32°. Однако вследствие присутствия в моющих средствах коллоидных веществ, мешающих кристаллизации, процесс несколько замедляется. В практических условиях определенная часть поглощенной воды (количественно это зависит от многих режимных параметров) образует с сульфатом натрия глауберову соль. Присутствие ее можно обнаружить под микроскопом, наблюдая при осторожном нагревании плавление сульфата на поверхности в собственной кристаллизационной воде. [c.526]
[c.526]
В значительной мере свободным от алхимических идей был Иоганн Рудольф Глаубер (1604—1670), выдающийся химик-практик, известный своим искусством экспериментатора. Среди многого другого он открыл реакцию между хлоридом натрия (поваренной солью) и серной кислотой, в результате которой образуются соляная кислота и сульфат натрия (глауберова соль). [c.14]
Натрий сернокислый (сульфат натрия, глауберова соль)…………….. [c.298]
И. Глаубер получил этилхлорид (действием соляной кислоты на винный спирт) описал сульфат натрия (глауберову соль) приготовил уксусную кислоту сухой перегонкой растительных веществ. [c.536]
Сульфат натрия (глауберова соль) Na2SO4-10HaO применяется в медицине и ветеринарии, в производстве соды и стекла. [c.389]
Первая по- Работы И. Р. Глаубера, в которых описаны многие реакции ловина получения солей, кислот, фармацевтических препаратов, XVII в. даны первые указашт иа относительную силу различных кислот. Открытие (1648) сульфата натрия (глауберова соль). [c.632]
даны первые указашт иа относительную силу различных кислот. Открытие (1648) сульфата натрия (глауберова соль). [c.632]
Распространение в природе. В природе часто встречаются значительные залежи серы (большей частью вблизи вулканов) в Европе она встречается прежде всего в Сицилии. Еш е большие ее залежи имеются в Америке (в штатах Луизиана и Техас), а также в Японии. В вулканических местностях часто наблюдается выделение сероводорода HjS как подземного газа там же он встречается и в растворенном виде в серных водах. Вулканические газы часто содержат сернистый газ SO2. Очень распространены сернистые соединения металлов. Наиболее часто встречающиеся сульфиды железный волче0ак (пирит) FeSg, медный колчедан uFeSj, св к-цовый блеск PbS и цинковая обманка ZnS. Еще чаще сера встречается в виде сульфатов, нанример сульфат кальция гипс и ангидрит), сульфат магния горькая соль и кизерит), сульфат бария тяжелый шпат), сульфат стронция целестин), сульфат натрия глауберова соль).
 [c.750]
[c.750]Гэрритт [81] недавно составил обзор многих из известных случаев промышленного применения формоизменения, а также рассмотрел факторы, которые необходимо принимать во внимание при выборе подходящего модификатора. Можно привести несколько примеров. Кристаллы буры могут быть изменены до пластинчатой или хлопьевидной формы путем добавки желатины или казеина в кристаллизующийся раствор эти вещества селективно поглощаются на основных гранях и снижают скорость их роста. Крупные кристаллы хлоридов натрия, калия и аммония, которые обычно трудно получить, могут быть выращены, если в растворе присутствуют ионы РЬ +. Большие гранулированные кристаллы декагидрата сульфата натрия (глауберова соль) могут быть получены из растворов побочного продукта вискозы, если добавить определенные поверхностно активные агенты, например, алкил арилсульфонаты в противном случае соль обычно имеет тенденцию выкристаллизовываться из этих растворов в виде небольших иголо . [c.180]
При глубоком охлаждении части осадительной ванны на станции кристаллизации сульфата натрия осуществляется непрерывная кристаллизация выделяющегося в процессе формования дееятиводного сульфата натрия (глауберовой соли), который затем переводится в безводный сульфат натрия, который высупгавается, охлаждается и упаковывается. [c.124]
[c.124]
Из раствора бисульфата натрия можно получать кристаллический сульфат натрия (глауберову соль). Металлический цинк может быть использован для получения сернокислого цинка. Углекислый цинк используется для получения окнси цинка—цинковых белил. Из горячего маточного раствора дополнительным охлаждением можно выкристаллизовать двухводн ю соль гидросульфита натрия и, добавив ее в отсолочный аппарат, тем самым увеличить полезный выход продукта. [c.284]
формула, свойства, применение и противопоказания. Глауберовая соль для похудения Na2so4 цвет
Глауберова соль: применение в медицине, свойства
Глауберова соль получила свое наименование благодаря немцу Глауберу, который ее открыл. Это вещество представляет собой прозрачные, бесцветные кристаллы, которые выветриваются со временем, и имеют горько-соленый вкус. Соль применяют в медицине в качестве сильного, эффективного слабительного средства.
Открытие глауберовой соли датировано зимой 1626 года и непосредственно связано с перенесённой в 1625 году Глаубером болезнью — сыпным тифом, в то время именуемого «венгерской лихорадкой». Вот как сам Глаубер описывал это:
Вот как сам Глаубер описывал это:
Несколько оправившись от болезни, я прибыл в Неаполис (латинизированное название Нойштадта, по-немецки — «нового города»; в Германии несколько городов имеют такое название). Там у меня снова начались приступы, и я должен был остаться в этом городе. Болезнь настолько ослабила мой желудок, что он не мог ни принимать, ни переваривать никакую еду. Местные жители посоветовали мне пойти к источнику, находящемуся вблизи виноградника в часе ходьбы от города. Они сказали, что вода источника вернет мне аппетит. Следуя их совету, я взял с собой большой кусок хлеба; мне сказали, что должен буду весь его съесть, но я мало верил в то, что это мне как-то поможет. Придя к источнику, я намочил хлебный мякиш в воде и съел его — причём с большим удовольствием, хотя перед этим не мог смотреть без отвращения на самые изысканные лакомства. Взяв оставшуюся от хлеба корку, я зачерпнул ею воды из источника и выпил её. Это настолько возбудило мой аппетит, что в конце концов я съел и «чашку» из хлеба, которой черпал воду. Домой я возвратился значительно окрепшим и поделился своими впечатлениями с соседями. Я чувствовал, что если буду и дальше лечиться этой водой, функции моего желудка полностью восстановятся. Я спросил, что это за вода. Мне сказали, что в ней содержится селитра, чему тогда, не будучи искушён в подобных вопросах, я поверил.
Домой я возвратился значительно окрепшим и поделился своими впечатлениями с соседями. Я чувствовал, что если буду и дальше лечиться этой водой, функции моего желудка полностью восстановятся. Я спросил, что это за вода. Мне сказали, что в ней содержится селитра, чему тогда, не будучи искушён в подобных вопросах, я поверил.
Глаубер заинтересовался химическим составом воды источника и посвятил этому изучению всю следующую зиму. Он подружился с местным аптекарем Айснером и использовал его лабораторию для опытов. В ходе исследований он выпаривал минеральную воду и анализировал осадки. Вместо селитры в осадке оказалась ранее неизвестная соль, которую он назвал «чудесной» — по латыни «sal mirabile». В частности, название природного минерала мирабилита происходит именно из латинского названия.
Более подробно об этом лекарственном средстве мы поговорим с вами на сайте www.rasteniya-lecarstvennie.ru, в публикации: глауберова соль применение в медицине, свойства.
Лечебные свойства глауберовой соли
Это мощное слабительное средство быстрого действия. Как правило, ее используют при сильных пищевых отравлениях, для тщательной очистки кишечника, лимфатической системы, а также по медицинским показаниям ее применяют при заболеваниях печени.
Как правило, ее используют при сильных пищевых отравлениях, для тщательной очистки кишечника, лимфатической системы, а также по медицинским показаниям ее применяют при заболеваниях печени.
При очистке кишечника, попадая в организм человека, раствор соли существенно разжижает каловые массы, увеличивает их объем, вызывая сильный понос. Главный эффект такого очищения, что раствор собирает вместе отмершие клетки, шлаки, токсины, выводя их наружу вместе с жидкостью.
При наружном применении это средство действует аналогично — отчищает ороговевший слой эпидермиса.
Как применять глауберову соль?
В медицине средство применяют внутрь в виде водного раствора, болюсов, кашки. Наружно — в виде раствора.
Наружно применяют раствор для лечения долго не заживающих гнойных ран, так как раствор обладает подсушивающим свойством, усиливает отделение гнойного содержимого, очищая, дезинфицируя, таким образом, рану.
Очищение кишечника
При приеме внутрь препарат плохо всасывается желудочно-кишечном трактом, притягивая к кишечнику большой объем жидкости. Для наилучшего эффекта очищения используют раствор 5—10%-ной концентрации. Послабление происходит через 2-5 часов после приема.
Для наилучшего эффекта очищения используют раствор 5—10%-ной концентрации. Послабление происходит через 2-5 часов после приема.
При применении средства внутрь, следует помнить, что глауберова соль медленно всасывается слизистой желудка, кишечника, обеспечивая медленное сгущение слизи. Поэтому очищение кишечника раствором проводят три дня.
Для приготовления раствора растворите 1 ст. л. препарата на 200 мл. кипяченой воды комнатной температуры.
Это средство нужно выпивать каждое утро на голодный желудок. Оно эффективно очистит организм от вредных веществ, ядов. Но так как раствор обладает высушивающими свойствами, это может привести к обезвоживанию.
Поэтому во время лечения каждый день выпивайте 2 л. смеси свежевыжатых соков из 4 плодов грейпфрута, 2 лимонов, 3 плодов апельсина. После проведения трехдневного очищения, на 4 день можно начать употреблять сырые овощи, фрукты, свежевыжатые овощные соки. Через неделю можно постепенно переходить к привычному режиму питания.
Как очистить лимфу с помощью глауберовой соли?
Лимфатическая система нашего организма защищает его от проникновения различных инфекций. Если лимфа загрязнена, вся система теряет свою защитную функцию, ставя здоровье человека под удар. В организм устремляются полчища микробов, вирусов, бактерий, уничтожая все на своем пути. Отсюда аллергические заболевания, простуды, грипп, астма, раковые опухоли.
Раствор глауберовой соли по утверждениям знахарей поможет эффективно очистить лимфу и восстановить защитные функции организма. Но тут есть одно необходимое условие: Очищение лимфы следует проводить только после
очистки печени.
Если это условие соблюдено, можно приступать непосредственно к процедуре очистки.
Приготовьте свежий сок из грейпфрутов, апельсинов. Их нужно взять по 900 г. Соки смешайте, добавьте туда же 200 мл лимонного сока. Все перемешайте, разбавьте смесь 2 л. чистой, свежей воды, храните в холодильнике. Сок делайте с утра, в день процедуры.
С вечера сделайте клизму. Утром натощак выпейте раствор глауберовой соли (50 г на 1 стакан чистой воды). Этот раствор вскоре начнет действовать, очищая лимфатическую систему от грязи.
Утром натощак выпейте раствор глауберовой соли (50 г на 1 стакан чистой воды). Этот раствор вскоре начнет действовать, очищая лимфатическую систему от грязи.
Через час начинайте пить приготовленный с утра напиток по 1 стакану каждые 30 мин. За весь день следует выпить все без остатка. Перед употреблением его лучше подогреть до 35 градусов. Никакой пищи в дни очистки употреблять нельзя. Но этот напиток является эффективным энергетиком, поэтому голод практически не ощущается.
Очищение следует проводить три дня подряд. Утром принимайте солевой раствор, затем пейте смесь соков и воды каждые полчаса. За это время лимфатическая система полностью очистится.
После полного проведения процедур, можно постепенно переходить на легкие, жидкие каши, кисломолочные продукты, свежие, нежирные куриные бульоны. Еще через пару дней, можно переходить к обычному рациону.
Будьте внимательны! Такую чистку следует проводить не чаще, чем 1 раз за год. Не следует проводить процедуры очистки при заболеваниях желудка и 12-перстной кишки.
Глауберова соль очень сильное послабляющее средство для очистки кишечника. Именно такое ее основное применение в медицине. Чтобы не нанести вреда своему организму, используйте очищающие свойства этого средства, посоветовавшись с врачом. Будьте здоровы!
Мирабилит (сульфат натрия, глауберова соль, Е 514) — слабительная соль, которая применяется в качестве слабительного средства для устранения запора, а также для очищения кишечника, печени, лимфы.
Свое название глауберова соль получила в честь Иоганна Рудольфа Глаубера, который ее впервые открыл (1604 – 1670). Ученый восстановился после болезни в 1624 году благодаря минеральным источникам с наличием сульфата натрия.
В традиционной медицине глауберова соль назначается для кратковременного использования против запора.
В альтернативной медицине глауберову соль используют для очищения организма, тела, при задержке жидкости в организме, при желудочно-кишечных и почечных жалобах.
В пищевой промышленности ее используют в качестве пищевой добавки (Е 514), а также добавляют в моющие средства.
Дозировка глауберовой соли при запоре:
Взрослым от 10 до 30 г сульфата натрия, растворенного в достаточном количестве воды (400-500 мл / доза). Эффект наступает через несколько часов.
Противопоказания:
воспалительные заболевания кишечника, кишечная непроходимость или стеноз
боль в животе неизвестного происхождения
кишечника перфорация
почечная недостаточность
электролитный дисбаланс: гипернатриемия
Побочные эффекты:
Желудочно-кишечные симптомы, такие как диарея и рвота возникают в основном при слишком высокой дозировке. При долгосрочном применении возможно привыкание, нарушение электролитного баланса, обезвоживание (гипертонические растворы).
Очищение кишечника глауберовой солью:
Глауберова соль – известное слабительное, которое можно купить в любой аптеке за углом. Эта соль аналогична английской соли (магнезия) с чрезвычайно горьким соленым вкусом, которая радикально влияет на желудочно-кишечный тракт. Во время очищения кишечника солью рекомендуется больше пить очищенной воды.
При диареи, которая вызвана приемом глауберовой соли, организм теряет большое количество воды. Однако, она идеально подходит для очищения организма от токсинов.
1. По книге Х. Майр:
Возьмите 1 – 3 чайные ложки глауберовой соли (около 7 – 21 г), растворите ее в 200 – 250 мл теплой воды. Для маскировки горького вкуса можно добавить несколько капель апельсинового сока. Выпейте напиток натощак (утром). Через 30 – 120 минут начнется очищение кишечника, диарея, вывод токсинов. Это очищение продолжится около 6 часов. Рекомендуется весь день пить воду, натуральные соки, пищу не принимать. Такое очищение кишечника лучше проводит 1 раз, максимум 2 дня подряд. Для наилучшего эффекта на следующий день можно поставить очистительную клизму (читайте здесь).
2. Второй вариант очищения кишечника:
За день до начала очищения приготовьте раствор глауберовой соли. Для этого смешайте соль 30 – 40 г в 250 – 400 мл теплой воды. Перемешивайте смесь в течение всего дня несколько раз.
Вечером за 2 часа до сна выпейте смесь соли с водой в небольших дозах, т. е. в течение 30 минут необходимо выпить всю приготовленную жидкость. Через некоторое время можно выпить 2 стакана очищенной воды, чтобы избежать обезвоживания.
е. в течение 30 минут необходимо выпить всю приготовленную жидкость. Через некоторое время можно выпить 2 стакана очищенной воды, чтобы избежать обезвоживания.
Эффект от глауберовой соли вы заметите на следующее утро. Ваш кишечник очистится от токсинов, завалов.
После очищения вам необходимо соблюдать диету в течение 3 дней, т.е. есть только легкие блюда, закуски (овощи, фрукты). Не ешьте пока мясо, масло, бобы, сою, рыбу, яйца и молочные продукты.
Кому глауберова соль не подходит? Тем, кто страдает хроническим запором, низким артериальным давлением, сердечной недостаточностью. Перед применением средства, проконсультируйтесь с врачом.
Ответить [x] Отменить ответ
будем пробовать
Ответить [x] Отменить ответ
Небольшая приусадебная ферма может быть очень продуктивной. Главное – хорошее содержание буренок, отвечающих потом высокими надоями.
Зимнее содержание, предполагающее кормление коровок сеном, сухими кормами, заметно снижает надои. Страдает и иммунная система стада, что грозит инфекционными болезнями. Положение исправляем «Глауберовой солью». Если растворять небольшой объем средства в воде, предназначенной для поения коров, то оно улучшает пищеварение. Заметно выправляются привесы, объемы получаемого молока.
Положение исправляем «Глауберовой солью». Если растворять небольшой объем средства в воде, предназначенной для поения коров, то оно улучшает пищеварение. Заметно выправляются привесы, объемы получаемого молока.
При проблемах с пищеварением, «Глауберова соль» тоже используется. Только концентрация раствора получается значительно выше. Препарат исправляет положение при перитоните, плеврите, которыми буренки тоже болеют. Заметила – чем больше стадо, тем чаще встречаешься с болезнями.
«Глауберова соль» — универсальное, многопрофильное средство, считаем с супругом. Емкость всегда под рукой, дополнительного инструментария не требует. Заранее составили памятку по концентрациям, вывесили в коровнике.
Ответить [x] Отменить ответ
Наша трёхлетняя кошка за зиму просилась к котам 6 или 7 раз подряд. Мы измучились и решили отвезти её на стерилизацию. После стерилизации оказалось, что проблема была в миоме, и животное мы привезли вовремя, еще неделя, и могли бы не спасти. Но это были не все наши злоключения: столкнулись с проблемой – кошка, выходя трудно и долго из наркоза почти не пила, хоть мы и пытались вливать воду шприцем. Еще, видимо, нормально сходить в туалет кошке мешала болезненность швов после операции – и из-за этого возник запор. Пришлось ломать голову, как спасать зверя. В интернете прочли о вазелиновом масле и глауберовой соли, проще оказалось на тот момент найти последнюю. Дали выпить со шприца 5 кубиков шестипроцентного солевого раствора, потом еще много раз насильно заливали в кошку воду, чтобы у неё не было обезвоживания после действия средства. Не скажу, что сразу, но дело постепенно наладилось, и сейчас те дни возни с несчастным животным вспоминаю, как страшный сон.
Но это были не все наши злоключения: столкнулись с проблемой – кошка, выходя трудно и долго из наркоза почти не пила, хоть мы и пытались вливать воду шприцем. Еще, видимо, нормально сходить в туалет кошке мешала болезненность швов после операции – и из-за этого возник запор. Пришлось ломать голову, как спасать зверя. В интернете прочли о вазелиновом масле и глауберовой соли, проще оказалось на тот момент найти последнюю. Дали выпить со шприца 5 кубиков шестипроцентного солевого раствора, потом еще много раз насильно заливали в кошку воду, чтобы у неё не было обезвоживания после действия средства. Не скажу, что сразу, но дело постепенно наладилось, и сейчас те дни возни с несчастным животным вспоминаю, как страшный сон.
Ответить [x] Отменить ответ
Я и моя мама работаем в сфере ветеринарной медицины. Мама врач, я – фельдшер. Мы работаем в районной ветеринарной поликлинике. Спектр деятельности достаточно широк, от лошадей и коров до попугаев и шиншилл. Очень часто нас вызывают к сельскохозяйственным животным. Как раз в работе с ними мы используем глауберовою соль. Это отличнейший препарат для промывания организма и для стимуляции пищеварения. Все зависит от доз. Вот недавно был случай с коровой у одной бабули в селе. Буренка как-то сама зашла в сарай, где были мешки с кукурузой. Этого никто не видел, ну и пробыла она там предостаточно. Кукурузы наелась столько, сколько сама хотела. От этого все внутри перестало работать, атония преджелудков. Пришлось ее с помощью желудочного зонда делать промывание растворам глауберовой соли. Процедуру повторяли два раза. Брали где-то 250 г препарата. Через пару дней Буренка пошла на поправку. Как только ее выпустили, она зразу же очутилась в том сарае. Только кукурузу уже не трогала, не захотела.
Как раз в работе с ними мы используем глауберовою соль. Это отличнейший препарат для промывания организма и для стимуляции пищеварения. Все зависит от доз. Вот недавно был случай с коровой у одной бабули в селе. Буренка как-то сама зашла в сарай, где были мешки с кукурузой. Этого никто не видел, ну и пробыла она там предостаточно. Кукурузы наелась столько, сколько сама хотела. От этого все внутри перестало работать, атония преджелудков. Пришлось ее с помощью желудочного зонда делать промывание растворам глауберовой соли. Процедуру повторяли два раза. Брали где-то 250 г препарата. Через пару дней Буренка пошла на поправку. Как только ее выпустили, она зразу же очутилась в том сарае. Только кукурузу уже не трогала, не захотела.
Ответить [x] Отменить ответ
Соль Глауберова — замечательное средство, применяемое при запорах у животных, а также некоторых других заболеваниях желудочно-кишечного тракта. В своей практике мы применяем его при запорах различной природы у мелкого рогатого скота. Данное средство действует весьма эффективно и при этом достаточно «мягко». Лично нами не наблюдалось никаких побочных эффектов от применения соли Глауберова, а также небыло передозировок у животных (хотя в некоторых случаях давали увеличенные дозы этого препарата). Кроме собственно запоров, в небольших количествах данное средство хорошо применять для снижения последствий и нормализации работы желудка и кишечника у коз и овец после нарушений работы рубца или атонии преджелудков. С другими средствами, применяемыми в этой ситуации (Тимпанол, Биогель-5, Ветом) соль Глауберова практически не взаимодействует, и по нашим наблюдениям их можно прекрасно применять вместе, не опасаясь последствий. Единственное, что стоит заметить о данном препарате — его желательно хранить при комнатной или ниже температуре, так как на жаре он имеет свойство переходить в жидкое состояние, и его применение может быть затруднительно.
Данное средство действует весьма эффективно и при этом достаточно «мягко». Лично нами не наблюдалось никаких побочных эффектов от применения соли Глауберова, а также небыло передозировок у животных (хотя в некоторых случаях давали увеличенные дозы этого препарата). Кроме собственно запоров, в небольших количествах данное средство хорошо применять для снижения последствий и нормализации работы желудка и кишечника у коз и овец после нарушений работы рубца или атонии преджелудков. С другими средствами, применяемыми в этой ситуации (Тимпанол, Биогель-5, Ветом) соль Глауберова практически не взаимодействует, и по нашим наблюдениям их можно прекрасно применять вместе, не опасаясь последствий. Единственное, что стоит заметить о данном препарате — его желательно хранить при комнатной или ниже температуре, так как на жаре он имеет свойство переходить в жидкое состояние, и его применение может быть затруднительно.
Ответить [x] Отменить ответ
Наставление по применению препарата «ГЛАУБЕРОВА СОЛЬ».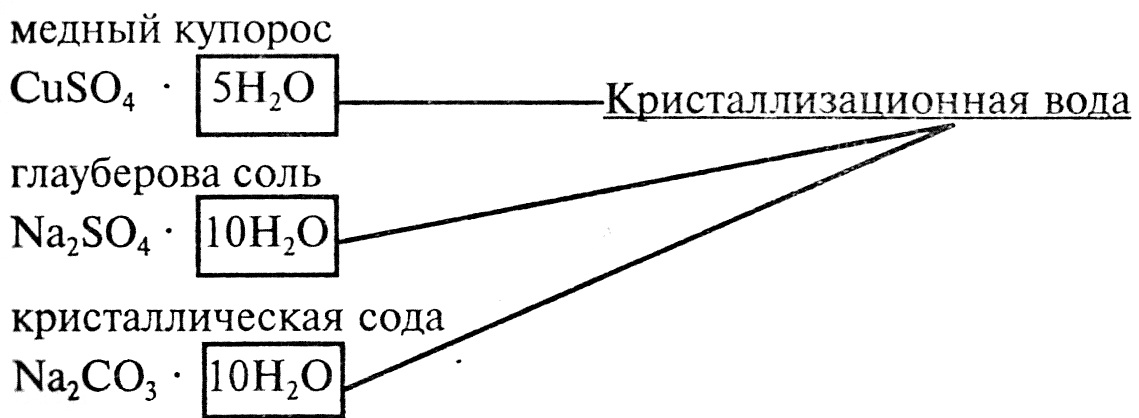
I. Общие сведения.
1. Торговое наименование: Глауберова соль (Nаtrii sulfas).
Международное непатентованное название: натрия сульфат 10-водный.
2. Лекарственная форма: крупнокристаллический порошок.
Глауберова соль представляет собой бесцветные, прозрачные кристаллы, выветривающиеся на воздухе или отсыревающие, без запаха, горько-соленого вкуса, хорошо растворимые в воде.
3. Расфасовывают Глауберову соль в пластмассовые банки по 250 г, 500 г и пакеты по 1кг.
Каждую упаковку маркируют с указанием предприятия изготовителя,его адреса и товарного знака, наименования препарата, содержания действующих веществ, емкости, номера серии, даты изготовления и срока годности (месяц, год), условий хранения, надписью « Стерильно», «Для ветеринарии», обозначения ТУ и снабжают инструкцией по применению. Срок годности Биотримеразина при соблюдении условий хранения и транспортирования — 3 года со дня изготовления.
4. Срок годности Глауберовой соли при хранении в таре производителя (мешки п/э 35кг) 1 год, при хранении в укупоренных банках или пакетах — 3 года со дня изготовления (препарат не подвержен влиянию внешней среды). Необходимо учитывать влияние условий хранения на качество препарата. В сухом месте он может терять кристаллизационную воду (порошок из прозрачного становится белым). В жаркую погоду, пр хранении в ангарах при температуре 33°С становится жидким. В сыром помещении отсыревает и «плывет».
Необходимо учитывать влияние условий хранения на качество препарата. В сухом месте он может терять кристаллизационную воду (порошок из прозрачного становится белым). В жаркую погоду, пр хранении в ангарах при температуре 33°С становится жидким. В сыром помещении отсыревает и «плывет».
II. Фармакологические свойства.
2.1. Натрия сульфат практически не всасывается в кишечнике и удерживает от всасывания воду. Сульфат-ион реагирует с различными катионами, образуя неабсорбируемые соединения, что объясняет эффективность препарата при отравлениях солями тяжелых металлов, при избытке меди и для снижения уровня кальция в кишечнике. В малых дозах, раздражая рецепторы слизистых оболочек желудка и кишечника, усиливает секрецию, перистальтику и моторику, улучшает пищеварение. Разжижая слизь, действует противокатарально.
2.2. Слабительное действие проявляется на всем протяжении кишечника. Считается, что натрия сульфат является наиболее эффективным и безопасным слабительным.
2.3. Глауберова соль стимулирует желчеобразование и перистальтику желчных каналов, ускоряет выделение с желчью продуктов обмена и токсинов.
2.4. При наружном применении гипертонические растворы натрия сульфата оттягивают жидкость из тканей, усиливая отток лимфы. Вместе с лимфой и раневым экссудатом удаляются токсины, бактерии, отторженный эпителий. Раны быстро очищаются и заживают.
III. Порядок применения препарата. Дозировки.
3.1. Глауберова соль применяется внутрь как слабительное, желчегонное, детоксицирующее и как антидот при отравлениях солями металлов (особенно меди, бария, ртути, свинца и др.).
3.2. В малых дозах (КРС, лошади 0,5г/кг массы животного; свиньи, овцы 0,3г/кг; собаки, кошки 1,0г/кг; в виде 1-2% раствора) применяют для повышения аппетита и улучшения пищеварения. В форме 1% раствора используют при гипотонии и атонии преджелудков путем промывания рубца через желудочный зонд.
3.3. В больших дозах (КРС, лошади 1,0г/кг; свиньи, овцы 0,5г/кг; собаки, кошки 1,5г/кг; в виде 6% раствора) как слабительное при запорах, переполнении и засорении кишечника, метеоризме.
В тех же дозах — для удаления из организма токсинов, ядов и других вредных веществ.
В тех же дозах — как отвлекающее, дегидратирующее средство при отеках, водянках, плеврите, перитоните и т.п.
3.4. Наружно в виде примочек гипертонические (10%) растворы сульфата натрия применяют для лечения ран, язв и др.
IV. Побочные действия. Противопоказания.
4.1. Нельзя назначать глауберову соль истощенным, обезвоженным животным.
4.2. В виду высоко содержания ионов натрия следует назначать препарат с осторожностью старым животным, а также животным с выраженной сердечной недостаточностью
V. Особые указания.
5.1. При применении глауберовой соли в качестве слабительного животным необходимо обильное питье.
5.2. Так как натрия сульфат не всасывается в кровь и не накапливается в тканях, мясо забитых животных пригодно в пищу без ограничения.
VI. Условия хранения. Срок годности.
6.1. В таре производителя (мешки п/э 35кг) хранится 1 год. Необходимо учитывать влияние условий хранения на качество препарата. В сухом месте он может терять кристаллизационную воду (порошок из прозрачного становится белым). В жаркую погоду, пр хранении в ангарах при температуре 33°С становится жидким. В сыром помещении отсыревает и «плывет».
Необходимо учитывать влияние условий хранения на качество препарата. В сухом месте он может терять кристаллизационную воду (порошок из прозрачного становится белым). В жаркую погоду, пр хранении в ангарах при температуре 33°С становится жидким. В сыром помещении отсыревает и «плывет».
6.2. В таре 1,0; 0,5; 0,4 кг в укупоренных банках хранится 3 года, не подвержен влиянию внешней среды.
6.3. Обезвоженную глауберову соль можно применять ограниченно в половинных дозах.
Мирабилит (сульфат натрия, глауберова соль, Е 514) — слабительная соль, которая применяется в качестве слабительного средства для устранения запора, а также для очищения кишечника, печени, лимфы.
Свое название глауберова соль получила в честь Иоганна Рудольфа Глаубера, который ее впервые открыл (1604 – 1670). Ученый восстановился после болезни в 1624 году благодаря минеральным источникам с наличием сульфата натрия.
Декагидрат сульфата натрия – белый или бесцветный кристаллический порошок. Он растворим в воде, имеет несколько солоноватый вкус и тает на языке с охлаждающим эффектом.
Безводный сульфат натрия представляет собой белый, гигроскопический порошок, который легко растворяется в воде, с выделением тепла.
Хранение: его следует хранить в плотно закрытых контейнерах, защищенных от света, тепла и влаги.
Показания и использование глауберовой соли
В традиционной медицине глауберова соль назначается для кратковременного использования против .
В альтернативной медицине глауберову соль используют для очищения организма, тела, при задержке жидкости в организме, при желудочно-кишечных и почечных жалобах.
В пищевой промышленности ее используют в качестве пищевой добавки (Е 514), а также добавляют в моющие средства.
Дозировка глауберовой соли при запоре
Взрослым от 10 до 30 г сульфата натрия, растворенного в достаточном количестве воды (400-500 мл / доза). Эффект наступает через несколько часов.
Противопоказания:
- воспалительные заболевания кишечника, кишечная непроходимость или стеноз
- боль в животе неизвестного происхождения
- кишечника перфорация
- почечная недостаточность
- электролитный дисбаланс: гипернатриемия
Побочные эффекты
Желудочно-кишечные симптомы, такие как диарея и рвота возникают в основном при слишком высокой дозировке. При долгосрочном применении возможно привыкание, нарушение электролитного баланса, обезвоживание (гипертонические растворы).
Очищение кишечника глауберовой солью
Глауберова соль – известное слабительное, которое можно купить в любой аптеке за углом. Эта соль аналогична английской соли ( с чрезвычайно горьким соленым вкусом, которая радикально влияет на желудочно-кишечный тракт. Во время очищения кишечника солью рекомендуется больше пить очищенной воды.
При диареи, которая вызвана приемом глауберовой соли, организм теряет большое количество воды. Однако, она идеально подходит для очищения организма от токсинов.
По книге Х. Майр
Возьмите 1 – 3 чайные ложки глауберовой соли (около 7 – 21 г), растворите ее в 200 – 250 мл теплой воды. Для маскировки горького вкуса можно добавить несколько капель апельсинового сока. Выпейте напиток натощак (утром). Через 30 – 120 минут начнется очищение кишечника, диарея, вывод токсинов. Это очищение продолжится около 6 часов. Рекомендуется весь день пить воду, натуральные соки, пищу не принимать. Такое очищение кишечника лучше проводит 1 раз, максимум 2 дня подряд. Для наилучшего эффекта на следующий день можно поставить очистительную клизму ().
Второй вариант очищения кишечника
За день до начала очищения приготовьте раствор глауберовой соли. Для этого смешайте соль 30 – 40 г в 250 – 400 мл теплой воды. Перемешивайте смесь в течение всего дня несколько раз.
Вечером за 2 часа до сна выпейте смесь соли с водой в небольших дозах, т.е. в течение 30 минут необходимо выпить всю приготовленную жидкость. Через некоторое время можно выпить 2 стакана очищенной воды, чтобы избежать обезвоживания.
Эффект от глауберовой соли вы заметите на следующее утро. Ваш кишечник очистится от токсинов, завалов.
После очищения вам необходимо соблюдать диету в течение 3 дней, т.е. есть только легкие блюда, закуски (овощи, фрукты). Не ешьте пока мясо, масло, бобы, сою, рыбу, яйца и молочные продукты.
Кому глауберова соль не подходит? Тем, кто страдает хроническим запором, низким артериальным давлением, сердечной недостаточностью. Перед применением средства, проконсультируйтесь с врачом.
Сульфат натрия 10-водный (Глауберова соль), 200 г
ИНСТРУКЦИЯпо применению глауберовой соли
СОСТАВ И ФОРМА ВЫПУСКА
Глауберова соль Na2SO4х10h3O — сульфат натрия 10-ти водный — бесцветные прозрачные кристаллы, выветривающиеся на воздухе, без запаха, горько-соленого вкуса, хорошо растворимы в воде. При хранении каменеет. Выпускается в виде порошка в пластиковых банках по 80 г, 200 г и 500 г.
ФАРМАКОЛОГИЧЕСКИЕ СВОЙСТВА
Натрия сульфат практически не всасывается в кишечнике и удерживает от всасывания воду. В малых дозах, раздражая рецепторы слизистых оболочек желудка и кишечника, усиливает секрецию, перистальтику и моторику, улучшает пищеварение. Разжижая слизь, действует противокатарально. Слабительное действие проявляется на всем протяжении кишечника. Стимулирует желчеобразование и перистальтику желчных каналов, ускоряет выделение с желчью продуктов обмена. При наружном применении гипертонические растворы натрия сульфата оттягивают жидкость из тканей и поэтому вызывают отток лимфы из тканей. Вместе с лимфой и раневым экссудатом удаляются токсины, бактерии, отторженный эпителий. Раны быстро очищаются и заживают.
ПОКАЗАНИЯ
В малых дозах применяют для повышения аппетита и улучшения пищеварения, в больших — как слабительное при запорах, переполнении и засорении кишечника, метеоризме; для удаления из организма токсинов, ядов и других веществ; как отвлекающее и обезвоживающее средство при отеках, водянках, плеврите, перитоните и т. п. Гипотонии и атонии преджелудков жвачных животных. Применяют как противоядие при отравлении солями бария, ртути, свинца. Назначают всем видам животных и птице.
ДОЗЫ И СПОСОБ ПРИМЕНЕНИЯ
Натрия сульфат применяют животным чаще всего внутрь с большим количеством воды в следующих дозах (г): как слабительное средство — лошадям 300 – 500, крупному рогатому скоту 400 – 800, оленям 100 – 300, овцам 50 – 100, свиньям 25 – 50, собакам 10 – 25, кошкам 3 – 10, курам 2 – 4, лисицам и песцам 5 – 20, норкам 5 – 15; как желчегонное средство — лошадям 150 – 250, крупному рогатому скоту 250 – 600, собакам 10 – 25; для улучшения пищеварения — лошадям и крупному рогатому скоту 250 – 600, собакам 10 – 15. Перед использованием растворяют в воде. В качестве слабительного применяют в виде 6 % раствора. Жвачным животным в форме 1 % раствора натрия сульфат используют при гипотонии и атонии преджелудков путем промывания рубца. В виде гипертонических (10 %) растворов используют наружно в виде примочек для лечения ран, язв и др. Выветренную и высушенную, то есть обезвоженную (потерявшую кристаллизационную воду (порошок из прозрачного становится белым)) глауберову соль назначают в половинной дозе, так как количество натрия сульфата в такой соли увеличивается примерно в 2 раза.
ПОБОЧНЫЕ ДЕЙСТВИЯ
При правильном использовании и даже при передозировке никаких побочных явлений не выявлено.
ПРОТИВОПОКАЗАНИЯ
Заворот кишок. Желательно не применять при поносе (диарее).
ОСОБЫЕ УКАЗАНИЯ
Особые меры предосторожности не предусмотрены.
УСЛОВИЯ ХРАНЕНИЯ
В сухом, темном месте. В хорошо укупоренной таре при температуре от минус 45 до плюс 30 ºС. При высокой температуре (в жаркую погоду) может растаять и стать жидкой! Срок годности не ограничен.
Состав и форма выпускаГлауберова соль Na2SO4х10h3O — сульфат натрия 10-ти водный — бесцветные
прозрачные кристаллы, выветривающиеся на воздухе, без запаха, горько-соленого
вкуса. Добывается в Канаде, Калифорнии, Греции и на Севере России. В Украине, к
сожалению, добычи нет. Применение препарата.
Действие.Выводит из всех частей организма токсины и отмершие клетки. На лимфу, этот раствор соли, действует, как магнит на металл, выводит до 3 литров жидкости. Потеря в день до 3 – ох килограмм веса плюс генеральная очистка организма, улучшает пищеварение, применяется одноразово как слабительное при запорах в той же пропорции, раз в неделю для профилактики как разгрузочный день, при болях в горле, язвах во рту (полоскание), при лечении гнойных ран на теле — в виде примочек. История открытияОткрытие глауберовой соли датировано зимой 1626 года и непосредственно связано с перенесённой в 1625 году Глаубером болезнью — сыпным тифом, в то время именуемого «венгерской лихорадкой». Вот как сам Глаубер описывал это:
Глаубер заинтересовался химическим составом воды источника и посвятил этому изучению всю следующую зиму. Он подружился с местным аптекарем Айснером и использовал его лабораторию для опытов. В ходе исследований он выпаривал минеральную воду и анализировал осадки. Вместо селитры в осадке оказалась ранее неизвестная соль, которую он назвал «чудесной» — по латыни «sal mirabile». В частности, название природного минерала мирабилита происходит именно из латинского названия. |
Глауберова соль: применение, дозировка и способ действия
Фото: CC0 / Pixabay / andreas160578
Глауберова соль в основном используется в качестве вспомогательного средства при голодании. Мы покажем вам, как правильно дозировать глауберову соль и какой эффект она оказывает.
Глауберова соль образуется при сочетании хлорида натрия и серной кислоты. Полученный сульфат натрия имеет чрезвычайно горький вкус, поэтому глауберову соль часто приравнивают к английской соли. Хотя оба имеют схожий или идентичный эффект, английская соль представляет собой сульфат магния.
Эффективность и области применения глауберовской соли
Глауберова соль обладает слабительным действием, особенно до Fast , используемого для опорожнения кишечника. Так называемый глаубер должен вымывать из кишечника все остатки пищи. Это также должно уменьшить чувство голода.
Помимо опорожнения кишечника перед голоданием, глауберова соль также подходит для очищения толстой кишки перед колоноскопией. Кроме того, глауберову соль можно использовать в течение коротких периодов времени при сильном запоре можно применять .В лечебных ваннах, например, в бассейнах с рассолом, вы часто найдете растворенную глауберову соль.
Побочные эффекты глауберовской соли
Головные боли могут возникать в результате потери жидкости.
(Фото: CC0 / Pixabay / pheee)
Не принимайте глауберову соль, если вы:
- имеют чувствительный желудочно-кишечный тракт
- Боль в животе
- беременны
- у вас заболевание сердца
- У вас высокое кровяное давление, так как глауберова соль может повышать кровяное давление.
Внимание при приеме противозачаточных таблеток, потому что дефекация может привести к потере их эффективности. Также может быть взаимодействие с другими лекарствами. Из-за ее сильного эффекта вам следует проконсультироваться с врачом по поводу использования глауберовской соли.
Также нужно быть осторожным, чтобы пить достаточно воды. Во время дефекации ваше тело теряет много жидкости, и если он не сбалансирован, может возникнуть головокружение или головная боль.
Правильно используйте глауберову соль
Глауберову соль можно растворить в холодной и теплой воде.
(Фото: CC0 / Pixabay / ExplorerBob)
Поскольку глауберова соль обладает относительно сильным действием, важна правильная дозировка. Обычно вы найдете рекомендацию:
- От двух до четырех чайных ложек глауберовской соли растворить в 250 миллилитрах воды.
- Для чрезвычайно быстрого опорожнения кишечника, особенно перед голоданием, одна-две столовые ложки глауберовской соли растворены в 500 миллилитрах воды.
- Выпейте солевой раствор Глаубера и промойте таким же количеством чистой воды.
Кристаллы соли должны полностью раствориться перед приемом внутрь, поэтому рекомендуется теплая вода. Глауберова соль начинает действовать через 30 минут или только через несколько часов. На всякий случай лучше иметь туалет поблизости и не ходить по магазинам в городе.
Совет против горького вкуса: Добавьте лимонный или апельсиновый сок. Зажмите нос во время питья, чтобы помешать вашим вкусовым сенсорам и не обращать внимания на горький привкус.
Глауберова соль в критике
Часто критика направлена не против глауберовской соли напрямую, а против контекста, в котором соль используется: например, голодание, очищение или очищение глауберовской солью.Уже упомянутые побочные эффекты глауберовской соли показывают, что ее не следует принимать регулярно. Особенно в контексте расстройств пищевого поведения существует высокий риск разрушения кишечника из-за регулярной чистки глауберовской солью.
Поэтому ни в коем случае не рекомендуется регулярное использование глауберовской соли, что также предупреждается на вкладышах в упаковку. Помимо разрушения кишечника, могут быть потеряны такие минералы, как калий, и могут возникнуть долгосрочные сердечные заболевания и мышечная слабость.Повышенное содержание натрия в организме может вызвать отек, поэтому во время беременности требуется особая осторожность.
Если упомянутые побочные эффекты слишком опасны для вас, вы можете использовать клизму в качестве альтернативы дефекации.
Подробнее на Techzle.com:
- Пластиковое голодание: 40 дней без пластика
- Прерывистое голодание: каковы реальные преимущества этого бедренного голодания?
- Тенденция к здоровому питанию: что за этим стоит?
Влияние условий эксперимента на переохлаждение глауберовской соли при использовании в качестве PCM
https: // doi.org / 10.1016 / j.solmat.2012.03.003Получить права и содержаниеAbstract
В данной статье оценивается влияние экспериментальных условий на определение переохлаждения декагидрата сульфата натрия (глауберова соль), образованного безводным и гидратированным тетраборатом натрия ( бура). Эксперименты проводились с помощью дифференциальной сканирующей калориметрии (DSC) и двух других специальных экспериментальных процедур, разработанных авторами, чтобы гарантировать, что небольшие образцы, испытанные с помощью DSC, и большие образцы, испытанные с использованием этих экспериментальных методов, проходят одинаковые или эквивалентные тепловые процессы.Были оценены два типа образцов: первый состоит из декагидрата сульфата натрия с 5% -ным декагидратом тетрабората натрия, второй — 32,3% безводного сульфата натрия, 1,4% безводного тетрабората натрия и остальная вода. Было исследовано влияние на определение переохлаждения экспериментальных условий, таких как скорость охлаждения, максимальная температура нагрева и время выдержки при максимальной температуре. Результаты показывают, что переменные масса / температура / время имеют сложное взаимодействие при достигнутом переохлаждении.В результате метод DSC недооценивает снижение переохлаждения, которое может быть достигнуто в больших массах глауберовской соли путем нуклеации с помощью буры.
Основные моменты
► Мы изучили зародышеобразование и переохлаждение глауберовской соли с помощью буры. ► Максимальная достигнутая температура и время достижения этой температуры определяют переохлаждение. ► Переохлаждение также зависит от размера образца, но не от скорости охлаждения. ► Этими выводами можно объяснить противоречивые результаты других авторов.► Выводы актуальны, если глауберова соль используется в реальных приложениях PCM
Ключевые слова
Материал с фазовым переходом
Глауберова соль
Сульфат натрия
Нуклеация
Borax
Накопители тепловой энергии
(Рекомендуемые статьи)
Просмотреть полный текстCopyright © 2012 Elsevier BV Все права защищены.
Рекомендуемые статьи
Цитирующие статьи
Глауберова соль — New Women’s Mag
Лечебное голодание (помимо духовных соображений) также служит для регенерации кишечника.Для этого в начале лечения голоданием сначала необходимо полностью опорожнить кишечник. Следовательно, первый день голодания должен быть признаком очищения толстой кишки. Помимо довольно неприятной клизмы подходит «глауберова соль». Как действует глауберова соль? «Глауберова соль» названа в честь врача и химика Иоганна Рудольфа Глаубера, который смешал поваренную соль и серную кислоту в начале 17 века. В результате получился сульфат натрия, известный как «глауберова соль».Соль обладает сильным слабительным действием. По крайней мере, через три часа после приема вы можете почувствовать первый эффект (у некоторых он быстрее — примерно через час после приема). Внимание: поскольку позывы к мочеиспусканию будут очень сильными, следующий туалет не должен быть слишком далеко. Поэтому очистку толстой кишки «глауберовской солью» следует перенести на выходные. Также важно, чтобы во время действия вы выпивали больше обычного (около 3 литров) — иначе грозит обезвоживание из-за потери жидкости! Как мне взять глауберову соль? В стакане с 200 до 250 миллилитрами теплой воды положите две-три чайные ложки соли с горкой.ВСЕ кристаллы должны раствориться — это может занять некоторое время. К сожалению, глауберова соль имеет довольно неприятный вкус. Здесь может помочь немного свежего апельсинового или лимонного сока. В любом случае у вас должен быть стакан воды, чтобы быстро смыть резкий привкус. По мнению некоторых экспертов по голоданию, распределение количества может также выглядеть иначе: растворить в трех четвертях литра воды от 20 до 40 граммов глауберовской соли. Однако такое большое количество не следует выпивать за один присест, а распределить по 20 минут. Кому не подходит глауберова соль? Тем, кто страдает пониженным кровяным давлением, сердечной недостаточностью, нарушением функции почек или нервным желудочно-кишечным трактом, ни при каких обстоятельствах не следует начинать лечение голоданием с помощью глауберовской соли. {\ circ} \ mathrm {C} в закрытом контейнере, содержащем образец \ mathrm {Na} _ {2} \ mathrm {SO} _ {4} \ cdot 10 \ mathrm {H} _ {2} \ mathrm {O} (s)? (б) Как следующие изменения влияют на соотношение (выше, ниже, одинаковое) гидратированной формы к безводной для указанной выше системы? (1) Добавьте больше \ mathrm {Na} _ {2} \ mathrm {SO} _ {4} (s) (2) Уменьшите объем контейнера (3) Добавьте больше водяного пара (4) Добавьте \ mathrm {N} _ {2} газ
Стенограмма видео
получали эту реакцию для превращения гидратированной формы любого в eso for в его безводную форму.Нам также сообщили значение константы равновесия K p при температуре 25 градусов Цельсия при той же температуре в части a. Мы хотели получить немца с давлением паров воды, так как у нас есть значение KP, мы можем записать выражение равновесия и видим, что пары H 20 являются единственными газами, образующими газы на стороне продукта этой реакции. Это означает, что KP равно парциальному давлению H 20 в степени 10. И теперь, поскольку мы знаем значение KP, мы можем решить для парциального давления H 20 в системе, которое будет равно давление пара при температуре, при которой нам известно значение K P.Таким образом, парциальное давление H 20 равно корню 10-й степени из КП или КП в степени 1/10 и равно корню 10-й степени из заданного значения КП 4,8 умноженному на 10 до отрицательного 25. И это получается, что давление водяного пара в этой системе составляет 25 градусов Цельсия, что составляет примерно три, 0,64 умноженное на 10, отрицательную третью атмосферу. А теперь, в части B, мы хотим использовать принцип люстр, чтобы определить, будет ли каждое из данных нарушений в системе увеличиваться, уменьшаться или не влиять на соотношение гидратированной формы к безводной форме любых двух s. 04 Итак, это гидратированная форма, и это безводная форма, потому что гидратированная форма имеет те 10, которые связаны с водой.Итак, мы начинаем с номера один и части B. Мы увеличиваем концентрацию любого вещества до твердого вещества S 04. Это наше выражение равновесия. И мы знаем, что КП зависит только от парциального давления каждых 20, и так оно и есть. Это означает, что коэффициент реакции также зависит только от этого. Таким образом, равновесие сместится только в том случае, если мы изменим парциальное давление H 20, поскольку в двухсекундном наборе из четырех единиц будет твердое тело. Если мы добавим его к системе, которая будет знать это, сместим равновесие и, следовательно, не изменим соотношение гидратированной формы к безводной.Номер два, уменьшаем громкость. На стороне реагента этого уравнения у нас есть ноль молей газа, а на стороне продукта у нас есть один моль газа. Если мы уменьшим объем, мы знаем, что это означает, что давление было увеличено, и система отреагирует уменьшением давления. Это можно сделать, сдвинувшись влево, чтобы уменьшить общее количество молей газа. Таким образом, это означает, что в продуктах будет образовываться больше реагентов, причем реактивное вещество имеет гидратированную форму, а сторона продукта — безводную форму.Это означает, что соотношение гидратированной формы к безводной будет увеличиваться. Таким образом, мы увеличиваем соотношение, когда уменьшаемся. Из всех вас номер три мы увеличиваем количество газа H 20. Это означает, что мы увеличиваем парциальное давление H 20. И когда мы это делаем, когда мы увеличиваем это значение и исследуем до степени 10, то результат для коэффициента реакции больше, чем равновесный. Постоянный. Так мило больше, чем K, и это означает, что реакция будет сдвигаться влево, чтобы восстановить равновесие.Итак, когда это снова имеет место, как и в случае номер два для Части B, у нас больше реагентов, чем продуктов, поэтому у нас больше гидратированной формы любого S 04, чем безводных форм. Так что это соотношение снова увеличивается. И число четыре, добавляем мы, и к газу, и к нигде в реакционной системе не появляется. Итак, это инертный газ. Поскольку это газ, он увеличивает давление в системе. Но на равновесие влияет только парциальное давление воды. И мы не изменили этого, добавив инертный газ.Мы только увеличили общее давление, поэтому соотношение гидратированной формы к безводной не изменится, потому что мы не изменили равновесие, добавив инертный
Глобальный рынок глауберовской соли 2017-2021 гг.
ЧАСТЬ 01: ИСПОЛНИТЕЛЬНАЯ ИНФОРМАЦИЯЧАСТЬ 02: ОБЪЕМ ОТЧЕТА
ЧАСТЬ 03: МЕТОДОЛОГИЯ ИССЛЕДОВАНИЯ
9000 ЧАСТЬ ЧАСТЬ 04: ВВЕДЕНИЕ РЫНКА- Обзор рынка
- Объем и прогноз рынка
- Анализ пяти сил
- Глобальный рынок глауберовской соли по конечным потребителям
- Глобальный рынок глауберовской соли по мылу и моющим средствам
- Глобальный рынок глауберовской соли по стеклу
- Глобальный рынок глауберовской соли по бумаге
- Глобальный рынок глауберовской соли по текстилю
- Глобальный рынок глауберовой соли по другим источникам
- Глобальный рынок глауберовской соли по источникам
- Глобальный рынок глауберовской соли по источникам
- Глобальный рынок глауберовской соли т по естественным источникам
- Глобальный рынок глауберовской соли по химическим источникам
- Географическая сегментация
- Сравнение регионов
- APAC — размер рынка и прогноз
- Америка — размер рынка и прогноз
- EMEA — размер рынка и прогноз
- Ключевые страны-лидеры
- Возможности рынка
ЧАСТЬ 10: ДРАЙВЕРЫ И ВЫЗОВЫ
- Движущие силы рынка
- Проблемы рынка
- Появление натриево-ионных батарей (SIB)
- Глауберова соль, используемая для хранения тепловой энергии
- Сценарий конкуренции
- Другие известные поставщики
- Alkim Alkali Kimya
- Jiangsu Jingshen Salt & Chem ical Industry Co.
- АО Кучуксульфат
- ЛЕНЗИНГ
- MINERA DE SANTA MARTA
- Sichuan Meishan Tianhe Chemical Co.
- Sichuan Xinxing Chemical
- XinLi Chemical
Приложение 02: Сегментация глобального рынка глауберовской соли
Приложение 03: Глобальный рынок глауберовской соли 2016-2021 (килотонны)
Приложение 04: Анализ пяти сил
Приложение 05: Глобальный рынок глауберовской соли по конечным потребителям в 2016 г. (% по объему) )
Приложение 06: Глобальный рынок глауберовской соли по конечным потребителям в 2021 г. (% доли по объему)
Приложение 07: Глобальный рынок глауберовской соли по конечным потребителям в 2016-2021 гг. (Доля в% по объему)
Приложение 08: Глобальный рынок глауберовской соли по мыло и моющие средства 2016-2021 (килотонны)
Экспонат 09: Мировой рынок глауберовской соли по стеклу 2016-2021 (килотонны)
Экспонат 10: Мировой рынок глауберовской соли по бумаге 2016-2021 (килот онс)
Приложение 11: Крафт-процесс
Приложение 12: Глобальный рынок глауберовской соли по текстилю 2016-2021 (килотонны)
Приложение 13: Глобальный рынок глауберовской соли по другим странам 2016-2021 (килотонны)
Приложение 14: Глобальный рынок глауберовской соли по источникам 2016 г. (% от объема)
Приложение 15: Глобальный рынок глауберовской соли по источникам 2021 г. (% доли от объема)
Приложение 16: Глобальный рынок глауберовской соли с разбивкой по источникам 2016-2021 гг. (% От объема)
Приложение 17: Глобальная глауберова соль рынок по естественным источникам 2016-2021 (килотонны)
Приложение 18: Глобальный рынок глауберовской соли по химическим источникам 2016-2021 (килотонны)
Приложение 19: Глобальный рынок глауберовской соли — размер рынка и прогноз на 2016-2021 годы (% от объема)
Приложение 20: Сравнение по регионам
Приложение 21: Азиатско-Тихоокеанский регион — размер рынка и прогноз на 2016-2021 гг. (Килотонны)
Приложение 22: Минеральные месторождения сульфата натрия в Азиатско-Тихоокеанском регионе
Приложение 23: Азиатско-Тихоокеанский регион — рост по сравнению с 2017-2021 годами (%)
Приложение 24: Топ-3 страны в Азиатско-Тихоокеанском регионе
E xhibit 25: Америка — размер рынка и прогноз на 2016-2021 гг. (килотонны)
Приложение 26: Минеральные месторождения сульфата натрия в Северной и Южной Америке
Приложение 27: Америка — Годовой рост 2017-2021 (%)
Приложение 28: Наверх 3 страны в Северной и Южной Америке
Приложение 29: EMEA — размер рынка и прогноз на 2016-2021 гг. (Килотонны)
Приложение 30: Минеральные месторождения сульфата натрия в EMEA
Приложение 31: EMEA — Годовой рост 2017-2021 (%)
Приложение 32: 3 ведущие страны в регионе EMEA
Приложение 33: Основные ведущие страны
Приложение 34: Производственные мощности основных поставщиков
Приложение 35: Глобальный рынок глауберовской соли: другие известные поставщики
Приложение 36: Alkim Alkali Kimya: Сегментация бизнеса по выручке 2016 ( % доли)
Приложение 37: Alkim Alkali Kimya: Географическая сегментация по выручке 2016 (доля в%)
Приложение 38: Jiangsu Jingshen Salt & Chemical Industry Co.: Сегментация бизнеса по операционным доходам, 2016 г. (доля в%)
Приложение 39: Компания Jiangsu Jingshen Salt & Chemical Industry Co .: Сегментация продукции по операционным доходам, 2016 г. (доля в%)
Приложение 40: Компания Jiangsu Jingshen Salt & Chemical Industry Co .: Географическая сегментация по операционная прибыль 2016 (доля в%)
Приложение 41: Jiangsu Jingshen Salt & Chemical Industry Co: Соли и промышленные соли
Приложение 42: АО «Кучуксульфат»: продукты
Приложение 43: LENZING: Сегментация бизнеса по выручке 2016 (доля в%)
Приложение 44: Географическая сегментация по выручке 2016 (доля в%)
Приложение 45: Производственные мощности и местонахождение Lenzing Visosis и Lenzing Modal
Приложение 46: MINERA DE SANTA MARTA: Продукция
Приложение 47: Sichuan Meishan Tianhe Chemical Co.: Продукция
Экспонат 48: Сычуань Синьсин Химикат: Продукты
Экспонат 49: Синьли Химикат: Производственные базы
Глауберова соль — DrugFreeHelp.com DrugFreeHelp.com
Цель глауберова соли в наших очищающих средствах — обезвоживать лимфатическую систему, таким образом «выдавливая» каждую последнюю каплю «неприятного» в наш кишечник. Это создает для нас «чистый лист», с которым мы можем работать, поэтому мы хотим использовать свежих соков цитрусовых для регидратации, поскольку они попадают в лимфатическую систему и быстро и полностью восстанавливаются.
Глауберова соль — феноменальный минерал, состоящий из натрия и сульфата. Он растворим в воде, имеет соленый, горький вкус и является важным питательным веществом для каждого из нас. Это важно для производства и здоровья нашего хряща, а также многих других тканей. Это жизненно важный компонент миелиновых мембран нашего мозга. Он свободно фильтруется и интенсивно реабсорбируется (реабсорбируется только хорошее вещество, поэтому мы можем его использовать) почками и часто используется для лечения:
- pH-баланс
- тяжелых металлов
- токсичность
- Лимфатический застой
- вздутие живота
- Боль в животе
- запор
- сухой кал
- ангины
- Аппендицит
- язвы во рту
- красные глаза
- Язвенные карбункулы
- отек
- боль
- воспаление
- ревматизм
- паразитов
- костные шпоры
В дополнение к внутреннему использованию, это также замечательно при местном использовании для:
- Мастит
- Геморрой опухший
- Свинка
- Аскаридоз
- Зуд
- экзема
Раствор глауберовской соли может предотвратить всасывание воды в кишечнике (это означает, что, как только вода попадет в кишечник, токсины, которые она помогала улавливать, не абсорбируются повторно, вы выводите их через кишечник.


 Ч., Эркаев А.У., Якубов Р.Я., Растворимость в системе 2Na+, 2NH4+ // 2Сl—, SО42-–Н2О при 100 °С. / Узб. хим. журн. 2005. № 1. С. 16-20.
Ч., Эркаев А.У., Якубов Р.Я., Растворимость в системе 2Na+, 2NH4+ // 2Сl—, SО42-–Н2О при 100 °С. / Узб. хим. журн. 2005. № 1. С. 16-20.