Как обозначается сульфат: для чего нужны, вред сульфатов, как определить шампунь без сульфатов
для чего нужны, вред сульфатов, как определить шампунь без сульфатов
19.06.2018
Признавайтесь, с каких пор вы заинтересовались составом своего шампуня? Я откровенничаю первая. Очнулась после того, как производители расставили акценты. Среди шампуней, украшенных заманчивыми обещаниями маркетологов, появились средства, скромно помеченные фразой: «Не содержит сульфатов». А ведь это примечание для многих является основным аргументом при покупке! Предлагаю разобраться, нужны ли сульфаты в шампунях, и как лучше – с ними или без них?
Что такое сульфаты
Вспоминаем школьные уроки химии! Сульфаты – это соли серной кислоты. Для производителей косметики они служат эффективным и дешевым компонентом, улучшающим свойства продукции: шампунь с сульфатами отлично пенится, удаляет загрязнения, моет «до скрипа». Такая практичность объясняет популярность солей: сегодня их добавляют и в средства бытовой химии, и в косметику, и в детские зубные пасты.
Надеюсь, вы не подумали, будто я восхваляю сульфаты? Этот компонент неплохо помогает производителям дешевой (а иногда и довольно дорогой) косметики, но может навредить потребителям. Доказанный вред сульфатов в шампунях:
- раздражают кожу головы;
- могут вызывать аллергию;
- провоцируют «пушистость» прически;
- способствуют выпадению волос (при регулярном использовании).
По мнению мнительных граждан, шампунь с сульфатами способен задержать развитие детей и подростков, привести к облысению и даже онкологии. Страшно?
Зачем добавляют эти вредные сульфаты в шампуни
Почему же производители рискуют нашим здоровьем и используют эти страшные компоненты? Да потому что нет подтвержденных данных об их опасности. Никаких заболеваний сульфаты не провоцируют, на функциональность организма не влияют. Зато наделяют косметику прекрасными свойствами.
- Смывают силикон – верного спутника гелей и лаков для укладки.
- Избавляют от перхоти, раскрывая чешуйки волоса и способствуя глубокому проникновению «антиперхотинных» компонентов.

- Отлично пенятся, а потому экономичны в использовании.
- Моментальный блеск, объем, гладкость волос – заслуга химии в косметике. И солей в том числе.
При регулярном использовании сульфаты ослабляют защитные функции кожи, с чем и связаны побочки вроде выпадения волос, электризации, сухости. Но даже эта проблема касается только тех, кто пренебрегает комплексным уходом! Современная косметика напичкана компонентами, нейтрализующими вредные свойства сульфатов. Кстати, это одна из причин, по которой стоит покупать шампунь и кондиционер (или бальзам) одинаковой серии.
Как обнаружить шампуни, не содержащие сульфатов
Вопрос о вреде сульфатов и другой химии в косметике становится все более острым. Некоторые производители даже стесняются наличия солей в своей продукции и тщательно их конспирируют. Но с вами такие уловки не сработают! И если вы намерены купить шампунь без сульфатов, обратите внимание на состав. Соли ищем в первом ряду, на второй или третьей позиции.
Обозначение сульфатов в шампунях (наиболее распространенных):
- SLS (лаурилсульфат натрия). Самый агрессивный, а потому опасный среди своих собратьев.
- SLES (лауретсульфат натрия). Более спокойный сульфат, чем SLS. Но отмывает кожу так же, «до скрипа».
- ALS и ALES – (лаурилсульфат и лауретсульфат аммония). Сульфаты, с которыми точно не стоит связываться. Агрессивные канцерогены легко проникают в организм через кожу.
Как понять, что шампунь без сульфатов? Его состав отличается минимализмом. Здесь нет зашифрованных ПАВ и сопровождающих его нейтрализаторов, а в качестве моющей основы выступают натуральные компоненты – кокосовое масло, кора мыльного дерева, глюкоза (Glucoside) какого-нибудь продукта. Эти ингредиенты отлично заменяют агрессивные соли, но стоят гораздо дороже.
Кому необходим безсульфатный шампунь?
Основываясь на плюсы и минусы сульфатов, вы легко можете определиться с покупкой шампуня. Однако выбор есть не всегда и не у всех: иногда применение безсульфатного средства – необходимость. Связано это с тем, что частички соли разрыхляют волос, вымывая из него все: грязь, химию, средства для укладки, красящие пигменты. Поэтому в случаях, перечисленных ниже, настоятельно рекомендуется использовать только шампуни на натуральной моющей основе.
Однако выбор есть не всегда и не у всех: иногда применение безсульфатного средства – необходимость. Связано это с тем, что частички соли разрыхляют волос, вымывая из него все: грязь, химию, средства для укладки, красящие пигменты. Поэтому в случаях, перечисленных ниже, настоятельно рекомендуется использовать только шампуни на натуральной моющей основе.
- После изменения цвета: окраски, тонирования, мелирования и т. д.
- Если волосы повреждены, секутся или выпадают.
- После ламинирования, кератинового выпрямления, ботокса, химической завивки и долговременной укладки.
- При повышенной чувствительности кожи головы, проявляющейся зудом, покраснениями, стянутостью.
Сульфаты вредны для окружающей природы. А потому всем тем, кто заботится об экологии, тоже придется от них отказаться.
Сульфаты в корейских и японских шампунях
Сегодня найти совершенно натуральную косметику непросто – современные химические компоненты значительно упрощают жизнь и относительно безопасны, так зачем их исключать из производства? Наши азиатские любимчики, пропагандирующие натуральные составы и безопасную косметику, тоже «грешат» добавляем сульфатов в шампуни. Разве это не еще одно подтверждение того, что соли безопасны для здоровья?
Разве это не еще одно подтверждение того, что соли безопасны для здоровья?
Бренды, угождающие самым требовательным клиентам, не могли обойти стороной органические составы. Конечно же, в их ассортименте нашлось место и безсульфатным шампуням:
При переходе с сульфатных шампуней на органику будьте готовы к потере объема и блеска волос. Как только все химические компоненты смоются, к прядкам вернется натуральная красота и здоровье!
Подведем итоги
Теперь вы знаете, каким средствам доверять свои волосы, и как определить шампунь без сульфатов. С вас право выбора, с меня – совет. Не будьте категоричны. Состав шампуня без сульфатов экологичнее, конечно, но справиться с сильными загрязнениями (особенно вызванными средствами для укладки и фиксации волос) не способен. Оптимальный вариант – комбинировать органику и соли. Или отказаться от любой химии, контактирующей с волосами: лаков, гелей, муссов, косметики с силиконами. Лично мне слабо, а вам? 😉
Обзор для вас подготовила я, Воробьева Настя.
Как обозначается сульфат в шампуне? Как понять, что шампунь без сульфатов?
Сегодня натуральная косметика без лишних химических компонентов в составе набирает все большую популярность. Однако часто очень трудно найти достойные ухаживающие средства с безопасным составом. Особенно страдают наши волосы: в составе большинства шампуней множество вредных компонентов вроде сульфатов, парабенов, отдушек. Сегодня мы выясним, как понять, что шампунь без сульфатов, узнаем, какой вред они несут. А также подскажем безопасные по составу средства.
Что такое сульфаты?
Сульфаты — это поверхностно-активные вещества, продукты переработки нефти. Благодаря способности образовывать пену и эффективно удалять жир с поверхностей они очень популярны в косметической промышленности. Лаурет сульфат натрия и лаурил сульфат натрия изобрели во время Второй мировой войны для быстрого очищения танков и прочей военной техники. Однако вскоре стало понятно, что вещества эти можно использовать и в мирное время.
Лаурет сульфат натрия и лаурил сульфат натрия изобрели во время Второй мировой войны для быстрого очищения танков и прочей военной техники. Однако вскоре стало понятно, что вещества эти можно использовать и в мирное время.
Благодаря их дешевизне (в сравнении с натуральной мыльной основой) сегодня сульфаты добавляют в многочисленные косметические средства: шампуни, зубные пасты, гели для душа, пенки для умывания. Общественности давно известно, что эти вещества очень опасны для организма, поэтому знать, как обозначаются сульфаты в шампуне, очень важно.
Вред сульфатов
Конечно, слухи о том, что они способны вызвать онкологические заболевания, несколько преувеличены (если, конечно, их не пить). Однако вред от их использования организм все же испытывает, поэтому важно знать, как обозначаются сульфаты в шампуне. Прежде всего они очень сушат кожу, а при длительном применении могут даже вызвать ее воспаление и выпадение волос. У людей с чувствительной кожей возможно появление аллергической реакции.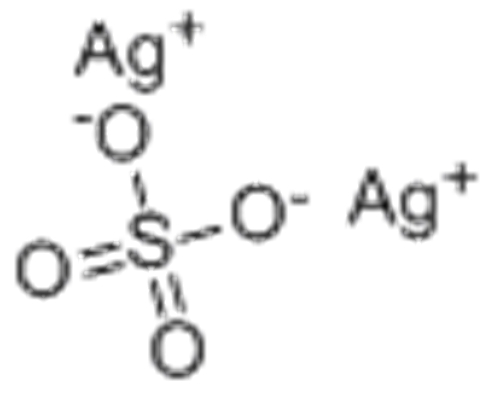
Однако стоит учесть, что серьезный вред коже они наносят в том случае, если концентрация их в составе превышает 2 %. Однако в уходовой косметике зачастую процент содержания этих веществ значительно ниже, несмотря на то что они стоят в строчке на втором месте после воды. То есть при недолгом контакте вред их не столь выражен. Но сухость кожи головы и перхоть вполне могут беспокоить девушек, которые моют голову шампунем с сульфатами ежедневно.
Как обозначаются сульфаты в составе шампуня?
Очень многие производители хитро обманывают покупателей, указывая на упаковке крупным шрифтом, что шампунь не содержит их. Однако если внимательно осмотреть список компонентов, входящих в состав, можно обнаружить их. Но ведь часто покупатели не читают напечатанный мелким шрифтом состав, предпочитая верить производителю.
Однако всегда следует проверять наличие сульфатов самостоятельно. Как обозначается сульфат в шампуне на этикетке? Рассмотрим:
- Sodium Lauryl Sulfate (SLS).

- Sodium Laureth Sulfate (SLES).
- Ammonium Lauryl Sulfate.
- Magnesium Lauryl Sulfate.
- Sodium myreth sulfate.
Вот как обозначается сульфат в шампуне. Зачастую, если шампунь не содержит лаурет сульфат натрия, в его состав входят его производные. Например, лаурет магния сульфат. Конечно, этот компонент менее агрессивен, но производитель сознательно обманывает покупателя, что не внушает доверия. Кроме этого, стоимость такого шампуня может быть значительно выше.
Как обозначаются сульфаты в составе шампуня? Увы, они указаны на упаковке мелким шрифтом — и больше никак не обнаруживают своего присутствия.
Также обратите внимание: если в составе указан sodium coco sulfate, не стоит паниковать. Этот компонент является более мягкой альтернативной вышеназванных, поэтому не вредит коже и самой шевелюре.
Обратите внимание, что на этикетках средств для укладки часто можно встретить пометку, указывающую, что они не содержат сульфатов. Однако это на 100% маркетинговый ход. Так как эти вещества не добавляют в укладочные средства.
Так как эти вещества не добавляют в укладочные средства.
В каких случаях сульфаты нужны?
Они являются эффективными очистителями, которые используют в химической промышленности. Они не только эффективно удаляют слой жира на сковороде, но и отлично очищают жирную кожу головы, слегка подсушивая ее. Поэтому некоторым девушкам не следует отказываться от шампуня с сульфатами. Также они помогают устранить перхоть, возникающую при излишней жирности кожи головы.
Вместо сульфатов
Как понять, что шампунь бессульфатный? В его составе вместо них будут присутствовать другие компоненты, которые эффективно очищают кожу головы. Однако они являются более дорогими аналогами сульфатов, поэтому стоимость таких средств выше.
Внимательно изучив состав бессульфатных шампуней (как понять, что они таковыми являются, указано выше), можно увидеть такие компоненты, как coco glucoside и lauryl glucoside.
Характеристика составляющих
Coco glucoside — это нежный ПАВ для волос, получаемый из мякоти кокоса. Он активно используется в составе шампуней, кремов (в том числе и детских), гелях для душа и для интимной гигиены. Он благоприятно воздействует на волосы, увеличивая их объем и облегчая расчесывание.
Он активно используется в составе шампуней, кремов (в том числе и детских), гелях для душа и для интимной гигиены. Он благоприятно воздействует на волосы, увеличивая их объем и облегчая расчесывание.
Lauryl glucoside — еще один высококачественный ПАВ, изготовленный из натуральных компонентов. Он деликатно ухаживает за кожей и успокаивает ее, добавляет шевелюре объема и отлично очищает грязь.
Кокамидопропилбетаин также нередко встречается в составе бессульфатных шампуней. Это поверхностно-активное вещество также создано на основе кокосового масла. Его отличительным свойством является качественное очищение волос и кожи головы от грязи и жира.
Кроме этого, в составе шампуней без сульфатов также можно встретить натуральные питательные компоненты вроде масла миндального, жожоба и других. Обычно их указывают в начале списка, что указывает на высокую концентрацию продукта в составе косметического средства.
Также можно увидеть в составе натуральные кондиционирующие добавки. Например, бегентримониум метосульфат, который облегчает процесс расчесывания волос.
Например, бегентримониум метосульфат, который облегчает процесс расчесывания волос.
Также в составе шампуней без сульфатов содержатся:
- sodium lauroyl sarcosinate;
- cocamidopropyl betaine;
- potassium cocoyl glycinat или sodium cocoyl glycinate.
Достоинства и недостатки шампуней без сульфата
Обсудив, как узнать, что шампунь бессульфатный, перейдем к плюсам и минусам его. В последнее время натуральная косметика становится все более популярной. Однако многие женщины опасаются использовать для мытья волос натуральные шампуни, так как они плохо пенятся и создается эффект немытых волос. Для более качественного очищения кожи головы рекомендуется наносить такие шампуни дважды. Первое время после смены средства волосы могут казаться безжизненными. Это нормальное временное явление, которое не требует смены шампуня.
Многие отмечают, что вернуть волосам блеск после регулярного использования шампуня с сульфатами очень трудно. Однако уже через месяц применения более натуральной продукции Ph кожи головы восстанавливается, что возвращает волосам блеск и крепость. Они также более полезны для окрашенных волос, так как надолго сохраняют интенсивность оттенка.
Они также более полезны для окрашенных волос, так как надолго сохраняют интенсивность оттенка.
Самые популярные шампуни без сульфатов
- «Натура Сиберика». Один из немногих недорогих шампуней с натуральным составом. Предназначено средство для жирной кожи головы.
- «Рецепты бабушки Агафьи». Еще одна линейка средств для жирной кожи головы. Отличается весьма демократичной ценой.
- Шампунь Loreal Delicate Color сохраняет насыщенный цвет шевелюры после окрашивания, придает волосам упругость.
- Estel Aqua Otium эффективно увлажняет, питает и смягчает локоны.
- Mulsan Cosmetic — недорогая продукция этой марки пользуется особым успехом у женщин благодаря натуральному составу.
- Teknia Gentle Balance содержит аминокислоты и экстракт свеклы, поддерживает волосы в отличном состоянии.
- COCOCHOCO — это израильская марка, которая подходит обладательницам слабых и поврежденных волос.
- AVEDA имеет абсолютно натуральный состав, однако приобрести шампунь этой марки можно только в интернет-магазинах.

- Kapous Professional profound — идеальный выбор для обладательниц жирного и комбинированного типа кожи. Однако средство плохо смывает укладочные средства.
И это далеко не полный состав шампуней, не содержащих сульфатов. Теперь вы знаете, как определить шампуни бессульфатные и какие производители выпускают подобные средства.
Как обозначается сульфат в шампуне- рецепт пошаговый с фото
- 20 Апреля, 2019
- Средства
- Яна Яковенко
Сегодня натуральная косметика без лишних химических компонентов в составе набирает все большую популярность. Однако часто очень трудно найти достойные ухаживающие средства с безопасным составом. Особенно страдают наши волосы: в составе большинства шампуней множество вредных компонентов вроде сульфатов, парабенов, отдушек. Сегодня мы выясним, как понять, что шампунь без сульфатов, узнаем, какой вред они несут. А также подскажем безопасные по составу средства.
Что такое сульфаты?
Сульфаты — это поверхностно-активные вещества, продукты переработки нефти. Благодаря способности образовывать пену и эффективно удалять жир с поверхностей они очень популярны в косметической промышленности. Лаурет сульфат натрия и лаурил сульфат натрия изобрели во время Второй мировой войны для быстрого очищения танков и прочей военной техники. Однако вскоре стало понятно, что вещества эти можно использовать и в мирное время.
Благодаря способности образовывать пену и эффективно удалять жир с поверхностей они очень популярны в косметической промышленности. Лаурет сульфат натрия и лаурил сульфат натрия изобрели во время Второй мировой войны для быстрого очищения танков и прочей военной техники. Однако вскоре стало понятно, что вещества эти можно использовать и в мирное время.
Благодаря их дешевизне (в сравнении с натуральной мыльной основой) сегодня сульфаты добавляют в многочисленные косметические средства: шампуни, зубные пасты, гели для душа, пенки для умывания. Общественности давно известно, что эти вещества очень опасны для организма, поэтому знать, как обозначаются сульфаты в шампуне, очень важно.
Вред сульфатов
Конечно, слухи о том, что они способны вызвать онкологические заболевания, несколько преувеличены (если, конечно, их не пить). Однако вред от их использования организм все же испытывает, поэтому важно знать, как обозначаются сульфаты в шампуне. Прежде всего они очень сушат кожу, а при длительном применении могут даже вызвать ее воспаление и выпадение волос. У людей с чувствительной кожей возможно появление аллергической реакции.
У людей с чувствительной кожей возможно появление аллергической реакции.
Однако стоит учесть, что серьезный вред коже они наносят в том случае, если концентрация их в составе превышает 2 %. Однако в уходовой косметике зачастую процент содержания этих веществ значительно ниже, несмотря на то что они стоят в строчке на втором месте после воды. То есть при недолгом контакте вред их не столь выражен. Но сухость кожи головы и перхоть вполне могут беспокоить девушек, которые моют голову шампунем с сульфатами ежедневно.
Как обозначаются сульфаты в составе шампуня?
Очень многие производители хитро обманывают покупателей, указывая на упаковке крупным шрифтом, что шампунь не содержит их. Однако если внимательно осмотреть список компонентов, входящих в состав, можно обнаружить их. Но ведь часто покупатели не читают напечатанный мелким шрифтом состав, предпочитая верить производителю.
Однако всегда следует проверять наличие сульфатов самостоятельно. Как обозначается сульфат в шампуне на этикетке? Рассмотрим:
- Sodium Lauryl Sulfate (SLS).

- Sodium Laureth Sulfate (SLES).
- Ammonium Lauryl Sulfate.
- Magnesium Lauryl Sulfate.
- Sodium myreth sulfate.
Вот как обозначается сульфат в шампуне. Зачастую, если шампунь не содержит лаурет сульфат натрия, в его состав входят его производные. Например, лаурет магния сульфат. Конечно, этот компонент менее агрессивен, но производитель сознательно обманывает покупателя, что не внушает доверия. Кроме этого, стоимость такого шампуня может быть значительно выше.
Как обозначаются сульфаты в составе шампуня? Увы, они указаны на упаковке мелким шрифтом — и больше никак не обнаруживают своего присутствия.
Также обратите внимание: если в составе указан sodium coco sulfate, не стоит паниковать. Этот компонент является более мягкой альтернативной вышеназванных, поэтому не вредит коже и самой шевелюре.
Обратите внимание, что на этикетках средств для укладки часто можно встретить пометку, указывающую, что они не содержат сульфатов. Однако это на 100% маркетинговый ход. Так как эти вещества не добавляют в укладочные средства.
Так как эти вещества не добавляют в укладочные средства.
В каких случаях сульфаты нужны?
Они являются эффективными очистителями, которые используют в химической промышленности. Они не только эффективно удаляют слой жира на сковороде, но и отлично очищают жирную кожу головы, слегка подсушивая ее. Поэтому некоторым девушкам не следует отказываться от шампуня с сульфатами. Также они помогают устранить перхоть, возникающую при излишней жирности кожи головы.
Вместо сульфатов
Как понять, что шампунь бессульфатный? В его составе вместо них будут присутствовать другие компоненты, которые эффективно очищают кожу головы. Однако они являются более дорогими аналогами сульфатов, поэтому стоимость таких средств выше.
Внимательно изучив состав бессульфатных шампуней (как понять, что они таковыми являются, указано выше), можно увидеть такие компоненты, как coco glucoside и lauryl glucoside.
Характеристика составляющих
Coco glucoside — это нежный ПАВ для волос, получаемый из мякоти кокоса. Он активно используется в составе шампуней, кремов (в том числе и детских), гелях для душа и для интимной гигиены. Он благоприятно воздействует на волосы, увеличивая их объем и облегчая расчесывание.
Он активно используется в составе шампуней, кремов (в том числе и детских), гелях для душа и для интимной гигиены. Он благоприятно воздействует на волосы, увеличивая их объем и облегчая расчесывание.
Lauryl glucoside — еще один высококачественный ПАВ, изготовленный из натуральных компонентов. Он деликатно ухаживает за кожей и успокаивает ее, добавляет шевелюре объема и отлично очищает грязь.
Кокамидопропилбетаин также нередко встречается в составе бессульфатных шампуней. Это поверхностно-активное вещество также создано на основе кокосового масла. Его отличительным свойством является качественное очищение волос и кожи головы от грязи и жира.
Кроме этого, в составе шампуней без сульфатов также можно встретить натуральные питательные компоненты вроде масла миндального, жожоба и других. Обычно их указывают в начале списка, что указывает на высокую концентрацию продукта в составе косметического средства.
Также можно увидеть в составе натуральные кондиционирующие добавки. Например, бегентримониум метосульфат, который облегчает процесс расчесывания волос.
Например, бегентримониум метосульфат, который облегчает процесс расчесывания волос.
Также в составе шампуней без сульфатов содержатся:
- sodium lauroyl sarcosinate;
- cocam >
Обсудив, как узнать, что шампунь бессульфатный, перейдем к плюсам и минусам его. В последнее время натуральная косметика становится все более популярной. Однако многие женщины опасаются использовать для мытья волос натуральные шампуни, так как они плохо пенятся и создается эффект немытых волос. Для более качественного очищения кожи головы рекомендуется наносить такие шампуни дважды. Первое время после смены средства волосы могут казаться безжизненными. Это нормальное временное явление, которое не требует смены шампуня.
Многие отмечают, что вернуть волосам блеск после регулярного использования шампуня с сульфатами очень трудно. Однако уже через месяц применения более натуральной продукции Ph кожи головы восстанавливается, что возвращает волосам блеск и крепость. Они также более полезны для окрашенных волос, так как надолго сохраняют интенсивность оттенка.
Самые популярные шампуни без сульфатов
- «Натура Сиберика». Один из немногих недорогих шампуней с натуральным составом. Предназначено средство для жирной кожи головы.
- «Рецепты бабушки Агафьи». Еще одна линейка средств для жирной кожи головы. Отличается весьма демократичной ценой.
- Шампунь Loreal Delicate Color сохраняет насыщенный цвет шевелюры после окрашивания, придает волосам упругость.
- Estel Aqua Otium эффективно увлажняет, питает и смягчает локоны.
- Mulsan Cosmetic — недорогая продукция этой марки пользуется особым успехом у женщин благодаря натуральному составу.
- Teknia Gentle Balance содержит аминокислоты и экстракт свеклы, поддерживает волосы в отличном состоянии.
- COCOCHOCO — это израильская марка, которая подходит обладательницам слабых и поврежденных волос.
- AVEDA имеет абсолютно натуральный состав, однако приобрести шампунь этой марки можно только в интернет-магазинах.
- Kapous Professional profound — идеальный выбор для обладательниц жирного и комбинированного типа кожи. Однако средство плохо смывает укладочные средства.
И это далеко не полный состав шампуней, не содержащих сульфатов. Теперь вы знаете, как определить шампуни бессульфатные и какие производители выпускают подобные средства.
Выбирая продукцию для мытья головы, потребители сталкиваются с огромным ассортиментом товаров. Производители обещают не только эффективное очищение от загрязнений, но и бережный уход за шевелюрой. Но так ли это? Подавляющее большинство шампуней содержат вредные для организма вещества, самыми обсуждаемыми из которых являются сульфаты.
Мы разберемся, так ли страшны эти компоненты, как о них рассказывают, какие функции они выполняют и чем можно их заменить.
Что такое сульфаты?
Вы наверняка много раз слышали, что сульфаты в шампунях – это одни из наиболее опасных веществ. Средства массовой информации навязывают мнение, что они сказываются негативно не только на состоянии волос, но и на здоровье в целом.
Что же такое сульфаты? Это поверхностно-активные вещества (ПАВы). Именно они наделяют все бытовые продукты (гели для умывания, стиральные порошки, средства для мытья посуды и т.д.) пенящимися свойствами. Еще одними «страшными» врагами организма, по мнению СМИ, являются парабены (paraben). Они обладают фунгицидными и бактерицидными особенностями, выполняют роль консерванта. Изначально компоненты извлекали из настойки брусники и черники, но вскоре научились добывать их из синтетических материалов.
Обозначение сульфатов в составе шампуня
Чтобы распознать «врага» среди десятков других компонентов, указанных на упаковке, нужно знать его обозначение. Всего наиболее широко используется такие:
- содиум лаурилсульфат (sodium laurel sulfate) или SLS, еще его называют лаурил сульфатом натрия – это продукт переработки нефтяной промышленности, который недобросовестные производители могут обозначать как «полученный из масла кокоса»;
- амониум лаурил сульфат (ammonium lauryl sulfate) или ALS, другое название которого – лаурет сульфат аммония (ammonium laureth sulfate или) или ALES, обладает высокими моющими, очищающими, смачивающими и жирорастворяющими свойствами.
Первую пару компонентов используют в более дорогих шампунях, а вторую – в дешевых, так как она требует меньших затрат на производство. Обозначение всегда указывается на упаковке. Чем ближе к началу списка вещества, тем больше их содержится в продукте.
Встречаются такие химикаты даже в зубных пастах, потому нужно внимательно изучать информацию о составе любой косметики.
Вред и польза
О вреде сульфатов и парабенов в шампунях написано множество статей, проведено масса исследований, которые опровергают или подтверждают смертельный риск использования косметики.
Научно доказано, что отрицательное воздействие на организм вещества не оказывают, если правильно использовать средства, в состав которых они входят. Сульфаты начинают негативно влиять, если их в косметике содержится от 2%. На современном рынке таких средств просто не существует, так как их применение в разных сферах строго ограничено.
Кроме того, химические соединения имеют и некоторые положительные стороны:
- помогают создавать плотную пену;
- хорошо справляются с жиром, выделяемым сальными железами;
- устраняют все виды загрязнений;
- не оказывают вреда на организм и локоны при невысокой концентрации в средствах и полном их смывании с головы.
Если хотя бы на один из сульфатов у вас есть аллергия, негативная реакция 100% обеспечена. Также вредными компоненты могут быть в случае их высокой концентрации (шампуни для жирных волос), или когда вы не до конца смываете их с кожного покрова и локонов.
В таком случае, соединения проникают через дерму в кровь, накапливаются и могут вызвать следующие негативные реакции:
- аллергия;
- сухость кожи головы, зуд, шелушение, и, как следствие, – перхоть;
- истощение фолликул и выпадение волос;
- иссушение локонов, повышение их ломкости, сечение кончиков;
- падение местного и общего иммунитета;
- повышение жирности в районе корней, что приводит к более частому мытью головы;
- проблемы с печенью, так как все химикаты выводятся именно через нее.
Чем заменить?
Многие задаются вопросом о том, зачем использовать опасный продукт, если есть полностью безвредные натуральные аналоги? Действительно, на полках специализированных магазинов можно найти органическую косметику, в которой вместо агрессивных ПАВов применяются диглицериды и моноглицериды, а вместо парабенов – лимонная и сорбиновая кислота.
Такие шампуни отлично подойдут аллергикам, девушкам с очень ослабленными и ломкими локонами, людям с серьезными системными заболеваниями.
Рассмотрим список средств, которыми заменять химические составы просто и полезно.
Kapous
Шампуни знаменитого производителя профессиональной косметики для ухода за волосами используют не только дома, но и в салонах. Они не содержат агрессивных химикатов, которые могут накапливаться в локонах и организме, не нарушают естественный pH кожи головы, снижают к минимуму риск возникновения перхоти и выпадение локонов.
В составе есть битоин – витамин, который запускает производство кератина и синтез белка. В линейке представлены шампуни для различных потребностей волос, они экономично расходуются, имеют приятный аромат и не вредят здоровью.
Vitamino Color от L’Oreal
Средство от «Лореаль» было разработано для салонного применения, но может использоваться и в домашних условиях. Производители решили создать продукт, который подойдет для слишком чувствительной кожи головы, также он позаботится о шевелюре людей, склонных к аллергии.
В состав входят только безвредные и мягкие моющие вещества, они деликатно удаляют пыль, загрязнения и кожный жир, но не нарушают обменные процессы в дерме.
Специалистам удалось сделать бессульфатный шампунь, который хорошо пенится, что немаловажно для потребителей. После него шевелюра становится мягкой, гладкой и ухоженной, перестают путаться кончики.
Shwarzkoph
В линейке знаменитой марки есть два средства, не содержащие вредных компонентов. Если ваши локоны поддавались окрашиванию перманентными составами или выпрямлению, стоит остановить выбор на Bonacure Color Freeze Sulfate-Free Shampoo. Он поможет предотвратить разрушение локонов, вернет им жизненные силы, блеск и здоровье.
Еще одним средством для девушек, которые мечтают дольше носить яркий и насыщенный цвет, является Essensity Color & Moisture Shampoo. Шампунь увлажняет пряди и кожу головы, препятствует выведению влаги из внутренних структур, укрепляет корни, «запечатывает» пигменты и не дает им вымываться.
Nature Siberica
Отечественная марка предлагает сравнительно недорогие, но качественные товары, в состав которых не входят вредные вещества. Натуральная косметика не вызывает аллергию, она оказывает исключительно положительное воздействие на локоны и кожу головы.
Состав всех шампуней обогащен вытяжками и экстрактами сибирских лекарственных трав. Считается, что сырье, выращенное в суровых условиях, имеет более высокую концентрацию полезных веществ.
В коллекции есть средства, подходящие для решения различных проблем:
- восстанавливающие для ослабленных волос;
- регулирующие работу сальных желез для устранения эффекта «грязной головы»;
- восстанавливающие поврежденные после окрашивания локоны.
«Рецепты бабушки Агафьи»
Еще один отечественный бренд, что предлагает доступную замену импортным гипоаллергенным средствам. В составе нет веществ, которые могут раздражать кожу, нарушать природную структуру локонов или накапливаться в организме, провоцируя серьезные проблемы. Вместо них производители обогатили шампуни растительными экстрактами, витаминными комплексами, натуральными маслами, фруктовыми кислотами и ферментами.
При регулярном применении шевелюра становится здоровой, приобретает объем и блеск, пропадают проблемы с укладкой и расчесыванием, прядки меньше выпадают.
Особенности использования
Прежде чем перейти на бессульфатные шампуни, задумайтесь, сможете ли вы это сделать без дискомфорта. Дело в том, что замена химических компонентов натуральными – это некий стресс для локонов. Вначале вы заметите, что загрязнения удаляются намного хуже, голову приходится намыливать несколько раз.
После мытья волосы не будут гладкими и послушными, им нужно определенное время, чтобы восстановиться. Ваша сульфатная косметика давала столь яркие результаты, так как действовала лишь на поверхности прядей, а натуральные продукты лечат их изнутри.
При смене моющих составов, будьте готовы столкнуться со следующими нюансами:
- Плохое намыливание – чтобы состав лучше пенился, хорошо намочите голову, влейте необходимое количество шампуня в руку, разведите водой до образования пузырьков и только тогда распределите его на прядях и коже головы.
- Плохой результат мытья – бессульфатные средства не смывают кожное сало так хорошо, как химические аналоги, потому ими сложно пользоваться, если у вас склонные к жирности волосы.
- Невозможность смыть масляную маску – для выполнения этой задачи лучше воспользоваться обычным шампунем для глубокого очищения.
- Жесткость прядей – с этим явлением девушки встречаются в начале знакомства с бессульфатной косметикой. Поскольку в ней нет силикона и других утяжеляющих компонентов, локоны сразу могут выглядеть неопрятно. Избежать этого поможет ополаскивание в подкисленной яблочным уксусом воде.
Подытожим
Несмотря на все трудности, с которыми можно столкнуться при переходе на натуральную косметику, со временем она даст потрясающие результаты. Когда пряди полностью восстановятся, вы заметите, насколько сильными и блестящими они стали. Отпадет надобность в регулярных салонных процедурах для регенерации и защиты, которые не всегда так полезны, как о них рассказывают, и имеют довольно высокую стоимость.
Кроме того, натуральные шампуни – это отличная инвестиция в здоровье, они не приведут к возникновению тяжелых заболеваний через несколько лет. Пользуйтесь только проверенными и качественными продуктами для красоты шевелюры.
Признавайтесь, с каких пор вы заинтересовались составом своего шампуня? Я откровенничаю первая. Очнулась после того, как производители расставили акценты. Среди шампуней, украшенных заманчивыми обещаниями маркетологов, появились средства, скромно помеченные фразой: «Не содержит сульфатов». А ведь это примечание для многих является основным аргументом при покупке! Предлагаю разобраться, нужны ли сульфаты в шампунях, и как лучше – с ними или без них?
Что такое сульфаты
Вспоминаем школьные уроки химии! Сульфаты – это соли серной кислоты. Для производителей косметики они служат эффективным и дешевым компонентом, улучшающим свойства продукции: шампунь с сульфатами отлично пенится, удаляет загрязнения, моет «до скрипа». Такая практичность объясняет популярность солей: сегодня их добавляют и в средства бытовой химии, и в косметику, и в детские зубные пасты.
Надеюсь, вы не подумали, будто я восхваляю сульфаты? Этот компонент неплохо помогает производителям дешевой (а иногда и довольно дорогой) косметики, но может навредить потребителям. Доказанный вред сульфатов в шампунях:
- раздражают кожу головы;
- могут вызывать аллергию;
- провоцируют «пушистость» прически;
- способствуют выпадению волос (при регулярном использовании).
По мнению мнительных граждан, шампунь с сульфатами способен задержать развитие детей и подростков, привести к облысению и даже онкологии. Страшно?
Зачем добавляют эти вредные сульфаты в шампуни
Почему же производители рискуют нашим здоровьем и используют эти страшные компоненты? Да потому что нет подтвержденных данных об их опасности. Никаких заболеваний сульфаты не провоцируют, на функциональность организма не влияют. Зато наделяют косметику прекрасными свойствами.
- Смывают силикон – верного спутника гелей и лаков для укладки.
- Избавляют от перхоти, раскрывая чешуйки волоса и способствуя глубокому проникновению «антиперхотинных» компонентов.
- Отлично пенятся, а потому экономичны в использовании.
- Моментальный блеск, объем, гладкость волос – заслуга химии в косметике. И солей в том числе.
При регулярном использовании сульфаты ослабляют защитные функции кожи, с чем и связаны побочки вроде выпадения волос, электризации, сухости. Но даже эта проблема касается только тех, кто пренебрегает комплексным уходом! Современная косметика напичкана компонентами, нейтрализующими вредные свойства сульфатов. Кстати, это одна из причин, по которой стоит покупать шампунь и кондиционер (или бальзам) одинаковой серии.
Как обнаружить шампуни, не содержащие сульфатов
Вопрос о вреде сульфатов и другой химии в косметике становится все более острым. Некоторые производители даже стесняются наличия солей в своей продукции и тщательно их конспирируют. Но с вами такие уловки не сработают! И если вы намерены купить шампунь без сульфатов, обратите внимание на состав. Соли ищем в первом ряду, на второй или третьей позиции.
Обозначение сульфатов в шампунях (наиболее распространенных):
- SLS (лаурилсульфат натрия). Самый агрессивный, а потому опасный среди своих собратьев.
- SLES (лауретсульфат натрия). Более спокойный сульфат, чем SLS. Но отмывает кожу так же, «до скрипа».
- ALS и ALES – (лаурилсульфат и лауретсульфат аммония). Сульфаты, с которыми точно не стоит связываться. Агрессивные канцерогены легко проникают в организм через кожу.
Как понять, что шампунь без сульфатов? Его состав отличается минимализмом. Здесь нет зашифрованных ПАВ и сопровождающих его нейтрализаторов, а в качестве моющей основы выступают натуральные компоненты – кокосовое масло, кора мыльного дерева, глюкоза (Glucoside) какого-нибудь продукта. Эти ингредиенты отлично заменяют агрессивные соли, но стоят гораздо дороже.
Кому необходим безсульфатный шампунь?
Основываясь на плюсы и минусы сульфатов, вы легко можете определиться с покупкой шампуня. Однако выбор есть не всегда и не у всех: иногда применение безсульфатного средства – необходимость. Связано это с тем, что частички соли разрыхляют волос, вымывая из него все: грязь, химию, средства для укладки, красящие пигменты. Поэтому в случаях, перечисленных ниже, настоятельно рекомендуется использовать только шампуни на натуральной моющей основе.
- После изменения цвета: окраски, тонирования, мелирования и т. д.
- Если волосы повреждены, секутся или выпадают.
- После ламинирования, кератинового выпрямления, ботокса, химической завивки и долговременной укладки.
- При повышенной чувствительности кожи головы, проявляющейся зудом, покраснениями, стянутостью.
Сульфаты вредны для окружающей природы. А потому всем тем, кто заботится об экологии, тоже придется от них отказаться.
Сульфаты в корейских и японских шампунях
Сегодня найти совершенно натуральную косметику непросто – современные химические компоненты значительно упрощают жизнь и относительно безопасны, так зачем их исключать из производства? Наши азиатские любимчики, пропагандирующие натуральные составы и безопасную косметику, тоже «грешат» добавляем сульфатов в шампуни. Разве это не еще одно подтверждение того, что соли безопасны для здоровья?
Бренды, угождающие самым требовательным клиентам, не могли обойти стороной органические составы. Конечно же, в их ассортименте нашлось место и безсульфатным шампуням:
При переходе с сульфатных шампуней на органику будьте готовы к потере объема и блеска волос. Как только все химические компоненты смоются, к прядкам вернется натуральная красота и здоровье!
Подведем итоги
Теперь вы знаете, каким средствам доверять свои волосы, и как определить шампунь без сульфатов. С вас право выбора, с меня – совет. Не будьте категоричны. Состав шампуня без сульфатов экологичнее, конечно, но справиться с сильными загрязнениями (особенно вызванными средствами для укладки и фиксации волос) не способен. Оптимальный вариант – комбинировать органику и соли. Или отказаться от любой химии, контактирующей с волосами: лаков, гелей, муссов, косметики с силиконами. Лично мне слабо, а вам?
Обзор для вас подготовила я, Воробьева Настя. Всем спасибо за внимание и… скоро обсудим парабены с силиконами! =)
Сульфаты. Действительно ли они так страшны?
Действительно ли сульфаты настолько вредны?
Растущая популярность «CLEAN BEAUTY» вместе с поразительной живучестью мифов о косметике поспособствовала распространению мнений о небезопасности и даже вредности компонентов, которые можно найти в большинстве составов косметических средств. В косметической индустрии маркировку «SLS-free» сегодня используют как оберег от падения продаж. Мы попытались разобраться, откуда взялась народная нелюбовь к этим веществам и существуют ли причины не доверять им с точки зрения косметической химии.
Сульфаты — что это?
К сульфатам относится класс химических веществ, обладающих выраженными очищающими и вспенивающими свойствами. В ежедневном использовании человеком многие продукты содержат сульфаты. Среди них — шампуни и зубные пасты, пенки для умывания и гели для душа. А еще — средства для мытья пола, гели для чистки ковров и другая бытовая химия.
Кому помешали сульфаты и почему на них ополчились все?
Если вы любите облачко воздушной пены, которое создает ваш любимый шампунь, в нем наверняка содержатся сульфаты. Ведь так работают именно они.
Сульфаты
На этикетке шампуней эти вещества обозначаются следующим образом:
- SLS – лаурилсульфат натрия (sodium lauryl sulfate) или SDS додецилсульфат натрия (sodium dodecyl sulfate) – обладает наиболее сильной очищающей способностью по сравнению с другими солями и тем самым имеет наибольшую степень раздражения кожи)
- SLES – лауретсульфат натрия (sodium laureth sulfat) и ALS – (ammonium laureth sulfate) – лаурет сульфат аммония (считаются менее агрессивными и более щадящим к защитным барьерам кожи).
Почему сульфаты ругают?
Молекулы любого ПАВ могут встраиваться в липидный барьер кожи и ослаблять его, делать проницаемым. Анионные ПАВ, такие как SLS и SLES, делают это особенно агрессивно: естественный барьер становится „решетом“, повышается потеря влаги. Это приводит к шелушению, раздражению и обезвоженности кожи».
Комиссия CIR (Cosmetic Ingredients Review) – организации, занимающейся проверкой безопасности косметических ингредиентов), исследовала оба ингредиента:впервые в 1983-м и повторно в 2002 году. Эксперты выяснили, что SLS и SLES могут раздражать кожу, если будут находиться на ней в высокой концентрации продолжительное время. Воздействие раствора SLS в концентрации свыше 2 % в течение суток может увеличить трансэпидермальную потерю влаги рогового слоя кожи и вызвать лёгкое, но обратимое воспаление. Чем выше концентрация сульфатов и чем дольше они остаются на коже, тем вероятнее раздражение. Также они обнаружили, что при продолжительном использовании лаурил сульфат натрия провоцирует комедоны у кроликов, серьёзные изменения на коже и повреждение волосяных фолликулов у крыс. Авторы исследования, опубликованного в Journal of Toxicology and Environmental Health, считают, что основную проблему — раздражение глаз и кожи под влиянием SLS — можно решить правильной разработкой формул и соответствующих испытаний.
Важные правила: кто должен избегать сульфатов.
Сульфаты в шампунях для волос основательно очищают пряди и кожу головы, но для того, чтобы локоны были здоровыми, им требуется немного естественной влаги и жиров. Давно известно, что сальной секрет, который производит кожа головы, является защитной смазкой для волос: он предупреждает их обламывание и истончение, уменьшает последствия разрушительного воздействия солнечных лучей, и многое другое. Лишаясь его, волосы остаются беззащитными перед агрессивной средой, становятся тусклыми и ломкими. При частом применении сульфаты сушат волосы и кожу головы, могут вызвать раздражение кожных покровов.
По большей части действие сульфатного шампуня на волосы и кожу головы мягкое, и часто потребители с удовольствием им пользуются, не замечая каких-либо недостатков. Люди с жирными волосами вообще могут отметить, что средства с сульфатами являются единственными, которые хорошо очищают их волосы, помогают сделать их послушными и податливыми к укладке. Тем не менее, некоторым потребителям от сульфатных средств все же стоит держаться подальше.
В первую очередь речь идет о людях с чувствительной кожей головы. Регулярное использование сульфатов может привести к сухости и обезвоженности чувствительных покровов, стать причиной раздражения и появления воспалительных элементов. Таким людям нужны максимально мягкие очищающие средства.
Такие же рекомендации эффективны и для обладателей сухих, вьющихся волос. Их локоны и так уязвимы, а сульфаты в косметике дополнительно будут их подсушивать.
Потребители, имеющие заболевания, как экзема и псориаз, также должны обходить стороной сульфаты. После использования шампуней с ними в составе у них может появиться зуд кожи головы, покраснение и даже микротрещинки.
Сомнительна польза бьюти-продуктов с сульфатами и для людей с окрашенными волосами, а также тех, кто делал химическую завивку, кератиновое выпрямление волос, ботокс, ламинирование и другие популярные процедуры на основе химических составов. Шампуни с сульфатами быстрее смывают краску и составы с волос, из-за чего эффект процедур держится заметно меньше времени.
В бессульфатных шампунях сульфаты заменяются следующими ПАВ:
- Coco Glucoside (кокоглюкизид) – имеет частично натуральное происхождение из масла кокоса и кукурузного крахмала, обладает низким раздражающим действием.
- Sodium Cocoyl Glutamate (натрия кокоилглутамат) – соль глутаминовой кислоты, не обладает сильным пенообразующим свойствами, но имеет сильные кондиционирующие свойства.
- Disodium Cocoamphodiacetate(кокоамфодиацетат динатрия) – анионный ПАВ, устраняет влияние раздражающего действия других ПАВ. Применяется в производстве средств ухода для маленьких детей, что говорит о его щадящих свойствах. Мягко ухаживает за кожей и не раздражает слизистые оболочки.
- Cocamidopropyl Betaine (кокамидопропил бетаин) – уменьшает агрессивное раздражающее действие других ПАВ, обладает антистатическими свойствами. Основой получения натрия кокоил глутамата является натуральная или синтетическая кокосовая (лауриновая) кислота.
- PEG-7 Glyceryl Cocoate (глицерин кокоат)-натуральное производное глюкозы, эффективный загуститель, обладает эмульгирующими свойствами.
- Disodium Alkyl Sulfosuccinate (динатрия лаурет сульфосукцинат) – это соль янтарной кислоты, а не серной. Молекула сульфосукцината намного крупнее, чем других ПАВ. Благодаря этому сукцинат не может проникать в кожные покровы. Даже в больших количествах он не является токсичным.
- Cocamide MEA (моноэтаноламид жирных кислот) – является неионным поверхностно-активным веществом. Также производится из кокосового масла. Экологически безвреден, отличается высокой степенью распада (до 97%).
Это ПАВы, по строению ближе к природным, по функциональности – более мягкие То, что бессульфатный шампунь не пенится вовсе, – это миф. Чтобы добиться плотной и густой пены, смывающей любые загрязнения, достаточно перед нанесением средства на волосы смешать нужное его количество с водой. Если же на вашей прическе слишком много лака или любой другой стайлинг-косметики, предварительно сполосните волосы под душем в течение одной минуты. И тогда шампунь даст очень обильную и крепкую пену с первого применения, промывая волосы «до скрипа».
Только Вы сможете сделать свой выбор.
Что такое лаурилсульфат натрия и натуральные альтернативы моющим средствам с SLS
Латинская аббревиатура SLS обозначает лаурилсульфат натрия (sodium lauryl sulfate) — поверхностно-активное вещество (ПАВ), который используется в моющих средствах как пенообразователь. Информация противоречива: SLS вреден или нет? Разбираемся в нюансах.
Лаурилсульфат натрия помогает пениться моющим средствам, эффективно расщепляет жир и борется с загрязнениями. Он содержится во многих шампунях, гелях для душа и других моющих средствах.
Вреден ли он? Короткий ответ — нет, не вреден. Однако и не полностью безопасен.
Недоказанный вред
Самый живучий миф об SLS — это связь лаурилсульфата натрия с возникновением рака. Но, согласно данным Американской онкологической ассоциации, это именно миф, не более. Не существует исследований, которые с достаточной степенью достоверности демонстрируют зависимость развития раковых образований от контактов с SLS. Иными словами, можно с достаточной степенью уверенности утверждать, что в большинстве ситуаций для большинства людей пенообразователь лаурилсульфат натрия безопасен.Однако «безопасен» еще не означает «полезен».
Результаты тестов показывают, что SLS может вызывать раздражение кожи и волос, сушит кожу и — при больших концентрациях и длительном контакте с кожей — может приводить к появлению экземы и разрушению кератина — строительного вещества наших волос. Важно понимать, что все эти результаты показали подобные эффекты только при повышенной концентрации и достаточно продолжительном контакте с SLS. Однако в реальной жизни такой уровень концентрации и время воздействия лаурилсульфата натрия едва ли встречается — едва ли кто-то держит гель для душа на коже больше часа.
Как обезопасить себя от вредного воздействия SLS?
- Во-первых, не рекомендуется использовать средства с SLS детям и людям с чувствительной кожей.
- Во-вторых, SLS-содержащие моющие средства, шампуни, гели для душа и проч. не рекомендуются людям с аллергией на SLS, а также его «родственников» SLES (лауретсульфат натрия) и ALS (лаурилсульфат аммония).
- В-третьих, при мытье посуды и работе с бытовой химией рекомендуется использовать резиновые перчатки — это защитит кожу рук от сухости и раздражения.
- Наконец, рекомендуем по максимуму использовать моющие средства без SLS
Натуральные альтернативы SLS
Существуют натуральные поверхностно-активные вещества, которые также образуют пену, но не вызывают аллергии и меньше сушат кожу. В частности, натриевые соли жирных кислот — основа для твердого туалетного и хозяйственного мыла — это натуральный пенообразователь, который подходит аллергикам и людям с чувствительной кожей.На многих продуктах, не содержащих лаурилсульфат натрия, стоит маркировка «Без SLS». Кроме того, всегда можно проверить эту информацию, прочитав состав моющего средства — в нем не должно быть sodium lauryl sulfate, sodium laureth sulfate и ammonium laurel sulfate.
Хозяйственное мыло НМЖК не одержит SLS. Оно пенится благодаря входящим в его состав натриевым солям жирных кислот, которые при контакте с водой образуют пену. Это мыло подходит для аллергиков и тех, кто решил минимизировать использование средств с лаурилсульфатом натрия. Мыло «Отбеливающее» и «Против пятен» подходят для стирки. состав мыла «Отбеливание» входят активные компоненты, помогающие сохранить белизну ткани и вернуть ее потускневшим белым вещам. В состав мыла «Против пятен» входят активные компоненты, удаляющие пятна красящих напитков (чая, кофе, соков, красного вина), фруктов, овощей, травы, жирные пятна и т.д. Оба продукта производятся в соответствии с ГОСТ.
Почему не нужно бояться «страшных» ингредиентов — Wonderzine
Парабены — химические вещества, которые используют как консерванты и пищевые добавки. В косметике, средствах личной гигиены и продуктах питания они выполняют роль предохранителя: не допускают, чтобы в массе появились микробы, плесень и дрожжи. Без парабенов косметика превратится в забродившее болото в течение нескольких часов. В начале
80-х группа по обзору косметических ингредиентов (CIR) проверила безопасность метил-, этил-, пропил- и бутилпарабенов и пришла к выводу, что для человека они безвредны.
«Парабены есть в разной косметике: в губной помаде, туши для ресниц и консилере, в санскрине, в зубной пасте, — рассказывает Алина Баева, косметический химик и основатель бренда Bjarmia. — Война с этими консервантами началась в 2004 году, после публикации исследования, авторы которого обнаружили следы парабенов в некоторых образцах опухолей рака молочной железы. С тех пор парабены засели в чёрных списках экоблогеров, а производители оперативно вывели их из рецептур, чтобы не будить лихо и не навлекать на себя гнев покупателей».
Результаты исследования 2004 года показали, что у парабенов есть эстрогеноподобные свойства. Эстрогены — это гормоны, которые вызывают рост и деление клеток молочной железы, как нормальных, так и злокачественных. Некоторые состояния женского организма (поздняя менопауза, резкий набор веса, отсутствие детей) могут увеличивать воздействие эстрогена на организм, а это связано с повышенным риском развития рака молочной железы. Этот факт и обеспокоил учёных. Тем не менее науке известно, что даже у самого «сильного» из парабенов — бутилпарабена — слабая эстрогеноподобная активность (в десятки тысяч раз ниже, чем активность эстрогенов, которые вырабатываются в человеческом организме). Поэтому природные эстрогены (или те, которые взяты в качестве замены гормонов) вероятнее сыграют в развитии рака молочной железы, потому что их активность во много раз выше, чем у парабенов.
Чего не должно быть в составе шампуня
Факт: большинство девушек выбирают шампуни по надписям на этикетке, по рекомендации подруги или любимого beauty-блогера. Тех, кто заморачивается над составом и пристально изучает перечень ингредиентов, указанных на этикетке, – единицы. Кому-то лень тратить время, чтобы прочесть порядка 30-40 наименований в составе, а для многих они звучат как марсианский язык. Однако составить список компонентов, которые могут навредить шевелюре и коже головы, и сверяться с ним при покупке шампуня – несложная задача, которая поможет каждому бьютиголику отрастить локоны мечты.
СиликоныЭти вещества в составе шампуня обеспечивают непревзойденное сияние, блеск и прекрасное расчесывание волос. Звездные hair-стилисты используют шампуни с силиконами, когда готовят своих подопечных к выходу на красную дорожку. Но это позволительный способ для достижения wow-эффекта: в случае регулярного использования силиконы делают волосы тусклыми, неопрятными на вид, утяжеляют их и создают «парниковый» эффект на коже головы. Силиконы маскируются под множеством нечитаемых для обычного взгляда названий: Trideceth-12, Dimethicone copolyol, Dimethicone copolyol/HWP, Hydroxypropyl, StearoxyDimethicone, Cetearylmethicone, CetylDimethicone, Cyclomethicone, Cyclopentasiloxane, Dimethicone, Dimethiconol, StearylDimethicone, AminopropylDimethicone, AminoFunctionalSilicones, Polysiloxane, Laurylmethiconecopolyol, Amodimethicone, BehenoxyDimethicone.
КокамидыКокамиды, которые чаще всего обозначаются производителями как Cocamide MEA, DEA или TEA, необходимы для густой текстуры шампуня и образования пышной пены во время мытья головы. В составе этих химических соединений присутствует аммиак, который сильно раздражает кожу головы, а волосы делает очень сухими, ломкими и тусклыми.
Минеральные маслаК минеральным маслам относят жидкие парафины и вазелины, которые образуют непроницаемую пленку на поверхности волос и кожи головы. Эти продукты нефтепереработки обозначают обычно как Mineral Oil и Paraffinum Liquidum. Всемирная организация здравоохранения относит минеральные масла к первой группе канцерогенных веществ – делайте выводы сами.
BHA и BHTПроизводители добавляют Butylated Hydroxyanisole (BHA) и Butylated Hydroxytoluene (BHT) для нейтрализации свободных радикалов в волосах, однако они могут накапливаться в тканях и способствовать возникновению рака. По этой причине во многих странах Евросоюза эти компоненты находятся в списке запрещенных.
Сульфаты SLS и SLESСульфаты SLS и SLES на этикетках шампуней – это очень агрессивные поверхностно-активные вещества с жирорастворимыми, пенообразующими и сильными очищающими свойствами. Например, Sodium lauryl sulfate, или SLS, – продукт нефтепереработки, который относится к дешевым и эффективным обезжиривающим средствам. Использование шампуня с его содержанием нарушает защитный барьер кожи, становится причиной появления сухости, шелушений, раздражений и сухой перхоти. Сульфат Sodium laureth sulfate, или SLES, ученые называют потенциальным канцерогеном, который за счет способности легко проникать в организм и накапливаться в нем может привести к развитию онкозаболеваний, нарушениям обмена веществ и гормональной системы, а также выпадению волос.
«Неконтролируемое количество SLS нарушает PH кожи головы и очень сильно сушит, твёрдые парафины и минеральные масла покрывают ее пленкой и могут закупоривать поры, силиконы могут вызывать комедоны и воспаления, этилендиаминтетрауксусная кислота может вызывать нарушения в репродуктивной системе», – дополняет специалист по реабилитации волос и кожи головы с 12-летним стажем Юлия Седлецкая.
Читайте также: Почему не стоит наносить аромат на волосы
Читайте также: Уход за волосами: правда или миф
Читайте также: 10 натуральных масел от выпадения волос
применений, дозировка, побочные эффекты, взаимодействия, предупреждение
ПРЕДУПРЕЖДЕНИЯ
Сульфат магния (инъекция сульфата магния (инъекция сульфата магния)) следует вводить очень осторожно при наличии серьезных нарушений функции почек, поскольку он почти полностью выводится почками.
Основная опасность парентеральной терапии магнием — это производство аномально высоких уровней магния в плазме. Такие высокие уровни могут вызвать покраснение кожи, потоотделение, гипотонию, нарушение кровообращения и угнетение функции сердца и центральной нервной системы.Самая непосредственная опасность для жизни — угнетение дыхания.
В период парентеральной терапии солями магния необходимо тщательное наблюдение за пациентом. Препарат кальция, такой как глюконат или глюцептат, должен быть под рукой для внутривенного введения в качестве противоядия.
При тяжелой почечной недостаточности не следует вводить более 20 граммов магния в течение 48 часов. Однако при эклампсии почечная функция серьезно не нарушается, и магний может выводиться быстрее.
Этот продукт содержит алюминий, который может быть токсичным. Алюминий может достигать токсических уровней при длительном парентеральном введении, если функция почек нарушена. Недоношенные новорожденные особенно подвержены риску, потому что их почки незрелые и им требуется большое количество растворов кальция и фосфата, которые содержат алюминий.
Исследования показывают, что пациенты с нарушением функции почек, в том числе недоношенные новорожденные, которые получают парентерально уровни алюминия более 4-5 мкг / кг / день накапливают алюминий на уровнях, связанных с центральной нервной системой и костями токсичность.Нагрузка на ткани может происходить даже при более низких дозах введения.
МЕРЫ ПРЕДОСТОРОЖНОСТИ
Когда барбитураты, наркотики или другие снотворные (или системные анестетики) назначаются вместе с магнием, их дозировку следует корректировать с осторожностью из-за дополнительных центральных депрессивных эффектов магния.
Беременность — Тератогенные эффекты : Категория беременности C. Исследования воспроизводства животных не проводились с инъекцией сульфата магния, USP 50%.Также неизвестно, может ли инъекция сульфата магния, USP 50%, причинить вред плоду при введении беременной женщине или может повлиять на репродуктивную функцию вместимость. Инъекции сульфата магния, USP 50% следует вводить беременным женщина, только если это явно необходимо.
Сульфат — обзор | ScienceDirect Topics
Судьба органических веществ на морском дне
Значительные скорости разложения обнаружены на поверхности океанических отложений (Emerson et al., 1985; Коул и др., 1987; Бендер и др., 1989; Smith, 1992), где скорость распада определяется продолжительностью воздействия кислорода на органическое вещество (рис. 9.25; Gélinas et al., 2001; Arnarson and Keil, 2007). Там, где роющие организмы перемешиваются или биотурбируют отложения , O 2 может проникать на значительную глубину (например, (Ziebis et al., 1996; Lohrer et al., 2004), стимулируя разложение захороненного органического вещества (Hulthe et al., 1998; Middelburg, 2017, 2019). Лишь небольшая часть бентосного углерода, который откладывается на морском дне, не подвергается минерализации.Эта доля рассчитывается как эффективность захоронения (BE):
Рис. 9.25. Эффективность захоронения органического углерода в зависимости от времени воздействия на него O 2 в отложениях восточной части северной части Тихого океана.
Из Hartnett et al. (1998).(9,8) BE = FBFC = FBFB + R
, где F C — входящий поток углерода, F B — скорость захоронения углерода, а R — общая скорость минерализации. Эффективность захоронения колеблется от долей процента в глубоководных отложениях до десятков процентов в быстро накапливающихся прибрежных отложениях (Canfield, 1994; Aller, 2014).R намного больше, чем F B в большинстве отложений, поэтому скорость дыхания часто используется в качестве надежного показателя для оценки скорости доставки органического углерода в отложения (F C ).
Поскольку гетеротрофы непрерывно разлагают органическое вещество во время его спуска через толщу воды (время пребывания от нескольких недель до месяцев), то, что приземляется на дно океана, уменьшается как по массе, так и по качеству по сравнению с тем, что выпадает из фотической зоны. Длительное время пребывания органических материалов в поверхностных отложениях океана (столетие и более) более чем компенсирует снижение качества, поэтому при разложении уходит большая часть даже самых стойких органических материалов.Количество времени, в течение которого осадочное органическое вещество подвергается воздействию кислорода (время его пребывания в поверхностных отложениях), во многом определяет вариацию эффективности захоронения (рис. 9.25).
На большей части морского дна микробы преобладают в биоте. Бактерии обнаруживаются на глубине 500 м в пелагических отложениях (Parkes et al., 1994; D’Hondt et al., 2004; Schippers et al., 2005). Жизнеспособные бактерии, собранные на глубине 1626 м ниже морского дна недалеко от Ньюфаундленда, Канада, где температура окружающей среды колеблется от 60 ° C до 100 ° C, в настоящее время представляют собой максимально известную протяженность биосферы до земной коры (Roussel et al., 2008). Учитывая возраст некоторых глубинных отложений (например, 111 000 000 лет; Roussel et al., 2008), неудивительно, что все, кроме наиболее тугоплавких органических соединений, исчезли. Недавние усилия по сбору и анализу микробной ДНК и изотопных сигнатур C и S выявили присутствие жизнеспособных микробов, циклирующих метан и серу, в подпольных базальтах возрастом 3,5 миллиона лет (Lever et al., 2013). В этих глубоких отложениях геогенный метан и водород могут подпитывать хемоавтотрофную активность, а также разложение древнего органического вещества.Геномный анализ «глубокой биосферы» документирует присутствие всех трех сфер жизни с активными бактериями, грибами и археями и предполагает, что восстановление сульфатов, метаногенез и анаэробное окисление метана являются основными формами метаболизма в глубокой биосфере (Orsi et al. ., 2013). Хотя их активность невысока (D’Hondt et al., 2002), огромное количество глубоководных отложений, по оценкам, содержит 2,9 × 10 29 микробных клеток, то есть примерно 4,1 × 10 15 г C и 0.6% от общей живой биомассы Земли — что эквивалентно нашим оценкам микробной биомассы почвы (Kallmeyer et al., 2012). Обратите внимание, что эта живая биомасса представляет собой лишь небольшую часть общего органического углерода, содержащегося в осадочной среде (Hartgers et al., 1994; Таблица 2.3).
После того, как органическое вещество захоронено на дне океана, недостаток кислорода под самыми мелкими поверхностными отложениями снижает скорость разложения. В пределах нескольких сантиметров от поверхности отложений NO 3 — и Mn 4 + также истощаются в результате анаэробного окисления органических веществ.В дополнение к поступлению NO 3 —, который диффундирует в отложения из вышележащих вод, некоторые подвижные микробы, по-видимому, переносят NO 3 — в отложения, где он может быть денитрифицирован (Prokopenko et al., 2011 ). Матообразующие бактерии из рода Thioploca обеспечивают пространственную связь внутри своих клеток, улавливая NO 3 — из вышележащей водной толщи и перенося его внутриклеточно в отложения, где они окисляют сульфиды, образующиеся при сульфатредукции. на глубине (Fossing et al., 1995). Недавно было обнаружено, что микробы могут способствовать внеклеточному переносу электронов через локальные окислительно-восстановительные градиенты в морских отложениях, создавая электропроводящие пилли, или нанопроволоки, или облегчая осаждение внеклеточных металлических матриц (Meysman et al., 2015; Shi et al., др., 2016а).
Сульфат, как наиболее распространенный альтернативный терминальный акцептор электронов (TEA) в морской воде, становится доминирующим TEA ниже зон восстановления Mn и восстановления Fe (рис.9.26). По оценкам, восстановление сульфата отвечает за окисление 12–29% потока органического углерода на морское дно (Bowles et al., 2014). Если предположить, что 12% органического вещества 0,2 × 10 15 г, которое достигает дна океана u , реминерализовано в результате восстановления сульфата, это должно привести к преобразованию примерно 24 × 10 12 г SO 4 2 — до сульфидов (Bowles et al., 2014). Сильное изотопное обогащение δ 18 O SO4 относительно δ 34 S SO4 в глубоководных отложениях предполагает, что до 99% сульфита, производимого в микробных клетках в результате восстановления сульфата, повторно окисляется до сульфата, помогая поддерживать микробная активность в регионах, где поступление новых концевых акцепторов электронов очень низкое (Antler et al., 2013; Финдли и др., 2020). В глубоких водах океана сульфат глубоко проникает в отложения из-за недостатка восстановленного органического вещества. Напротив, сульфаты быстро истощаются в океанских отложениях с высоким содержанием органических веществ.
Рис. 9.26. Распределение поровой воды Mn 2 + , Fe 2 + и H 2 S в прибрежных отложениях Дании, показывающее приблизительную глубину восстановления Mn, Fe и SO 4 , соответственно .
Из Thamdrup et al.(1994).Существует критический переход во всех морских отложениях между зоной восстановления сульфатов и метаногенными отложениями, называемый зоной перехода сульфат-метан или SMTZ. Текущие оценки показывают, что может быть до 10 8 км 3 океанических отложений ниже SMTZ (определяется как <0,1 мМ сульфата), где микробы полностью поддерживаются ферментацией и метаногенезом. В самых глубоких отложениях Земли большая часть метана образуется в результате восстановления CO 2 , поскольку обычно ацетат истощается до того, как SO 4 полностью удаляется из отложений (Sansone and Martens, 1981; Crill and Martens, 1986; Whiticar et al. al., 1986). Однако ацетат также может поступать в результате автотрофного ацетогенеза в результате восстановления CO 2 (Heuer et al., 2009).
В глобальном масштабе 9–14% органического углерода в осадках могут окисляться посредством анаэробного дыхания, особенно сульфатредукции (Lein, 1984; Henrichs and Reeburgh, 1987). Значение сульфатредукции намного больше в богатых органическими веществами прибрежных отложениях, чем в отложениях открытого океана (Skyring, 1987; Canfield, 1989a). Прибрежная среда характеризуется высокими показателями АЭС и большой доставкой органических частиц к поверхности отложений.Сульфатредукция обычно увеличивается с увеличением общей скорости седиментации, которая также является максимальной у континентов (Canfield, 1989a, b, 1993). Аноксические условия развиваются быстро, поскольку органические вещества погребены в этих отложениях. В морском бассейне у побережья Северной Каролины (США) Мартенс и Вал Кламп (1984) обнаружили, что выпадало 149 моль C м — 2 лет — 1 , из которых 35,6 моль выделялось ежегодно. Дыхательные пути включали 27% в аэробное дыхание, 57% в восстановление сульфатов, приводящее к CO 2 , и 16% в метаногенезе.Прибрежная среда способствует гидрированию осадочного органического углерода, часто с помощью H 2 S из сульфатредуцирующих бактерий (Hebting et al., 2006). Эти восстановленные органические остатки более устойчивы к распаду и, вероятно, являются предшественниками образования ископаемой нефти (Gélinas et al., 2001).
Напротив, пелагические районы имеют более низкую ЧПП, более низкий нисходящий поток органических частиц и более низкие общие скорости седиментации. В пелагических отложениях Тихого океана чистое захоронение углерода было 0.005 моль C м — 2 год — 1 (D’Hondt et al., 2004). Отложения в этих областях обычно содержат кислород (Murray and Grundmanis, 1980; Murray and Kuivila, 1990), поэтому аэробное дыхание во много раз превышает восстановление сульфата (Canfield, 1989a, b). Остается мало органического вещества для поддержки сульфатредукции на глубине (Berner, 1984).
В некоторых отложениях метан, образующийся в холодных условиях высокого давления, кристаллизуется с водой с образованием гидратов метана или клатратов , которые нестабильны и улетучиваются CH 4 при попадании на поверхность Земли (Zhang et al., 2011а, б; Рис. 9.27). Существует большой интерес к клатратам как к коммерческому источнику природного газа, а также опасения, что катастрофическая дегазация клатратов в ответ на глобальное потепление может высвободить огромное количество метана в атмосферу, усугубив дальнейшее потепление (Archer et al., 2009). Однако свидетельства больших выбросов метана из клатратов во время потепления климата в конце последней ледниковой эпохи неоднозначны (Kennett et al., 2000; Sowers, 2006; Petrenko et al., 2009).
Рис. 9.27. Метан, испарившийся из замороженного клатрата, можно сжечь на поверхности Земли.
Фото Гэри Клинкхаммера, любезно предоставлено НАСА.Когда метан, образующийся на глубине, диффундирует вверх через отложения, он подвергается анаэробному окислению метанотрофами (АОМ), которые используют SO 4 — 2 , Mn 4 + и Fe 3 + в качестве альтернативных акцепторов электронов в отсутствие O 2 (Reeburgh, 2007; Beal et al., 2009). Некоторые анаэробные метанотрофы представляют собой археи, которые, по-видимому, сосуществуют в консорциуме с сульфатредуцирующими бактериями (Hinrichs et al., 1999; Боэтиус и др., 2000; Михаэлис и др., 2002). Когда в отложениях мало органического вещества, скорость восстановления сульфатов может определяться исключительно восходящим потоком метана, который обеспечивает органический субстрат для метаболизма (Hensen et al., 2003; Sivan et al., 2007). Известно, что археи, потребляющие метан, фиксируют азот для поддержки своего роста в глубоких отложениях, где нитраты были истощены в результате денитрификации (Dekas et al., 2009).
Метан, выделяемый из океанических отложений, естественных просачиваний и гидротермальных источников, легко окисляется микробами до того, как достигнет поверхности (Iversen, 1996).Большое количество природного газа, связанное с прорывом нефтяной скважины Deep-Water Horizon в Мексиканском заливе, по-видимому, окислилось до того, как достигло поверхности (Kessler et al., 2011).
Сульфат — обзор | Темы ScienceDirect
Переносчики сульфатов обеспечивают эффективную транслокацию сульфатов
Сульфат является основным клеточным анионом в цитоплазме и вакуоли растительных клеток. 54 Ожидается, что этот внутриклеточный пул будет служить резервом для роста, когда встречаются условия S-дефицита.В поддержку этой идеи известно, что содержание сульфатов в листьях резко снижается после S голодания. 55–57
Третий член высокоаффинной группы SULTR1 локализованных на плазматической мембране переносчиков сульфата, SULTR1; 3 (At1g22150), обнаруживает сильную индуцированную экспрессию после S голодания. Однако, в отличие от двух других членов этой группы (SULTR1; 1 и SULTR1; 2), его роль заключается в транслокации сульфатов. 58 SULTR1; 3 экспрессируется в клетках флоэмы семядолей, гипокотилей и корней; но не молодые листья розетки.Мутант с разрушением гена Т-ДНК показал пониженную способность транспортировать сульфат из семядолей после воздействия S-голодания на проростков Arabidopsis . 58 Смысл этого фенотипа в сочетании с локализацией флоэмы состоит в том, что SULTR1; 3 выполняет функцию загрузки сульфата в клетки ситовой трубки для транспорта в другие ткани.
Низкоаффинные транспортеры SULTR2; 1 (At5g10180) и SULTR3; 5 (At5g19600) действуют в сосудистом транспорте сульфата от корня к побегу. 59 Оба белка локализованы в плазматической мембране паренхимы ксилемы и клетках перицикла корней, предполагая, что они ответственны за перемещение апопластного сульфата в ксилему. Экспрессия SULTR3; 5 не отвечает на S-голодание, но экспрессия SULTR2; 1 сильно индуцируется S-голоданием в корнях, но не в листьях. Экспрессия обоих переносчиков в одной и той же клетке необходима для эффективного перемещения сульфата от корней к побегу. SULTR2; 1 , как было обнаружено, экспрессируется также в сосудистой ткани кремнеземов и семенного канатика. Подавление антисмысловой РНК экспрессии SULTR2; 1 привело к снижению содержания сульфата в семенах, но не в листьях, что указывает на его роль в транслокации сульфата в семена. 53
Вакуоль растения представляет собой основное клеточное хранилище сульфата, когда растения выращивают с достаточным запасом S. 60–62 Однако, когда встречается S голодание, вакуолярный сульфат используется для роста. 63 SULTR4; 1 (At5g13550) и SULTR4; 2 (At3g12520) представляют собой низкоаффинные переносчики сульфата, локализованные на мембране тонопласта, которые, как предполагается, ответственны за отток сульфата из вакуолей. 64 Эти гены экспрессируются как в паренхиме ксилемы, так и в клетках перицикла корней. Экспрессия SULTR4; 1 является конститутивной, а SULTR4; 2 индуцируется S-голоданием. Было обнаружено, что мутант с двойным нокаутом sultr4; 1 — sultr4; 2 накапливает более высокие уровни сульфата в вакуолях (по сравнению с диким типом) и в корнях.Мутантные фенотипы предполагают, что SULTR4; 1, который экспрессируется конститутивно, играет роль в гомеостазе сульфатов, тогда как SULTR4; 2, который экспрессируется после S голодания, вместе с SULTR4; 1, функционирует в мобилизации сульфата, управляемой потребностями. 64 SULTR4; 1 также может играть роль в гомеостазе вакуолярного сульфата во время развития семян. Экспрессия мРНК SULTR4; 1 в 10 раз выше, чем экспрессия мРНК SULTR4; 2 при развивающихся семенах Arabidopsis . 65 A sultr4; 1 мутант накапливает избыток сульфата в зрелых семенах, что предполагает его роль в ремобилизации пула вакуолярных сульфатов в развивающихся семенах, а также во время прорастания семян. Несмотря на этот захватывающий прогресс, неизвестно, как сульфат транспортируется в вакуоль.
В образовании сульфатов преобладает катализируемое марганцем окисление SO2 на аэрозольных поверхностях во время событий помутнения
Лабораторные исследования
Эксперименты по окислению SO 2 были выполнены в камере с регулируемой температурой и влажностью, которая подробно описана в Раздел «Методы» (дополнительный рис.1) 29 . Частицы выбранного размера (сульфат аммония или хлорид натрия) с различными концентрациями аэрозольной фазы Mn 2+ добавляли в камеру вместе с различными соотношениями смешивания SO 2 и NH 3 . Быстрый рост массовой концентрации и диаметра частиц наблюдался в присутствии Mn 2+ при 298 К (рис. 1а), особенно с затравочными частицами хлорида натрия. Однако явного образования сульфатов в отсутствие любого из этих факторов, включая O 2 , аэрозольную фазу Mn 2+ и аэрозольную жидкую воду, не наблюдалось (дополнительный рис.2). Кроме того, было обнаружено, что эта реакция ингибируется более кислыми затравочными частицами (сульфатом аммония) и более низкой концентрацией NH 3 , что позволяет предположить, что pH может быть еще одним критическим фактором для образования сульфата. Расчетная скорость образования сульфатов варьировала от 14,1 до 24,5 мкг м −3 ч −1 , в то время как средний диаметр затравочных частиц мог увеличиваться с ~ 60 до 82–105 нм за 50 мин. Это явление нельзя объяснить путём водного катализа Mn 2+ на основе модельных расчетов, даже без учета эффекта ингибирования ионной силы (рис.1а). Скорость образования сульфатов по водному пути примерно на несколько порядков ниже наблюдаемой скорости образования 6 . Харрис и др. 30 также обнаружил неожиданно высокую скорость окисления SO 2 в фильтре выщелачивания пыли, который содержал смесь TMI (Fe, Ti, Mn и Cr), а не каталитический путь, содержащий только железо. В нашем исследовании, по сравнению с Mn-каталитической реакцией, не наблюдалось заметного образования сульфата через Fe-каталитический путь в камерном эксперименте (дополнительный рис.3), а скорость реакции Fe-Mn-каталитической реакции не показала эффекта усиления синергизма. Эти данные указывают на то, что роль отдельных TMI или их совокупного воздействия на образование сульфатов требует дальнейшего повторного исследования в условиях, близких к реальным атмосферным. Гетерогенная реакция на поверхности аэрозоля, вероятно, играет важную роль в этом процессе.
Рис. 1: Образование сульфата посредством Mn-каталитической реакции в экспериментах в камере.a Массовая концентрация и рост среднего диаметра NaCl и (NH 4 ) 2 SO 4 затравочных частиц посредством Mn-каталитической реакции при 298 K.В эксперименте с NaCl (белые оранжевые кружки) исходная концентрация Mn 2+ составляла 49,7 нг / м -3 , соотношение смешивания SO 2 составляло 116 частей на миллиард, а соотношение смешивания NH 3 составляло 84 частей на миллиард ниже Относительная влажность 80%. Для эксперимента (NH 4 ) 2 SO 4 начальная концентрация Mn составляла 450,4 нг м −3 (сплошные синие кружки) или 225,4 нг м −3 (сплошные зеленые кружки), а Соотношения смешивания SO 2 и NH 3 были такими же, как и в эксперименте с NaCl при относительной влажности 89%.Пунктирные и пунктирные синие линии изображают массовые концентрации частиц, рассчитанные с помощью каталитической водной фазовой реакции Mn с учетом и без учета эффекта ионной силы. Начальные условия были такими же, как у сплошных синих кружков. b Зависимость скорости сульфатообразования ( r ) от Mn (за исключением воздействия соотношений смешивания SO 2 и концентрации площади поверхности ( A ), белые красные кружки) и соотношений смешивания SO 2 (без воздействия Концентрация Mn и концентрация на поверхности, белые кружки).Планки погрешностей представляют собой стандартное отклонение. c Просвечивающая электронная микроскопия и картографические изображения частиц, полученные в ходе экспериментов в камере.
Для дальнейшей оценки роли SO 2 и Mn 2+ были проведены эксперименты в камере с различными концентрациями Mn 2+ и SO 2 при одинаковой относительной влажности (RH) и NH 3 условия. Как показано на рис. 1b, измеренные скорости образования сульфатов линейно изменялись в зависимости от концентраций Mn 2+ и SO 2 , что свидетельствует о реакции первого порядка как SO 2 , так и Mn 2+ .Просвечивающая электронная микроскопия с энергодисперсионной рентгеновской спектроскопией (TEM-EDX) была использована для анализа морфологии отдельных частиц и химического состава на микроуровне (рис. 1c). Большинство частиц, содержащих Mn, генерировали гораздо больший размер (минимум 100 нм) во время реакций в камере (дополнительная таблица 1) по сравнению с исходным размером полученных затравочных частиц (50 нм). Элементы N и S, обнаруженные в одном и том же месте, указывают на образование сульфата аммония. Морфология частиц и распределение элементов S, Mn и N подтвердили, что образование сульфата аммиака присутствовало в каталитической реакции Mn.
В каталитической водно-фазовой реакции Mn 2+ Tursic et al. 31 обнаружили, что замена NaCl на NaNO 3 в качестве затравочного материала может привести к более быстрой реакции в кислых (pH = 3) и темных условиях из-за образования ионов-радикалов Cl 2 —. Более того, Harris et al. 32 обнаружили, что SO 2 быстро окисляется аэрозолем NaOCl, что приводит к образованию HOCl в растворе. Чтобы проверить, будет ли одновременное присутствие Mn 2+ , O 2 и Cl — в аэрозольной жидкой воде способствовать образованию HOCl, эксперименты в камере также были проведены в условиях затравки NaNO 3 .Как показано на дополнительном рисунке 4, в затравочной реакции NaNO 3 не наблюдалось явного снижения скорости реакции.
Путь образования сульфата через путь Mn-каталитической реакции, который был обнаружен в экспериментах в камере, следует отличать от традиционных водных путей. Поэтому измерения химического состава in situ в отдельных каплях с использованием конфокального рамановского микроскопа были выполнены для дальнейшей оценки этого механизма (дополнительный рис. 5). Дополнительный рис.7 представлены изменения спектра комбинационного рассеяния смеси хлорида аммония и хлорида марганца в капле при воздействии SO 2 и нулевого воздуха, в котором наблюдалось заметное увеличение интенсивности пика сульфата с увеличением времени воздействия. Как показано на рис. 2, параллельные эксперименты проводились с каплями диаметром от 5 до 50 мкм. Отношение площадей пика сульфата A (SO 4 2-) / A (H 2 O) с калибровкой стандартного раствора, представляющее содержание сульфата в этих трех сериях экспериментов, показало отчетливую тенденцию к увеличению.Скорость образования сульфата увеличивалась с уменьшением диаметра капель, показывая, что скорости реакции коррелировали с отношением площади поверхности к объему в соответствии с процессом гетерогенной реакции 33 . Эти результаты подтвердили важную роль поверхности аэрозоля в образовании сульфатов во время камерных экспериментов.
Рис. 2: Отношение площадей пика комбинационного рассеяния сульфата к воде как функция времени реакции, а также изображения капель под микроскопом.Взаимосвязь между отношением площадей сульфата и диаметром капли, а также изображения капель, полученные с помощью оптического микроскопа × 50. A представляет площадь пика комбинационного рассеяния, а d представляет диаметр. Все эти эксперименты проводились при 298 K, относительной влажности (RH) 85% и 327 ppbv SO 2 .
Камерные эксперименты проводились в широком диапазоне температур от 298 до 278 К для изучения температурной зависимости скоростей образования сульфатов. Как показано на рис. 3а, в условиях высокой относительной влажности (> 84%) скорость образования сульфата снижалась с понижением температуры. Это явление соответствует экзотермической реакции.Реакция образования сульфата будет иметь тенденцию к подкислению аэрозолей, а NH 3 будет ингибировать гидролиз аммония, тем самым влияя на концентрацию H + в аэрозольной фазе. Следовательно, скорость образования сульфата отрицательно коррелировала с концентрацией H + , которая соответствовала форме f (H + ), как показано на рис. 3a и уравнении. (5) (раздел «Метод»). Значение pH рассчитывали с использованием прибора Extended Aerosol Inorganics Model IV 34 .Мы дополнительно исследовали влияние ионной силы на образование сульфата при 298 K (рис. 3b). В отличие от ограничений реакций в водной фазе, катализируемых TMI, в условиях высокой ионной силы 9,35 , не было явного уменьшения с увеличением ионной силы, в отличие от механизма реакции ион-ионной водной фазы. Между тем, в условиях низких температур (278 и 283 К) наблюдались ускоренные скорости образования сульфатов, когда относительная влажность была ниже 84% и 82% соответственно.Факторы усиления составляли ~ 10.0 ± 1.5 (278 K) и 10.6 ± 0,11 (283 K), когда ионная сила аэрозоля превышала 14.2 и 15.3 моль л / -1 соответственно. Эти пороговые значения положительно коррелировали с температурой, и факторы увеличения образования сульфатов были аналогичными (рис. 3b). Кроме того, экспериментальное исследование путей NO 2 и O 3 в условиях низкой температуры и высокой ионной силы не выявило видимого образования сульфата (дополнительный рис.8). Скорость образования сульфата не превышала скорость реакции в водной фазе при комнатной температуре, и влияние ионной силы на путь NO 2 было почти незначительным.
Рис. 3: Влияние температуры и ионной силы на Mn-каталитическую реакцию.a Влияние температуры на реакцию, скорость образования сульфата ( r ), исключая влияние концентрации Mn 2+ , соотношение смеси SO 2 и концентрацию площади поверхности частиц ( A ) (см.(4) и (5)) показана на оси y , а концентрация H + показана на оси x . Синий, фиолетовый и красный символы обозначают эксперименты, проведенные при 298, 288 и 278 K соответственно. Все эксперименты при 278 К проводились в условиях относительной влажности (RH)> 84%, в то время как эксперименты при 288 и 298 K проводились при относительной влажности> 80%. b Влияние ионной силы на реакцию; светло-синяя заштрихованная область указывает относительную влажность от 82 до 84%; синяя заштрихованная область указывает на относительную влажность <82%.{2 -}. $$
(3)
Схематично SO 2 сначала абсорбируется поверхностным слоем капель, содержащих растворенный Mn 2+ и затравочные вещества (сульфат аммония или хлорид натрия в этой работе). Затем в поверхностном слое быстро протекает Mn-каталитическая реакция, и образовавшийся сульфат, наконец, диспергируется по всей жидкой фазе (рис. 4). В этих реакциях Mn (III) является промежуточным продуктом, который может окислять S (IV).Из-за высокого значения константы равновесия гидролиза Mn 3+ , Mn (III) в основном существует в формах Mn (OH) 2 — и Mn (OH) 2-, а их концентрации коррелируют с кислотностью аэрозольной фазы и концентрацией Mn (II). В условиях высокой ионной силы высокие концентрации электролита могут ускорить скорость ионно-нейтральных молекулярных реакций за счет образования ассоциации или ионной пары в качестве нового центра активации 36 . На энергетический барьер этих промежуточных продуктов могут влиять температурные изменения, что приводит к температурному эффекту повышения порога ионной силы.
Рис. 4: Схема Mn-каталитического окисления SO 2 на поверхности аэрозоля и в водной фазе.Красные, синие и белые сферы представляют собой атомы кислорода, азота и водорода соответственно.
Катализируемое Mn окисление S (IV) в водной фазе было тщательно исследовано, и критическим процессом окисления является реакция между Mn (III) и гидросульфитом или его комплексом с Mn (II). Тогда радикалы SO 3 — могут реагировать с растворенным O 2 с образованием радикалов SO 5 —, которые могут окислять Mn (II), чтобы регенерировать Mn (III), и скорость реакции не зависит. концентрации кислорода 6 .Каталитическая реакция в объеме марганца — это ион-ионная реакция, в которой константа скорости резко уменьшается с увеличением ионной силы под влиянием первичного кинетического солевого эффекта 36 . Повышенная скорость Mn-каталитической реакции на поверхности аэрозоля по сравнению с водной реакцией в основном объясняется несколькими различиями: различием между ионно-нейтральной молекулой и ион-ионной реакцией, которые протекают по-разному при высокой ионной силе; различное реакционное пространство; и поверхность аэрозоля и нерасфасованного раствора.AWC мало по сравнению с содержанием воды в облаках, а низкие значения pH ограничивают растворимость SO 2 . Отношение площади поверхности к объему увеличивается с уменьшением диаметра аэрозоля, что делает химический состав на поверхности более важным, чем в объемной фазе. Кроме того, Ян и др. 37 и Zhang et al. 38 обнаружили, что реакция, протекающая в микрокаплях, имеет более высокую скорость, чем та же реакция в объеме раствора. Hung et al. 39 предложили образование сульфата в реакции микрокапли сернистой кислоты и кислорода без дополнительных окислителей, а также обнаружение спонтанного образования H 2 O 2 в распыленных объемных микрокаплях воды Lee et al. 40 может пролить свет на это явление. Эти результаты продемонстрировали, что может существовать значительный разрыв в скорости реакции между поверхностью раздела воздух-жидкость и объемным раствором, а механизм эффекта увеличения скорости границы раздела воздух-жидкость может сильно отличаться в разных реакционных системах. {{\ mathrm {2 +}}} } \ right] \ times \ left [{\ mathrm {SO}} _ 2 {\ mathrm {(g)}}} \ right] \ times A $$
(4)
, где k — константа скорости, f (H + ) — функция H + , f ( T ) — функция температуры, f ( I ) — коэффициент увеличения ионной силы, [Mn 2+ ] — концентрация Mn 2+ , [SO 2 (г)] — концентрация SO 2 в газовой фазе и A представляет собой концентрацию частиц на поверхности (подробности приведены в разделе «Методы»).
Полевые наблюдения
Шесть эпизодов продолжительной дымки произошли над Северо-Китайской равниной (СКП) в январе 2015 г. и декабре 2016 г. (раздел «Методы»). Примерно 90% дней во время этих эпизодов дымки сопровождались температурными инверсиями, которые в основном были поверхностными, с инверсионными слоями, простирающимися от поверхности до высот 500–1000 м (дополнительный рис. 9). Температурные инверсии снижают вертикальную передачу импульса, тепла и влаги, что приводит к высокой влажности и слабым ветрам 41,42 .Средняя относительная влажность во время этих эпизодов дымки составляла 65 ± 23%, а скорость ветра обычно была <3 м с -1 . Застойные условия во время эпизодов дымки не только концентрируют первичные загрязнители у поверхности, но также способствуют гетерогенному образованию вторичных аэрозолей 43 .
Было проведено несколько полевых наблюдений для установления взаимосвязи между предлагаемым путем и эпизодами дымки. Как показано на дополнительном рисунке 10, мы проанализировали корреляцию между Mn и концентрацией сульфатов на Северно-Китайской равнине (Баодин, Тяньцзинь, Пекин, Таншань, Дэчжоу и Синьсян) с 1 по 22 декабря 2016 г.Концентрация Mn находилась в диапазоне 21,3–91,9, 14,1–105,6, 14,5–107,6, 20,4–327,0, 31,3–92,7 и 29,1–123,6 нг м –3 соответственно. На всех участках отбора проб массовая концентрация Mn демонстрировала такую же тенденцию изменения, как и концентрация сульфата, за исключением небольшой части подъема и спада сульфата. Кроме того, зимой мы проводили концентрацию водорастворимого Mn в НКТ. По сравнению с общим Mn водорастворимый Mn точно отслеживал все тренды вариаций сульфатов в период наблюдений (рис.5). Поскольку эти результаты соответствовали нашим предыдущим экспериментам, они предоставили твердые доказательства того, что растворенный Mn играет ключевую роль в образовании сульфатов. Распределение по размерам Mn и содержания сульфата, отобранного в зимнее время в Пекине в 2013, 2014 и 2016 годах, показало аналогичную тенденцию изменения частиц в режиме накопления в разные периоды загрязнения (дополнительный рисунок 11), подразумевая, что процесс образования сульфата может быть тесно связан до Mn. Кроме того, мы обнаружили присутствие Mn в богатых железом частицах смеси богатых железом и богатых серой частиц, собранных в зимнее время в Пекине и измеренных с помощью TEM-EDX (дополнительный рис.12), хотя предел обнаружения EDX ограничивал обнаружение следа Mn в S-богатой части. Fe, обнаруженное в богатой серой части, также может указывать на существование растворенного металла в сульфате, поскольку растворимость Mn была выше, чем Fe в AWC. ПЭМ и карты элементов образцов, собранных в NCP (Шицзячжуан), показали, что Fe и Mn были окружены S (дополнительный рис. 13), что указывает на образование сульфата, происходящее с частицами, содержащими Fe и Mn. Более того, Mn, по-видимому, был диспергирован в частицах, что доказывало, что Mn и сульфат были внутренне смешаны, что указывает на то, что образование сульфата могло происходить с Mn.Используя данные о химических компонентах окружающей среды PM 2,5 и метод положительной матричной факторизации 44 , результаты распределения источников показали, что более 80% Mn было выброшено в результате сжигания угля во время событий дымки (дополнительный рисунок 14).
Рис. 5: Временные изменения концентрации водорастворимого Mn, общего Mn и сульфатов в PM 2,5 на Северо-Китайской равнине (Баодин и Тяньцзинь) с 1 по 12 января 2015 г.a Относится к Баодин, а b относится к Тяньцзинь.Ионы металлов и концентрацию сульфатов измеряли с помощью масс-спектрометрии с индуктивно связанной плазмой и ионной хроматографии соответственно.
Моделирование химического переноса
Три эпизода дымки в декабре 2016 года были выбраны для дальнейшего подробного анализа. Наблюдаемая среднесуточная концентрация SO 4 2- составила 31 ± 17 мкг / м 3 . Модель исследования и прогнозирования погоды в сочетании с программой Chemistry (WRF-Chem) использовалась для исследования механизма образования сульфатов (раздел «Методы»).Подобно результатам предыдущих исследований 5,7 , традиционные пути (газовая фаза и окисление в облаке) объясняли только 10% сульфата в региональной модели (эксперимент I) (рис. 6a, d). Мы обнаружили, что Mn-каталитическая реакция на аэрозольных поверхностях (эксперимент II) значительно улучшила моделирование сульфатов в региональном масштабе (рис. 6b). Разрыв значений SO 4 2− между Экспериментом I и наблюдениями был значительно сокращен в Эксперименте II (NMB = −2.8%) (рис. 6г). Аналогичные результаты были также получены для трех эпизодов дымки в январе 2015 года (дополнительный рис. 15). Смоделированные концентрации других неорганических компонентов в PM 2,5 (NO 3 — , NH 4 + , Fe и Mn; дополнительные рисунки 16 и 17) и газообразных частицах (SO 2 , O 3 и NO 2 ; дополнительный рис. 18) также были сопоставимы с наблюдениями (раздел «Методы»).
Рис. 6: Наблюдаемые и смоделированные WRF-Chem концентрации сульфатов и вклад различных путей образования сульфатов.a Пространственные распределения смоделированных WRF-Chem концентраций сульфатов в эксперименте I во время трех эпизодов дымки в декабре 2016 года. b То же, что и a , но для эксперимента II. c То же, что a , но для эксперимента III. d Сравнение наблюдаемых и смоделированных WRF-Chem концентраций сульфатов во время трех эпизодов дымки в декабре 2016 года на шести участках, местоположения которых обозначены черными точками на и .Планки погрешностей представляют собой стандартное отклонение. e Состав твердых частиц серы и вклад различных путей образования сульфата в образование сульфата во время шести эпизодов помутнения в январе 2015 и декабре 2016 года, включая катализируемое марганцем окисление SO 2 на поверхности аэрозоля (Mn_AS), реакцию S ( IV) с H 2 O 2 в аэрозольной воде (H 2 O 2 _AW), окисление в газовой фазе (газовая фаза) и другие пути образования сульфатов (другие, включая окисление в облаке и реакции S (IV) с O 3 , NO 2 и O 2 , катализируемые TMI в аэрозольной воде).Вклады каждого пути образования сульфата были пространственно усреднены по области с концентрацией сульфата> 20 мкг / м 3 . Карты были созданы авторами с использованием программного обеспечения NCAR Command Language Version 6.6.2 71 .
Каталитическая реакция Mn поддерживалась высокими концентрациями SO 2 , Mn и площадью поверхности аэрозоля. Смоделированная концентрация аэрозоля на площади поверхности была> 10 см 2 м -3 над NCP, обеспечивая достаточно места для поверхностной реакции (дополнительный рис.19а). Кроме того, высокие концентрации SO 2 (81 ± 61 мкг / м 3 ) и Mn (90 ± 49 нг / м 3 ) обеспечили обилие реагентов и катализаторов для реакции. Следует отметить, что каталитическую роль играл только растворенный Mn (II) в жидкой фазе расплывчатых аэрозолей. Высокая относительная влажность во время эпизодов помутнения была благоприятной для растекания аэрозолей, а средний AWC достигал 50 мкг / м 3 над NCP (дополнительный рисунок 19b). Причем pH аэрозоля над NCP колеблется от 4.От 0 до 4,6 (дополнительный рис. 19c), что было сопоставимо со значениями, полученными в предыдущих исследованиях 11,12,13 . Кислотные расплывчатые аэрозоли солюбилизировали Mn, так что он мог действовать как катализатор 45,46 .
Недавно выделенные пути образования сульфатов были также оценены с использованием модели WRF-Chem в Эксперименте III, включая аэрозольную жидкофазную реакцию S (IV) с O 3 , H 2 O 2 , NO 2 и O 2 , катализируемые TMI.Смоделированная концентрация сульфата в Эксперименте III почти эквивалентна Эксперименту II (Рис. 6c, d). В образовании сульфатов во время событий помутнения преобладает Mn-каталитическое окисление на аэрозольных поверхностях, что составляет 92,5 ± 3,9% образования сульфатов (рис. 6e). Хотя скорость реакции S (IV) с H 2 O 2 в аэрозольной воде при высокой ионной силе могла быть намного выше 9 , она вносила лишь 4,0 ± 3,7% в образование сульфата. Смоделированное среднее значение по региону H 2 O 2 уменьшилось с 0.От 7 частей на миллиард в эксперименте II до 0,1 частей на миллиард в эксперименте III (уменьшение на 85%), что указывает на то, что ограниченная скорость производства H 2 O 2 не может поддерживать быструю реакцию H 2 O 2 с S (IV). Окисление SO 2 в газовой фазе радикалами ОН является третьим по важности путем окисления, на которое приходится 3,2 ± 0,6% образования сульфатов. Вклады аэрозольного окисления жидкой фазы S (IV) O 3 (0,2 ± 0,1%) и NO 2 (0.1 ± 0,1%) были незначительными. Для этого было две основных причины. Во-первых, скорость реакции S (IV) с O 3 и NO 2 была низкой при pH аэрозоля 4.0–4.6. Во-вторых, даже если бы скорость этой реакции могла поддерживать быстрый выход сульфата, она потребляла бы эквивалентное количество O 3 и NO 2 . В этом исследовании смоделированные концентрации O 3 и NO 2 хорошо соответствовали наблюдениям (дополнительный рисунок 18). Таким образом, это не будет эффективным путем образования сульфата.Катализируемые TMI реакции окисления SO 2 в аэрозольной воде также мало влияют на образование сульфата. Были протестированы три схемы катализируемого Mn (II), катализируемого Fe (III) и синергетического Fe (III) -Mn (II) окисления, и их вклады составили 0,09 ± 0,05%, 0,02 ± 0,02% и 0,05 ± 0,08% соответственно. Низкая концентрация Fe 3+ в умеренно кислой аэрозольной воде не способствует каталитическим реакциям железа. Кроме того, скорости катализируемого Mn (II) и синергетического Fe (III) -Mn (II) -катализируемого окисления в жидкой фазе экспоненциально снижались с увеличением ионной силы 6,47 и подавлялись высокой ионной силой в аэрозольная вода (30–50 моль л –1 ; рис.19d).
Кроме того, Song et al. 10 предположил, что HMS обычно ошибочно определялся как сульфат в предыдущих наблюдениях и мог способствовать наблюдаемому высокому содержанию серы. В эксперименте III этот механизм также рассматривался как сток SO 2 . Результаты показали, что вклад HMS из этого пути в смоделированные твердые частицы серы составил 25,0 ± 7,8% (рис. 6e), что немного выше, чем полевые наблюдения во время эпизодов дымки зимой 2014 г. (17 ± 7%) 10 .Если сера в виде твердых частиц состоит из сульфата и HMS, на сульфат может приходиться около 75% концентрации серы в твердых частицах, при этом 92,5 ± 3,9% возникают в результате Mn-каталитического окисления SO 2 на аэрозольных поверхностях. Таким образом, Mn-каталитическая гетерогенная реакция может вносить 69,2 ± 5,0% в твердую серу. Соответственно, результаты стабильных изотопов серы предоставили твердые данные полевых наблюдений, свидетельствующие о том, что TMI-каталитическая реакция может быть доминирующим путем образования сульфатов. ТМИ способствовали 49 ± 10% образования сульфатов зимой 2015 г. в Нанкине 48 .
Атмосферные последствия
Механизм быстрого образования сульфатных аэрозолей во время эпизодов зимней дымки над НКТ долгое время оставался нерешенной проблемой. Примечательно, что большинство предыдущих исследований было сосредоточено на механизмах в водной фазе 6,8,9,10,35,49 . Тем не менее, процессы окисления в водной фазе, такие как окисление NO 2 , O 3 , H 2 O 2 и так далее, не ограничиваются только наличием окислителей в атмосфере и растворимостью SO 2 , но эти окислители также будут израсходованы в том же порядке, что и образование сульфата.Однако каталитическая окислительно-восстановительная реакция Mn может продолжать образовывать сульфат, потребляя только кислород и SO 2 , что означает, что эта реакция будет происходить на протяжении всего процесса образования сульфата, от чистого воздуха до случаев сильного помутнения. Сравнение между всеми известными основными путями образования сульфатов и обнаруженным Mn-каталитическим окислительно-восстановительным процессом показало, что Mn-каталитическая гетерогенная реакция на аэрозольных поверхностях преобладает над образованием сульфатов, и этот механизм значительно улучшает моделирование модели в региональном масштабе.Идентификация пути образования сульфата Mn при катализе дает представление об образовании аэрозолей в атмосфере, подчеркивая необходимость всестороннего понимания реакций на поверхности аэрозолей, а также, возможно, окисления на поверхности капель в облаке. Этот образ мышления широко применим в различных условиях окружающей среды, и знание этого механизма будет полезно при разработке стратегий контроля загрязнения в Китае и других странах.
Состав семян мутантов арабидопсиса для переносчиков сульфатов группы 3 указывает на их роль в транслокации сульфатов в развивающихся семенах | Физиология растений
Аннотация
Сульфат необходим для синтеза серосодержащих аминокислот и многих других соединений, необходимых для жизненного цикла растений.Доставка сульфата к семенам и его перемещение между тканями семян, вероятно, потребуют определенных переносчиков. У Arabidopsis ( Arabidopsis thaliana ) предсказанные плазмалеммой переносчики сульфатов группы 3 (SULTR3) включают пять генов, все экспрессируемые в развивающихся семенах, особенно в тканях, окружающих зародыш. Здесь мы показываем, что на поступление серы в семена не влияют вставки Т-ДНК в генах SULTR3. Однако примечательно, что повышенное накопление сульфата было обнаружено в зрелых семенах четырех мутантов из пяти.В этих мутантных семенах соотношение серы в сульфатной форме по сравнению с общей серой было значительно увеличено, что сопровождалось снижением содержания свободного цистеина, которое варьировалось в зависимости от инактивированного гена. Эти результаты демонстрируют пониженную способность мутантных семян метаболизировать сульфат и предполагают, что эти переносчики могут участвовать в транслокации сульфата между компартментами семян. Это было дополнительно подтверждено измерениями содержания сульфатов в оболочках, отделенных от зародыша мутантных семян sultr3; 2 , которые показали различия в распределении сульфатов по сравнению с диким типом.Рассечение протеома семян мутантов sultr3 выявило белковые изменения, характерные для реакции на серный стресс, что подтверждает роль этих переносчиков в обеспечении эмбриона сульфатом. Мутанты были затронуты в накоплении 12S глобулина, демонстрируя важность транспорта сульфата внутри семян для синтеза и созревания белков эмбриона. Также были обнаружены метаболические изменения, некоторые из которых могут высвобождать серу из глюкозинолатов.
Сера является важным макроэлементом для всех живых организмов.В растениях сера является составной частью аминокислот Met и Cys, последняя регулирует укладку белка и / или активность за счет образования обратимой дисульфидной связи. Как составная часть Met, сера важна для питания животных и людей, которые не могут синтезировать Met и полагаются на пищевые источники. Кроме того, различные соединения, необходимые для роста и развития растений, получают из серосодержащих аминокислот (например, глутатион, S -аденозилметионин, этилен и биотин).В последние десятилетия уменьшение загрязнения атмосферы привело к увеличению дефицита серы в сельском хозяйстве Европы (Schnug, 1991; McGrath et al., 1993; Zhao and McGrath, 1993). Это агрономическая проблема, поскольку во многих исследованиях сообщалось, что дефицит серы приводит к вариациям урожайности сельскохозяйственных культур и белкового состава семян (Chandler et al., 1984; Higgins et al., 1986; Naito et al., 1994; Hirai et al. , 1995; Higashi et al., 2006). Таким образом, выявление механизмов, участвующих в переносе серы в растениях, представляет большой интерес для улучшения или поддержания урожайности семян и белкового состава при таких колебаниях окружающей среды.Несколько исследований были сосредоточены на поглощении серы корнями и транспортировке к надземным частям растения (Smith et al., 1995, 1997; Takahashi et al., 2000; Shibagaki et al., 2002; Yoshimoto et al., 2002; Buchner et al., 2002; Buchner et al. al., 2004a; Kataoka et al., 2004a; El Kassis et al., 2007), но на сегодняшний день транспорт серы семенами и метаболическая адаптация семян к активности транспорта с низким содержанием серы еще предстоит изучить.
У растений сера обычно поглощается корнями в виде сульфата и распределяется в тканях в этой форме.Табе и Дру (2001) продемонстрировали, что сульфат является доминирующей формой серы, обнаруживаемой во флоэме, поставляющей стручки во время развития семян люпина ( Lupinus albus ), и что семена способны восстанавливать и усваивать сульфат. Если сульфат не восстанавливается, избыток сульфата сохраняется в вакуоли (Kaiser et al., 1989; Martinoia et al., 2000, 2007). Недавний анализ транскриптома развивающихся семян Medicago truncatula показал, что в тканях семян есть два разных пути ассимиляции серы: большая часть сульфата попадает в зародыш, используется для синтеза Cys и его включения в белки, а сульфат — в Семенная оболочка и эндосперм служат преимущественно для синтеза связанных с защитой соединений серы (Gallardo et al., 2007). Это межтканевое разделение подразумевает активный обмен сульфата между семенными отделами.
Сульфат доставляется в ткани и клеточные компартменты растений с помощью специфических переносчиков сульфатов (SULTR), которые кодируются большими семействами генов (12–14 членов) у арабидопсиса ( Arabidopsis thaliana ) и риса ( Oryza sativa ). Основываясь на сходстве последовательностей, переносчики сульфатов можно разделить на четыре группы (от SULTR1 до -4), члены которых обладают 12 доменами, пронизывающими мембрану, и доменом STAS на С-конце (Rouached et al., 2005), а пятая группа (SULTR5) лишена этих свойств (Buchner et al., 2004b). У Arabidopsis недавно было продемонстрировано, что ген SULTR5; 2 кодирует высокоаффинный корневой транспортер молибдата (Tomatsu et al., 2007), что поднимает вопрос о роли генов группы 5 в транспорте сульфатов. Различия в кинетике и паттернах экспрессии в группах с 1 по 4 наводят на мысль о функциональных подтипах (Hawkesford, 2003). В последние годы переносчики сульфатов 1 и 2 групп, локализованные на плазматической мембране, стали предметом нескольких исследований.Члены группы 1 представляют собой переносчики с высоким сродством, которые способствуют поглощению сульфата корнем (SULTR1; 1 и SULTR1; 2) или перемещению сульфата из источника в приемник (SULTR1; 3; Smith et al., 1995, 1997; Takahashi et al., 2000; Shibagaki et al., 2002; Yoshimoto et al., 2002; El Kassis et al., 2007). Группа 2 состоит из генов-переносчиков сульфата с низким сродством, экспрессируемых в тканях сосудов и, как сообщается, участвующих в транслокации сульфата внутри растения (Takahashi et al., 2000; Buchner et al., 2004b; Awazuhara et al., 2005). В отличие от групп 1 и 2, переносчики сульфатов группы 4 были локализованы в мембране тонопласта, где, как предполагается, они опосредуют отток сульфата из просвета вакуоля в цитоплазму (Kataoka et al., 2004b) и играют роль в окислительно-восстановительном процессе. гомеостаз семян (Zuber et al., 2010).
Хотя группа 3 является самой большой группой переносчиков сульфатов у Arabidopsis, состоящей из пяти членов (SULTR3; от 1 до -3; 5), их роли еще не установлены. Предполагается, что все эти переносчики локализуются на плазматической мембране.Это было подтверждено для транспортера SULTR3; 5 бомбардировкой частицами эпидермальных клеток лука ( Allium cepa ) с использованием слитой конструкции SULTR3; 5, меченной GFP (Kataoka et al., 2004a). Имеющиеся в литературе данные для этих генов указывают на дифференциальную экспрессию в тканях растений, которая не стимулируется дефицитом серы (Buchner et al., 2004a), и на роль SULTR3; 5 в транспорте сульфата от корня к побегам. в сотрудничестве с SULTR2; 1 у Arabidopsis в условиях дефицита серы (Kataoka et al., 2004а).
В этом исследовании мы наблюдали, что гены Arabidopsis SULTR3 экспрессируются в развивающихся семенах, особенно в тканях, окружающих зародыш. Чтобы предоставить информацию об их возможном вкладе в транспорт сульфатов семян и в установление состава семян, мы охарактеризовали линии вставки Т-ДНК Arabidopsis для пяти генов SULTR3 . В то время как общее содержание серы не варьировалось между семенами дикого типа и мутантными семенами, содержание сульфатов было увеличено в зрелых семенах четырех мутантов из пяти, что демонстрирует снижение ассимиляции сульфатов во время развития семян.На зрелых семенах этих мутантных линий был проведен протеомный анализ, который выявил метаболические изменения, характерные для реакции дефицита серы. Также наблюдалось снижение созревания эмбрион-специфических белков, принадлежащих к семейству 12S глобулинов, что согласуется с ролью транспортеров SULTR3 в транслокации сульфата к эмбриону.
РЕЗУЛЬТАТЫ
Экспрессия гена
SULTR 3 в Arabidopsi s Органы растенияСначала мы исследовали с помощью количественной обратной транскрипции (qRT) -PCR в реальном времени относительные количества мРНК генов-переносчиков сульфата Arabidopsis группы 3 (SULTR3; 1; SULTR3; 2, SULTR3; 3, SULTR3; 4 и SULTR3; 5; рис. .1А). РНК из изолированных семян (через 7 и 10 дней после цветения, что соответствует стадиям эмбриогенеза и заполнения семян, соответственно), изолированных стручков (через 7-10 дней после цветения) и других тканей (листья, цветы, корни и стебли). проанализированы. Все ткани были собраны во время фазы репродуктивного роста при неограниченном доступе серы. Данные qRT-PCR, которые согласовывались с доступным набором данных транскриптомики на основе микрочипов (Toufighi et al., 2005; Supplemental Fig. S1), выявили дифференциальную экспрессию пяти переносчиков сульфатов группы 3 в органах растений (рис.1А). В то время как SULTR3; 1 преимущественно экспрессировалась в стеблях, SULTR3; 2 и SULTR3; 4 более широко экспрессировались в различных органах. Ген SULTR3; 3 также экспрессировался в нескольких органах (зрелые семена и листья), но на относительно низких уровнях по сравнению с другими генами. Интересно, что SULTR3; 5 сильно экспрессируется в зрелых семенах по сравнению со всеми другими органами растений.
Рисунок 1.
Профили экспрессии пяти генов ( SULTR3; 1 , SULTR3; 2 , SULTR3; 3 , SULTR3; 4 и SULTR3; 5 ), кодирующих переносчики сульфатов группы 3 в тканях растений и семян арабидопсиса.A: Относительное количество мРНК, оцененное с помощью qRT-PCR в развивающихся семенах, отделенных от стручков, в зрелых семенах, в стручках, собранных через 7-10 дней после цветения (DAF), и в других тканях растений дикого типа (Col-0), выращенных в серо-достаточных условиях. 7 DAF, Эмбриогенез; 10 DAF, раннее засыпание семян. Столбцы представляют собой средние значения ± стандартное отклонение трех независимых измерений из двух биологических экспериментов. B, данные об экспрессии в тканях семян из набора данных Harada-Goldberg Arabidopsis LCM GeneChip (Seedgenenetwork по адресу http: // estdb.biology.ucla.edu/seed/, серия доступа GSE12404 в омнибусе экспрессии гена). Эти данные были нормализованы к наивысшему значению экспрессии, установленному на 1, и представлены в виде цветовой шкалы (программное обеспечение Genesis; Sturn et al., 2002), в которой красный и желтый представляют собой наивысшее и наименьшее значения экспрессии, соответственно. Для каждого гена максимальный уровень экспрессии обозначен белой точкой.
Рисунок 1.
Профили экспрессии пяти генов ( SULTR3; 1 , SULTR3; 2 , SULTR3; 3 , SULTR3; 4 и SULTR3; 5 ), кодирующих переносчики сульфата группы 3 в тканях растений и семян арабидопсиса.A: Относительное количество мРНК, оцененное с помощью qRT-PCR в развивающихся семенах, отделенных от стручков, в зрелых семенах, в стручках, собранных через 7-10 дней после цветения (DAF), и в других тканях растений дикого типа (Col-0), выращенных в серо-достаточных условиях. 7 DAF, Эмбриогенез; 10 DAF, раннее засыпание семян. Столбцы представляют собой средние значения ± стандартное отклонение трех независимых измерений из двух биологических экспериментов. B, данные об экспрессии в тканях семян из набора данных Harada-Goldberg Arabidopsis LCM GeneChip (Seedgenenetwork по адресу http: // estdb.biology.ucla.edu/seed/, серия доступа GSE12404 в омнибусе экспрессии гена). Эти данные были нормализованы к наивысшему значению экспрессии, установленному на 1, и представлены в виде цветовой шкалы (программное обеспечение Genesis; Sturn et al., 2002), в которой красный и желтый представляют собой наивысшее и наименьшее значения экспрессии, соответственно. Для каждого гена максимальный уровень экспрессии обозначен белой точкой.
В то время как все гены группы 3 экспрессировались во время развития семян, время их экспрессии различалось (рис. 1А; дополнительный рис.S1): SULTR3; 1 и SULTR3; 2 экспрессировались на протяжении всего развития семян, в то время как SULTR3; 3 и SULTR3; 5 экспрессировались исключительно на поздних стадиях, а SULTR3; 4 транскриптов специфически накапливались во время эмбриогенеза. и раннее засыпание семян. В дополнение к профилям qRT-PCR мы исследовали экспрессию SULTR3 в тканях семян, изучая данные Laser Capture Microdissection / GeneChip из Seedgenenetwork (Harada-Goldberg Arabidopsis LCM GeneChip Data Set [http: // seedgenenetwork.net /], серия присоединения Омнибуса экспрессии гена GSE12404; Le et al., 2010). Все гены SULTR3 сильно экспрессировались в тканях, окружающих и / или прикрепленных к эмбриону (рис. 1B). SULTR3; 1 и SULTR3; 2 предпочтительно экспрессировались в общей семенной оболочке и эндосперме микропилар. Гены SULTR3; 3 и SULTR3; 5 сильно экспрессировались в трех компартментах эндосперма (т.е. халазальном, периферическом и микропилярном) и в халазальной оболочке семян. SULTR3; 4 показал отчетливый паттерн экспрессии, сильно выраженный в суспензоре и эндосперме микропилар. Эти профили экспрессии согласуются с ролью генов SULTR3 в развитии семян либо в импорте сульфата в семена, либо в транслокации сульфатов внутри семян.
Геномная и фенотипическая характеристика
sultr3 Мутантные линиимутантных линий на фоне Колумбии (Col-0) для SULTR3; 1 , -3; 2 , -3; 3 и -3; 4 были из вставок Т-ДНК SALK (Alonso и другие., 2003), а мутантная линия SULTR3; 5 — из коллекции SLAT (Tissier et al., 1999). Все мутантные линии, подвергнутые обратному скрещиванию один раз с Col-0, и соответствующий дикий тип выращивали в теплице при неограниченном доступе серы. Для каждого проанализированного растения наличие инсерции и гомозиготность аллелей определяли с помощью ПЦР. Секвенирование участков генома, фланкирующих границы Т-ДНК, выявило возможные множественные вставки Т-ДНК в генах SULTR3, 1 , — 3, 3 и — 3, 4 : в первом экзоне SULTR3; 1 с делецией 36 п.н. в четвертом экзоне SULTR3; 3 с делецией 32 п.н. и в промоторной области SULTR3; 4 с делецией 27 п.н. в положении -180 относительно Старт-кодон ATG (рис.2А). Одиночные вставки обнаружены в генах SULTR3; 2 и — 3; 5 : в пятом интроне SULTR3; 2 с делецией 35 п.н. и в четвертом интроне SULTR3; 5 (рис. 2А). Подробная информация о последовательности и праймерах доступна на дополнительном рисунке S2. Остаточную экспрессию нарушенных генов SULTR3 измеряли с помощью qRT-PCR с использованием специфичных для генов праймеров, описанных в дополнительной таблице S1. Для пяти мутантных линий количество мРНК снизилось на 92–100% по сравнению с диким типом (рис.2Б). Наконец, мы оценили количество копий Т-ДНК в геноме каждого мутанта с помощью количественной ПЦР в реальном времени по сравнению с тремя генами с одной копией (см. «Материалы и методы»). Были идентифицированы от одной до двух копий Т-ДНК (дополнительная таблица S2), за исключением sultr3; 2 , который имеет пять копий. Тот факт, что две левые пограничные последовательности Т-ДНК были идентифицированы в мутантных линиях SULTR3; 1 , — 3; 3 и — 3; 4 , предполагает, что эти линии содержат вставки Т-ДНК только в SULTR3. гена (рис.2А; Дополнительный рис. S2).
Рисунок 2.
сайтов инсерции Т-ДНК и остаточная экспрессия из нарушенных генов SULTR3 . A. Структура генов SULTR3 с сайтами инсерции для мутантных линий SALK-023190 ( sultr3; 1 ), SALK-023980 ( sultr3; 2 ), SALK-031340 ( sultr3; 3 ), SALK-100362 ( sultr3; 4 ) и NASC-N112372 ( sultr3; 5 ). Экзоны обозначены белыми прямоугольниками, нетранслируемые области — черными прямоугольниками, а Т-ДНК — пунктирными прямоугольниками.ПЦР выполняли с использованием специфических праймеров для каждого гена, связывающегося выше и ниже предсказанной вставки Т-ДНК, и связывания праймеров в пограничных областях соответствующей Т-ДНК (черные стрелки). Подробная информация о праймерах и последовательностях доступна на дополнительном рисунке S2. B: уровень остаточной экспрессии нарушенных генов SULTR3 с использованием ген-специфичных праймеров, перечисленных в дополнительной таблице S1, из РНК, экстрагированной из развивающихся стеблей (для sultr3; 1 , sultr3; 4 и sultr3; 5 мутанты по сравнению с диким типом [Wt]), цветы (для sultr3 ; мутант 2 по сравнению с диким типом) или листья (для мутанта sultr3 ; мутант 3 по сравнению с диким типом).Столбцы представляют собой средние значения ± стандартное отклонение трех биологических повторов. Lb и Lspm, праймеры левой границы Т-ДНК из линий SALK и NASC, соответственно; Rb и Rspm, праймеры правой границы Т-ДНК из линий SALK и NASC, соответственно.
Рисунок 2.
сайтов инсерции Т-ДНК и остаточная экспрессия из нарушенных генов SULTR3 . A. Структура генов SULTR3 с сайтами инсерции для мутантных линий SALK-023190 ( sultr3; 1 ), SALK-023980 ( sultr3; 2 ), SALK-031340 ( sultr3; 3 ), SALK-100362 ( sultr3; 4 ) и NASC-N112372 ( sultr3; 5 ).Экзоны обозначены белыми прямоугольниками, нетранслируемые области — черными прямоугольниками, а Т-ДНК — пунктирными прямоугольниками. ПЦР выполняли с использованием специфических праймеров для каждого гена, связывающегося выше и ниже предсказанной вставки Т-ДНК, и связывания праймеров в пограничных областях соответствующей Т-ДНК (черные стрелки). Подробная информация о праймерах и последовательностях доступна на дополнительном рисунке S2. B: уровень остаточной экспрессии нарушенных генов SULTR3 с использованием ген-специфичных праймеров, перечисленных в дополнительной таблице S1, из РНК, экстрагированной из развивающихся стеблей (для sultr3; 1 , sultr3; 4 и sultr3; 5 мутанты по сравнению с диким типом [Wt]), цветы (для sultr3 ; мутант 2 по сравнению с диким типом) или листья (для мутанта sultr3 ; мутант 3 по сравнению с диким типом).Столбцы представляют собой средние значения ± стандартное отклонение трех биологических повторов. Lb и Lspm, праймеры левой границы Т-ДНК из линий SALK и NASC, соответственно; Rb и Rspm, праймеры правой границы Т-ДНК из линий SALK и NASC, соответственно.
Фенотипические индикаторы продуктивности растений (начало цветения, поверхность розетки листьев при цветении и урожай семян) были измерены на мутантных растениях и растениях дикого типа и подверглись статистическому анализу для определения наличия значительных различий между диким типом и мутантные растения (рис.3). Рост мутантных растений не был остановлен, но четыре мутанта группы 3 ( sultr3; 2 , -3; 3 , -3; 4 и -3; 5 ) имели более раннее начало цветения и в среднем Площадь листьев розетки примерно на 20% меньше, чем у дикого типа (рис. 3А). Эти фенотипические различия аналогичны тем, которые наблюдаются в условиях роста с низким содержанием сульфатов (Никифорова и др., 2004). Кроме того, sultr3; 3 , -3; 4 и — 3; 5 имели массу на 100 семян больше, чем у дикого типа (рис.3Б). Поскольку значительного изменения урожайности семян не наблюдалось, мы предположили, что это связано с меньшим количеством семян на одно растение.
Рисунок 3.
Фенотипические характеристики гомозиготных мутантных растений sultr3 . A, Начало цветения (черные полосы) и проекция поверхности листьев розетки при цветении (белые полосы) для растений дикого типа (Wt) и мутантных растений. B, масса семян (черные столбцы) и урожайность на растение (белые столбцы) для растений дикого типа и мутантных растений. Каждая полоса представляет собой среднее значение ± стандартное отклонение четырех биологических повторностей (масса семян 100) или девяти биологических повторностей (другие символы).Данные были представлены в тесте Левена для оценки однородности дисперсии, а затем в тесте Стьюдента t для определения наличия статистически значимых различий между растениями дикого типа и мутантными растениями. Звездочки обозначают значения P : * P <0,05, ** P <0,01. [Цветную версию этого рисунка см. В статье в Интернете.]
Рисунок 3.
Фенотипические характеристики гомозиготных мутантных растений sultr3 . A, Начало цветения (черные полосы) и проекция поверхности листьев розетки при цветении (белые полосы) для растений дикого типа (Wt) и мутантных растений.B, масса семян (черные столбцы) и урожайность на растение (белые столбцы) для растений дикого типа и мутантных растений. Каждая полоса представляет собой среднее значение ± стандартное отклонение четырех биологических повторностей (масса семян 100) или девяти биологических повторностей (другие символы). Данные были представлены в тесте Левена для оценки однородности дисперсии, а затем в тесте Стьюдента t для определения наличия статистически значимых различий между растениями дикого типа и мутантными растениями. Звездочки обозначают значения P : * P <0.05, ** P <0,01. [Цветную версию этого рисунка см. В статье в Интернете.]
Содержание серы / азота / углерода, а также уровни анионов и тиолов в зрелых семенах
sultr3 Линии мутантовОбщее содержание серы, измеренное в зрелых семенах каждой линии, существенно не отличалось между мутантами и диким типом (фиг. 4A). Этот результат и отсутствие значительных изменений в урожайности семян указывают на то, что выделение соединений серы в семенной отсек (т.е. общая масса семян) не была затронута во всех мутантах группы 3. Далее мы определили уровни сульфата в зрелых семенах и листьях (рис. 4В; дополнительный рис. S3). Интересно, что мутанты sultr3; 2 , -3; 3 , -3; 4 и — 3; 5 мутанты обладали средним содержанием сульфатов в семенах от 1,7 до 2,3 раза выше, чем у дикого типа ( Рис. 4B). Напротив, мы не обнаружили каких-либо значительных вариаций содержания сульфатов в листьях розетки (дополнительный рис. S3). Путем расчета доли серы (S), накопленной в зрелых семенах в форме сульфата [S (SO 4 2−)], по формуле S (SO 4 2−) × 100 / S (общая), мы наблюдали, что сера в форме сульфата составляет 6% от общего содержания серы у дикого типа, тогда как у мутантов sultr3 она составляет до 16%.Это увеличенное соотношение S (SO 4 2-) по сравнению с S (общим) указывает на пониженную ассимиляцию сульфатов в развивающихся семенах мутантных линий. Чтобы выяснить, может ли измененная ассимиляция сульфатов быть объяснена дефектами разделения сульфатов между основными тканями семян, оболочки были отделены от зрелого зародыша после короткого периода впитывания для одной выбранной мутантной линии и для дикого типа, а затем содержания сульфатов. был определен в обеих тканях и во всем семени, также подвергнутом короткому периоду набухания.Зная, что в зрелом возрасте эндосперм представляет собой только тонкий слой, а семенная оболочка является основной оболочкой, окружающей зародыш, мы выбрали одну мутантную линию для гена SULTR3, сильно экспрессируемого в семенной оболочке. Среди двух генов, экспрессируемых в этой ткани (SULTR3; 1 и SULTR3; 2; рис. 1B), мы решили сосредоточиться на SULTR3; 2 из-за увеличения S (SO 4 2-) по сравнению с S (всего ) соотношения соответствующих мутантных семян (рис. 4). Интересно, что статистически значимый ( P <0.05) разница в распределении сульфатов между тканями семян наблюдалась между диким типом и sultr3; 2 мутантными семенами (фиг. 4B). Доля сульфата в оболочках была выше (59,4%), чем наблюдаемая для семян дикого типа (45,7%). Кроме того, несмотря на то, что это не является статистически значимым, в эмбрионе для этого мутанта наблюдали пониженную долю сульфата по сравнению с диким типом. Это указывает на дефект транслокации сульфата из основных оболочек в зародыш в развивающихся семенах sultr3; 2 .
Рис. 4.
Содержание азота / углерода / серы, тиола и анионов в зрелых семенах дикого типа (Wt) и мутантных растений sultr3 . A, содержание затравки азота / углерода / серы (%), измеренное с помощью высокоэффективной ионной хроматографии. B, содержание хлоридов, нитратов, сульфатов, фосфатов, малатов и цитрат в затравках (мкмоль г -1 ), измеренное с помощью высокоэффективной ионной хроматографии. Содержание C, Cys и глутатиона (GSH) (нмоль г -1 ), измеренное с помощью ВЭЖХ.Сера в форме сульфата составляет 6,3%, 8,9%, 15,7%, 14,2%, 16,3% и 11,8% от общей серы в зрелых семенах дикого типа, sultr3; 1 , -3; 2 , . -3; 3 , -3; 4 и -3; 5 соответственно. Столбцы представляют собой средние значения ± стандартное отклонение не менее четырех биологических повторов. Таблица в B показывает среднее ± стандартное отклонение процентного содержания сульфата во всем зрелом семени, которое разделено между зародышем и окружающими оболочками у дикого типа и sultr3; 2 после 90 часов набухания семян (три биологических и три технических повторения. из каждой биологической копии).* P <0,05, ** P <0,01 (тест Стьюдента t ).
Рис. 4.
Содержание азота / углерода / серы, тиолов и анионов в зрелых семенах растений дикого типа (Wt) и мутантных растений sultr3 . A, содержание затравки азота / углерода / серы (%), измеренное с помощью высокоэффективной ионной хроматографии. B, содержание хлоридов, нитратов, сульфатов, фосфатов, малатов и цитрат в затравках (мкмоль г -1 ), измеренное с помощью высокоэффективной ионной хроматографии. Содержание C, Cys и глутатиона (GSH) (нмоль г -1 ), измеренное с помощью ВЭЖХ.Сера в форме сульфата составляет 6,3%, 8,9%, 15,7%, 14,2%, 16,3% и 11,8% от общей серы в зрелых семенах дикого типа, sultr3; 1 , -3; 2 , . -3; 3 , -3; 4 и -3; 5 соответственно. Столбцы представляют собой средние значения ± стандартное отклонение не менее четырех биологических повторов. Таблица в B показывает среднее ± стандартное отклонение процентного содержания сульфата во всем зрелом семени, которое разделено между зародышем и окружающими оболочками у дикого типа и sultr3; 2 после 90 часов набухания семян (три биологических и три технических повторения. из каждой биологической копии).* P <0,05, ** P <0,01 (тест Стьюдента t ).
Далее мы измерили уровни свободного Cys и глутатиона в зрелых семенах и в листьях каждого мутанта (рис. 4C; дополнительный рис. S3). Интересно, что уровень Cys был снижен в 2,6, 1,8 и 1,6 раза в зрелых семенах sultr3; 1 , sultr3; 2 и sultr3; 3 соответственно (рис. 4C), тогда как он был не поражается в листьях (дополнительный рис. S3). Это может указывать на снижение активности путей ассимиляции серы, ведущих к синтезу Cys в развивающихся мутантных семенах.Это согласуется с пониженной эффективностью использования сульфатов, наблюдаемой для мутантных семян sultr3; 2 и — 3; 3 . Это также предполагает, что изменение метаболизма серы, такое как пониженное высвобождение и / или преобразование Cys из других предшественников, кроме сульфата, может происходить в мутантных семенах sultr3; 1 , на содержание сульфата в семенах значительного влияния не оказываемых.
Наконец, в семенах каждого мутанта измеряли содержание других минеральных и основных органических анионов (нитрат, фосфат, хлорид, малат и цитрат) и определяли общее содержание азота и углерода (рис.4Б). Содержание нитратов в зрелых семенах мутантов sultr3; 3 и — 3; 4 было снижено в 1,7 и 2,3 раза соответственно по сравнению с диким типом. В зрелых семенах мутанта sultr3; 4 также наблюдалось значительное снижение содержания хлоридов, достигающее гораздо более низкого значения (в 1,4 раза), чем в других линиях. Для других измеренных анионов и элементов изменений не обнаружено.
Протеомный анализ семян мутантов
SULTR3Для дальнейшего изучения того, могут ли изменения в способности транспорта сульфатов повлиять на состав белков семян, был проведен протеомный анализ зрелых семян мутантов Arabidopsis группы 3 и дикого типа.Для каждой линии белки извлекали из четырех биологических повторов и разделяли в двух повторах с помощью двумерного (2D) электрофореза. Анализ изображений гелей кумасси бриллиантового синего с использованием программного обеспечения Samespots позволил количественно оценить содержание белка для 273 хорошо разрешенных пятен (дополнительный рисунок S4; дополнительные таблицы S3 и S4). Статистический анализ (тесты Левена и Стьюдента t ) выявил 68 пятен, относительная численность которых в зрелых семенах варьировалась между диким типом и, по крайней мере, одной мутантной линией (рис.5). Из них 41 и 23 пятна показали повышенный и пониженный уровень накопления, соответственно, в семенах мутантных линий, тогда как четыре пятна (пятна 35, 45, 120 и 188) демонстрировали отчетливые вариации численности в зависимости от мутанта (рис. 5). Интересно, что изменения протеома семян, наблюдаемые для sultr3; 1 , — 3; 2 и — 3; 3; 3 мутантов, затронутых на содержание свободного Cys (рис. 4C), были относительно схожими, тогда как некоторые белки различались специфически по содержанию свободного Cys (рис. 4C). sultr3; 4 и — 3; 5 мутанты (рис.5).
Рисунок 5.
Кластерные отношения экспрессии 68 белков семян, дифференциально накапливаемых в пяти мутантных линиях sultr3 , по сравнению с диким типом. Каждая строка представляет один белок, а каждый столбец представляет мутантную линию. Log 2 отношения экспрессии были рассчитаны для различных мутантов относительно дикого типа и визуализированы с использованием программного обеспечения Genesis (Sturn et al., 2002). Цветовая шкала указана вверху.Красный цвет указывает на чрезмерное накопление белка в мутантных семенах, зеленый указывает на пониженное содержание белка в мутантных семенах, а черный указывает на отсутствие изменений в содержании белка между мутантными семенами и семенами дикого типа. * P <0,05, ** P <0,01 (дисперсионный анализ с последующим тестом t ). Номер доступа, название белка и онтологическая классификация (Bevan et al., 1998) указаны для каждого пятна. В каждом классе количество идентифицированных белков, количество которых варьировалось по сравнению с общим количеством идентифицированных белков, указано в скобках.Подробная информация о белках приведена в дополнительных таблицах S3, S4 и S5 (см. Также справочную карту протеома на дополнительном рис. S4).
Фиг. 5.
Кластерные отношения экспрессии 68 белков семян, дифференциально накапливаемых в пяти мутантных линиях sultr3 , по сравнению с диким типом. Каждая строка представляет один белок, а каждый столбец представляет мутантную линию. Log 2 отношения экспрессии были рассчитаны для различных мутантов относительно дикого типа и визуализированы с использованием программного обеспечения Genesis (Sturn et al., 2002). Цветовая шкала указана вверху. Красный цвет указывает на чрезмерное накопление белка в мутантных семенах, зеленый указывает на пониженное содержание белка в мутантных семенах, а черный указывает на отсутствие изменений в содержании белка между мутантными семенами и семенами дикого типа. * P <0,05, ** P <0,01 (дисперсионный анализ с последующим тестом t ). Номер доступа, название белка и онтологическая классификация (Bevan et al., 1998) указаны для каждого пятна.В каждом классе количество идентифицированных белков, количество которых варьировалось по сравнению с общим количеством идентифицированных белков, указано в скобках. Подробная информация о белках приведена в дополнительных таблицах S3, S4 и S5 (см. Также справочную карту протеома на дополнительном рис. S4).
Чтобы изучить предполагаемые функции этих белков, мы дополнительно аннотировали 152 пятна, обнаруженные на 2D-гелях, с помощью протеомных справочных карт, ранее созданных для зрелых семян Arabidopsis (Gallardo et al., 2001, 2002; Rajjou et al., 2004; Хигаши и др., 2006; Дополнительный рис. S4; Дополнительные таблицы S3 и S4). Мы проверили идентичность 53 пятен с помощью масс-фингерпринта триптических пептидов или жидкостной хроматографии в сочетании с тандемной масс-спектрометрией (LC-MS / MS). Во всех случаях их личность была подтверждена (дополнительная таблица S5).
Вариация содержания глобулина 12S
Полипептиды, соответствующие четырем изоформам 12S глобулина (At12S1 [At4g28520], At12S2 [At1G03890], At12S3 [At1g03880] и At12S4 [At5g44120]), были идентифицированы на 2D-гелях из зрелых семян (57 точек; дополнительная таблица S3).Из этих 57 пятен численность 32 значительно варьировала по крайней мере у одного мутанта группы 3 по сравнению с диким типом. 12S-глобулины синтезируются в виде предшественников, которые посттрансляционно расщепляются с образованием α- и β-субъединиц. Эти субъединицы далее процессируются за счет ограниченного C-концевого протеолиза во время созревания (Higashi et al., 2006). Основываясь на С-концевых последовательностях пятен, идентифицированных на 2D-гелях, и на их экспериментальной молекулярной массе и pI, мы смогли различить предшественник, зрелые субъединицы и протеолизированные формы для различных изоформ.Девять пятен соответствуют остаточным формам-предшественникам, три пятна — интактным α-субъединицам из At12S1 (пятно 261), At12S3 (пятно 259) и At12S4 (пятно 46), и 36 точек — протеолизированным α-субъединицам (рис. 5; дополнительная таблица). S4).
Эти подробные аннотации показали, что все пятна 12S-глобулина, численность которых снизилась в семенах sultr3 , были протеолизированными α- и / или β-субъединицами (18 пятен; рис. 5; дополнительная таблица S4). Напротив, пятна 12S-глобулина, которые увеличились в семенах sultr3 , соответствовали остаточным предшественникам (восемь пятен) и интактным субъединицам At12S1 и At12S4 (два пятна; рис.5 и 6). В мутантных семенах sultr3; 3 и — 3; 4 мы также обнаружили повышенное содержание некоторых менее протеолизированных субъединиц At12S1 и At12S4 (т. Е. Более высокая молекулярная масса; пятна 35, 65, 106, 120 и 230 на рис.4). Мутант, демонстрирующий наиболее выраженные изменения в накоплении 12S глобулина, оказался sultr3; 5 (рис. 5 и 6). Напротив, очень немногие 12S-глобулины различаются в мутантных семенах sultr3; 4 по сравнению с диким типом. Таким образом, все мутанты sultr3 затронуты в накоплении и / или процессинге запасного белка, наиболее затронутым является мутант sultr3; 5 , а наименее затронутым — sultr3; 4 .
Рисунок 6.
Профили накопления 12S глобулинов в зрелых семенах дикого типа и sultr3; 5 гомозиготных мутантных линий. Увеличены участки 2D гелей из тотальных белков семян дикого типа (слева) и мутантных линий sultr3; 5 (справа). Красный и зеленый представляют полипептиды, уровни которых увеличиваются и уменьшаются соответственно в мутантных семенах по сравнению с диким типом. Предшественники и зрелые формы 12S-глобулинов показаны сплошными кружками и пунктирными кружками, соответственно, а фрагментированные формы обозначены звездами.Подчеркнутые и жирные числа представляют изоформы At12S1 и At12S4 соответственно. Карта протеома семян, показанная слева, увеличена и представлена на дополнительном рисунке S4.
Рисунок 6.
Профили накопления 12S глобулинов в зрелых семенах дикого типа и sultr3; 5 гомозиготных мутантных линий. Увеличены участки 2D гелей из тотальных белков семян дикого типа (слева) и мутантных линий sultr3; 5 (справа). Красный и зеленый представляют полипептиды, уровни которых увеличиваются и уменьшаются соответственно в мутантных семенах по сравнению с диким типом.Предшественники и зрелые формы 12S-глобулинов показаны сплошными кружками и пунктирными кружками, соответственно, а фрагментированные формы обозначены звездами. Подчеркнутые и жирные числа представляют изоформы At12S1 и At12S4 соответственно. Карта протеома семян, показанная слева, увеличена и представлена на дополнительном рисунке S4.
Вариации в содержании белка без хранения
Мутанты группы 3 также демонстрировали различия в уровнях 26 белков, не относящихся к запасам (из 68), по сравнению с диким типом.Белки без хранения, идентифицированные в этом исследовании, были классифицированы по функциональным категориям в соответствии с генной онтологией Bevan et al. (1998; рис. 5; дополнительная таблица S3). Эти функциональные аннотации показали, что пятна, количество которых варьировалось в мутантных семенах группы 3, связаны с энергией (идентифицировано семь пятен из 13), метаболизмом белка (шесть пятен из 11), метаболизмом липидов и стеролов (три пятна из пяти). , защита (три точки из 16), структура клетки (две точки из восьми) и передача сигнала (две точки из трех).
Несколько вариаций, наблюдаемых на уровне протеома у мутантов sultr3; 1 , -3; 2 , -3; 3 и — 3; 5 , согласуются с нижестоящей регуляцией, наблюдаемой на уровне метаболома у Проростки арабидопсиса в условиях серного стресса. Они изображены на дополнительном рисунке S5. Например, пониженный уровень фермента, участвующего в синтезе лактоилглутатиона из глутатиона (лактоилглутатионлиаза; пятно 48 на рис.5; дополнительный рис.S5), что согласуется с пониженным уровнем глутатиона в проростках, лишенных сульфатов (Hirai et al., 2003; Nikiforova et al., 2003, 2005). В качестве второго примера, резкое уменьшение количества фосфатидилэтаноламин-связывающего белка (пятно 42 на фиг.5; дополнительный рисунок S5) наблюдалось в семенах нескольких мутантов группы 3, что согласуется с общим снижением содержания липидов. в растениях с дефицитом серы, в том числе снижение содержания фосфатидилэтаноламина (Никифорова и др., 2005). Наконец, мы наблюдали повышенное накопление белка ATARCA, связанного с сигнальной трансдукцией (пятно 94 на рис. 5; дополнительный рис. S5), экспрессия гена которого индуцируется в ответ на ауксин (Vahlkamp and Palme, 1997). Это подтверждает предыдущие данные о избыточном метаболическом потоке через ауксин и активации ауксин-индуцированных генов во время дефицита серы (Kutz et al., 2002; Nikiforova et al., 2003).
Модуляция нескольких других метаболических путей, которые ранее не были связаны с серным стрессом, по-видимому, происходит у всех мутантов группы 3, за исключением sultr3; 4 .Примечательно, что мы наблюдали чрезмерное накопление нескольких ферментов, связанных с гликолизом, а именно глицеральдегид-3-фосфатдегидрогеназы (пятна 44, 116 и 187), енолазы (пятно 251) и малат оксидоредуктазы (пятно 205) в семенах этих мутантов (рис. . 5; дополнительный рис. S5). Переход к гликолизу может быть способом поддержания потока углерода и выработки энергии для резервного синтеза во время развития семян. Интересно, что мы наблюдали сверхаккумуляцию алкогольдегидрогеназы в семенах мутанта sultr3 (пятно 40 на рис.5; Дополнительный рис. S5). Повышенный уровень этого фермента, который участвует в ферментации, может способствовать усилению гликолиза, поскольку анаэробное дыхание считается ключевым каталитическим процессом для регенерации NAD + , необходимого для гликолиза (Tadege et al., 1999; Fernie et al. ., 2004). Более того, один ключевой фермент цикла Кальвина, рибулозо-1,5-бифосфаткарбоксилаза (пятно 39 на рис. 5; дополнительный рис. S5), был чрезмерно накоплен в мутантах sultr3 , которые могут быть важны для рециркуляции высвободившегося углерода.
Интересно, что среди белков, избыточно накопленных в мутантных семенах sultr3; 4 , были два белка, выделяющие соединения серы. Они соответствовали ферменту, связанному с защитой (пятно 140 на фиг. 5 и 7A), гомолог которого у животных участвовал в превращении глутатиона в Cys (Lieberman et al., 1995; Habib et al., 2003) и нитрил -специфический белок NSP2 (пятно 49 на фиг. 5 и 7A), участвующий в катаболизме глюкозинолатов.
Рисунок 7.
Предлагаемые механизмы компенсации в семенах мутантов sultr3; 4 . А. Пути ассимиляции сульфатов и регуляции в мутантных семенах, отраженные протеомными анализами. Столбики указывают на изменение содержания белка в зрелых семенах (log 2 объемных соотношений в мутантных семенах по сравнению с семенами дикого типа). APS, аденозин-5′-фосфосульфат; GSH, глутатион; OAS, O -ацетилсерин. B, уровни глюкозинолатов, определенные в семенах дикого типа и sultr3 ; 4 мутантных семенах .Столбики представляют собой средние значения ± стандартное отклонение для четырех биологических повторов. Звездочки и красный цвет указывают на значительные различия (тест Стьюдента t , P <0,05). См. Фигуру 4С для уровней Cys и GSH в зрелых семенах мутантов sultr3 . [Цветную версию этого рисунка см. В онлайн-статье]
Рисунок 7.
Предлагаемые механизмы компенсации в мутантных семенах sultr3; 4 . А. Пути ассимиляции сульфатов и регуляции в мутантных семенах, отраженные протеомными анализами.Столбики указывают на изменение содержания белка в зрелых семенах (log 2 объемных соотношений в мутантных семенах по сравнению с семенами дикого типа). APS, аденозин-5′-фосфосульфат; GSH, глутатион; OAS, O -ацетилсерин. B, уровни глюкозинолатов, определенные в семенах дикого типа и sultr3 ; 4 мутантных семенах . Столбики представляют собой средние значения ± стандартное отклонение для четырех биологических повторов. Звездочки и красный цвет указывают на значительные различия (тест Стьюдента t , P <0,05). См. Фигуру 4С для уровней Cys и GSH в зрелых семенах мутантов sultr3 .[Цветную версию этого рисунка см. В статье в Интернете.]
Уровни глюкозинолатов в sultr3
; 4 Семена мутантовПоскольку протеомические данные, полученные для мутанта sultr3; 4 , предполагают механизмы компенсации, включающие деградацию глюкозинолатов (рис. 7A), мы определили уровни глюкозинолатов с помощью ультраэффективной (UP) LC-MS / MS в диком типе. и sultr3; 4 мутантных семян . Стоит отметить, что это исследование предоставляет, насколько нам известно, наиболее полный список глюкозинолатов в семенах Arabidopsis, в котором идентифицировано восемь форм (рис.7B): 4-метилтиобутил (отношение массы к заряду [ m / z ] 420), индол-3-илметил ( m / z 447), 8-метилсульфинилоктил ( m / z 492), 5 -метилтиопентил ( m / z 434), 3-бензоилоксипропил ( m / z 480), 4-бензоилоксибутил ( m / z 494), 7-метилтиогептил ( m / z 462) и 8- метилтиооктил ( m / z 476). Несмотря на то, что тенденция к снижению общего уровня глюкозинолатов в мутантных семенах sultr3; 4 статистически не различалась по сравнению с диким типом, три отдельных глюкозинолата демонстрируют значительно сниженное накопление (рис.7Б). Это индол-3-илметилглюкозинолат, 8-метилсульфинилоктилглюкозинолат и 7-метилтиогептилглюкозинолат.
ОБСУЖДЕНИЕ
В начале этого исследования не было доступной информации о возможной роли переносчиков сульфата, локализованных в плазматической мембране группы 3, в семенах. Сравнивая состав семян мутантов Т-ДНК арабидопсиса для пяти генов этой группы, мы наблюдали резкое увеличение содержания сульфатов: sultr3; 2 , -3; 3 , -3; 4 и — . 3; 5 мутантных семян по сравнению с диким типом и неизменное содержание сульфатов в мутантных семенах sultr3; 1 (рис.4Б). Эти данные контрастируют с пониженным уровнем сульфата в мутантных семенах для транспортера SULTR2; 1, который, как известно, контролирует импорт сульфата в развивающиеся семена (Awazuhara et al., 2005). Следовательно, ни один из генов SULTR3 , взятых по отдельности, не может быть существенным для поглощения сульфатов развивающимися семенами Arabidopsis. Однако заметное увеличение отношения S (SO 4 2-) к S (общему) (то есть количество серы в форме сульфата по сравнению с общей серой) в семенах четырех из пяти мутантов по сравнению с диким типом. указывает на снижение способности развивающихся мутантных семян ассимилировать сульфат, таким образом подразумевая функцию соответствующих переносчиков в развивающихся семенах.Поскольку все гены SULTR3 и преимущественно экспрессировались в тканях, окружающих эмбрион, возможно, что транспортеры SULTR3 контролируют транслокацию сульфата к созревающему эмбриону и, когда они дефектны, приводят к повышенному уровню сульфата в оболочках. Изучая распределение сульфата в тканях семян мутанта sultr3; 2 , мы действительно наблюдали повышенную долю сульфата в оболочках по сравнению с диким типом (фиг. 4B). Сниженный обмен сульфата между семенными отсеками мог повлиять на метаболизм серы, который, как было ранее показано, действует в различных тканях семян (Gallardo et al., 2007). Действительно, уровень свободного Cys был снижен до 50% в семенах этого мутанта, но также и в мутантах sultr3; 1 и sultr3; 3 по сравнению с диким типом (рис. 4C). Более того, несколько протеомных изменений, наблюдаемых для мутантных семян sultr3 , параллельны изменениям, наблюдаемым с помощью транскриптомики и / или метаболомики в проростках, листьях или корнях Arabidopsis в условиях дефицита серы (Hirai et al., 2003; Maruyama-Nakashita et al., 2003 ; Никифорова и др., 2003, 2005; дополнительный рис.S5). Эти результаты указывают на роль транспортеров SULTR3 в транслокации сульфата между тканями семян, предположительно для обеспечения сульфатом развивающегося эмбриона. Тем не менее, следует отметить, что использование единичных аллелей потери функции для каждого гена несколько ограничивает выводы, которые можно сделать в отношении функции каждого переносчика сульфата группы 3.
Интересно, что среди общих изменений, наблюдаемых на уровне протеома в семенах мутанта s ultr3 , были изменения в накоплении эмбрион-специфических запасных белков семейства 12S-глобулинов, отражающие снижение процессинга (рис.5). Аналогичные наблюдения были сделаны для зрелых семян Arabidopsis, выращенных в условиях дефицита сульфатов (Higashi et al., 2006). Основная причина изменения процессинга глобулина, предложенная Higashi et al. (2006), что связано с подавлением синтеза протеазы в условиях низкой доступности сульфатов, остается неясным и заслуживает дальнейшего изучения. Интересно, что разные мутанты по-разному влияли на накопление и процессинг 12S глобулина. Наиболее пораженный мутант, sultr3; 5 , сильно экспрессируется на позднем созревании семян по сравнению с другими стадиями развития и органами (рис.1 и 6). Это предполагает, что основная роль SULTR3; 5 в семенах заключается в обеспечении серы для созревания белков зародыша. Хотя SULTR3; 5 является наиболее изученным переносчиком сульфатов группы 3, его биологическая активность все еще остается неясной. Действительно, хотя было показано, что гомолог Lotus japonicus SULTR3; 5, SST1, комплементарен мутанту с дефицитом переносчика сульфата дрожжей (Krusell et al., 2005), переносчик Arabidopsis SULTR3; 5 не обнаруживает поглощения сульфата. активность в системе экспрессии дрожжей, но действовать синергетическим образом за счет усиления активности транспорта сульфатов SULTR2; 1, когда гены, кодирующие оба белка, коэкспрессируются в дрожжевом мутанте, дефектном в транспорте сульфатов (Kataoka et al., 2004а). Дополнительные эксперименты с qRT-PCR, проведенные в нашем исследовании, показывают, что SULTR3; 5 и SULTR2; 1 коэкспрессируются в корнях Arabidopsis (дополнительный рис. S6), но в развивающихся семенах паттерны экспрессии двух генов сильно контрастируют: SULTR3; 5 сильно экспрессируется в созревающих семенах, тогда как SULTR2; 1 экспрессируется в меньшей степени на ранних стадиях развития семян (дополнительный рисунок S6). Исходя из этих данных и контрастного содержания сульфата в семенах между sultr3; 5 (данное исследование) и sultr2; 1 (Awazuhara et al., 2005) мутанты, кажется маловероятным, что два транспортера сотрудничают в развитии семян в условиях нашего культивирования (достаточно серы).
В то время как способность семян мутанта sultr3; 4 ассимилировать сульфат была значительно снижена, этот мутант наименее подвержен накоплению 12S-глобулина и другим белкам, связанным с серным стрессом (рис. 5; дополнительный рис. S5). Следовательно, похоже, что этот мутант способен компенсировать ограниченную доступность сульфата.Профили экспрессии генов во время развития семян (рис. 1A; дополнительный рис. S1) позволяют предположить, что SULTR3; 4 играет роль на ранних стадиях, когда соединения серы (например, глюкозинолаты, глутатион) все еще могут переноситься из других частей растения в развивающиеся семена в ответ. стрессу от серы и, таким образом, обеспечивают альтернативные источники серы. Более того, SULTR3; 4 — единственный ген группы 3, сильно экспрессируемый в суспензоре (Рис. 1B), органе, который, как сообщается, является основным путем поглощения питательных веществ эмбрионом (Yeung and Meinke, 1993).Интересно, что одним из немногих различий, конкретно наблюдаемых в протеоме мутантных семян sultr3; 4 , было чрезмерное накопление двух белков, которые могут выделять серу из альтернативных источников серы (рис. 7A). Первый белок представляет собой мембранную пептидазу Ala (пятно 140 на фиг. 5 и 7A), описанная у животных как приводящая к образованию Cys посредством разложения глутатиона (Lieberman et al., 1995). Перенакопление этого белка может отражать адаптивные механизмы обеспечения Cys посредством гидролиза глутатиона, который является одной из основных форм хранения и транспорта серы (Foyer et al., 2001). Второй — это белок-спецификатор нитрила NSP2 (пятно 49 на рис. 5 и 7A), участвующий в гидролизе глюкозинолатов до нитрила, серы и сульфата (Wittstock и Halkier, 2002; Grubb and Abel, 2006; Kissen and Bones, 2009). ), что свидетельствует о повышенном катаболизме этих соединений у sultr3; 4 развивающихся семян. Глюкозинолаты переносятся из всех частей растения в развивающиеся семена, и большая часть глюкозинолатов, содержащихся в масличных семенах, находится в эмбрионе (Josefsson, 1970; Gijzen et al., 1989). Их катаболизм может высвобождать сульфат в зародышах семян для ассимиляционных путей. Дефицит сульфата вызывает активацию генов, кодирующих белки, связанные с деградацией глюкозинолатов (две предполагаемые тиоглюкозидазы [Maruyama-Nakashita et al., 2003; Hirai et al., 2005], белок, связывающий мирозиназу, и предшественник мирозиназы [ Никифорова и др., 2003]), что еще раз подтверждает роль глюкозинолатов как источника серы в стрессовых условиях. Интересно, что среди трех глюкозинолатов, количество которых снизилось в семенах мутанта sultr3; 4 , был глюкобрассицин (i.е. индол-3-илметилглюкозинолат; Рис. 7B), которые, как сообщается, разлагаются преимущественно среди всех других глюкозинолатов во время сульфатной депривации (Kutz et al., 2002). Эти данные подтверждают гипотезу, основанную на данных протеомики, о том, что катаболизм глюкозинолатов произошел во время развития мутантных семян sultr3; 4 для противодействия серному стрессу и поддержания метаболизма эмбриона. Это также указывает на новые направления к поддержанию ассимиляции серы семенами в условиях низкой доступности сульфатов.
МАТЕРИАЛЫ И МЕТОДЫ
Растительные материалы, условия роста и генотипирование
Мы изучили линии вставки Т-ДНК арабидопсиса ( Arabidopsis thaliana ) (Col-0) из Ноттингемского фонда арабидопсиса на предмет генов, кодирующих транспортеры сульфатов группы 3: SULTR3; 1 (At3g51895), SULTR3; 2 ( At4g02700), SULTR3; 3 (At1g23090), SULTR3; 4 (At3g15990) и SULTR3; 5 (At5g19600; Tissier et al., 1999; Алонсо и др., 2003). Эти линии Т-ДНК, ранее использовавшиеся El Kassis et al. (2007), имеют следующие инвентарные номера: SALK-023190 ( SULTR3; 1 ), SALK-023980 ( SULTR3; 2 ), SALK-031340 ( SULTR3; 3 ), SALK-100362 ( SULTR3; 4 ) и NASC-N112372 ( SULTR3; 5 ). Границы Т-ДНК этих мутантных линий были секвенированы в этом исследовании после ПЦР с использованием специфических праймеров для каждого гена, связывающегося выше и ниже предсказанной вставки Т-ДНК и связывания праймеров в пограничных областях соответствующей Т-ДНК.Подробная информация о праймерах и последовательностях доступна на дополнительном рисунке S2. Все пять линий Т-ДНК перед анализом подвергали обратному скрещиванию один раз с Col-0 дикого типа. Гомозиготные инсерционные линии, производные Col-0, и соответствующий Col-0 дикого типа выращивали в условиях неограниченного содержания серы (смесь торфа и перлита) и удобряли три раза в неделю субирригацией (азот: фосфор: калий, 20:20:20) в теплица с дополнительным освещением до 16 ч в сутки. Для генотипирования ДНК экстрагировали с листового диска с использованием метода бромида цетил-триметиламмония, предложенного Doyle and Doyle (1990).Скрининг ПЦР выполняли с использованием специфических праймеров для каждого гена, связывающегося выше и ниже предсказанной вставки Т-ДНК, а также связывания одного праймера в левой пограничной области соответствующей Т-ДНК (информацию о последовательностях праймеров для генотипирования см. Дополнительная таблица S1).
Оценка количества копий Т-ДНК с помощью количественной ПЦР в реальном времени
Число копийТ-ДНК в геноме оценивали для каждого мутанта с помощью количественной ПЦР в реальном времени с использованием метода порога дельта-цикла, как описано ранее Mason et al.(2002) и Skulj et al. (2008). В этом методе количество копий Т-ДНК определяли путем сравнения количественных данных, полученных для вставки Т-ДНК с тремя эндогенными генами ( At12S4, [At5g44120], SULTR1; 1 [At4G08620] и SULTR4; 1 [AT5G13550]) присутствует в единственной копии в геноме Arabidopsis. Информация о праймерах размещена в дополнительной таблице S1. ПЦР в реальном времени выполняли в системе LightCycler 480 Real-Time PCR System (Roche) с использованием MESA GREEN qPCR MasterMix Plus for SYBR Assay (Eurogentec).ПЦР в реальном времени выполняли в 10-мкл смеси, содержащей 1 × MESA GREEN qPCR MasterMix Plus для SYBR, 100 нмоль мкл -1 прямого и обратного праймеров и 2,5 мкл ДНК. Анализ кривой плавления применяли для проверки специфичности ПЦР путем нагревания продуктов ПЦР от 59 ° C до 96 ° C. Стандартные кривые были получены для каждой пары праймеров, и все коэффициенты корреляции стандартных кривых превышали 0,99. Каждую реакцию проводили в трех повторностях из четырех биологических повторностей и повторяли два раза (дополнительная таблица S2).
Измерения фенотипических признаков
Площадь листьев розетки и урожай семян измеряли у девяти отдельных растений. Площадь листьев определяли количественно по сканированию розетки во время цветения с использованием программного обеспечения Visilog 5.4 (Noesis). Начало цветения оценивали по девяти отдельным растениям и выражали в ° C в день. Вес семян был определен из трех образцов семян по 10 мг (около 400 семян), собранных на четырех отдельных растениях. Все фенотипические данные были подвергнуты тесту Левена для оценки однородности дисперсии, а затем был проведен тест Стьюдента t для сравнения каждого мутанта с диким типом с использованием Statistica 7.0 (StatSoft).
Экстракция РНК и определение уровня транскрипта
Silique и образцы семян на трех стадиях развития (7 и 10 дней после цветения и созревания семян) и образцы тканей (цветы, корни, листья и стебли) были собраны на двух независимых партиях растений. Замороженные ткани измельчали в жидком азоте и общую РНК экстрагировали согласно Chang et al. (1993). РНК (10 мкг) инкубировали с 10 единицами свободной от РНКазы RQ1-ДНКазы (Promega).Образцы РНК без обратной транскрипции проверяли на отсутствие загрязняющей геномной ДНК с помощью ПЦР с использованием праймеров для конститутивно экспрессируемого гена α-цепи фактора элонгации (At5g60390). РНК, свободная от ДНК, была преобразована в кДНК первой цепи. Образцы подвергали обратной транскрипции с использованием набора для синтеза кДНК iScript (Bio-Rad). QRT-PCR выполняли для каждого гена SULTR3 и для гена SULTR2; 1 с использованием метода SYBR Green в реальном времени на термоциклере Bio-Rad iQ5 с использованием iQ SYBR Green Supermix (Bio-Rad) и гена специфические праймеры (дополнительная таблица S1).Чтобы установить присутствие одного продукта ПЦР и отсутствие димеров праймеров, сразу после ПЦР проводили анализ плавления (т.е. тепловую диссоциацию олигонуклеотидов) путем нагревания продуктов ПЦР от 59 ° C до 96 ° C. Нормализацию количества кДНК проводили для каждой матрицы с использованием гена фактора элонгации (At5g60390) в качестве контроля в соответствии с методом относительной стандартной кривой (порог дельта-цикла; см. Ручные инструкции Bio-Rad). Стабильность экспрессии контрольного гена в различных тестируемых образцах подтверждали сравнением с двумя другими конститутивно экспрессируемыми генами, кодирующими убиквитин (At4g27960) и протеинфосфатазу (At1g13320; данные не показаны).Этот метод qRT-PCR также использовался для оценки уровня экспрессии нарушенных генов SULTR3 с использованием специфичных для генов праймеров, перечисленных в дополнительной таблице S1 из РНК, экстрагированной из развивающихся стеблей (для sultr3; 1 , sultr3; 4 и sultr3; 5 мутантов ), цветы ( sultr3; 2 мутант) или листья ( sultr3; 3 мутант).
Определение содержания анионов, углерода / азота / серы, глутатиона и цис
Для каждой линии розеточные листья и зрелые семена, собранные с четырех отдельных растений, измельчали в жидком азоте.Ткани семян были вручную препарированы из трех биологических повторностей 50 зрелых семян для линий sultr3; 2 и линий дикого типа (повторены три раза) с использованием микроскопа после 90-минутного пропитывания водой Milli-Q при 4 ° C. Анионы экстрагировали в воде Milli-Q, нагретой до 70 ° C в течение 20 мин, из 50 мг замороженного порошка или из изолированных тканей семян. Экстракт центрифугировали не менее трех раз при 20 000 g в течение 10 мин при 4 ° C. Содержание анионов в конечном прозрачном супернатанте определяли с помощью высокоэффективной ионной хроматографии (LC20 Dionex) с использованием колонки IonPaq AS11 и линейного градиента гидроксида натрия (1-22 мм), как описано (El Kassis et al., 2007). Содержание общей серы, азота и углерода измеряли в 10 мг высушенного порошка образцов семян с помощью элементного анализатора (система элементного анализатора Vario EL; Elementar). Содержание глутатиона и Cys определяли количественно с помощью ВЭЖХ после дериватизации. Процедуру дериватизации и разделение производных тиола проводили, как описано Wirtz et al. (2004) из 50 мг семян и листьев. Все данные были подвергнуты тесту Левена для оценки однородности дисперсии, а затем был проведен тест Стьюдента t для сравнения каждого мутанта с диким типом с использованием Statistica 7.0 (StatSoft). Достоверными считались только различия с P <0,05.
Экстракция общего протеина семян и 2D-электрофорез
Образцы семян, подвергнутые протеомике, немедленно замораживали в жидком азоте после сбора урожая, чтобы избежать изменений в содержании белка, которые могут быть вызваны хранением. Общие белки экстрагировали, как описано Gallardo et al. (2003) из 20 мг зрелых семян, собранных на четырех отдельных растениях. Концентрацию белка измеряли согласно Брэдфорду (1976).Постоянный объем (57 мкл) белковых экстрактов (около 200 мкг белков) использовали для изоэлектрофокусировки, что соответствовало постоянной массе семян (2 мг). Белки разделяли в двух экземплярах из четырех биологических образцов семян с использованием гелевых полосок, формирующих иммобилизованный нелинейный градиент pH от 3 до 10 (Immobiline DryStrip, 24 см; GE Healthcare / Amersham Biosciences). Полоски регидратировали в системе IPGphor (GE Healthcare / Amersham Biosciences) в течение 7 часов при 20 ° C с буфером для лизиса тиомочевины / мочевины, содержащим 2% (об. / Об.) Triton X-100, 20 мМ дитиотреитола и белковые экстракты.Изоэлектрофокусировку проводили при 20 ° C в системе IPGphor в течение 7 ч при 50 В, 1 ч при 300 В, 2 ч при 3,5 кВ и 7 ч при 8 кВ. Перед вторым измерением каждую полоску геля инкубировали при комнатной температуре в течение 2 × 15 мин в 2 × 15 мл уравновешивающего буфера, как описано Gallardo et al. (2002). Белки разделяли на вертикальных полиакриламидных гелях согласно Gallardo et al. (2002).
Окрашивание и количественное определение белков
Гелиокрашивали кумасси бриллиантовым синим G-250 (Bio-Rad) согласно Mathesius et al.(2001). Получение изображений осуществлялось с помощью системы инфракрасной визуализации Odyssey (LI-COR Biosciences) на длине волны 700 нм с разрешением 169 мкм. Анализ изображений и количественная оценка объема пятна были выполнены с использованием программного обеспечения Progenesis Samespots версии 2.0 (нелинейная динамика) в соответствии с инструкцией по эксплуатации. Для каждого геля нормированные объемы пятен рассчитывались как отношение объема каждого пятна к общему объему пятна в геле (произвольная единица). Восемь гелей (четыре биологических повтора и два технических повтора из каждого биологического повтора) были использованы и проанализированы для каждой линии дикого типа и мутантной линии.Молекулярную массу и pI рассчитывали в соответствии с миграцией стандартных белков (стандарты Bio-Rad 2D SDS-PAGE). Белковые пятна были иерархически кластеризованы с использованием программного обеспечения Genesis (версия 1.7.2; Sturn et al., 2002) в соответствии с методом кластеризации среднего сцепления. Все данные были подвергнуты статистическому анализу (тест Левена, затем тест Стьюдента t ) с использованием программного обеспечения Statistica 7.0 (StatSoft). Достоверными считались только различия с P <0,05.
Идентификация белка
пятен были аннотированы с использованием протеомных справочных карт, ранее созданных для зрелых семян Arabidopsis (Gallardo et al., 2001, 2002; Rajjou et al., 2004; Higashi et al., 2006; http://www.seed-proteome.com) . Идентичность 53 пятен была подтверждена методом нано-ЖХ-МС / МС (Q-TOF-Ultima Global, оборудованный источником нано-ESI, соединенным с системой нано-ВЭЖХ Cap LC; Waters Micromass), как описано Gallardo et al. (2007) и использовали в параллельном исследовании состава семян мутанта по переносчику сульфата, принадлежащему к группе 4 (Zuber et al., 2010). Подробная информация о переваривании белков и получении данных МС приведена в дополнительной таблице S5. Списки пиков ионов-предшественников и фрагментов были сопоставлены с белками в неизбыточной базе данных Национального центра биотехнологической информации (март 2008 г .; 7 387 702 последовательности, 2551 671 261 остаток, таксономия Arabidopsis) с использованием программы MASCOT версии 2.2 (Matrix Science). Параметры поиска MASCOT описаны в дополнительной таблице S4. Учитывались только совпадения с индивидуальным количеством ионов выше 20.
Измерения глюкозинолатов
Для экстракции полярных соединений 50 мг зрелых семян арабидопсиса из четырех биологических повторностей измельчали в течение 1,5 мин в жидком азоте при 1500 об / мин с помощью шаровой мельницы Mikro-Dismembrator S (Sartorius Stedim Biotech). Немедленно добавляли в общей сложности 700 мкл метанола, содержащего 500 мкм синигрина в качестве внутреннего стандарта (2-пропенилглюкозинолат; Sigma-Aldrich), пробирки герметично закрывали и обрабатывали ультразвуком при 50 ° C в течение 20 мин, а затем 400 мкл хлороформа. добавляли перед еще 5 мин обработкой ультразвуком при 50 ° C.Затем добавляли 600 мкл сверхчистой воды (Millipore), образцы встряхивали с помощью вихревой мешалки и центрифугировали в течение 2 минут при 4000 g для сбора супернатанта метанол / вода, который хранили при -20 ° C для осаждения. Образцы центрифугировали в течение 15 мин при 16000 г , 200 мкл экстракта сушили в вакуумном концентраторе и растворяли в 150 мкл сверхчистой воды. Идентификацию и определение глюкозинолатов в образцах семян проводили с использованием Waters Quattro Premier XE (Waters), снабженного источником ионизации электрораспылением и соединенного с системой Acquity UPLC (Waters).Хроматографическое разделение было достигнуто с использованием колонки Acquity UPLC BEH C18 (100 × 2,1 мм, 1,7 мкм; Waters), соединенной с предколонкой Acquity UPLC BEH C18 (2,1 × 5 мм, 1,7 мкм; Waters). Подвижная фаза состояла из воды (A) и ацетонитрила (B), оба содержали 0,1% муравьиной кислоты. Эксперимент начинали с 2 минут 98% A, затем применяли линейный градиент для достижения 85% A через 5,5 минут, затем 0% A через 10 минут, а затем изократический прогон с использованием B в течение 2,8 минут. Наконец, возврат к исходным условиям (98% A) был достигнут в 2.2 мин. Общее время работы 15 мин. Колонка работала при 28 ° C со скоростью потока 0,4 мл мин. -1 (объем ввода пробы 3 мкл). Азот, полученный из сжатого воздуха в генераторе азота N2G (Mistral), использовали в качестве осушающего и распыляющего газа. Расход газа в распылителе составлял приблизительно 50 л / ч -1 , а расход газа для десольватации — 900 л / ч -1 . Температура интерфейса была установлена на уровне 400 ° C, а температура источника — 135 ° C. Капиллярное напряжение было установлено равным 3.4 кВ и конусное напряжение 25 В, ионизация была в отрицательном режиме. Разрешение при малой и большой массе составляло 15 для обоих масс-анализаторов, энергии ионов 1 и 2 составляли 0,5 В, потенциал на входе и выходе составлял 2 и 1 В, а коэффициент усиления детектора (умножителя) составлял 650 В. Сбор данных и анализ выполнялись. с программным обеспечением MassLynx (версия 4.1), работающим под управлением Windows XP professional на персональном компьютере Pentium. Образцы семян сначала были проанализированы в режиме полного сканирования ( m / z 90–600). Выбранный режим МС с записью ионов был использован для определения перехода исходной массы внутреннего стандарта синигрина ( m / z 358) и восьми глюкозинолатов m / z 420, 434, 447, 462, 476, 480, 492, и 494.Фрагментацию глюкозинолата проводили путем диссоциации, вызванной столкновением, с аргоном при 1,0 × 10 -4 мбар с использованием дочернего сканирования. Энергия столкновения была установлена равной 20 В, и для идентификации глюкозинолатов были использованы следующие переходы: [M-H] — > 275, 259, 195, 97 и 96, как описано Mellon et al. (2002) и Cataldi et al. (2007). Ионы исходной массы и характерных фрагментов использовали для однозначной идентификации глюкозинолатов. Площади пиков 4-метилтиобутилглюкозинолата ( m / z 420) и 4-бензоилоксибутилглюкозинолата ( m / z 494) были самыми высокими (рис.7B), что хорошо согласуется с ранее сообщенным содержанием глюкозинолатов в семенах Arabidopsis (Petersen et al., 2002; Brown et al., 2003).
Данные последовательности из этой статьи можно найти в библиотеках данных GenBank / EMBL под номерами доступа At3g51895, At4g02700, At1g23090, At3g15990 и At5g19600.
Дополнительные данные
В онлайн-версии статьи доступны следующие материалы.
БЛАГОДАРНОСТИ
Мы благодарим Ноттингемский фондовый центр арабидопсиса за предоставление нам линий вставки Т-ДНК арабидопсиса.Мы искренне благодарим Джона Харада (Отдел биологии растений, Отделение биологических наук, Калифорнийский университет, Дэвис) и Боба Голдберга (Отдел молекулярной, клеточной биологии и биологии развития, Калифорнийский университет, Лос-Анджелес) за разрешение ссылаться на экспрессию генов. данные с веб-сайта Seedgenenetwork. Мы также благодарим Мириам Санчес, Жана Потье и Марио Рега (Отдел экофизиологии и генетики бобовых, Центр INRA в Дижоне) за их очень ценную техническую поддержку и Джудит Бёрстин (Отдел исследований экофизиологии и генетики бобовых, Центр INRA в Дижоне) за критическое чтение рукописи и полезные обсуждения.
ЦИТИРОВАННАЯ ЛИТЕРАТУРА
и другие. (
2003
)Полногеномный инсерционный мутагенез Arabidopsis thaliana
.Наука
301
:653
—657
(
2005
)Функция SULTR2; 1 транспортер сульфата во время развития семян у Arabidopsis thaliana
.Plant Physiol
125
:95
—105
и другие. (
1998
)Анализ 1,9 МБ непрерывной последовательности хромосомы 4 Arabidopsis thaliana
.Природа
391
:485
—488
(
1976
)Быстрый и чувствительный метод количественного определения количества белка в микрограммах, использующий принцип связывания белок-краситель
.Анал Биохим
72
:248
—254
(
2003
)Различия в накоплении глюкозинолатов между различными органами и стадиями развития Arabidopsis thaliana
.Фитохимия
62
:471
—481
(
2004a
)Регулирование поглощения сульфатов и экспрессии генов-переносчиков сульфатов в Brassica oleracea под влиянием атмосферного h3S и сульфатного питания педосферы
.Plant Physiol
136
:3396
—3408
(
2004b
)Растительные транспортеры сульфатов: координация поглощения, внутриклеточного и дальнего транспорта
.J Exp Bot
55
:1765
—1773
(
2007
)Природные глюкозинолаты в растительных экстрактах рукколы ( Eruca sativa L.) идентифицированы жидкостной хроматографией в сочетании с ионизацией электрораспылением отрицательных ионов и квадрупольной масс-спектрометрией с ионной ловушкой
.Масс-спектрометр Rapid Commun
21
:2374
—2388
(
2008
)Протеомная характеристика силы семян сахарной свеклы и ее тканеспецифической экспрессии
.Proc Natl Acad Sci USA
105
:10262
—10267
(
1984
)Влияние серного питания на паттерны развития некоторых основных белков семян гороха и их мРНК
.Plant Physiol
75
:651
—657
(
1993
)Простой и эффективный метод выделения РНК из сосны
.Завод Мол Биол Реп
11
:113
—116
(
1990
)Выделение растительной ДНК из свежих тканей
.Фокус
12
:13
—15
(
2007
)Характеристика селенат-устойчивого мутанта Arabidopsis: рост корней как потенциальная мишень для токсичности селената
.Plant Physiol
143
:1231
—1241
(
2004
)Респираторный метаболизм: гликолиз, цикл TCA и митохондриальный транспорт электронов
.Curr Opin Plant Biol
7
:254
—261
(
2001
)Функции меж- и внутриклеточных транспортных систем глутатиона в растениях
.Trends Plant Sci
6
:486
—492
(
2007
)Комбинированный протеомный и транскриптомный анализ развивающихся семян Medicago truncatula : свидетельство метаболической специализации материнских и дочерних тканей
.Протеомика клеток Mol
6
:2165
—2179
(
2001
)Протеомный анализ прорастания семян арабидопсиса и прайминга
.Plant Physiol
126
:835
—848
(
2002
)Протеомика прорастания семян Arabidopsis: сравнительное исследование семян дикого типа и семян с дефицитом гиббереллина
.Plant Physiol
129
:823
—837
(
2003
)Протеомика развития семян Medicago truncatula устанавливает временные рамки разнообразных метаболических процессов, связанных с накоплением резервов
.Plant Physiol
133
:664
–682
(
1989
)Поглощение глюкозинолатов развивающимися зародышами рапса
.Plant Physiol
89
:260
—263
(
2006
)Метаболизм глюкозинолатов и его контроль
.Trends Plant Sci
11
:89
—100
(
2003
)Идентификация двух дополнительных членов семейства мембраносвязанных дипептидаз
.FASEB J
17
:1313
—1315
(
2003
)Семейства генов-переносчиков в растениях.Семейство генов-переносчиков сульфатов: избыточность или специализация?
Physiol Plant
117
:115
—163
(
2006
)Протеомный и транскриптомный анализ семян Arabidopsis: молекулярные доказательства последовательного процессинга белков семян и его влияния на стрессовую реакцию на серное питание
.Завод J
48
:557
—571
(
1986
)Структура гена, структура белка и регуляция синтеза богатого серой белка в семенах гороха
.J Biol Chem
261
:11124
—11130
(
2003
)Глобальное профилирование экспрессии арабидопсиса с дефицитом серы с помощью ДНК-макроматрицы показывает роль O-ацетил-1-серина как общего регулятора экспрессии генов в ответ на питание серой
.Завод J
33
:651
—663
(
1995
)Влияние концентраций сульфатов на экспрессию гена запасного белка семян сои и его обратимость у трансгенного растения Arabidopsis thaliana
.Физиология растительных клеток
36
:1331
—1339
(
2005
)Выявление сетей ген-ген и метаболит-ген у Arabidopsis путем интеграции метаболомики и транскриптомики
.J Biol Chem
280
:25590
—25595
(
1970
)Содержание глюкозинолатов и аминокислотный состав рапсовой муки ( Brassica napus ) под влиянием серного и азотного питания
..Лундский университет
,Лунд, Швеция
(
1989
)Активный транспорт сульфата в вакуоль растительных клеток обеспечивает галотолерантность и может детоксифицировать SO 2
.J Plant Physiol
133
:756
—763
(
2004a
)Транспорт сульфата от корня к побегу у Arabidopsis: доказательства роли SULTR3; 5 как компонента системы транспорта сульфата с низким сродством в сосудистой сети корня
.Plant Physiol
136
:4198
—4204
(
2004b
)Вакуолярные переносчики сульфата являются важными детерминантами, контролирующими внутреннее распределение сульфата в Arabidopsis
.Растительная ячейка
16
:2693
—2704
(
2009
)Нитрилспецифические белки, участвующие в гидролизе глюкозинолатов у Arabidopsis thaliana
.J Biol Chem
284
:12057
—12070
и другие. (
2005
)Переносчик сульфатов SST1 имеет решающее значение для симбиотической фиксации азота в корневых клубеньках Lotus japonicus
.Растительная ячейка
17
:1625
—1636
(
2002
)Роль нитрилазы 3 в регуляции морфологии корней у страдающих серным голоданием Arabidopsis thaliana
.Завод J
30
:95
—106
и другие. (
2010
)Глобальный анализ активности генов во время развития семян Arabidopsis и идентификация факторов транскрипции, специфичных для семян
.Proc Natl Acad Sci USA
107
:8063
—8070
(
1995
)γ-Глутамилтранспептидаза: что организация и экспрессия мультипромоторного гена говорят нам о его функциях?
Am J Pathol
147
:1175
—1185
(
2007
)Вакуолярные переносчики и их важная роль в метаболизме растений
.J Exp Bot
58
:83
—102
(
2000
)Процессы переноса растворенных веществ через вакуолярную мембрану высших растений
.Физиология растительных клеток
41
:1175
—1186
(
2003
)Транскриптомное профилирование серочувствительных генов у Arabidopsis выявило глобальное влияние серного питания на множественные метаболические пути
.Plant Physiol
132
:597
—605
(
2002
)Оценка количества интеграций в трансформированных растениях с помощью количественной ПЦР в реальном времени
.BMC Biotechnol
2
:20
(
2001
)Создание справочной карты протеома корня для модельного бобового Medicago truncatula с использованием базы данных тегов экспрессированной последовательности для фингерпринта пептидной массы
.Протеомика
1
:1424
—1440
(
1993
)Состояние серы в зерне британской пшеницы и его связь с параметрами качества
.Asp Appl Biol
36
:317
—326
(
2002
)Анализ интактного глюкозинолата в растительных экстрактах с помощью электрораспыления с запрограммированным конусным напряжением. ЖХ / МС: эффективность и сравнение с методами ЖХ / МС / МС
.Анал Биохим
306
:83
—91
(
1994
)Экспрессия гена запасного белка семян сои ( Glycine max [L.] Merr.) В трансгенном Arabidopsis thaliana и ее ответ на пищевой стресс и на мутации абсцизовой кислоты
.Plant Physiol
104
:497
—503
(
2003
)Транскриптомный анализ истощения запасов серы в Arabidopsis thaliana : переплетение биосинтетических путей обеспечивает специфичность ответа
.Завод J
33
:633
—650
(
2004
)На пути к анализу метаболизма питательных веществ в растениях: тематическое исследование системной биологии, посвященное метаболизму серы
.J Exp Bot
55
:1861
—1870
(
2005
)Системная перебалансировка метаболизма в ответ на недостаток серы, как показывает анализ метаболома растений арабидопсиса
.Plant Physiol
138
:304
—318
(
2002
)Состав и содержание глюкозинолатов в развивающихся продуктах Arabidopsis thaliana
.Планта
214
:562
—571
(
2004
)Эффект α-аманитина на протеом семян Arabidopsis подчеркивает различные роли сохраненных и неосинтезированных мРНК во время прорастания
.Plant Physiol
134
:1598
—1613
(
2005
)Структурный и функциональный анализ C-концевого домена STAS (транспортера сульфата и анти-сигма-антагониста) транспортера сульфата Arabidopsis thaliana SULTR1.2
.J Biol Chem
280
:15976
—15983
(
1991
)Питательный статус европейских сельскохозяйственных культур по сере и последствия для сельского хозяйства
.Sulfur Agric
15
:7
—12
(
2002
)Селенат-устойчивые мутанты Arabidopsis thaliana идентифицируют Sultr1; 2, переносчик сульфата, необходимый для эффективного транспорта сульфата в корни
.Завод J
29
:475
—486
(
2008
)Улучшенное определение количества копий плазмиды с использованием количественной ПЦР в реальном времени для мониторинга процессов ферментации
.Microb Cell Fact
7
:6
(
1995
)Растения, принадлежащие к семейству переносчиков сульфатов, выявляют функциональные подтипы
.Proc Natl Acad Sci USA
92
:9373
—9377
(
1997
)Регуляция экспрессии кДНК из корней ячменя, кодирующей высокоаффинный транспортер сульфата
.Завод J
12
:875
—884
(
2002
)Genesis: кластерный анализ данных микрочипов
.Биоинформатика
18
:207
—208
(
2001
)Ассимиляция серы в развивающихся семядолях люпина может внести значительный вклад в накопление запасов органической серы в семенах
.Plant Physiol
126
:176
—187
(
1999
)Этанольная ферментация: новые функции для старого пути
.Trends Plant Sci
4
:320
—325
(
2000
)Роли трех функциональных транспортеров сульфата, участвующих в захвате и перемещении сульфата в Arabidopsis thaliana
.Завод J
23
:171
—182
(
1999
)Множественные независимые дефектные вставки транспозонов супрессор-мутатор в Arabidopsis : инструмент для функциональной геномики
.Растительная ячейка
11
:1841
—1852
(
2007
)Высокоаффинный переносчик молибдата Arabidopsis thaliana , необходимый для эффективного поглощения молибдата из почвы
.Proc Natl Acad Sci USA
104
:18807
—18812
(
2005
)Ресурс Botany Array: электронные северяне, анализ экспрессии и анализ промоторов
.Завод J
43
:153
—163
(
1997
)AtArcA. Номер доступа U77381, гомолог Arabidopsis thaliana гена ArcA табака (PGR97-145)
.Plant Physiol
115
:863
(
2004
)О-ацетилсерин (тиол) лиаза: загадочный фермент биосинтеза цистеина растений, пересмотренный в Arabidopsis thaliana
.J Exp Bot
55
:1785
—1798
(
2002
)Исследование глюкозинолатов в эпоху Arabidopsis
.Trends Plant Sci
7
:263
—270
(
1993
)Эмбриогенез покрытосеменных растений: развитие суспензора
.Растительная ячейка
5
:1371
—1381
(
2002
)Два различных высокоаффинных транспортера сульфата с разными индуцируемыми способностями опосредуют поглощение сульфата корнями Arabidopsis
.Завод J
29
:465
—473
(
1993
)Оценка риска дефицита серы в зерновых
.J Sci Food Agric
63
:119
(
2010
)Мутантные семена Sultr4; 1 Arabidopsis имеют повышенное содержание сульфатов и модифицированный протеом, что указывает на метаболическую адаптацию к измененной компартментализации сульфатов
.БМК Завод Биол
10
:78
Заметки автора
© 2010 Американское общество биологов растений
© Автор (ы) 2010. Опубликовано Oxford University Press от имени Американского общества биологов растений. Это статья в открытом доступе, распространяемая в соответствии с условиями лицензии Creative Commons Attribution License (https://creativecommons.org/licenses/by/4.0/), которая разрешает неограниченное повторное использование, распространение и воспроизведение на любом носителе при условии, что оригинальная работа правильно процитировано.
% PDF-1.6 % 834 0 объект> эндобдж xref 834 114 0000000016 00000 н. 0000003774 00000 н. 0000003953 00000 н. 0000003988 00000 н. 0000004306 00000 н. 0000004340 00000 н. 0000004478 00000 н. 0000004616 00000 н. 0000005115 00000 п. 0000005869 00000 н. 0000006143 00000 н. 0000006411 00000 н. 0000006488 00000 н. 0000007283 00000 н. 0000007967 00000 п. 0000008723 00000 н. 0000008759 00000 н. 0000009627 00000 н. 0000010530 00000 п. 0000011109 00000 п. 0000011331 00000 п. 0000012311 00000 п. 0000013169 00000 п. 0000013771 00000 п. 0000051390 00000 п. 0000100227 00000 н. 0000102897 00000 н. 0000102972 00000 н. 0000103024 00000 н. 0000103095 00000 п. 0000103180 00000 н. 0000103284 00000 н. 0000103344 00000 п. 0000103455 00000 п. 0000103515 00000 н. 0000103605 00000 н. 0000103665 00000 н. 0000103786 00000 п. 0000103840 00000 н. 0000104028 00000 н. 0000104107 00000 п. 0000104161 00000 п. 0000104289 00000 п. 0000104440 00000 н. 0000104528 00000 н. 0000104582 00000 н. 0000104710 00000 н. 0000104812 00000 н. 0000104866 00000 н. 0000104960 00000 н. 0000105014 00000 н. 0000105145 00000 н. 0000105237 00000 п. 0000105297 00000 н. 0000105389 00000 п. 0000105486 00000 н. 0000105539 00000 п. 0000105634 00000 п. 0000105687 00000 н. 0000105777 00000 н. 0000105830 00000 н. 0000105929 00000 н. 0000105988 00000 н. 0000106049 00000 п. 0000106110 00000 п. 0000106198 00000 п. 0000106252 00000 н. 0000106342 00000 п. 0000106429 00000 н. 0000106483 00000 н. 0000106611 00000 н. 0000106695 00000 н. 0000106749 00000 н. 0000106886 00000 н. 0000106947 00000 н. 0000107001 00000 н. 0000107055 00000 п. 0000107109 00000 п. 0000107163 00000 п. 0000107293 00000 н. 0000107347 00000 п. 0000107451 00000 п. 0000107505 00000 н. 0000107605 00000 н. 0000107659 00000 н. 0000107760 00000 н. 0000107814 00000 п. 0000107868 00000 н. 0000107922 00000 п. 0000108005 00000 н. 0000108059 00000 н. 0000108189 00000 п. 0000108312 00000 н. 0000108396 00000 н. 0000108450 00000 н. 0000108523 00000 п. 0000108646 00000 н. 0000108728 00000 н. 0000108782 00000 н. 0000108864 00000 н. 0000108918 00000 н. 0000108972 00000 н. 0000109026 00000 н. 0000109113 00000 п. 0000109167 00000 н. 0000109264 00000 н. 0000109318 00000 п. 0000109372 00000 п. 0000109426 00000 н. 0000109542 00000 п. 0000109596 00000 н. 0000109650 00000 н. 0000109704 00000 н. 0000002576 00000 н. трейлер ] >> startxref 0 %% EOF 947 0 obj> поток xUoLe = l (]], 5, RCi; Z -) ‘Ә-DlF \ tN0% Cp * YTe] 4> {0K {y ~ r
Образование сульфатов во время сильной зимней дымки и потенциальный вклад гетерогенных реакций SO2 + NO2 в районе дельты реки Янцзы, Китай
Cheng, Y., Чжэн, Г., Вэй, Ч., Му, К., Чжэн, Б., Ван, З., Гао, М., Чжан, Q., He, K., Carmichael, G., Pöschl1, U., и Su, H .: реактивный азот. химии в аэрозольной воде в качестве источника сульфата во время событий дымки в Китай, Науки. Adv., 2, e1601530, https://doi.org/10.1126/sciadv.1601530, 2016.
Эммонс, Л.К., Уолтерс, С., Гесс, П.Г., Ламарк, Ж.-Ф., Пфистер, Г.Г., Филмор, Д., Гранье, К., Гюнтер, А., Киннисон, Д., Лэппл , Т., Орландо, Дж., Ти, X., Тиндалл, Г., Видинмайер, К., Богкум, С.Л. и Клостер, С .: Описание и оценка модели озона и связанных с ним химических индикаторов, версия 4 (MOZART-4), Geosci. Model Dev., 3, 43–67, https://doi.org/10.5194/gmd-3-43-2010, 2010.
Фунтукис, К. и Ненес, А .: ISORROPIA II: эффективное с точки зрения вычислений термодинамическое равновесие модель для аэрозолей K + -Ca2 + -Mg2 + -Nh5 + -Na + -SO42 — NO 3 -Cl — -H 2 O, Атмос. Chem. Phys., 7, 4639–4659, https://doi.org/10.5194/acp-7-4639-2007, 2007.
Фу, X., Ван, С., Чжао, Б., Син, Дж., Ченг, З., Лю, Х. и Хао, Дж .: Кадастр выбросов первичных загрязнителей и химического состава в 2010 г. регион дельты реки Янцзы, Китай, Атмос. Environ., 70, 39–50, https://doi.org/10.1016/j.atmosenv.2012.12.034, 2013.
Гао, М., Кармайкл, Г.Р., Ван, Й., Цзи, Д., Лю, З. и Ван, З. .: Улучшение моделирования сульфатных аэрозолей во время зимней дымки над Северной Китай: влияние гетерогенного окисления NO 2 , Front.Environ. Sci. Англ., 10, 16, https://doi.org/10.1007/s11783-016-0878-2, 2016a.
Гао, М., Кармайкл, Г.Р., Ван, Й., Саиде, П.Е., Ю, М., Синь, Дж., Лю, З., и Ван, З .: Моделирование исследования явления региональной дымки 2010 г. в г. Северо-Китайская равнина, Атмос. Chem. Phys., 16, 1673–1691, https://doi.org/10.5194/acp-16-1673-2016, 2016б.
Гюнтер, А. Б., Цзян, Х., Хилд, К. Л., Сакулянонтвиттая, Т., Дул, Т., Эммонс, Л. К., и Ван, X .: Модель выбросов газов и аэрозолей из природы, версия 2.1 (MEGAN2.1): расширенная и обновленная структура для моделирования биогенных выбросов, Geosci. Model Dev., 5, 1471–1492, https://doi.org/10.5194/gmd-5-1471-2012, 2012.
Гуо, Х., Вебер, Р.Дж., и Ненес, А .: Высокие уровни аммиак не повышается pH мелких частиц, достаточный для получения сульфата с преобладанием оксида азота производство, Науки. Реп., 7, 12109, https://doi.org/10.1038/s41598-017-11704-0, 2017.
He, H., Wang, Y., Ma, Q., Ma, J., Chu, B., Ji, D., Tang, G., Liu, C., Zhang, Х., Хао Дж.: Минеральная пыль и NOx способствуют превращению SO 2 в сульфат в дни сильного загрязнения, Sci. Реп., 4, 4172, г. https://doi.org/10.1038/srep04172, 2014.
Хуанг, К., Чен, Ч., Ли, Л., Ченг, З., Ван, Х.Л., Хуанг, Х.Й., Улицы, Д.Г., Ван, Ю.Дж., Чжан, Г.Ф., и Чен, Ю.Р .: Кадастр выбросов антропогенных загрязнителей воздуха. и виды ЛОС в районе дельты реки Янцзы, Китай, Atmos. Chem. Phys., 11, 4105–4120, https://doi.org/10.5194/acp-11-4105-2011, 2011.
Huang, Q., Cheng, S., Li, J., Chen, D., Wang, H., and Guo, X .: Оценка PM 10 источников выбросов для приоритетного регулирования качества городского воздуха управление с использованием нового объединенного подхода к моделированию MM5-CAMx-PSAT, Environ. Англ. Sci., 29, 343–349, https://doi.org/10.1089/ees.2011.0229, 2012.
Hung, H. M., Hsu, M. N., и Hoffmann, M.R .: Количественная оценка SO 2 Окисление на межфазных поверхностях кислых микрокапель: значение для Образование сульфатов в окружающей среде, Окружающая среда. Sci.Технол., 52, 9079–9086, https://doi.org/10.1021/acs.est.8b01391, 2018.
Якобсон, М. З .: Разработка и применение нового моделирования загрязнения воздуха. система — II, Устройство и конструкция аэрозольного модуля, Атмос. Environ., 31, 131–144, 1997.
Jia, J., Cheng, S., Liu, L., Lang, J., Wang, G., Chen, G., и Liu, X .: An Интегрированный подход к моделированию WRF-CAMx для анализа воздействия внедрения Аварийный PM 2,5 Меры контроля во время красных тревог в Пекине в Декабрь 2015 г., Aerosol Air Qual.Res., 17, 2491–2508, https://doi.org/10.4209/aaqr.2017.01.0009, 2017.
Li, L., Chen, CH, Fu, JS, Huang, C., Streets, DG, Huang, HY, Zhang, GF, Wang, YJ, Jang, CJ, Wang, HL, Chen, YR и Fu, JM: Качество воздуха и выбросы в дельте реки Янцзы, Китай, Atmos. Chem. Phys., 11, 1621–1639, https://doi.org/10.5194/acp-11-1621-2011, 2011.
Li, L., Cheng, S., Li, J., Lang, J. , и Чен, Д .: Применение Подход к моделированию MM5-CAMx-PSAT для исследования источника выбросов Вклад в загрязнение атмосферы в Таншане, Северный Китай, Математика.Пробл. Англ., 2013, 1–12, https://doi.org/10.1155/2013/136453, 2013.
Ли, Л., Ан, Дж. Ю., Чжоу, М., Янь, Р. С., Хуанг, К., Лу, К., Лин, Л., Ван, Ю. Дж., Тао, С. К., Цяо, Л. П., Чжу, С. Х. и Чен, К. Х .: Источник распределение мелких частиц и их химических компонентов над Янцзы Дельта реки, Китай, во время эпизода загрязнения из-за сильной дымки, Атмос. Environ., 123, 415–429, https://doi.org/10.1016/j.atmosenv.2015.06.051, 2015.
Liu, Y., Li, L., An, J., Huang, L. , Ян Р., Хуанг, К., Ван, Х., Ван, К., Ван М. и Чжан В .: Оценка биогенных выбросов ЛОС и их воздействия. об образовании озона над районом дельты реки Янцзы, Китай, Атмос. Environ., 186, 113–128, https://doi.org/10.1016/j.atmosenv.2018.05.027, 2018.
Мартин, Л. Р. и Гуд, Т. У .: Катализированное окисление диоксида серы в решение: железо-марганцевый синергизм, Атмос. Environ. А Gen. Top., 25, 2395–2399, 1991.
Massling, A., Stock, M., Wehner, B., Wu, Z.J., Hu, M., Брюггеманн, Э., Гнаук Т., Херрманн Х. и Виденсохлер А. городской субмикронный аэрозоль в Пекине, Атмос. Окружающая среда, 43, 1578–1589, 2009.
Ming, L., Ling, J., Li, J., Fu, P., Yang, W., Di, L., Gan, Z., Wang, Z., and Ли, X .: PM 2,5 в дельте реки Янцзы, Китай: химический состав, сезонные колебания и региональные явления загрязнения окружающей среды, Environ. Pollut., 223, г. 200–212, https://doi.org/10.1016/j.envpol.2017.01.013, 2017.
Quan, J., Tie, X., Zhang, Q., Liu, Q., Li, X., Gao, Y., и Zhao, D .: Характеристики сильного аэрозольного загрязнения зимой 2012–2013 гг. В г. Пекин, Китай, Атмос. Environ., 88, 83–89, https://doi.org/10.1016/j.atmosenv.2014.01.058, 2014.
Ramboll Environ: Руководство пользователя комплексной модели качества воздуха с Extensions Version 6.40, Ramboll Environ, Novato, California, доступно по адресу: http://www.camx.com/files/camxusersguide_v6-40.pdf (последний доступ: 23 ноября 2019 г.), 2016 г.
Сайнфельд, Дж.Х. и Пандис, С. Н .: Химия и физика атмосферы: от от загрязнения воздуха до изменения климата, Химия и физика атмосферы: из воздуха загрязнение к изменению климата, John Wiley & Sons, Chichester, 2006. s
Shao, J., Chen, Q., Wang, Y., Lu, X., He, P., Sun, Y., Shah, V ., Мартин, Р., Филип, С., Сонг, С., Чжао, Ю., Се, З., Чжан, Л., и Александер, Б.: Механизмы образования гетерогенных сульфатных аэрозолей во время зимней дымки в Китае: качество воздуха оценка модели с использованием наблюдений за сульфатными изотопами кислорода в Пекине, Атмос.Chem. Phys., 19, 6107–6123, https://doi.org/10.5194/acp-19-6107-2019, 2019.
Ши, Г., Сюй, Дж., Пэн, X., Сяо, З., Чен, К., Тянь, Ю., Гуань, X., Фэн, Ю., Ю, Х., Нэнес, А., и Рассел А.Г.: pH аэрозолей в загрязненной атмосфере: вклад источников в сильнокислый аэрозоль, Environ. Sci. Технол., 51, 4289–4296, 2017.
Сонг, С., Гао, М., Сюй, В., Шао, Дж., Ши, Г., Ван, С., Ван, Ю., Сунь, Ю. и МакЭлрой , МБ: pH мелких частиц для зимней дымки в Пекине по данным различных моделей термодинамического равновесия, Атмос.Chem. Phys., 18, 7423–7438, https://doi.org/10.5194/acp-18-7423-2018, 2018.
Сонг, С., Гао, М., Сюй, В., Сун, Ю. , Worsnop, DR, Jayne, JT, Zhang, Y., Zhu, L., Li, M., Zhou, Z., Cheng, C., Lv, Y., Wang, Y., Peng, W., Xu , X., Lin, N., Wang, Y., Wang, S., Munger, JW, Jacob, DJ, and McElroy, MB: Возможный гетерогенный химический состав гидроксиметансульфоната (HMS) в зимней дымке на севере Китая, Atmos. Chem. Phys., 19, 1357–1371, https://doi.org/10.5194/acp-19-1357-2019, 2019.
Wang, G., Чжан, Р., Гомес, М. Э., Ян, Л., Замора, М. Л., Ху, М., Линь, Ю., Пэн, Дж., Го, С., Мэн Дж. И Ли, Дж .: Устойчивое образование сульфатов из Лондонский туман превращается в китайскую дымку, P. Natl. Акад. Sci. USA, 113, 13630–13635, https://doi.org/10.1073/pnas.1616540113, 2016.
Wang, M., Cao, C., Li, G., and Singh, RP: Анализ серьезного продолжительный эпизод региональной дымки в дельте реки Янцзы, Китай, Атмос. Environ., 102, 112–121, https://doi.org/10.1016/j.atmosenv.2014.11.038, 2015.
Ван С., Нан, Дж., Ши, К., Фу, К., Гао, С., Ван, Д., Цуй, Х., Сайз-Лопес и Чжоу Б.: Атмосферный аммиак и его влияние на региональные качество воздуха над мегаполисом Шанхай, Китай, Науки. Реп., 5, 15842, https://doi.org/10.1038/srep15842, 2015.
Ван, Ю., Чжан, К., Цзян, Дж., Чжоу, В., Ван, Б., Хе, К., Дуань, Ф., Чжан, К., Филип С. и Се Ю.: усиление образования сульфатов во время суровых условий Китая. эпизод зимней дымки в январе 2013 года, отсутствующий в нынешних моделях, J. Geophys. Res.-Atmos., 119, 10425–10440, https: // doi.org / 10.1002 / 2013jd021426, 2014.
Ван, X., Ли, Дж., Чжан, Й., Се, С., и Тан, X: указание источника озона во время сильного фотохимического смога в Пекине, Китай, Sci. China B Chem., 52, 1270–1280, https://doi.org/10.1007/s11426-009-0137-5, 2009.
Xie, Y., Wang, G., Wang, X., Chen, J., Chen, Y., Tang, G., Wang, L., Ge, S., Xue, G., Wang , Ю. и Гао, Дж .: Наблюдение за PM 2,5 с преобладанием нитратов и повышением pH частиц в городском Пекине зимой 2017 г., Atmos.Chem. Phys. Обсудить., Https://doi.org/10.5194/acp-2019-541, в обзоре, 2019.
Сюй, Дж.С., Сюй, ХХ, Сяо, Х., Тонг, Л., Снейп, СЕ, Ван, CJ, и он, J .: Состав и источники аэрозолей в периоды высокого и низкого уровня загрязнения в Нинбо, Китай, Атмос. Res., 178–179, 559–569, https://doi.org/10.1016/j.atmosres.2016.05.006, 2016.
Ярвуд, Г., Юнг, Дж., Уиттен, Г. З., Хео, Г., Меллберг, Дж., И Эстес, Э .: Обновления механизма углеродных связей для версии 6 (CB6), представленные на 9-я ежегодная конференция CMAS, Чапел-Хилл, октябрь 2010 г.
Ye, X. N., Ma, Z., Hu, D. W., Yang, X., and Chen, J.M .: Разрешение по размеру гигроскопичность субмикронных городских аэрозолей в Шанхае во время зима, Атмос. Res., 99, 353e364, https://doi.org/10.1016/j.atmosres.2010.11.008, 2011.
Йе, X., Тан, К., Инь, З., Чен, Дж., Ма, З., Конг, Л., Ян, X., Гао, В., и Гэн, Ф .: Гигроскопический рост городских аэрозольных частиц в 2009 г. Кампания Мираж-Шанхай, Атмос. Environ., 64, 263–269, 2013.
Ye, C., Liu, P., Ma, Z., Xue, C., Zhang, C., Zhang, Y., Liu, J., Liu, C., Sun, X., и Mu, Y .: Высокая концентрация H 2 O 2 , наблюдаемая во время дымки периоды зимой в Пекине: важность окисления H 2 O 2 в образовании сульфатов, Environ. Sci. Tech. Lett., 5, 757–763, 2018.
Zhang, L., Brook, J. R., and Vet, R .: Пересмотренная параметризация для газообразного сухого осаждения в моделях качества воздуха, Atmos. Chem. Phys., 3, 2067–2082, https://doi.org/10.5194/acp-3-2067-2003, 2003.
Zheng, B., Zhang, Q., Zhang, Y., He, KB, Wang, K., Zheng, GJ, Duan, FK, Ma, YL, and Kimoto, T.: Гетерогенная химия: механизм отсутствует в существующих моделях для объяснения образования вторичного неорганического аэрозоля во время эпизода дымки в январе 2013 г.