Как образуются положительно и отрицательно ионы: как образуются положительно и отрицательно заряженные ионы?
Ионы положительные — Справочник химика 21
Под действием световой энергии и амфотерных ионов двойные связи акцептора поляризуются, что приводит к повышению реакционной способности я-электропов. Сложный амфотерный ион (XXVII) выделяет молекулу кислорода, которая действует так же, как амфотерный ион, и превращается сам в нормальный эозин (XXIV). Образование конечных продуктов фотосенсибилизированного окисления объясняется присоединением молекулы кислорода, действующей как амфотерный ион, положительно заряженным атомом к я-электронам двойной связи, в результате чего образуется новый амфотерный ион (XXVIII), который затем перестраивается в стабильную гидроперекись. Если в качестве акцептора использован а-пинен, то эти стадии реакции можно представить следующим образом [c.359]Когда кристалл соли, например, хлорида калия, попадает 3 воду, то расположенные на его поверхности ионы притягивают к себе полярные молекулы воды (ион-дипольное взаимодействие), К ионам калия молекулы воды притягиваются своими отрицательными полюсами, а к хлорид-ионам — положительными (рпс. 80).
Наиболее распространенной теорией механизма каталитического крекинга является карбоний-ионная, предложенная Уитмором (карбо-ний-ион — положительно заряженный углеводородный ион). [c.88]
По условию электронейтральности можно написать, что 7м = —найти величину функцию потенциала, необходимо сделать определенные предположения о законе ее изменения с расстоянием от электрода. Гуи и Чапман считают, что ионы можно рассматривать как материальные точки, не имеющие собственного объема, но обладающие определенным зарядом, и что их распределение в поле заряда, равномерно размазанного по поверхности электрода, подчиняется формуле Больцмана (рис. 12.2). Величина /ь определяется при этом суммированием всех избыточных зарядов ионов (положительных при отрицательно заряженной поверхности металла и отрицательных при ее положительном заряде), находящихся в столбе жидкости, перпендикулярном поверхности электрода и имеющем сечение 1 см .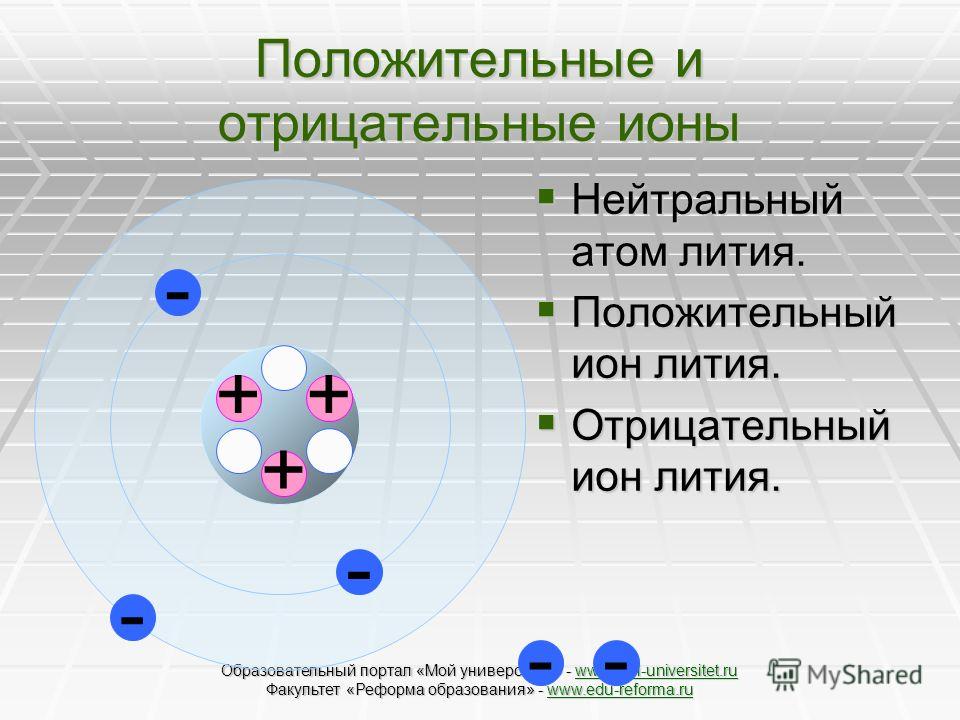
При ионизации образуются как положительные, так и отрицательные ионы положительные ионы остаются вблизи короны , а отрицательные направляются с огромной скоростью к аноду, встречая и заряжая на своем пути взвешенные в газе частицы. [c.62]
Чтобы определить какие ионы и сколько их находится в водных растворах, существует широкий набор методов. В этой работе вы будете использовать методы, которые действительно могут использоваться для проверки наличия в воде тех или иных ионов. Положительно заряженные ионы имеют недостаток электронов и называются катионами, отрицательно заряженные ионы несут избыток электронов и называются анионами. Общая цель состоит в качественном определении двух катионов и двух анионов. [c.45]
Активными центрами реакции цепной полимеризации могут быть свободные радикалы (электронейтральные частицы, имеющие неспаренный электрон) или ионы (положительно или отрицательно заряженные частицы). В зависимости от характера активных центров различают радикальную и ионную полимеризацию. [c.330]
Электролиты при растворении в воде диссоциируют (распадаются) на ионы — положительные и отрицательные. [c.119]
Условились записывать схемы элементов таким образом, чтобы левый электрод был отрицательным (электроны текут по металлическому проводнику слева направо и в том же направлении переносится ионами положительное электричество внутри элемента). Такая запись отвечает протеканию реакции, сопровождающейся убылью свободной энергии, и положительной величине э. д. с. [c.157]
Каковы должны быть заряд иона (положительный, отрицательный, высокий, низкий) и его размеры (большой, небольшой), чтобы в результате гидролиза раствор имел наименьшее значение pH [c.217]
Соли, молекулы кислот и оснований в водном растворе диссоциируют (распадаются) на положительно и отрицательно заряженные частицы — ионы. Положительные ионы называются катионами, а отрицательные — анионами. Распад молекул на ионы объясняется электростатическим взаимодействием между молекулами воды и молекулами кислот и оснований и солями. [c.129]
Положительные ионы называются катионами, а отрицательные — анионами. Распад молекул на ионы объясняется электростатическим взаимодействием между молекулами воды и молекулами кислот и оснований и солями. [c.129]
Если в раствор электролита внести два электрода, один из которых соединен с положительным полюсом внешнего источника постоянного тока (батареи), другой — с отрицательным, то наблюдается следующая картина под влиянием электрических полей электродов положительные ионы двигаются к отрицательному электроду (катоду), отрицательные ионы — к положительному электроду (аноду). Столкнувшись с катодом, положительные ионы получают от него электроны, переходя в нейтральное состояние отрицательные ионы, столкнувшись с анодом, отдают ему свои электроны, переходя также в нейтральное состояние. Таким образом, в растворе устанавливается движение ионов — положительных (катионов) к катоду, отрицательных (анионов) к аноду.
Если взять сто элементов периодической системы, то они могут образовать 100 одноатомных молекул, 200 возможных одновалентных ионов (положительных и отрицательных, 5050 двухатомных молекул, 10 трехатомных молекул и приблизительно 10 многоатомных молекул). Ясно, что при таком положении бесполезно надеяться иметь таблицы с экспериментальными термохимическими данными по всем многоатомным частицам или даже по всем ограниченным подклассам среди них. Поэтому для различных типичных термохимических расчетов часто возникает необходимость оценить эти величины с помощью приближенных термохимических закономерностей. [c.72]
Ионная [гетерополярная) решетка. В узлах пространственной решетки в этом случае находятся электрически заряженные частицы — ионы положительно заряженные — катионы и отрицательно заряженные — анионы. Ионные решетки характерны для множества неорганических соединений, принадлежащих ко всем их классам (разнообразные окислы, соли и т. д.). Ионное строение имеет также большинство минералов.
Активными центрами реакции цепной полимеризации могут быть свободные радикалы (электронейтральные частицы, имеющие один или два неспаренных электрона), ионы (положительно или отрицательно заряженные частицы) или ион-радикалы. [c.63]
Отрицательные ионы Положительные ионы с зарядностью [c.197]
В гидроокисях и солях имеются оба вида связи. Атомы элементов гидроксила и кислотных остатков связаны друг с другом ковалентными связями, а между металлами и гидроксилом или металлами и кислотными остатками связь ионная. Таким образом, кристаллы щелочей и солей кислородных кислот, подобно солям бескислородных кислот, например Na+ I , слагаются из ионов. Положительно заряжены в них ионы металла, а отрицательно заряжены ионы гидроксила и ионы кислотных остатков. Ионами, таким образом, могут быть не только заряженные атомы, но и заряженные группы атомов.
Диссоциация электролита приводит к образованию разноименно заряженных ионов — положительных (катионов) и отри- [c.105]
Эти предположения б дальнейшем были развиты в стройную теорию, получившую иазваине теории электролитической диссоциации. Согласно этой теории, при растворении в воде электролиты распадаются (диссоциируют) на положительно и отрицательно заряженные ионы. Положительно заряженные ионы называются катионами к ним относятся, например, ионы йодорода и металлов. Отрицательно заряженные ионы называются анионами к ннм принадлежат ионы кислотных остатков и [c.233]
Диссоциация электролита приводит к образованию разноименно заряженных ионов — положительных (катионов) и отрицательных (анионов). При этом суммарные заряды тех и других равны по абсолютной величине, поэтому раствор электролита всегда электронейтрален. [c.118]
Размытость полосы поглощения гидроксония можно объяснить особенностью строения этого иона. Положительный заряд elo мигрирует по всему объему гидрата, вызывая непрерывное изменение силовых постоянных ОН-связей и, следовательно, частот их колебаний.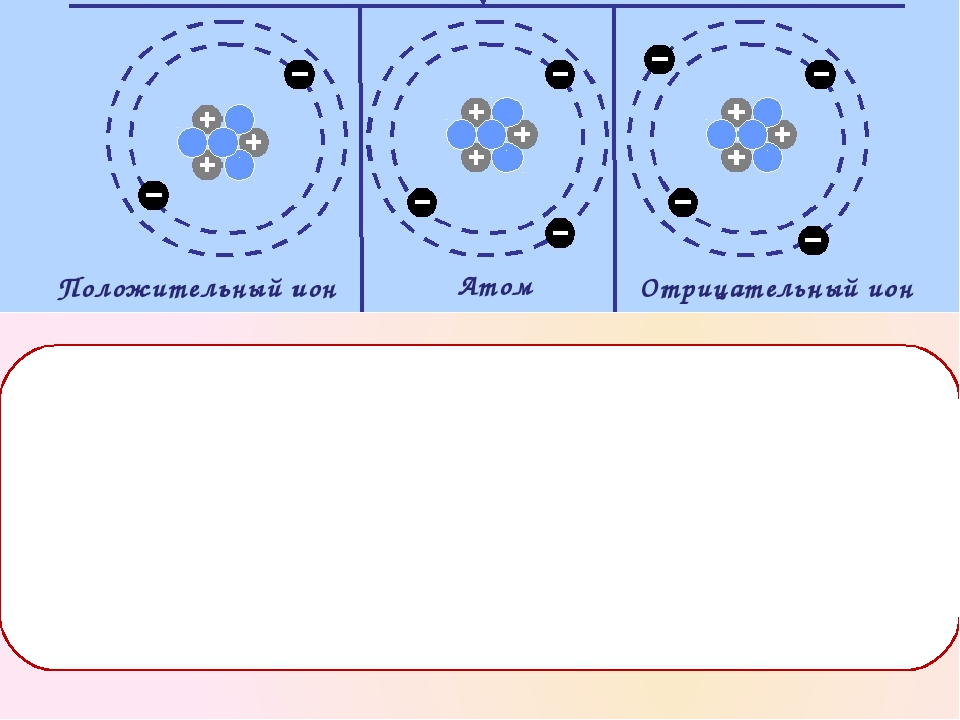 Поэтому невозможно определить раздельно полосы поглощения, соответствующие ОН-связям Н3О+ и гидратной оболочки. [c.45]
Поэтому невозможно определить раздельно полосы поглощения, соответствующие ОН-связям Н3О+ и гидратной оболочки. [c.45]
Каковы должны быть заряд иона (положительный, отрицательный, высокий, низкий) и его размеры (больщой, небольшой), чтобы, прогидролизо-вавщись, ион дал раствор с наинизшим значением pH.
Принято записывать подобные схемы таким образом, чтобы левый электрод был отрицательным (электроны текут по металлическому проводнику слева направо и в том же направлении переносится ионами положительное электричество внутри элемента). Такая запись отвечает проте- [c.208]
Отрицательно заряженные ионы хлора (СР) называются хлорид-ионы. Очень небольшая часть молекул воды (Н О) тоже всегда присутствует в виде ионов-положительно заряженных ионов водорода (Н ) и отрицательно заряженных гидроксид-ионов (ОН ). [c.120]
Введение в систему вода — растворитель солей или кислот также изменяет соотношение между содержанием молекул в ассоциатах различного типа. Особенно сильные изменения наблюдаются в спектрах поглощения при введении в растворитель, содержащий воду, некоторых определенных количеств кислоты [152]. При введении, например, НС1 в области первого обертона валентных колебаний ОН-групп появляется и с увеличением концентрации НС1 растет широкая, размытая полоса с максимумом в области 6200—6000 см , которую следует приписать гидратированному иону гидроксония. Размытость этой полосы может быть объяснена особенностью строения этого иона. Положительный заряд его мигрирует по всему объему гидрата, вызывая непрерывное изменение силовых постоянных ОН-связи и, следовательно, частот колебаний. Поэтому невозможно определить раздельно полосы поглощения, соответствующие ОН-связям самого иона гидроксония и его гидратной оболочки. [c.162]
В соединениях, молекулы которых содержат гетероатом X с неподе-ленной электронной парой, разрывается соседняя с гетероатомом С—С-связь (ониевое расщепление). Механизм этого процесса можно легко представить, фиксируя заряд и электрон радикала на гетероатоме. Тогда при миграции электрона получатся алкильный радикал и ониевый ион, положительный заряд которого может стабилизироваться вследствие его делокализации
Механизм этого процесса можно легко представить, фиксируя заряд и электрон радикала на гетероатоме. Тогда при миграции электрона получатся алкильный радикал и ониевый ион, положительный заряд которого может стабилизироваться вследствие его делокализации
До сих пор обсуждался только один тип полимеризации, протекающей через свободные радикалы. Однако использование других инициаторов или катализаторов позволяет провести полимеризацию через стадию образования промежуточных ионов положительных ионов катионная полимеризация), если в качестве катализатора используется кислота, или отрицательных ионов анионная полимеризация), когда катализатором служит основание. [c.256]
Весьма своеобразно коагулирующее действие проявляется у органических ионов. Положительно заряженные одновалентные ионы алкалоидов и красителей действуют гораздо сильнее, чем соответствующие им по валентности ионы неорганических электролитов. Это объясняется высокой адсорбционной способшстью громоздких органических ионов, обладающих большей поляризуемостью. [c.288]
Когда нейтральный атом теряет или приобретает электрон, то образуется ион. Положительные ионы меньше, чем исходные атомы, отрицательные — больше. Это становится понятным, если иметь в виду число электронов, которые должен удерживать заряд ядра. В положительном ионе заряд ядра действует на меньшее число электронов и поэтому притягивает их ближе к себе, гогда как в отрицательном ионе заряд ядра должен действовать на большее число электронов, каждый удерживается менее прочно, и электронное облако расширяется. Как и следует ожидать, радиус иона уменьшается по мере увеличения числа потерянных электронов (см. табл. 4-4 и 4-5). [c.112]
В первом случае трансляционное движение молекул воды вблизи иона ослабнет, вследствие чего они станут менее подвижными и свяжутся с ионом (положительная гидратация). Такая гидратация возникает в присутствии в растворе ионов с больплой плотностью заряда, например А1з+, Сг +, Mg , a +, Ва +, Ыа+, ОН , 504. [c.26]
[c.26]
А. Нира (рис. 3). Для ионизации молекул обычно используют электроны с энергиями 70-100 эВ, к-рые движутся со скоростью 10 см/с и проходят путь, равный диаметру молекулы орг. соед. за 10 с. Этого времени достаточно для удаления электрона из молекулы в-ва и образования мол. иона-положительно заряженного ион-радикала М , имеющего энергию 2-8 эВ. Ионы с миним. запасом энергии достаточно устойчивы и достигают приемника. Ионы с большим запасом внутр. энергии распадаются на пути движения на ионы с меньшей мол. массой (т, наз. осколочные ионы), характерные для в-ва определенного строения. Для ионизации молекул энергия электронного пучка должна превышать нек-рую критическую для в-ва величину, наз. потенциалом ионизации. Потенциалы ионизации лежат в пределах 3,98 эВ (Рг)-24,58 эВ (Не), для большинства орг. соед. 7-11 эВ. Используя моноэнергетич. пучки электронов и снижая их энергию до пороговых значений, можно определять потенциалы ионизации в-в и потенциалы появления ионов-критич. энергию электронов, при к-рой в спектре появляются линии соответствующих осколочных ионов. [c.659]
Эти предположения в дальнейшем были развиты в стройную теорию, получившую название теории электролитической диссоциации. Согласно этой теории, при растворении в воде электролиты распадаются (диссоциируют) на положительно и отрицательно заряженные ионы. Положительно заряженные ионы называются катионами к ним относятся, например, ионы водорода и метгиллов. Отрицательно заряженные ионы называются анионами к ним принадлежат ионы кислотных остатков и гидроксид-ионы. Как и молекулы растворителя, ионы в растворе находятся в состоянии неупорядоченного теплового движения. [c.233]
Изучение продуктов электролиза позволяет приписать ионам положительные или отрицательные заряды. Очевидно, если кислота, например хлорная H IO4, диссоциирует, предположим, на два иона и при электролизе водного раствора на катоде выделяется водород, то уравнение диссоциации следует записать так [c. 279]
279]
Электролиты при растворении в воде распадаются (диссоциируют) на ионы — положительные н отрицательные. Свойстиа ионов совершенно иные, чем у образовавшпх их атомов. Напрнмер, атомы металлического [ атрия Na .пергичпо разлагают воду с выделением водорода, в то время как патрин-ионы Na воду не разлагают. Атомы хлора С1 образуют двухатомные молекулы, которые имеют желто-зеленый цвет и резкий запах. Хлорнд-ионы i бесцветны и не имеют запаха. Ионы водорода Н окрашивают спипй лакмус в красный цвет. Но это свойство отсутствует у атомов водорода Н. [c.71]
Специфическая роль третичных водородных атомов в распространении карбоний-ионов отмечается в реакциях крекинга и риформинга, протекающих при высоких температурах в присутствии твердых катализаторов. Связь углерод — углерод характеризуется наличием электронной пары, поделенной между двумя углеродными атомами. В углеводороде, в котором протекает скелетная перегруппировка, должна разрываться по крайней мере одна такая связь при этом электроны могут быть поделены поровну (образование свободного радикала) или один углеродный атом сохраняет оба электрона, в то время как при другом не остается ни одного (образование иона). Энергетические барьеры для обоих этих случаев сильно различаются так, для образования двух нропильных радикалов из к-гексана требуется всего 76 ккал [69], в то время как для образования пары нропильных ионов требуется 260 ккал [67. Однако в присутствии надлежащим образом выбранного катализатора, особенно если он обладает в какой-то стенени ионной функцией, может инициироваться предварительная стадия — образование положительно заряженного иона за счет передачи протона или гидридного иона. После этого разрыв связи углерод — углерод происходит в результате образования из нестабильного карбоний-иона положительно заряженных ионных осколков и нейтральной молекулы алкена или ароматического углеводорода. [c.170]
Аррениус (1887 г.) высказал гипотезу, объясняющую увеличение числа частиц в растворах электролитов диссоциацией их молекул в процессе растворения. Учитывая, что растворы кислот, оснований и солей проводят электрический ток, Аррениус предположил, что в результате диссоциации получаются заряженные частицы — ионы положительные — катионы и отрицательные — анмояы. Поскольку раствор в целом электро-нейтрален, сумма всех положительных зарядов должна быть равна суммарному отрицательному заряду. [c.92]
Учитывая, что растворы кислот, оснований и солей проводят электрический ток, Аррениус предположил, что в результате диссоциации получаются заряженные частицы — ионы положительные — катионы и отрицательные — анмояы. Поскольку раствор в целом электро-нейтрален, сумма всех положительных зарядов должна быть равна суммарному отрицательному заряду. [c.92]
Из (8.55) вытекают два важных следствия. Во-первых, константа скорости ионной реакции зависит от ионной силы раствора, и в разбавленных растворах, когда 1, Д1пА эксп что подтверждается большим экспериментальным материалом. В случае реакции одноименно заряженных ионов наклон Мпк/А(Р/ ) положительный (ионная атмосфера облегчает течение реакции), в случае реакции между разноименно заряженными ионами этот наклон отрицателен, и чем больще произведение зарядов гв, тем больще абсолютная величина тангенса угла наклона. Часто наблюдаются отклонения из-за особенностей механизмов реакций. Во-вторых, к сп зависит от е так, что AlnA n — А(е» )- И в этом случае наклон тем больше, чем больше произведение гв1, и для одноименно заряженных ионов наклон отрицательный,, для разноименных ионов — положительный. [c.225]
В молекулах электролитов атом1 связаны ионной или достаточно полярной ковалентной сйязью. В соответствии с представлениями, развитыми шведским ученым Сванте Аррениусом (1887), такие вещества в растворе диссоциируют па противоположно заряженные ионы положительно заряженные — катионы и отрицательно заряженные — анионы [c.87]
Отрицательные ионы
ВОЗДУХ – ЭТО ПАСТБИЩЕ ЖИЗНИ
Воздух — это смесь газов, формирующая защитную оболочку вокруг Земли, называемую атмосферой.
Воздух необходим для жизни на Земле — для дыхания и для питания растений. Воздух также защищает поверхность Земли от опасного ультрафиолетового излучения Солнца. Воздух состоит из азота- 78%, кислорода — 21%, других газов — 1%.
У атома кислорода в наружной оболочке 6 электронов. Для того чтобы стать устойчивым, ему необходимо наполнить свою оболочку ещё двумя электронами, поэтому молекула кислорода воздуха легко присоединяет к себе 1 или 2 свободных элементов, ионизируется и превращается в аэроион (анион) кислорода отрицательной полярности. Ионами называются атомы или молекулы, потерявшие или присоединившие электрон, из-за чего получили положительный или отрицательный заряд.
В результате потери или присоединения одного или нескольких электронов атом становится ионом. Все ионы — электрически заряженные частицы. Заряд в ионе возникает из-за того, что количество положительно заряженных протонов и отрицательно заряженных электронов становится разным.
Атом, потерявший электрон, делается положительно заряженным ионом — катионом (от греч. kation, буквально — идущий вниз). Атом, который приобрёл электрон, становится отрицательно заряженным ионом — анионом (от греч. anion, буквально идущий вверх).
Атмосферный воздух всегда содержит одновременно отрицательные и положительные частицы. Основным источником этой естественной ионизации служат присутствующие в воздухе:
1. Газообразные продукты распада радия и тория, находящиеся в воздухе. Они вызывают диссоциацию воздушных молекул, рождая отрицательно заряженные молекулы кислорода, называемые легкими аэроионами.
2. Гамма-излучение радиевых солей, находящихся в поверхностном слое земной коры в ничтожном количестве. Установлено, что почти все каменные породы радиоактивны. Природные воды также содержат соли радиоактивных веществ.
3. Солнечная радиация.
4. Ультрафиолетовый свет Солнца.
5. Космические лучи.
6. Электрические разряды в атмосфере (молнии, разряды на вершинах гор).
7. Дробление и распыление воды над водопадами, поверхностью моря во время прибоя и прилива, морской бури, при дожде — это баллоэлектрический эффект.
8. Трибоэлектрический эффект — взаимное трение песчинок, частиц пыли, снега, града.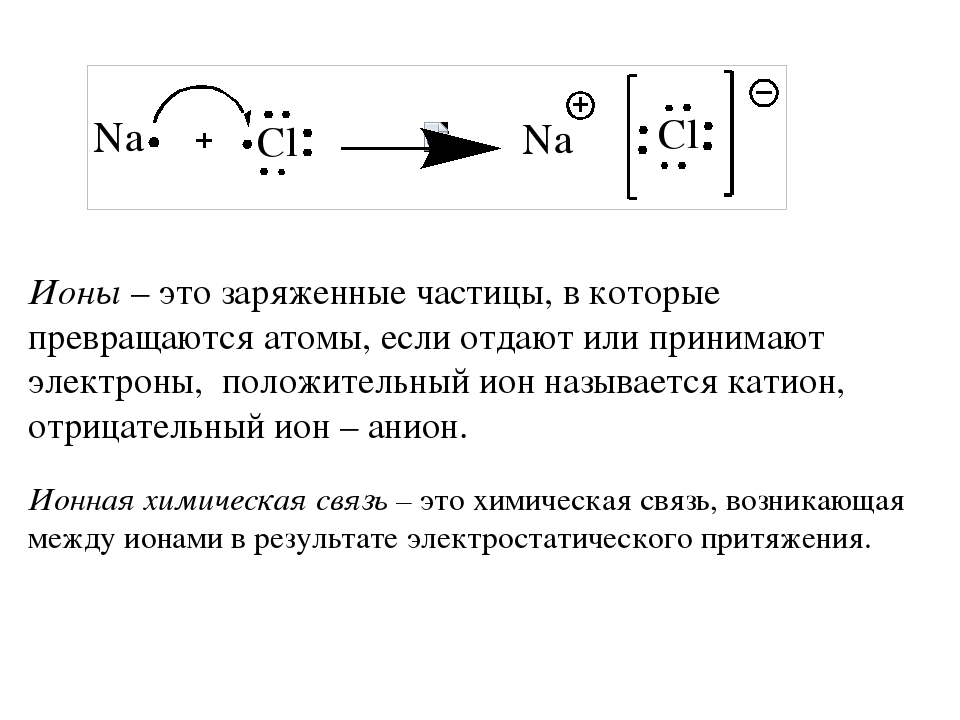
9. Распад органических веществ, многообразные химические реакции, КУПИТЬ
протекающие на поверхности почвы, испарение воды.
В горном воздухе возле водопадов, бурных рек, на морском берегу во время интенсивного прибоя число легких отрицательно заряженных анионов резко возрастает. Достаточно в течение нескольких минут побыть в отрицательно ионизированном воздухе, как электрический потенциал всех клеток организма начинает возрастать и потом долго держится на достигнутом уровне.
Значит, электростатическим «багажом» организма можно управлять.
Под влиянием кислорода отрицательной полярности меняется качество функций органов и общее нервно-психическое состояние организма.
Как отрицательные ионы воздействуют на человека?
* помогают человеку чувствовать себя лучше физически и психологически
* помогают справиться со стрессом
* облегчают боль в мышцах
* увеличивают сексуальную активность
* помогают бороться с агрессивностью и усталостью
* имеют некоторый обезболивающий эффект
* помогают в регулировании кровяного давления
* благотворно действует на состояние кожи
* уменьшают клеточный склероз
* помогают при коронарных и респираторных проблемах, ангинах и т.п.
* помогают в улучшение метаболизма
Анионы способствуют излечению многих заболеваний. Это болезни сердечно-сосудистой системы, от которых стали страдать не только пожилые люди, это гипертония и стенокардия, которые тоже помолодели. Успех лечения гипертонической и гипотонической болезней определяется тем, что отрицательные ионы кислорода стабилизируют функциональное состояние центральной нервной системы и гемодинамического центра, меняют тонус гладкой мускулатуры сосудов, уменьшают содержание холестерина. Ионизированный воздух благотворно влияет на дыхательную и ЛОР-систему человека, аэроионотерапии поддаются ангина, сезонные катары и даже начальные стадии туберкулеза.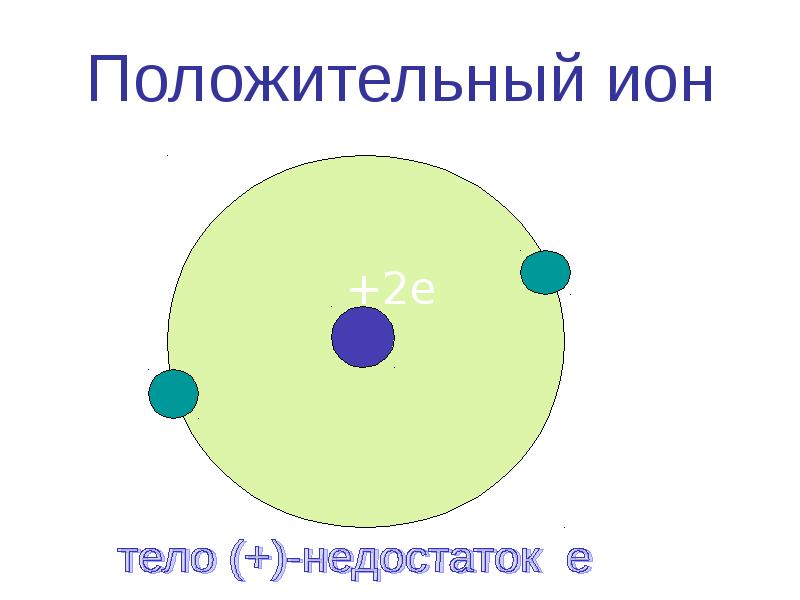 Анионы повышают трудоспособность, возбуждают хороший аппетит и заставляют правильно функционировать кишечник, а также усиливают метаболизм в слизистой оболочке желудочно-кишечного тракта более чем на 50%, а это ускоряет темпы регенерации и ликвидирует язвенные дефекты. Неврозы, бессонница, мигрени, раздражительность, быстрая утомляемость отступают под действием анионов, которые понижают возбудимость нервной системы (в том числе и вегетативной) и стабилизируют ее тонус на оптимальном уровне. Отрицательные ионы кислорода дают хороший эффект при вегетативно-эндокринных нарушениях. Неплохие результаты отрицательные ионы кислорода могут дать и в косметологии, они улучшают тургор кожи и ведут к исчезновению преждевременных морщин
Анионы повышают трудоспособность, возбуждают хороший аппетит и заставляют правильно функционировать кишечник, а также усиливают метаболизм в слизистой оболочке желудочно-кишечного тракта более чем на 50%, а это ускоряет темпы регенерации и ликвидирует язвенные дефекты. Неврозы, бессонница, мигрени, раздражительность, быстрая утомляемость отступают под действием анионов, которые понижают возбудимость нервной системы (в том числе и вегетативной) и стабилизируют ее тонус на оптимальном уровне. Отрицательные ионы кислорода дают хороший эффект при вегетативно-эндокринных нарушениях. Неплохие результаты отрицательные ионы кислорода могут дать и в косметологии, они улучшают тургор кожи и ведут к исчезновению преждевременных морщин
Как отрицательные ионы кислорода влияют на сердечно-сосудистую систему?
Большинство сердечно-сосудистых заболеваний связано с нарушением свертываемости крови и целостности стенок кровеносных сосудов. Компоненты крови имеют отрицательный заряд, который препятствует слипанию их друг с другом. С потерей заряда вязкость крови увеличивается, образуются тромбы. Одновременно в стенках кровеносных сосудов откладывается холестерин, сосуды теряют эластичность, сужается их просвет. Именно в этом кроется причина нарушения давления, инфарктов и инсультов.
Отрицательные ионы кислорода восстанавливают электрический заряд на кровеносных тельцах, кровоток приходит в норму. Экперименты показали, что при вдыхании аэроионов сосуды остаются элестиными, атеросклеротические бляшки не образуются.
Таким образом, отрицательные ионы кислорода обладают противотромботическим действием и противо атеросклеротическим действием, что помогает снизить риск сердечно-сосудистых катастроф.
При лечении гипертонии ионами кислорода А.Л. Чижевский отмечал снижение артериального давления у больных на 10-20 единиц уже после первого сеанса. Затем давление поднималось почти до первоначального уровня, а после 30-35 сеансов устойчиво нормализовалось. Причем результаты были тем успешней, чем хуже было первоначальное состояние пациентов.
Причем результаты были тем успешней, чем хуже было первоначальное состояние пациентов.
Почему легкие аэроионы помогают сохранить молодость?
С годами в организме человека происходят существенные изменения: уменьшается количество воды в тканях, снижается величина электрического заряда клеток, ухудшается тканевый электрообмен, то есть происходит постепенная электроразрядка организма. Все эти изменения характерны для старения.
Значит, если замедлить электроразрядку, постоянно дыша воздухом с оптимальным количеством аэроионов, можно остановить старость.
В лабораториях Мордовского государственно университета установлено, что ионы кислорода уменьшают содержание в крови свободных радикалов, разрушающих молекулы клеток и приводящих к старению.
Профессор Калифорнийского университета М. Роуз обнаружил ген-регенератор, который обновляет клетки. С возрастом его активность уменьшается, что ведет к старению. Не исключено, что продление жизни ионами кислорода связано с тем, что они повышают активность гена-регенератора.
Так или иначе, постоянное использование ионизатора воздуха дарит человеку несколько дополнительных лет жизни: улучшаются дыхание и состояние кожи, отступают морщины, перестают выпадать волосы.
В первых экспериментах А.Л. Чижевского (1918-1924 гг.) подопытные животные, вдыхавшие отрицательные ионы кислорода, жили на 42% дольше своих собратьев, причем продлевался период активности и бодрости.А.Л. Чижевский подсчитал, что падение электрического потенциала клеток до уровня, не совместимого с жизнью, занимает 180 лет. Таков срок жизни, отпущенный человеку природой.
Многочисленные электрометрические наблюдения показали, что в 1 смЗ воздуха:
|
Дикий лес и естественный водопад |
10 000 ионов/куб.см |
|
Горы и морское побережье |
5 000 ионов/куб. |
|
Сельская местность |
700-1 500 ионов/куб.см |
|
Центр городского парка |
400-600 ионов/куб.см |
|
Парковые аллеи |
100-200 ионов/куб.см |
|
Городская территория |
40-50 ионов/куб.см |
|
Кондиционируемые закрытые помещения |
0-25 ионов/куб.см |
Концентрация отрицательно-заряженных ионов и ее влияние на здоровье человека:
|
100 000 – 500 000 ионов/куб.см |
Достигается естественный терапевтический эффект |
|
50 000 – 100 000 ионов/куб.см |
Обретается способность стерилизации, дезодорирования и уничтожения токсинов |
|
5 000 – 50 000 ионов/куб.см |
Благотворное влияние на укрепление иммунной системы человека, помогающей бороться с болезнями |
|
1 000 — 2 000 ионов/куб.см |
Обеспечение основы для здорового существования |
|
Менее 50 ионов/куб.см |
Предпосылка для психологических расстройств |
Средняя продолжительность жизни анионов 46—60 секунд. В чистом воздухе — 100 секунд и больше.
В чистом воздухе — 100 секунд и больше.
Анионы быстроподвижны. Средняя скорость их движения равна 1—2 см/сек. Подвижность отрицательно заряженного иона превосходит подвижность положительно заряженных ионов в сотни раз.
Многочисленные наблюдения показывают, что ионизация отрицательной полярности резко улучшает физиологическое состояние подопытных животных, в то время как преобладание положительных зарядов при дефиците отрицательных, оказывается для них вредным.
Это действие ионов, как известно, было открыто и использовано еще в начале прошлого века великим русским ученым Чижевским. Он предложил обогащать воздух в помещениях отрицательными ионами с помощью сконструированных им ионизаторов воздуха генераторов отрицательных ионов. Он считал, что особенно важно это делать в каменных зданиях, содержащих избыток положительных ионов и недостаток отрицательных.
Впервые ионы воздуха были «предложены» животным 2 января 1919 года. Очень быстро были получены первые результаты: «отрицательные ионы воздуха влияют на организм хорошо, а положительные, наоборот, вредят здоровью, отрицательно влияют на рост, вес, аппетит, поведение и внешний вид животных».
После ряда опытов Чижевский пришел к выводу, что аеро ионизация может стать существенным фактором в решении проблемы сохранения здоровья и удлинение жизни человека.
Так появилась всем известная люстра Чижевского.
Современная среда обитания
|
Крупные города, большие потоки автомобилей, загрязнение воздуха, курение, одежда и мебель из синтетических тканей; современные строительные и отделочные материалы, системы центрального отопления и охлаждения в непроветриваемых высотных офисных и жилых зданиях — это наша среда обитания, почти не оставляющая отрицательных ионов для здоровой жизни. Электрическое поле Земли является причиной миграции заряженных частиц в атмосфере. Эти перепады отображаются на нашем самочувствии. Одним из факторов, которые влияют на ионизацию воздуха, является ветер. Биометеорологи утверждают, что в периоды преобладания теплых ветров у людей чаще наблюдается депрессивное состояние. В это время возрастает количество сердечных приступов, суицидов и агрессии. В некоторых больницах на юге Германии даже запретили проведение операций через сутки к ожидаемым ветрам. Человек, как и любой живой организм, имеет собственную «оболочку» из электрических зарядов соответствующей поверхностной плотности. Излишек положительно заряженных ионов вокруг человека приводит к «разрядке» организма и разрушения его электрического равновесия. Аероионы проникают в организм сквозь кожу и дыхательные пути. Вдыхание положительных ионов в течение 20 минут служит причиной кашля, головной боли и насморка. Положительные ионы могут стать причиной неправильного функционирования щитовидной железы, послужить причиной депрессии, бессонницы, тахикардии. Отрицательные ионы ускоряют окислительную деградацию серотонина, а положительные – имеют обратное действие и деактивируют энзимы, повреждающие серотонин. Повышение уровня серотонина вызывает: а) тахикардию б) повышение кровяного давления в) спазм бронхов, вплоть до приступа астмы г) повышенную перистальтику кишечника д) повышенную чувствительность к боли е) повышенную агрессивность Снижение уровня серотонина является успокаивающим и увеличивает защитные силы организма против различных инфекций (например, гриппа). Отрицательные ионы приводят к повышению гемоглобинового/кислородного сродства, и кислородное давление в крови повышается, но диоксидное давление частично понижается. Это приводит к снижению частоты дыхания и увеличивает метаболизм растворяемых в воде витаминов. К тому же, отрицательные ионы приводят к повышению уровня pH тела, делая жидкости организма более щелочными. Из-за загрязнения воздуха отрицательных ионов становится еще меньше. В городском воздухе опасно мало отрицательных ионов, нарушено естественное соотношение положительных и отрицательных ионов — 5:4, поэтому люди неизбежно и постоянно отравляются положительными ионами. Более половины городского населения страдает, не осознавая, почему они чувствуют себя не лучшим образом. В загородном воздухе присутствует около 6000 частиц пыли на 1 мл, а в промышленных городах в 1 мл воздуха – миллионы частиц пыли. Пыль разрушает аэроионы, укрепляющие человеческое здоровье. И в первую очередь пыль «съедает» отрицательные ионы, т.к. пыль заряжена положительно и притягивается к отрицательным ионам, при этом легкий отрицательный ион превращается во вредный тяжелый ион. Регулярные измерения на главных улицах Санкт-Петербурга, Дублина, Мюнхена, Парижа, Цюриха и Сиднея показывают, что в полдень остается всего 50 — 200 легких ионов в 1 см³, это в 2-4 раза ниже нормы, необходимой для нормального самочувствия. Как действует ионное истощение в закрытом пространстве еще в конце 30-х годов продемонстрировали японские ученые Имперского Университета о. Хоккайдо. В комнате можно было изменять температуру, количество кислорода и влажность, а отрицательные ионы — постепенно удалять. 14 мужчин и женщин 18-40 лет находились в этой комнате. Уровень температуры, влажности и кислорода был на оптимальном уровне, а отрицательные ионы из воздуха начали удалять. Испытуемые почувствовали недомогания от простой головной боли, усталости и усиленного потоотделения до чувства обеспокоенности и понижения давления. Все заявили, что комната душная с “мертвым” воздухом. Вторая группа находилась в кинотеатре, где в полном зале из-за пыли и большого количества людей легких отрицательных ионов почти не осталось естественным путем. После окончания фильма зрители чувствовали неприятную головную боль и потливость. Этих людей проводили в комнату, в которой генерировались отрицательные ионы, и скоро они почувствовали себя легче, головная боль и потоотделение исчезли. В следующий раз ученые направили людей в заполненный кинозал, а когда многие стали жаловаться на головную боль и потоотделение, в воздух зала из нескольких мест выпустили отрицательные ионы. Количество отрицательных ионов достигло 500 — 2500 в 1 куб. см. Через 1,5 часа фильма страдавшие головной болью и потоотделением, совершенно о них забыли, и чувствовали себя хорошо. Психиатры и психологи последние 20 лет говорят об огромных размерах проблемы “обеспокоенности”. До некоторого уровня беспокойство — это нормальное явление, основа для выживания человека. Но уровень беспокойства стал намного выше “здорового”. Симптомы отравления положительными ионами очень похожи на те, с которыми обращаются к врачам при психоневрозе беспокойства: неразумное беспокойство, бессонница, необъяснимая депрессия, раздражительность, внезапная паника, приступы абсурдной неуверенности и постоянные простуды. Врач Католического Аргентинского университета лечил пациентов, страдающих классическим беспокойством, с помощью отрицательных ионов. Все они жаловались на необъяснимые страхи и напряженность, типичные для психоневроза беспокойства. Через 10-20 15-тиминутных сеансов лечения воздухом с отрицательными ионами у 80% пациентов симптомы беспокойства исчезли полностью. По мнению японских исследователей, положительные ионы являются причиной многих сердечно-сосудистых и нервных заболеваний. Японские врачи-онкологи выдвигают новую теорию борьбы с раковыми заболеваниями. Эта теория была разработана на основе исследований, проводимых группой ученых под руководством Кэндзи Тадзавы, профессора университета медицины и фармакологии в Тояма, и профессора Нобору Хориути, директора онкологической клиники в Сакайдэ (префектура Кагава). Подробный доклад о результатах исследования был сделан на конференции Онкологической ассоциации Японии, в Нагое. Как объясняет профессор Хориути, если человек находится в помещении, насыщенном отрицательными ионами, под их воздействием его организм вырабатывает антиоксидант, называемый убиквинол. Убиквинол уничтожает высокоактивные молекулы и ионы, образующиеся из кислорода. Ученые называют эти соединения «активным кислородом». «Активный кислород повреждает клеточные белки и таким образом стимулирует процесс, который приводит к образованию раковой опухоли», — говорит Хориути. Но убиквинол воздействует на активный кислород раньше, чем тот начинает воздействовать на белки, то есть делает его безопасным. Свой эксперимент ученые проводили в двух помещениях. В одном был установлен генератор отрицательных ионов, а в другом помещении такого генератора не было. Генератор производил 27 тыс. ионов на 1 кубический сантиметр в диапазоне 3 метров. Благодаря генератору в помещении объем насыщения ионами увеличился в 27 раз. Для участия в эксперименте были приглашены 11 человек, имеющие атлетического телосложения, поскольку именно у спортсменов наблюдается повышенное содержание активного кислорода в организме. В течение шести ночей пять человек спали в ионизированном помещении, а шесть человек — в обычном. В последний день у каждого участника эксперимента были взяты анализы крови и мочи. Эксперимент показал, что у всех находившихся в ионизированном помещении содержание убиквинола в организме оказалось в пять раз выше, чем у контрольной группы. «Это еще раз подтверждает, что отрицательные ионы вступают во взаимодействие с активным кислородом и не позволяют ему оказывать негативное воздействие на организм», — заявили ученые. |
Недавно американские психоаналитики обратили внимание на одну особенность своих пациентов: у тех, кто жалуется на мрачное настроение, правая ноздря шире левой. Проверили, как обстоят дела у оптимистов, оказалось, что у них, наоборот, левая ноздря шире правой. Это случайное наблюдение, проанализированное совместно с физиологами и отоларингологами, позволило высказать оригинальную гипотезу о связи способа носового дыхания с психическим состоянием человека.
Какое отношение к настроению человека имеет то, какой ноздрей он вдыхает воздух? Да и вообще, может быть, он дышит одновременно обеими или попеременно то одной, то другой. Действительно, на первый взгляд гипотеза американских психоаналитиков воспринимается мистификацией. Но предоставим слово специалистам.
Как утверждают отоларингологи, по статистике, у большинства людей правая ноздря бывает несколько шире левой, и дышат многие преимущественно правой ноздрей. Более того, в результате искривления носовой перегородки гораздо чаще затрудняется дыхание именно левой ноздрей.
По мнению некоторых физиологов, все дело в насыщении организма ионами. С воздухом при дыхании в организм человека попадают положительные и отрицательные ионы. При этом нос человека работает как фильтр: при носовом дыхании отрицательные ионы поступают в организм преимущественно через левую ноздрю, а положительные через правую.
Правая и левая половины носа различаются остротой обоняния. Большая чувствительность левой стороны носа к запахам установлена у 71 % взрослых, правой у 13%, одинаковая чувствительность у 16%. У детей цифры совсем другие 35%, 30% и 35% соответственно. Как видим, асимметрия обоняния у взрослых по сравнению с детьми возрастает вдвое. Ученые объясняют это искривлением носовой перегородки, которая встречается у большинства людей после 30-40 лет.
Ученые объясняют это искривлением носовой перегородки, которая встречается у большинства людей после 30-40 лет.
Известно, что воздух, обогащенный отрицательными ионами, благотворно влияет на общее состояние здоровья и психику человека. Отрицательные ионы называют ионами здоровья и хорошего настроения. Считается, что недостаток в воздухе невентилируемых помещений отрицательно заряженных ионов (а значит, и избыток ионов положительных) приносит немалый вред организму.
Отрицательные ионы, которых много в свежем воздухе, повышают тонус вегетативной нервной системы через рецепторы кожи, слизистых оболочек верхних дыхательных путей. В результате повышается жизненный тонус, появляется бодрость, хорошее настроение. Именно поэтому на берегу моря, в лесу или даже в городе после грозы мы с наслаждением вдыхаем живительный воздух. Почему? Потому что он обогащен отрицательно заряженными ионами.
По представлениям йогов, у большинства людей утром при пробуждении функционирует только левая ноздря, соответствующая лунной стороне человека. В полдень дышат через обе ноздри. Вечером в момент отхода ко сну функционирует правая ноздря, взаимодействующая с солнечной стороной.
Мы привыкли что наше настроение поднимается или опускается только за счет внешних факторов, погода, еда, покупки, просмотр кинофильма, неприятности или успех на работе. Приглашенный тамада на свадьбу поднимает настроение сотням гостей, а юмористическая передача вызывает улыбку на лице у тысяч зрителей! А что будет если внешние факторы исключить, оставив человека с самим собой?
Психологи, связав имеющиеся у них данные, пришли к практическому заключению: улучшить настроение можно с помощью дыхания.
Нужно увеличить поступлении через левую ноздрю отрицательных ионов и одновременно затруднить поступление через правую ноздрю положительных ионов. Для этого достаточно периодически на несколько минут закрывать правую ноздрю и дышать только левой.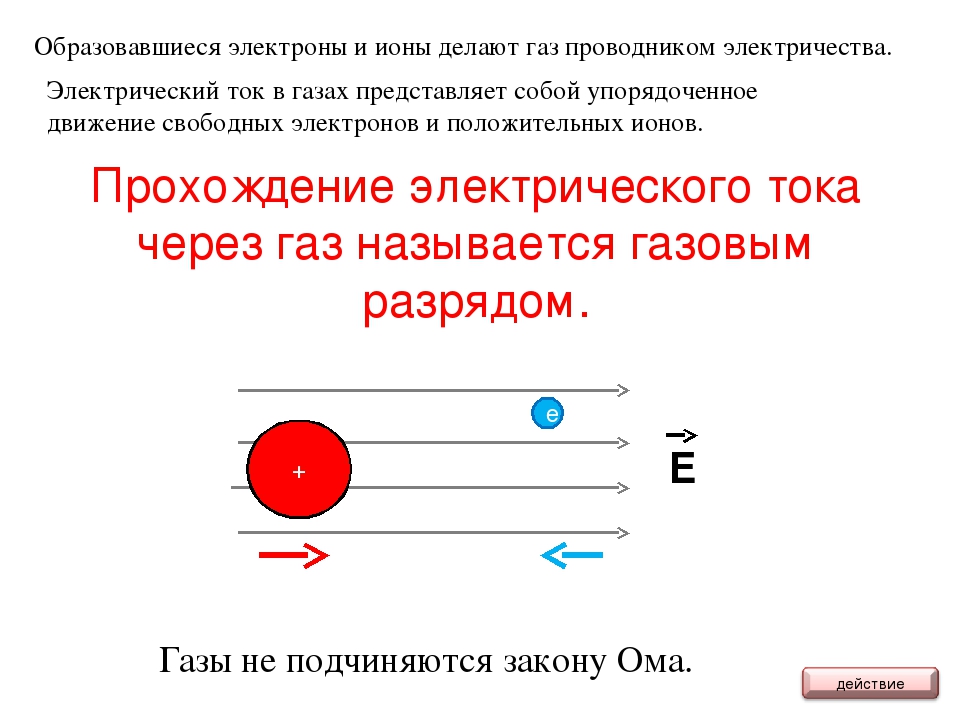
Эта рекомендация на столько проста, что каждый может немедленно испытать, ее на себе. Сначала подышите попеременно то правой, то левой ноздрей, чтобы сравнить легкость прохождения воздуха. Хорошо, если у вас через левую ноздрю воздух поступает заметно легче. Но даже если это не так, не печальтесь. Прижмите пальцем правую ноздрю или вставьте в нее тампончик и подышите левой ноздрей в течение двух-трех минут. Через несколько таких сеансов с интервалом около получаса вы наверняка почувствуете, что настроение улучшается.
Можно заподозрить, что это происходит благодаря самовнушению. Но проверка показала, что оно играет лишь второстепенную роль. Чтобы удостоверится в верности гипотезы, проводили эксперименты во время сна, когда наше сознание отключается. Испытуемым вставляли на ночь в правую ноздрю тампон, и утром даже те их них, кто склонен к депрессивным состояниям, просыпались в хорошем настроении.
Этот вывод западных психотерапевтов удивительным образом совпадает с представлениями восточных целителей. Мастер инструктор целительного Дао Сергей Орешкин, которому открылись многие секреты восточной медицины, рассказывает как правильно засыпать:
Каждый человек должен знать свою сонную ноздрю. Обычно, она левая. Почему? Потому что левая ноздря напрямую связана с правым полушарием. Во время бодрствования мы решаем множество вопросов, напрягая левое полушарие, которое отвечает за логику. Время сна дано нам для того, чтобы сбалансировать эти два полушария. Когда мы начинаем более активно дышать через левую ноздрю, мы напитываем энергией наше правое полушарие
Как известно, на Востоке большое внимании уделяют правильному дыханию. Ему долго и кропотливо обучают тех, кто хочет овладеть йогой. Но есть и упрощенные техники дыхания, более доступные для западного человека. Одна из них, предложенная Ричардом Хитлеманом, помогает быстро сбросить напряжение и расслабиться. Хитлеман называет эту технику попеременным дыханием через ноздри
Положите указательный и средний пальцы правой руки на середину лба.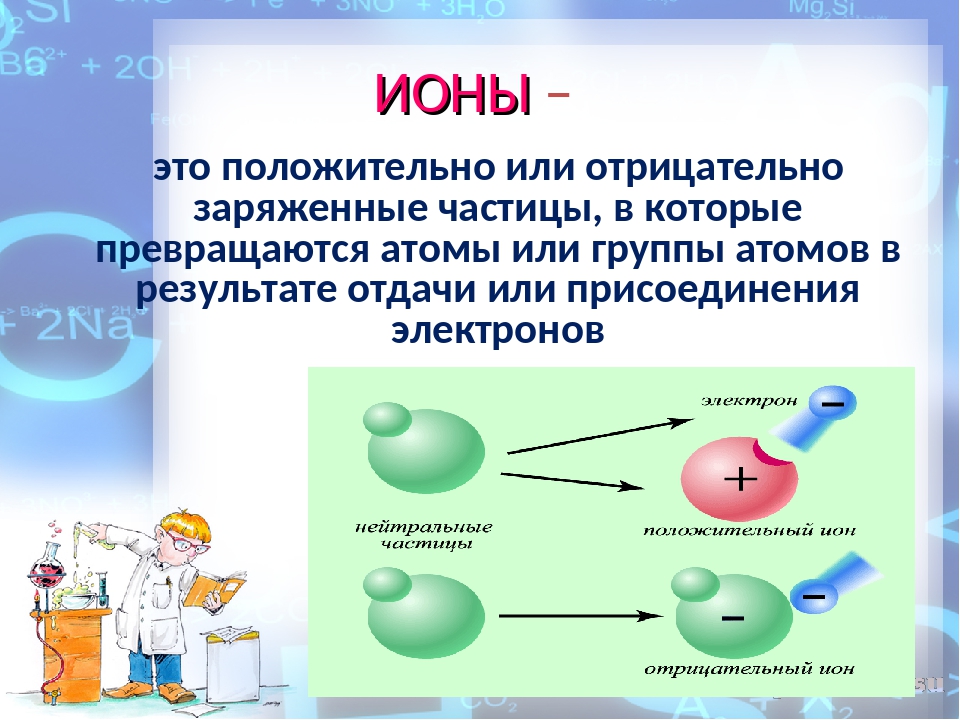 При этом большой палец будет находиться с правой стороны носа, а безымянный и мизинец с левой.
При этом большой палец будет находиться с правой стороны носа, а безымянный и мизинец с левой.
1. Зажмите большим пальцем правую ноздрю. Сделайте медленный глубокий вдох через левую ноздрю так, чтобы ваши легкие пополнились, пока вы досчитаете до восьми.
2. Зажмите левую ноздрю (теперь зажаты обе) и задержите дыхание на восемь секунд.
3. Отпустите правую ноздрю (удерживая левую зажатой) и выдохните равномерно через правую ноздрю, считая до восьми.
4. Закончив выдох, не останавливайтесь, а немедленно начните вдох через правую ноздрю, отсчитывая восемь секунд.
5. Зажмите обе ноздри и задержите дыхание, считая до восьми.
6. Теперь выдохните через левую ноздрю за восемь секунд.
Проделайте все эти шаги в зеркальном отражении, то есть начните со вдоха правой ноздрей (зажав левую ноздрю).
Такое попеременное дыхание как бы выравнивает активность между левым и правым полушарием мозга. По моим собственным наблюдениям, это не только расслабляет но и повышает настроение.
Схема успокаивающего попеременного дыхания Р.Хитлемана
Вдох слева……8
Пауза……………8
Выдох справа…8
Вдох справа…..8
Пауза……………8
Выдох слева…..8
Тысинюк Н.М. О химическом составе легких ионов и их влиянии на самочувствие людей
Миллионы людей, особенно в преклонном возрасте, испытывают периодические ухудшения самочувствия, часто совпадающие с резкими изменениями погоды. Обостряются хронические заболевания, ноют давно зажившие раны, ощущаются боли в суставах и в мышцах, обостряются психические и неврологические заболевания, снижается работоспособность даже у здоровых людей, повышается аварийность на транспорте и производстве, растет смертность по самым различным причинам, особенно при сердечно-сосудистых заболеваниях. Резкие изменения погоды ощущают и маленькие дети. Влияние погодных условий, как правило, объясняют изменениями атмосферного давления, температуры и влажности воздуха. Легко доказать, что указанные параметры погоды в большинстве случаев не имеют никакого отношения к страданиям людей. В повседневной жизни на нас действуют значительно большие колебания атмосферного давления, температуры и влажности воздуха, но мы это даже не замечаем. Поднявшись на лифте на верхний этаж, человек испытывает за несколько секунд такое изменение атмосферного давления, которое не встречается в природе. То же самое мы испытываем в отношении температуры и влажности воздуха, выйдя из квартиры на улицу в морозный день.
Следовательно, болезненные ощущения у людей вызывают другие факторы, которые связанны с изменениями погоды. Такими факторами являются так называемые легкие ионы. О том, что ионы влияют на живые организмы, известно давно. Русский ученый А.Л.Чижевский экспериментально доказал, что воздействие ионов на человека и животных зависит от их знака заряда [1]. Отрицательные ионы влияют на живые организмы благотворно. Эта особенность ионов используется для лечения некоторых заболеваний дыхательных путей. Положительные же ионы вызывают обострение сердечно-сосудистых и других хронических заболеваний. Механизм этого воздействия остается до конца не изученым.
Попытаемся объяснить причину неоднозначного влияния ионов различных знаков заряда на самочувствие людей. Для решения этого вопроса необходимо, прежде всего, определить химический состав легких ионов. Как известно, в воздухе 78% азота, 21% кислорода и около 1% других газов. В результате действия ионизирующего излучения земного и космического происхождений нейтральные молекулы газов воздуха ионизируются с образованием свободного электрона и положительного молекулярного иона. В процессе хаотического движения нейтральные молекулы кислорода сталкиваясь, прилипают к электрону. Молекулы азота не прилипают к электрону и отрицательному иону, так как они не имеют сродства к электрону [2]. Это является физическим свойством молекулярного азота. Таким образом, отрицательные легкие ионы состоят из нескольких десятков молекул кислорода с небольшой примесью других газов, кроме азота.
К положительным молекулярным ионам кислорода и азота прилипает примерно такое же количество нейтральных молекул этих газов. Но, во первых, азота в воздухе в 3.7 раза больше, чем кислорода, поэтому вероятность прилипания первого во столько же раз больше. Во вторых, нейтральная молекула азота имеет енергию сродства к протону на 15% большую, чем молекула кислорода (4,8 и 4,1 электроновольт соответственно) поэтому он более энергично прилипает к положительным ионам, вытесняя молекулы кислорода. В результате этого образуются положительные легкие ионы, состоящие преимущественно из молекул азота.
Таким образом, химический состав легких ионов определяется их зарядом: отрицательные ионы состоят из молекул кислорода, а положительные — из молекул азота.
Влияние легких ионов на самочувствие людей мы объясняем не зарядом, а их химическим составом.
Отрицательные ионы, состоящие из кислорода, попадая в кровь, усиливают окислительные процессы, облегчают дыхание, благотворно действуют на весь организм.
Нейтральный азот не растворяется в крови и при выдохе полностью без изменений выводится наружу. Положительные ионы, состоящие из молекул азота, хорошо растворяются в жидкостях, в том числе и в крови. Попадая в процессе дыхания в кровь, распадаются на отдельные молекулы азота. Не связанный с другими химическими элементами азот у людей со слабым функционированием почек не выводится из организма, заполняет в виде микропузырьков кровеносные сосуды и капилляры, скапливается в области сердца, создавая дополнительные трудности в кровообращении. Это ощущается в виде недомогания, головных болей, повышения артериального давления и так далее.
В обычных условиях, когда концентрация ионов в атмосфере не превышает 103 ионов в 1см3 [3], в кровь попадает ничтожное количество азота, не создающее особых проблем для самочувствия и здоровья. При значительном увеличении количества ионов в атмосфере, концентрация азота, попадающего в организм, может превысить возможности почек по его выведению из организма. В этом случае происходит постепенное накопление свободного азота в крови. Самочувствие у людей с сердечно-сосудистыми и другими заболеваниями ухудшается спустя несколько часов после начала действия этого фактора, а иногда и после прекращения, когда накопится достаточное количество азота в крови. Поэтому часто бывает трудно увязать ухудшение самочувствия с фактором, вызвавшим это ухудшение.
Концентрация легких ионов в атмосфере, в том числе положительных, зависит от погодных условий, уровня радиоактивного загрязнения местности, а также от корпускулярного и жесткого електромагнитного излучения, поступающего на Землю от Солнца и из Космоса [3]. Луна вносит определенные коррективы в корпускулярный поток, поступающий на Землю. Вот почему мы увязываем наше самочувствие с погодой, активностью Солнца, фазами Луны и повышенным радиоактивным фоном. Влияние последнего фактора ощутили на себе тысячи людей в условиях радиоактивного загрязнения местности и воздуха в результате аварии на Чернобыльской АЭС. Малые дозы ионизирующего излучения, ионизирующие и разрушающие составляющие клеток, практически, не ощущаются человеком пока не наступит заболевание какого-то органа. Чувствительность к малым дозам радиации вызывается посредством указанных выше положительных легких ионов, образующихся в воздухе в результате действия ионизирующего излучения. Механизм воздействия на самочувствие людей положительных легких ионов действует независимо от их происхождения: высокоэнергетическими заряженными частицами Солнечного или Космического происхождения, конвективными или иными явлениями в атмосфере или же радиоактивными продуктами распада техногенного или естественного происхожения. Человек, в зависимости от возроста, состояния сердечно-сосудистой системы и работоспособности почек, в той или иной степени ощущает повышенную концентрацию положительных ионов.
Исключить или уменьшить влияние легких ионов на самочувствие людей можно путем применения специальных фильтров, очищающих вдыхаемый воздух от положительных ионов.
Кроме положительных легких ионов на наше самочувствие действуют также и другие природные факторы. Речь идет о так называемых биологически активных излучениях. Эти излучения оказывают глобальное влияние на все биологические объекты, в том числе и на человека. Механизм воздействия биологически активных излучений на самочувствие людей совершенно иной, чем положительных ионов, но возникновение этих излучений связано с теми же погодными условиями, активностью Солнца и, в некоторой степени, зависит от фаз Луны.
Л И Т Е Р А Т У Р А
1.Ягодинский В.Н. Александр Леонидович Чижевский. М.Наука. 1987. 315 с.
2.Радциг А.А., Смирнов Б.М. Справочник по атомной и молекулярной физике. М. Атомиздат. 1980. 240 с.
3.Тверской П.Н. Курс метеорологии. Л. Гидрометиздат. 1962. 693 с.
ионизация воздуха | Heat Plus
ионизация воздуха инфракрасной пленкой heat plus
Интересное свойство инфракрасной отопительной системы «Heat Plus» — повышение концентрации в помещении отрицательно заряженных ионов. В городском воздухе, работающая инфракрасная пленка «Heat Plus» повысит содержание отрицательно заряженных ионов в 4 раза.анионное излучение (ионизация воздуха)
Анион (от греч. ana — вверх и ion — идущий), отрицательно заряженный ион в электрическом поле движется к положительному электроду — аноду.
Анионы оказывают благоприятное воздействие на человеческий организм (ионизация воздуха). Анионы, соединяясь с кислородом воздуха, образуют ионизированный кислород, способный улучшить иммунные качества человеческого организма и предотвратить многие заболевания. Анионы очищают, стерилизуют воздух и придают ему антисептические качества. Функция генерации анионов (ионизации) автоматически включается при включении обогревателя. Ионизация воздуха (приобретение воздухом электрических зарядов — аэроионов) — естественный процесс, происходящий в природе под действием различных природных факторов.
лечебный эффект ионизации воздуха
Ионизация воздуха необходима для создания в помещениях оптимальной концентрации отрицательно заряженных ионов, которые необходимы для нормальной жизнедеятельности организма. Лишенный ионов воздух — «мертвый», ухудшает здоровье и ведет к заболеваниям. Мы тяжело переносим скученность, места, где скапливается много народа. Человек выделяет с дыханием положительные ионы. Работающие электронагревательные приборы, экраны дисплеев и телевизоров так же вырабатывают положительные ионы. Это подтверждается многочисленными опытами А. Л. Чижевского и других ученых. А. Л. Чижевский доказал, что отрицательные ионы воздуха биологически благотворны, а положительные ионы оказывают вредное воздействие на организм.
примеры природной ионизации воздуха
Для сравнения — естественная концентрация отрицательных ионов на открытом воздухе 1000.. 10000 ионов/куб.см, а в помещении падает до 40.. 100 ионов/см3.
Морской прибой. При разбрызгивании жидкости мелкие капельки ее заряжаются отрицательно и при испарении отдают свой заряд воздуху, происходит насыщение его отрицательными ионами.
В горах также дышится легко. Там усилена ионизация за счет более сильного потока ультрафиолетовых лучей, неослабленных атмосферой. Во время грозы так же происходит ионизация за счет электрических разрядов.
Ионизация воздуха уменьшает токсичность воздуха и очищает его от пыли, микробов. Взвешенные частицы загрязнений и пыли электризуются и оседают на потолок, стены, пол. Воздух очищается.
В настоящее время народная корейская медицина, кожные отделения, ортопедия и т.п. используют недавно разработанные аппараты с применением инфракрасного излучения.
эффект отрицательно заряженных ионов
В атмосфере находится большое количество микроскопических частиц воздуха (ионов) со слабым электрическим зарядом. Положительно заряженные ионы(катионы) движутся к отрицательному полюсу, а отрицательно заряженные, движущиеся к положительному полюсу называются анионами. Они образуются под воздействием большого количества энергии на атом или молекулу.
общие свойства
Доказано, что зависимость концентрации в атмосфере отрицательно заряженных (-) ионов оказывает положительное воздействие при лечении. Содержание более 1000 анионов на 1м3 повышает активность головного мозга, устраняет последствия напряженности и беспокойства, проявляющиеся в астматических симптомах и мигренях, подавляет выработку гистамина, вызывающего заболевания органов дыхания, повышает ионизацию минеральных компонентов крови, способствует релаксации, подщелачиванию кровеносной среды организма, укрепляет функции респираторной иммунной системы.отдельные свойства
Релаксация
Благодаря высокой концентрации отрицательных ионов в сосновом лесу, вблизи водопадов или фонтанов мы чувствуем себя особенно хорошо, можем по-настоящему расслабиться и ощутить прилив бодрости.
Антиоксидантное воздействие на клетки
Отрицательно заряженные ионы отдают свой электрон активным формам кислорода, что предотвращает окисление клеток и повышенное образование свободных радикалов (реакция восстановления). Активизирует действие защитных сил организма.
Ощелачивание крови
Отрицательно заряженные ионы обладают эффектом преобразования состава крови, т.е. преобразуют окисленную кровь в умеренно щелочную. Активизирует обменные процессы организма на межклеточном уровне, способствует релаксации.
Укрепление нервной и эндокринной системы
Способствует улучшению функций вегетативной нервной системы, нормализации функций эндокринной системы, оказывает положительное воздействие на центральную и периферийную нервную систему, повышает кроветворные способности организма. Укрепление иммунитета способствует повышению общего тонуса и сопротивлению организма различным заболеваниям. Оказывает положительное воздействие на лимфодренаж, клеточный метаболизм и нервную систему, что нормализирует функционирование всех органов и систем организма, регулирует работу вегетативной нервной системы и эндокринной системы
Антиоксидантные и антисептические свойства
Антиоксидантное действие отрицательно заряженных ионов обладает дезодорирующими и антисептическими свойствами, которые активно применяются для сохранения свежести цветов или рыбы. Отрицательно заряженные ионы иногда еще называют витаминами воздуха
Польза и вред аэроионов | Управление Роспотребнадзора по Республике Мордовия
Аэроионы — это положительно и отрицательно заряженные частицы, постоянно образующиеся при расщеплении газовых молекул и атомов (ионизация воздуха). Ионизация происходит под влиянием радиоактивного излучения как с поверхности земли так и космической радиации, электрических разрядов в атмосфере. Аэроионы обусловливают электропроводность воздуха и постоянный электрический обмен между организмом и воздушной средой.
Обычно в кубическом сантиметре атмосферного воздуха содержится около тысячи положительно и отрицательно заряженных аэроионов. На некоторых курортах, отличающихся высокими природными достоинствами, обнаружены повышенные концентрации аэроионов (2 000—4 000), а в крупных промышленных городах и в помещениях, переполненных людьми,— наоборот, более низкие.
А.Л. Чижевский называл легкие отрицательные аэроионы «витаминами воздуха». Он утверждал, что воздух, насыщенный такими «витаминами», не только позволяет продлить жизнь, но и помогает сохранять бодрость и энергию.
При повышении относительной влажности воздуха число легких аэроионов уменьшается, что объясняется образованием тяжелых аэроионов вследствие оседания легких аэроионов на микроскопических капельках воды. С этим также связано уменьшение подвижности аэроионов. Понижение среднесуточной температуры обычно сопровождается резким падением числа легких аэроионов, и наоборот. При облачности, высокой влажности и слабых или умеренных осадках число аэроионов убывает. Сильные осадки, наоборот, вызывают значительное увеличение числа отрицательных частиц. В тех случаях, когда осадки сопровождаются грозами, число как положительных, так и отрицательных аэроионов достигает высоких значений.
Число легких аэроионов резко уменьшается, как только в воздухе появляются пыль, дым, частички влаги, туман и т.д. Твердые и жидкие частички, взвешенные в воздухе, адсорбируют легкие аэроионы и увеличивают таким образом число тяжелых частиц. Твердо установлено, что число тяжелых частиц находится в прямом соответствии со степенью загрязнения атмосферы:
а) чистый воздух содержит в 1 см 700—800 легких и 1000— 1500 тяжелых аэроионов;
б) по мере увеличения загрязнения воздуха число легких и тяжелых аэроионов в нем изменяется: число легких аэроионов падает до 200, а тяжелых — возрастает до 65000.
Однозарядный отрицательный ион кислорода представляет собой одну из активных форм кислорода (АФК). В воде и воздухе природной окружающей среды всегда есть небольшие количества озона, перекиси водорода и супероксида, присутствующего в атмосфере в виде отрицательных аэроионов кислорода. Небольшие количества АФК, поступающие в организм извне с пищей, водой, воздухом, способны усиливать межклеточное взаимодействие и нормализовать функционирование клеток и слагаемых ими тканей. На этом основано действие озонотерапии, аэроионотерапии, терапии перекисью водорода.
Чувствительность к аэроионам кислорода у млекопитающих обеспечивается нервными окончаниями в слизистых оболочках носовой полости, а также рецепторами вомероназального органа, которые напрямую связаны с гипоталамусом. Этот отдел мозга управляет действием всех органов посредством механизма нейрогуморального регулирования.
Отсутствие аэроионов кислорода во вдыхаемом воздухе воспринимается гипоталамусом как сигнал тревоги и опасности для жизни. Функционирование гипоталамуса нарушается, что приводит к разладу во всем организме. Наоборот, повышенные концентрации всегда оказывают на гипоталамус нормализующее воздействие, позволяют ему справиться со многими заболеваниями, в том числе и сердечно-сосудистыми. На здоровый организм большие концентрации вдыхаемых аэроионов кислорода оказывают адаптогенное действие, то есть повышают его приспособительные и защитные возможности, оказывают выраженное влияние на сердечно-сосудистую, дыхательную и нервную системы, причем оно всегда направлено в сторону улучшения их функционирования.
Медицинские научные работы доказали неоспоримые преимущества благоприятного воздействия заряженных биполярных ионов:
— улучшение психологического и физического состояния;
— увеличение сопротивляемости заболеваниям;
— снижение количества бактерий в помещении;
— очищение воздуха от взвешенных микрочастиц;
— ослабление эффекта, вызванного статическим электричеством.
Однако передозировка воздействия отрицательными аэроионами может приводить к извращению реакций организма, т.е. к появлению нежелательных эффектов, аналогичных вызываемым положительными аэроионами.
Давно замечено, что в душных непроветриваемых помещениях человек испытывает различного рода дискомфортные состояния: вялость, усталость, потерю аппетита, головную боль, бессонницу, слабость, головокружение, ослабление памяти и др. Это приводит к недомоганию, способствует падению защитных сил организма и предрасполагает к его преждевременному изнашиванию и старению. Было обнаружено, что в подобных помещениях имеет место избыток положительных и недостаток отрицательных аэроионов. На состоянии организма сказывается также погода: в дождливую туманную погоду, особенно осенью, когда число отрицательных аэроионов в воздухе понижается до минимального предела, чаще возникают инфекционные заболевания, обостряются хронические недуги, ухудшается состояние духа человека; настроение становится меланхоличным. Было установлено, что именно аэроионы положительной полярности оказывают крайне неблагоприятное действие на лиц слабого телосложения, стариков, ревматиков, неврастеников, вызывая у них ощущения боли, слабости, озноба.
Аэроионы могут принести пользу не всем и не при любых условиях, а лишь при строго определенных показаниях и дозировках. Вот почему их применяют только по назначению врачей и под их контролем.
В соответствии СанПиН 2.2.4.1294-03 «Гигиенические требования к аэроионному составу воздуха производственных и общественных помещений» нормируемыми показателями аэроионного состава воздуха производственных и общественных помещений являются:
— концентрации аэроионов (минимально допустимая и максимально допустимая) обеих полярностей;
— коэффициент униполярности У (минимально допустимый и максимально допустимый), определяемый как отношение концентрации аэроионов положительной полярности к концентрации аэроионов отрицательной полярности.
Нормируемые показатели | Концентрации аэроионов, р (ион/см3) | Коэффициент униполярности, У | |
Положит.полярности | Отрицат.полярности | ||
Минимально допустимые |
>= 400 |
> 600 |
0,4 <= У < 1,0 |
Максимально допустимые |
< 50000 |
<= 50000 | |
Для измерения концентраций аэроионов и коэффициента униполярности в закрытых помещениях Испытательный лабораторный центр ФБУЗ «Центр гигиены и эпидемиологии в Республике Мордовия» обладает современным прибором. В короткие сроки специалисты Центра проведут качественные исследования аэроионного состава воздуха на рабочих местах промышленных предприятий и в общественных зданиях.
Литература:
1. А.Л.Чижевский “Аэронификация в народном хозяйстве”
2. В.П.Скипетров «Аэроионы и жизнь» (о А.Л.Чижевском)
3.СанПиН 2.2.4.1294-03 «Гигиенические требования к аэроионному составу воздуха производственных и общественных помещений»
4. В.Панов «Люстра Чижевского – прибор долголетия»
Врач по гигиене труда С.А.Самарин
Bonding in Metals | Protocol (Translated to Russian)
Summary
Металлические связи образуются между двумя атомами металла. Упрощенная модель для описания металлических связей была разработана Полом Дреде под названием «Электронная морская модель».
Электронная морская модель
Большинство атомов металла не обладают достаточным количеством валентных электронов, чтобы войти в ионическую или ковалентную связь. Тем не менее, валентные электроны в атомах металла слабо проводятся из-за их низкой электронегатисти или притяжения с ядром. Энергия ионизации атомов металла (энергия, необходимая для удаления электрона из атома) низка, что облегчает легкое удаление валентных электронов из родительского атома. Атом образует положительно заряженный ион металла, в то время как свободные внешние электроны существуют как отрицательно заряженные делокализованные электронные облака. Эти электроны могут быть разделены несколькими соседними металлическими котами через сильную, привлекательную силу между этими негативно и положительно заряженными видами. Такая привлекательная сила между отрицательно заряженными электронами и металлическими котами называется металлическими связями, удерживав атомы вместе. Эта модель электронного моря объясняет большинство физических свойств металлов, таких как проводимость тепла и электричества, высокие точки плавления и кипения, податливость и воздуховод.
Металлические твердые тела
Электронная морская модель имеет несколько металлических свойств, включая высокую тепловую и электрическую проводимость, металлический блеск, воздуховодность и податливость. Делокализованные электроны могут проводить как электричество, так и тепло от одного конца металла к другому с низким сопротивлением. Металлическая связь находится не между двумя специфическими атомами металла, а между ионами металла и многими делокализованными электронами, что позволяет металлам деформироваться под давлением и теплом без разрушения или разрушения. Различные металлы, такие как железо, ртуть или медь, отличаются по своим физическим свойствам, что отражает разницу в прочности металлических связей между металлами.
Металлические твердые вещества, такие как кристаллы меди, алюминия и железа, образуются атомами металла: все они обладают высокой тепло- и электрической проводимостью, металлическим блеском и податливостью. Многие из них очень жесткие и довольно сильные. Из-за своей податливости (способность деформироваться под давлением или молотком) они не разрушаются и, следовательно, делают полезные строительные материалы. Точки плавления металлов сильно различаются. Ртуть является жидкостью при комнатной температуре, а щелочные металлы тают ниже 200 градусов по Цельсию. Некоторые металлы после перехода также имеют низкие точки плавления, в то время как переходные металлы тают при температурах выше 1000 градусов по Цельсию. Эти различия отражают различия в прочности металлической связи между металлами.
Этот текст адаптирован из Openstax, Химия 2e, Раздел 10.5: Твердое состояние материи.
Ионизация — все статьи и новости
Ионизация — образование положительных и отрицательных ионов, а также свободных электронов из электрически нейтральных атомов и молекул. Этот процесс относится к типу эндотермической реакции, при которой происходит поглощение теплоты.
При ионизации образуется положительно заряженный ион, если электрон в атоме или молекуле получает достаточную энергию для преодоления потенциального барьера, равную ионизационному потенциалу. Отрицательно заряженный ион образуется при захвате дополнительного электрона атомом с высвобождением энергии. В продуктах данной реакции содержится больше энергии, чем в исходных компонентах.
Можно выделить несколько типов ионизации, таких как столкновительная (ударная), фотоионизация, термическая ионизация и ионизация лазерным излучением. В процессе столкновительной ионизации происходит столкновение свободного электрона с невозбуждёнными или возбужденными атомами или молекулами. Данный процесс является важнейшим механизмом при ионизации в газах и плазме. При фотоионизации происходит ионизация молекул и атомов под действием света. Термическая ионизация происходит при достаточно высокой температуре, когда велика энергия теплового движения атомов или молекул. В этом случае частицы могут ионизовать друг друга при взаимных ударах без участия других частиц извне. В качестве примера можно привести термическую ионизацию при нагревании газа. Для ионизации лазерным излучением необходимо достаточное количество частоты лазерного излучения, чтобы поглощение одного фотона вызвало ионизацию. В этом случае требуется высокая плотность потока фотонов в лазерном пучке, чтобы произвести многофотонную ионизацию, которая осуществляется при помощи одновременного поглощения нескольких фотонов.
Также различают процесс ионизации в электролитах и в газах. Ионизация в электролитах — веществах, которые обладают ионной проводимостью — происходит в процессе распада электролита на ионы под действием растворителя. Такой процесс называют электролитической диссоциацией. Ионизация в газах осуществляется в результате отрыва от атома или молекулы одного или нескольких электронов под влиянием внешних воздействий. Энергия, необходимая для отрыва электрона, называется энергией ионизации.
Также существует понятие «степени ионизации» — отношение числа ионов к числу нейтральных частиц в единице объема.
Стоит отметить, что при ионизации самих ионов увеличивается их разряд.
Положительно заряженный ион — водород
Положительно заряженный ион — водород
Cтраница 3
Вода также подвергается электролитической диссоциации с образованием положительно заряженных ионов водорода и отрицательно заряженных ионов гидроксильной группы. [31]
Какая часть гидроксида металла способна связываться с положительно заряженными ионами водорода и что образуется в этом процессе. [32]
При растворении в воде к электронейтральной молекуле аммиака присоединяется положительно заряженный ион водорода. [33]
Кислотами называются соединения, диссоциирующие в водных растворах на положительно заряженные ионы водорода и отрицательно заряженные ноны кислотных остатков. [34]
Атом водорода может терять единственный электрон, превращаясь в положительно заряженный ион водорода — протон. При взаимодействии с металлами он бывает отрицательно одновалентным — присоединяет один электрон. Соединения эти называют гидридами. [35]
Кислотами называются соединения, диссоциирующие в водных растворах на положительно заряженные ионы водорода и отрицательно заряженные ионы кислотных остатков. [36]
Кислота-это соединение, которое при диссоциации в воде образует положительно заряженные ионы водорода. [37]
В приборе, использованном в разделе 28.4 для измерения массы положительно заряженного иона водорода ( протона), в качестве источника ионов примените тяжелый водород и наблюдайте пики, которые соответствуют ионам, приходящим со временем пролета, в 1 4 раза превышающим время пролета обычных положительно заряженных ионов водорода. [38]
Определяющим свойством всех кислот является присутствие в их водных растворах положительно заряженных ионов водорода. По-видимому, если основания способны противодействовать кислотам, т.е. оказывать действие, противоположное кислотам, то они могут каким-то образом обезвреживать положительно заряженные ионы водорода, образуемые кислотами. Следовательно, такие соединения должны обладать способностью захватывать положительно заряженные ионы водорода. [39]
Попробуйте сообразить, какие из этих ионов способны связываться с положительно заряженными ионами водорода и что должно образовываться при этом. [40]
Нет, кислоты-это соединения, которые при диссоциации в воде образуют положительно заряженные ионы водорода. [41]
Кислотами называют соединения, при диссоциации которых в водных растворах образуются положительно заряженные ионы водорода, при этом не возникают другие положительные ионы. [42]
Кислотами Называют соединения, при диссоциации которых в водных растворах образуются положительно заряженные ионы водорода, при этом не возникают другие положительные ионы. [43]
Кислота — это соединение, которое при диссоциации в воде образует положительно заряженные ионы водорода. [44]
Действительно, характерные свойства кислот обусловлены существованием в их водных растворах положительно заряженных ионов водорода. Например, мы уже знаем, что кислоты можно опознавать при помощи синей лакмусовой бумаги, которая под действием кислоты становится красной. Что, по вашему мнецию, является непосредственной причиной появления этой красной окраски. [45]
Страницы: 1 2 3
Что такое отрицательные и положительные ионы?
1Ионы сейчас окружают вас повсюду, и, хотя вы их не замечаете, они могут влиять на ваше самочувствие.
Так что же такое ион? Это молекула, которая потеряла или приобрела электрон из-за различных атмосферных сил или воздействий окружающей среды.
Существуют как положительные, так и отрицательные ионы, но определения вводят в заблуждение с точки зрения того, как они влияют на вас.
Что такое положительно заряженные ионы?
Простое определение положительного иона — это электрически заряженный атом или группа атомов, образованная потерей одного или нескольких электронов.Число протонов не меняется, но уменьшение количества электронов дает атому положительный заряд.
Положительные ионы в воздухе — это обычно молекулы углекислого газа, лишенные электрона. Было доказано, что они, также известные как положительно заряженные ионы или катионы, оказывают негативное влияние на ваше тело, когда вы подвергаетесь их чрезмерному воздействию.
Это особенно касается ваших легких и дыхательных путей, хотя ваша иммунная система также может быть затронута.Это связано с тем, что ионы настолько малы, что они попадают прямо в кровоток из воздуха, которым вы дышите.
Избыток положительно заряженных ионов в окружающей среде может способствовать усталости и нехватке энергии, напряженности, беспокойству и раздражительности. Они даже были исследованы как фактор, способствующий аллергии, мигрени и расстройствам настроения.
Как образуется положительный ион?
В природе положительные ионы обычно образуются из-за сильного ветра, пыли, влажности и загрязнения.Они достигли своего пика прямо перед грозой.
Это было выдвинуто предположением о том, почему так много людей чувствуют себя неуютно перед бурей и почему респираторные проблемы часто возникают в это время.
Если вы когда-либо проводили много времени, гуляя по оживленной дороге или в прачечной, вы испытали на себе утомляющие эффекты высоко заряженной среды.
К сожалению, наши современные дома и рабочие места также стали хроническими генераторами потенциально вредных положительных ионов.
Офисные системы кондиционирования воздуха, флуоресцентные лампы, сотовые телефоны, электрическое и компьютерное оборудование — все это мощные генераторы положительных ионов, особенно плохие принтеры и копировальные аппараты.
Хороший настольный очиститель воздуха и ионизатор могут помочь бороться с загрязнением положительными ионами во время работы, а также с вредными летучими органическими соединениями, которые так часто встречаются в офисном воздухе открытой планировки.
В вашем доме люминесцентные лампы, телевизоры, кондиционеры и микроволновые печи являются излучателями положительных ионов.
Тепловентиляторы, фены и сушилки для одежды также являются особенно сильными источниками положительно заряженных ионов.
Что еще хуже, так как большинство домов изолированы снаружи, вероятность поступления свежего воздуха и его отрицательных ионов достаточно высока, чтобы противодействовать загрязнению положительными ионами.
Если вы не живете в деревне, открывать окно в любом случае может быть не так полезно. В больших городах и городских условиях в воздухе гораздо больше катионов и гораздо меньше анионов, чем в сельской местности.
Что такое отрицательно заряженные ионы?
Определение отрицательного иона — это электрически заряженный атом или кластер атомов, образованный путем получения одного или нескольких электронов. Число протонов в атоме не меняется, но лишние электроны придают ему отрицательный заряд.
Отрицательные ионы, также известные в науке как анионы, противоположны положительным ионам, и они оказывают противоположное влияние на ваше настроение, уровень энергии и самочувствие, когда вы подвергаетесь их воздействию.
Анионы имеют сильный отрицательный заряд и статически притягиваются к частицам, находящимся в воздухе, таким как пыль, споры плесени, шерсть домашних животных и другие аллергены.
Присоединяясь к плавающим загрязнителям, они придают им отрицательный заряд и, вместо того, чтобы летать в воздухе, они заземляются и падают на пол или ближайшую поверхность.
Научные исследования показывают, что даже бактерии и вирусы, циркулирующие в воздухе вашего дома, могут быть удалены путем прикрепления к ним отрицательно заряженных ионов и удаления их из воздуха, которым вы дышите.
Как образуется отрицательный ион?
В природе отрицательные ионы обнаруживаются в изобилии, особенно в лесах, на пляже и особенно у водопадов, где разбивающаяся вода является естественным генератором анионов.
Это хорошая часть причины, по которой вы обычно так хорошо себя чувствуете в этих местах и вам трудно быть усталым или несчастным в такой обстановке.
Самую яркую демонстрацию бодрящего и освежающего действия отрицательно заряженных ионов можно ощутить в воздухе после сильной грозы, который насыщен полезными анионами.
Что, если бы вы могли приносить такой очищенный воздух в свой дом каждый день?
Можно с отрицательным ионизатором высокой мощности.Это специальные устройства, генерирующие отрицательные ионы, которые используют способ генерации молнии в гораздо меньшем масштабе.
Их использование может помочь вернуть баланс положительных и отрицательных ионов в вашем доме или офисе в сторону, более благоприятную для здоровья.
Многие люди удивляются тому, насколько хорошо они себя чувствуют с большим количеством отрицательно заряженных ионов по сравнению с положительно заряженными ионами, циркулирующими в их жилом пространстве.
Еще один хороший вариант — это ионизирующий очиститель воздуха, подобный этому, специально разработанный для наполнения воздуха в вашем доме полезными отрицательно заряженными ионами, в то же время, когда они фильтруют воздух от загрязняющих веществ.
Здесь вы узнаете больше о многих преимуществах отрицательных ионов для вашего здоровья, а также о том, как работают генераторы ионов, чтобы изменить воздух, которым вы дышите.
Я надеюсь, что эта страница помогла прояснить разницу между положительно заряженными ионами и отрицательно заряженными ионами. А также почему полезно иметь меньше катионов и гораздо больше анионов там, где вы работаете и живете.
Простой и недорогой способ противодействовать разрушающим положительным ионам и очищать воздух, которым вы дышите, где бы вы ни находились, с помощью одного из этих персональных очистителей воздуха, которые вы можете носить.Они приносят здоровые отрицательные ионы даже в самые загрязненные места.
Образование ионов — Ионные соединения — Eduqas — GCSE Chemistry (Single Science) Revision — Eduqas
Ион — это атом или группа атомов с положительным или отрицательным зарядом. Ионы образуются, когда атомы теряют или приобретают электроны для получения полной внешней оболочки:
- атомы металла теряют электроны, образуя положительно заряженные ионы
- Атомы неметаллов получают электроны, образуя отрицательно заряженные ионы
Образующие положительные ионы
Атомы металлов теряют электроны из своей внешней оболочки, когда они образуют ионы:
- образованные ионы являются положительными, потому что у них больше протонов, чем электронов
- образованные ионы имеют полные внешние оболочки
- для элементов в группах 1, 2 и 3, число Количество потерянных электронов совпадает с номером группы
Формирование отрицательных ионов
Внешние оболочки неметаллических атомов получают электроны, когда они образуют ионы:
- образованные ионы отрицательны, потому что у них больше электронов, чем протонов
- образующиеся ионы имеют полные внешние оболочки
- для групп 6 и 7, количество электронов gai ned равно: 8 — номер группы
Примеры групп и зарядов ионов
| Группа | Элемент | Заряд иона | Символ иона | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| 1 | Na | 1+ | Na + | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 2 | Mg | 2+ | Mg 2+ | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 6 | O | 2- | O 2- | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 7 | Класс | 1- | Класс — |
| Название иона | Символ иона | Атомный номер | Масса нет. | Протоны | Нейтроны | Электроны | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| Алюминий | Al 3+ | 13 | 27 | 13 | 14 | Calium 902 | 20 | 40 | 20 | 20 | 18 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Сульфид | S 2- | 16 | 32 | 16 | 16 9019 |
Каким образом фтор завершит свой октет? Сначала исследуйте электронное устройство атома. Атомный число девять, следовательно, есть девять электронов и девять протоны на нейтральном атоме фтора. Напишите диаграмму Бора и символ Льюиса для фтора: (см. рисунок справа) | |||||||||||||||||
| Этот анализ показывает, что фтор уже имеет семь электронов на внешнем уровне.Ближайший редкий газ — неон с 8 электронами на внешнем энергетическом уровне. Следовательно только один дополнительный электрон необходим для завершения октета в атоме фтора, чтобы сделать ион фтора. Если один электрон добавлены диаграммы Бора и символы Льюиса для фтора и неон идентичны. Правило октетов выполнено. | |||||||||||||||||
Ионный заряд? Каков заряд фтора в результате добавления единицы электрон? Сравнение атома и иона даст следующее отвечать.
| |||||||||||||||||
| * Окончание имени «ide» означает простой отрицательный ион. | |||||||||||||||||
КРАТКИЙ ПРИНЦИП ОТРИЦАТЕЛЬНЫХ ИОНОВ Отрицательный ион образуется добавлением отрицательно заряженных электроны. Протоны не меняются. Только неметаллические атомы с 1-3 электронов, отсутствующих на внешнем уровне , добавляют электроны к пройдите этот уровень, как ближайший редкий ga s. Металлы никогда образуют отрицательные ионы. | |||||||||||||||||
| Правило октетов: Элементарные атомы обычно теряют, приобретают или делятся электронами с
другие атомы , чтобы достичь такой же электронной структуры, как ближайший инертный газ с восемью электроном на внешнем уровне. |
Ионы и ионные соединения — Вводная химия — 1-е канадское издание
Цели обучения
- Узнайте, как образуются ионы.
- Узнайте характерные заряды ионов.
- Составьте правильную формулу ионного соединения.
- Создайте собственное имя для ионного соединения.
До сих пор мы обсуждали элементы и соединения, которые являются электрически нейтральными. У них такое же количество электронов, что и у протонов, поэтому отрицательные заряды электронов уравновешиваются положительными зарядами протонов.Тем не менее, это не всегда так. Электроны могут переходить от одного атома к другому; когда они это делают, образуются виды с общими электрическими зарядами. Такие разновидности называются ионами. Виды с общим положительным зарядом называются катионами, а виды с общим отрицательным зарядом — анионами. Помните, что ионы образуются только тогда, когда электрон перемещаются от одного атома к другому; протон никогда не перемещается от одного атома к другому. Соединения, образованные из положительных и отрицательных ионов, называются ионными соединениями.
Отдельные атомы могут приобретать или терять электроны. Когда они это сделают, они станут одноатомным ионом . Когда атомы приобретают или теряют электроны, они обычно получают или теряют определенное количество электронов и, таким образом, приобретают характерный общий заряд. В таблице 3.6 «Одноатомные ионы разного заряда» перечислены некоторые общие ионы с точки зрения того, сколько электронов они теряют (образуют катионы) или приобретают (образование анионов). Об ионах в Таблице 3.6 «Одноатомные ионы разного заряда» следует обратить внимание на несколько моментов.Во-первых, каждый элемент, образующий катионы, является металлом, за исключением одного (водорода), в то время как каждый элемент, образующий анионы, является неметаллом. На самом деле это одно из химических свойств металлов и неметаллов: металлы имеют тенденцию образовывать катионы, а неметаллы имеют тенденцию образовывать анионы. Во-вторых, большинство атомов образуют ионы с одним характерным зарядом. Когда атомы натрия образуют ионы, они всегда образуют заряд 1+, но никогда — заряд 2+, 3+ или даже 1–. Таким образом, если вы запомните информацию из Таблицы 3.6 «Одноатомные ионы с разным зарядом», вы всегда будете знать, какие заряды образуют большинство атомов.(В главе 9 «Химические связи» мы обсудим , почему атома образуют заряды, которые они образуют.)
Таблица 3.6 Одноатомные ионы различных зарядов
| Ионы, образованные потерей одного электрона | H + |
| Na + | |
| К + | |
| руб + | |
| Ag + | |
| Au + | |
| Ионы, образованные при потере двух электронов | мг 2+ |
| Ca 2+ | |
| Sr 2+ | |
| Fe 2+ | |
| Co 2+ | |
| Ni 2+ | |
| Cu 2+ | |
| Zn 2+ | |
| Sn 2+ | |
| Hg 2+ | |
| Pb 2+ | |
| Ионы, образованные потерей трех электронов | SC 3+ |
| Fe 3+ | |
| Сообщество 3+ | |
| Ni 3+ | |
| Au 3+ | |
| Al 3+ | |
| Cr 3+ | |
| Ионы, образованные при потере четырех электронов | Ti 4+ |
| Sn 4+ | |
| Pb 4+ | |
| Ионы, образованные за счет получения одного электрона | Ф — |
| Класс — | |
| Br — | |
| Я — | |
| Ионы, образованные за счет двух электронов | О 2− |
| S 2- | |
| SE 2- | |
| Ионы, образованные за счет трех электронов | Н 3- |
| П 3- |
В-третьих, есть некоторые исключения из предыдущего пункта.Несколько элементов, все металлы, могут образовывать более одного заряда. Например, атомы железа могут образовывать 2+ катионов или 3+ катионов. Кобальт — еще один элемент, который может образовывать более одного возможного заряженного иона (2+ и 3+), в то время как свинец может образовывать 2+ или 4+ катионов. К сожалению, мало кто понимает, какие два заряда может принимать атом металла, поэтому лучше просто запомнить возможные заряды, которые может иметь конкретный элемент.
Обратите внимание на условные обозначения иона. Величина заряда указывается в правом верхнем индексе рядом с символом элемента.Если заряд однократный, положительный или отрицательный, цифра 1 не записывается; если величина заряда больше 1, то записывается число перед знаком + или -. Символ элемента без заряда, написанный рядом с ним, считается незаряженным атомом.
Иону присвоить имя просто. Для катиона просто используйте имя элемента и добавьте слово ion (или, если вы хотите быть более конкретным, добавьте катион ) после имени элемента.Итак, Na + — это ион натрия; Ca 2+ — ион кальция. Если элемент имеет более одного возможного заряда, значение заряда идет после имени элемента и перед словом ion . Таким образом, Fe 2+ — это два иона железа, а Fe 3+ — это три иона железа. В печати мы используем римские цифры в скобках для обозначения заряда иона, поэтому эти два иона железа будут представлены как катион железа (II) и катион железа (III) соответственно.
Для одноатомного аниона используйте основу имени элемента и добавьте к нему суффикс -ide , а затем добавьте ион . Это похоже на то, как мы называли молекулярные соединения. Таким образом, Cl — представляет собой хлорид-ион, а N 3- представляет собой нитрид-ион.
Пример 6
Назовите каждый вид.
- O 2-
- Co
- Co 2+
Решение
- Этот вид имеет заряд 2−, поэтому это анион.Анионы названы с использованием основы имени элемента с добавленным суффиксом -ide . Это оксид-анион.
- Поскольку этот вид не имеет заряда, это атом в своей элементарной форме. Это кобальт.
- В данном случае атом имеет заряд 2+, значит, это катион. Мы отмечаем из Таблицы 3.6 «Одноатомные ионы с разным зарядом», что катионы кобальта могут иметь два возможных заряда, поэтому имя иона должно указывать, какой заряд он имеет. Это катион кобальта (II).
Проверьте себя
Назовите каждый вид.
- П 3-
- Sr 2+
ответы
- анион фосфида
- катион стронция
Химические формулы ионных соединений называются ионными формулами. Правильная ионная формула содержит катион и анион; ионное соединение никогда не образуется только между двумя катионами или только двумя анионами. Ключ к написанию правильных ионных формул прост: общий положительный заряд должен уравновешивать общий отрицательный заряд.Поскольку заряды на ионах характерны, иногда нам нужно иметь более одного катиона или аниона, чтобы сбалансировать общие положительные и отрицательные заряды. Принято использовать наименьшее соотношение ионов, необходимое для уравновешивания зарядов.
Например, рассмотрим ионное соединение между Na + и Cl —. Каждый ион имеет один заряд, один положительный и один отрицательный, поэтому нам нужен только один ион каждого из них, чтобы сбалансировать общий заряд. При написании ионной формулы мы следуем двум дополнительным соглашениям: (1) сначала записываем формулу для катиона, а затем формулу для аниона, но (2) не записываем заряды на ионах.Таким образом, для соединения между Na + и Cl — мы имеем ионную формулу NaCl (рис. 3.5 «NaCl = столовая соль»). Формула Na 2 Cl 2 также имеет сбалансированные заряды, но принято использовать наименьшее соотношение ионов, по одному каждого из них. (Помните из наших правил написания формул, что мы не пишем нижний индекс 1, если присутствует только один атом определенного элемента.) Для ионного соединения между катионами магния (Mg 2+ ) и оксидными анионами (O ) 2-), нам снова нужен только один ион каждого типа, чтобы сбалансировать заряды.По соглашению формула — MgO.
Рис. 3.5 NaCl = столовая соль
Ионное соединение NaCl очень распространено.Источник: «Кошерная соль» от stlbites.com под лицензией Creative Commons Attribution-NoDerivs 2.0 Generic.
Для ионного соединения между ионами Mg 2+ и ионами Cl — мы теперь рассмотрим тот факт, что заряды имеют разные величины: 2+ на ионе магния и 1− на ионе хлорида. Чтобы сбалансировать заряды с наименьшим возможным количеством ионов, нам нужно иметь два иона хлорида, чтобы сбалансировать заряд на одном ионе магния.Вместо того, чтобы писать формулу MgClCl, мы объединяем два иона хлорида и записываем ее с нижним индексом 2: MgCl 2 .
О чем нам говорит формула MgCl 2 ? В формуле два хлорид-иона. Хотя хлор как элемент представляет собой двухатомную молекулу, Cl 2 , элементарный хлор не является частью этого ионного соединения. Хлор находится в форме отрицательно заряженного иона , а не нейтрального элемента . Нижний индекс 2 находится в ионной формуле, потому что нам нужны два иона Cl — , чтобы сбалансировать заряд на одном ионе Mg 2+ .
Пример 7
Напишите правильную ионную формулу для каждого из двух данных ионов.
- Ca 2+ и Cl —
- Al 3+ и F —
- Al 3+ и O 2-
Решение
- Нам нужны два иона Cl — , чтобы сбалансировать заряд одного иона Ca 2+ , поэтому правильная ионная формула — CaCl 2 .
- Нам нужны три иона F — , чтобы сбалансировать заряд иона Al 3+ , поэтому правильная ионная формула — AlF 3 .
- Обратите внимание, что с Al 3+ и O 2- ни один из зарядов не является точным кратным другому. Это означает, что нам нужно перейти к наименьшему общему кратному, которым в данном случае будет шесть. Чтобы получить в сумме 6+, нам понадобятся два иона Al 3+ ; чтобы получить 6−, нам нужно три иона O 2- . Следовательно, правильная ионная формула — Al 2 O 3 .
Проверьте себя
Напишите правильные ионные формулы для каждого из двух данных ионов.
- Fe 2+ и S 2-
- Fe 3+ и S 2-
ответы
- FeS
- Fe 2 S 3
Назвать ионные соединения просто: объедините название катиона и название аниона, в обоих случаях опуская слово ion . Не используйте числовые префиксы, если для балансировки зарядов необходимо более одного иона. NaCl — хлорид натрия, сочетание названия катиона (натрий) и аниона (хлорид).MgO — оксид магния. MgCl 2 представляет собой хлорид магния — , а не дихлорид магния.
При обозначении ионных соединений, катионы которых могут иметь более одного возможного заряда, мы также должны включать заряд в скобках и римскими цифрами как часть названия. Следовательно, FeS — сульфид железа (II), а Fe 2 S 3 — сульфид железа (III). Опять же, в названии нет числовых префиксов. Количество ионов в формуле продиктовано необходимостью сбалансировать положительный и отрицательный заряды.
Пример 8
Назовите каждое ионное соединение.
- CaCl 2
- AlF 3
- Co 2 O 3
Решение
- Используя названия ионов, это ионное соединение называется хлорид кальция. Это не хлорид кальция (II) , потому что кальций образует только один катион, когда образует ион, и он имеет характерный заряд 2+.
- Название этого ионного соединения — фторид алюминия.
- Мы знаем, что кобальт может иметь более одного заряда; нам просто нужно определить, что это такое. Оксид всегда имеет заряд 2−, поэтому с тремя оксидными ионами общий отрицательный заряд равен 6−. Это означает, что два иона кобальта должны давать вклад 6+, что для двух ионов кобальта означает, что каждый из них равен 3+. Следовательно, собственное название этого ионного соединения — оксид кобальта (III).
Проверьте себя
Назовите каждое ионное соединение.
- Sc 2 O 3
- AgCl
ответы
- оксид скандия
- хлорид серебра
Как узнать, предназначена ли формула — и, в более широком смысле, название — для молекулярного соединения или для ионного соединения? Молекулярные соединения образуются между неметаллами и неметаллами, а ионные соединения образуются между металлами и неметаллами.Периодическая таблица Менделеева (рис. 3.2 «Простая таблица Менделеева») может использоваться, чтобы определить, какие элементы являются металлами и неметаллами.
Также существует группа ионов, содержащих более одного атома. Их называют многоатомными ионами. В таблице 3.7 «Общие многоатомные ионы» перечислены формулы, заряды и названия некоторых общих многоатомных ионов. Только один из них, ион аммония, является катионом; остальные — анионы. Большинство из них также содержат атомы кислорода, поэтому иногда их называют оксианионами .Некоторые из них, такие как нитрат и нитрит, сульфат и сульфит, имеют очень похожие формулы и названия, поэтому необходимо позаботиться о том, чтобы формулы и названия были правильными. Обратите внимание, что многоатомный ион -ite имеет в своей формуле на один атом кислорода меньше, чем -ат-ион, но с тем же ионным зарядом.
Таблица 3.7 Общие многоатомные ионы
| Имя | Формула и заряд | Имя | Формула и заряд | |
|---|---|---|---|---|
| аммоний | NH 4 + | гидроксид | ОН — | |
| ацетат | C 2 H 3 O 2 — или CH 3 COO — | нитрат | НЕТ 3 — | |
| бикарбонат (гидрокарбонат) | HCO 3 — | нитрит | НЕТ 2 — | |
| бисульфат (гидросульфат) | HSO 4 — | перекись | О 2 2- | |
| карбонат | CO 3 2- | перхлорат | ClO 4 — | |
| хлорат | ClO 3 — | фосфат | PO 4 3- | |
| хромат | CrO 4 2- | сульфат | СО 4 2- | |
| цианид | CN — | сульфит | СО 3 2- | |
| дихромат | Cr 2 O 7 2- | трииодид | Я 3 — |
Именование ионных соединений, содержащих многоатомные ионы, следует тем же правилам, что и наименования других ионных соединений: просто объедините название катиона и название аниона.Не используйте числовые префиксы в имени, если многоатомных ионов более одного; единственное исключение из этого — если название самого иона содержит числовой префикс, например дихромат или трииодид.
Написание формул ионных соединений имеет одно важное отличие. Если для уравновешивания общего заряда в формуле требуется более одного многоатомного иона, заключите формулу многоатомного иона в скобки и напишите правильный числовой индекс справа и после скобок.Таким образом, формула между ионами кальция Ca 2+ и нитрат-ионами NO 3 — правильно написана Ca (NO 3 ) 2 , а не CaNO 32 или CaN 2 О 6 . При необходимости используйте круглые скобки. Название этого ионного соединения — просто нитрат кальция.
Пример 9
Напишите правильную формулу и дайте собственное название для каждого ионного соединения, образованного между двумя перечисленными ионами.
- NH 4 + и S 2-
- Al 3+ и PO 4 3-
- Fe 2+ и PO 4 3-
Решение
- Поскольку ион аммония имеет заряд 1+, а сульфид-ион имеет заряд 2−, нам нужны два иона аммония, чтобы сбалансировать заряд одного сульфид-иона.Заключив формулу иона аммония в скобки, мы получим (NH 4 ) 2 S. Название соединения — сульфид аммония.
- Поскольку ионы имеют одинаковую величину заряда, нам нужен только один из них, чтобы сбалансировать заряды. Формула — AlPO 4 , название соединения — фосфат алюминия.
- Ни один из зарядов не является точным кратным другому, поэтому мы должны перейти к наименьшему общему кратному 6. Чтобы получить 6+, нам нужны три иона железа (II), а чтобы получить 6−, нам нужны два иона фосфата.Правильная формула — Fe 3 (PO 4 ) 2 , а название соединения — фосфат железа (II).
Проверьте себя
Напишите правильную формулу и дайте собственное название для каждого ионного соединения, образованного между двумя перечисленными ионами.
- NH 4 + и PO 4 3-
- Co 3+ и NO 2 —
ответы
- (NH 4 ) 3 PO 4 , фосфат аммония
- Co (NO 2 ) 3 , нитрит кобальта (III)
Приложение для еды и напитков: натрий в продуктах питания
Элемент натрий, по крайней мере в его ионной форме, такой как Na + , является необходимым питательным веществом для жизни человека.Фактически, человеческое тело состоит примерно на 0,15% натрия, при этом у среднего человека в любой момент времени содержится от одной двадцатой до одной десятой килограмма килограмма, в основном в жидкостях вне клеток и в других жидкостях организма.
Натрий также присутствует в нашем рационе. Поваренная соль, которую мы используем в наших продуктах, представляет собой ионное соединение натрия. Многие обработанные пищевые продукты также содержат значительное количество натрия, добавленного к ним в виде различных ионных соединений. Почему так много соединений натрия? Обычно соединения натрия недорогие, но, что более важно, большинство ионных соединений натрия легко растворяются.Это позволяет производителям пищевых продуктов добавлять натрийсодержащие вещества в пищевые смеси и знать, что соединение растворяется и равномерно распределяется по пище. Простые ионные соединения, такие как нитрит натрия (NaNO 2 ), добавляют в колбасы, такие как бекон и мясные деликатесы, в то время как соединение, называемое бензоатом натрия, добавляют во многие упакованные продукты в качестве консерванта. Таблица 3.8 «Некоторые соединения натрия, добавляемые в пищу» — это неполный список некоторых добавок натрия, используемых в пищевых продуктах.Некоторые из них вы можете узнать после прочтения этой главы. Другие, возможно, вы не узнаете, но все они представляют собой ионные соединения натрия с некоторыми отрицательно заряженными ионами.
Таблица 3.8 Некоторые соединения натрия, добавляемые в пищу
| Соединение натрия | Использование в продуктах питания |
|---|---|
| Ацетат натрия | консервант, регулятор кислотности |
| Адипат натрия | пищевая кислота |
| Альгинат натрия | загуститель, растительная камедь, стабилизатор, желирующий агент, эмульгатор |
| Натрий-алюминийфосфат | регулятор кислотности, эмульгатор |
| Алюмосиликат натрия | противослеживающий агент |
| Аскорбат натрия | антиоксидант |
| Бензоат натрия | консервант |
| Бикарбонат натрия | соль минеральная |
| Бисульфит натрия | консервант, антиоксидант |
| Карбонат натрия | соль минеральная |
| Карбоксиметилцеллюлоза натрия | эмульгатор |
| Цитрат натрия | пищевая кислота |
| Дегидроацетат натрия | консервант |
| Эриторбат натрия | антиоксидант |
| Эриторбин натрия | антиоксидант |
| Этилпарагидроксибензоат натрия | консервант |
| Ферроцианид натрия | противослеживающий агент |
| Формиат натрия | консервант |
| натрия фумарат | пищевая кислота |
| Глюконат натрия | стабилизатор |
| Гидроацетат натрия | консервант, регулятор кислотности |
| Гидроксид натрия | соль минеральная |
| Лактат натрия | пищевая кислота |
| Малат натрия | пищевая кислота |
| метабисульфит натрия | консервант, антиоксидант, отбеливающее средство |
| Метилпара-гидроксибензоат натрия | консервант |
| Нитрат натрия | консервант, фиксатор цвета |
| Нитрит натрия | консервант, фиксатор цвета |
| Ортофенилфенол натрия | консервант |
| Пропионат натрия | консервант |
| Пропилпарагидроксибензоат натрия | консервант |
| Сорбат натрия | консервант |
| Стеароиллактилат натрия | эмульгатор |
| Сукцинат натрия | регулятор кислотности, усилитель вкуса |
| Натриевые соли жирных кислот | эмульгатор, стабилизатор, антислеживающий агент |
| Сульфит натрия | соль минеральная, консервант, антиоксидант |
| Сульфит натрия | консервант, антиоксидант |
| Тартрат натрия | пищевая кислота |
| Тетраборат натрия | консервант |
Использование такого количества соединений натрия в готовых и обработанных пищевых продуктах встревожило некоторых врачей и диетологов.Они утверждают, что средний человек потребляет слишком много натрия из своего рациона. Среднестатистическому человеку требуется всего около 500 мг натрия в день; большинство людей потребляют больше — до 10 раз больше. Некоторые исследования связывают повышенное потребление натрия с повышенным кровяным давлением; более новые исследования показывают, что ссылка сомнительна. Тем не менее, было стремление уменьшить количество натрия, которое большинство людей потребляет каждый день: избегайте обработанных и промышленных продуктов, читайте этикетки на упакованных пищевых продуктах (которые включают указание на содержание натрия), не пересоливайте продукты и используйте другие продукты. травы и специи помимо соли в кулинарии.
На этикетках пищевых продуктов указано количество натрия на порцию. На этой этикетке указано, что в одной порции этого продукта содержится 75 мг натрия.
Основные выводы
- Ионы образуются, когда атомы теряют или приобретают электроны.
- Ионные соединения содержат положительные и отрицательные ионы.
- Ионные формулы уравновешивают общие положительные и отрицательные заряды.
- Ионные соединения имеют простую систему наименований.
- Группы атомов могут иметь общий заряд и образовывать ионные соединения.
Упражнения
Объясните, как образуются катионы.
Укажите заряд, который принимает каждый атом, когда образует ион. Если возможно более одного заряда, укажите оба.
а) К
б) О
c) Co
4. Дайте заряд, который получает каждый атом, когда образует ион.Если возможно более одного заряда, укажите оба.
а) Ca
б) Я
в) Fe
5. Дайте заряд, который получает каждый атом, когда образует ион. Если возможно более одного заряда, укажите оба.
а) Ag
б) Au
в)
рублей6. Дайте заряд, который принимает каждый атом, когда образует ион. Если возможно более одного заряда, укажите оба.
а) Ю
б) Na
c) H
7.Назовите ионы из упражнения 3.
8. Назовите ионы из упражнения 4.
9 Назовите ионы из упражнения 5.
10. Назовите ионы из упражнения 6.
11. Дайте формулу и название для каждого ионного соединения, образованного между двумя перечисленными ионами.
a) Mg 2+ и Cl —
б) Fe 2+ и O 2-
c) Fe 3+ и O 2-
12.Дайте формулу и название для каждого ионного соединения, образованного между двумя перечисленными ионами.
a) K + и S 2-
б) Ag + и Br —
в) Sr 2+ и N 3-
13. Дайте формулу и название для каждого ионного соединения, образованного между двумя перечисленными ионами.
а) Cu 2+ и F —
б) Ca 2+ и O 2-
c) K + и P 3-
14.Дайте формулу и название для каждого ионного соединения, образованного между двумя перечисленными ионами.
а) Na + и N 3−
б) Co 2+ и I —
c) Au 3+ и S 2-
15. Дайте формулу и название для каждого ионного соединения, образованного между двумя перечисленными ионами.
a) K + и SO 4 2-
б) NH 4 + и S 2-
c) NH 4 + и PO 4 3-
16.Дайте формулу и название для каждого ионного соединения, образованного между двумя перечисленными ионами.
a) Ca 2+ и NO 3 —
б) Ca 2+ и NO 2 —
c) Sc 3+ и C 2 H 3 O 2 —
17. Дайте формулу и название для каждого ионного соединения, образованного между двумя перечисленными ионами.
а) Pb 4+ и SO 4 2-
б) Na + и I 3 —
c) Li + и Cr 2 O 7 2-
18.Дайте формулу и название для каждого ионного соединения, образованного между двумя перечисленными ионами.
a) NH 4 + и N 3-
б) Mg 2+ и CO 3 2-
c) Al 3+ и OH —
19. Дайте формулу и название для каждого ионного соединения, образованного между двумя перечисленными ионами.
a) Ag + и SO 3 2-
б) Na + и HCO 3 —
c) Fe 3+ и ClO 3 —
20.Дайте формулу и название для каждого ионного соединения, образованного между двумя перечисленными ионами.
а) Rb + и O 2 2-
б) Au 3+ и HSO 4 —
c) Sr 2+ и NO 2 —
21. В чем разница между SO 3 и SO 3 2-?
22. В чем разница между NO 2 и NO 2 — ?
ответы
1.
Катионы образуются за счет потери электронов.
3.
а) 1+
б) 2−
в) 2+, 3+
5.
а) 1+
б) 1+, 3+
в) 1−
7.
а) ион калия
б) оксид-ион
в) ионы кобальта (II) и кобальта (III) соответственно
9.
а) ион серебра
б) ионы золота (I) и золота (III) соответственно
в) бромид-ион
11.
а) хлорид магния, MgCl 2
б) оксид железа (II), FeO
в) оксид железа (III), Fe 2 O 3 13.
а) фторид меди (II), CuF 2
б) оксид кальция, CaO
в) фосфид калия, K 3 P
15.
а) сульфат калия, К 2 SO 4
б) сульфид аммония, (NH 4 ) 2 S
c) фосфат аммония, (NH 4 ) 3 PO 4 17.
а) сульфат свинца (IV), Pb (SO 4 ) 2
б) трииодид натрия, NaI 3
в) дихромат лития, Li 2 Cr 2 O 7 19.
а) сульфит серебра, Ag 2 SO 3
б) гидрокарбонат натрия, NaHCO 3
c) хлорат железа (III), Fe (ClO 3 ) 3 21.
SO 3 — триоксид серы, а SO 3 2- — сульфит-ион.
Что заставляет ионы образовывать ионные связи?
Что заставляет ионы образовывать ионные связи?- Ионная связь образуется, когда металл соединяется с неметаллом с образованием соединения.
- Образовавшееся соединение называется ионным соединением .
Металл + Неметалл → Ионное соединение - Ионная связь образуется посредством переноса электронов от атомов металла к атомам неметалла .
- Атомы металла теряют свои валентные электроны для достижения стабильного расположения электронов благородного газа . Таким образом, образуется положительно заряженных ионов .
- Атомы неметаллов принимают электроны , пожертвованные атомами металла, для достижения стабильного расположения электронов благородного газа . Таким образом, образуется отрицательно заряженных ионов .
- Положительно заряженные ионы и отрицательно заряженные ионы затем притягиваются друг к другу сильными электростатическими силами , которые плотно упакованы упорядоченным образом в кристаллической решетке, образуя ионное соединение .
- Сильная электростатическая сила притяжения между противоположно заряженными ионами называется ионной связью .
- На рисунке показана диаграмма, которая суммирует образование ионной связи между атомом металла и атомом неметалла.
- Примеры ионных соединений:
Люди также спрашивают
Образование ионов
- В атоме количество протонов равно числу электронов.Следовательно, атом нейтральный .
- Ион — это заряженная частица , образованная, когда атом теряет или принимает электроны .
- Ион является заряженной частицей, потому что число протонов не равно числу электронов.
- В таблице сравнивается образование катионов и анионов из соответствующих элементов.
Образование катионов:
- Атом, который теряет электроны из своей валентной оболочки, образует положительный ион , называемый катионом .
- Катион заряжен положительно, потому что в нем на протонов больше, чем электронов .
- Металлы образуют положительных ионов (катионов) , отдавая электроны.
Образование анионов:
- Атом, который принимает электроны в свою валентную оболочку, образует отрицательный ион , называемый анионом .
- Анион заряжен отрицательно, потому что у него на электронов больше, чем у протонов .
- Неметаллы образуют отрицательных ионов (анионов) , принимая электроны.
На рисунке показано, как нейтральный атом становится ионом , поскольку передает или принимает электронов.
Образование катионов (положительных ионов)
- Металлы из группы 1, 2 и 13 Периодической таблицы образуют катионов (положительно заряженные ионы), отдавая свою валентность электроны.
- Металлы обычно на электроположительнее .
- (a) Это означает, что металлы легко теряют свои валентные электроны для достижения стабильного дуплета или октета электронного расположения, аналогичного благородным газам.
(b) При этом образуются катионы (положительно заряженные ионы).
Образование катионов элементами 1-й группы:
- Металл атомов элементов 1-й группы имеют один валентный электрон .
- Для каждого из этих атомов легче потерять один электрон , чем получить семь электронов для достижения стабильного дуплетного или октетного расположения электронов.
- В результате атом металла группы 1 теряет один валентный электрон с образованием катиона с зарядом +1 .
- Пример: Литий
- Атом лития имеет расположение электронов 2,1 .
- Имеет один валентный электрон .
- При образовании связи каждый атом лития теряет один валентный электрон для достижения стабильного дуплета электронного расположения, аналогичного гелию (благородный газ).
- Следовательно, образуется ион лития Li + .
- На рисунке ниже показано образование иона лития из атома лития:
Образование катионов элементами 2-й группы:
- Металл атомов 2-й группы элементов двух валентных электронов.
- Для каждого из этих атомов легче потерять два электрона , чем получить шесть электронов для достижения стабильного расположения электронов благородного газа.
- В результате атом металла группы 2 теряет два валентных электрона с образованием катиона с зарядом +2 .
- Пример: Кальций
- Атом кальция имеет расположение электронов 2.8.8.2 .
- Он имеет двух валентных электронов .
- Таким образом, каждый атом кальция теряет два валентных электрона для достижения стабильного расположения электронов октета , аналогичного аргону.
- Следовательно, образуется ион кальция Ca 2+ .
- На рисунке ниже показано образование иона кальция из атома кальция:
Образование катионов элементами 13 группы:
- Металл атомов Группы 13 элементов имеют три валентных электронов.
- Чтобы достичь стабильного расположения электронов благородных газов, каждый из атомов металла Группы 13 теряет всех трех валентных электронов с образованием катиона с зарядом +3 .
- Пример: Алюминий
- Атом алюминия имеет расположение электронов 2,8,3 .
- Он имеет трех валентных электронов .
- Таким образом, каждый атом алюминия теряет три валентных электрона для достижения стабильного расположения электронов октета , аналогичного неону.
- Следовательно, образуется ион алюминия Al 3+ .
- На рисунке ниже показано образование иона алюминия из атома алюминия:
Изменения количества субатомных частиц во время образования катионов:
- Ниже приведен список из четырех важных факты относительно образования катиона из атома.
Когда атом металла превращается в катион,- количество протонов и нейтронов в ядре остается неизменным .
- только количество электронов уменьшается на .
- расположение электронов изменяется для достижения стабильного расположения электронов благородных газов.
- количество протонов (общий положительный заряд) на больше, чем количество электронов (общий отрицательный заряд) в образующемся катионе .
- В общем, атом металла X теряет n электронов (все свои валентные электроны), чтобы сформировать положительный ион (катион) с зарядом + n .
Метод определения заряда положительного иона:
- Частица положительно заряжена , если число из протонов (общий положительный заряд) больше, чем количество электронов ( общий отрицательный заряд).
- Заряд можно рассчитать следующим образом:
Образование анионов (отрицательных ионов)
- Неметаллы , из Группы 15, 16 и 17 Периодической таблицы, образуют анионы (отрицательно заряженные ионы) на , приняв электронов в свои валентные оболочки.
- Неметаллы обычно на более электроотрицательны .
- (a) Это означает, что неметаллы легко принимают электроны в свои валентные оболочки для достижения стабильных расположений октетных электронов (аналогичных расположениям благородных газов).
(b) При этом образуются анионы (отрицательно заряженные ионы).
Образование анионов элементами 15-й группы:
- Неметаллы атомов элементов 15-й группы имеют пять валентных электронов .
- Для каждого из этих атомов легче принять три электрона , чем потерять пять электронов для достижения стабильного октетного расположения электронов.
- В результате атом неметалла группы 15 принимает три электрона в свою валентную оболочку с образованием аниона с зарядом -3 .
- Пример: Азот
- Атом азота имеет электронных расположений 2,5.
- Имеет пять валентных электронов .
- При образовании связи каждый атом азота получает три электрона для достижения стабильного расположения электронов октета (аналогично неону).
- Следовательно, образуется нитрид-ион N 3-.
- На рисунке ниже показано образование нитрид-иона из атома азота:
Образование анионов элементами 16-й группы:
- Неметаллические атомов элементов 16-й группы элементов имеют шесть валентных электронов.
- Для каждого из этих атомов легче принять два электрона , чем потерять шесть электронов для достижения стабильного расположения электронов благородного газа.
- Следовательно, атом неметалла группы 16 принимает два электрона в свою валентную оболочку с образованием аниона с зарядом -2 .
- Пример: сера
- Атом серы имеет расположение электронов 2,8,6.
- Он имеет шесть валентных электронов .
- Следовательно, каждый атом серы принимает два электрона в свою валентную оболочку для достижения стабильного расположения электронов октета (аналогично аргону).
- Таким образом, образуется сульфид-ион S 2-.
Образование анионов элементами группы 17:
- Неметаллические атомов элементов группы 17 имеют семь валентных электронов .
- Для каждого из этих атомов легче принять один электрон , чем потерять семь электронов для достижения стабильного октетного расположения электронов.
- Следовательно, атом неметалла Группы 17 принимает один электрон в свою валентную оболочку с образованием аниона с зарядом -1 .
- Пример: Хлор
- Атом хлора имеет расположение электронов 2,8,7.
- Он имеет семь валентных электронов .
- При образовании связи каждый атом хлора принимает один электрон в валентную оболочку для достижения стабильного расположения электронов октета (аналогично аргону).
- Таким образом, образуется хлорид-ион Cl —.
- На рисунке ниже показано образование иона хлорида из атома хлора:
Изменения количества субатомных частиц во время образования анионов:
- Ниже приведен список из четырех важных факты об образовании аниона из атома.Когда атом неметалла превращается в анион,
- , количество протонов и нейтронов в ядре остается неизменным .
- только количество электронов увеличивается на .
- расположение электронов изменяется для достижения стабильного расположения электронов благородных газов.
- количество электронов (общий отрицательный заряд) на больше, чем количество протонов (общий положительный заряд) в образующемся анионе .
- Обычно атом неметалла Y, принимает m электронов в валентную оболочку для достижения стабильного расположения электронов благородного газа. В результате образуется отрицательный ион (анион) с зарядом -m .
Метод определения заряда отрицательного иона
- Заряд отрицательного иона можно определить на основе количества субатомных частиц.
- В отрицательно заряженном ионе количество электронов (общий отрицательный заряд) на больше, чем на количество протонов (общий положительный заряд)
- Заряд можно рассчитать следующим образом:
1. Ион элемента Y имеет следующее количество субатомных частиц:
25 протонов, 30 нейтронов, 23 электрона
(a) Этот ион заряжен положительно или отрицательно? Поясните свой ответ.
(b) Рассчитайте заряд этого иона.
(c) Напишите формулу этого иона.
Решение:
2. Элемент W имеет нуклонное число 27. Он содержит 14 нейтронов. Образует ион с формулой W 3+ .
(а) Сколько протонов и электронов в ионе W 3+ ?
(b) Запишите расположение электронов иона W 3+ .Раствор
Раствор:
3. Элемент G образует ион с формулой G + . В атоме G 20 нейтронов. Электронное расположение иона G + равно 2,8,8. Какое число нуклонов у элемента G?
Решение:
4. Элемент J имеет протонное число 16 и нуклонное число 32. Атом J образует отрицательный ион J n- .
(a) Определите количество протонов, нейтронов и электронов в ионе J n- .
(б) Каково значение n?
Решение:
5. Ион элемента M имеет следующее количество субатомных частиц:
15 протонов, 16 нейтронов, 18 электронов
(а) Каков заряд этого иона?
(b) Напишите формулу этого иона.
Раствор:
6. Атом R имеет нуклонное число 19. Он образует ион с формулой R — . Ион R — имеет расположение электронов 2.8. Какое количество нейтронов в атоме R?
Раствор:
7. Элемент D образует ион D 2+ .
Электронное расположение иона D 2+ равно 2.8.8.
(a) Где находится элемент D в Периодической таблице?
(b) Каково протонное число элемента D?
Решение:
8. Элемент G помещен в группу 16 и период 2 Периодической таблицы. Когда атом G образует ион, его электронное расположение изменяется.
(a) Ион, образованный элементом G, заряжен положительно или отрицательно?
(b) Какова формула иона, образованного элементом G?
(c) Запишите расположение электронов иона, образованного элементом G.
Решение:
Образование ионов и ионных соединений
Щелкните изображения, чтобы просмотреть рабочий лист этого урока и Рабочую тетрадь по химии за 9-й год (PDF-версия и версия для печати)
Введение
- Электронная конфигурация атомов определяет их стабильность.
- Это, в свою очередь, определяет, насколько химически активен элемент.
- Химическая стабильность конкретно связана с количеством валентных электронов в атомах; другими словами, количество электронов в валентной оболочке (внешней оболочке).
- Наиболее стабильными электронными конфигурациями являются те, в которых атомы имеют полные валентные оболочки.
- Атомы, у которых нет полных валентных оболочек, могут приобретать или терять электроны, приобретая полновалентные оболочки и становясь более стабильными.
Благородные газы стабильны, поскольку имеют полновалентные оболочки.
Прибыль и потеря электронов
- Полная валентная оболочка содержит восемь электронов, за исключением случая, когда валентная оболочка является единственной оболочкой — здесь полная валентная оболочка содержит два электрона.
- Единственные элементы, у которых есть атомы с полной валентной оболочкой, — это благородные газы.
- Все они имеют восемь валентных электронов, за исключением гелия, у которого их два.
- Благородные газы очень инертны и редко образуют соединения.
- Все остальные элементы состоят из атомов, не имеющих полных валентных оболочек.
- Однако большинство из них могут достигать полных валентных оболочек, теряя или получая электроны.
- Натрий имеет следующую электронную конфигурацию:
- ▸ 1-я оболочка: 2 электрона
- ▸ 2-я оболочка: 8 электронов
- ▸ 3-я оболочка: 1 электрон
- Наличие одного электрона в валентной оболочке делает атом натрия нестабильным.
- Чтобы иметь полную внешнюю оболочку и, следовательно, быть более стабильным, он легко теряет 1 электрон.
Атомы натрия могут потерять электрон, чтобы достичь полной валентной оболочки.
- Хлор имеет следующую электронную конфигурацию:
- ▸ 1-я оболочка: 2 электрона
- ▸ 2-я оболочка: 8 электронов
- ▸ 3-я оболочка: 7 электронов
- Наличие 7 электронов в валентной оболочке делает атом хлора нестабильным.
- Чтобы иметь полную внешнюю оболочку и, следовательно, быть более стабильным, он легко получает 1 электрон.
Атомы хлора могут получить электрон для достижения полной валентной оболочки.
- Когда атомы достигают полных валентных оболочек, теряя или приобретая электроны, они достигают электронной конфигурации благородного газа.
- В приведенных выше примерах натрий достигает электронной конфигурации неона, а хлор — электронной конфигурации аргона.
Положительные и отрицательные ионы
- Когда атом теряет или приобретает электроны, количество электронов больше не равно количеству протонов.
- Таким образом, он больше не является электрически нейтральным — теперь он заряжен.
- Атом, заряженный за счет получения или потери электронов, называется ионом.
- Атомы, образующие ионы, приобретают или теряют то количество электронов, которое приводит к тому, что они имеют полные валентные оболочки.
- Для большинства атомов полная валентная оболочка состоит из восьми электронов.
- Для мельчайших атомов и ионов (водорода, гелия, лития и бериллия) полная валентная оболочка состоит из двух электронов.
- Когда атом теряет электроны, он образует положительный ион.
- Это потому, что теперь положительно заряженных протонов больше, чем отрицательно заряженных электронов.
- Положительный ион также называют катионом.
- Когда атом получает электроны, он образует отрицательный ион.
- Это потому, что теперь отрицательно заряженных электронов больше, чем положительно заряженных протонов.
- Отрицательный ион также называют анионом.
Атомы имеют равное количество протонов и электронов.
Отрицательные ионы имеют больше электронов, чем протонов.
Положительные ионы содержат больше протонов, чем электронов.
- Заряд иона называется его валентностью.
- Размер заряда равен разнице в количестве протонов и электронов.
- Если атом получает один электрон, он будет иметь на один электрон больше, чем протонов; впоследствии образующийся ион будет иметь заряд –1. Точно так же, если атом получает два электрона, результирующий ион будет иметь заряд –2, а если атом получит три электрона, результирующий ион будет иметь заряд –3.
- Если атом теряет один электрон, у него будет на один протон больше, чем электронов; впоследствии получившийся ион будет иметь заряд +1.Точно так же, если атом теряет два электрона, образующийся ион будет иметь заряд +2, а если атом теряет три электрона, образующийся ион будет иметь заряд +3.
Ионы кислорода имеют заряд –2, так как электронов на два больше, чем протонов.
Ионы и периодическая таблица
- Поскольку структура таблицы Менделеева отражает электронные конфигурации элементов, существует взаимосвязь между положением элемента в таблице Менделеева и типом иона, который он образует, или если он не образует ионы.
Группы 1, 2 и 13
- Атомы всех элементов в группе 1 периодической таблицы имеют 1 валентный электрон.
- При образовании ионов эти атомы теряют 1 электрон, чтобы достичь полных валентных оболочек.
- Следовательно, все они образуют положительные ионы с зарядом +1.
- Атомы всех элементов в группе 2 периодической таблицы имеют 2 валентных электрона.
- При образовании ионов эти атомы теряют 2 электрона, чтобы достичь полных валентных оболочек.
- Следовательно, все они образуют положительные ионы с зарядом +2.
- Атомы всех элементов 13 группы периодической таблицы имеют 3 валентных электрона.
- При образовании ионов эти атомы теряют 3 электрона, чтобы достичь полных валентных оболочек.
- Следовательно, все они образуют положительные ионы с зарядом +3.
Группы 15, 16 и 17
- Атомы всех элементов 15-й группы периодической таблицы имеют 5 валентных электронов.
- При образовании ионов эти атомы получают 3 электрона для достижения полных валентных оболочек.
- Следовательно, все они образуют отрицательные ионы с зарядом –3.
- Атомы всех элементов 16-й группы периодической таблицы имеют 6 валентных электронов.
- При образовании ионов эти атомы получают 2 электрона для достижения полных валентных оболочек.
- Следовательно, все они образуют отрицательные ионы с зарядом –2.
- Атомы всех элементов 17-й группы периодической таблицы имеют 7 валентных электронов.
- При образовании ионов эти атомы получают 1 электрон для достижения полных валентных оболочек.
- Следовательно, все они образуют отрицательные ионы с зарядом -1.
Группы 3-12
- Атомы элементов 3–12 групп периодической таблицы (известные как переходные металлы) имеют 1 или 2 электрона в валентных оболочках.
- При образовании ионов эти атомы обычно теряют 1 или 2 электрона, образуя положительные ионы с зарядом +1 или +2.
- Однако количество валентных электронов этих элементов и заряды ионов, которые они формируют, трудно предсказать, исходя из их положения в периодической таблице.
- Кроме того, некоторые из этих элементов могут образовывать ионы с зарядом +3, а многие могут образовывать более одного типа ионов.
- Например, хром может образовывать ионы с зарядом +2 или +3.
- Единственный способ определить ионы, образованные переходными металлами (и постпереходными металлами, такими как олово и свинец), — это обратиться к таблице валентностей.
Группа 18
- Атомы всех элементов в группе 18 периодической таблицы (известные как благородные газы) имеют 8 электронов в их валентных оболочках, за исключением гелия, который имеет 2
- Другими словами, они имеют оболочки полной валентности.
- Это делает их очень стабильными и, как следствие, они не образуют ионы.
Другие элементы, не образующие ионы
- Помимо благородных газов, есть некоторые другие элементы, которые не образуют ионы, даже если у них нет полных валентных оболочек.
- К ним относятся элементы бор, углерод и кремний.
- Эти элементы все еще вступают в реакцию с образованием соединений, но при этом происходит процесс, который включает обмен электронами между атомами, а не перенос электронов. (Мы узнаем об этих типах соединений в следующем году.)
Существует взаимосвязь между положением элемента в таблице Менделеева и типом иона, который он образует.
Химическая реакционная способность и периодическая таблица
- Мы видели, что наиболее стабильными элементами являются благородные газы (группа 18), поскольку они состоят из атомов с полными валентными оболочками.
- Мы также видели, что элементы в группах 1, 2 и 13 реагируют с образованием положительных ионов, а элементы в группах 15, 16 и 17 реагируют с образованием отрицательных ионов.
- Для этих элементов, образующих ионы, существует взаимосвязь между электронной конфигурацией (и, следовательно, номером группы) и их реакционной способностью.
- Элементы, атомы которых ближе всего к полновалентным оболочкам, являются наиболее реактивными.
- Это потому, что для их превращения из атома в ион требуется наименьшее количество энергии.
- То есть для приобретения одного электрона требуется меньше энергии, чем для получения двух, и для потери одного электрона требуется меньше энергии, чем для потери двух.
- Следовательно, наиболее реактивные металлы (которые образуют положительные ионы) находятся в группе 1, так как им нужно только потерять один электрон, чтобы получить полную валентную оболочку.
Наиболее химически активные металлы относятся к 1 группе периодической таблицы Менделеева.
- Точно так же наиболее реактивные неметаллы (которые образуют отрицательные ионы) находятся в группе 17, так как им нужен только один электрон, чтобы иметь полную валентную оболочку.
Самые химически активные неметаллы находятся в 17-й группе таблицы Менделеева.
Одноатомные и многоатомные ионы
- Как мы видели выше, атомы могут приобретать или терять электроны, образуя ионы.
- Эти ионы известны как одноатомные ионы, так как они образованы из отдельных атомов.
- Ионы также могут образовываться, когда определенные молекулы приобретают или теряют электроны.
- Эти ионы известны как многоатомные ионы, так как они образованы из нескольких атомов.
- В многоатомных ионах заряд распределяется между атомами внутри них.
- Например, ионы гидроксида состоят из атома водорода и атома кислорода с общим зарядом –1.
- Другие общие многоатомные ионы включают аммоний, нитрат, сульфат и карбонат.
- Символы и заряды многоатомных ионов можно найти в таблице валентностей.
Одноатомные ионы образуются из отдельных атомов.
Многоатомные ионы происходят из молекул.
Ионные соединения
- Атомы не могут просто приобретать или терять электроны для достижения полных валентных оболочек. Они могут образовывать ионы только тогда, когда соединяются с другими атомами, которые могут отдавать или принимать электроны.
- Когда атомы образуют положительные ионы, их валентные электроны передаются другим атомам, которым эти электроны нужны для достижения полных валентных оболочек, и которые впоследствии образуют отрицательные ионы.
- Таким образом, образование положительных и отрицательных ионов происходит одновременно.
- После образования положительных и отрицательных ионов они объединяются в ионные соединения.
- Эти соединения удерживаются вместе сильными электростатическими силами, называемыми ионными связями, которые образуются между противоположно заряженными положительными и отрицательными ионами.
- Ионы в ионных соединениях расположены в трехмерной решетчатой структуре.
- Из-за своей кристаллической решетки ионные соединения представляют собой твердые кристаллические вещества при комнатной температуре.
- Многие из них, например хлорид натрия, растворимы в воде; другие, такие как карбонат кальция, нерастворимы в воде.
Ионные соединения имеют решетчатую структуру.
(Изображение: Benjah-bmm27, Wikimedia Commons)
Металлы и неметаллы
- Когда металлы образуют ионы, они всегда образуют положительные ионы.
- Когда неметаллы образуют ионы, они всегда образуют отрицательные ионы.
- Когда ионные соединения состоят только из одноатомных ионов, они, следовательно, будут состоять из положительных ионов металлов и отрицательных ионов неметаллов.
- Поскольку металлы всегда образуют положительно заряженные ионы, два металла не могут образовывать ионное соединение.
- Точно так же, поскольку неметаллы всегда образуют отрицательно заряженные ионы, два неметалла не могут образовывать ионное соединение.
Натрий (металл) и хлор (неметалл) реагируют с образованием ионного соединения хлорида натрия (соли).
(Изображения: Dnn87, Wikimedia Commons; Larenmclane, Wikimedia Commons; Chemicalinterest, Wikimedia Commons)
Сводка
- Самая стабильная электронная конфигурация атомов — это наличие полной валентной оболочки.
- Благородные газы имеют полновалентные оболочки и поэтому очень инертны.
- Большинство других элементов могут достигать полных оболочек, приобретая или теряя электроны.
- Когда атомы приобретают или теряют электроны, они образуют ионы, которые являются заряженными частицами из-за неравномерного количества протонов и электронов.
- Если атом получает электроны, он образует отрицательный ион (анион), так как электронов больше, чем протонов.
- Если атом теряет электроны, он образует положительный ион (катион), поскольку протонов больше, чем электронов.
- Размер заряда иона равен разнице в количестве протонов и электронов.
- Атомы элементов группы 1 имеют 1 валентный электрон, поэтому теряют 1 электрон, образуя ионы с зарядом +1.
- Атомы элементов группы 2 имеют 2 валентных электрона, поэтому теряют 2 электрона, образуя ионы с зарядом +2.
- Атомы элементов группы 13 имеют 3 валентных электрона, поэтому теряют 3 электрона, образуя ионы с зарядом +3.
- Атомы элементов группы 17 имеют 7 валентных электронов, поэтому получают 1 электрон для образования ионов с зарядом –1.
- Атомы элементов группы 16 имеют 6 валентных электронов, поэтому получают 2 электрона, чтобы образовать ионы с зарядом –2.
- Атомы элементов группы 15 имеют 5 валентных электронов, поэтому приобретают 3 электрона для образования ионов с зарядом –3.
- Для элементов, образующих ионы, чем ближе их атомы к полновалентным оболочкам, тем они более реактивны.
- Следовательно, металлы 1-й группы более активны, чем металлы 2-й группы, а металлы 2-й группы более активны, чем металлы 13-й группы.
- Точно так же неметаллы 17-й группы более реакционноспособны, чем неметаллы 16-й группы, а неметаллы 16-й группы обладают большей реакционной способностью, чем неметаллы 15-й группы.

 см
см И если положительные ионы притягиваются к Земле, то отрицательные — отталкиваются от нее. Когда происходят резкие колебания температуры, в атмосфере нарушается равновесие ионов: уменьшается количество отрицательных и возрастает — положительных.
И если положительные ионы притягиваются к Земле, то отрицательные — отталкиваются от нее. Когда происходят резкие колебания температуры, в атмосфере нарушается равновесие ионов: уменьшается количество отрицательных и возрастает — положительных. Перенасыщение серотонином (его еще называют «гормоном стрессов») приводит к нервному истощению — типичной болезни XXI столетия.
Перенасыщение серотонином (его еще называют «гормоном стрессов») приводит к нервному истощению — типичной болезни XXI столетия.
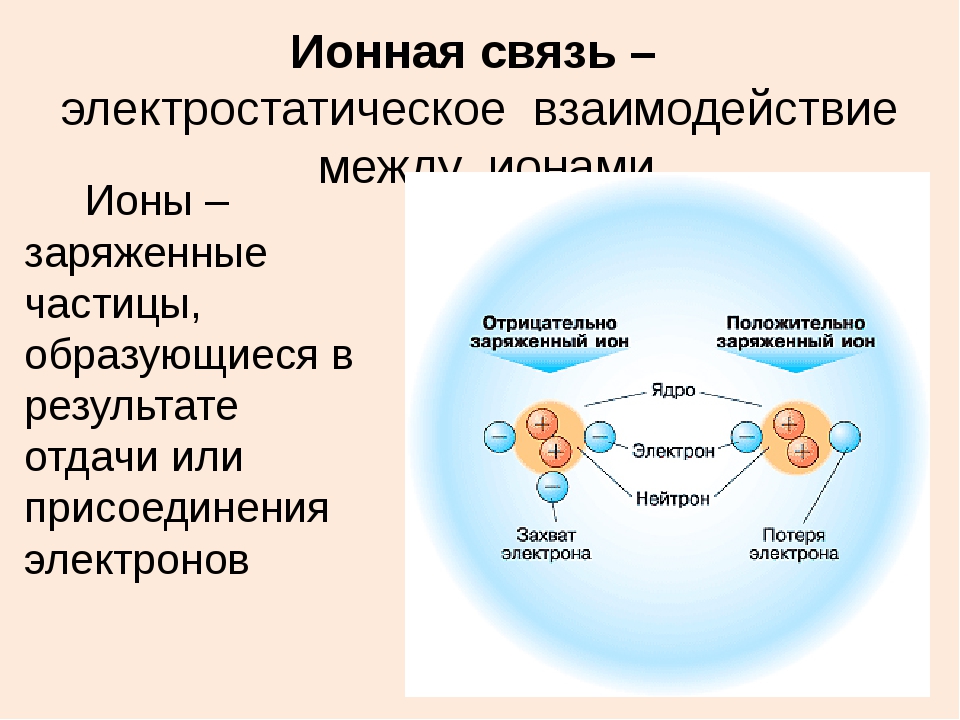
 В ее основе лежит воздействие на организм отрицательных ионов, которые стимулируют выработку антиоксидантов, устраняющих канцерогенные вещества.
В ее основе лежит воздействие на организм отрицательных ионов, которые стимулируют выработку антиоксидантов, устраняющих канцерогенные вещества.