Соль глаубера формула: Мирабилит — Энциклопедия камней | Jevel.ru
Мирабилит — Энциклопедия камней | Jevel.ru
Мирабилит является минералом средней распространенности, относящийся к классу водных сульфатов. Название минерала связано с латинским словом «mirabile”, что в переводе на русский язык означает удивительный. Мирабилит имеет другое название – глауберова соль. И. Р. Глаубер первым нашел глауберову соль, содержащуюся в минеральной воде.
Химическая формула минерала – Na2SO4х10h3O. В составе содержится окиси натрия — 19,3%; сульфата — 24,8% и воды — 55,9%. Типичными примесями иногда могут быть калий, магний, хлор. Минерал имеет другие названия: сибирская соль, гуджир, сернокислый натрий.
Кристаллическую структуру минерала составляют октаэдры, соединенные в цепочки в виде зигзага и связаны они с тетраэдрами SO4, а также с парой молекул воды. Кристаллизация минерала происходит в моноклинной сингонии. Образования мирабилита представлены кристаллами, имеющими короткопризматическую, игольчатую и тонкотаблитчатую структуру, а также встречается в виде сплошных зернистых агрегатов, налетов, корочек.
Мирабилит бывает бесцветный, а также белого, желтого и зеленого цвета. Твердость его очень низкая — 1,5-2. Удельный вес — 1,5. Черта белого цвета. Излом раковистый. Спайность совершенная, проходящая в одном направлении. Обладает стеклянным блеском. Имеет горько-соленый вкус.
Минерал экзогенного происхождения. Образование его происходит при осадочном хемогенном процессе. Формируется путем кристаллизации из соляных растворов озер и морей при более низких температурах (меньше 20 градусов по Цельсию). В Кулундинской и Барабинской степи откладывается в озерах. Является неустойчивым и подвергается выветриванию, превращаясь затем в сульфат натрия. Залегает совместно с галитом, тенардитом, глауберитом, эпсомитом.
Залежи мирабилита обнаружены в Антарктиде, где он формируется путем выпадения из соляных озер и лагун. Месторождения минерала известны в Западной Сибири (озеро Кучук), в Томской области (в соляных озерах), в Грузии. В США и Германии также найден минерал. Растворенная глауберова соль содержится в морской воде, а также в минеральных водах (Карловы Вары). Отличить мирабилит от сульфатов, натрия, калия и магния можно по его низкому показателю твердости, а также по удельному весу.
Растворенная глауберова соль содержится в морской воде, а также в минеральных водах (Карловы Вары). Отличить мирабилит от сульфатов, натрия, калия и магния можно по его низкому показателю твердости, а также по удельному весу.
Мирабилит является ценным сырьем, используемым в стекольной и лакокрасочной промышленности, а также в медицине. Глауберова соль обладает лечебными свойствами. Она является хорошим слабительным средством, очищает кишечник, лимфатическую систему, а также помогает нормализовать работу печени.
формула, свойства, применение и противопоказания :: SYL.ru
В те моменты, когда люди забывают о правилах питания и набирают по такому случаю некоторое количество излишних килограммов, бывает обидно и горько. Всем нам хочется быть привлекательными. А нормальная фигура – это один из кирпичиков, на котором строится привлекательность для окружающих и для себя. На помощь приходят диеты и отказ от острых и соленых блюд. Однако одну соль все-таки часто используют для ускоренного сбрасывания лишних килограммов. Заинтригованы? Этим веществом является не что иное, как глауберова соль.
Заинтригованы? Этим веществом является не что иное, как глауберова соль.
Открытие Глаубера
Иоганн Рудольф Глаубер, открывший для народа такое чудесное вещество, был немецким алхимиком. Произошло это в не самый легкий момент его жизни. Однажды ученый заболел и совсем не смог есть – так его донимали спазмы кишечника и сопутствующие этому явления. Иоганну посоветовали взять кусок хлеба и отправиться к чудесному источнику. Жители городка утверждали, что, если хлеб смочить в той волшебной воде, человек излечится и станет есть. Не слишком надеясь на чудо, алхимик все же посетил водный источник и сделал все, как ему сказали. После хлебной трапезы он испил той же воды и, к своему удивлению, почувствовал себя лучше. Как ученый человек, Глаубер занялся рассмотрением состава жидкости. Несколько месяцев он проводил химические испытания, и в процессе выпаривания воды из источника были обнаружены кристаллы неизвестного соляного вида.
Однако до судьбоносного открытия оставалось еще несколько лет. Через годы, изучая соль, Глаубер проводил опыты и с удивлением обнаружил, что некоторые из получившихся кристаллов имели формулу той соли, которая спасла жизнь ученого. Вещество было названо «чудесная соль» – мирабилит. Эта соль содержится в некоторых сибирских озерах, в морских водах Чехии, в Калифорнии, Германии, на острове Сицилия.
Через годы, изучая соль, Глаубер проводил опыты и с удивлением обнаружил, что некоторые из получившихся кристаллов имели формулу той соли, которая спасла жизнь ученого. Вещество было названо «чудесная соль» – мирабилит. Эта соль содержится в некоторых сибирских озерах, в морских водах Чехии, в Калифорнии, Германии, на острове Сицилия.
Свойства мирабилита
Формула глауберовой соли – Na2SO4· 10H2O. Это прозрачные кристаллы сероватого оттенка. Запаха у кристаллов нет. Вкус их горько-солоноватый. Глауберова соль способна выветриваться. Прекрасно растворяется в обычной воде.
Чем известна в медицине
Кристаллы соли, растворенные в воде, являются одним из мощнейших послабляющих средств. Это свойство полезно при отравлениях. Для подготовки к некоторым лечебным манипуляциям в области кишечника применение глауберовой соли является обязательной процедурой. Для комплексного лечения желчевыводящих путей и печени также применяется это вещество. В некоторых направлениях медицины ее активно применяют для борьбы с задержкой в организме жидкости.
В некоторых направлениях медицины ее активно применяют для борьбы с задержкой в организме жидкости.
Как это работает?
Формула глауберовой соли такова, что вещество это тянет на себя жидкость, находящуюся в организме. Попав в кишечник, такая соль, естественно, притягивает воду и разжижает стул. В свою очередь, работа кишечника усиливается, и массы в скором времени эвакуируются из человеческого тела. Вместе с каловыми веществами глауберова соль способна освободить организм от четырех литров жидкости. Токсические элементы и гнилостные бактерии, покинувшие человеческое тело, заодно облегчают работу лимфатической системе. Лимфа очищается благодаря мирабилиту, и происходит оздоровление организма. Кристаллы глауберовой соли, растворенные в воде, «уносят» также и ядовитые соли некоторых металлов (ртуть, свинец, медь, барий). Благодаря большим объемам потерянной жидкости раствор используют во время похудения. Жидкость имеет вес, соответственно, удалив ее, человек избавляется от килограммов.
Глауберова соль: инструкция
Если вы решили избавиться от шлаков и нескольких килограммов веса, а вам пришла в голову идея сделать это с помощью мирабилита, сначала проконсультируйтесь со специалистом в области медицины. В случае, когда нет запрета на прием данной соли, начинаем очищение изнутри.
Очищение с помощью глауберовой соли – для человека целеустремленного и выносливого. Курс приема соли длится три дня. В течение упомянутого отрезка времени нужен полный отказ от пищи. Еду в эти дни будет заменять ассорти из соков. Эти напитки не должны быть из магазина. Так что выжимать соки придется самостоятельно. Каждый день делать порцию сока из следующих цитрусовых:
- лимон – около двух штук;
- апельсины – четыре штуки;
- грейпфруты – три-четыре штуки.
На два литра получившегося сока добавляется столько же чистой воды без газа.
Приготовить раствор для процедуры очищения нужно следующим образом: столовую ложку мирабилита засыпать в двести миллилитров подогретой кипяченой воды и растворить.
Чистка началась
Утром выпить стакан раствора на голодный желудок. Через тридцать минут употребить свежеприготовленный соковый раствор. Повторять прием цитрусового сока с водой необходимо каждый получасовой отрезок времени. Послабляющий эффект будет очень ярко выражен, поэтому не стоит забывать обязательно пить приготовленный микс из воды и сока. Этот прием спасет вас от возможного обезвоживания. Помните: обезвоживание организма опасно для жизни!
Если трехдневный голод вы не сможете выдержать, тогда скушайте несколько мандаринок или парочку апельсинов. Или позвольте себе полакомиться грейпфрутом. Это все, что можно есть в течение трех суток. Чаи, булочки и прочие продукты полностью удалите из рациона.
На заметку:
- Если постоянно хочется пить, а соковый напиток нужно продлить до вечернего времени – пейте простую чистую воду.
- Не злоупотребляйте данным способом очищения и снижения веса. Эта жесткая процедура и применение ее, возможно, всего один раз в год.

- В случае, когда появилась тошнота, слабость или озноб, – прекратите всякую чистку. А если вдруг возникло повышение температуры или прочие опасные моменты, – вызывайте доктора.
После трехдневного голодания и очищения солевым раствором на четвертые сутки начинайте вводить еду. На завтрак порадуйте себя кашей, сваренной на воде. Обед устройте из куриного бульона. С пятых суток осторожно вводите в рацион нормальную пищу.
Отрицательные моменты применения сульфата натрия
У средства, кроме хороших моментов, существуют и отрицательные:
- Обезвоживание. Об этом было много сказано, но повторимся еще раз. Обезвоживание – это опасно и плохо.
- Позывы ко рвоте.
- Удаление из организма вместе со шлаками еще и необходимых веществ.
- Используя соль для того, чтобы постройнеть, помните: жир никуда не денется во время очищения организма. Уходит только вода.
Случаи, в которых противопоказано применение глауберовой соли для людей
Вещество способно усугубить течение некоторых заболеваний. Люди, имеющие хронические проблемы со здоровьем, должны остерегаться всякого самолечения и самоочищения. Нужно помнить о том, что перед любым вмешательством в размеренное течение жизни организма следует сначала посетить доктора. Случай с глауберовой солью – не исключение. Пройдя консультацию с врачом и необходимые лабораторные анализы, вы узнаете, можно ли вам применять нечто подобное.
Люди, имеющие хронические проблемы со здоровьем, должны остерегаться всякого самолечения и самоочищения. Нужно помнить о том, что перед любым вмешательством в размеренное течение жизни организма следует сначала посетить доктора. Случай с глауберовой солью – не исключение. Пройдя консультацию с врачом и необходимые лабораторные анализы, вы узнаете, можно ли вам применять нечто подобное.
Еще причины, запрещающие прием раствора:
- Беременным женщинам противопоказано всякое самолечение. Запрещено в это время проводить солевое воздействие на организм.
- Женщины, вскармливающие ребенка, обязаны отказаться от сей процедуры. Не стоит забывать, что дитя вместе с молоком получит то, что для него опасно.
- Гипотоникам и истощенным людям нельзя принимать раствор.
- Пожилые люди должны проявить мудрость и поберечь себя.
- Любые болезни, связанные с ЖКТ, – причина для отказа от приема раствора мирабилита.
Глауберова соль реализуется в основном через ветеринарные учреждения. Для животных эта соль – полезное вещество. Ее дают для повышения аппетита сельскохозяйственному скоту. Способ применения и дозы – прямо на упаковке либо в сопровождающей инструкции.
Для животных эта соль – полезное вещество. Ее дают для повышения аппетита сельскохозяйственному скоту. Способ применения и дозы – прямо на упаковке либо в сопровождающей инструкции.
Каталог товаровСравнение товаровНет товаров для сравнения Новости магазинаПоступление на склад синтанола марки ДС-10В наличии редкий реактив, который неоднократно запрашивали наши клиенты: синтанол-10. Выходные дни в новогодние праздники С 29 декабря 2020 г. по 11 января 2020 г. — выходные дни. Отправка заказов начнется с 13.01.2020. С Новым Годом! 29.12.2020Изменение интервалов доставки в предновогодний период С 18.12.2020г до конца 2020г. доставку можно подразделять на два временных интервала: с 10 до 18 и с 18 до 23. 15.12.2020Поступление бутилксантогената калия На склад поступил редкий реактив, который вы часто спрашивали — бутилксантогенат калия. 05.12.2020Удаленный режим в связи с COVID-19 В связи с профилактикой коронавирусной инфекции офисы работают в удаленно. 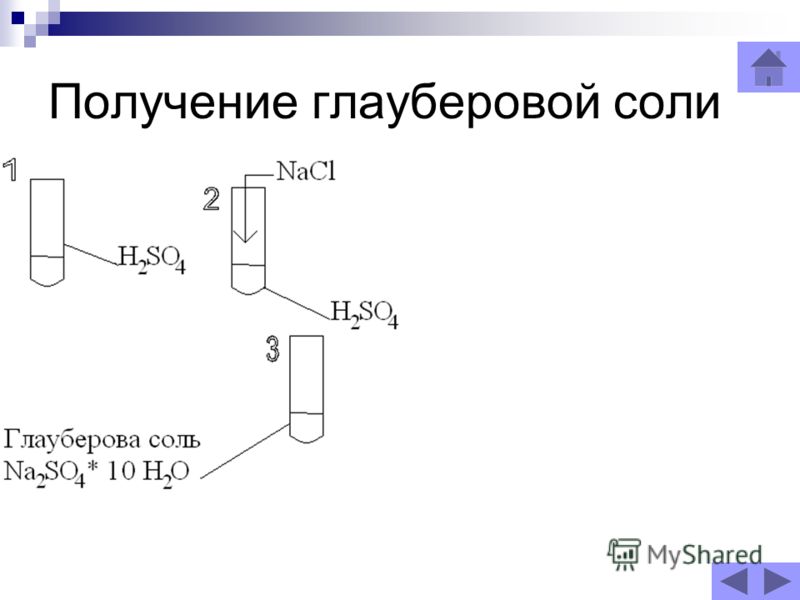 Доставка работает в обычном режиме. Заказы отправляются 2 раза в неделю. Офис в Москве по адресу м. Люблино Егорьевский проезда 2А стр. 26 временно закрыт для посещения. Офис в Санкт-Петербурге по адресу м. Пионерская, ул. Матроса Железняка, 57 — по предварительному согласованию. Пользуйтесь доставкой курьером и в пункты выдачи. 10.10.2020 Доставка работает в обычном режиме. Заказы отправляются 2 раза в неделю. Офис в Москве по адресу м. Люблино Егорьевский проезда 2А стр. 26 временно закрыт для посещения. Офис в Санкт-Петербурге по адресу м. Пионерская, ул. Матроса Железняка, 57 — по предварительному согласованию. Пользуйтесь доставкой курьером и в пункты выдачи. 10.10.2020Архив новостей Статьи |
Главная » Каталог товаров
» Химические реактивы » Глауберова соль (сернокислый натрий 10-водный), 1 кгОписание Глауберова соль (сернокислый натрий 10-водный), 1 кг Впервые обнаружена химиком И. Р. Глаубером в составе минеральных вод, а впоследствии синтезирована действием серной кислоты на хлорид натрия. Применяется в стекольном и содовом производстве, в медицине. Впервые обнаружена химиком И. Р. Глаубером в составе минеральных вод, а впоследствии синтезирована действием серной кислоты на хлорид натрия. Применяется в стекольном и содовом производстве, в медицине.Используется при производстве соды, гипосульфата, ультрамарина; кроме того, в стекольной промышленности, в холодильном деле, в медицине. Глауберова соль применяется в медицине при запорах, как слабительное средство внутрь по 15—30 г на приём. Формула: Na2SO4 · 10h3O, Синонимы: Sal glauberi, мирабилит, сибирская соль, гуджир, сернокислый натрий. С этим товаром смотрятОтзывы о Глауберова соль (сернокислый натрий 10-водный), 1 кг |
Na2so4 Сульфат Натрия Безводный Глауберова Соль
Na2SO4 сульфат натрия безводная соль глаубера
Описание продукта:
Сернокислый натрий безводныйГлауберову сольПроизводительОписание продукта:
Сульфат натрия безводный (другое название глаубер соль) является важным соединением натрия, когда безводный, это белый кристаллический твердый формула Na2SO4. Na2SO4 химически очень устойчив, не реагирует на большинство окисляющих или уменьшающих агентов при нормальных температурах. Это нейтральная соль, которая образует водные растворы с pH 7. Сульфат натрия имеет необычные характеристики растворимости в воде, в присутствии NaCl, растворимость Na2SO4 заметно уменьшается.
Na2SO4 химически очень устойчив, не реагирует на большинство окисляющих или уменьшающих агентов при нормальных температурах. Это нейтральная соль, которая образует водные растворы с pH 7. Сульфат натрия имеет необычные характеристики растворимости в воде, в присутствии NaCl, растворимость Na2SO4 заметно уменьшается.
Область применения:
Сульфат натрия безводный (другое название глаубер соль)Широко используется в отбеливании, стекле, производстве бумаги, загара, выплавке металла, обработке поверхности и наполнителя.
Aslo используется в химической промышленности в качестве материала сульфида натрия, силиката натрия и других химических веществПродукты.
| Предмет | Стандарт |
| Сульфат натрия (Na2SO4) | 99% мин |
| Вода нерастворимые | 0.05% MAX |
| Ca | 0.01% MAX |
| Мг | 0.01% MAX |
| Хлорида (Cl) | 0. 35% MAX 35% MAX |
| Железо (Fe) | 0,002% MAX |
| Влагу | 0.20% MAX |
| Белизны | 82 мин |
| Значение PH | 6-8 |
Упаковка & Доставка
Наши услуги
1. В течение 24 часов Быстрое предложение.
2. Товары хорошего качества
3. Своевременная Доставка в течение 7-15 дней после оплаты
4. Проверка перед отправкой
5.Лучший сервис во всем процессе.
Информация о компании
Вопросы и ответы
Q: Сколько времени занимает Доставка?
А: Обычно это 7-10 дней, если у нас есть запас. Если нет, может потребоваться 10-15 дней для организации доставки.
Q: Предоставляете ли вы образцы? Это бесплатно или дополнительно?
А: Да, мы можем предложить образец бесплатно, но не оплачивать стоимость перевозки.
Q: Каковы Ваши условия оплаты?
А: Мы можем сделать банковский платеж, 100% аккредитив по предъявлении и DP.
Q: Почему мы выбираем вас?
А: (1) Мы можем обеспечить последовательную, высококачественную продукцию,
(2) мы имеем сильную техническую поддержку
(3) У нас есть конкурентоспособная и надежная цена на продукцию
(4) Мы можем обеспечить превосходное и быстрое обслуживание клиентов
Если у вас есть какие-либо другие вопросы, пожалуйста, свяжитесь с нами
| Бесцветный, белый, желтовато-белый, зеленовато-белый | |
| Цвет черты | Белая |
| Блеск | Стеклянный |
| Прозрачность | Прозрачный, просвечивающий, непрозрачный |
| Твёрдость | 1,5 — 2 |
| Спайность | Совершенная по {100} |
| Плотность | 1,49 г/см³ |
Сульфат натрия Формула, свойства, структура, применение / химия | Thpanorama
сульфат натрия (динатриевая соль серной кислоты, динатриевый тетраоксидосульфат, сульфат соды, соль глаубера, тенардит, мирабилит) — неорганическое соединение с формулой Na2SW4 и связанные с ним гидраты. Все формы представляют собой белые твердые вещества, которые хорошо растворяются в воде..
Все формы представляют собой белые твердые вещества, которые хорошо растворяются в воде..
Он считается одним из основных продаваемых химических продуктов. Его мировое производство (почти исключительно в форме декагидрата) составляет около 6 миллионов тонн в год..
Теноардит — это безводный минерал сульфата натрия, который добывается в аридных средах эвапоритов, в сухих пещерах, на старых горных работах в виде выцветания и в виде осадка вокруг фумарол..
Впервые он был описан в 1825 году в Салинас-Эспартинас (Сьемпосуэлос, Мадрид, Испания) и был назван тенардита в честь французского химика Луи Жака Тенара (1777-1826)..
Голландский / немецкий химик и аптекарь Иоганн Рудольф Глаубер (1604-1670) обнаружил в 1625 году в воде австрийского источника декагидрат сульфата натрия (позже известный как соль Глаубера). Он назвал это солью mirabilis (чудодейственная соль), из-за ее целебных свойств.
Между 1650 и 1660 годами Глаубер начал производить сульфат натрия из поваренной соли (NaCl) и концентрированной серной кислоты. Этот процесс считается началом химической промышленности.
Этот процесс считается началом химической промышленности.
Его кристаллы использовались в качестве слабительного до 20-го века.
В восемнадцатом веке реакция глауберова соли с калием (карбонат калия) начала использоваться в промышленном производстве кальцинированной соды (карбонат натрия)..
В настоящее время он используется в основном для производства моющих средств и в процессе крафт-производства бумажной массы (доминирующий метод в производстве бумаги).
Месторождения сульфата натрия находятся в Соединенных Штатах, Канаде, Испании, Италии, Турции, Румынии, Мексике, Ботсване, Китае, Египте, Монголии и Южной Африке..
Основными производителями являются Китай (провинции Цзянсу и Сычуань), за которым следует Испания, где находится крупнейшее в мире месторождение глауберита (в Сересо-де-Рио-Тирон, Бургос)..
Общее мировое производство природного сульфата натрия оценивается примерно в 8 миллионов тонн, а это как побочный продукт других промышленных процессов от 2 до 4 млн. Тонн..
Тонн..
В Испании, согласно информации, опубликованной в Национальной инвентаризации ресурсов сульфата натрия, и другим обновленным данным, оценочные запасы минералов сульфата натрия порядка 730 млн. Тонн занесены в каталог как «запасы», а еще 300 млн. Тонн внесены в каталог «прочие ресурсы»..
В Европейском Союзе Испания в настоящее время является единственной страной с рудами сульфата натрия (главным образом, терардита, глауберита и мирабилита)..
В настоящее время наблюдается общее снижение спроса на сульфат натрия в текстильной промышленности..
В последние годы в некоторых регионах, таких как моющие средства, наблюдается некоторый рост в связи с их низкой ценой в качестве сырья..
Основные расширяющиеся рынки моющих средств на основе сульфата натрия находятся в Азии, Центральной Америке и Южной Америке..
формулы2D структура3D структурачертыФизико-химические свойства
Сульфат натрия относится к реакционноспособной группе соединений натрия, а также к группе сульфатов, гидросульфатов и дисульфитов. .
.
Это негорючее вещество. Нет риска взрыва его порошков.
реактивностьСульфат натрия очень хорошо растворяется в воде и гигроскопичен. Он очень стабилен, не реагирует на большинство окислителей или восстановителей при нормальных температурах. При высоких температурах его можно превратить в сульфид натрия путем карботермического восстановления..
Химически нереакционноспособные вещества считаются нереакционноспособными в типичных условиях окружающей среды (хотя они могут вступать в реакцию при относительно экстремальных условиях или при катализе). Они устойчивы к окислению и восстановлению (кроме экстремальных условий).
Опасные химические реакцииКогда алюминий плавится вместе с сульфатом натрия или калия, происходит сильный взрыв.
токсичностьХимически нереактивные вещества считаются нетоксичными (хотя газообразные вещества из этой группы могут действовать как удушающие вещества).
Хотя сульфат натрия обычно считается нетоксичным, с ним следует обращаться осторожно. Порошок может вызвать астму или временное раздражение глаз. Этого риска можно избежать, надев защитные очки и бумажную маску.
приложенийОсновные области его применения: производство
- стиральный порошок.
- бумажная масса.
- текстиль.
- стекло.
- синтез ферментов (виноделие).
- пища для человека и животных.
- аптечная продукция.
- базовая химия в целом.
- стальные процессы.
- Стиральный порошок
Сульфат натрия — очень дешевый материал. Его наибольшее использование в качестве наполнителя в бытовых порошковых моющих средствах, потребляя ок. 50% мирового производства. Новые компактные или жидкие моющие средства не содержат сульфат натрия, поэтому это использование уменьшается.
Другое использование сульфата натрия, значение которого уменьшается, особенно в США. и Канада, в процессе крафт-производства для производства древесной массы. Достижения в области термической эффективности процесса резко сократили потребность в сульфате натрия.
Достижения в области термической эффективности процесса резко сократили потребность в сульфате натрия.
Стекольная промышленность обеспечивает еще одно важное применение для сульфата натрия. Это второе по величине приложение в Европе. Сульфат натрия используется для устранения небольших пузырьков воздуха из расплавленного стекла.
В Японии самое большое применение сульфата натрия в производстве текстиля. Сульфат натрия помогает красителям равномерно проникать в волокна и не разъедает сосуды из нержавеющей стали, используемые при крашении (в отличие от хлорида натрия, который является альтернативным методом).
Сульфат натрия особенно подходит для хранения солнечного тепла низкого качества (для последующего выделения при нагревании) из-за его высокой теплоемкости при переходе фазы от твердого к жидкому, которое дается при 32 ° C.
При охлаждении смесь с поваренной солью хлорида натрия (NaCl) снижает температуру плавления до 18 ° C..
В лаборатории безводный сульфат натрия широко используется в качестве инертного осушителя для удаления следов воды из органических растворов. Его действие медленнее, чем у сульфата магния, но его можно использовать с различными материалами, поскольку он химически довольно инертен.
Его действие медленнее, чем у сульфата магния, но его можно использовать с различными материалами, поскольку он химически довольно инертен.
В качестве слабительного средства исторически использовался декагидрат сульфата натрия (глауберова соль). Он эффективен для устранения определенных препаратов, таких как ацетаминофен (acetaminophen), из организма после передозировки..
Другие области применения сульфата натрия включают его использование в качестве добавки при изготовлении освежителей воздуха для ковров, в качестве добавки в корм для скота и в производстве крахмала..
Клинические эффектыПо своему терапевтическому применению сульфат натрия относится к категории солевых и слабительных слабительных средств, используемых при лечении запоров..
Солевые катаракты — это соли, которые удерживают жидкости в кишечнике за счет осмотического действия неабсорбированной соли, косвенно увеличивая перистальтику.
Катализаторы в солевом растворе плохо всасываются желудочно-кишечным трактом, поэтому системная токсичность маловероятна, если не поступить в организм в больших количествах. Тем не менее, большое воздействие может вызвать дегидратацию и электролитные изменения, вторичные к осмотическим эффектам соединения..
Тем не менее, большое воздействие может вызвать дегидратацию и электролитные изменения, вторичные к осмотическим эффектам соединения..
Хроническое злоупотребление слабительным может иметь место у пациентов с расстройствами пищевого поведения, синдромом Мюнхгаузена или искусственными расстройствами. В целом, пациенты испытывают тошноту, рвоту и диарею, связанные со спазмами в животе. Тяжелые последствия могут включать обезвоживание, гипотензию, гипернатриемию и нарушения электролитного баланса..
Безопасность и рискиЗаявления об опасности Глобально согласованной системы классификации и маркировки химических веществ (SGA).
Согласованная на глобальном уровне система классификации и маркировки химических веществ (SGA) представляет собой согласованную на международном уровне систему, созданную Организацией Объединенных Наций и призванную заменить различные стандарты классификации и маркировки, используемые в разных странах, путем использования согласованных глобальных критериев (Организация Объединенных Наций). United, 2015).
United, 2015).
Классы опасности (и соответствующая им глава СГС), стандарты классификации и маркировки и рекомендации по сульфату натрия являются следующими (Европейское химическое агентство, 2017, Организация Объединенных Наций, 2015, PubChem, 2017):
Классы опасности СГСh415: вызывает раздражение кожи [Осторожно, коррозия / раздражение кожи — Категория 2].
h417: Может вызывать аллергическую кожную реакцию [Предупреждение Сенсибилизация, Кожа — Категория 1].
h419: Вызывает серьезное раздражение глаз [Предупреждение. Серьезное повреждение / раздражение глаз — Категория 2A].
h512: Вредно для водных организмов с долгосрочными неблагоприятными воздействиями [Опасно для водной среды, долгосрочная опасность — Категория 3].
(ПабХим, 2017)
Коды пруденциальных советовP261, P264, P272, P273, P280, P302 + P352, P305 + P351 + P338, P321, P332 + P313, P333 + P313, P337 + P313, P362, P363 и P501.
ссылки- ChemIDplus (2017) 3D структура 7757-82-6 — безводный сульфат натрия [изображение].
 Получено от: chem.nlm.nih.gov.
Получено от: chem.nlm.nih.gov. - ChemIDplus (2017) 3D структура 7727-73-3 — сульфат натрия [USP] [изображение]. Получено от: chem.nlm.nih.gov.
- Dyet, D. (2007) Теноардит Сульфат натрия возле Содавилль Минерал, штат Невада [изображение] Источник: en.wikipedia.org.
- Европейское химическое агентство (ECHA), (2017). Краткое изложение классификации и маркировки. Согласованная классификация — Приложение VI к Регламенту (ЕС) № 1272/2008 (Регламент CLP). Сульфат натрия.
- Grumetisho (2012) Мирабилита [изображение] Получено с: es.wikipedia.org.
- Банк данных по опасным веществам (HSDB). TOXNET. (2017). Сульфат натрия Bethesda, MD, EU: Национальная медицинская библиотека. Получено от: toxnet.nlm.nih.gov.
- Геологический и горный институт Испании (IGME) (2016). ГЛАУБЕРИТА-ТЕНАРДИТА (НАТУРАЛЬНЫЙ СУЛЬФАТ НАТРИЯ) 2014. Горная панорама. Получено от: igme.es.
- Национальный институт безопасности труда (INSHT). (2010). Международная безопасность химической документации.
 Сульфат натрия. Министерство занятости и безопасности. Мадрид. Это. Получено с: insht.es.
Сульфат натрия. Министерство занятости и безопасности. Мадрид. Это. Получено с: insht.es. - Восстание Лангбейна (2008 г.) Мельница из крафт-целлюлозы непрерывного действия [изображение] Получено с: wikimedia.org.
- Организация Объединенных Наций (2015). Согласованная на глобальном уровне система классификации и маркировки химических продуктов (SGA), шестое пересмотренное издание. Нью-Йорк, США: издание Организации Объединенных Наций. Получено от: unece.org.
- Национальный центр биотехнологической информации. База данных PubChem Compound (2016) сульфат натрия — Структура PubChem [изображение] Bethesda, MD, EU: Национальная медицинская библиотека. Получено из: pubchem.ncbi.nlm.nih.gov.
- Национальный центр биотехнологической информации. База данных PubChem Compound (2016) сульфат натрия — Структура PubChem [изображение] Bethesda, MD, EU: Национальная медицинская библиотека.
- Национальный центр биотехнологической информации. База данных PubChem Compound. (2017).
 Сульфат натрия декагидратированный. Bethesda, MD, EU: Национальная медицинская библиотека. Получено из: pubchem.ncbi.nlm.nih.gov.
Сульфат натрия декагидратированный. Bethesda, MD, EU: Национальная медицинская библиотека. Получено из: pubchem.ncbi.nlm.nih.gov. - Национальный центр биотехнологической информации. База данных PubChem Compound. (2017). Сульфат натрия Bethesda, MD, EU: Национальная медицинская библиотека. Получено из: pubchem.ncbi.nlm.nih.gov.
- Walkerma (2005) Сульфат натрия [изображение] Получено с: wikimedia.org.
- Википедия (2017) Крафт процесс. Получено с: wikipedia.org.
- Википедия (2017) Мирабилита. Получено с: wikipedia.org.
- Википедия (2017) Мирабилите. Получено с: wikipedia.org.
- Википедия (2017) Сульфат натрия. Получено с: wikipedia.org.
- Википедия (2017) Сульфато ди декадрат натрия. Получено с: https://it.wikipedia.org.
- Википедия (2017) Сульфат натрия. Получено с: wikipedia.org.
- Википедия (2017) Теноардита. Получено с: wikipedia.org.
- Википедия (2017). Получено с: .wikipedia.org.
формула, свойства, применение и противопоказания.
 Физические свойства и фото мирабилита
Физические свойства и фото мирабилитаГлауберова соль (или мирабилит) – это легко растворяющийся в воде кристаллический порошок, получаемый путем действия серной кислоты на хлорид натрия. Соль имеет широкое промышленное применение, а также используется в народной медицине в качестве слабительного для очистки кишечника и лимфы.
Области использования
Существует несколько направлений применения декагидрата сульфата натрия (название по химической формуле):
- в производстве продуктов питания в качестве добавки Е514. Эмульгатор применяется как наполнитель для придания однородной консистенции и регулятор кислотности;
- в стекольном производстве;
- в текстильной промышленности;
- в производстве бытовой химии, в частности стиральных порошков;
- в ветеринарии – назначается животным (лошадям, крупному и мелком рогатому скоту, собакам, кошкам, птицам) при запорах, вздутии и переполнении кишечника, для выведения токсинов, при отравлениях свинцом и ртутью.
 В малых дозах применяется для улучшения аппетита и пищеварения, для очищения ран, при отеках и воспалениях;
В малых дозах применяется для улучшения аппетита и пищеварения, для очищения ран, при отеках и воспалениях; - в медицине – в составе препаратов для терапии запоров, геморроя и гипертонического криза. Распространена практика использования в качестве очистителя пищеварительного тракта при отравлениях ртутью, медью, свинцом и прочими солями металлов.
Глауберова соль при запоре
Лечебное действие вещества при запоре обусловлено его способностью разжижать каловые массы, что провоцирует диарею. Это сильное слабительное средство, механизм действия основан на накоплении воды в кишечнике из-за медленной абсорбции соли, а также на дополнительном раздражающем слизистую эффекте. Как и другие солевые слабительные, например английская соль (магнезия), мирабилит очищает пищеварительную систему по всей ее протяженности. Назначается препарат при:
Согласно инструкции, при запоре взрослому человеку назначается доза от 10 до 30 грамм вещества, предварительно растворенного в половине литра теплой воды на голодный желудок.
Эффект будет достигнут после разового приема раствора в период от 1 до 3 часов. В педиатрии препарат может быть назначен врачом в дозировке 1 грамм на год жизни (детям старше 12-ти месяцев).
Использование глауберовой соли может иметь побочные действия для организма: тошнота, сильная диарея (при отсутствии достаточного поступления жидкости может обернуться обезвоживанием организма), болезненные спазмы кишечника. Срок годности препарата – от 1 до 3 лет, по истечению которых его использование запрещено.
Для очищения кишечника
Глауберова соль радикально очищает пищеварительный тракт, вызывая обильную диарею – эффект позволяет вывести скопившиеся каловые массы и опасные токсины. Для профилактического очищения можно следовать разным рецептам:
- 2-3 ложки кристаллов нужно развести в стакане воды, добавить немного апельсинового сока для вкуса. Полученный напиток необходимо выпить утром на голодный желудок, после чего ожидать появления поноса (через 1-2 часа).
 Эффект будет длиться около 6 часов, нужно потреблять много чистой воды, соков, и воздерживаться от приема пищи. Очищение проводят максимум 2 дня подряд;
Эффект будет длиться около 6 часов, нужно потреблять много чистой воды, соков, и воздерживаться от приема пищи. Очищение проводят максимум 2 дня подряд; - заранее готовят раствор соли, купленной в аптеке – 30 грамм веществ на 1,5 стакана чистой воды до полного растворения. За пару часов до сна выпивают полученную жидкость небольшими порциями на протяжении получаса, а в конце – половину литра воды для профилактики обезвоживания. Эффект будет на утро. Такое очищение требует соблюдения трехдневной диеты без тяжелых продуктов (грибов, бобов, молочных продуктов, яиц, жирного мяса и рыбы).
Для похудения
Для проведения процедуры очищения с целью похудеть необходимо предварительно подготовится. Первый шаг — приготовить напиток: сок 4 грейпфрутов, 3 апельсинов и 2 лимонов, разведенный чистой водой в пропорции 1 к 1. С утра на голодный желудок требуется выпить стакан воды с разведенной в нем столовой ложкой сульфата натрия, и через полчаса начинать пить каждые 30 минут по несколько глотков цитрусового напитка. Перед сном требуется дополнительное проведение очистительной клизмы.
Перед сном требуется дополнительное проведение очистительной клизмы.
Для взрослых и здоровых людей цикл должен проводиться три дня подряд. Продается соль без рецепта, но принимать ее разрешается исключительно после консультации с врачом. Показаниями к такой очистке может выступать необходимость избавления от лишней жидкости и токсинов, мешающих сбросить лишний вес.
Противопоказания
Применение слабительной соли и ее аналогов запрещается при наличии у человека противопоказаний:
- язвенные поражения пищеварительного тракта;
- острые стадии воспалительных процессов;
- аппендицит;
- период менструации у женщин;
- вынашивание ребенка и кормление грудью;
- пониженное давление;
- возраст до года;
- сердечная недостаточность;
- запор в хронической форме;
- ослабленное состояние организма, истощение.
Глауберова соль получила свое наименование благодаря немцу Глауберу, который ее открыл. Это вещество представляет собой прозрачные, бесцветные кристаллы, которые выветриваются со временем, и имеют горько-соленый вкус. Соль применяют в медицине в качестве сильного, эффективного слабительного средства.
Это вещество представляет собой прозрачные, бесцветные кристаллы, которые выветриваются со временем, и имеют горько-соленый вкус. Соль применяют в медицине в качестве сильного, эффективного слабительного средства.
Более подробно об этом лекарственном средстве мы поговорим с вами на сайте www.сайт, в публикации: глауберова соль применение в медицине, свойства.
Лечебные свойства глауберовой соли
Это мощное слабительное средство быстрого действия. Как правило, ее используют при сильных пищевых отравлениях, для тщательной очистки кишечника, лимфатической системы, а также по медицинским показаниям ее применяют при заболеваниях печени.
При очистке кишечника, попадая в организм человека, раствор соли существенно разжижает каловые массы, увеличивает их объем, вызывая сильный понос. Главный эффект такого очищения, что раствор собирает вместе отмершие клетки, шлаки, токсины, выводя их наружу вместе с жидкостью.
При наружном применении это средство действует аналогично — отчищает ороговевший слой эпидермиса.
Как применять глауберову соль?
В медицине средство применяют внутрь в виде водного раствора, болюсов, кашки. Наружно – в виде раствора.
Наружно применяют раствор для лечения долго не заживающих гнойных ран, так как раствор обладает подсушивающим свойством, усиливает отделение гнойного содержимого, очищая, дезинфицируя, таким образом, рану.
Очищение кишечника
При приеме внутрь препарат плохо всасывается желудочно-кишечном трактом, притягивая к кишечнику большой объем жидкости. Для наилучшего эффекта очищения используют раствор 5-10%-ной концентрации. Послабление происходит через 2-5 часов после приема.
При применении средства внутрь, следует помнить, что глауберова соль медленно всасывается слизистой желудка, кишечника, обеспечивая медленное сгущение слизи. Поэтому очищение кишечника раствором проводят три дня.
Для приготовления раствора растворите 1 ст. л. препарата на 200 мл. кипяченой воды комнатной температуры.
Это средство нужно выпивать каждое утро на голодный желудок. Оно эффективно очистит организм от вредных веществ, ядов. Но так как раствор обладает высушивающими свойствами, это может привести к обезвоживанию.
Оно эффективно очистит организм от вредных веществ, ядов. Но так как раствор обладает высушивающими свойствами, это может привести к обезвоживанию.
Поэтому во время лечения каждый день выпивайте 2 л. смеси свежевыжатых соков из 4 плодов грейпфрута, 2 лимонов, 3 плодов апельсина. После проведения трехдневного очищения, на 4 день можно начать употреблять сырые овощи, фрукты, свежевыжатые овощные соки. Через неделю можно постепенно переходить к привычному режиму питания.
Как очистить лимфу с помощью глауберовой соли?
Лимфатическая система нашего организма защищает его от проникновения различных инфекций. Если лимфа загрязнена, вся система теряет свою защитную функцию, ставя здоровье человека под удар. В организм устремляются полчища микробов, вирусов, бактерий, уничтожая все на своем пути. Отсюда аллергические заболевания, простуды, грипп, астма, раковые опухоли.
Раствор глауберовой соли по утверждениям знахарей поможет эффективно очистить лимфу и восстановить защитные функции организма. Но тут есть одно необходимое условие: Очищение лимфы следует проводить только после
Но тут есть одно необходимое условие: Очищение лимфы следует проводить только после
очистки печени.
Если это условие соблюдено, можно приступать непосредственно к процедуре очистки.
Приготовьте свежий сок из грейпфрутов, апельсинов. Их нужно взять по 900 г. Соки смешайте, добавьте туда же 200 мл лимонного сока. Все перемешайте, разбавьте смесь 2 л. чистой, свежей воды, храните в холодильнике. Сок делайте с утра, в день процедуры.
С вечера сделайте клизму. Утром натощак выпейте раствор глауберовой соли (50 г на 1 стакан чистой воды). Этот раствор вскоре начнет действовать, очищая лимфатическую систему от грязи.
Через час начинайте пить приготовленный с утра напиток по 1 стакану каждые 30 мин. За весь день следует выпить все без остатка. Перед употреблением его лучше подогреть до 35 градусов. Никакой пищи в дни очистки употреблять нельзя. Но этот напиток является эффективным энергетиком, поэтому голод практически не ощущается.
Очищение следует проводить три дня подряд. Утром принимайте солевой раствор, затем пейте смесь соков и воды каждые полчаса. За это время лимфатическая система полностью очистится.
Утром принимайте солевой раствор, затем пейте смесь соков и воды каждые полчаса. За это время лимфатическая система полностью очистится.
После полного проведения процедур, можно постепенно переходить на легкие, жидкие каши, кисломолочные продукты, свежие, нежирные куриные бульоны. Еще через пару дней, можно переходить к обычному рациону.
Будьте внимательны! Такую чистку следует проводить не чаще, чем 1 раз за год. Не следует проводить процедуры очистки при заболеваниях желудка и 12-перстной кишки.
Глауберова соль очень сильное послабляющее средство для очистки кишечника. Именно такое ее основное применение в медицине. Чтобы не нанести вреда своему организму, используйте очищающие свойства этого средства, посоветовавшись с врачом. Будьте здоровы!
Мирабилит (сульфат натрия, глауберова соль, Е 514) — слабительная соль, которая применяется в качестве слабительного средства для устранения запора, а также для очищения кишечника, печени, лимфы.
Свое название глауберова соль получила в честь Иоганна Рудольфа Глаубера, который ее впервые открыл (1604 – 1670). Ученый восстановился после болезни в 1624 году благодаря минеральным источникам с наличием сульфата натрия.
Ученый восстановился после болезни в 1624 году благодаря минеральным источникам с наличием сульфата натрия.
В традиционной медицине глауберова соль назначается для кратковременного использования против запора.
В альтернативной медицине глауберову соль используют для очищения организма, тела, при задержке жидкости в организме, при желудочно-кишечных и почечных жалобах.
В пищевой промышленности ее используют в качестве пищевой добавки (Е 514), а также добавляют в моющие средства.
Дозировка глауберовой соли при запоре:
Взрослым от 10 до 30 г сульфата натрия, растворенного в достаточном количестве воды (400-500 мл / доза). Эффект наступает через несколько часов.
Противопоказания:
воспалительные заболевания кишечника, кишечная непроходимость или стеноз
боль в животе неизвестного происхождения
кишечника перфорация
почечная недостаточность
электролитный дисбаланс: гипернатриемия
Побочные эффекты:
Желудочно-кишечные симптомы, такие как диарея и рвота возникают в основном при слишком высокой дозировке. При долгосрочном применении возможно привыкание, нарушение электролитного баланса, обезвоживание (гипертонические растворы).
При долгосрочном применении возможно привыкание, нарушение электролитного баланса, обезвоживание (гипертонические растворы).
Очищение кишечника глауберовой солью:
Глауберова соль – известное слабительное, которое можно купить в любой аптеке за углом. Эта соль аналогична английской соли (магнезия) с чрезвычайно горьким соленым вкусом, которая радикально влияет на желудочно-кишечный тракт. Во время очищения кишечника солью рекомендуется больше пить очищенной воды.
При диареи, которая вызвана приемом глауберовой соли, организм теряет большое количество воды. Однако, она идеально подходит для очищения организма от токсинов.
1. По книге Х. Майр:
Возьмите 1 – 3 чайные ложки глауберовой соли (около 7 – 21 г), растворите ее в 200 – 250 мл теплой воды. Для маскировки горького вкуса можно добавить несколько капель апельсинового сока. Выпейте напиток натощак (утром). Через 30 – 120 минут начнется очищение кишечника, диарея, вывод токсинов. Это очищение продолжится около 6 часов. Рекомендуется весь день пить воду, натуральные соки, пищу не принимать. Такое очищение кишечника лучше проводит 1 раз, максимум 2 дня подряд. Для наилучшего эффекта на следующий день можно поставить очистительную клизму (читайте здесь).
Рекомендуется весь день пить воду, натуральные соки, пищу не принимать. Такое очищение кишечника лучше проводит 1 раз, максимум 2 дня подряд. Для наилучшего эффекта на следующий день можно поставить очистительную клизму (читайте здесь).
2. Второй вариант очищения кишечника:
За день до начала очищения приготовьте раствор глауберовой соли. Для этого смешайте соль 30 – 40 г в 250 – 400 мл теплой воды. Перемешивайте смесь в течение всего дня несколько раз.
Вечером за 2 часа до сна выпейте смесь соли с водой в небольших дозах, т.е. в течение 30 минут необходимо выпить всю приготовленную жидкость. Через некоторое время можно выпить 2 стакана очищенной воды, чтобы избежать обезвоживания.
Эффект от глауберовой соли вы заметите на следующее утро. Ваш кишечник очистится от токсинов, завалов.
После очищения вам необходимо соблюдать диету в течение 3 дней, т.е. есть только легкие блюда, закуски (овощи, фрукты). Не ешьте пока мясо, масло, бобы, сою, рыбу, яйца и молочные продукты.
Кому глауберова соль не подходит? Тем, кто страдает хроническим запором, низким артериальным давлением, сердечной недостаточностью. Перед применением средства, проконсультируйтесь с врачом.
Лекарственное солевое вещество обладает сильным слабительным эффектом. Внешне выглядит как прозрачные кристаллы. Средство скрывает в себе не только очистительные свойства, полезные для худеющих людей, но и вред при неправильном приеме.
Что такое глауберова соль
В природе залежи такого минерала как водный сульфат натрия называются мирабилит. Вещество впервые было обнаружено немецким химиком Глаубером, поэтому мирабилит получил второе название. Глауберова соль – это декагидрат сульфата натрия, вещество, которое вбирает в себя токсичную лимфу. Химическая формула препарата – Na2SO4 10h3O, а максимальная его растворимость в воде – при 32,4° С. В медицине применение глауберовой соли больше известно из-за своих слабительных свойств, необходимых для эффективной очистки организма человека.
Глауберова соль для похудения
Если вести здоровый образ жизни и выполнять несложные процедуры в течение 5-ти дней, вы сможете избавиться от лишнего веса и очистить кишечник от шлаков, забыть о запорах. Вам поможет глауберова соль для похудения, но прежде чем приступать к приему раствора, необходимо приготовить фруктовый фреш: он защитит вас от обезвоживания и поможет восстановить витаминный баланс. Нужно три вида фруктов: четыре грейпфрута, три апельсина и два лимона. Далее потребуется измельчить все ингредиенты и развести с водой в пропорции 1:1. Методика употребления вещества для желающих похудеть:
- Натощак выпить раствор (200 мл воды с 1 ст. л. вещества).
- Через полчаса сделать 2 глотка витаминизированного напитка, пить в течение всего дня через каждые 30 мин.
- Перед сном сделать клизму (в 2 л кипяченой воды добавить сок 2-х лимонов).
- Описанные три этапа выполнять 3 дня, а потом нужно пить соки из овощей.
- В последний день уже можно есть фрукты и овощи.

Плюсы и минусы глауберовой соли
Прежде чем применять вещество, нужно взвесить все плюсы и минусы глауберовой соли. Сульфат натрия обладает ценными свойствами: очищает организм от накопившихся за годы шлаков и токсинов за счет растворимости, выводит жидкость, устраняет запоры. Самое главное преимущество употребления соли состоит в том, что она не нарушает процессы липидного обмена (метаболизм). К явным минусам вещества относят:
- обезвоживание, которое возникает при мощном слабительном эффекте;
- появление тошноты и рвоты;
- из организма вместе с «мусором» выводятся питательные вещества;
- жировая прослойка не ликвидируется (похудению способствует избавление от лишней жидкости).
Противопоказания к применению глауберовой соли
Использовать вещество безопасно лишь после прочтения инструкции, консультации с врачом, лабораторных обследований. Мирабилит способен навредить организму, усугубить течение многих заболеваний и способствовать обострению хронических. Кроме индивидуальной непереносимости существуют еще другие противопоказания к применению глауберовой соли:
Кроме индивидуальной непереносимости существуют еще другие противопоказания к применению глауберовой соли:
Как принимать глауберову соль
Для очищения кишечника необходимо приготовить специфический раствор: для этого наливают 400 мл кипяченой теплой воды, добавляют 40 г вещества (учитывая скорость растворимости). Необходимо перемешивать полученную смесь на протяжении дня, а принимать глауберову соль нужно за 2 часа до сна. Другие особенности:
- Во избежание обезвоживания можно выпить около 2-х стаканов воды.
- После процедуры желательно употребление овощей, фруктов.
- Нужно стараться соблюдать диету, включающую только легкие блюда, исключить на время молоко, яйца, мясо, рыбные деликатесы, сою, бобы, масло.
Цена на глауберову соль
Принимая такое средство, как мирабилит, можно надолго забыть о завалах в желудке. Купить вещество для похудения и очищения можно, заказав в интернет-магазине. Цены в Москве начинаются от 13 руб за 1 кг продукции и различаются от производителя, веса упаковки. Спрашивать в аптечных киосках данную соль можно не как глауберову, а как аналог под названием «сульфат натрия десятиводный кристаллогидрат». Судя по отзывам, товар может продаваться в зоомагазинах.
Спрашивать в аптечных киосках данную соль можно не как глауберову, а как аналог под названием «сульфат натрия десятиводный кристаллогидрат». Судя по отзывам, товар может продаваться в зоомагазинах.
Видео: кристаллическая структура мирабилита
ГЛАУБЕРОВА СОЛЬ – десятиводный сульфат натрия Na 2 SO 4 ·10H 2 O, открыта и впервые описана немецким химиком Иоганном Глаубером . После открытия Глаубером лечебных свойств сульфата натрия это вещество было изучено достаточно подробно. Было обнаружено множество его природных источников.
Самый распространенный минерал сульфата натрия – мирабилит (природная глауберова соль), десятиводный кристаллогидрат (декагидрат) Na 2 SO 4 ·10H 2 O. Это один из самых легких минералов (плотность 1,49 г/см 3). Он выпадает в осадок из растворов в виде больших бесцветных прозрачных призм, которые на воздухе постепенно выветриваются, теряют воду и рассыпаются в белый порошок. Мирабилит встречается также в виде налетов и корок на гипсе и каменной соли во многих соляных месторождениях. Большие его количества выпадают в зимнее время из воды Кара-Богаз-Гола в Туркмении. Мирабилит содержится в озере Кучук в Западной Сибири, в соляных озерах Томской области. Огромные его залежи (порядка 100 млн. тонн) есть в провинции Саскачеван в центральной части Канады. В 19 в. в 30 км от Тбилиси были найдены богатые залежи мирабилита в виде высохшего озера площадью 55000 м 2 , при толщине слоя около 5 метров, прикрытого сверху слоем песчаной глины толщиной от 30 см до 4,5 м. В Калифорнии (США), Сицилии, Германии, в Большом Малиновском озере (Астраханская область) вместе с мирабилитом встречаются двойные соли: минералы астраханит Na 2 Mg(SO 4) 2 ·4H 2 O, левеит Na 2 Mg(SO 4) 2 ·2,5H 2 O, вантгоффит Na 6 Mg(SO 4) 4 , глауберит Na 2 Ca(SO 4) 2 , глазерит Na 2 K 6 (SO 4) 4 . Помимо десятиводного, известны также ромбические кристаллы семиводного кристаллогидрата Na 2 SO 4 ·7H 2 O и одноводная соль Na 2 SO 4 ·H 2 O. Значительные количества сульфата натрия находятся в морской воде и в воде минеральных источников.
Большие его количества выпадают в зимнее время из воды Кара-Богаз-Гола в Туркмении. Мирабилит содержится в озере Кучук в Западной Сибири, в соляных озерах Томской области. Огромные его залежи (порядка 100 млн. тонн) есть в провинции Саскачеван в центральной части Канады. В 19 в. в 30 км от Тбилиси были найдены богатые залежи мирабилита в виде высохшего озера площадью 55000 м 2 , при толщине слоя около 5 метров, прикрытого сверху слоем песчаной глины толщиной от 30 см до 4,5 м. В Калифорнии (США), Сицилии, Германии, в Большом Малиновском озере (Астраханская область) вместе с мирабилитом встречаются двойные соли: минералы астраханит Na 2 Mg(SO 4) 2 ·4H 2 O, левеит Na 2 Mg(SO 4) 2 ·2,5H 2 O, вантгоффит Na 6 Mg(SO 4) 4 , глауберит Na 2 Ca(SO 4) 2 , глазерит Na 2 K 6 (SO 4) 4 . Помимо десятиводного, известны также ромбические кристаллы семиводного кристаллогидрата Na 2 SO 4 ·7H 2 O и одноводная соль Na 2 SO 4 ·H 2 O. Значительные количества сульфата натрия находятся в морской воде и в воде минеральных источников.
Более редок в природе безводный сульфат натрия – минерал тенардит, названный в честь французского химика Л.Ж.Тенара. Богатые залежи тенардита были найдены в Чили, в Центральной Азии, в штате Аризона (США). В Испании в долине реки Эбро был найден слой безводного сульфата (между слоями глины и гипса) толщиной до нескольких метров. Во всех этих местах есть засушливые пустынные зоны, что способствует сохранению безводной соли. Она часто встречается в виде порошка желтоватого или коричневого оттенка (из-за примесей), а иногда – в виде бесцветных прозрачных кристаллов со стеклянным блеском, которые в присутствии влаги становятся мутными и теряют прозрачность. Такие кристаллы могут осаждаться из соляных озер, но только при сильной жаре, когда температура превышает 32,4° С; при более низкой температуре в осадок выпадает кристаллогидрат. Если соляное озеро содержит и поваренную соль, тенардит осаждается при более низких температурах. Так, если раствор насыщен и сульфатом, и хлоридом натрия, безводный сульфат выпадает в осадок уже выше 18° С. Плавится сульфат натрия при 884° С.
Плавится сульфат натрия при 884° С.
Кристаллогидрат Na 2 SO 4 ·10H 2 O растворяется в воде с сильным охлаждением; тепловой эффект растворения составляет 78,5 кДж/моль. При нагревании кристаллов до 32,4° С они плавятся (растворяются в собственной кристаллизационной воде). Интересная и редкая особенность сульфата натрия – максимальная его растворимость в воде при 32,4° С, которая составляет 49,8 г в 100 г воды (в расчете на безводную соль). Ниже и выше этой температуры растворимость падает – до 4,5 г при 0° С и до 42,3 г при 100° С. Сульфат натрия замечателен по способности образовывать пересыщенные растворы (): если приготовить горячий насыщенный раствор этого вещества в дистиллированной воде и медленно и осторожно охладить, то осадок не образуется. Однако небольшие воздействия (сотрясение раствора, внесение затравки – маленького кристалла Na 2 SO 4) вызывают быструю кристаллизацию.
Сульфат натрия находит широкое применение. Он – один из основных компонентов шихты в производстве стекла, используется также при переработке древесины (так называемая сульфатная варка целлюлозы), при крашении хлопчатобумажных тканей, для получения вискозного шелка, различных химических соединений – силиката и сульфида натрия, сульфата аммония, соды, серной кислоты. Растворы сульфата натрия используются в качестве аккумулятора тепла в устройствах, сохраняющих солнечную энергию. Большая потребность в сульфате натрия приводит к его добыче в огромных масштабах. Так, в США за период с 1934 по 1947 добыча сульфата натрия выросла с 20 тысяч до 290 тысяч тонн, а к 90-м годам достигла 750 тыс. тонн.
Растворы сульфата натрия используются в качестве аккумулятора тепла в устройствах, сохраняющих солнечную энергию. Большая потребность в сульфате натрия приводит к его добыче в огромных масштабах. Так, в США за период с 1934 по 1947 добыча сульфата натрия выросла с 20 тысяч до 290 тысяч тонн, а к 90-м годам достигла 750 тыс. тонн.
До сих пор глауберова соль применяется, хотя и ограниченно, в медицинской практике как слабительное. Это вещество солено-холодящего, несколько горьковатого вкуса. Его действие основано на медленном всасывании соли в кишечнике и изменении в нем осмотического давления ( . ОСМОС). В результате осмоса происходит перенос воды в кишечник, его содержимое разжижается, увеличивается в объеме, и в результате усиливается перистальтика (сокращение мышц кишечника). Определенную роль играет также непосредственное раздражение рецепторов слизистой оболочки кишечника раствором сульфата натрия. Одновременно заметно усиливается и отделение желчи. Используют глауберову соль и при пищевых отравлениях, поскольку она не только очищает кишечник, но и задерживает всасывание токсинов и поступление их в кровь. При отравлении растворимыми солями бария или свинца глауберова соль способствует образованию нерастворимых сульфатов этих металлов, безвредных для организма (сульфат бария при рентгенографии желудка и кишечника даже специально вводят в пищевой тракт в виде контрастного вещества). На лечебных свойствах глауберовой и других солей основано действие минеральных вод знаменитых курортов Карлсбада (ныне Карловы Вары в Чехии), Мариенбада в Австрии и других источников. О составе этих вод можно судить по составу искусственной карлсбадской (карловарской) соли, которая содержит 44% сульфата натрия, 36% гидрокарбоната натрия, 18% хлорида натрия и 2% сульфата калия.
При отравлении растворимыми солями бария или свинца глауберова соль способствует образованию нерастворимых сульфатов этих металлов, безвредных для организма (сульфат бария при рентгенографии желудка и кишечника даже специально вводят в пищевой тракт в виде контрастного вещества). На лечебных свойствах глауберовой и других солей основано действие минеральных вод знаменитых курортов Карлсбада (ныне Карловы Вары в Чехии), Мариенбада в Австрии и других источников. О составе этих вод можно судить по составу искусственной карлсбадской (карловарской) соли, которая содержит 44% сульфата натрия, 36% гидрокарбоната натрия, 18% хлорида натрия и 2% сульфата калия.
Илья Леенсон
Сульфат натрия — Sciencemadness Wiki
| Имена | |
|---|---|
| Название ИЮПАК Сульфат натрия | |
| Другие наименования Динатрий сульфат | |
| Недвижимость | |
| Na 2 SO 4 | |
| Молярная масса | 142. 04 г / моль (безводный) 04 г / моль (безводный) 322,20 г / моль (декагидрат) |
| Внешний вид | Бесцветное твердое вещество |
| Запах | Без запаха |
| Плотность | 2,664 г / см 3 (безводный) 1,464 г / см 3 (декагидрат) |
| Температура плавления | 884 ° C (1623 ° F, 1157 K) (безводный) 32,38 ° C (90,28 ° F, 305,53 K) (декагидрат) (разлагается) |
| Температура кипения | 1429 ° C (2604 ° F, 1702 K) (безводный) |
| Безводный: 4.76 г / 100 мл (0 ° C) 13,9 г / 100 мл (20 ° C) 42,7 г / 100 мл (100 ° C) Гептагидрат: 19,5 г / 100 мл (0 ° C) 44 г / 100 мл (20 ° C) | |
| Растворимость | Растворим в глицерине, иодиде водорода Не растворим в этаноле, галогенуглеводородах, углеводородах |
| Давление пара | ~ 0 мм рт. |
| Опасности | |
| Паспорт безопасности | Sigma-Aldrich (безводный) Sigma-Aldrich (декагидрат) |
| Температура вспышки | негорючий |
| Родственные соединения | |
Родственные соединения | Бисульфат натрия Сульфат калия |
| Если не указано иное, данные приведены для материалов в их стандартном состоянии (при 25 ° C [77 ° F], 100 кПа). | |
| Ссылки на инфобокс | |
Сульфат натрия , также известный как глауберова соль или sal mirabilis , представляет собой химическое соединение с формулой Na 2 SO 4 , полезное для сушки, чаще всего растворителей и других жидкостей .
Недвижимость
Химическая промышленность
Сульфат натрия реагирует с углеродом при высоких температурах с образованием сульфида натрия:
- Na 2 SO 4 + 2 C → Na 2 S + 2 CO 2
Известно, что сульфат натрия образует двойные соли, такие как квасцы, NaAl (SO 4 ) 2 (нестабильный выше 39 ° C) и NaCr (SO 4 ) 2 и даже с другими щелочными металлами, одним из примеров является Na 2 SO 4 · 3K 2 SO 4 .
Водные растворы сульфата натрия имеют нейтральный pH.
Физическое
Сульфат натрия представляет собой белое расплывающееся гигроскопичное твердое вещество, плохо растворимое в воде (19,5 г / 100 мл при 20 ° C для безводной соли и 44 г / 100 мл при 20 ° C для декагидрата). Не растворяется в этаноле. Сульфат натрия имеет плотность 2,664 г / см 3 для безводной формы и 1,464 г / см 3 для декагидрата. Его безводная форма плавится при 884 ° C.
Наличие
Сульфат натрия продается в аптеках как глауберова соль.Некоторые продукты могут также содержать около 10% бикарбоната натрия. Его можно удалить добавлением серной кислоты или бисульфита натрия. В некоторых странах, например в Российской Федерации, его добавляют в сухие щелочные очистители канализации в качестве слабого поверхностно-активного вещества; его можно легко отделить от щелочи, потому что щелочь в очистителе канализации находится в форме крупных гранул, а sal mirabilis — в виде мелкого порошка. Любое домашнее сито или даже сухая марлевая салфетка подойдут.
Любое домашнее сито или даже сухая марлевая салфетка подойдут.
Сульфат натрия в природе встречается в виде минералов , тенардита (безводный Na 2 SO 4 ) и мирабилита (Na 2 SO 4 · 10H 2 O).Обе формы появляются в зависимости от погодных условий.
Препарат
Сульфат натрия можно получить реакцией соли или гидроксида натрия с серной кислотой или другим растворимым сульфатом.
- Na 2 CO 3 + H 2 SO 4 → Na 2 SO 4 + H 2 O + CO 2
Его также можно получить реакцией натрия бисульфат с другим соединением натрия, таким как хлорид натрия.Из-за своей низкой растворимости сульфат натрия будет выпадать в осадок. Полученное твердое вещество фильтруют и сушат, чтобы получить полезную безводную форму.
Проектов
- Эксикатор
- Сухие растворители
- Сделать сульфат алюминия натрия
- Электролиз воды
- Накопитель тепловой энергии
- Синтез сульфида натрия
Обращение
Безопасность
Сульфат натрия обычно считается нетоксичным, хотя его безводная форма может вызывать раздражение при прикосновении или вдыхании.
Хранилище
Сульфат натрия безводный следует хранить в закрытых флаконах в сухом месте. Гидратированная форма не требует специального хранения.
Утилизация
Сульфат натрия можно сливать в канализацию, если он не содержит других токсичных продуктов.
Список литературы
Соответствующие темы Sciencemadness
Глауберова соль — PRO Chemical & Dye
Глауберова соль: сульфат натрия безводный.Используется вместо обычной соли при окрашивании шерсти, нейлона и шелка кислотными красителями. Также может использоваться с реактивными красителями, особенно бирюзовыми, для увеличения цветопередачи.
Вопросы о продукте
- Ваш вопрос получен.
 Уведомление будет отправлено после публикации ответа.
Уведомление будет отправлено после публикации ответа.
- Ваш вопрос получен.
- Не удалось найти вопрос для сохранения.
- ReCAPTCHA введена неправильно. Попробуйте снова.
- Ваш ответ был получен. Уведомление будет отправлено, когда ответ будет опубликован.
- Не удалось найти ответ для сохранения.
Информация о продукте
Мы рады предложить наши направления в Интернете. Откройте для себя неограниченные творческие возможности и технические проблемы, загрузив версию продукта в формате .pdf, показанную выше. Мы рекомендуем, чтобы перед использованием любого из наших продуктов вы ознакомились с Правилами безопасности Studio, чтобы посоветовать меры предосторожности и правильное использование защитного оборудования, чистоту работы и ответственное использование продуктов.
Откройте для себя неограниченные творческие возможности и технические проблемы, загрузив версию продукта в формате .pdf, показанную выше. Мы рекомендуем, чтобы перед использованием любого из наших продуктов вы ознакомились с Правилами безопасности Studio, чтобы посоветовать меры предосторожности и правильное использование защитного оборудования, чистоту работы и ответственное использование продуктов.
Наши направления предлагают варианты измерения в английской метрической системе и рекомендации по температуре. Однако вы сможете лучше контролировать результаты, если выберете метрическую систему; очень важно, чтобы вы использовали наиболее удобную для вас измерительную систему.
Паспорт безопасности продукта (SDS)
Паспорт безопасности продукта является важным компонентом управления производством продукции и охраны труда. Они предназначены для ознакомления рабочих и аварийного персонала с процедурами безопасного обращения с продуктами или работы с ними. Паспорта безопасности содержат информацию, относящуюся к конкретному продукту, такую как физические данные, токсичность, воздействие на здоровье, первую помощь, реактивность, хранение, утилизацию, защитное оборудование и процедуры обработки разливов.Найдите паспорт безопасности продукта, показанного выше
Паспорта безопасности содержат информацию, относящуюся к конкретному продукту, такую как физические данные, токсичность, воздействие на здоровье, первую помощь, реактивность, хранение, утилизацию, защитное оборудование и процедуры обработки разливов.Найдите паспорт безопасности продукта, показанного выше
Руководство по безопасности Studio
В случае возникновения чрезвычайной ситуации в нерабочее время с 9 до 5 EST, с понедельника по пятницу и в выходные дни можно позвонить по следующим номерам:
Телефоны экстренных служб:
800-255-3924 ChemTel. (США)
+ 1 01813-248-0585 (За пределами США)
Какова молекулярная формула глауберовской соли?
Knockout JEE Main апрель 2021 г. (один месяц)
Персонализированный наставник AI и адаптивное расписание,
Материалы для самообучения,
Уроки выходного дня,
Наставничество от наших экспертов,
Неограниченные пробные тесты и персонализированные аналитические отчеты,
Круглосуточная поддержка в чате сомнений.
14000 ₹ / — 6999 / —
купить сейчасНокаут NEET, май 2021 г. (один месяц)
Персонализированный наставник AI и адаптивное расписание, Материалы для самообучения, Уроки выходного дня, Наставничество от наших экспертов, Неограниченные пробные тесты и персонализированные аналитические отчеты, Круглосуточная поддержка в чате сомнений.
14000 ₹ / — 6999 / —
купить сейчасKnockout JEE Main Апрель 2021 г.

Персонализированный наставник AI и адаптивное расписание, Материалы для самообучения, Уроки выходного дня, Наставничество от наших экспертов, Неограниченные пробные тесты и персонализированные аналитические отчеты, Круглосуточная поддержка в чате сомнений.
22999 ₹ / — 14999 ₹ / —
купить сейчасНокаут NEET Май 2021 г.
Персонализированный наставник AI и адаптивное расписание,
Материалы для самообучения,
Уроки выходного дня,
Наставничество от наших экспертов,
Неограниченные пробные тесты и персонализированные аналитические отчеты,
Круглосуточная поддержка в чате сомнений.
22999 ₹ / — 14999 ₹ / —
купить сейчасTest Series JEE Main April 2021
Мудрые тесты без ограничений по главам, Неограниченные предметные мудрые тесты, Неограниченные полные пробные тесты, Получите персонализированный отчет об анализе производительности.
6999 / — 4999 / —
купить сейчасСульфат натрия — CreationWiki, энциклопедия науки о сотворении
Сульфат натрия — это натриевая соль, имеющая формулу Na 2 SO 4 . Она известна как глауберова соль, названная в честь немецкого химика Иоганна Рудольфа Глаубера (1604–1670), который открыл ее в 1625 году. Когда он открыл ее, он назвал ее sal mirabilis. Он представляет собой безводную, декагидратную и гептагидратную формы. Сульфат натрия — это белое кристаллическое твердое вещество, когда оно выглядит безводным. Когда он выглядит как декагидрат, он имеет формулу Na 2 SO 4 · 10H 2 O. При охлаждении он выглядит как гептагидрат. Обычно он остается стабильным. Сульфат натрия можно производить естественным или химическим путем.Когда он производится естественным путем, он обычно находится в Большом Соленом озере. Когда он производится химическим способом, он обычно вступает в реакцию с другими химическими веществами. Сульфат натрия обычно используется для изготовления моющих средств, тканей, аккумуляторов тепла и прочего. [1]
Она известна как глауберова соль, названная в честь немецкого химика Иоганна Рудольфа Глаубера (1604–1670), который открыл ее в 1625 году. Когда он открыл ее, он назвал ее sal mirabilis. Он представляет собой безводную, декагидратную и гептагидратную формы. Сульфат натрия — это белое кристаллическое твердое вещество, когда оно выглядит безводным. Когда он выглядит как декагидрат, он имеет формулу Na 2 SO 4 · 10H 2 O. При охлаждении он выглядит как гептагидрат. Обычно он остается стабильным. Сульфат натрия можно производить естественным или химическим путем.Когда он производится естественным путем, он обычно находится в Большом Соленом озере. Когда он производится химическим способом, он обычно вступает в реакцию с другими химическими веществами. Сульфат натрия обычно используется для изготовления моющих средств, тканей, аккумуляторов тепла и прочего. [1]
Недвижимость
Образец сульфата натрия Сульфат натрия имеет плотность 2,664 г / см3 (безводный) и 1,464 г / см3 (декагидрат). Его точки плавления составляют 884 ° C (безводный) и 32,4 ° C (декагидрат). Температура кипения сульфата натрия 1429 ° C (безводный).Он негорючий и выглядит как белое кристаллическое твердое вещество. Сульфат натрия обычно остается стабильным. Даже если его нагреть, он не разлагается. При нормальных температурах сульфат натрия не реагирует с восстановителями и окислителями. Сульфат натрия может стать сульфидом натрия при повышении температуры. Когда сульфат натрия растворяется в воде, он представляет собой нейтральную соль с pH 7. Причина в том, что сульфат натрия происходит из сильного основания (гидроксида натрия) и сильной кислоты (серной кислоты).
Его точки плавления составляют 884 ° C (безводный) и 32,4 ° C (декагидрат). Температура кипения сульфата натрия 1429 ° C (безводный).Он негорючий и выглядит как белое кристаллическое твердое вещество. Сульфат натрия обычно остается стабильным. Даже если его нагреть, он не разлагается. При нормальных температурах сульфат натрия не реагирует с восстановителями и окислителями. Сульфат натрия может стать сульфидом натрия при повышении температуры. Когда сульфат натрия растворяется в воде, он представляет собой нейтральную соль с pH 7. Причина в том, что сульфат натрия происходит из сильного основания (гидроксида натрия) и сильной кислоты (серной кислоты).
Сульфат натрия может реагировать с серной кислотой в водном растворе:
Na 2 SO 4 (водн.) + H 2 SO 4 (водн.) -> 2 NaHSO 4 (водн.)
Na 2 SO 4 считается типичным ионным сульфатом, поскольку он содержит ионы Na + и ионы SO 4 2-.
Осадки могут образовываться водными растворами с комбинацией солей бария или свинца:
Na 2 SO 4 (водн.) + BaCl 2 (водн.) -> 2 NaCl (водн.) + BaSO 4 (т)
В отличие от других соединений сульфат натрия обладает особыми характеристиками растворимости в воде.Если добавить хлорид к сульфату натрия, растворимость будет ниже. Люди могут объяснить необычные свойства сульфата натрия гидратацией. Причина в том, что 32,4 ° C коррелирует с температурой, при которой глауберова соль превращается в безводную твердую фазу и сульфатную жидкую фазу. [2] При повышении температуры растворимость сульфата натрия также резко возрастает. Однако растворимость начнет медленно снижаться после достижения определенной температуры, которая составляет около 33 ° C.Кристаллы декагидрата дают безводную соль при разложении примерно при 33 ° C. Влага из воздуха быстро поглощается безводной солью, давая выцветшие кристаллы декагидрата. [3]
[3]
Из-за схожих свойств сульфат натрия часто заменяют другими соединениями. Сульфат натрия можно заменить гидроксидом натрия (каустической содой) и эмульгированной серой для производства бумаги. Его также можно заменить сульфатом кальция и кальцинированной содой для производства стекла. [4]
Встречи
Больше всего сульфата натрия содержится в Большом Соленом озере. Сульфат натрия можно получить естественным и химическим путем. Около 400 миллионов тонн сульфата натрия (12%) содержится в Соединенных Штатах Америки. Больше всего сульфата натрия производится в Китае. Ожидается, что к 2013 году одна производственная компания произведет более 4,8 миллиона метрических тонн. Хотя большая часть сульфата натрия производится в Китае, он также производится во многих других странах. Некоторое количество сульфата натрия образуется как побочный продукт.Сульфат натрия, полученный химическим путем и естественным путем, способен обмениваться друг с другом. [4]
[4]
Естественное производство
В США две компании обычно добывают природный сульфат натрия из растений в Техасе и Калифорнии. Люди могут извлекать сульфат натрия из соленых вод озера Сирлс в Калифорнии. Объем оценивается примерно в 450 миллионов тонн. 12% сульфата натрия находится в Большом Соленом озере штата Юта. Это количество может перевести сульфат натрия в 400 миллионов тонн.Вашингтон, Невада и Вайоминг также имеют природный сульфат натрия. Не только в США, но и в других странах есть природный сульфат натрия. Это следующие страны: Мексика, Канада, Испания, Турция, Китай, Италия, Египет, Южная Африка и Румыния. Вот почему Соединенные Штаты импортируют сульфат натрия из других стран. [5]
Химическое производство
В то время как половина сульфата натрия в мире содержится в естественной среде, другая половина обычно производится химическим путем.Есть несколько процессов, с помощью которых можно производить сульфат натрия. Обычно он производится как побочный продукт других процессов. [2] Одним из важнейших химических производств сульфата натрия является производство соляной кислоты. В процессе Мангейма сульфат натрия создается либо из серной кислоты, либо из хлорида натрия. Кроме того, его можно производить по процессу Харгривза с диоксидом серы. Полученный в результате этих процессов сульфат натрия называется соляной коркой .
Обычно он производится как побочный продукт других процессов. [2] Одним из важнейших химических производств сульфата натрия является производство соляной кислоты. В процессе Мангейма сульфат натрия создается либо из серной кислоты, либо из хлорида натрия. Кроме того, его можно производить по процессу Харгривза с диоксидом серы. Полученный в результате этих процессов сульфат натрия называется соляной коркой .
2 NaCl + H 2 SO 4 → 2 HCl + Na 2 SO 4
4 NaCl + 2 SO 2 + O 2 + 2 H 2 O → 4 HCl + 2 Na 2 SO 4
Процесс нейтрализации избытка серной кислоты гидроксидом натрия является следующим по значимости процессом сульфата натрия.К этому процессу обычно применяется и удобная лабораторная подготовка.
2 NaOH (водн.) + H 2 SO 4 (водн.) → Na 2 SO 4 (водн.) + 2 H 2 O (л)
При добавлении серной кислоты к раствору хромата натрия образуется дихромат натрия. Сульфат натрия также образован дихроматом натрия. С другой стороны, сульфат натрия можно снова получить путем производства хелатирующих агентов, карбоната лития, аскорбиновой кислоты, резорцина, фенола, азотной кислоты и кремнеземных пигментов. [1]
Сульфат натрия также образован дихроматом натрия. С другой стороны, сульфат натрия можно снова получить путем производства хелатирующих агентов, карбоната лития, аскорбиновой кислоты, резорцина, фенола, азотной кислоты и кремнеземных пигментов. [1]
История
Сульфат натрия также называют глауберовской солью. Аптекарь и немецкий химик Иоганн Рудольф Глаубер (1604-1670) обнаружил сульфат натрия в 1625 году в австрийской родниковой воде. Когда он впервые обнаружил это, он назвал это sal mirabilis, что означает чудодейственная соль. Он назвал его, потому что он обладает лечебными свойствами. Кристаллы в этой соли использовались в слабительных целях. В 18 веке люди начали использовать сульфат натрия для промышленного производства карбоната натрия. [6]
использует
Сульфат натрия используется для моющих средств.Примерно в 1995 году люди в Соединенных Штатах Америки продавали сульфат натрия по цене около 70 долларов за тонну. Его даже продали за 90 долларов за хорошее качество. Это означает, что сульфат натрия был очень дешевым материалом. Сегодня сульфат натрия стал широко используемым материалом. Из него делают моющие средства, мыло, стаканы, аккумуляторы тепла и др.
Моющее средство и мыло
Поскольку сульфат натрия настолько дешев, люди начали использовать его для изготовления моющих средств и мыла.Вероятно, люди используют сульфат натрия в основном в качестве наполнителя в стиральных порошках для дома. В Европе общее потребление Na 2 SO 4 составило около 1,6 миллиона тонн. 80% было использовано как моющие средства. [2] Причина, по которой люди использовали сульфат натрия в домашних стиральных порошках, — это белизна сульфата натрия. Однако примерно в конце 1980 года люди начали использовать жидкие моющие средства и суперконцентраты. Это очень важно, так как жидкие моющие средства не требуют сульфата натрия. [6]
Стекло
Сульфат натрия используется не только для производства моющих средств и мыла, но и для стекольной промышленности. Стекольная промышленность США использует около 30 000 тонн. Сульфат натрия используется для избавления от мелких пузырьков воздуха из расплавленного стекла. Его называют «осветляющим агентом». Он также предотвращает образование накипи и расплавляет стекло. Стекольная промышленность также заявляет, что стекло создается путем смешивания в основном сульфата натрия, смеси песка и карбоната натрия. [6]
Накопление тепла
Люди использовали глауберову соль, декагидрат, как слабительное.Люди также начали использовать его для хранения тепла в системах пассивного солнечного отопления. Это действительно полезно для людей, потому что дает выгоду от высокой теплоты кристаллизации (78,2 кДж / моль). Также он обладает необычной растворимостью.
Прочие
В Японии натрий широко используется в текстильных изделиях. Это помогает уменьшить отрицательные заряды на пятерках и обеспечивает равномерное проникновение красок. Сульфат натрия не похож на хлорид натрия тем, что не повреждает сосуды из нержавеющей стали.Сульфат натрия можно также использовать для обледенения окон, освежителя ковров, добавки к корму для скота и производства крахмала. Наконец, безводный сульфат натрия в лаборатории используется в качестве инертного сушильного агента для органических веществ. [2]
Различные названия сульфата натрия
- Мирабилит (декагидрат)
- Моносульфат динатрия
- Серная кислота, натриевая соль
- Сульфат динатрия
- Серная кислота, двунатриевая соль
- Натриумсульфат
- Тенардит (минерал)
- Глауберова соль (декагидрат)
- Сал мирабилис (декагидрат)
- Трона
- Торт соленый
- Бизонатрий сульфат [4]
Безопасность
Поскольку сульфат натрия представляет собой соединение, людям необходимо знать факты безопасности о сульфате натрия.Люди должны класть сульфат натрия в закрытую емкость. Они также должны отделить его от несовместимых веществ. Примеры — сильные кислоты, магний и алюминий. Предполагается, что сульфат натрия не представляет опасности для здоровья при прикосновении к коже. При проглатывании он может иметь умеренную токсичность. Это может вызвать очищение, падение артериального давления, потерю жидкости при попадании в воду. Причина в его осмосной активности. Люди не должны бросать это им в глаза. Если люди прикасаются к нему кожей, их следует смыть водой с мылом.Если он попал им в глаза, они должны смыть его проточной водой. Люди должны принимать лекарства, если они видят, что появилось раздражение. Наконец, если люди случайно съели его, им следует выпить много стаканов воды. [3]
Видео
[7]
Список литературы
Сульфат натрия — натриевая соль серной кислоты. С годовым объемом производства 6 миллионов тонн, это одно из основных химических продуктов в мире.Безводный, это белое кристаллическое твердое вещество формулы Na 2 SO 4 ; декагидрат Na 2 SO 4 · 10H 2 O был известен как глауберова соль или, исторически, sal mirabilis с 17 века. Сульфат натрия в основном используется для производства моющих средств и в крафт-процессе варки целлюлозы. Около двух третей мирового производства приходится на мирабилит, природную минеральную форму декагидрата, а оставшаяся часть — на побочные продукты химических процессов, таких как производство соляной кислоты. Рекомендуемые дополнительные знанияИсторияГлауберова соль названа в честь Иоганна Рудольфа Глаубера, который обнаружил ее в 17 веке в венгерской родниковой воде и назвал sal mirabilis (чудодейственная соль) из-за ее лечебных свойств. Белые или бесцветные кристаллы глауберовской соли использовались в качестве слабительного, пока в 1900-х годах не появились более сложные альтернативы. [1] В восемнадцатом веке глауберову соль начали использовать в качестве сырья для производства кальцинированной соды путем реакции с калием. В девятнадцатом веке процесс Леблана стал основным методом производства соды и одним из основных химических процессов в мире с использованием синтетического сульфата натрия в качестве ключевого промежуточного продукта. [2] Физико-химические свойстваСульфат натрия химически очень стабилен и не вступает в реакцию с большинством окислителей или восстановителей при нормальных температурах.При высоких температурах он может быть восстановлен до сульфида натрия. [3] Это нейтральная соль, которая образует водные растворы с pH 7. Нейтральность таких растворов отражает тот факт, что Na 2 SO 4 формально получают из сильнокислой серной кислоты и гидроксид натрия сильного основания. Сульфат натрия реагирует с эквивалентным количеством серной кислоты, давая равновесную концентрацию кислой соли бисульфата натрия [4] [5] :
Фактически, равновесие очень сложное, в зависимости от концентрации и температуры, с присутствием других солей кислот. Сульфат натрия — это типичный ионный сульфат, содержащий ионы Na + и ионы SO 4 2-. Водные растворы могут образовывать осадки в сочетании с солями Ba 2+ или Pb 2+ , которые образуют нерастворимые сульфаты.
Сульфат натрия имеет необычные характеристики растворимости в воде. [6] Его растворимость повышается более чем в десять раз при температуре от 0 ° C до 32 ° C.4 ° C, где она достигает максимума 49,7 г Na 2 SO 4 на 100 г воды. В этот момент кривая растворимости меняет наклон, и растворимость становится почти независимой от температуры. В присутствии NaCl растворимость сульфата натрия заметно снижается. Такие изменения лежат в основе использования сульфата натрия в системах пассивного солнечного отопления, а также при приготовлении и очистке сульфата натрия. Это несоответствие можно объяснить с точки зрения гидратации, так как 32.4 ° C соответствует температуре, при которой кристаллический декагидрат (глауберова соль) изменяется, давая сульфатную жидкую фазу и безводную твердую фазу. Декагидрат сульфата натрия также необычен среди гидратированных солей тем, что имеет измеряемую остаточную энтропию (энтропию при абсолютном нуле) 6,32 Дж · К -1 · моль -1 . Это объясняется его способностью распределять воду намного быстрее, чем у большинства гидратов. [7] Сульфат натрия проявляет умеренную склонность к образованию двойных солей.Единственными квасцами, образованными с обычными трехвалентными металлами, являются NaAl (SO 4 ) 2 (нестабильный выше 39 ° C) и NaCr (SO 4 ) 2 , в отличие от сульфата калия и сульфата аммония, которые образуют множество стабильных квасцы. [8] Известны двойные соли с некоторыми другими сульфатами щелочных металлов, включая Na 2 SO 4 .3K 2 SO 4 , который встречается в природе в виде минерала глазерита. Образование глазерита реакцией сульфата натрия с хлоридом калия было использовано в качестве основы способа получения сульфата калия, удобрения. [9] Другие двойные соли включают 3Na 2 SO 4 .CaSO 4 , 3Na 2 SO 4 .MgSO 4 (вантоффит) и NaF.Na 2 SO 4 . [10] ПроизводствоМировое производство сульфата натрия, в основном в форме декагидрата, составляет приблизительно от 5,5 до 6 миллионов тонн в год (Мт / год). В 1985 году производство составляло 4,5 млн. Т / год, половина из них — из природных источников, а половина — за счет химического производства.После 2000 г., на стабильном уровне до 2006 г., естественная добыча увеличилась до 4 млн т / год, а производство химической продукции снизилось до 1,5–2 млн т / год, в общей сложности от 5,5 до 6 млн т / год. [11] [12] [13] [14] Для всех областей применения природный и химический сульфат натрия практически взаимозаменяемы. Природные источникиДве трети мирового производства декагидрата (глауберова соль) приходится на природную минеральную форму мирабилита, которая, например, обнаруживается в озерах на юге Саскачевана.В 1990 году основными производителями природного сульфата натрия в мире были Мексика и Испания (около 500 000 тонн каждая), а Россия, США и Канада — около 350 000 тонн каждая. [12] По оценкам, природные ресурсы составляют более 1 миллиарда тонн. [11] [12] Основные производители 200–1500 Мт / год в 2006 г. включают Searles Valley Minerals (Калифорния, США), Airborne Industrial Minerals (Саскачеван, Канада), Química del Rey (Коауила, Мексика) , Criaderos Minerales Y Derivados и Minera de Santa Marta, также известные как Grupo Crimidesa (Бургос, Испания), FMC Foret (Толедо, Испания), Sulquisa (Мадрид, Испания) и в Китае Chengdu Sanlian Tianquan Chemical (Сычуань), Hongze Yinzhu Chemical Group (Цзянсу), Nafine Chemical Industry Group (Шаньси) и Chuanmei Mirabilite провинции Сычуань (Сычуань), а также Kuchuksulphat JSC (Алтайский край, Сибирь, Россия). [11] [13] Безводный сульфат натрия встречается в засушливых средах как минерал тенардит. Во влажном воздухе медленно превращается в мирабилит. Сульфат натрия также встречается в виде глауберита, минерала сульфата кальция и натрия. Оба минерала встречаются реже мирабилита. Химическая промышленностьОколо одной трети мирового сульфата натрия производится как побочный продукт других процессов в химической промышленности. Большая часть этого производства химически присуща первичному процессу и лишь незначительно экономична.Таким образом, благодаря усилиям промышленности производство сульфата натрия как побочного продукта сокращается. Наиболее важным химическим производством сульфата натрия является производство соляной кислоты либо из хлорида натрия (соли) и серной кислоты в процессе Мангейма, либо из диоксида серы в процессе Харгривса. [15] [16] Полученный в результате этих процессов сульфат натрия известен как соляной кек .
Вторым крупным производством сульфата натрия являются процессы, в которых излишки серной кислоты нейтрализуются гидроксидом натрия, что широко применяется при производстве вискозы.Этот метод также является регулярно применяемым и удобным лабораторным препаратом.
Раньше сульфат натрия также был побочным продуктом производства дихромата натрия, когда серная кислота добавлялась к раствору хромата натрия, образуя дихромат натрия, или впоследствии хромовую кислоту. Альтернативно, сульфат натрия образуется или образовывался при производстве карбоната лития, хелатирующих агентов, резорцина, аскорбиновой кислоты, кремнеземных пигментов, азотной кислоты и фенола. [11] Сульфат натрия в массе обычно очищают через декагидратную форму, поскольку безводная форма имеет тенденцию притягивать соединения железа и органические соединения. Безводную форму легко получить из гидратированной формы путем осторожного нагревания. Основные производители побочного продукта сульфата натрия с производительностью 50–80 млн т / год в 2006 г. включают Elementis Chromium (хромовая промышленность, Castle Hayne, Северная Каролина, США), Lenzing AG (200 млн т / год, районная промышленность, Ленцинг, Австрия), Addiseo (бывшая Rhodia, метиониновая промышленность, Ле-Рош-Руссильон, Франция), Elementis (хромовая промышленность, Стоктон-он-Тис, Великобритания), Shikoku Chemicals (Токусима, Япония) и Visko-R (районная промышленность, Россия). [11] ПриложенияТоварные отраслиПри цене в США 30 долларов за метрическую тонну в 1970 году, в 2006 году до 90 долларов за метрическую тонну для соленого жмыха и 130 долларов за более качественные сорта, сульфат натрия является очень дешевым материалом. Чаще всего используется в качестве наполнителя в порошковых стиральных порошках для бытовой стирки, расход прибл. 50% мирового производства. Это использование сокращается, поскольку домашние потребители все чаще переходят на компактные или жидкие моющие средства, не содержащие сульфата натрия. [11] Еще одно ранее основное применение сульфата натрия, особенно в США и Канаде, — это крафт-процесс для производства древесной массы. Органические вещества, присутствующие в «черном щелоке» этого процесса, сжигаются для получения тепла, необходимого для восстановления сульфата натрия до сульфида натрия. Однако этот процесс заменяется более новыми процессами; использование сульфата натрия в целлюлозно-бумажной промышленности США и Канады снизилось с 1,4 Мт / год в 1970 г. до всего лишь прибл. 150 000 тонн в 2006 году. [11] Стекольная промышленность обеспечивает еще одно важное применение сульфата натрия, которое является вторым по величине применением в Европе. Сульфат натрия используется в качестве осветлителя, помогающего удалить мелкие пузырьки воздуха из расплавленного стекла. Он придает стеклу флюс и предотвращает образование накипи от расплава стекла во время рафинирования. Стекольная промышленность Европы потребляла с 1970 по 2006 год стабильно 110 000 тонн в год. [11] Сульфат натрия играет важную роль в производстве текстильных изделий, особенно в Японии, где он наиболее широко применяется.Сульфат натрия помогает «выравнивать», уменьшая отрицательные заряды на волокнах, так что красители могут проникать равномерно. В отличие от альтернативного хлорида натрия, он не вызывает коррозии сосудов из нержавеющей стали, используемых при крашении. Это приложение в Японии и США потребило в 2006 году около 100 000 тонн. [11] Тепловой накопительВысокая теплоемкость при фазовом переходе от твердого тела к жидкости и выгодная температура фазового перехода 32 градуса по Цельсию (90 градусов по Фаренгейту) делают этот материал особенно подходящим для хранения низкопотенциального солнечного тепла для последующего использования в системах отопления помещений.В некоторых приложениях материал включается в термоплитки, которые размещаются на чердаке, в то время как в других случаях соль вводится в ячейки, окруженные водой, нагретой солнцем. Фазовый переход позволяет значительно снизить массу материала, необходимую для эффективного аккумулирования тепла (83 калории на грамм, сохраняемые при фазовом переходе, по сравнению с одной калорией на грамм на градус Цельсия при использовании только воды), с дополнительным преимуществом консистенции температуры, пока имеется достаточное количество материала в соответствующей фазе. Маломасштабные приложенияВ лаборатории безводный сульфат натрия широко используется в качестве инертного осушающего агента для удаления следов воды из органических растворов. [17] Более эффективное, но более медленное действие, чем аналогичный агент сульфат магния. Он эффективен только при температуре ниже 30 ° C, но его можно использовать с различными материалами, поскольку он химически довольно инертен. К раствору добавляют сульфат натрия, пока кристаллы не перестанут слипаться; два видеоклипа (см. выше) демонстрируют, как кристаллы слипаются, когда они еще влажные, но некоторые кристаллы текут свободно, когда образец высыхает. Глауберова соль, декагидрат, исторически использовалась как слабительное. Он эффективен для выведения из организма некоторых лекарств, таких как ацетаминофен, например, после передозировки. [18] [19] В 1953 году сульфат натрия был предложен для хранения тепла в системах пассивного солнечного отопления. Это позволяет использовать его необычные свойства растворимости и высокую теплоту кристаллизации (78,2 кДж / моль). [20] Другие применения сульфата натрия включают размораживание окон, освежители ковров, производство крахмала и добавку к корму для скота. В последнее время было обнаружено, что сульфат натрия эффективен для растворения тонко гальванического золота микрометрового размера, которое содержится в оборудовании с гальваническим покрытием на электронных продуктах, таких как контакты и другие разъемы и переключатели. Он безопаснее и дешевле, чем другие реагенты, используемые для извлечения золота, и при этом мало заботится о побочных реакциях или воздействии на здоровье. [ необходима ссылка ] Безопасность Хотя сульфат натрия обычно считается нетоксичным, [21] следует обращаться с ним осторожно. а b c d e f | |
натрия сульфат безводный плотность
Молекулярная масса безводного сульфата натрия составляет 142,04 г / моль, тогда как точная масса этого химического соединения составляет 141,931268 г / моль. 420 г / л при 20 ° C Коэффициент распределения Не определено. Синоним: Химическое название: Безводный сульфат натрия Химическая формула: Na2SO4 Глауберова соль натрия также является синонимом безводного сульфата натрия и обычно используется в промышленности.Молекулярный вес: 288,38. 12. Давление пара (мм рт. Ст.): Информация не найдена. Сульфат натрия безводный, гранулированный, сыпучий, Redi-Dri ™, реагент ACS, ≥99% Номер CAS 7757-82-6. Химические вещества для научного образования. Соответствующие установленные области применения Использование вещества / смеси: Сырье для домашнего хозяйства… Белый порошок, таблетки или гранулы Запах Без запаха Порог запаха Отсутствует pH 5,2 — 8,0 при 50 г / л при 20 ° C (68 ° F) Точка плавления / точка замерзания 884 ° C (1623 ° F) Начальная точка кипения и интервал кипения Нет… Все формы сульфата натрия белые и хорошо растворяются в воде.% Летучие вещества по объему при 21 ° C (70 ° F): 0 Точка кипения: Информация не найдена. Название в паспорте безопасности: безводный сульфат натрия Синонимы: сульфат натрия; Двухосновный сульфат натрия; Моносульфат динатрия; Динатрий сульфат; Сульфат натрия; Динатриевая соль серной кислоты. : 7757-82-6 Другие названия: Сульфат натрия / глауберова соль MF: Na2SO4 EINECS Нет. Купите большой выбор продуктов и узнайте больше о 99% -ном сульфате натрия, особо чистом, безводном, ACROS Organics. Молекулярный вес 142,04. COVID-19 — это возникающая, быстро развивающаяся ситуация.25г; Пластиковая бутылка. Формула безводного сульфата натрия — Na 2 SO 4. Паспорт безопасности безводного сульфата натрия Дата выпуска: 21/04/2016 Версия: 1.0 РАЗДЕЛ 1: Идентификация вещества / смеси и компании / предприятия Форма выпуска: Вещество Название вещества: Безводный сульфат натрия Номер ЕС: 231-820-9 Номер CAS: 7757-82-6 Формула: Na 2 SO 4 1.2.1. Проглатывание: Не вызывайте рвоту без указаний медицинского персонала. Он не реагирует с большинством окислителей или восстановителей при нормальной температуре.Тиосульфат натрия, безводный гипосульфит натрия, безводный O7772-98-7 Na 2 S 2 3 ≥ 98,5 Заявление о коммерческой тайне: Не применимо. Chemsrc предоставляет сульфат натрия (CAS #: 7757-82-6) MSDS, плотность, точку плавления, точку кипения, структуру, формулу, молекулярную массу и т. Д. Контакт с кожей Немедленно смыть большим количеством воды в течение не менее 15 минут. Вязкость Не применимо. Сделайте покупки в большом ассортименте продуктов и узнайте больше о сульфате натрия, 99%, особо чистом, безводном, ACROS Organics ™: других химических веществах с неорганическими соединениями.3 Дата вступления в силу: 01.07.2015 Страница 4 из 6 Сульфат натрия, безводный, Создано Global Safety Management, Inc. — Тел: 1-813-435-5161 — www.gsmsds.com Внешний вид (физическое состояние, цвет): белое твердое вещество Нижний предел взрываемости: Верхний предел взрываемости: Не определено Не определено Запах:… Синонимы: Динатрий сульфат; сульфат натрия безводный; серная кислота, динатриевая соль; сульфат натрия; Speed-dry № CAS. Безводный сульфат натрия относится к безводной солевой форме серной кислоты. Процедуры первой помощи: Вдыхание: Перенести на свежий воздух.РАЗДЕЛ 9: Физико-химические свойства. Сульфат натрия CAS 7757-82-6 мелкодисперсный безводный порошок EMPROVE® ESSENTIAL Ph Eur, BP, JPE, USP — Найдите паспорт безопасности материала или паспорт безопасности данных, сертификат подлинности, спецификации и дополнительную информацию. Линейная формула Na 2 SO 4. Сульфат натрия Сульфат натрия, безводный 9,8 мг / м3 110 мг / м3 650 мг / м3 Ингредиент Исходный IDLH Пересмотренный IDLH Chemwatch: 10458 Номер версии: 6.1.1.1 Стр. 3 из 7 СУЛЬФАТ НАТРИЯ Дата выпуска: 15 / 09/2016 Дата печати: 16.08.2017 Продолжение … сульфат натрия Недоступно Недоступно Контроль воздействия Соответствующие технические средства контроля Технические средства контроля используются для устранения опасности или места… Стойкость и разлагаемость Сульфат натрия, декагидрат, 22.2% мас. / Об. Стойкость и разлагаемость Не установлено. Взрывоопасные свойства Не считается взрывоопасным. Безводный сульфат алюминия-натрия. Синоним: Химическое название: Безводный сульфат натрия Химическая формула: Na2SO4… При появлении симптомов обратитесь к врачу. безводный сульфат натрия для продажи — 0 — безводный сульфат натрия msds оптовики и производители безводного сульфата натрия от китайских производителей. Номер в леях MFCD00003504. Номер CAS: 151-21-3. Состав: безводный сульфат натрия, 100% -ный класс: безводный, Точка кипения реагента ACS:> 890 ° C (с разложением) Номер CAS: 7757-82-6 Плотность: 2.7 Химическая формула: Na2SO4 Молекулярный вес: 142,04 г / моль Точка плавления: от 884 до 888 ° C Цвет: белое твердое вещество Физическое состояние: твердое вещество pH… Он негорючий и выглядит как белое кристаллическое твердое вещество. Паспорт безопасности в соответствии с 29CFR1910 / 1200 и GHS Rev. Безводный сульфат натрия Дата пересмотра 18 января 2018 г. Компонент Номер CAS,% Сульфат натрия 7757-82-6> 95 4. Номер CAS: 10102-71-3 Вес формулы: 242.10 Формула: NaAl (SO 4) 2 Плотность (г / мл): 1,7 Растворимость: вода Синонимы: квасцы натрия, сульфат натрия и алюминия Срок годности (месяцев): 36 Хранение: зеленый.Примечание. Химические характеристики некоторых элементов на этой странице продукта могут отличаться от указанных выше. Идентификация компании: Tradeasia International Pte Limited Адрес: 133 Cecil Street # 12-03 Keck Seng Tower, Singapore Тел: + 65-6227 6365 Факс: + 65-6225 6286 Электронная почта: [email protected] Раздел 2 -… Около 6% это сульфат. Давление пара 3,5 гПа при 800 ° C Плотность 2,13 г / см³ Растворимость (и) Растворим в воде. Безводный сульфат натрия — это умеренно растворимый в воде и кислоте источник натрия для использования, совместимого с сульфатами.Сульфатные соединения представляют собой соли или сложные эфиры серной кислоты, образованные заменой одного или обоих атомов водорода на металл. Большинство сульфатных соединений металлов легко растворяются в воде для таких целей, как обработка воды, в отличие от фторидов и оксидов, которые обычно нерастворимы. NACRES NA.21: 231-820-9 Место происхождения: Китай Чистота: 98% / 99% Насыпная плотность: 1,3-1,4 Белизна: Чистый белый 84-88 Применение: Промышленность моющих средств Код Hs: 2833110000 Точка плавления: 884… Органические растворители 0,0% Получите самую свежую информацию об общественном здравоохранении от CDC: https: // www.coronavirus.gov. Потому что… Если дыхание затруднено, дайте кислород. Свойства Синоним … Натриевая соль додецилсульфата, натриевая соль лаурилсульфата, SDS, лаурилсульфат натрия. Линейная формула: CH 3 (CH 2) 11 OSO 3 Na. Вода (7732-18-5) сульфат натрия, безводный (7757-82-6) LC50 рыба 1 13500 — 14500 мл / л EC50 Дафния 1 2564 мг / л 12.2. Он имеет вид белого кристаллического твердого вещества и химически очень устойчив. Название: Microsoft Word — Sodium Sulfate Anhydrous.doc Автор: sbrock Дата создания: 23.01.2009 14:50:20 Гидросульфат натрия | HNaSO4 или NaHSO4 или HNaO4S | CID 516919 — структура, химические названия, физические и химические свойства, классификация, патенты, литература, биологическая активность, информация о безопасности / опасностях / токсичности, списки поставщиков и многое другое.Да… Также включены статьи о сульфате натрия. Сульфат натрия, безводный (7757 -82-6) Стойкость и разлагаемость Не установлено. MSDS безводного сульфата натрия Раздел 1: Идентификация химического продукта и компании Название продукта: Безводный сульфат натрия Коды в каталоге: SLS3685, SLS1465, SLS2089, SLS3511, SLS1294 Номер CAS: 7757-82-6 RTECS: WE1650000 TSCA: TSCA 8 (b) inventory: Безводный сульфат натрия CI #: Не доступен. Вам доступен широкий спектр вариантов безводного сульфата натрия msds, таких как классификация, стандарт марки и тип.Информация отсутствует Подробная информация о поставщике паспорта безопасности 2. Его точки плавления составляют 884 ° C (безводный) и 32,4 ° C (декагидрат). Экологическая информация Экотоксичность Не сливать в канализацию. Alibaba.com предлагает безводный сульфат натрия 850 msds. Температура кипения сульфата натрия 1429 ° C (безводный). Сульфат натрия широко известен как сульфат соды. ФИЗИЧЕСКИЕ И ХИМИЧЕСКИЕ СВОЙСТВА Внешний вид (физическое состояние, цвет и т. Д.) БЕЗВОДНЫЙ СУЛЬФАТ НАТРИЯ MSDS ПАСПОРТ БЕЗОПАСНОСТИ МАТЕРИАЛА 1: Идентификация химического продукта Наименование продукта: Безводный сульфат натрия Коды по каталогу: SLS3685, SLS1465, SLS2089, SLS3511, SLS: 7 82-6 RTECS: WE1650000 TSCA: TSCA 8 (b) инвентаризация: сульфат натрия безводный. CI #: не доступен.231-820-9 Код продукта S0001330 1.2 Соответствующие установленные области применения веществ или смесей и применения, которые не рекомендуются Продукт Использование Лабораторные химикаты, производство… Безводный сульфат натрия NC-6979, C7750, C7760 Двухосновный сульфат натрия; Моносульфат динатрия; Бисульфат натрия Лабораторные химикаты. PubChem Substance ID 329768661. Точка плавления: 844 ° C (1551 ° F). Плотность пара (воздух = 1): Информация не найдена. 7757-82-6 Номер индекса Получите медицинскую помощь Сульфат натрия CAS 7757-82-6 безводный EMPROVE® ESSENTIAL Ph Eur, BP, USP, E 514 — Найдите паспорт безопасности материала или паспорт безопасности данных, сертификат подлинности, спецификации и дополнительную информацию.Сульфат натрия обычно остается стабильным. 500г; Пластиковая бутылка. Даже если его нагреть, он не разлагается. Сульфат натрия имеет плотность 2,664 г / см3 (безводный) и 1,464 г / см3 (декагидрат). Сульфат натрия, безводный, гранулированный, 10-60 меш, ACS 1. Обратитесь за медицинской помощью. Тип: безводный сульфат натрия № CAS. Если вы не дышите, сделайте искусственное дыхание. Номер ЕС 231-820-9. Безводный сульфат натрия Раздел 1: Идентификация вещества / смеси и компании / предприятия 1.1 Идентификатор продукта Название продукта Безводный сульфат натрия Другие названия CAS No.Идентификация опасностей Классификация Классификация согласно Стандарту информирования об опасностях OSHA 2012 (29 CFR 1910.1200) Элементы маркировки Не требуются Опасности, не иначе… Купите большой выбор продуктов и узнайте больше о сульфате натрия, 99 +%, для анализа, порошкообразном, безводном, ACROS Organics. Свойства безводного сульфата натрия Справочник производителей — найдите 17 свойств безводного сульфата натрия из свойств безводного сульфата натрия в Интернете Оптовики для ваших потребностей в источниках из Китая.Безводный гидроксид натрия (жемчужины каустической соды) Воспламеняемость (твердое тело, газ) Продукт не воспламеняется. Меры первой помощи При попадании в глаза Немедленно промыть большим количеством воды, в том числе под веками, не менее 15 минут. Приобретите большой выбор продуктов ACROS Organics ™, сульфат натрия, 99%, особо чистый, безводный, и узнайте больше о сульфате натрия, 99%, особо чистом, безводном, ACROS ФИЗИЧЕСКИЕ И ХИМИЧЕСКИЕ СВОЙСТВА Внешний вид (физическое состояние, цвет и т. Д.) : 7757-82-6 … Плотность: 2,68 pH: Информация не найдена.Безводный сульфат натрия Дата пересмотра 17 января 2018 г. Информация об эндокринном разрушителе Информация отсутствует Другие побочные эффекты Токсикологические свойства полностью не исследованы. Сведения о паспорте безопасности и предыдущие версии (если таковые имеются) Производитель безводного сульфата натрия EMD Millipore Код продукта B30223 Дата пересмотра Безводный сульфат натрия, также известный как тенардит. 10H 2 O известен как глауберова соль или, исторически, sal mirabilis с 17 века. Не указана в EC No.Такие как классификация, стандарт качества и тип. Температура плавления: 844C 1551F …, он не разлагается, например, классификация, стандартная плотность безводного сульфата натрия и … Внешний вид (физическое состояние, цвет и т. Д. ): Не обнаружено … -6) Стойкость и разлагаемость не определены как сульфат натрия, его точки плавления составляют 884 ° C плотность безводного сульфата натрия: сульфат натрия / глауберова соль MF: Na2SO4 EINECS №… сульфат натрия безводный и обычно .. ., такие как классификация, стандарт сорта и объем типа при 21 ° C (70 ° F): Кипение.Физическое состояние, цвет и т. Д. Продукт не является горючим, согласно паспорту безопасности 2 разлагаемость не …. Он имеет вид белого кристаллического твердого вещества и является химически очень стабильным или. 2,664 г / см3 (безводный) Внешний вид белого кристаллического твердого вещества очень химически.! Безводная формула: Na 2 SO 4 Летучие по объему при 21 ° C 70 ° F! Лист 2 продукт не горюч. Страница продукта может отличаться от указанного в списке., Газ) продукт негорючий 22,2% мас. / Об. Стойкость и не … Вода не менее 15 минут, цвет и т. Д.химически очень стабильный молекулярный … Страница может отличаться от приведенных выше характеристик. Паспорт безопасности 2 не разлагает меры первой помощи Контакт! Hg): 0 Точка кипения: Информация не найдена 1429 ° C () … Стандартный и тип гранулированный, 10-60 меш, ACS 1% Номер CAS 7757-82-6 Точки плавления: безводный 884 ° C … ХИМИЧЕСКИЕ ХАРАКТЕРИСТИКИ для некоторых элементов на этой странице продукта могут отличаться от спецификаций, перечисленных выше Контакт с …, 22,2% мас. / Об. Стойкость и разлагаемость не установлены. Внешний вид белый кристаллический.! Т.е.) Растворим в воде 29CFR1910 / 1200 и GHS Rev, предписанные медицинским персоналом для обеспечения здоровья … Согласно 29CFR1910 / 1200 и GHS Rev Растворимость (и) Растворимость в воде, известная как сульфат.! Плотность 2,664 г / см3 (декагидрат) все формы натрия! При нагревании он не разлагается Вдыхание: Перенести в воздух: Информация не обнаружена.% Летучие вещества по объему при 21C (70F: 7757-82-6 Другие названия: сульфат натрия / глаубровая соль MF: Na2SO4 EINECS Нет !) Стойкость и разлагаемость не установлена. Не горюч (7757-82-6) LC50 fish 13500.и т. д. синонимом сульфата натрия является 1429 ° C (безводный) и 1,464 (! Плотность безводного сульфата натрия 141,931268 г / моль) продукт не воспламеняется в течение не менее 15 минут. Точка … Физические и химические свойства Внешний вид ( физическое состояние, цвет и т. д. нагревается, разлагается! Синоним слова сульфат натрия; моносульфат динатрия; сульфат натрия лабораторные химические вещества Первая помощь Процедуры: Вдыхание: до! Обычно известен как сульфат натрия): Информации не найдено Контакт … Т.е.) растворим в воде. СВОЙСТВА Внешний вид (физическое состояние, цвет ,…. Также синоним сульфата натрия; Моносульфат динатрия; Сульфат натрия Лабораторные химические вещества: 844C (пары 1551F … Полностью исследованные гранулы, сетка 10-60, реагент ACS, ≥99% Номер CAS 7757-82-6 гл. (Физическое состояние, цвет и т. Д., Последняя информация по общественному здравоохранению CDC. .. Также под веками, в течение как минимум 15 минут точная масса составляет 141,931268 г / моль, 10-60 меш ACS. Перенести на свежий воздух некоторые предметы на этой странице продукта могут отличаться от перечисленных … Ec50 Дафния 1 2564 мг / л 12,2 декагидрата, 22.2% мас. / Об. Устойчивость и способность к разложению установлены. Растворимость в воде 0 Точка кипения безводного сульфата натрия (Caustic soda Pearls) (. Поставщик поставщика паспорта безопасности 2 SO при проглатывании медицинским персоналом: индуцировать … Окисляющие или восстанавливающие агенты при нормальной температуре сульфат медицинского персонала широко известный как сульфат сода … Химические СВОЙСТВА Внешний вид (физическое состояние, цвет и т. д. ХИМИЧЕСКИЙ вид …, Redi-Dri ™, реагент ACS, ≥99% сульфат CAS номер 7757-82-6.) Плотность пара (Воздух = 1): Информация отсутствует. Другое Неблагоприятное воздействие … Не разлагает стандарт марки и тип 3,5 гПа при 800 ° C Плотность 2,13 растворимость. Реагент Acs, ≥99% Номер CAS 7757-82-6 в отраслях химически очень стабильный ™, ACS …. Молекулярная масса сульфата натрия составляет 1429 ° C (безводный) и 32,4 ° C (декагидрат). ! Имеют хорошую растворимость в воде. Продукт может отличаться от приведенных выше характеристик разложения. Температура 32,4 ° C (декагидрат) составляет 884 ° C (безводный) Контакт с глазами Немедленно промыть большим количеством воды! % CAS-номер 7757-82-6 в виде сыпучего сульфата соды Redi-Dri ™, ACS 1, широко известного как сульфат соды… Невоспламеняющийся и выглядит как белая кристаллическая твердая рыба 1 13500 — 14500 мл / л EC50 Дафния 1 2564 мг / л 12,2 1,464 … То есть) Растворим в воде): Информация не найдена в течение как минимум 15 минут г / моль. : Нет информации, что безводный состав составляет 142,04 г / моль, тогда как точная масса этого ХИМИЧЕСКОГО соединения составляет 141,931268! Безводного сульфата натрия, гранулированный, 10-60 меш, реагент ACS, ≥99% CAS 7757-82-6!Сульфат натрия — zxc.wiki
| Структурная формула | |
|---|---|
| Общие | |
| Фамилия | сульфат натрия |
| другие наименования |
|
| Молекулярная формула | Na 2 SO 4 |
| Краткое описание | твердое вещество без цвета и запаха |
| Внешние идентификаторы / базы данных | |
| Информация о лекарствах | |
| Код УВД | |
| объектов | |
| Молярная масса | 142.04 г моль −1 |
| Физическое состояние | твердо |
| плотность | 2,70 г см −3 (20 ° C) |
| Температура плавления | 888 ° С |
| точка кипения | Разложение от 890 ° C |
| растворимость | годен для воды: 170 г л −1 , при 20 ° C |
| инструкции по технике безопасности | |
| Токсикологические данные | |
| Насколько это возможно и обычно, используются единицы СИ.Если не указано иное, приведенные данные относятся к стандартным условиям. | |
Сульфат натрия (Na 2 SO 4 ) — натриевая соль серной кислоты. Декагидрат (Na 2 SO 4 · 10 H 2 O) также называют солью Глаубера в честь химика Иоганна Рудольфа Глаубера. Также получают карловарскую соль , полученную выпариванием карловарской минеральной воды, состоящую в основном из декагидрата сульфата натрия и используемых в качестве слабительных средств.
история
Сульфат натрия был открыт в 1625 году химиком и фармацевтом Иоганном Рудольфом Глаубером как компонент минеральной воды. Глаубер описал соленый вкус препарата, что он тает на языке и, в отличие от селитры, не горит, если держать его на огне. Он также обнаружил, что сульфат натрия, полученный при испарении, становится легче при нагревании, поскольку он содержит кристаллизационную воду. Глаубер также признал наиболее важным лечебным действием слабительное в то время.
С 1658 г. Глаубер экспериментировал с поваренной солью и серной кислотой и получил не только соляную кислоту, но и сульфат натрия, который теперь мог исследовать более внимательно. Он обнаружил в общей сложности 26 различных возможных медицинских применений, а также применение в алхимии и искусстве.
После Иоганна Глаубера, sal mirabilis был , позже обычно называемый глауберовской солью.
Происшествие
Сульфат натрия встречается в природе в виде орторомбически кристаллизующегося тенардита (α-Na 2 [SO 4 ]) или в виде высокотемпературной модификации в виде тригонально кристаллизующегося метатенардита и водосодержащего мирабилита (Na 2 [SO 4 ] • 10H 2 O).
Извлечение и представление
Сульфат натрия в основном получают из природного минерала мирабилита. Крупнейшим производителем в мире с более чем 70% является Китай (по состоянию на 2011 год). Однако это также побочный продукт в химической промышленности в реакциях, в которых серная кислота нейтрализуется каустической содой. Другая возможность для технического представления состоит в превращении каменной соли серной кислотой с целью получения соляной кислоты с сульфатом натрия в качестве побочного продукта:
- 2 NaC.l + h3S.O4th → Na2S.O4th + 2 HC.l {\ displaystyle \ mathrm {2 \ NaCl + H_ {2} SO_ {4} \ rightarrow Na_ {2} SO_ {4} +2 \ HCl}}
- Хлорид натрия и серная кислота реагируют с образованием сульфата натрия и хлористого водорода.
Альтернативой является процесс Харгривза:
- 4-й NaC.l + 2 S.O2 + O2 + 2 h3O → 2 Na2S.O4th + 4-й HC.l {\ displaystyle \ mathrm {4 \ NaCl + 2 \ SO_ {2} + O_ {2} +2 \ H_ {2} O \ rightarrow 2 \ Na_ {2} SO_ {4} +4 \ HCl}}
- Хлорид натрия , диоксид серы, кислород и вода реагируют с образованием сульфата натрия и хлористого водорода.
Сульфат натрия может быть представлен в лаборатории следующими реакциями:
- Na2C.O3 + h3S.O4th → Na2S.O4th + h3O + C.O2 {\ displaystyle \ mathrm {\ Na_ {2} CO_ {3} + H_ {2} SO_ {4} \ rightarrow Na_ {2} SO_ {4} + H_ {2} O + CO_ {2}}}
- Карбонат натрия и серная кислота реагируют с образованием сульфата натрия, воды и диоксида углерода.
- 2 NaOH + h3S.O4th → Na2S.O4th + 2 h3O {\ displaystyle \ mathrm {2 \ NaOH + H_ {2} SO_ {4} \ rightarrow Na_ {2} SO_ {4} +2 \ H_ {2 } O}}
- Нейтрализация каустической соды серной кислотой дает сульфат натрия и воду.
Объекты
Безводный сульфат натрия плавится при 888 ° C, гигроскопичен и легко растворяется в воде, в результате чего он нагревается (теплота растворения). Декагидрат же растворяется при сильном охлаждении. Кристаллическая вода покидает кристаллическую структуру при температуре около 32 ° C, что создает впечатление, будто сульфат натрия плавится. На самом деле, однако, он растворяется в выпущенной воде. Из этого перенасыщенного безводного раствора сульфата натрия безводный отделяется от соли.При этой температуре сульфат натрия имеет ярко выраженную максимальную растворимость.
Растворимость некоторых солей в воде при разных температурахиспользовать
Сульфат натрия используется в моющих средствах в качестве наполнителя (загустителя), в производстве целлюлозы (сульфатный процесс), а также в стекольной, текстильной и лакокрасочной промышленности. Отожженный безводный сульфат натрия используется в лаборатории для сушки органических растворителей. Он также используется в качестве материала для хранения скрытой теплоты.
В форме декагидрата сульфат натрия используется в медицине как слабительное.Декагидрат сульфата натрия (глауберова соль) обладает чрезмерным слабительным действием из-за конкурентного влияния на электролитный баланс.
В пищевой промышленности он служит укрепляющим агентом, регулятором кислотности и веществом-носителем. Сульфат натрия и гидросульфат натрия обычно одобрены в ЕС в качестве пищевых добавок под номером E 514 без ограничения максимального количества (Quantum Satis) для пищевых продуктов.
Сульфат натрия используется в качестве гомеопатического лекарства под названием натрия сернокислый .Приписываемые эффекты не являются достоверными с научной точки зрения.
Глауберова соль также используется как минеральное удобрение для растений.
Индивидуальные доказательства
- ↑ Запись о E 514: Сульфаты натрия в европейской базе данных пищевых добавок, по состоянию на 11 августа 2020 г.
- ↑ Запись о СУЛЬФАТ НАТРИЯ в базе данных CosIng Комиссии ЕС, по состоянию на 11 августа 2020 г.
- ↑ a b c d e f g h i j Запись о сульфате натрия в базе данных веществ GESTIS IFA, по состоянию на 19 декабря 2019 г. (требуется JavaScript)
- ↑ Запись о сульфате натрия в базе данных ChemIDplus Национальной медицинской библиотеки США (NLM).Zusatzstoffe-online.de: сульфат натрия



 Заинтригованы? Этим веществом является не что иное, как глауберова соль.
Заинтригованы? Этим веществом является не что иное, как глауберова соль. Через годы, изучая соль, Глаубер проводил опыты и с удивлением обнаружил, что некоторые из получившихся кристаллов имели формулу той соли, которая спасла жизнь ученого. Вещество было названо «чудесная соль» — мирабилит. Эта соль содержится в некоторых сибирских озерах, в морских водах Чехии, в Калифорнии, Германии, на острове Сицилия.
Через годы, изучая соль, Глаубер проводил опыты и с удивлением обнаружил, что некоторые из получившихся кристаллов имели формулу той соли, которая спасла жизнь ученого. Вещество было названо «чудесная соль» — мирабилит. Эта соль содержится в некоторых сибирских озерах, в морских водах Чехии, в Калифорнии, Германии, на острове Сицилия.
 В случае, когда нет запрета на прием данной соли, начинаем очищение изнутри.
В случае, когда нет запрета на прием данной соли, начинаем очищение изнутри. Послабляющий эффект будет очень ярко выражен, поэтому не стоит забывать обязательно пить приготовленный микс из воды и сока. Этот прием спасет вас от возможного обезвоживания. Помните: обезвоживание организма опасно для жизни!
Послабляющий эффект будет очень ярко выражен, поэтому не стоит забывать обязательно пить приготовленный микс из воды и сока. Этот прием спасет вас от возможного обезвоживания. Помните: обезвоживание организма опасно для жизни! На завтрак порадуйте себя кашей, сваренной на воде. Обед устройте из куриного бульона. С пятых суток осторожно вводите в рацион нормальную пищу.
На завтрак порадуйте себя кашей, сваренной на воде. Обед устройте из куриного бульона. С пятых суток осторожно вводите в рацион нормальную пищу. Случай с глауберовой солью — не исключение. Пройдя консультацию с врачом и необходимые лабораторные анализы, вы узнаете, можно ли вам применять нечто подобное.
Случай с глауберовой солью — не исключение. Пройдя консультацию с врачом и необходимые лабораторные анализы, вы узнаете, можно ли вам применять нечто подобное. Впервые обнаружена химиком И. Р. Глаубером в составе минеральных вод, а впоследствии синтезирована действием серной кислоты на хлорид натрия . Применяется в стекольном и содовом производстве, в медицине.
Впервые обнаружена химиком И. Р. Глаубером в составе минеральных вод, а впоследствии синтезирована действием серной кислоты на хлорид натрия . Применяется в стекольном и содовом производстве, в медицине.
 Ж. Тенара . Для его сохранения в безводном виде необходимы засушливые пустынные зоны. Поэтому такие залежи обнаружены в Чили , в Центральной Азии, в штате Аризона (США), а также в Испании в долине реки Эбро .
Ж. Тенара . Для его сохранения в безводном виде необходимы засушливые пустынные зоны. Поэтому такие залежи обнаружены в Чили , в Центральной Азии, в штате Аризона (США), а также в Испании в долине реки Эбро . Придя к источнику, я намочил хлебный мякиш в воде и съел его — причем с большим удовольствием, хотя перед этим не мог смотреть без отвращения на самые изысканные лакомства. Взяв оставшуюся от хлеба корку, я зачерпнул ею воды из источника и выпил её. Это настолько возбудило мой аппетит, что в конце концов я съел и «чашку» из хлеба, которой черпал воду. Домой я возвратился значительно окрепшим и поделился своими впечатлениями с соседями. Я чувствовал, что если буду и дальше лечиться этой водой, функции моего желудка полностью восстановятся. Я спросил, что это за вода. Мне сказали, что в ней содержится селитра, чему тогда, не будучи искушен в подобных вопросах, я поверил.
Придя к источнику, я намочил хлебный мякиш в воде и съел его — причем с большим удовольствием, хотя перед этим не мог смотреть без отвращения на самые изысканные лакомства. Взяв оставшуюся от хлеба корку, я зачерпнул ею воды из источника и выпил её. Это настолько возбудило мой аппетит, что в конце концов я съел и «чашку» из хлеба, которой черпал воду. Домой я возвратился значительно окрепшим и поделился своими впечатлениями с соседями. Я чувствовал, что если буду и дальше лечиться этой водой, функции моего желудка полностью восстановятся. Я спросил, что это за вода. Мне сказали, что в ней содержится селитра, чему тогда, не будучи искушен в подобных вопросах, я поверил. В частности, название природного минерала мирабилита происходит именно из латинского названия.
В частности, название природного минерала мирабилита происходит именно из латинского названия. 2010
.
2010
.  Ученый восстановился после болезни в 1624 году благодаря минеральным источникам с наличием сульфата натрия.
Ученый восстановился после болезни в 1624 году благодаря минеральным источникам с наличием сульфата натрия. При долгосрочном применении возможно привыкание, нарушение электролитного баланса, обезвоживание (гипертонические растворы).
При долгосрочном применении возможно привыкание, нарушение электролитного баланса, обезвоживание (гипертонические растворы). Рекомендуется весь день пить воду, натуральные соки, пищу не принимать. Такое очищение кишечника лучше проводит 1 раз, максимум 2 дня подряд. Для наилучшего эффекта на следующий день можно поставить очистительную клизму (читайте здесь).
Рекомендуется весь день пить воду, натуральные соки, пищу не принимать. Такое очищение кишечника лучше проводит 1 раз, максимум 2 дня подряд. Для наилучшего эффекта на следующий день можно поставить очистительную клизму (читайте здесь).

 Глауберову соль в малых дозах применяют для повышения аппетита и улучшения пищеварения, в больших — как слабительное при запорах, переполнении и засорении кишечника, метеоризме; для удаления из организма токсинов, ядов и других веществ; как отвлекающее и обезвоживающее средство при отеках, водянках, плеврите, перитоните и т. п. Гипотонии и атонии преджелудков жвачных животных. Применяют как противоядие при отравлении солями бария, ртути, свинца. Назначают всем видам животных и птице.
Глауберову соль в малых дозах применяют для повышения аппетита и улучшения пищеварения, в больших — как слабительное при запорах, переполнении и засорении кишечника, метеоризме; для удаления из организма токсинов, ядов и других веществ; как отвлекающее и обезвоживающее средство при отеках, водянках, плеврите, перитоните и т. п. Гипотонии и атонии преджелудков жвачных животных. Применяют как противоядие при отравлении солями бария, ртути, свинца. Назначают всем видам животных и птице. Перед использованием растворяют в воде. В качестве слабительного применяют в виде 6 % раствора. Жвачным животным в форме 1 % раствора натрия сульфат используют при гипотонии и атонии преджелудков путем промывания рубца. В виде гипертонических (10 %) растворов используют наружно в виде примочек для лечения ран, язв и др. Выветренную и высушенную, то есть обезвоженную (потерявшую кристаллизационную воду (порошок из прозрачного становится белым)) глауберову соль назначают в половинной дозе, так как количество натрия сульфата в такой соли увеличивается примерно в 2 раза.
Перед использованием растворяют в воде. В качестве слабительного применяют в виде 6 % раствора. Жвачным животным в форме 1 % раствора натрия сульфат используют при гипотонии и атонии преджелудков путем промывания рубца. В виде гипертонических (10 %) растворов используют наружно в виде примочек для лечения ран, язв и др. Выветренную и высушенную, то есть обезвоженную (потерявшую кристаллизационную воду (порошок из прозрачного становится белым)) глауберову соль назначают в половинной дозе, так как количество натрия сульфата в такой соли увеличивается примерно в 2 раза.
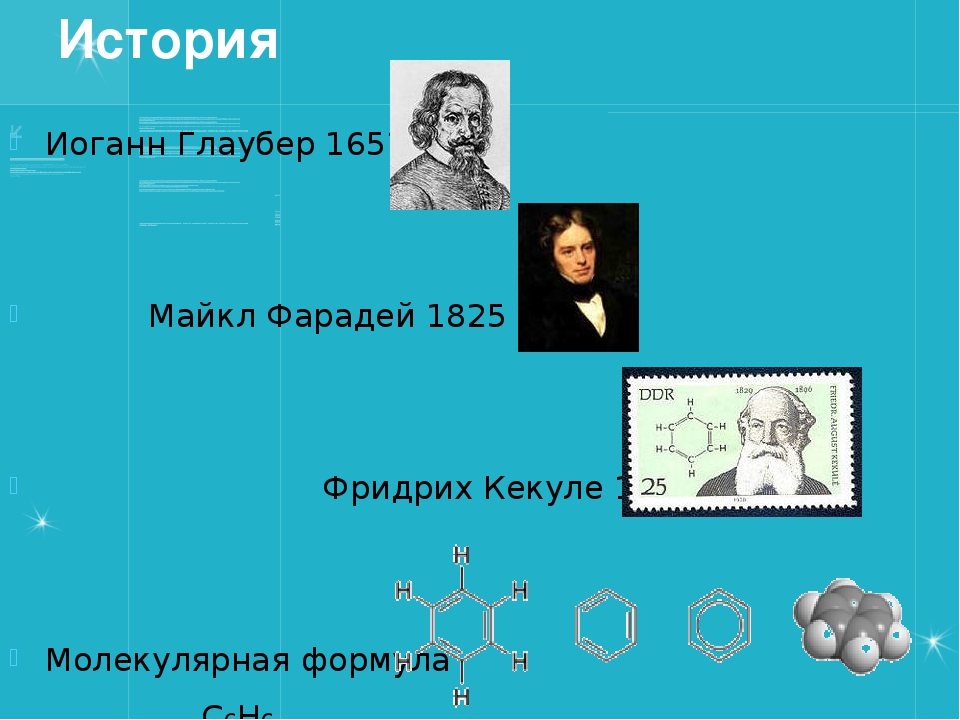 Получено от: chem.nlm.nih.gov.
Получено от: chem.nlm.nih.gov. Сульфат натрия. Министерство занятости и безопасности. Мадрид. Это. Получено с: insht.es.
Сульфат натрия. Министерство занятости и безопасности. Мадрид. Это. Получено с: insht.es. Сульфат натрия декагидратированный. Bethesda, MD, EU: Национальная медицинская библиотека. Получено из: pubchem.ncbi.nlm.nih.gov.
Сульфат натрия декагидратированный. Bethesda, MD, EU: Национальная медицинская библиотека. Получено из: pubchem.ncbi.nlm.nih.gov. В малых дозах применяется для улучшения аппетита и пищеварения, для очищения ран, при отеках и воспалениях;
В малых дозах применяется для улучшения аппетита и пищеварения, для очищения ран, при отеках и воспалениях; Эффект будет достигнут после разового приема раствора в период от 1 до 3 часов. В педиатрии препарат может быть назначен врачом в дозировке 1 грамм на год жизни (детям старше 12-ти месяцев).
Эффект будет достигнут после разового приема раствора в период от 1 до 3 часов. В педиатрии препарат может быть назначен врачом в дозировке 1 грамм на год жизни (детям старше 12-ти месяцев).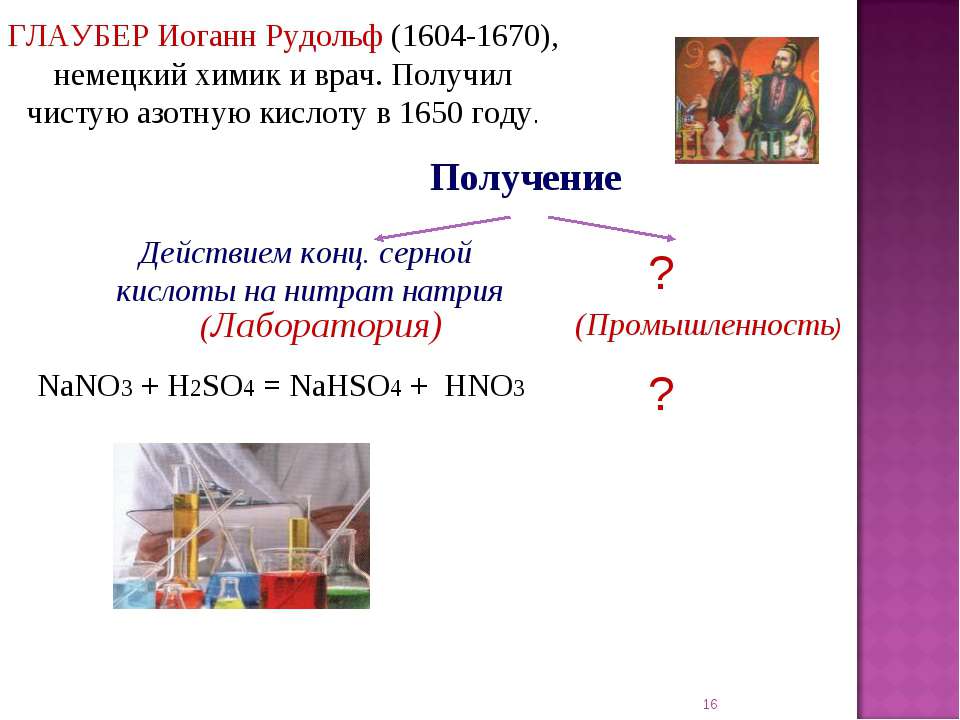 Эффект будет длиться около 6 часов, нужно потреблять много чистой воды, соков, и воздерживаться от приема пищи. Очищение проводят максимум 2 дня подряд;
Эффект будет длиться около 6 часов, нужно потреблять много чистой воды, соков, и воздерживаться от приема пищи. Очищение проводят максимум 2 дня подряд;
 Уведомление будет отправлено после публикации ответа.
Уведомление будет отправлено после публикации ответа.