Википедия лимфатическая система: Лимфатическая система — это… Что такое Лимфатическая система?
ЛИМФАТИЧЕСКАЯ СИСТЕМА — это… Что такое ЛИМФАТИЧЕСКАЯ СИСТЕМА?
- ЛИМФАТИЧЕСКАЯ СИСТЕМА
ЛИМФАТИЧЕСКАЯ СИСТЕМА, система соединения сосудов и органов у позвоночных, функция которой состоит в распространении ЛИМФЫ по организму. Лимфа попадает в маленькие тонкие лимфатические капилляры, а оттуда — в лимфатические сосуды, которые, соединяясь, образуют более крупные ЛИМФАТИЧЕСКИЕ УЗЛЫ. В лимфатических узлах скапливается лимфа и определенный запас ЛЕЙКОЦИТОВ (белых кровяных телец). Лимфатические узлы, в свою очередь, переходят в крупные сосуды, связанные с лимфатическими каналами, выходящими непосредственно в СИСТЕМУ КРОВООБРАЩЕНИЯ. Лимфатическая система напрямую связана с иммунной системой организма. В лимфатических узлах МАКРОФАГИ (крупные лейкоциты) попадают в сеть волокон и отторгают, выводя из лимфы, чужеродные частицы, включая бактерии. Лимфоциты также попадают в кровь из лимфатических узлов.

Научно-технический энциклопедический словарь.
- ЛИМФА
- ЛИМФАТИЧЕСКИЙ УЗЕЛ
Смотреть что такое «ЛИМФАТИЧЕСКАЯ СИСТЕМА» в других словарях:
ЛИМФАТИЧЕСКАЯ СИСТЕМА — (ЖЕЛЕЗЫ, СОСУДЫ), система щелей, каналов, сосудов и специальных образований (лимфатич. желез) по ходу их, отводящих из тканей т. н. лимфу (см.). Понятие Л. с. включает в себя также нек рые образования из аденоидной ткани (см.). Сюда принадлежат… … Большая медицинская энциклопедия
Лимфатическая система — человека Лимфатическая система (лат. systema lymphaticum) часть сосудистой системы у позвоночных животных и человека, дополняющая сердечно сосудистую систему.
Она играет важную роль в обмене веществ и очищении клеток и тканей организма … Википедия
ЛИМФАТИЧЕСКАЯ СИСТЕМА — представляет совокупность мелких сосудов, расходящихся почти по всем тканям тела, имея своим назначением вводить в кровь лимфу и пищевой сок. Словарь иностранных слов, вошедших в состав русского языка. Чудинов А.Н., 1910. ЛИМФАТИЧЕСКАЯ СИСТЕМА… … Словарь иностранных слов русского языка
Лимфатическая система — является частью сердечно сосудистой системы и дополняет венозную, принимает участие в обмене веществ, очищает клетки и ткани. Она состоит из лимфоносных путей, выполняющих транспортные функции, и органов иммунной системы, выполняющих функции… … Атлас анатомии человека
ЛИМФАТИЧЕСКАЯ СИСТЕМА — (systema lymphaticum), у позвоночных совокупность сосудов, собирающих лимфу из тканей и органов и отводящих её в венозную систему. Из межклеточных пространств лимфа насасывается слепыми окончаниями лимфатич.

лимфатическая система — защитная система организма. ♥ лимфа. лимфатический. миндалина. хилус. ликвор … Идеографический словарь русского языка
ЛИМФАТИЧЕСКАЯ СИСТЕМА — ЛИМФАТИЧЕСКАЯ СИСТЕМА, совокупность специализированных капилляров и сосудов, участвующих в проведении лимфы от тканей и органов в венозную систему у позвоночных животных и человека. По ходу крупных сосудов располагаются лимфатические узлы (у… … Современная энциклопедия
ЛИМФАТИЧЕСКАЯ СИСТЕМА — совокупность сосудов, узлов и лимфоидной ткани у позвоночных животных и человека. Основные функции проведение лимфы и защита организма … Большой Энциклопедический словарь
лимфатическая система — — [http://www.eionet.europa.eu/gemet/alphabetic?langcode=en] EN lymphatic system A system of vessels and nodes conveying lymph in the vertebrate body, beginning with capillaries in tissue spaces and eventually forming the thoracic ducts… … Справочник технического переводчика
Лимфатическая система — совокупность капилляров и др.
 сосудов, собирающих лимфу (См. Лимфа) из тканей и органов и отводящих её в венозную систему у позвоночных животных и человека; в Л. с. входят и Лимфатические узлы («железы»), расположенные по ходу сосудов. Л … Большая советская энциклопедия
сосудов, собирающих лимфу (См. Лимфа) из тканей и органов и отводящих её в венозную систему у позвоночных животных и человека; в Л. с. входят и Лимфатические узлы («железы»), расположенные по ходу сосудов. Л … Большая советская энциклопедия
Книги
- Анатомия человека. Фотографический атлас. Учебное пособие. В 3 томах. Том 2. Сердечно-сосудистая система. Лимфатическая система, Э. И. Борзяк, Г. фон Хагенс, И. Н. Путалова. В предлагаемом атласе не красочные схемы и рисунки строения тела человека, в основном далекие от действительности, а фотографии натуральных анатомических препаратов, демонстрирующие истинные… Подробнее Купить за 3265 грн (только Украина)
- Анатомия человека. Фотографический атлас. Учебное пособие. В 3 томах. Том 2. Сердечно-сосудистая система. Лимфатическая система, Э. И. Борзяк, Г. фон Хагенс, И. Н. Путалова. В предлагаемом атласе не красочные схемы и рисунки строения тела человека, в основном далекие от действительности, а фотографии натуральных анатомических препаратов, демонстрирующие истинные… Подробнее Купить за 3157 руб
- Анатомия человека.
 Фотографический атлас. Учебное пособие. В 3 томах. Том 2. Сердечно-сосудистая система. Лимфатическая система, Борзяк Эдуард Иванович, Гунтер фон Хагенс, Путалова Ирина Николаевна. В предлагаемом атласе не красочные схемы и рисунки строения тела человека, в основном далекие от действительности, а фотографии натуральных анатомических препаратов, демонстрирующие истинные… Подробнее Купить за 2815 грн (только Украина)
Фотографический атлас. Учебное пособие. В 3 томах. Том 2. Сердечно-сосудистая система. Лимфатическая система, Борзяк Эдуард Иванович, Гунтер фон Хагенс, Путалова Ирина Николаевна. В предлагаемом атласе не красочные схемы и рисунки строения тела человека, в основном далекие от действительности, а фотографии натуральных анатомических препаратов, демонстрирующие истинные… Подробнее Купить за 2815 грн (только Украина)
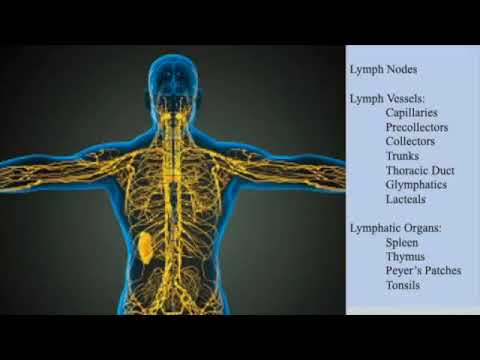
Строение лимфатической системы
Лимфатическая система состоит из лимфатических сосудов, лимфатических узлов и органов – селезёнки и вилочковой железы.
В лимфатических сосудах циркулирует жидкость — лимфа, которая транспортирует клетки, белки, питательные вещества и конечные продукты метаболизма от тканей к крупным венам.
Лимфатические сосуды сливаются в лимфатические узлы. Лимфатические узлы содержат большое количество лимфоцитов и действуют подобно фильтрам, задерживая возбудителей инфекции, например, бактерии и вирусы.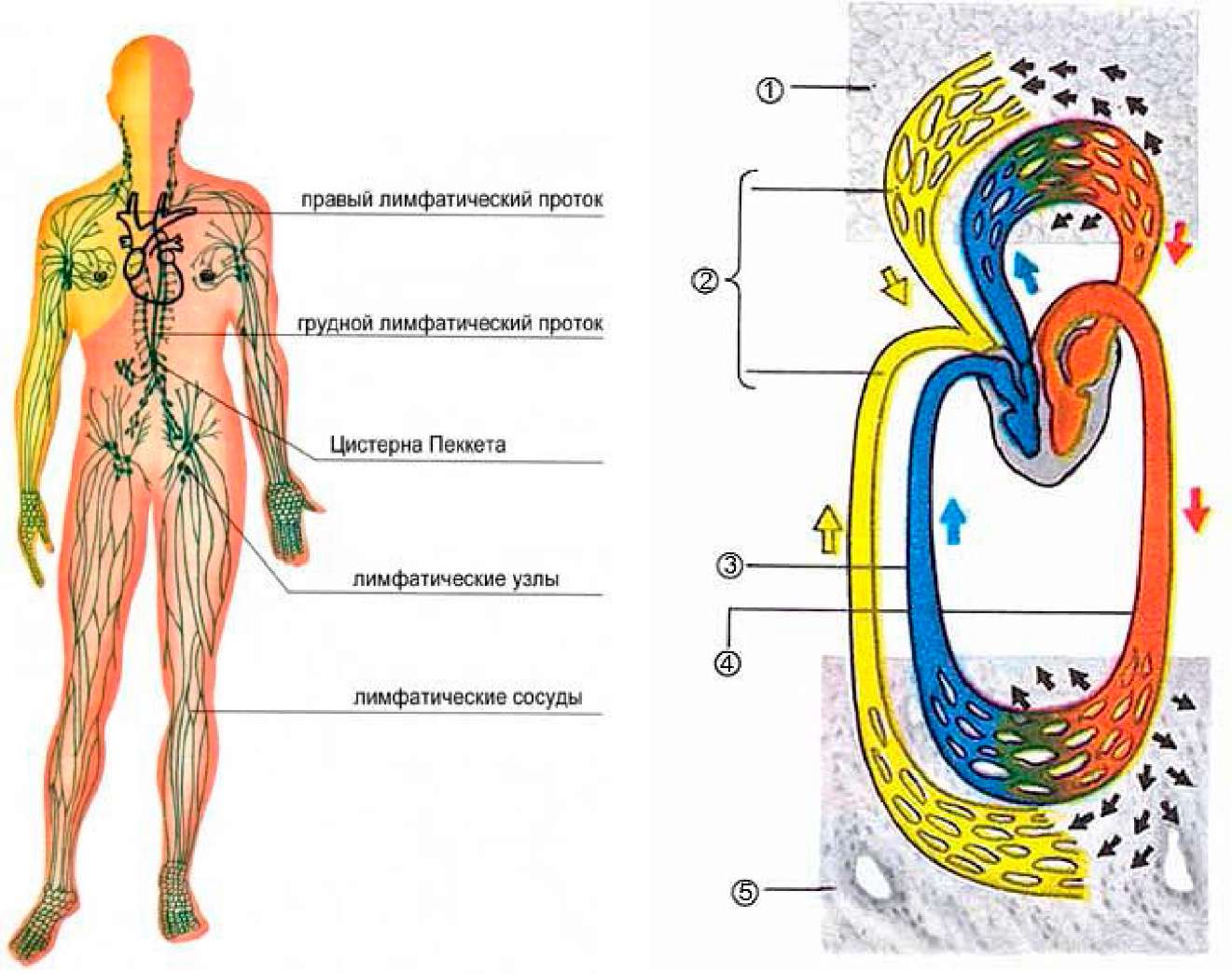
Лимфатические узлы обычно собраны в группы. В подмышечных впадинах, с боковых сторон шеи и в паху находятся большие группы лимфатических узлов.
Если в каком-то месте организма образуется очаг инфекции или воспаление, то ближайшие лимфатические узлы увеличиваются и становятся болезненными. Например, у человека с воспалением миндалин увеличиваются шейные лимфатические узлы. Лимфа от миндалин течёт к шейным лимфатическим узлам, где микроорганизмы, вызывающие инфекцию, уничтожаются, и останавливается их дальнейшее распространение по организму.
T и B клетки
Есть два вида лимфоцитов: T un B клетки
Как и другие клетки крови, лимфоциты образуются в костном мозге из особых клеток предшественников или стволовых клеток. Молодые лимфоциты проходят многие стадии развития, пока не станут зрелыми T или B лимфоцитами. Лимфоциты обоих видов играют важную роль в распознавании и уничтожении микроорганизмов, вызывающих инфекцию.
Обычно большая часть циркулирующих в крови лимфоцитов является T клетками. Они отвечают за распознавание и уничтожение изменённых клеток организма (точнее, клеток, инфицированных вирусами или бактериями).
B клетки узнают ‘чужие’ клетки и чужеродные тела (например, бактерии, попавшие в организм). Когда B клетки соприкасаются с чужеродным белком (например, на поверхности бактерий), они начинают вырабатывать антитела, которые присоединяются к поверхности чужеродной клетки и вызывают её гибель.
Хирургические методы профилактики и лечения лимфатического отека руки после лечения рака молочной железы
Многие женщины в мире страдают раком молочной железы. Лучевая терапия и хирургическое лечение рака молочной железы связаны с воздействием на молочную железу, грудную клетку и подмышечную впадину пораженной стороны и могут повредить местную лимфатическую систему. Это приводит к нарушению оттока жидкости из пораженной руки, что может вызвать ощущение тяжести и видимый отек. Для описания этого состояния используется термин «лимфедема». Лимфедема хорошо известна пациентам и медицинским работникам. Это состояние несет дискомфорт и может мешать многим аспектам повседневной жизни. Кроме того, некоторые пациенты считают односторонний отек руки неприглядным. Длительный отек также может ухудшить качество кожи и привести к рецидивирующим кожным инфекциям. Традиционные меры борьбы с этим неприятным состоянием включают упражнения для рук, массаж и компрессионные чулки. Хотя эти меры эффективно уменьшают отек руки, они требуют времени, терпения и ежедневной отдачи со стороны пациента, а также могут стоить ему больших затрат. Эти традиционные меры необходимо продолжать на протяжении всей жизни, чтобы они оставались эффективными.
Это приводит к нарушению оттока жидкости из пораженной руки, что может вызвать ощущение тяжести и видимый отек. Для описания этого состояния используется термин «лимфедема». Лимфедема хорошо известна пациентам и медицинским работникам. Это состояние несет дискомфорт и может мешать многим аспектам повседневной жизни. Кроме того, некоторые пациенты считают односторонний отек руки неприглядным. Длительный отек также может ухудшить качество кожи и привести к рецидивирующим кожным инфекциям. Традиционные меры борьбы с этим неприятным состоянием включают упражнения для рук, массаж и компрессионные чулки. Хотя эти меры эффективно уменьшают отек руки, они требуют времени, терпения и ежедневной отдачи со стороны пациента, а также могут стоить ему больших затрат. Эти традиционные меры необходимо продолжать на протяжении всей жизни, чтобы они оставались эффективными.
Вопрос исследования
Медицинские работники искали альтернативные способы лечения лимфедемы после лечения рака молочной железы.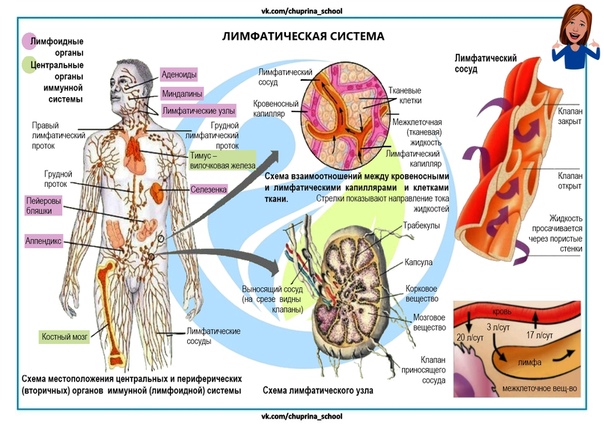 В этом обзоре рассматривается эффективность хирургических методов, разработанных для профилактики или лечения этого состояния.
В этом обзоре рассматривается эффективность хирургических методов, разработанных для профилактики или лечения этого состояния.
Результаты исследования
Был предложен ряд методов, но лишь три исследования, опубликованные до ноября 2017 года, соответствовали критериям включения в наш обзор. В двух исследованиях рассматривалась профилактика лимфедемы, а в одном лечение. Всего в трех этих исследованиях принял участие 131 человек.
Два исследования были посвящены хирургическому методу лимфовенозного анастомоза (профилактическая процедура), который соединяет лимфатические сосуды с кровеносными и использует систему кровообращения для оттока избыточной жидкости из руки. Они показали, что люди, прошедшие эту хирургическую процедуру, имеют меньший риск развития лимфедемы (на 255 случаев лимфедемы на 1 000 женщин меньше; истинное значение уменьшения может составлять от 118 до 300 женщин на 1 000) в сравнению с теми, кому она не проводилась. Эти два исследования не предоставили данных для важных вторичных исходов, таких как сообщенные пациентом исходы, способность прекратить дальнейшие вмешательства по поводу лимфедемы, хирургические или долгосрочные осложнения.
В одном исследовании оценивалась техника переноса васкуляризованных лимфатических узлов, согласно которой часть ткани с лимфатическими узлами из паха или брюшной полости переносится в подмышечную впадину конечности, пораженной лимфедемой. Авторы отмечали среди перенесших эту процедуру уменьшение:
— объема конечности: в среднем, у женщин, перенесших процедуру, объем конечности уменьшался на 39% по сравнению с получавшими лишь стандартную помощь;
— боли: в среднем, женщины, перенесшие процедуру, набрали на 4,16 балла меньше по 10-балльной шкале (где 1 = отсутствие боли, 10 = крайне сильная боль), чем получавшие лишь стандартную помощь;
— чувства тяжести: в среднем, женщины, перенесшие процедуру, набрали на 4,27 балла меньше по 10-балльной шкале чувства тяжести (где 1 = отсутствие чувства тяжести, 10 = крайне сильное чувство тяжести), чем получавшие лишь стандартную помощь;
— инфекции: в среднем, у женщин, перенесших процедуру, отмечалось на 1,22 инфекций в год меньше по сравнению с получавшими лишь стандартную помощь.
Техника переноса васкуляризованных лимфатических узлов также дала функциональное улучшение – в среднем, женщины, перенесшие процедуру, набрали на 3,77 балла меньше по 10-балльной шкале общей функции (где 1 = отличная функция, 10 = очень плохая функция) в сравнении с получавшими лишь стандартную помощь. Исследование не предоставило данных для некоторых важных вторичных исходов, таких как возможность прекратить дальнейшие вмешательства по поводу лимфедемы или долгосрочные осложнения.
Уверенность в доказательствах
Уверенность в доказательствах в пользу лимфовенозного анастомоза для профилактики лимфедемы была низкой – они были представлены двумя небольшими исследованиями из одного центра. Аналогично, лишь в одном одноцентровом исследовании оценивался перенос васкуляризованных лимфатических узлов, и были представлены доказательства очень низкого качества в пользу этой процедуры для лечения лимфедемы верхней конечности.
АНГИОГЕНЕЗ
М.В.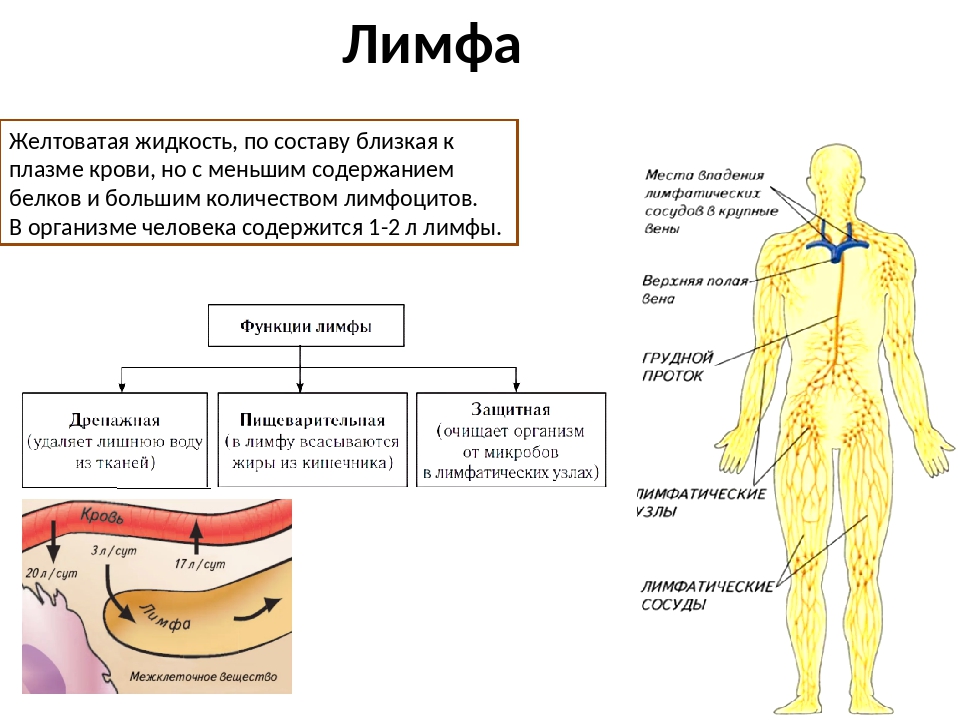 Спринджук 1, 2
Спринджук 1, 2
Национальная Академия Наук Беларуси
Объединенный Институт Проблем Информатики
1 Объединенный институт проблем информатики Национальной академии наук Беларуси
ул. Сурганова, 6, 220012, г. Минск, Беларусь
2 Автор для связи: Беларусь, 220040, Минск, Ул. Богдановича 112/38.
Электронная почта:
Резюме
Тема ангиогенеза – образования сосудов из уже существующих – сегодня является наиболее финансируемой и изучаемой медицинской научной темой в мире. Это связано с тем, что приблизительно 500 млн. жителей планеты нуждается в терапевтической коррекции патологических процессов ангиогенеза. В статье – обзоре литературы систематизированы только наиболее яркие источники литературы, намеренно преимущественно отечественных авторов. Работа проиллюстрирована для доступного понимания. В статье рассматриваются вопросы биохимии и патологической физиологии ангиогенеза в непосредственной связи с современной фармакотерапией. Целью литобзора является предоставление читателю возможности ознакомиться с современной медицинской проблемой 21 века: патологическим кровоснабжением и связанными с этим феноменом вопросами.
Целью литобзора является предоставление читателю возможности ознакомиться с современной медицинской проблемой 21 века: патологическим кровоснабжением и связанными с этим феноменом вопросами.
Ключевые слова: ангиогенез, неоваскуляризация, фактор роста эндотелия сосудов, метастазированиe, рак, злокачественные опухоли, антиангиогенная фармакотерапия.
Angiogenesis in thyroid gland
Review article
M.V. Sprindzuk 1, 2
1 United Institute of Informatics Problems, National Academy of Sciences of Belarus
Surganov str., 6, 220012, Minsk, Belarus
Tel: +375-17-274-21-71
Fax: +375-17-331-84-03
2 Corresponding author: Belarus, 220040, Minsk, Bogdanovicha lane 112/38.
Email:
Abstract
The research theme of angiogenesis – the development of blood vessels from the already existing, is one of the most financially supported medical scientific activities in the world. This is so, because 500 000000 citizen need the therapeutic correction of the pathologic angiogenesis processes. The review article is an assembly of the brightest research articles written in and translated into Russian. The paper has several figures, prepared in an attempt to provide the understandable educational resource. The biochemical and pathophysiological questions of angiogenesis are discussed in close relation to the modern angiogenic pharmacotherapy. The objective of the article is to present the reader an opportunity to discover the biomedical research challenge of the 21 century: the pathologic blood supply, vascularization and the associated phenomena.
This is so, because 500 000000 citizen need the therapeutic correction of the pathologic angiogenesis processes. The review article is an assembly of the brightest research articles written in and translated into Russian. The paper has several figures, prepared in an attempt to provide the understandable educational resource. The biochemical and pathophysiological questions of angiogenesis are discussed in close relation to the modern angiogenic pharmacotherapy. The objective of the article is to present the reader an opportunity to discover the biomedical research challenge of the 21 century: the pathologic blood supply, vascularization and the associated phenomena.
Key words: angiogenesis, neovascularization, vascular endothelial growth factor, metastasis, cancer, malignant tumors, antiangiogenic pharmacotherapy.
Содержание
Определение ангиогенеза
Ангиогенез (A.) – процесс образования новых кровеносных сосудов в органе или ткани. В норме в организме процессы ангиогенеза протекают с умеренной интенсивностью и только при регенерации поврежденных тканей, канализации тромбов, ликвидации очагов воспаления, образовании рубца и тому подобных процессах восстановления, а также при росте и развитии организма [1]. Отдельной областью изучения физиологического ангиогенеза является гинекология, так как А. является неотъемлемой частью циклических превращений в яичниках. Ангиогенез необходим для нормального роста эмбриональных и постнатальных тканей, пролиферации эндометрия, созревания в яичнике фолликула и желтого тела, заживления ран, коллатерализации, стимулированной ишемией [2]. Установлено, что эндотелиальные клетки вырабатывают цитокины, которые стимулируют не только пролиферацию и миграцию самих эндотелиальных клеток, но и пролиферацию опухолевых клеток. Иногда эти аутокринные и паракринные факторы секретирует сама опухоль [3-5].
В норме в организме процессы ангиогенеза протекают с умеренной интенсивностью и только при регенерации поврежденных тканей, канализации тромбов, ликвидации очагов воспаления, образовании рубца и тому подобных процессах восстановления, а также при росте и развитии организма [1]. Отдельной областью изучения физиологического ангиогенеза является гинекология, так как А. является неотъемлемой частью циклических превращений в яичниках. Ангиогенез необходим для нормального роста эмбриональных и постнатальных тканей, пролиферации эндометрия, созревания в яичнике фолликула и желтого тела, заживления ран, коллатерализации, стимулированной ишемией [2]. Установлено, что эндотелиальные клетки вырабатывают цитокины, которые стимулируют не только пролиферацию и миграцию самих эндотелиальных клеток, но и пролиферацию опухолевых клеток. Иногда эти аутокринные и паракринные факторы секретирует сама опухоль [3-5].
Рис.1 [23].
Особенности физиологического ангиогенеза
Физиологический ангиогенез представляет собой тканевый ответ либо на гормональную стимуляцию (ангиогенез в репродуктивной системе), либо на изменение окружающей среды (ткань способна расширять сосудистую сеть в ответ на ишемию).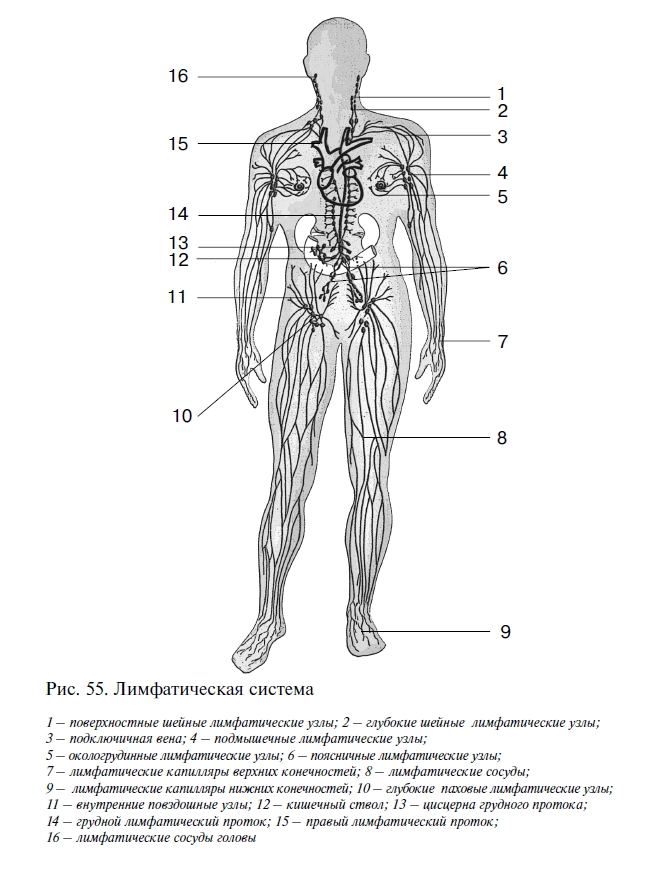 Учитывая, что фактор роста эндотелия сосудов (endothelial growth factor = VEGF) – это стрессиндуцированный белок, его регуляция сравнивается с другими кислород- и глюкозорегулируемыми белками, поэтому физиологический и ростовой ангиогенез можно рассматривать как адаптационный ответ на дефицит кислорода. Для того чтобы кислород и питательные вещества поступали в достаточном количестве, каждая клетка макроорганизма должна быть близко расположена к капилляру [2].
Учитывая, что фактор роста эндотелия сосудов (endothelial growth factor = VEGF) – это стрессиндуцированный белок, его регуляция сравнивается с другими кислород- и глюкозорегулируемыми белками, поэтому физиологический и ростовой ангиогенез можно рассматривать как адаптационный ответ на дефицит кислорода. Для того чтобы кислород и питательные вещества поступали в достаточном количестве, каждая клетка макроорганизма должна быть близко расположена к капилляру [2].
Особенности патологического и опухолевого ангиогенеза
В последние годы благодаря достижениям в области молекулярной онкологии удалось расшифровать некоторые механизмы канцерогенеза и определить признаки злокачественного фенотипа: самодостаточность в отношении ростовых сигналов, нечувствительность к рост-игибиторным сигналам, уклонение от программированной клеточной смерти (апоптоза), неограниченность репликативного потенциала, ангиогенез, тканевая инвазия и метастазирование.
Злокачественной опухоли требуются питательные вещества.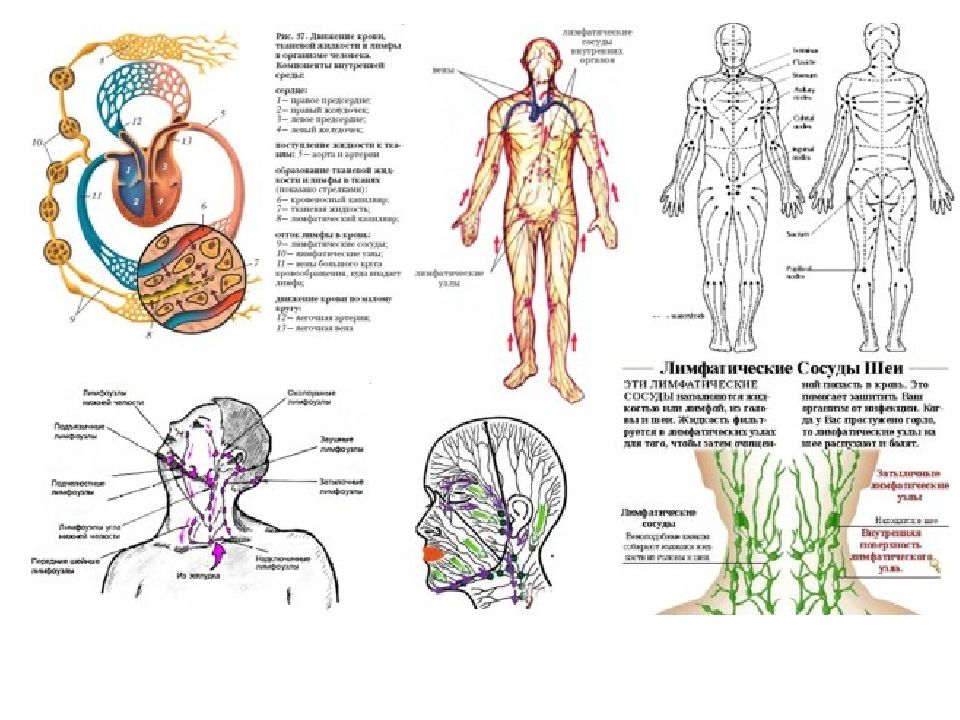 Опухоль объемом более 1-2 мм3 для продолжения своего роста нуждается в собственной системе кровоснабжения. Эта фраза цитируется во многих сотнях статей и книжных главах. Патологический ангиогенез наблюдается при ангиогенных заболеваниях, к которым, помимо опухолевого роста, метастазирования, атеросклероза, диабетической ретинопатии, эндометриоза, меноррагий, псориаза, относится и плоский лишай [2,6,7, 15-18, 20-22].
Опухоль объемом более 1-2 мм3 для продолжения своего роста нуждается в собственной системе кровоснабжения. Эта фраза цитируется во многих сотнях статей и книжных главах. Патологический ангиогенез наблюдается при ангиогенных заболеваниях, к которым, помимо опухолевого роста, метастазирования, атеросклероза, диабетической ретинопатии, эндометриоза, меноррагий, псориаза, относится и плоский лишай [2,6,7, 15-18, 20-22].
Наиболее яркими примерами патологий, связанных с ангиогенезом, являются атеросклероз (Koch et al., 1994), язвенная болезнь (Folkman et al., 1987) и некоторые аутоиммунные заболевания. Существуют косвенные указания на нарушения нормальных процессов А. при ряде патологий развития (Jackson et al., 1995) и при опухолеобразовании [8].
Метастазирование и ангиогенез
Метастазирование
- Метастазирование – это процесс, при помощи которого раковые клетки могут менять свое положение в организме.

- Большинство связанных с раком смертей вызвано метастазированием первоначальных раковых клеток.
- Для того чтобы разрушать в организме барьеры, метастазирующие раковые клетки должны секретировать смесь переваривающих ферментов.
- Для перемещения и осаждения в подходящей части тела раковые клетки могут использовать кровеносную систему.
- Метастазирование – это очень неэффективный процесс. Большинство раковых клеток гибнет после того, как они покидают первоначальную опухоль. Усиленный А. в опухоли является одним из механизмов ее быстрого метастазирования, так как опухолевые клетки имеют свойство метастазировать по ходу кровеносных сосудов (вдоль стенок) или разносятся по всему организму с током крови [1].
Сосуды питают опухоль и позволяют ей метастазировать [8].
Иногда уже на самых ранних стадиях развития опухоли в ней появляются субпопуляции клеток с высокой способностью к метастазированию. Установлено, что рак молочной железы способен метастазировать сразу после разрастания в опухоли сосудов, когда ее размеры еще не превышают 0,125 см2. Полагают, что поздно метастазирующие опухоли недостаточно васкуляризованы [8].
Лимфатическое метастазирование
- Для метастазирования раковые клетки могут использовать как кровеносную, так и лимфатическую систему.
- Перемещение раковых клеток в лимфатические узлы посредством лимфатической системы используется при определении метастатического заболевания и стадии опухоли.
Метастазы опухолей в местные и регионарные лимфоузлы, куда опухолевые клетки попадают по лимфатическим сосудам, представляют собой ранний этап метастазирования (см. рис.2). В ряде исследований было показано, что VEGF индуцирует как лимфангиогенез, так и распространение опухолевых клеток в регионарные лимфатические узлы. Экспрессия ростовых факторов типа VEGF может определять способность опухоли к метастазированию. VEGF оказывает более широкие эффекты на другие клетки, помимо эндотелия сосудов, и на другие процессы, помимо А.:
- Связываясь с рецептором-2 VEGF и стимулируя его, VEGF способствует формированию лимфатических сосудов.
- VEGF оказывает не полностью изученное действие на иммунные функции, в том числе:
- подавляет образование дендритных клеток, необходимых для осуществления клеточного иммунного ответа;
- стимулирует хемотаксис моноцитов [9].
Рис.2. Ангиогенез и развитие злокачественной опухоли [19].
Фактор роста эндотелия сосудов
Фактор роста эндотелия сосудов (или фактор проницаемости сосудов) является основным регулятором А. Его важнейшая роль подтверждается тем, что мыши, имеющие всего один аллель нормального VEGF-A, погибают внутриутробно. В большинстве опухолей человека концентрация VEGF повышается, что сопровождается усилением инвазивности, склонностью к рецидивам и худшим прогнозом [6].
VEGF – гомодимерный, сильно гликолизированный белок, митогенный только для эндотелиальных клеток, уровень его повышается в тканях, где активно идет А., его рецепторы экспрессируются на эндотелиальных клетках-мишенях в близлежащих кровеносных сосудах. Основными биологически активными формами являются молекулы размером 121 и 165 аминокислотных остатков. В 1989 г. несколько независимых групп ученых получили данные в пользу индукции VEGF гипоксией и гипогликемией. По данным ряда авторов, А. функционирует в динамическом сочетании с цитокинами, их растворимыми рецепторами и антагонистами, протеолитическими ферментами, регулирующими их освобождение из внеклеточного матрикса [2].
Семейство VEGF
Семейство VEGF включает прототипную молекулу VEGF-A, а также VEGF-B, VEGF-C, VEGF-D, вирусный гомолог VEGF-E и плацентарный ростовой фактор (PLGF). VEGF-A повышает сосудистую проницаемость и способствует А., VEGF-B, как полагают, играет роль в регуляции деградации внеклеточного матрикса, клеточной адгезии и миграции, а VEGF-C и VEGF-D участвуют, главным образом, в лимфангиогенезе. PLGF в большом количестве экспрессируется тромбобластом, модулируя развитие сосудистой сети в плаценте (см. рис.3).
Рис.3. Семейство молекул и рецепторов VEGF (более подробные объяснения см. в тексте).
Cвязывание VEGF с рецептором VEGFR-2 ведет к активации каскада различных сигнальных путей. Примеры двух из них изображены на рисунке 3. Такое взаимодействие приводит к включению генов, вовлекаемых в опосредование процессов пролиферации и миграции клеток эндотелия, и обеспечивает клеточное выживание, а также сосудистую проницаемость. Например, связывание VEGF с рецептором VEGFR-2 приводит к димеризации рецептора, за которым следует активация PLC–PKC–Raf киназа–MEK–митоген-активированной протеин киназы (MAPK) и последующая инициация синтеза ДНК и роста клеток, тогда как активация фосфатидилинозитол 3’–киназа (PI3K)–Akt пути приводит к увеличению роста выживания эндотелиальных клеток. Активация гена src может повлечь изменения актина цитоскелета и индуцировать миграцию клеток. Рецепторы VEGF локализованы на поверхности клеток эндотелия, однако могут присутствовать также и внутриклеточные («интракринные») VEGF-сигнальные рецепторы (VEGFR-2). Они вовлекаются в процессы обеспечения выживания эндотелиальных клеток. Детальная структура внутриклеточного VEGFR-2 до сих пор неизвестна, но на рисунке он показан как полноразмерный рецептор, который в норме прикреплен к поверхности клетки. Cвязывание VEGF-C c VEGFR-3 опосредует лимфангиогенез. VEGF может присоединяться к рецепторам нейропилина (NRP), которые могут действовать как корецепторы с VEGFR-2 (горизонтальная стрелка) и осуществлять регуляцию А.
KDR – kinase-insert domain–containing receptor – рецептор, имеющий в составе домен, содержащий киназу.
flk-1 – fetal liver kinase 1 – киназа печени плода.
EGFR – фактор роста эпидермиса, epidermal growth factor receptor.
PLGF – плацентарный фактор роста, placental growth factor.
PTEN – гомолог фосфатазы и тензина, phosphatase and tensin homologue.
S–S – дисульфидная связь, disulfide bond.
VHL – вон Гиппель-Ландау, von Hippel–Lindau.
(рисунок из NEMJ, google images)
Изоформы VEGF
У человека выделены 4 изоформы VEGF-A – VEGF121, VEGF165, VEGF189 и VEGF206, которые образуются в результате альтернативного сплайсинга мРНК VEGF.
Изоформы, которые имеют сходную биологическую активность, но сильно различаются по биодоступности, определяющейся размером молекулы и регулирующейся на генетическом уровне при альтернативном сплайсинге мРНК [cплайсинг протеинов – это внутримолекулярная реакция отдельного протеина, при которой внутренний сегмент протеина (называемый интеин) удаляется из протеина-предшественника одновременно с лигацией – отщеплением С-терминальных и Т-терминальных наружных протеинов (называемых экстеинами) с обеих сторон] [10] и протеолитическом расщеплении синтезированных молекул с участием системы активации плазминогена [2].
Более крупные формы VEGF связаны с матриксом через гепаринсвязывающие домены, в то время как VEGF165 (наиболее распространенная и значимая изоформа) и VEGF121 находятся в состоянии, способном к диффузии. Более крупные изоформы находятся в латентном состоянии во внеклеточном матриксе до того момента, как они высвобождаются под действием протеолитических ферментов, таких как плазмин или ММП-9 (матричная металлопротеаза). Этот процесс повышает местные концентрации VEGF-A в процессе роста и перестройки тканей и участвует в активации ангиогенного включения в некоторых опухолях. Как описывалось выше, VEGF-A также играет важную роль в удержании эндотелиальных клеток новообразованных кровеносных сосудов до момента присоединения к ним перицитов. Новообразованные сосуды, у которых еще нет перицитов, зависят от VEGF-A, препятствующего апоптозу эндотелиальных клеток и обратному развитию незрелых сосудов [6].
Лиганд VEGF
VEGF – один из членов семейства структурно близких между собой белков, которые являются лигандами для семейства рецепторов VEGF (лиганд – ион, молекула или их группа, которые сывязываются с другой химической структурой, формируя более крупный комплекс) [11]. VEGF влияет на развитие новых кровеносных сосудов (А.) и выживание незрелых кровеносных сосудов (сосудистая поддержка), связываясь с двумя близкими по строению мембранными тирозинкиназными рецепторами (рецептором-1 VEGF и рецептором-2 VEGF) и активируя их (рецептор – молекула белка, которая получает сигнал: нейропередатчик, гормон или другой, и отвечает на него) [12]. Эти рецепторы экспрессируются клетками эндотелия стенки кровеносных сосудов.
VEGF лиганд запускает сигнальный каскад, который в конечном итоге стимулирует рост эндотелиальных клеток сосуда, их выживание и пролиферацию. Эндотелиальные клетки участвуют в таких разнообразных процессах, как вазоконстрикция и вазодилатация, презентация антигенов, а также служат очень важными элементами всех кровеносных сосудов – как капилляров, так и вен или артерий. Таким образом, стимулируя эндотелиальные клетки, VEGF играет центральную роль в процессе А. [7,13].
Таблица 1. Рецепторная специфичность лигандов VEGF и их биологические эффекты [13].
| Лиганд | Рецептор | Функция |
|---|---|---|
| VEGF (VEGF-A) | Рецепторы-1, -2, VEGFR, нейропилин-1 | Ангиогенез, сосудистая поддержка |
| VEGF-B | VEGFR-1 | Неизвестна |
| VEGF-C | VEGFR-2, VEGFR-3 | Лимфангиогенез |
| VEGF-D | VEGFR-2, VEGFR-3 | Лимфангиогенез |
| VEGF-E (Вирусный фактор) | VEGFR-2 | Ангиогенез |
| ПлРФ | VEGFR-1, нейропилин-1 | Ангиогенез и воспаление |
ПлРФ – плацентарный ростовой фактор.
Рецепторы VEGF
Точка приложения действия бевацизумаба (медикамент, который рассматривается в последней части статьи) – VEGF-A – связывается с соответствующими тирозинкиназными рецепторами VEGF 1 (flt-1) и 2 (flk-1). Гипоксия в сочетании с возросшими местными концентрациями VEGF-A усиливает экспрессию как VEGF рецептора-1, так и VEGF рецептора-2 на эндотелиальных клетках опухоли. Интересно, что рецепторы VEGF также экспрессируются опухолевыми клетками, в том числе VEGF рецептор-1 обнаруживается в раковых клетках. Это позволяет предположить, что анти-VEGF-терапия может оказывать и другие эффекты, помимо подавления А.
Связывание VEGF-A с VEGF рецептором-2 необходимо для нормального А. и гемопоэза, и основные эффекты VEGF-A опосредованы через этот рецептор (рис.1). Связывание VEGF-A ведет к образованию димеров VEGF рецепторов-2, что запускает процесс фосфорилирования тирозинкиназы. Это, в свою очередь, индуцирует фосфорилирование нескольких цитоплазматических сигнальных белков и начало соответствующих сигнальных каскадов, таких как каскад фосфолипазы С, фосфоинозитол-3-киназы, Ras и Src [24,25]. VEGF-C и VEGF-D тоже связываются с VEGF рецептором-2, а также с VEGF рецептором-3 (flt-4). Следовательно, если VEGF-A, доминирующий внутри опухоли, будет нейтрализован действием бевацизумаба, сигнальные пути, опосредованные VEGF рецептором-2, могут быть активными в том случае, если опухоль продуцирует значительное количество VEGF-C и VEGF-D. Действительно, уровни экспрессии VEGF-C и VEGF рецептора-2 в первичных опухолях ободочной кишки и метастазах в лимфатические узлы позволяют предположить наличие сигнального пути VEGF-C [6].
Препараты, точкой приложения действия которых являются все эти три члена семейства VEGF (VEGF-A, -C и -D) или рецепторы VEGF (в частности, VEGF рецептор-2), также могут быть эффективными средствами лечения. VEGF рецептор-1 связывается с VEGF-A, VEGF-B и PIGF, но его точные функции неясны. Помимо мембранно-связанной формы, существуют также четыре растворимые изоформы, блокирующие VEGF-A путем конкурентного связывания и тем самым предотвращающие взаимодействие с VEGF рецептором-1 и VEGF рецептором-2. Лиганд, связывающийся с мембрано-связанной формой VEGF рецептора-1, вызывает лишь слабое аутофосфорилирование тирозинкиназы. По этой причине предположили, что VEGF рецептор-1 является decoy-рецептором, участвующим в отрицательной регуляции митогенного сигнала как в мембрано-связанной, так и в растворимой формах. Дальнейшие доказательства такой роли были получены при добавлении PLGF, который конкурирует с VEGF-A за VEGF рецептор-1 и потенцирует эффекты VEGF-A. Присутствие PLGF повышает доступность VEGF-A для связывания с VEGF рецептором-2, в результате чего возникает сильный митогенный сигнал. Однако для опосредованной VEGF миграции моноцитов, активации предшественников эндотелиальных клеток и индукции активности ММП необходим интактный сигнальный каскад VEGF рецептора-1. Другие данные указывают на роль сигнального пути VEGF рецептора-1 в перицитах.
Третий рецептор VEGF – VEGF рецептор-3, не связывается с VEGF-A и обнаруживается, главным образом, в лимфатическом эндотелии. VEGF рецептор-3 связывается с VEGF-C и VEGF-D и участвует в основном в лимфангиогенезе [6].
Значение VEGF для онтогенеза
VEGF чрезвычайно важен для формирования адекватной функционирующей сосудистой системы в ходе эмбриогенеза и в раннем постнатальном периоде, однако у взрослых его физиологическая активность ограничена. Эксперименты на мышах показали следующее:
- Целенаправленное повреждение одной или двух аллелей гена VEGF приводит к гибели эмбриона.
- Инактивация VEGF в период раннего постнатального развития также ведет к летальному исходу.
- Повреждение VEGF у взрослых мышей не сопровождается какими-либо явными аномалиями, поскольку его роль ограничена развитием фолликулов, заживлением ран и репродуктивном циклом у самок.
Ограниченное значение А. у взрослых означает, что подавление активности VEGF представляет собой выполнимую терапевтическую задачу [9].
Воздействие VEGF на незрелые сосуды
Незрелые кровеносные сосуды существуют преимущественно на этапе развития, а у взрослых индивидуумов – лишь в некоторых ситуациях, например, в процессе заживления ран или заболеваний, характеризующихся аномальным А., таких как онкологические. В отсутствие ростовых сигналов эндотелиальные клетки этих незрелых кровеносных сосудов подвергаются программированной клеточной гибели (апоптозу). VEGF препятствует апоптозу эндотелиальных клеток в незрелых кровеносных сосудах, тем самым сохраняя их жизнеспособность. В отличие от этого зрелые кровеносные сосуды, из которых сформирована сосудистая система взрослого, больше не нуждаются в VEGF для своего выживания и поэтому вряд ли будут страдать от подавления активности VEGF [9].
Влияние VEGF на иммунный ответ
Опухоли обладают рядом механизмов, которые позволяют им избежать иммунного ответа организма хозяина. Один из этих механизмов подразумевает ингибирование дендритных клеток – антиген-презентирующих клеток, которые стимулируют В- и Т-лимфоциты. VEGF препятствует функциональному созреванию дендритных клеток из их гемопоэтических клеток-предшественников. Таким образом, секреция VEGF опухолью может иметь важное значение в подавлении иммунного противоопухолевого ответа [9].
Корреляция степени экспрессии VEGF опухолью с неблагоприятным прогнозом
При целом ряде онкологических заболеваний у человека экспрессия VEGF усиливается (табл.2). Несколько исследований также продемонстрировали усиление экспрессии VEGF в стромальных клетках, ассоциированных с опухолью; возможно, в них экспрессия усиливается под влиянием факторов окружающей микросреды, созданных самой опухолью.
Таблица 2. В опухолях усиливается экспрессия VEGF, что коррелирует с прогнозом.
| Тип опухоли | % опухолей с избыточной экспрессией | Корреляция |
|---|---|---|
| Немелкоклеточный рак легкого | 45-90 | Рецидивы, выживаемость |
| Колоректальный рак | 40-60 | Рецидивы/выживаемость |
| Рак молочной железы | 30-60 | Плотность сосудов, выживаемость |
| Почечноклеточная карцинома | 30-100 | Плотность сосудов, стадия опухоли, степень, злокачественности |
| Рак поджелудочной железы | 75-90 | Выживаемость |
| Мультиформная глиобластома | 65-85 | Выживаемость |
| Рак предстательной железы | 30-80 | Плотность сосудов, безрецидивная выживаемость |
При многих видах опухолей усиление экспрессии VEGF коррелирует с неблагоприятным прогнозом, в том числе с агрессивным ростом опухоли, рецидивами, метастазированием и уменьшением выживаемости. Кроме того, экспрессия VEGF коррелирует с повышением плотности микрососудистой сети в опухоли, что само по себе служит индикатором прогноза при различных онкологических заболеваниях [9,13].
Этапы ангиогенеза
А. был впервые описан Hunter в конце 18 века [24], является комплексным процессом, включающим четыре стадии: протеолитическое разрушение базальной мембраны сосудов и межклеточного матрикса, миграцию и прикрепление эндотелиальных клеток, их пролиферацию и, наконец, формирование тубулярных структур [2].
Включение ангиогенеза
Недостаточное кровоснабжение ведет к гипоксии вследствие уменьшения диффузии кислорода. Гипоксия – главный стимул А. Происходит активация метаболических путей, регулируемых такими белками, как индуцируемый гипоксией фактор 1, что ведет к увеличению экспрессии проангиогенных факторов, включая VEGF и факторы роста фибробластов. Опухоли также снижают экспрессию антиангиогенных факторов, таких как тромбоспондин-1. В тот момент, когда действие проангиогенных факторов превышает действие антиангиогенных, эндотелиальные клетки переходят из обычного дремлющего состояния в активное. Этот момент называется «включением ангиогенеза».
После включения А. происходит разрыв базальных мембран и внеклеточного матрикса (ВКМ), главным образом, в результате повышения активности матричных металлопротеаз. Эти изменения матрикса способствуют миграции эндотелиальных клеток во внесосудистое пространство, где они начинают размножаться. Затем клетки организуются в трубочки с просветом, образуя новую капиллярную сеть. По ходу этого процесса привлекаются перициты, которые прикрепляются к новым сосудам и стабилизируют их. До этой точки созревания целостность и выживание эндотелиальных клеток зависят от VEGF. Несмотря на сходство процессов А., в опухоли образуется сосудистая сеть, которая сильно отличается от сосудов здоровых тканей. Сосудистое русло опухоли с морфологической точки зрения является крайне атипичным и составляет значительную часть опухолевой стромы. Системы артериол, капилляров и венул, присущей большинству здоровых органов, там нет. Макроскопически обнаруживаются два общих типа периферической и центральной сосудистой перфузии. В центре опухолей с периферической сосудистой сетью имеются крупные участки некроза, в опухолях с центральным типом сосудистого русла – наоборот. Однако эти фенотипы внутри опухоли во многом перекрываются, причем в одной части опухоли может быть любой из этих двух типов кровоснабжения. Кроме того, многие сосуды опухоли находятся в спавшемся состоянии из-за недостаточной механической поддержки окружающей их стромы. Микроскопически сосуды выглядят расширенными, извитыми, выявляется наличие слепых петель и выростов, шунтов и немногочисленных анастомозов. Эти структурные различия влияют на внутриопухолевый кровоток; кровь проходит через опухоли непредсказуемым образом, что оказывает неотвратимое отрицательное влияние на доставку лекарственных препаратов [6,14].
Опухолевые кровеносные сосуды не выстланы обычным монослоем эндотелиальных клеток, являются дезорганизованными, рыхлыми и беспорядочно связанными друг с другом. Во многих кровеносных сосудах опухоли также имеются эндотелиальные выросты из просвета, которые проникают глубоко в периваскулярную строму. Поскольку клетки эндотелия не образуют нормального монослоя, они не могут выполнять обычную барьерную функцию эндотелия, что играет роль в аномально высокой проницаемости этой сосудистой сети и ее склонности к кровотечениям. Далее стабилизирующая связь перицитов с эндотелием слабеет, а большие концентрации VEGF являются мощным фактором, повышающим проницаемость [6].
Вопросы контроля баланса регуляции ангиогенеза
Еще совсем недавно основным показателем активности А. в опухолях являлась микроскопическая оценка плотности сосудов в ткани самой опухоли, но за последнее десятилетие в результате исследования молекулярных механизмов опухолевого А. была выявлена группа регуляторных ангиогенных и антиангиогенных факторов, обеспечивающих формирование новых сосудов внутри опухоли [6]. Имеется необходимость отметить, что измерение площади и плотности капилляров опухоли – это морфометрический метод исследования, и равноценно сравнивать его с биохимическими методами, основанными на выявлении РНК и ДНК в тканях и клетках неадекватно. Еще один путь экспрессии А. происходит через вовлечение воспалительных клеток, секретирующих цитокины ФНО-α (альфа фактор некроза опухолей) и ИЛ-1, которые в свою очередь индуцируют продукцию – нормальными клетками. Процесс роста капилляров продолжается, пока не будет достигнута достаточная близость с клеткой. Затем А. вступает в фазу покоя (за исключением ангиогенных циклов в женской репродуктивной системе). Каждое увеличение тканевой массы сопровождается неоваскуляризацией, что поддерживает адекватную сосудистую плотность. Таким образом, А. индуцируется тогда, когда метаболические потребности превышают перфузионную способность существующих сосудов. По-видимому, механизм этого адаптивного ответа в том, что относительный недостаток кислорода приводит к повышению ангиогенных стимулов. Паракринный механизм влияния А. заключается в действии на рост сосудов в тканях с низким уровнем перфузии. Существует ряд клеток, способных повышать уровень VEGF in vitro во время гипоксии, к которым относятся фибробласты, миоциты гладкой и поперечнополосатой мускулатуры, пигментный эпителий сетчатки, астроциты и эндотелиальные клетки, а также некоторые опухолевые клетки. Таким образом, А. VEGF индуцируется гипоксией в большинстве, если не во всех, клеток in vitro. Гипоглиекмия также активирует экспрессию VEGF. Эксперименты, проведенные в клеточных монослоях, показали, что А. может быть независимо индуцирован гипоксией или гипогликемией. Интересен факт, что не происходит индукции VEGF в культивируемых клетках глиомы, лишенных и кислорода, и глюкозы. Повышение экспрессии VEGF требует синтеза белка, который не может идти при двойном стрессе. Способность реагировать на гипоксию и гипогликемию дает преимущество в ситуации, когда существует дефицит только одного из метаболитов. Неясно, однако, проходят ли эти два ответа через два разных пути или они вырабатывают общий медиатор, действующий как проксимальный индуктор VEGF. Исследования разных метаболитов, накапливаемых во время гипоксии и гипогликемии, по отношению к их способности непосредственно индуцировать VEGF не дали убедительных результатов. Показано, что VEGF индуцируется аденозином, а также ионами кобальта. Это свидетельствует о том, что белок гема может быть вовлечен в этот процесс [6].
Рис.4. Cхема факторов развития А. [23].
Роль стромы в патогенезе ангиогенеза
Наряду с факторами роста в процессе А. имеет большое значение состав экстрацеллюлярного матрикса стромы опухоли. Благоприятным является содержание в нем компонентов базальных мембран – ламинина, фибронектина и коллагена IV типа [4].
Формирование сосудов в опухолях происходит на фоне извращенной митогенетической стимуляции и измененного экстрацеллюлярного матрикса. Это приводит к развитию неполноценных сосудов преимущественно капиллярного типа, имеющих нередко прерывистую базальную мембрану и нарушенную эндотелиальную выстилку. Эндотелий может замещаться опухолевыми клетками, а иногда и вовсе отсутствовать [4].
Роль эфринов в патогенезе ангиогенеза
Роль эфринов в А. была впервые продемонстрирована Pandey A. с соавторами (Pandey et al., 1995). Исследователи обнаружили, что эфрин А1 принимает участие в развитии кровеносных сосудов роговицы глаза, он стимулирует А. in vivo и способствует хемотаксису эндотелиальных клеток in vitro. В дальнейшем в экспериментах in vitro было показано, что и другие белки семейства эфринов (эфрин B1, эфрин B2, эфрин B3) способствуют росту капилляров и «сборке» эндотелиальных клеток внутри сосуда, т.е. стимулируют морфо- и А., а также участвуют в процессах ремоделирования сосудов (Adams et al., 1999; Daniel et al., 1996; Stein et al., 1998) [8].
Полученные результаты были подтверждены исследованиями in vivo в экспериментах на животных (Wang et al., 1998). У эмбрионов мыши с «выключением» гена EFNB2 эфрина B2 наблюдается нарушение кровоснабжения формирующихся органов и тканей, вызванное повреждением кровеносных сосудов (Wang et al., 1998). В исследовании Adams R.H. с соавторами была также показана роль эфрина В3 в процессах А. и ремоделирования сосудов (Adams et al., 1999) [8].
Антиангиогенная фармакотерапия
Способность индуцировать и поддерживать А. – важнейший этап развития опухоли. А. лежит в основе разработки методов целенаправленного воздействия на этот процесс как средства терапии рака. В плане возможной разработки препаратов идентифицировано несколько молекулярных мишеней и клеточных путей. Одной из таких мишеней является VEGF [6].
Благодаря расшифровке некоторых молекулярных механизмов канцерогенеза лечение онкологических больных переходит на принципиально новый уровень – воздействие на молекулярные мишени, ответственные за процесс пролиферации злокачественной клетки, гиперэкспрессирующиеся преимущественно в опухоли и являющиеся доступными для идентификации рутинными способами. Результаты внедрения в клиническую практику первых таргетных препаратов, блокирующих ростовые факторы, доказало перспективность данного направления, способного значительно повысить эффективность медикаментозного лечения злокачественных опухолей.
Ингибиторы А. имеют два преимущества над другими лекарствами:
- они должны быть менее токсичны, чем используемые при обычной химиотерапии лекарства;
- так как их мишенью являются нормальные клетки, а не непосредственно раковые клетки, гораздо меньше вероятность, что они приведут к отбору устойчивых к лекарству опухолей.
С учетом вышеописанных характеристик VEGF становится ясно, что ингибирование VEGF представляет собой новаторский подход к противоопухолевой терапии, который может:
- привести к обратному развитию незрелых кровеносных сосудов, типичных для опухолей;
- снизить проницаемость сосудов и, тем самым, внутриопухолевое давление;
- уменьшить вероятность метастазирования опухоли [9,13].
Можно ожидать, что эти эффекты блокады VEGF на сосудистую сеть опухоли не повлияют на нормальные, зрелые сосуды, выживание которых не зависит от VEGF. Кроме того, ингибирование VEGF дополнило бы современные методы лечения, в частности, химиотерапию и противоопухолевую биотерапию, увеличив проникновение препаратов в опухолевые клетки благодаря обратному развитию аномального сосудистого русла опухоли и снижению внутриопухолевого давления. Эти наблюдения позволяют предполагать, что подавление активности VEGF может стать обоснованным принципом терапии целого ряда опухолей [9].
Целенаправленное воздействие на VEGF препаратом бевацизумаб (Авастин, Ф. Хоффманн-Ля Рош Лтд., Базель, Швейцария), гуманизированным моноклональным антителом класса IgG, в комбинации с известными режимами химиотерапии показало эффективность при лечении раков различной локализации.
Как уже упоминалось, А. играет важную роль в процессе заживления ран, поэтому высказываются опасения, что бевацизумаб может вызвать увеличение осложнений у пациентов, требующих оперативного лечения. Хотя в целом препарат хорошо переносится, примерно у 2% больных описаны серьезные проявления токсичности, включая перфорацию желудочно-кишечного тракта и ухудшение заживления ран, несмотря на то, что после операции препарат вводили с отсрочкой не менее 28 дней. Эти осложнения чаще возникают у тех пациентов, которые были оперированы на фоне терапии бевацизумабом, что имеет очевидные последствия для хирургической практики. Тем не менее, значительное улучшение выживаемости, которое можно получить с помощью бевацизумаба, означает высокую вероятность его широкого применения [6].
Заключение
Тема нуждается в дальнейших исследованиях, так как абсолютно эффективная ангиогенная терапия рака еще не разработана, а количество людей, в ней нуждающихся, не уменьшается.
Список литературы
- Ангиогенез. Википедия. 2009.
- Петрова Л.В., Кушлинский Н.Е., Ильина Л.В. Фактор роста эндотелия сосудов как показатель гипоксии тканей, его возможная роль в патогенезе плоского лишая слизистой оболочки рта. Вестник дерматологии и венерологии. 2004, №5.
- Соколов Д.И., Кондратьева П.Г., Розломий В.Л., Крамарева Н.Л., Сельков С.А. Роль ангиогенеза в развитии наружного генитального эндометриоза. Журнал «Цитокины и воспаление». 2007, Т.6, №2. С.10-17.
- Автономный рост и прогрессия опухолей. Российский журнал гастроэнтерологии, гепатологии, колопроктологии. 2002, №4, Т.12, С.45-49.
- Махачев С.М., Османов А.О., Рамазанов М.Р. Механическое стимулирование ангиогенеза. Издательство «Медицина». 2003, 160 с.
- A.D. Thornton, P. Ravn, M. Winslet, K. Chester. Angiogenesis inhibition with bevacizumab and the surgical management of colorectal cancer. British Journal of Surgery Society Ltd. 2006, Vol.93, Issue 12, P.1456-63.
- В. Прозоровский. Кровеносные сосуды и рак. Журнал «Наука и жизнь». 2006, №9.
- Ангиогенез: общие сведения. Биология и медицина. 2009.
- VEGF – фактор роста эндотелия сосудов. MEDI.RU. 2009.
- Protein splicing. Encyclopedia article about Protein splicing. 2009.
- Ligand (biochemistry). Encyclopedia article about Ligand (biochemistry). 2009.
- Receptor. Encyclopedia article about Receptor. 2009.
- Инновации в онкологии. Рош – Швейцарская фармацевтическая компания. 2009.
- Шадеркина В.А. Таргетная терапия в онкоурологии. UroWeb.ru. 2007.
- Carmeliet P. Mechanisms of angiogenesis and arteriogenesis. Nature medicine. 2000, Vol.6, №4, P.389-395.
- Carmeliet P. Angiogenesis in health and disease. Nature medicine. 2003, Vol.9, P.653-660.
- Carmeliet P. Angiogenesis in life, disease and medicine. Nature. 2005, Vol.438, №7070, PP.932-936.
- Carmeliet P., Jain R. Angiogenesis in cancer and other diseases. Nature. 2000, Vol.407, №6801, P.249-257.
- Figg W.D., Folman J.E. Angiogenesis: An Integrative Approach From Science To Medicine. Edited by New York, Random House. 2008, P.601.
- Folkman J. What is the evidence that tumors are angiogenesis dependent? Edited by © Oxford University Press. 1990, P.4-7.
- Folkman J. Clinical applications of research on angiogenesis. New England Journal of Medicine. 1995, Vol.333, №26, P.1757-1763.
- Folkman J. A new link in ovarian cancer angiogenesis: lysophosphatidic acid and vascular endothelial growth factor expression. J Natl Cancer Inst. 2001, Vol.93, №10, P.734-735.
- Forough R., SpringerLink (Online service). New Frontiers in Angiogenesis. Edited by Dordrecht, Springer. 2006, P.344.
- Ribatti D., ebrary Inc. History of research on tumor angiogenesis. Edited by Dordrecht, Springer Netherlands.2009, P.125.
Работа выполнена в рамках проектов CRDF-4028 и МНТЦ-1682.
Лимфодренажный массаж в Москве в клинике Дикуля: цены, запись на прием
Лимфодренаж – это методика массажа, направленная на восстановление и стимуляцию движения лимфы (жидкости, которая транспортирует лейкоциты, кислород и питательные вещества к тканям по всему организму). Так называемый «лимфатический или лимфодренажный массаж включает в себя аккуратные круговые движения.
В связи с тем, что лимфатическая система является частью иммунной системы человека, приверженцы этого вида массажа считают, что его помощью можно лечить различные заболевания.
Использование лимфодренажа
Лимфодренаж был разработан в 1930-х годах датскими врачами Эмилем и Эстридом Воддером для лечения лимфедемы (состояния, которое проявляется отеком и скоплением лимфы в мягких тканях, вследствие инфекций, травм и других патологических состояний, оказывающих влияние на лимфатическую систему. Лимфедема может приводить к появлению таких симптомов как слабость, боли и тяжесть в конечностях.
Довольно часто, лимфодренажный массаж применяется для лечения лимфедемы, развивающейся после удаления лимфоузлов во время операции при раке молочной железы.
Кроме того, лимфодренаж может быть использован при заболеваниях опорно-двигательного аппарата, при хронической венозной недостаточности, рассеянном склерозе.
Преимущества
Лимфодренажный массаж — это разновидность мягких техник массажа для стимуляции лимфотока в организме человека.
Лимфатическая жидкость помогает выводить продукты обмена и токсические вещества из тканей. Некоторые заболевания могут приводить к накоплению лимфатической жидкости. Лимфодренажный массаж может помочь пациентам с лимфедемой, фибромиалгией и другими заболеваниями.
Если сердце человека постоянно прокачивает кровь по сосудам, то лимфатическая система с помощью гладкой мускулатуры транспортирует жидкости по лимфатическим сосудам.
При патологических состояниях (например, при лечении рака) происходит нарушение оттока лимфатической жидкости, что может приводить к развитию отека лимфедема.
Лимфодренажный массаж может уменьшить отеки и улучшить кровообращение в лимфатической системе.
Показания
Лимфодренажный массаж может быть полезен при следующих состояниях:
- лимфедема
- отеки на ногах или руках – до или после операции, или вследствие задержки жидкости
- кожные заболевания
- усталость
- бессонница
- проблемы с пищеварением
- артрит
- эпизоды мигрени.
- фибромиалгия и волчанка
- синдром хронической усталости
- депрессия и беспокойство
- гормональный и эмоциональный дисбаланс.
- рецидивирующие инфекции, такие как ОРЗ, грипп, тонзиллит.
Побочные эффекты и меры предосторожности
Лимфодренаж следует избегать пациентам с наличием следующих состояний:
- Хроническая сердечная недостаточность
- Воспаление или инфекция лимфатических сосудов
- Повышенная свертываемость риск крови
- Кожные инфекции
- Послеоперационная лимфедема, отмеченная локализованным отеком
При наличии у пациента лимфедемы, врач может назначить анализы для выявления причины отека. Кроме того, использование лимфодренажного массажа при верифицированных состояниях необходимо согласовать с врачом, так как врач может дополнительно рекомендовать компрессионную терапию и физические упражнения, а при тяжелой лимфедеме лечение основного заболевания.
Лимфодренажный массаж должен выполнять только сертифицированный специалист с медицинским образованием.
Продолжительность сеанса лимфатического массажа
Длительность лимфатического массажа варьируется от 30 до 90 минут, в зависимости от патологического состояния. Для первого сеанса лимфатического массажа одной конечности рекомендуется длительность 60 минут, при лечении двух конечностей рекомендуется длительность процедуры в 90 минут
Чего ожидать от первого сеанса лимфатического массажа?
На первом сеансе специалист, выполняющий лимфатический массаж, выяснит историю заболевания, изучит верификацию диагноза. Лимфатический массаж выполняется на массажной кушетке. Массажные движения должны быть легкими и ритмичными и массаж должен быть безболезненным.
После завершении массажа специалист может рекомендовать использование компрессионного белья. Кроме того, могут быть даны рекомендации по физическим упражнениям, по уходу за кожей и самомассажу.
Какие органы иммунной системы? — InformedHealth.org
Наша иммунная система состоит как из отдельных клеток и белков, так и из целых органов и систем органов. Органы иммунной системы включают кожу и слизистые оболочки, а также органы лимфатической системы.
Органы, которые действуют как барьеры
Ваша кожа и слизистые оболочки являются первой линией защиты от микробов, проникающих извне. Они действуют как физический барьер при поддержке следующих людей:
Кроме того, рефлексы, которые заставляют нас кашлять и чихать, помогают освободить наши дыхательные пути от микробов.
Части иммунной системы
Лимфоидные органы
Лимфатическая система состоит из:
Первичные лимфоидные органы: Эти органы включают костный мозг и тимус. Они создают особые клетки иммунной системы, называемые лимфоцитами.
Вторичные лимфоидные органы: Эти органы включают лимфатические узлы, селезенку, миндалины и определенные ткани в различных слоях слизистой оболочки тела (например, в кишечнике).Именно в этих органах клетки иммунной системы выполняют свою фактическую работу по борьбе с микробами и чужеродными веществами.
Костный мозг
Костный мозг — это губчатая ткань, находящаяся внутри костей. Именно здесь вырабатывается и размножается большинство клеток иммунной системы. Эти клетки перемещаются в другие органы и ткани через кровь. При рождении многие кости содержат красный костный мозг, который активно создает клетки иммунной системы. В течение нашей жизни все больше и больше красного костного мозга превращается в жировую ткань.В зрелом возрасте только некоторые из наших костей все еще содержат красный костный мозг, включая ребра, грудину и таз.
Тимус
Тимус расположен за грудиной над сердцем. Этот железоподобный орган достигает полной зрелости только у детей, а затем медленно превращается в жировую ткань. В тимусе созревают особые типы клеток иммунной системы, называемые лимфоцитами клеток тимуса (Т-лимфоцитами). Помимо прочего, эти клетки координируют процессы врожденной и адаптивной иммунной систем.Т-клетки перемещаются по телу и постоянно отслеживают изменения на поверхности всех клеток.
Лимфатические узлы
Лимфатические узлы — это небольшие бобовидные ткани, расположенные вдоль лимфатических сосудов. Лимфатические узлы действуют как фильтры. Различные клетки иммунной системы улавливают микробы в лимфатических узлах и активируют выработку специальных антител в крови. Увеличенные или болезненные лимфатические узлы являются признаком активности иммунной системы, например, для борьбы с инфекцией.
Селезенка
Селезенка расположена в левой верхней части живота, под диафрагмой, и отвечает за различные виды работ:
Она хранит различные клетки иммунной системы.При необходимости они перемещаются с кровью в другие органы. Клетки-мусорщики (фагоциты) в селезенке действуют как фильтр для микробов, попадающих в кровоток.
Разрушает эритроциты (эритроциты).
Он накапливает и расщепляет тромбоциты (тромбоциты), которые, помимо прочего, отвечают за свертывание крови.
Через ткань селезенки всегда течет много крови. В то же время ткань очень мягкая.В случае серьезной травмы, например, в результате несчастного случая, селезенка может легко разорваться. В этом случае обычно требуется хирургическое вмешательство, поскольку в противном случае существует опасность умереть от кровотечения. Если необходимо полностью удалить селезенку, другие органы иммунной системы могут выполнять ее функции.
Миндалины
Миндалины также являются частью иммунной системы. Благодаря своему расположению в горле и на небе, они могут препятствовать проникновению микробов в организм через рот или нос. Миндалины также содержат много лейкоцитов, которые убивают микробы.Существуют разные типы миндалин: небные миндалины, аденоиды и язычные миндалины. Все эти структуры миндалин вместе иногда называют кольцом Вальдейера, поскольку они образуют кольцо вокруг отверстия, ведущего к горлу, от рта и носа.
Со стороны горла также находится лимфатическая ткань, которая может выполнять функции небных миндалин, если их удалить.
Слизистые оболочки
Кишечник играет центральную роль в защите организма от микробов: более половины всех клеток организма, вырабатывающих антитела, находятся в стенке кишечника, особенно в последней части тонкой кишки и в аппендиксе. .Эти клетки обнаруживают посторонние вещества, а затем маркируют и уничтожают их. Они также сохраняют информацию о веществах, чтобы в следующий раз реагировать быстрее. В толстом кишечнике также содержатся безвредные бактерии, называемые флорой желудочно-кишечного тракта или кишечника. Здоровая флора кишечника затрудняет распространение и попадание микробов в организм.
Слизистые оболочки поддерживают иммунную систему и в других частях тела, таких как дыхательные и мочевыводящие пути, а также слизистая оболочка влагалища.Клетки иммунной системы находятся непосредственно под слизистыми оболочками, где они предотвращают прикрепление бактерий и вирусов.
Что такое неходжкинская лимфома?
Рак начинается, когда клетки начинают бесконтрольно расти. Клетки практически в любой части тела могут стать раком и распространиться на другие области. Чтобы узнать больше о том, как рак начинается и распространяется, см. Что такое рак?
Неходжкинская лимфома (также известная как неходжкинская лимфома, НХЛ или иногда просто лимфома) — это рак, который начинается в белых кровяных тельцах, называемых лимфоцитами , которые являются частью иммунной системы организма.
- НХЛ — это термин, который используется для обозначения множества различных типов лимфомы, которые имеют одни и те же характеристики. Существует еще один основной тип лимфомы, называемый лимфомой Ходжкина, который лечится по-другому. См. Лимфома Ходжкина.
- NHL чаще всего поражает взрослых, но могут заболеть и дети. См. Неходжкинская лимфома у детей.
- НХЛ обычно начинается в лимфатических узлах или другой лимфатической ткани, но иногда может поражать кожу. См. Лимфома кожи.
Где начинается лимфома
Лимфома поражает лимфатическую систему организма (также известную как лимфатическая система ). Лимфатическая система — это часть иммунной системы, которая помогает бороться с инфекциями и некоторыми другими заболеваниями. Это также помогает жидкостям перемещаться по телу.
Лимфомы могут возникать в любом месте тела, где находится лимфатическая ткань. Основные участки лимфатической ткани:
- Лимфатические узлы: Лимфатические узлы — это скопления лимфоцитов и других клеток иммунной системы размером с боб по всему телу, в том числе внутри грудной клетки, брюшной полости и таза.Они связаны системой лимфатических сосудов.
- Селезенка: Селезенка — это орган под нижними ребрами на левой стороне тела. Селезенка производит лимфоциты и другие клетки иммунной системы. Он также хранит здоровые клетки крови и отфильтровывает поврежденные клетки крови, бактерии и клеточные отходы.
- Костный мозг: Костный мозг — это губчатая ткань внутри определенных костей. Здесь образуются новые клетки крови (в том числе некоторые лимфоциты).
- Тимус: Тимус — это небольшой орган за верхней частью грудины и перед сердцем.Это важно для развития Т-лимфоцитов.
- Аденоиды и миндалины: Это скопления лимфатической ткани в задней части глотки. Они помогают вырабатывать антитела против вдыхаемых или проглатываемых микробов.
- Пищеварительный тракт: Желудок, кишечник и многие другие органы также содержат лимфатическую ткань.
Типы неходжкинской лимфомы
Лечение НХЛ зависит от его типа, поэтому врачам важно выяснить, какой именно у вас тип лимфомы.Тип лимфомы зависит от того, какой тип лимфоцитов поражен (В-клетки или Т-клетки), насколько зрелыми становятся клетки, когда они становятся злокачественными, и других факторов.
В-клеточные и Т-клеточные лимфомы
Лимфатическая система состоит в основном из лимфоцитов, типа белых кровяных телец, которые помогают организму бороться с инфекциями. Существует 2 основных типа лимфоцитов:
- В-лимфоциты (В-клетки): В-клетки обычно помогают защитить организм от микробов (бактерий или вирусов), вырабатывая белки, называемые антителами.Антитела прикрепляются к микробам, помечая их для разрушения другими частями иммунной системы.
- Т-лимфоциты (Т-клетки): Есть несколько типов Т-клеток. Некоторые Т-клетки уничтожают микробы или аномальные клетки в организме. Другие Т-клетки помогают повысить или замедлить активность других клеток иммунной системы.
Лимфома может начаться в любом типе лимфоцитов, но наиболее распространены В-клеточные лимфомы.
Индолентные и агрессивные лимфомы
Типы НХЛ также можно сгруппировать в зависимости от того, насколько быстро они растут и распространяются:
- Индолентные лимфомы медленно растут и распространяются Некоторые вялотекущие лимфомы могут не нуждаться в немедленном лечении, но вместо этого можно внимательно наблюдать.Самым распространенным типом вялотекущей лимфомы в США является фолликулярная лимфома.
- Агрессивные лимфомы быстро растут и распространяются и обычно требуют немедленного лечения. Наиболее распространенным типом агрессивной лимфомы в США является диффузная В-крупноклеточная лимфома (DLBCL).
- Некоторые типы лимфомы, например лимфома из мантийных клеток, не подходят ни к одной из этих категорий.
Независимо от того, насколько быстро они растут, все неходжкинские лимфомы могут распространяться на другие части лимфатической системы, если их не лечить.В конце концов, они также могут распространяться на другие части тела, такие как печень, мозг или костный мозг.
Классификация типов НХЛ
Существует много разных типов неходжкинской лимфомы (НХЛ), поэтому ее классификация может быть довольно запутанной (даже для врачей). Было использовано несколько различных систем, но самой последней является классификация Всемирной организации здравоохранения (ВОЗ). Система ВОЗ группирует лимфомы на основе:
- Тип лимфоцита, с которого начинается лимфома
- Как выглядит лимфома под микроскопом
- Хромосомные особенности клеток лимфомы
- Наличие определенных белков на поверхности раковых клеток
Лимфодренаж груди | Справочная статья по радиологии
Лимфодренаж груди берет начало от долек груди и течет через интрамаммарные узлы и каналы в субареолярное сплетение, называемое сплетением Саппея.От этого сплетения лимфатический дренаж проходит по трем основным маршрутам, параллельным венозным притокам. Лимфатические сосуды из левой груди в конечном итоге заканчиваются в грудном протоке и левой подключичной вене, а из правой груди — в правой подключичной вене.
- подмышечный или боковой путь
- доминирующий путь (получает> 75% лимфы из груди)
- дренирует латеральные квадранты груди напрямую или через сплетение Саппея в подмышечные узлы
- либо проходит вокруг нижней границы большой грудной мышцы, достигая грудной группы лимфатических узлов, либо проходит непосредственно в подлопаточную группу
- Несколько каналов от верхней груди к апикальной группе, иногда прерываемой подключичной группой лимфатических узлов
- внутренний путь молочной железы
- берет начало как в медиальном, так и в латеральном квадрантах груди
- проходит через межреберные промежутки и большую грудную мышцу в парастернальные / внутренние лимфатические узлы молочной железы Соединения
- могут проходить через среднюю плоскость и, следовательно, к контралатеральной груди
- ретромаммарный путь
- идет от более глубокой части груди
- дренаж подключичного сплетения
Другие пути возникают, когда обычные каналы заблокированы при болезни.Лимфа может проходить в контралатеральную грудь, шейные узлы, брюшную полость и печень через диафрагму или через влагалище прямой мышцы живота.
Подмышечные лимфатические узлы можно разделить на хирургические уровни:
- уровень 1: ниже малой грудной мышцы
- уровень 2: лежа за малой грудной мышцей
- уровень 3: лежит между верхней границей малой грудной мышцы и нижней границей ключицы
лимфатическая система | Примеры предложений
о лимфатической системе еще нет в Кембриджском словаре.Ты можешь помочь!
Отсутствие лимфатической системы считается одной из причин отсутствия идентифицированных экстракраниальных метастазов в подавляющем большинстве опухолей глиобластомы. Саппей был уважаемым анатомом, которого запомнили своими исследованиями лимфатической системы . ИзВикипедия
Этот пример взят из Википедии и может быть повторно использован по лицензии CC BY-SA.В 2006 г. у одного вида костистых рыб — рыбок данио — была описана лимфатическая система , аналогичная таковой у млекопитающих. ИзВикипедия
Этот пример взят из Википедии и может быть повторно использован по лицензии CC BY-SA.Капиллярный обмен между лимфатической системой и кровотоком задерживается из-за неспособности организма эффективно преодолевать градиент гидростатического давления. ИзВикипедия
Этот пример взят из Википедии и может быть повторно использован по лицензии CC BY-SA.По мнению авторов, ограничительный характер бюстгальтера подавляет лимфатическую систему . ИзВикипедия
Этот пример взят из Википедии и может быть повторно использован по лицензии CC BY-SA.Опять же, этот эффект усугубляется отсутствием лимфатической системы , что ограничивает способность мозга снимать давление. Однако взрослые черви ведут малоподвижный образ жизни, и как только они попадают в лимфатическую систему , дальнейшие миграции не обнаруживаются.Функционирующая лимфатическая система является основным органом, реализующим иммунологическую компетентность хозяина. Лимфоциты — это мобильные иммунные клетки, которые способны циркулировать в кровеносных сосудах и лимфатической системе и мигрировать через ткани. Лимфатическая система пронизывает все наше тело и обычно получает лишь поверхностное освещение во время обучения врачей общей практики.Это также может помочь сбалансировать физический аспект — стимулировать кровь и лимфатическую систему , которая способствует выведению токсичных отходов из организма. Вкратце, это хронический отек из-за неспособности лимфатической системы дренировать должным образом. Удивительно, что так мало состояний, которые влияют на лимфатическую систему , признаны ключевыми областями для медицинских исследований или особенностями популярного словаря.Лимфатический отек обычно ассоциируется с женщинами, у которых был рак груди и которые пострадали от рака, хирургического вмешательства или рентгенографии. Они транспортируются плазмой крови и лимфатической системой . ИзВикипедия
Этот пример взят из Википедии и может быть повторно использован по лицензии CC BY-SA.В отличие от сердечно-сосудистой системы лимфатическая система не является закрытой системой. ИзВикипедия
Этот пример взят из Википедии и может быть повторно использован по лицензии CC BY-SA. Опухоль агрессивна и быстро распространяется на миометрий и лимфатическую систему .ИзВикипедия
Этот пример взят из Википедии и может быть повторно использован по лицензии CC BY-SA.Эти примеры взяты из корпусов и из источников в Интернете. Любые мнения в примерах не отражают мнение редакторов Cambridge Dictionary, Cambridge University Press или его лицензиаров.сообщение}}
Выберите часть речи и введите свое предложение в поле «Определение».
{{/сообщение}} Часть речиВыберите существительное, глагол и т.
Определение
Представлять на рассмотрение Отмена
Ведение: лимфатические пороки развития и лимфедема
Как работает лимфатическая система?
Чтобы понять лимфатические мальформации и лимфедему, давайте посмотрим на лимфатическую систему.
Лимфатическая система — это часть системы кровообращения и жизненно важная часть иммунной системы.
Артериальная кровь переносит кислород, питательные вещества и гормоны для клеток. Чтобы достичь этих клеток, кровь покидает мелкие артерии и течет в ткани. Эта жидкость теперь известна как межклеточная жидкость и доставляет свои питательные продукты к клеткам. Затем он покидает клетку и удаляет продукты жизнедеятельности.
После выполнения этой задачи 80-90% этой жидкости возвращается в систему кровообращения в виде венозной крови.
Что такое лимфа?
Оставшиеся 10-20% жидкости, остающейся в тканях, представляют собой прозрачную или желтоватую жидкость, известную как лимфа.
Лимфа образуется, когда жидкость, которая находится в промежутках между тканями тела (интерстициальная жидкость), собирается через лимфатические капилляры. Затем он транспортируется по лимфатическим сосудам к лимфатическим узлам, прежде чем в конечном итоге попадает в правую или левую подключичную вену, где снова смешивается с кровью.
Слово лимфа происходит от имени римского божества пресной воды Лимфа. ( Википедия, )
В отличие от крови, которая непрерывно течет по всему телу, лимфа течет только в одном направлении в пределах своей собственной системы — вверх к шее. Это движение вверх от интерстициальных пространств вверх по телу зависит от движения мышечных и суставных насосов, температуры, диафрагмального дыхания и пульсации в соседних артериях.
Проходя через тело, лимфа проходит через лимфатические узлы, которые отфильтровывают мусор и болезнетворные микроорганизмы. Миндалины, аденоиды, селезенка и вилочковая железа являются частью лимфатической системы. Когда отфильтрованная лимфа достигает шеи, она попадает в венозный кровоток через подключичные вены, расположенные по обе стороны шеи рядом с ключицами.
Поскольку лимфа происходит из межклеточной жидкости, ее состав постоянно меняется, поскольку кровь и окружающие клетки постоянно обмениваются веществами с межклеточной жидкостью.В целом он похож на плазму крови, за исключением того, что он также содержит лейкоциты. Лимфа возвращает в кровоток белки и избыток межклеточной жидкости. Лимфа может собирать бактерии и переносить их в лимфатические узлы, где они разрушаются. Метастатические раковые клетки также могут переноситься через лимфу. Лимфа также переносит жиры из пищеварительной системы. ( Википедия, )
Лимфатическая система
Лимфатические пороки
Лимфатические мальформации — это заполненные жидкостью каналы или сосуды, в которых лимфатическая система не развита должным образом, вызывая расширение сосудов и скопление чистой жидкости в результате медленного оттока лимфы.
Капли наполненные кровью
Лимфатические мальформации (LM), как правило, разрастаются между кожей и мышцами. Также может быть асимметрия, деформация и разрастание кости. LM в конечности часто ассоциируется с лимфедемой. Когда они возникают ближе к коже, они могут проявляться как пузырьков или пузырьков , которые являются прозрачными или голубоватыми, или капиллярное кровотечение может смешиваться с лимфатической жидкостью, в результате чего пузырьки кажутся заполненными кровью (см. Фото).
Лимфатические мальформации могут иметь крошечные жидкостные пространства (микрокистозные) или большие жидкостные пространства (макрокистозные), либо они могут быть комбинацией того и другого. Они могут быть только в одной области или очень обширными, поражая несколько частей тела. Правильный диагноз важен, поскольку лечение каждого типа разное. Ваш врач может порекомендовать компрессионное белье для контроля наполнения расширенных лимфатических каналов и отека конечностей. Также чрезвычайно важно поддерживать чистоту области лимфатической мальформации, поскольку это снижает риск разрушения кожи и инфекции, особенно при поражениях стоп и ног. Риск заражения присутствует всегда.
Внезапное увеличение лимфатической мальформации, вероятно, является результатом кровотечения или инфекции (целлюлит). Если есть инфекция, затрагивающая область, содержащую лимфатическую мальформацию, необходимо начать терапию антибиотиками. Целлюлит можно отличить от кровотечения чаще всего по симптомам покраснения и жара над лимфатической мальформацией. Поскольку некоторые штаммы бактерий могут быть опасными, , если вы подозреваете целлюлит, вам следует как можно скорее обратиться за медицинской помощью .Кровотечение в лимфатическую аномалию может быть болезненным и также должно быть осмотрено врачом.
Детская больница Цинциннати
Детская больница Лос-Анджелеса
Лимфедема
Лимфатическая система состоит из сосудистых каналов, которые видны только на определенных снимках. Лимфа — это жидкость, богатая белком, которая помогает переносить определенные жиры и лейкоциты (лимфоциты) по телу, а также помогает уносить клеточные примеси.Когда избыток лимфатической жидкости просачивается из лимфатических сосудов в окружающие ткани, это состояние называется лимфедемой.
Лимфедема характеризуется чрезмерной задержкой жидкости и отеком пораженного участка из-за аномалий или плохого функционирования лимфатической системы.
- Пораженная область может быть больше других участков тела, иметь «тучный» вид, бугорчатую или неровную поверхность.
- Также могут быть симптомы, такие как просачивание лимфатической жидкости через кожу, наполненные жидкостью шишки или «пузырьки», а также чувство тяжести и / или боли в пораженной области.
- Асцит (лимфатические полости в брюшной или тазовой области) может обнаруживаться при сканировании.
Существует два основных типа лимфедемы:
- Первичная лимфедема: Это вызвано ранее существовавшими аномалиями или «пороками», обычно присутствующими при рождении, которые вызывают плохую функцию лимфатической системы.Может быть чрезмерный рост лимфатической системы в одной или нескольких областях, отсутствующие части лимфатической системы или другие аномальные структуры, приводящие к симптомам.
- Вторичная лимфедема: Это лимфедема, которая постепенно развивается с течением времени в результате нарушения кровотока в сосудах. Например, у человека с нарушенной венозной функцией может первоначально развиться состояние, называемое «отек сосудов», которое представляет собой задержку жидкости и отек, вызванные нарушением кровотока, но не связанные с лимфатической системой.Однако со временем это состояние может вызвать нагрузку на лимфатическую систему, в результате чего она будет плохо функционировать. На этом этапе у человека разовьется лимфедема, вторичная по отношению к (или косвенно вызванная) нарушением кровотока в сосудах.
( Laredo J & Lee NN. Lymphedema-Chapter 23 of Phlebology , Хирургия вен и УЗИ. 2014 ed.) ( Liu, Lu, Yan, 2010 . J.Vasc Surg) ( Fialka-Moser et al.2013 г. J.Реабилитация)
В случае сосудистых аномалий лимфедема может быть изолированной или сопровождать другие симптомы. Это может повлиять на одну или несколько участков тела. Это может быть связано с проблемой развития лимфатических сосудов (первичная), в результате затруднения лимфатического кровотока (вторичная) или и тем, и другим. Любой, кто лечит лимфедему при комбинированной сосудистой мальформации, должен знать о лимфатических пороках.
Лимфатическая система — это часть сосудистой системы.При K-T и подобных фенотипах лимфатические мальформации являются одним из компонентов, составляющих диагноз. Лимфатические пороки развития отличаются от лимфедемы.
Жизнь с лимфедемой
В большинстве случаев ответственность за лечение лимфедемы ложится на пациента. Самообразование о заболевании и о том, как с ним справиться, является важной частью управления общим состоянием здоровья. Лечение включает устранение застойных явлений в сокращенных лимфатических путях; поощрение развития дополнительных дренажных маршрутов и стимулирование функционирования оставшихся патентных маршрутов.
Шаги, которые вы можете предпринять, чтобы избежать проблем в областях, склонных к лимфедеме:
- Найдите хороший источник учебных материалов.
- Найдите сертифицированного терапевта по лимфедеме пораньше. Стандарта обучения, признанного правительством США, не существует, но мы рекомендуем терапевтов, которые следуют рекомендациям, установленным Лимфологической ассоциацией Северной Америки (LANA), которые включают минимум из 135 часов обучения, чтобы считаться квалифицированными.
- По возможности приподнимите пораженную конечность.
- Используйте компрессию по рекомендации врача.
- Избегайте нанесения тепла на пораженный участок.
- Риск заражения повышен и может возникнуть в результате попадания бактерий или грибков в мельчайшие трещинки или сухие участки кожи. Кожные инфекции, известные как целлюлит (или рожа), могут быть очень серьезными и даже опасными для жизни. Держите кожу и ногти в чистоте , чтобы избежать заражения.
- Научитесь распознавать воспаление, целлюлит и лимфангит, и когда обращаться за медицинской помощью.
- Защитите себя от травм, особенно конечностей, которые могут быть повреждены.
- Не носите тесную одежду .
- Избегайте положений, движений или действий, которые могут ограничить кровообращение (ношение тяжелых сумок, скрещивание ног, тесные носки или украшения).
- Обычно выполняйте какое-нибудь упражнение (ходьба, плавание, езда на велосипеде, йога).
- Избегайте босых ног .
- Соблюдайте меры предосторожности в периоды продолжительной иммобилизации и во время движения .
- Сообщите своему терапевту по лимфедеме, если вы принимаете антикоагулянты , особенно перед CDT.
- Избегайте заборов крови , иммунизации (включая другие иглы) или измерения артериального давления в области лимфедемы.
- Поговорите со своим врачом о необходимости иметь под рукой рецепт на антибиотик на случай, если во время путешествия случится эпизод.
Стадии лимфедемы
Стадия 0 — предварительная стадия: латентная или субклиническая стадия
Может не быть видимых изменений снаружи, или может быть прогрессирующий отек или полнота в конечности, или может возникнуть покалывание, усталость, тяжесть или даже боль в пораженной области.
Лимфедема может оставаться в латентной стадии в течение месяцев или даже лет, прежде чем симптомы станут очевидными.
Стадия I — точечный отек
Если стадия задержки игнорируется или пропускается, может возникнуть точечный отек.Это первая стадия лимфедемы, также называемая обратимой лимфедемой. Пораженный участок слегка опухнет, наполнится лимфатической жидкостью, богатой белком (по сравнению с венозным отеком). При нажатии на ткань часто появляется небольшая вмятина или «ямка». Симптомы проходят с повышением, но обычно ухудшаются в течение дня. При возвышении или в постели конечность должна вернуться в нормальное состояние. На этом этапе лимфедема не повреждает кожу или ткани.
Стадия II — Спонтанно необратимая лимфедема
Происходят изменения тканей (воспаление, уплотнение, утолщение).Происходит прогрессирование отека. Кожа затвердевает, и опухоль больше не проходит после пробуждения. Язвы меньше из-за фиброза тканей. Лимфедема II стадии поддается лечению, но повреждение тканей невозможно исправить.
Стадия III — лимфостатический слон
Точечная коррозия больше не возникает.К этому моменту болезнь прогрессирует и включает необратимые трофические изменения кожи (изменения, возникающие в результате прерывания нервного питания). Кожа сухая и чешуйчатая, из конечности может вытекать жидкость. Часто встречаются кожные инфекции. Пораженный участок тела становится очень большим и деформируется. Кожа будет иметь бородавчатый разрастание, выглядеть кожистым и морщинистым, и на коже могут появиться выступы или волдыри, пытающиеся удержать жидкость.
Традиционное лечение лимфедемы
( Finnane et al .2015 )
В настоящее время не существует общепринятого лекарства от лимфедемы. Поэтому лечение необходимо периодически повторять, чтобы состояние было управляемым. Перечислены традиционные методы лечения. Комбинация процедур называется Полная Противозастойная терапия. (CDT) . CDT состоит из начальной восстановительной фазы, за которой следует поддерживающая фаза. Основные цели ранней CDT — уменьшение размера пораженной части и улучшение кожи.Эффекты CDT —
- уменьшить отек
- увеличить отток лимфы из перегруженной области
- уменьшить фиброз кожи и улучшить состояние кожи
- улучшить функциональное состояние пациента
- уменьшить дискомфорт и улучшить качество жизни
- снизить риск целлюлита и синдрома Стюарта-Тревеса, редкая форма ангиосаркомы
Компоненты CDT:
- Ручной лимфодренаж (MLD): Этот метод может включать наложение повязки на пораженный участок с использованием техник MLD-массажа или их комбинации.Лицензированный терапевт MLD (предпочтительно сертифицированный терапевт по лимфедеме, но часто физиотерапевт или терапевт) должен начать лечение. Как только цели будут достигнуты, пациент будет освобожден от терапии с домашним планом обслуживания.
- Компрессионная терапия (короткие эластичные бинты и компрессионное белье)
- короткие эластичные бинты используются во время интенсивной фазы CDT, так как объем конечности изменяется почти ежедневно, поэтому всю одежду необходимо постоянно обновлять
- Компрессионное белье обычно используется для обслуживания, чтобы ограничить дополнительное набухание или повторное набухание.
- Lym фатические упражнения
- Уход за кожей и образование
Одежда для лимфедемы бывает разных стилей и степеней сжатия. Тип одежды, градиент сжатия, а также готовность одежды или ее размер по индивидуальному заказу могут зависеть от потребностей пациента.
Некоторые типы неэластичных леггинсов, сапоги Унна и пневматическая компрессия иногда используются для краткосрочного лечения, например, для лечения язв.Известно, что другие неэластичные типы, такие как Solaris или Tribute, удобны и эффективны, но в первую очередь предназначены для ношения дома.
Традиционная эластичная одежда в настоящее время является наиболее известным вариантом и используется для повседневного ухода. В таблице ниже перечислены различные предметы одежды, как нестандартные, так и готовые к продаже.
| Compression Company | Тип продукта | Custom / Off-the Shelf |
|---|---|---|
| Solaris | Ночная одежда, готовая упаковка, чулок / рукав, Swell Spots | Custom, Off-the-the-Spot -Полка |
| Barton Carey | Чулок / рукав | Custom |
| Bio-Concepts | Stocking / Sleeve | Custom, Off-the Shelf |
| Jobst | Чулок / рукав | Пользовательский, стандартный |
| Mediven | Circaid, чулок / рукав Circaid Juxtafit (неэластичный) | the-Shelf |
| Lymphadiva | Гильза | Готовая продукция |
| Sigvaris | Чулок / Гильза | Готовая к продаже | 9063 9
Пневматические насосы для лимфедемы: Пневматические насосы для лимфедемы, хотя и не являются частью традиционной CDT, эффективны как для уменьшения отека, так и для поддержания отеков в будущем.Насосы для лимфедемы необходимо использовать регулярно, чтобы эффективно контролировать лимфедему. Эти устройства используют градиентное давление, что означает, что они качают вверх, чтобы вытолкнуть лимфатическую жидкость из пораженной области, чтобы организм мог вывести лишнюю жидкость.
Elevation помогает лимфатической жидкости стекать в области лимфатических узлов и в грудной проток, а уход за кожей, например увлажнение, снижает риск инфекции и язв.
Elevation и уход за кожей
Было показано, что различные формы упражнений, включая физиотерапевтические упражнения, упражнения для лечения лимфедемы, занятия спортом и даже йогу, уменьшают лимфедему и улучшают результаты.( Morris & Wonders, 2015 ) ( Ahmed et al. 2006 ) ( McNeely et al. 2010 ) ( Aggithaya et al. 2015 ) Хотя большая часть результатов касается лимфедемы, связанной с раком, полезность упражнений по-прежнему применимо к людям с лимфатическими мальформациями, в том числе с КТ и другими комбинированными сосудистыми мальформациями. Причина, по которой упражнения работают, заключается в том, что сочетание движения и мышечного воздействия помогает «перекачивать» лимфатическую жидкость по сосудам в кровоток.
Осложнения при лимфедеме
- Лимфангиэктазия ( Ingle and Ingle, 2014 ) ( Wen et al. 2010 ) Распространенность этого состояния при K-T и других лимфатических мальформациях неизвестна, однако вероятность его развития присутствует.Лимпангиэктазия — это форма «энтеропатии с потерей белка». По сути, лимфатическая жидкость просачивается в кишечник или почечную систему, вызывая потерю белка и нарушение всасывания питательных веществ ( Kumar et al. 2014 ). Симптомы могут включать частую диарею, тошноту, дефицит белка (низкий уровень альбумина в крови или преальбумина), дефицит витаминов, асцит, присутствующий при сканировании, и непереносимость продуктов с высоким содержанием жиров. Лечение является диетическим и обычно состоит из диеты с высоким содержанием белка и низким содержанием жиров с добавлением пищевых добавок в соответствии с клиническими рекомендациями.Одно исследование действительно указывает на то, что триглицериды со средней длиной цепи могут быть терапевтическими ( Desai et al. 2009 ). Кроме того, существует единичное исследование препарата Эверолимус, успешно лечившего педиатрическую кишечную лимфангиэктазию ( Ozeki et al. 2016 . Pediatrics ). Лимфатическое сканирование обычно является диагностическим, хотя в прошлом для диагностики использовались и другие методы.
- Лимфаденит: это воспаление лимфатических узлов.
- Инфекция: скопление лимфатической жидкости, воздействие на иммунную функцию и возможное разрушение кожи при лимфедеме резко увеличивает риск инфекций.Сюда входят целлюлит и инфекции самих лимфатических узлов и лимфатических сосудов (1) (2), лимфангитит, рожа и сепсис. 1) ( Carlson. 2014. ClinDermatol ) 2) ( Vaillant & Gironet, 2002 )
- Лимфангиосаркома: редкое осложнение хронической лимфедемы, иногда называемое синдромом Стюарта-Тревеса ( Komoroswski WM, Wysocki , Mitus J. Ангиосаркома в хронически лимфедематиозной ноге: необычное проявление синдрома Стюарта-Тревеса. Южный Мед Дж. . 2003; 96 (8): 807-8 )
Обработка изображений
Сканирование лимфатических пороков часто используется не в диагностических целях (хотя иногда это может иметь место), а чаще для подтверждения диагноза или более четкого представления о том, как конкретно поражена лимфатическая система человека. Перечислены методы сканирования лимфатической сосудистой сети.( Lohrmann, 2007 . Br J Radiol ) ( Liu, Zhang.2014 J Recons Microsurg )
- МРТ Лимфангиография (MRL): самая современная форма оценки структуры лимфатической системы с использованием технологии магнитно-резонансной томографии (MRI) в сочетании с совместимым контрастом.
- Лимфосцинтография: изотопный контраст в сочетании с компьютерной томографией.
- Лимфография: Обычно больше не проводится.Йодное масло используется для контраста лимфатических сосудов при получении рентгеновских снимков
Поддержка лимфедемы
Полезная поддержка и дополнительная информация доступны в Национальной сети лимфедемы или Лимфатической образовательной и исследовательской сети.
Последнее обновление страницы: 8 апреля 2016 г.
Что такоеЛимфатическая система? Также см. Рак.gov « Shotty лимфатические узлы «означает скопление небольших опухших узлы. Дробленые узлы могут возникать, когда иммунная система реагирует на инфекция — это не обязательно указывает на какой-либо конкретный болезнь. « Громоздкий болезнь «обычно описывает лимфатический узел или экстранодальная опухоль размером более десяти сантиметров в любом измерение. Кальцинированные узлы на самом деле не редкость и обычно являются результатом какой-то излеченной инфекции в прошлом. Туберкулез, как известно, вызывает их, шейная лимфа узлы — лимфатические узлы расположен в области шеи и вокруг нее. См. Изображение маг на WebMD Anatomy Анатомические области для стадирования лимфомы Ходжкина SEER нажмите, чтобы увеличить Лимфатические сосуды — исчерпывающий список (в алфавитном порядке) http: // bit.ly / лимф-альфа Лимфа узлы на голове и шее 1: Субменталь Википедия См. Также: каталог Вернуться к началу | Понимание лимфатическая системаЛимфатическая система состоит из органов, протоков и узлов. Переносит водянистую прозрачную жидкость, называемая лимфой. Эта жидкость распределяет иммунные клетки и другие факторы по всему телу.Он также взаимодействует с кровью кровеносная система для отвода жидкости из клеток и тканей. Лимфатическая система содержит иммунные клетки, называемые лимфоцитов , защищающих организм от антигенов (вирусов, бактерии и т. д.), которые проникают в организм. Смотрите больше на лимфоциты внизу. Именно аномальные клетки этого типа вызывают лимфома. Основные функции лимфатической системы
Органы лимфы Включите костный мозг, лимфатические узлы, селезенка и тимус.Клетки-предшественники в костном мозге производить лимфоциты. В-лимфоциты (В-клетки) созревают в кости костный мозг. Т-лимфоциты (Т-клетки) созревают в вилочковой железе. Помимо предоставления убежища для лимфоцитов (В-клеток и Т-клетки) протоки лимфатической системы обеспечивают транспортировка белков, жиров и других веществ в среде называется лимфой. Лимфатические узлы : «Лимфатические узлы человека имеют бобовидную форму и имеют размер от от нескольких миллиметров до примерно 1-2 см в нормальном состоянии . Они могут увеличиваться из-за опухоли или инфекции. белый клетки крови расположены в сотовых структурах лимфы. узлы. Лимфатические узлы увеличиваются, когда организм инфицирован из-за усиленное производство некоторых клеток и деление активированных T и B клетки. В некоторых случаях они могут ощущаться увеличенными из-за перенесенных инфекций; хотя человек может быть здоровым, он все еще может ощущать их остаточные увеличено.»Wikipedia.org Лимфа«Означает чистую воду, и в основном это жидкость и белок, был выдавлен из крови (т. е. из плазмы крови). Лимфа дренируется из ткани в микроскопических слепых сосудах, называемых лимфатические капилляры. Эти лимфатические капилляры очень проницаемы и, поскольку они под давлением лимфатическая жидкость может легко стекать из ткани в лимфатические капилляры. Как и сеть крови, лимфатические сосуды образуют сеть по всему телу, в отличие от крови лимфатическая система представляет собой улицу с односторонним движением, отводящую лимфу от ткани и возвращающую ее в кровь ». Источник bbc.co.uk «В отличие от сердечно-сосудистой системы, лимфатическая система не закрыт и не имеет центрального насоса ». wikipedia.org «Движение лимфы происходит, несмотря на низкое давление. из-за перистальтика — деятельность гладких мышц и скелета (повседневная активность и движение тела). «Среднее лимфатические ткани контролируют качество иммунных ответов. Различия между различными лимфатическими тканями значительно влияют на формы иммунитета и относятся к тому, как антигены (бактерии, вирусы, грибок и др.) приобретаются этими органами. Лимфома Это болезнь, при которой злокачественные лимфоциты слишком быстро растут или живут слишком долго.Эти клетки могут затем накапливаются в лимфатических узлах или других участках лимфатической система образования опухолей. Когда эти клетки накапливаются в лимфе узлы, это часто называют аденопатия — увеличение лимфатических узлов; но аденопатия может иметь и другие причины. Есть много доброкачественные причины увеличения лимфы узлы:
Лимфатические узлы нормального размера?Лимфатические узлы человека имеют бобовидную форму. Эти органы иммунной системы могут иметь размер от нескольких миллиметров примерно до 12 см в нормальном состоянии. Они могут увеличиться из-за к опухоли или инфекции, или лимфоме. Уорик, Роджер; Питер Л. Уильямс (1973) [1858]. «Ангиология (Глава 6) ». Анатомия Грея . Реактивные лимфатические узлы«ЛИМФА-узлы представляют собой комбинацию охранной сигнализации и Вест-Пойнт. Как охранная сигнализация, они включены. предохраняться от навязчивого антигена. Как и в Вест-Пойнте, узлы находятся в дело подготовки боевой элиты: » pleiad.umdnj.edu Что такое восковая эпиляция, убыль и Постоянно увеличенные лимфатические узлы?Лимфатические узлы могут увеличиваться или уменьшаться размер по многим причинам, включая реакцию на лечение, прогрессирование лимфома, спонтанный регресс лимфомы, активация иммунной системы против лимфомы, инфекции или разрешения инфекции (реактивной, см. выше) и т. д. Следовательно, изображение лимфома — это только оценка реакции на лечение и направления заболевания.
Ресурсы | ЛимфоцитыВернуться к началу | Лимфоциты, также называемый лейкоциты описаны ниже.Эти мелкие клетки диаметром 7-9 м в мазках крови … Эти клетки являются вторыми по распространенности лейкоцитами. тип, составляющий около 30% популяции лейкоцитов периферических кровь …. Лимфоциты перемещаются по крови, но обычно покидают капилляры. и блуждают по соединительной ткани. Следовательно, лимфоциты могут обычно можно встретить в любое время в любом месте.Они даже входят эпителиальная ткань, ползание между эпителиальными клетками. Они повторно входят кровообращение через каналы лимфатической системы (отсюда и их название) ». Источник: Blood Cells www.siumed.edu Жизненный цикл лимфоцитов
|
Что такое лимфодренажный массаж?
Лимфодренажный массаж — это узкоспециализированный стиль, основной целью которого является перемещение лимфатической жидкости по телу.
Лимфатическая система
Упрощенная диаграмма лимфатической системы (через WikiPedia)Лимфатическая система является жизненно важной частью иммунной системы вашего организма.Жидкость, содержащая белки, антитела, продукты жизнедеятельности и другие материалы, циркулирует по всему телу, где загрязнения фильтруются лимфатическими узлами. Эти узлы расположены по всему телу, но особенно сконцентрированы в подмышечных впадинах, паху и животе.
Есть несколько лимфатических узлов, которые вы можете почувствовать на себе, особенно когда вы заболели. На нижней стороне челюсти есть два, которые часто опухают при простуде или боли в горле. Вы также можете почувствовать подмышечные узлы в подмышечных впадинах (это важный ориентир при самостоятельном обследовании груди).
Лимфатическая жидкость может иногда скапливаться в ваших голенях и ступнях, предплечьях и кистях рук, вызывая отек, известный как «лимфедема». Это обычная проблема для пациентов, проходящих химиотерапию, или больных диабетом. Это состояние также может возникать при длительных периодах бездействия, например при длительном перелете или поездке на автомобиле.
Лимфедема нижних конечностей различных стадий.Лимфодренажный массаж (LD)
Используя серию компрессов и легких ударов, я буду следовать строгой схеме смывания лимфатической жидкостью от конечностей к основным лимфатическим узлам и к брюшной полости, где жидкость фильтруется несколькими внутренними органами для удаления отходов. удаление.
Лимфодренажный массаж всегда заканчивается медленными и точными манипуляциями брюшной полости с мышцами и другими мягкими тканями, а также с нижележащими органами.
Преимущества лимфодренажного массажа
Лимфодренажный массаж в домашних условиях дает много преимуществ.
- Детоксикация
- Перемещение лимфатической жидкости через лимфатические узлы вручную ускоряет фильтрацию и детоксикацию.
- Aesthetics
- LD уменьшает видимые отеки.
- Обезболивание
- Лимфедема может быть довольно болезненной, особенно в нижних конечностях, из-за чего ходить и стоять невыносимо.
- Решение проблем с пищеварением
- Манипуляции с брюшной полостью и нижележащими органами могут помочь с перистальтикой кишечника и облегчить боль при газах.
- Послеоперационное облегчение
- Лимфодренажный массаж может помочь вывести анестетики из вашей системы.
- LD также может помочь уменьшить отек и связанную с ним боль в пораженных участках.
- Снятие стресса
- Организм вырабатывает много гормонов и химикатов в ответ на физический и эмоциональный стресс.
- Организм вырабатывает много гормонов и химикатов в ответ на физический и эмоциональный стресс.

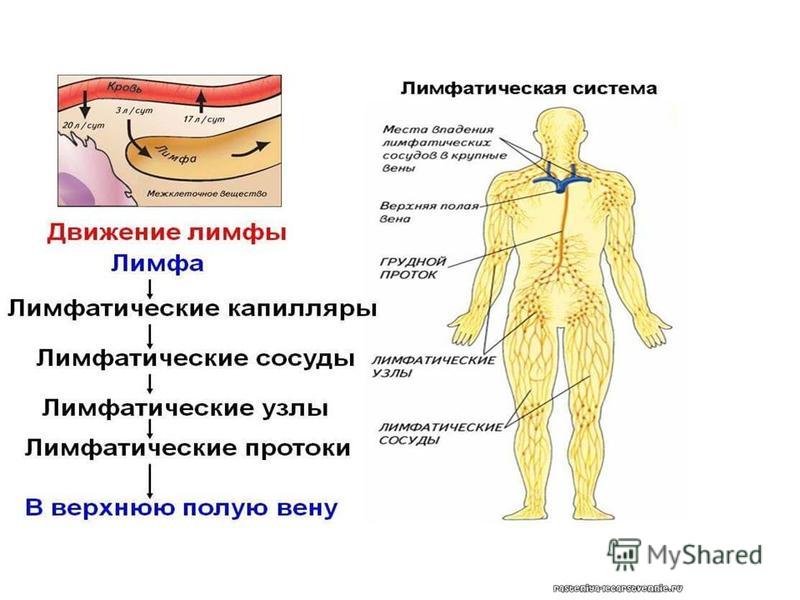


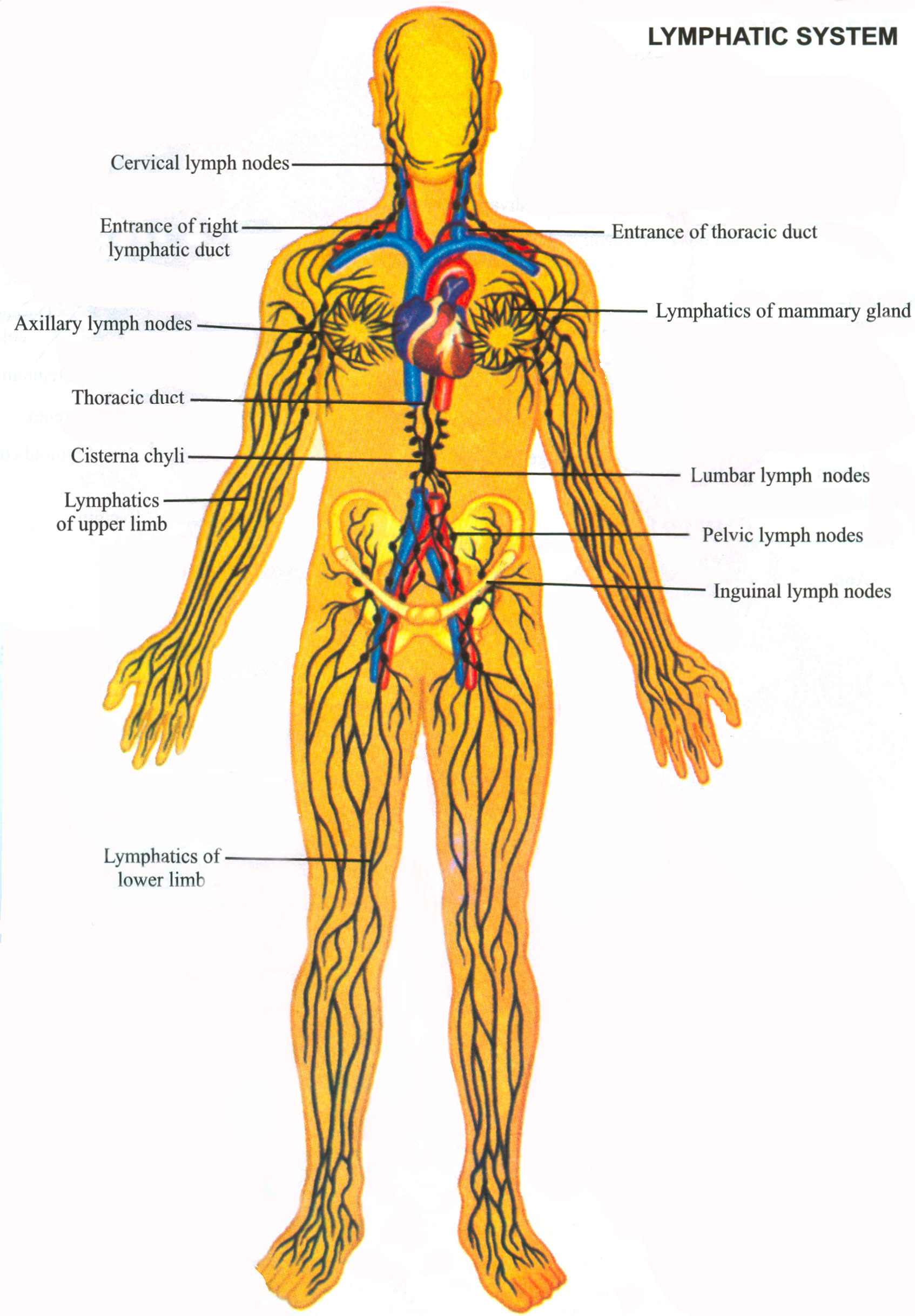 сосудов, собирающих лимфу (См. Лимфа) из тканей и органов и отводящих её в венозную систему у позвоночных животных и человека; в Л. с. входят и Лимфатические узлы («железы»), расположенные по ходу сосудов. Л … Большая советская энциклопедия
сосудов, собирающих лимфу (См. Лимфа) из тканей и органов и отводящих её в венозную систему у позвоночных животных и человека; в Л. с. входят и Лимфатические узлы («железы»), расположенные по ходу сосудов. Л … Большая советская энциклопедия Фотографический атлас. Учебное пособие. В 3 томах. Том 2. Сердечно-сосудистая система. Лимфатическая система, Борзяк Эдуард Иванович, Гунтер фон Хагенс, Путалова Ирина Николаевна. В предлагаемом атласе не красочные схемы и рисунки строения тела человека, в основном далекие от действительности, а фотографии натуральных анатомических препаратов, демонстрирующие истинные… Подробнее Купить за 2815 грн (только Украина)
Фотографический атлас. Учебное пособие. В 3 томах. Том 2. Сердечно-сосудистая система. Лимфатическая система, Борзяк Эдуард Иванович, Гунтер фон Хагенс, Путалова Ирина Николаевна. В предлагаемом атласе не красочные схемы и рисунки строения тела человека, в основном далекие от действительности, а фотографии натуральных анатомических препаратов, демонстрирующие истинные… Подробнее Купить за 2815 грн (только Украина)