Как образуются положительно отрицательно заряженные ионы: как образуются положительно и отрицательно заряженные ионы?
Список положительных и отрицательных ионов — Наука и Техника — Каталог статей
Каждый из элементов периодической таблицы способен образовывать ион. Ионы — это атомы, которые имеют положительный или отрицательный заряд и участвуют в процессе ионной связи, чтобы образовать соединение. Не все соединения являются ионными, но все атомы способны образовывать ион.
Формирование ионов
Все атомы содержат компоненты, называемые субатомными частицами. Нейтроны — это нейтральные частицы, которые находятся в ядре атома вместе с положительно заряженными протонами. Количество протонов определяет идентичность элементов атома, а нейтроны помогают определить конкретный изотоп атома. Электроны заряжены отрицательно и свободно вращаются вокруг ядра на трехмерных орбиталях. Способность электронов перемещаться по орбиталям и прыгать от атома к атому способствует процессу образования ионов. Атомы отдают электроны другим атомам, образуя положительно заряженные ионы, называемые катионами, а атомы, которые захватывают дополнительные электроны из других атомов, образуют отрицательно заряженные ионы, называемые анионами.
Катионы
Катионы образуются из атомов металла, таких как медь, золото, серебро и натрий. Это составляет около двух третей всей периодической таблицы. Потеря электронов превратит нейтральный атом в положительный, когда атом имеет большее количество протонов по сравнению с электронами, оставшимися в атоме. Металлы являются отличными проводниками электричества благодаря тому, что электроны легко перемещаются от одного атома к другому, неся электрическую энергию вместе с ними. Металлы можно найти в группах с 1 по 16 в периодической таблице. Все металлы в первой группе образуют катионы с зарядом +1, металлы в группах от 2 до 12 и группе 16 образуют катионы с зарядом +2, металлы в группах тринадцатой и пятнадцатой образуют катион +3, а металлы, расположенные в группе 14, образуют +4 катиона.
АнионыАнионы образуются из неметаллических элементов периодической таблицы, таких как кислород, сера и углерод. Эти элементы находятся в группах с 13 по 17, и каждый из них получает электроны от других атомов в процессе ионной связи. Это усиление приводит к большему количеству отрицательно заряженных электронов, чем положительно заряженных протонов в ранее нейтральном атоме. Они не проводят электричество. Неметаллы в группах 13 и 15 каждая образуют катион -3, в то время как неметаллы в группе 14 образуют анионы с зарядом -4. Неметаллы группы 16 образуют анионы с -2 зарядами, а галогены группы 17 каждый образуют -1 заряженный анион.
Это усиление приводит к большему количеству отрицательно заряженных электронов, чем положительно заряженных протонов в ранее нейтральном атоме. Они не проводят электричество. Неметаллы в группах 13 и 15 каждая образуют катион -3, в то время как неметаллы в группе 14 образуют анионы с зарядом -4. Неметаллы группы 16 образуют анионы с -2 зарядами, а галогены группы 17 каждый образуют -1 заряженный анион.
ИОНЫ — это… Что такое ИОНЫ?
ИОНЫ — (от греч. ion идущий,странствующий), атомы или хим. радикалы, несущие электрические заряды. И с т о р и я. Как установил впервые Фарадей (Faraday), проведение электрического тока в растворах связано с передвижением материальных частиц, несущих… … Большая медицинская энциклопедия
ионы — – электрически заряженные атомы или молекулы. Общая химия : учебник / А. В. Жолнин [1] Ионы – электрически заряженные частицы, возникающие при потере или присоединении электронов атомами, молекулами и радикалами. Словарь по аналитической химии… … Химические термины
Словарь по аналитической химии… … Химические термины
ИОНЫ — Продукты разложения какого либо тела при посредстве электролиза. Словарь иностранных слов, вошедших в состав русского языка. Чудинов А.Н., 1910 … Словарь иностранных слов русского языка
ионы — (от греч. iōn идущий), заряженные частицы, образующиеся из атома (молекулы) в результате потери или присоединения одного или нескольких электронов. В растворах положительно заряженные ионы называются катионами, отрицательно заряженные ионы … … Энциклопедический словарь
Ионы — Ион (греч. ιόν «идущий») электрически заряженная частица (атом, молекула), образующаяся, обычно[1], в результате потери или присоединения одного или нескольких электронов атомами или молекулами. Заряд иона кратен заряду электрона. Понятие и… … Википедия
Ионы — [ions] (от греческого ion идущий) электрически заряженные частицы, образующиеся при потере или присоединении электронов (или других заряженных частиц) атомами или группами атомов (молекулы, радикалы и др. ). Понятие и термин ионы ввел в 1834 г.… … Энциклопедический словарь по металлургии
). Понятие и термин ионы ввел в 1834 г.… … Энциклопедический словарь по металлургии
ИОНЫ — (от греч. идущий), одноатомные или многоатомные частицы, несущие электрич. заряд, напр. Н +, Li+, Аl3+, Nh5+, F , SO42 . Положительные И. называют катионами (от греч. kation, буквально идущий вниз), отрицательные а н и о н а м и (от греч. anion,… … Химическая энциклопедия
Ионы — (от греч. ión идущий) электрически заряженные частицы, образующиеся при потере или присоединении электронов (или других заряженных частиц) атомами или группами атомов. Такими группами атомов могут быть молекулы, радикалы или другие И.… … Большая советская энциклопедия
ионы — физ. частицы, несущие положительный или отрицательный заряд. Положительно заряженные ионы несут меньше электронов, чем положено , а отрицательные больше … Универсальный дополнительный практический толковый словарь И. Мостицкого
Ионы — (физ.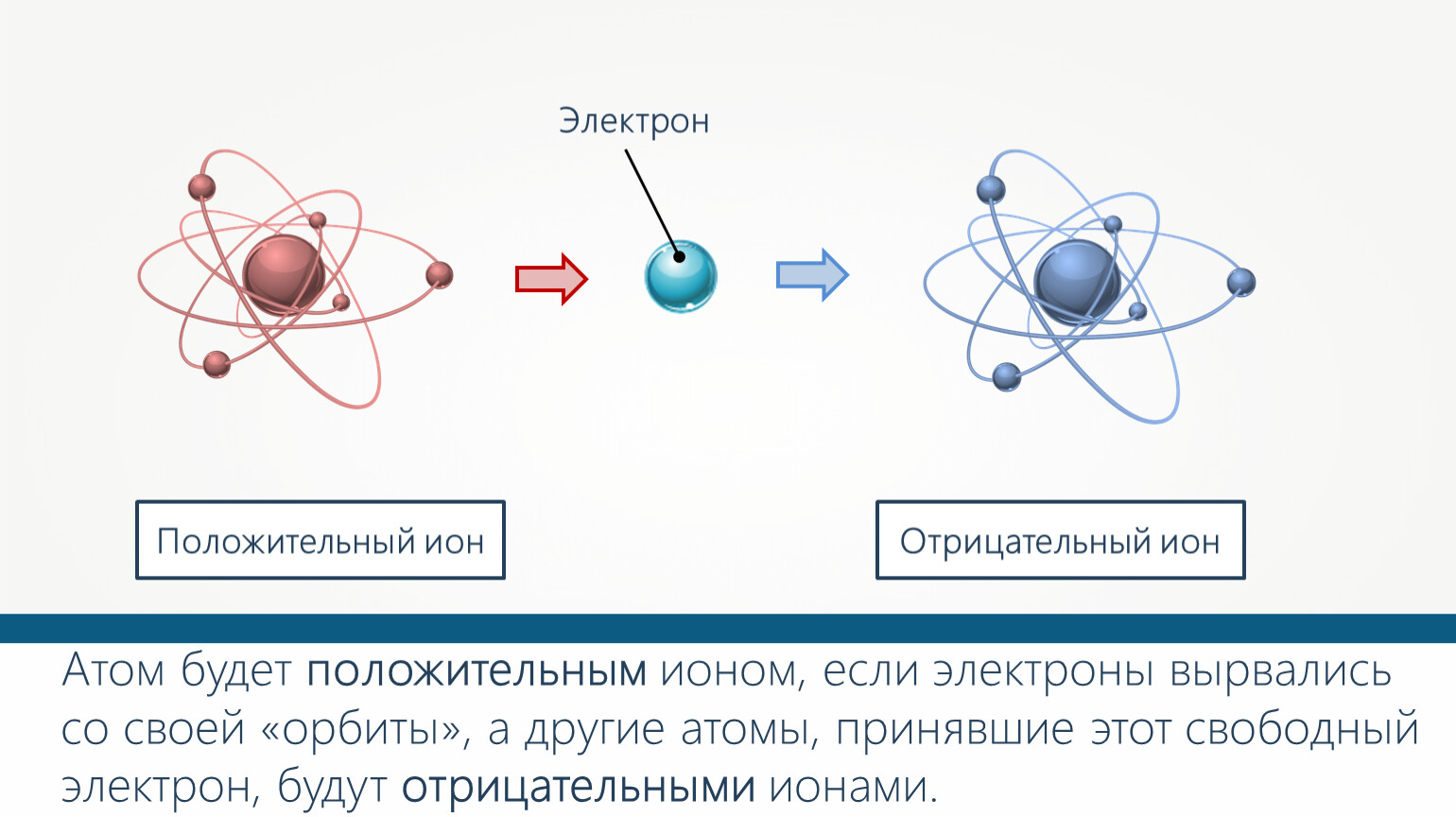 ) По терминологии, введенной в учение об электричестве знаменитым Фарадеем, тело, подвергающееся разложению действием на него гальванического тока, называется электролитом, разложение таким путем электролизом, а продукты разложения ионами.… … Энциклопедический словарь Ф.А. Брокгауза и И.А. Ефрона
) По терминологии, введенной в учение об электричестве знаменитым Фарадеем, тело, подвергающееся разложению действием на него гальванического тока, называется электролитом, разложение таким путем электролизом, а продукты разложения ионами.… … Энциклопедический словарь Ф.А. Брокгауза и И.А. Ефрона
Ионизация — все статьи и новости
Ионизация — образование положительных и отрицательных ионов, а также свободных электронов из электрически нейтральных атомов и молекул. Этот процесс относится к типу эндотермической реакции, при которой происходит поглощение теплоты.
При ионизации образуется положительно заряженный ион, если электрон в атоме или молекуле получает достаточную энергию для преодоления потенциального барьера, равную ионизационному потенциалу. Отрицательно заряженный ион образуется при захвате дополнительного электрона атомом с высвобождением энергии. В продуктах данной реакции содержится больше энергии, чем в исходных компонентах.
Можно выделить несколько типов ионизации, таких как столкновительная (ударная), фотоионизация, термическая ионизация и ионизация лазерным излучением. В процессе столкновительной ионизации происходит столкновение свободного электрона с невозбуждёнными или возбужденными атомами или молекулами. Данный процесс является важнейшим механизмом при ионизации в газах и плазме. При фотоионизации происходит ионизация молекул и атомов под действием света. Термическая ионизация происходит при достаточно высокой температуре, когда велика энергия теплового движения атомов или молекул. В этом случае частицы могут ионизовать друг друга при взаимных ударах без участия других частиц извне. В качестве примера можно привести термическую ионизацию при нагревании газа. Для ионизации лазерным излучением необходимо достаточное количество частоты лазерного излучения, чтобы поглощение одного фотона вызвало ионизацию. В этом случае требуется высокая плотность потока фотонов в лазерном пучке, чтобы произвести многофотонную ионизацию, которая осуществляется при помощи одновременного поглощения нескольких фотонов.
В процессе столкновительной ионизации происходит столкновение свободного электрона с невозбуждёнными или возбужденными атомами или молекулами. Данный процесс является важнейшим механизмом при ионизации в газах и плазме. При фотоионизации происходит ионизация молекул и атомов под действием света. Термическая ионизация происходит при достаточно высокой температуре, когда велика энергия теплового движения атомов или молекул. В этом случае частицы могут ионизовать друг друга при взаимных ударах без участия других частиц извне. В качестве примера можно привести термическую ионизацию при нагревании газа. Для ионизации лазерным излучением необходимо достаточное количество частоты лазерного излучения, чтобы поглощение одного фотона вызвало ионизацию. В этом случае требуется высокая плотность потока фотонов в лазерном пучке, чтобы произвести многофотонную ионизацию, которая осуществляется при помощи одновременного поглощения нескольких фотонов.
Также различают процесс ионизации в электролитах и в газах.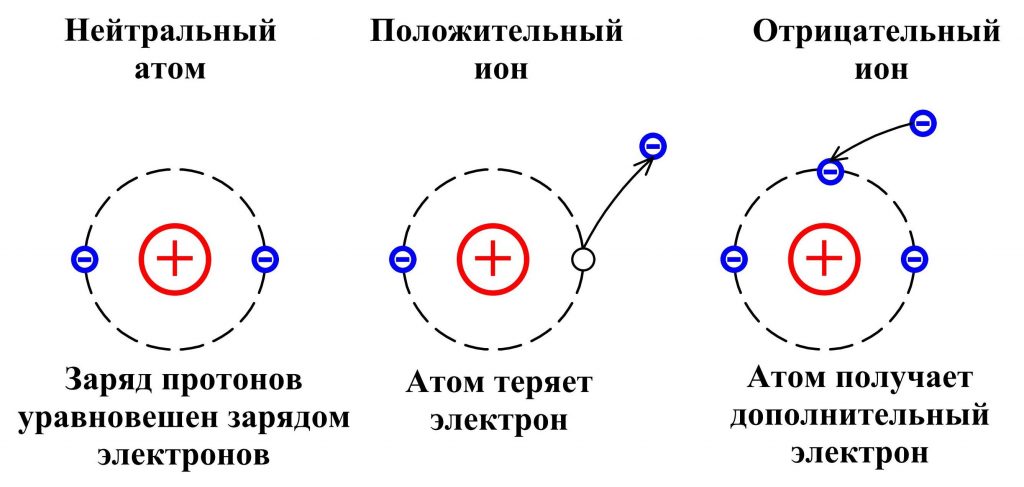 Ионизация в электролитах — веществах, которые обладают ионной проводимостью — происходит в процессе распада электролита на ионы под действием растворителя. Такой процесс называют электролитической диссоциацией. Ионизация в газах осуществляется в результате отрыва от атома или молекулы одного или нескольких электронов под влиянием внешних воздействий. Энергия, необходимая для отрыва электрона, называется энергией ионизации.
Ионизация в электролитах — веществах, которые обладают ионной проводимостью — происходит в процессе распада электролита на ионы под действием растворителя. Такой процесс называют электролитической диссоциацией. Ионизация в газах осуществляется в результате отрыва от атома или молекулы одного или нескольких электронов под влиянием внешних воздействий. Энергия, необходимая для отрыва электрона, называется энергией ионизации.
Также существует понятие «степени ионизации» — отношение числа ионов к числу нейтральных частиц в единице объема.
Стоит отметить, что при ионизации самих ионов увеличивается их разряд.
Кислоты при диссоциации образуют положительно заряженный ион водорода и отрицательно заряженный кислотный остаток.
Кислоты при диссоциации образуют положительно заряженный ион водорода и отрицательно заряженный кислотный остаток. Серная кислота (H 2S0 4) распадается на два положительно заряженных иона водорода (2Н+) и кислотный остаток — анион (S0 4 —), обладающий двумя отрицательными зарядами. K+-fOH~). Положительные и отрицательные ионы, образующиеся при растворении в воде солей, кислот и оснований, переносят через раствор электрический ток.
K+-fOH~). Положительные и отрицательные ионы, образующиеся при растворении в воде солей, кислот и оснований, переносят через раствор электрический ток.
Если в раствор, содержащий ионы, поместить две металлические пластинки и подключить к ним постоянный ток от аккумулятора, то положительные ионы — катионы — сразу же начнут передвигаться к отрицательному электроду, который называется катодом, а отрицательные ионы — анионы — направятся к положительному полюсу — аноду. Находящиеся у электрода анионы отдадут ему свои отрицательные заряды — электроны (е) — и разрядятся.
Чтобы получить много ионов, недостаточно растворить много вещества. Необходимо, чтобы взятая соль, кислота или основание хорошо распадались на ионы, то-есть хорошо диссоциировали.
Отношение числа распавшихся молекул к общему числу растворенных молекул называется степенью диссоциации. Чем меньше степень диссоциации, тем хуже электропроводность раствора.
К соединениям, обладающим плохой электропроводностью, относится дистиллированная вода. Подсчитано, что из 10 миллионов молекул воды на ионы распадается
Water and Mineral Acquisition | Protocol (Translated to Russian)
34.11: Получение воды и минералов
Специализированные ткани корней растений эволюционировали для захвата воды, минералов и некоторых ионов из почвы. У корней есть множество паттернов ветвления, которые облегчают этот процесс. Самые внешние корневые клетки имеют специализированные структуры, называемые корневыми волосками, которые увеличивают поверхность корня, тем самым увеличивая контакт с почвой. Вода может пассивно проникать в корни, так как концентрация воды в почве выше, чем в ткани корня. Минералы же, напротив, активно транспортируются в клетки корня.
Почва имеет отрицательный заряд, поэтому положительные ионы, как правило, остаются прикрепленными к частицам почвы. Чтобы избежать этого, корни закачивают в почву углекислый газ, который самопроизвольно разрушается, выделяя в почву положительно заряженные протоны (H + ). Эти протоны вытесняют связанные с почвой положительно заряженные ионы, которые можно перекачивать в ткань корня, этот процесс называется катионным обменом. Отрицательно заряженные анионы используют тенденцию ионов H + диффундировать вниз по градиенту их концентрации и обратно в клетки корня с помощью совместного транспорта: ионы, подобные Cl-, котранспортируются в ткань корня вместе с H + ионы.
Молекулы могут проникать в сердцевину корневой ткани, называемую стелой, двумя путями. Апопластический транспорт — это движение молекул в пространствах, созданных между непрерывными клеточными стенками соседних клеток и их соответствующими мембранами. Напротив, симпластический транспорт — это движение молекул через цитоплазму растительных клеток, которое использует клеточные соединения, называемые плазмодесмами, которые обеспечивают свободный цитоплазматический проход молекул между соседними клетками.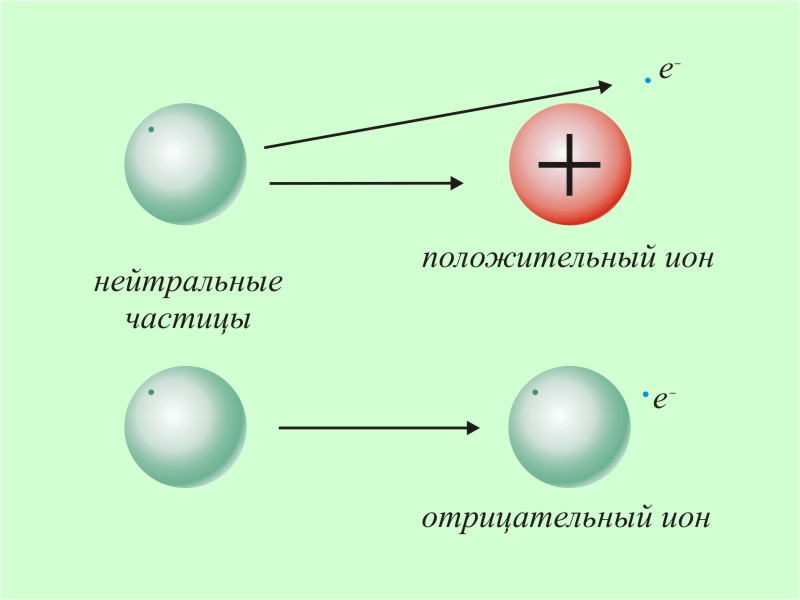 Чтобы попасть в стелу, молекулы должны переместиться в симпласт, поскольку полоски Каспария, расположенные в энтодерме корня, предотвращают попадание растворенных веществ в апопласт в стелу. Следовательно, чтобы попасть в симпласт, растворенные вещества должны пройти через полупроницаемую мембрану клетки, защищая клетки от токсичных или нежелательных молекул почвы.
Чтобы попасть в стелу, молекулы должны переместиться в симпласт, поскольку полоски Каспария, расположенные в энтодерме корня, предотвращают попадание растворенных веществ в апопласт в стелу. Следовательно, чтобы попасть в симпласт, растворенные вещества должны пройти через полупроницаемую мембрану клетки, защищая клетки от токсичных или нежелательных молекул почвы.
Литература для дополнительного чтения
Barberon, Marie, and Niko Geldner. «Radial Transport of Nutrients: The Plant Root as a Polarized Epithelium.» Plant Physiology 166, no. 2 (October 1, 2014): 528–37. [Source]
Kim YX, Ranathunge K, Lee S, Lee Y, Lee D, Sung J. «Composite Transport Model and Water and Solute Transport across Plant Roots: An Update.» Front Plant Sci. 2018 Feb 16;9:193. [Source]
Ионы. Ионизация воздуха.
Множество полезных веществ человек получает из пищи и воды, — витаминов, минералов, белков жиров. Но это лишь часть тех ресурсов, что нам нужны для жизни. Колоссальные объёмы энергии человек получает именно в процессе дыхания. Дыхание, это, казалось бы, элементарное действие – сложнейший механизм, покрывающий более 70% всех наших энергетических потребностей. Не удивительно, что без пищи мы можем прожить дольше, чем без воздуха.
Но это лишь часть тех ресурсов, что нам нужны для жизни. Колоссальные объёмы энергии человек получает именно в процессе дыхания. Дыхание, это, казалось бы, элементарное действие – сложнейший механизм, покрывающий более 70% всех наших энергетических потребностей. Не удивительно, что без пищи мы можем прожить дольше, чем без воздуха.
Следовательно, о качестве воздуха важно заботится. Воздух в городах и мегаполисах естественно будет отличаться от чистого воздуха заповедников, лесов и гор. И это отличие не только механическое в виде примесей и загрязнение, отличается само строение, в природной среде воздух природно ионизирован.
Воздух несет в себе частицы с разными зарядами. Это положительно, нейтрально и отрицательно заряженные атомы.
Когда под воздействием разных сил молекула теряет один электрон и количество протонов и электронов становится неравным, мы получаем положительно заряженный ион. При захвате молекулой дополнительного электрона образуется отрицательно заряженный ион с высвобождением энергии.
Наиболее благоприятными и полезными для дыхания человека считаются легкие отрицательно заряженные ионы – отдельные молекулы с отрицательным зарядом. В случае, когда легкие ионы – отдельные молекулы, прикрепляются к частичкам пыли и смога они становятся тяжелыми ионами. Они могут иметь как положительный так и отрицательный заряд, но для человека вредны.
И конечно можно предположить, что в естественной природной среде гораздо меньше частиц смога, нежели в условиях города. В урбанистической среде не только выше концентрация вредных выбросов, но и огромное количество искусственных поверхностей, наполняющих воздух мельчайшими частицами пыли. В помещении к этому прибавляется электромагнитные излучение от телевизоров, компьютеров, прочей бытовой техники, да и сам человек является постоянным источником тяжелых ионов. А вот процессов природных ионизаторов здесь меньше.
Наш воздух подвергается ионизации в следствии разных природных явлений, например под воздействием космического излучения на поверхность моря, особые свойства некоторых растений или молнии. Можно вспомнить ту особую свежесть и легкость воздуха после грозы, когда воздух наполнен ионами.
Можно вспомнить ту особую свежесть и легкость воздуха после грозы, когда воздух наполнен ионами.
Существенно повысить ионизацию в воздухе способны некоторые растения. Это белая акация Robinia Pseudoacacia, Дуб красный Quercus rubra и черешчатый Quercus robur, пихта кавказская Abies nordmaniana, лиственница сибирская Larix sibirica, клен красный Acer rubrum, рябина обыкновенная Sorbus aucuparia, различные виды можжевельника Juniperus.
Эти габаритные растения безусловно могут привнести в сад многое, ведь они не только полезны, но и весьма декоративны. Однако это применимо исключительно для сада. В зимнее время их свойства ионизации приостанавливаются, да и мы больше времени проводим в помещениях в это время. А значит для дома стоит применять и другие методы. Существуют разнообразные ионизаторы воздуха, которые различаются по объему, способу ионизации а главное характеристикам ионизированного воздуха. Существуют модели продуцирующие в массе только отрицательно заряженные частицы, а есть варианты производящие и отрицательно и положительно заряженные ионы.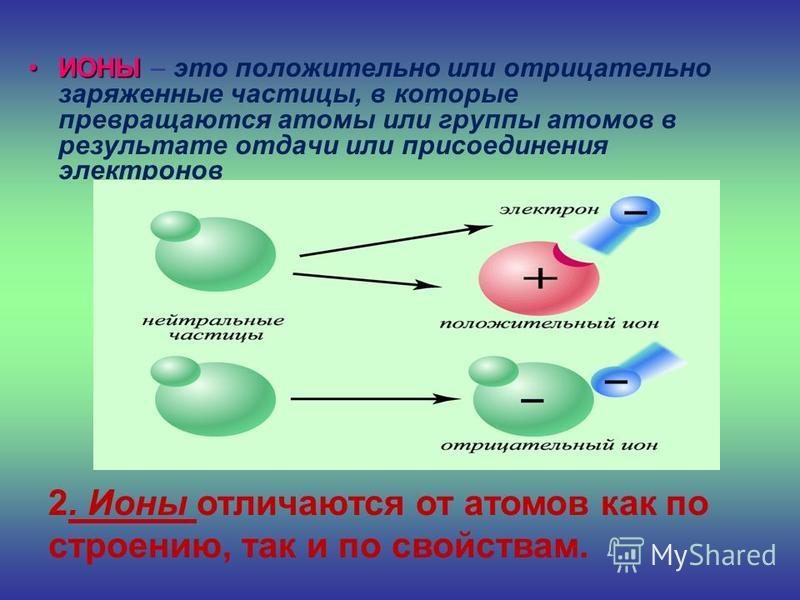 Это объясняется тем, что помимо полезных для человека отрицательных ионов, положительные проще присоединяются к частицам в воздухе и оседают на вертикальных и горизонтальных поверхностях, откуда их проще убрать.
Это объясняется тем, что помимо полезных для человека отрицательных ионов, положительные проще присоединяются к частицам в воздухе и оседают на вертикальных и горизонтальных поверхностях, откуда их проще убрать.
Хотя не существует стопроцентно доказанного влияния ионизированного воздуха, но исследования выявили четкую закономерность того что ионизированный воздух улучшает качество сна, повышает работоспособность и концентрацию, подымает иммунитет, ускоряет метаболизм, что в целом улучшает качество жизни, облегчает течение заболеваний и симптомы. Как уже было сказано положительно заряженные ионы притягивают частички пыли о быстро оседают, что помогает в уборке и очистке помещений.
Кроме положительных моментов эти же свойства ионизированного воздуха могут привносить негативные моменты в жизнь человека. Так к примеру ускорение обмена веществ может осложнить некоторые хронические заболевания, ионизированный воздух противопоказан онкобольным людям, он усложняет течение бронхиальной астмы. Не желателен такой воздух детям до года или больным в послеоперационный период. Кроме того ионизированный воздух в разы повышает скорость распространения заболеваний передающихся воздушно-капельным путем.
Не желателен такой воздух детям до года или больным в послеоперационный период. Кроме того ионизированный воздух в разы повышает скорость распространения заболеваний передающихся воздушно-капельным путем.
Так же можно упомянуть про негативное влияние озона, образовывающегося при ионизации и на технику и на человека. Хотя негативные моменты могут провялятся лишь спустя годы активного использования ионизаторов, полностью исключать их возможность не стоит. В природной среде, в вашем саду, в лесу или у моря воздух будет нести природные объемы озона, безопасные для человека. А кроме самого воздуха перебывание в природной среде дарит человеку положительные эмоции, спокойствие и душевный комфорт. Так что даже если нет возможности посещения первозданных лесов и гор, частичку природной среды возможно воссоздать у дома, подобрав не только привлекательные но и полезные растения, создав правильный микроклимат в саду с правильным настроением.
Получив образование бакалавра по специальности ландшафтный дизайн и архитектура в НАРККиИ имею значительный практический опыт. Свыше 8 лет разрабатываю и воплощаю проекты различной сложности, как небольших, так и масштабных, трудоемких объектов, в сфере частного и общественного строительства.
Свыше 8 лет разрабатываю и воплощаю проекты различной сложности, как небольших, так и масштабных, трудоемких объектов, в сфере частного и общественного строительства.
Фотоэлектрический эффект . Краткая история химии. Развитие идей и представлений в химии
Оставалось установить, существует ли какая-либо связь между электроном и атомом. Итак, электрон — это частица электричества, атом — частица вещества; и тот и другой могут быть лишенными внутренней структуры конечными частицами, совершенно независимыми друг от друга. И тем не менее мало кто сомневался в том, что какая-то связь между атомом и электроном существует.
В 80-х годах XIX в. Аррениус разработал теорию ионной диссоциации (см. гл. 9). Объясняя поведение ионов, он исходил из того, что ионы — это электрически заряженные атомы или группы атомов. В то время большинству химиков такое объяснение показалось абсурдным, но впоследствии выяснилось, что оно имеет глубокий смысл.
Если электрон присоединится к атому хлора, то при этом получится атом хлора, несущий единичный отрицательный заряд, т. е. образуется ион хлора (хлорид-ион). Если к группе атомов, состоящей из атома серы и четырех атомов кислорода, присоединятся два электрона, то в результате получится сульфат-ион, несущий двойной отрицательный заряд, и т. д. Таким образом можно легко объяснить причины образования всех отрицательно заряженных ионов.
Но как образуются положительно заряженные ионы, например ион натрия? Ион натрия — это атом натрия, несущий единичный положительный заряд. Никакими данными о существовании положительно заряженной частицы, аналогичной электрону, исследователи того времени не располагали. Поэтому оставалось допустить, что положительный заряд может создаваться в результате ухода одного или двух электронов из атома. Иными словами, эти один или два электрона должны быть как бы частью самого атома!
Это допущение нарушало все привычные представления, и тем не менее оно было, как показал в 1888 г.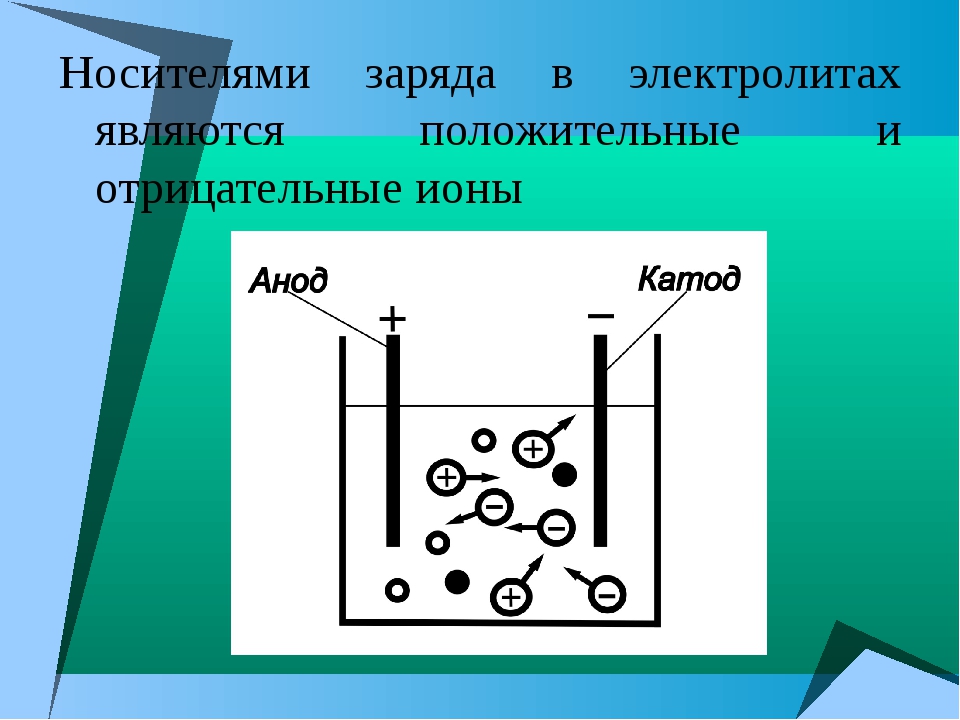 немецкий физик Генрих Рудольф Герц (1857—1894), вполне вероятным.
немецкий физик Генрих Рудольф Герц (1857—1894), вполне вероятным.
В 1886—1887 гг. Герц, пропуская электрическую искру через воздушный зазор между двумя электродами (так называемый искровой промежуток), обнаружил, что при облучении катода ультрафиолетовым светом искра возникала легче. Это и другие подобные явления, наблюдаемые при освещении металлов светом, как было установлено впоследствии, обусловлены фотоэлектрическим эффектом[112].
В 1902 г. немецкий физик Филипп Эдуард Антон Ленард (1862—1947), работавший раньше ассистентом в лаборатории Герца, показал, что фотоэлектрический эффект вызывается эмиссией электронов из металла.
Фотоэлектрический эффект характерен для многих металлов, причем металлы испускают электроны под действием света даже в отсутствие электрического тока или электрического заряда в непосредственной близости от них. Этот факт дал повод предполагать, что атомы металлов (а возможно, и атомы вообще) содержат электроны.
Однако в обычном состоянии атомы не несут электрического заряда. Поэтому если атомы содержат отрицательно заряженные электроны, они должны содержать и положительно заряженные частицы, чей положительный заряд компенсирует отрицательный заряд электронов. Ленард полагал, что атомы могут представлять собой скопление как отрицательно, так и положительно заряженных частиц, различающихся только зарядом. Такое предположение казалось совершенно невероятным — почему в таком случае атом никогда не испускает положительно заряженных частиц? И почему он всегда испускает электроны и только электроны?
Пытаясь решить этот вопрос, Дж. Дж. Томсон предположил, что атом представляет собой твердый шар из положительно заряженного вещества, в который, как изюминки в пироге, вкраплены отрицательно заряженные электроны. В обычном атоме отрицательный заряд электронов полностью нейтрализован положительным зарядом самого атома. В результате присоединения дополнительных электронов атом получает отрицательный заряд, а в результате потери нескольких первоначальных электронов — положительный. Однако это представление Томсона поддержки не получило. Хотя положительно заряженные частицы, адекватные электронам, в первые десятилетия XX в. оставались неизвестными, положительно заряженные частицы, правда другого вида, открыты были.
Однако это представление Томсона поддержки не получило. Хотя положительно заряженные частицы, адекватные электронам, в первые десятилетия XX в. оставались неизвестными, положительно заряженные частицы, правда другого вида, открыты были.
В 1886 г. Гольдштейн проводил эксперименты с решетчатым катодом в вакуумной трубке. Он нашел, что в то время, как катодные лучи распространяются только в одном направлении — к аноду, через отверстия в катоде проходят другие лучи, которые распространяются в обратном направлении.
Поскольку направление распространения этих лучей обратно направлению распространения отрицательно заряженных катодных лучей, то вполне возможно, что они состоят из положительно заряженных частиц. Гипотеза подтвердилась, когда удалось определить, как эти лучи отклоняются магнитным полем. В 1907 г. Дж. Дж. Томсон предложил называть их положительно заряженными лучами.
Эти лучи отличались от электронов не только зарядом. Все электроны имеют одну и ту же массу, равную 1/1837 массы водорода — самого легкого атома; частицы положительно заряженных лучей различались по массе в зависимости от того, следы каких газов содержались в вакуумной трубке, а массы частиц, положительно заряженных лучей были такими же, как и массы атомов. Масса самой легкой частицы равнялась массе атома водорода.
Масса самой легкой частицы равнялась массе атома водорода.
Английский физик (уроженец Новой Зеландии) Эрнест Резерфорд (1871—1937) решил, наконец, признать, что единица положительного заряда принципиально отличается от электрона — единицы отрицательного заряда. В 1914 г. Резерфорд предложил принять в качестве основной единицы положительного заряда частицу положительно заряженных лучей с наименьшей массой, равной массе атома водорода. Когда, уже позднее, Резерфорд занялся изучением ядерных реакций (см. гл. 14), он сам неоднократно получал частицы, идентичные ядру водорода, что окончательно убедило его в правильности такой точки зрения. В 1920 г. Резерфорд предложил назвать эту основную положительно заряженную частицу протоном.
Формирование ионов — Ионные соединения — Eduqas — GCSE Chemistry (Single Science) Revision — Eduqas
ycakj8bjle.0.0.0.1:0.1.0.$0.$1.$0″> Ион — это атом или группа атомов с положительным или отрицательным зарядом. Ионы образуются, когда атомы теряют или приобретают электроны для получения полной внешней оболочки:- атомов металла теряют электроны, образуя положительно заряженные ионы
- Атомы неметаллов получают электроны, образуя отрицательно заряженные ионы
Формируя положительные ионы
Атомы металлов теряют электроны из своей внешней оболочки, когда они образуют ионы:
- образованные ионы являются положительными, потому что у них больше протонов, чем электронов ycakj8bjle.0.0.0.1:0.1.0.$0.$2.$2.$1″> образованные ионы имеют полные внешние оболочки
- для элементов в группах 1, 2 и 3, число Количество потерянных электронов совпадает с номером группы
Формирование отрицательных ионов
Внешние оболочки атомов неметаллов получают электроны, когда они образуют ионы:
- образованные ионы отрицательны, потому что у них больше электронов, чем протонов
- образованные ионы имеют полные внешние оболочки
- для групп 6 и 7, количество электронов gai ned равно: 8 — номер группы
| Группа | Элемент | Заряд иона | Символ иона |
|---|---|---|---|
| $0″> 1 | Na | 1+ | Na + |
| 2 | Mg | 2+ | Mg 2+ |
| ycakj8bjle.0.0.0.1:0.1.0.$0.$3.$5.$2.$2.$0″> 3 | Al | 3+ | Al 3+ |
| 6 | O | 2- | O 2- |
| 7 | Cl | 1- | Cl — |
Число протонов , нейтроны и электроны в ионе могут быть рассчитаны по его атомному номеру, массовому числу и ионному заряду.
Помните, что:
- атомный номер дает количество протонов
- массовое число дает общее количество протонов + нейтроны ycakj8bjle.0.0.0.1:0.1.0.$0.$3.$8.$2″> количество электронов = количество протонов (если атом нейтрален)
- положительных иона потеряно электронов
- отрицательных ионов приобрели электроны
| Название иона | Символ иона | Атомный номер | 1.0.$0.$3.$9.$1.$0.$3″> Масса нет. | Протоны | Нейтроны | Электроны |
|---|---|---|---|---|---|---|
| Алюминий | Al 3+ | 13 | 27 | 13 | ycakj8bjle.0.0.0.1:0.1.0.$0.$3.$9.$2.$0.$5″> 14 | 10 |
| Кальций | Кальций | 20 | 40 | 20 | 20 | 18 |
| ycakj8bjle.0.0.0.1:0.1.0.$0.$3.$9.$2.$2.$0″> Сульфид | S 2- | 16 | 32 | 16 | 16 | 18 |
С.№ | Имя | Формула | Наличие ионов |
1 | Натрия хлорид | NaCl | Na + и Cl — |
| 2 | Калия хлорид | KCl | K + и класс — |
3 | Хлорид аммония | NH 4 Класс | NH 4 + и Cl — |
4 | Хлорид магния | MgCl 2 | мг 2+ и Cl — |
| 5 | Хлорид кальция | CaCl 2 | Ca 2+ и Cl — |
| 6 | Оксид магния | MgO | Mg 2+ и O 2– |
| 7 | Оксид кальция | CaO | Ca 2+ и O 2– |
| 8 | Оксид алюминия | Al 2 O 3 | Al 3+ и O 2– |
| 9 | Натрия гидроксид | NaOH | Na + и OH — |
| 10 | Сульфат меди | CuSO 4 | Cu 2+ и SO 4 2– |
| 11 | Нитрат кальция | Ca (НЕТ 3 ) 2 | Ca 2+ и NO 3 — |
Химические связи — анатомия и физиология
Цели обучения
К концу этого раздела вы сможете:
- Объясните связь между молекулами и соединениями
- Различают ионы, катионы и анионы
- Определите ключевое различие между ионными и ковалентными связями
- Различают неполярные и полярные ковалентные связи
- Объясните, как молекулы воды связываются водородными связями
Атомы, разделенные большим расстоянием, не могут связываться; скорее, они должны подойти достаточно близко, чтобы электроны в их валентных оболочках могли взаимодействовать.Но действительно ли атомы касаются друг друга? Большинство физиков сказали бы нет, потому что отрицательно заряженные электроны в их валентных оболочках отталкиваются друг от друга. Никакая сила внутри человеческого тела — или где-либо в мире природы — не достаточно сильна, чтобы преодолеть это электрическое отталкивание. Поэтому, когда вы читаете об атомах, которые соединяются или сталкиваются, имейте в виду, что атомы не сливаются в физическом смысле.
Вместо этого атомы соединяются, образуя химическую связь. Связь — это слабое или сильное электрическое притяжение, которое удерживает атомы в одном месте.Новая группа обычно более стабильна — с меньшей вероятностью снова вступит в реакцию — чем составляющие ее атомы, когда они были разделены. Более или менее стабильная группа из двух или более атомов, удерживаемых вместе химическими связями, называется молекулой. Связанные атомы могут быть одного и того же элемента, как в случае H 2 , который называется молекулярным водородом или газообразным водородом. Когда молекула состоит из двух или более атомов разных элементов, она называется химическим соединением. Таким образом, единица воды или H 2 O представляет собой соединение, как и отдельная молекула газового метана, или CH 4 .
Три типа химических связей важны в физиологии человека, потому что они удерживают вместе вещества, которые используются организмом для критических аспектов гомеостаза, передачи сигналов и производства энергии, и это всего лишь несколько важных процессов. Это ионные связи, ковалентные связи и водородные связи.
Ионы и ионные связи
Напомним, что в атоме обычно одинаковое количество положительно заряженных протонов и отрицательно заряженных электронов. Пока сохраняется эта ситуация, атом электрически нейтрален.Но когда атом участвует в химической реакции, которая приводит к передаче или принятию одного или нескольких электронов, атом становится положительно или отрицательно заряженным. Это часто случается с большинством атомов, чтобы иметь полную валентную оболочку, как описано ранее. Это может происходить либо путем получения электронов для заполнения оболочки, заполненной более чем наполовину, либо путем передачи электронов для опустошения оболочки, заполненной менее чем наполовину, тем самым оставляя следующую меньшую электронную оболочку в качестве новой, полной валентности. оболочка.Атом, имеющий электрический заряд — положительный или отрицательный — является ионом.
Посетите этот веб-сайт, чтобы узнать об электрической энергии и притяжении / отталкивании зарядов. Что происходит с заряженным электроскопом, когда проводник перемещается между пластиковыми пластинами и почему?
Калий (K), например, является важным элементом во всех клетках организма. Его атомный номер 19. В валентной оболочке всего один электрон. Эта характеристика делает калий весьма вероятным для участия в химических реакциях, в которых он отдает один электрон.(Калию легче отдать один электрон, чем получить семь электронов.) Потеря приведет к тому, что положительный заряд протонов калия будет иметь большее влияние, чем отрицательный заряд электронов калия. Другими словами, полученный ион калия будет слегка положительным. Ион калия записан K + , что указывает на то, что он потерял один электрон. Положительно заряженный ион известен как катион.
Теперь рассмотрим фтор (F), компонент костей и зубов.Его атомный номер девять, и он имеет семь электронов в валентной оболочке. Таким образом, высока вероятность связывания с другими атомами таким образом, что фтор принимает один электрон (фтору легче получить один электрон, чем отдать семь электронов). Когда это произойдет, количество его электронов будет на единицу больше, чем протонов, и у него будет общий отрицательный заряд. Ионизированная форма фтора называется фторидом и обозначается как F —. Отрицательно заряженный ион известен как анион.
Атомы, которые должны отдать или принять более одного электрона, в конечном итоге будут иметь более сильный положительный или отрицательный заряд.Катион, который подарил два электрона, имеет чистый заряд +2. На примере магния (Mg) это можно записать как Mg ++ или Mg 2+ . Анион, который принял два электрона, имеет чистый заряд –2. Ионная форма селена (Se), например, обычно обозначается как Se 2–.
Противоположные заряды катионов и анионов создают умеренно сильное взаимное притяжение, которое удерживает атомы в непосредственной близости, образуя ионную связь. Ионная связь — это постоянная тесная связь между ионами противоположного заряда.Поваренная соль, которую вы добавляете в пищу, обязана своим существованием ионной связи. Как показано на (Рисунок), натрий обычно отдает электрон хлору, превращаясь в катион Na + . Когда хлор принимает электрон, он становится хлорид-анионом, Cl —. Обладая противоположными зарядами, эти два иона сильно притягиваются друг к другу.
Ионное связывание
(a) Натрий легко отдает одиночный электрон в своей валентной оболочке хлору, которому нужен только один электрон, чтобы иметь полную валентную оболочку.(b) Противоположные электрические заряды образующихся катиона натрия и аниона хлорида приводят к образованию связи притяжения, называемой ионной связью. (c) Привлечение большого количества ионов натрия и хлора приводит к образованию больших групп, называемых кристаллами.
Вода — важный компонент жизни, потому что она способна разорвать ионные связи в солях, чтобы высвободить ионы. Фактически, в биологических жидкостях большинство отдельных атомов существует в виде ионов. Эти растворенные ионы производят электрические заряды в теле.Поведение этих ионов позволяет отслеживать работу сердца и мозга в виде волн на электрокардиограмме (ЭКГ или ЭКГ) или электроэнцефалограмме (ЭЭГ). Электрическая активность, возникающая в результате взаимодействия заряженных ионов, является причиной того, что их также называют электролитами.
Ковалентные облигации
В отличие от ионных связей, образованных притяжением между положительным зарядом катиона и отрицательным зарядом аниона, молекулы, образованные ковалентной связью, обмениваются электронами во взаимно стабилизирующем соотношении.Как и у ближайших соседей, дети которых сначала проводят в одном доме, а затем в другом, атомы не теряют и не приобретают электроны навсегда. Вместо этого электроны движутся вперед и назад между элементами. Из-за близкого распределения пар электронов (по одному электрону от каждого из двух атомов) ковалентные связи сильнее ионных.
Неполярные ковалентные связи
(рисунок) показывает несколько распространенных типов ковалентных связей. Обратите внимание, что два ковалентно связанных атома обычно разделяют только одну или две пары электронов, хотя возможны и более крупные разделения.Важная концепция, которую следует извлечь из этого, заключается в том, что в ковалентных связях электроны во внешней валентной оболочке используются совместно, чтобы заполнить валентные оболочки обоих атомов, в конечном итоге стабилизируя оба задействованных атома. В одинарной ковалентной связи один электрон используется совместно двумя атомами, в то время как в двойной ковалентной связи две пары электронов используются совместно двумя атомами. Есть даже тройные ковалентные связи, в которых разделяются три атома.
Ковалентное связывание
Вы можете видеть, что ковалентные связи, показанные на (Рисунок), сбалансированы.Доля отрицательных электронов относительно одинакова, как и электрическое притяжение положительных протонов в ядрах участвующих атомов. Вот почему ковалентно связанные молекулы, которые электрически сбалансированы таким образом, описываются как неполярные; то есть ни один участок молекулы не является более положительным или отрицательным, чем любой другой.
Полярные ковалентные связи
Авторы новостей часто называют группы законодателей, придерживающихся совершенно противоположных взглядов по тому или иному вопросу, «поляризованными».В химии полярная молекула — это молекула, которая содержит области с противоположными электрическими зарядами. Полярные молекулы возникают, когда атомы делят электроны неравномерно в полярных ковалентных связях.
Самый известный пример полярной молекулы — вода ((рисунок)). Молекула состоит из трех частей: один атом кислорода, ядро которого содержит восемь протонов, и два атома водорода, каждое из ядер которых содержит только один протон. Поскольку каждый протон обладает одинаковым положительным зарядом, ядро, содержащее восемь протонов, имеет заряд в восемь раз больше, чем ядро, содержащее один протон.Это означает, что отрицательно заряженные электроны, присутствующие в молекуле воды, сильнее притягиваются к ядру кислорода, чем к ядрам водорода. Таким образом, единственный отрицательный электрон каждого атома водорода мигрирует к атому кислорода, делая кислородный конец их связи немного более отрицательным, чем водородный конец их связи.
Полярные ковалентные связи в молекуле воды
То, что верно для связей, верно для молекулы воды в целом; то есть область кислорода имеет слегка отрицательный заряд, а области атомов водорода имеют слегка положительный заряд.Эти заряды часто называют «частичными зарядами», потому что сила заряда меньше одного полного электрона, как в ионной связи. Как показано на (Рисунок), области слабой полярности обозначены греческой буквой дельта (δ) и знаком плюс (+) или минус (-).
Хотя одна молекула воды невообразимо крошечная, у нее есть масса, и противоположные электрические заряды на молекуле притягивают эту массу таким образом, что она создает форму, напоминающую треугольную палатку (см. (Рисунок) b ).Этот диполь, с положительным зарядом на одном конце, образованном атомами водорода на «дне» палатки, и отрицательным зарядом на противоположном конце (атом кислорода на «вершине» палатки) делает заряженные области очень вероятными. взаимодействовать с заряженными областями других полярных молекул. Для физиологии человека образующаяся связь является одной из самых важных, образованных водой, — водородной связью.
Водородные связи
Водородная связь образуется, когда слабо положительный атом водорода, уже связанный с одним электроотрицательным атомом (например, кислород в молекуле воды), притягивается к другому электроотрицательному атому другой молекулы.Другими словами, водородные связи всегда включают водород, который уже является частью полярной молекулы.
Самый распространенный пример водородной связи в мире природы происходит между молекулами воды. Это происходит у вас на глазах, когда две капли дождя сливаются в большую бусину или ручей впадает в реку. Водородная связь возникает из-за того, что слабоотрицательный атом кислорода в одной молекуле воды притягивается к слабоположительным атомам водорода двух других молекул воды ((Рисунок)).
Водородные связи между молекулами воды
Обратите внимание, что связи возникают между слабо положительным зарядом атомов водорода и слабо отрицательным зарядом атомов кислорода.Водородные связи относительно слабые, поэтому обозначены пунктирной (а не сплошной) линией.
Молекулы воды также сильно притягивают другие типы заряженных молекул, а также ионы. Это объясняет, почему, например, «поваренная соль» на самом деле представляет собой молекулу, называемую в химии «солью», которая состоит из равного количества положительно заряженного натрия (Na + ) и отрицательно заряженного хлорида (Cl — ). , так легко растворяется в воде, в этом случае образуя диполь-ионные связи между водой и электрически заряженными ионами (электролитами).Молекулы воды также отталкивают молекулы с неполярными ковалентными связями, такие как жиры, липиды и масла. Вы можете продемонстрировать это с помощью простого кухонного эксперимента: налейте чайную ложку растительного масла, соединения, образованного неполярными ковалентными связями, в стакан с водой. Вместо того, чтобы мгновенно растворяться в воде, масло образует четкую гранулу, потому что полярные молекулы воды отталкивают неполярное масло.
Обзор главы
В каждый момент жизни атомы кислорода, углерода, водорода и других элементов человеческого тела создают и разрывают химические связи.Ионы — это заряженные атомы, которые образуются, когда атом отдает или принимает один или несколько отрицательно заряженных электронов. Катионы (ионы с положительным зарядом) притягиваются к анионам (ионам с отрицательным зарядом). Это притяжение называется ионной связью. В ковалентных связях участвующие атомы не теряют и не приобретают электроны, а скорее делятся ими. Молекулы с неполярными ковалентными связями электрически сбалансированы и имеют линейную трехмерную форму. Молекулы с полярными ковалентными связями имеют «полюса» — области со слабым положительным и отрицательным зарядом — и имеют трехмерную треугольную форму.Атом кислорода и два атома водорода образуют молекулы воды посредством полярных ковалентных связей. Водородные связи связывают атомы водорода, уже участвующие в полярных ковалентных связях, с анионами или электроотрицательными областями других полярных молекул. Водородные связи связывают молекулы воды, в результате чего вода приобретает важные для живых существ свойства.
Вопросы по интерактивной ссылке
Посетите этот веб-сайт, чтобы узнать об электрической энергии и притяжении / отталкивании зарядов.Что происходит с заряженным электроскопом, когда проводник перемещается между пластиковыми пластинами и почему?
Пластиковые листы прыгают на гвоздь (проводник), потому что проводник принимает электроны от электроскопа, уменьшая силу отталкивания двух листов.
Обзорные вопросы
Что из следующего является молекулой, но не соединением?
- H 2 O
- 2 H
- H 2
- H +
Молекула аммиака содержит один атом азота и три атома водорода.Они связаны с ________.
- ионные связи
- неполярные ковалентные связи
- полярные ковалентные связи
- водородные связи
Когда атом отдает электрон другому атому, он становится
- ион
- анион
- неполярный
- все вышеперечисленное
Вещество, состоящее из кристаллов равного числа катионов и анионов, удерживаемых вместе ионными связями, называется a (n) ________.
- благородный газ
- соль
- электролит
- диполь
Какое из следующих утверждений о химических связях верно?
- Ковалентные связи прочнее ионных.
- Водородные связи возникают между двумя атомами водорода.
- Связывание легко происходит между неполярными и полярными молекулами.
- Маловероятно, что молекула воды соединится с ионом.
Вопросы о критическом мышлении
Объясните, почему CH 4 — одна из наиболее распространенных молекул, встречающихся в природе.Связи между атомами ионные или ковалентные?
У атома углерода четыре электрона в валентной оболочке. Согласно правилу октетов, он будет легко участвовать в химических реакциях, в результате которых его валентная оболочка будет иметь восемь электронов. Водород с одним электроном завершит свою валентную оболочку двумя. Совместное использование электронов между атомом углерода и четырьмя атомами водорода отвечает требованиям всех атомов. Связи ковалентны, потому что электроны общие: хотя водород часто участвует в ионных связях, углерод не участвует, потому что маловероятно отдавать или принимать четыре электрона.
Однажды в спешке вы просто ополоснете посуду для обеда водой. Когда вы сушите салатник, вы замечаете, что на нем все еще есть маслянистая пленка. Почему вода была неэффективна для очистки чаши?
Вода — полярная молекула. Он имеет область слабого положительного заряда и область слабого отрицательного заряда. Эти области притягиваются как к ионам, так и к другим полярным молекулам. Масла неполярны и отталкиваются водой.
Могут ли два атома кислорода вступать в ионную связь? Почему или почему нет?
Одинаковые атомы имеют одинаковую электроотрицательность и не могут образовывать ионные связи.Кислород, например, имеет шесть электронов в валентной оболочке. Ни передача, ни принятие электронов валентной оболочки другого не приведет к тому, что атомы кислорода завершат свои валентные оболочки. Два атома одного и того же элемента всегда образуют ковалентные связи.
Глоссарий
- анион
- атом с отрицательным зарядом
- облигация
- электрическая сила, связывающая атомы
- катион
- атом с положительным зарядом
- ковалентная связь
- химическая связь, в которой два атома разделяют электроны, образуя таким образом свои валентные оболочки
- водородная связь
- диполь-дипольная связь, в которой атом водорода, ковалентно связанный с электроотрицательным атомом, слабо притягивается ко второму электроотрицательному атому
- ион
- атом с общим положительным или отрицательным зарядом
- ионная связь
- притяжение между анионом и катионом
- молекула
- два или более атома, ковалентно связанных вместе
- полярная молекула
- Молекула с областями, которые имеют противоположные заряды в результате неравномерного количества электронов в ядрах атомов, участвующих в ковалентной связи
Как в межзвездной среде образуются отрицательно заряженные молекулы — ScienceDaily
Линейные молекулы могут захватывать и связывать свободные электроны за счет взаимодействия постоянного дипольного момента.Физики Инсбрука добились лабораторного подтверждения существования дипольно-связанных состояний. Такие состояния могут образовывать промежуточный этап в создании отрицательно заряженных молекул и объяснять существование отрицательных ионов в межзвездных облаках в космосе.
Межзвездные облака — это места рождения новых звезд, но они также играют важную роль в зарождении жизни во Вселенной через области пыли и газа, в которых образуются химические соединения. Исследовательская группа молекулярных систем, возглавляемая лауреатом премии ERC Роландом Вестером из Института ионной физики и прикладной физики Университета Инсбрука, поставила перед собой задачу лучше понять развитие элементарных молекул в космосе.«Проще говоря, наша ионная ловушка позволяет нам воссоздать космические условия в нашей лаборатории», — объясняет Роланд Вестер. «Этот аппарат позволяет нам детально изучать образование химических соединений». Ученые, работающие с Роландом Вестером, теперь нашли объяснение того, как в космосе образуются отрицательно заряженные молекулы.
Идея, построенная на теоретических основах
До открытия первых отрицательно заряженных молекул углерода в космосе в 2006 году предполагалось, что межзвездные облака содержат только положительно заряженные ионы.С тех пор вопрос о том, как образуются отрицательно заряженные ионы, оставался открытым. Итальянский теоретик Франко А. Джантурко, который восемь лет работал ученым в Университете Инсбрука, несколько лет назад разработал теоретическую основу, которая могла бы дать возможное объяснение. Существование слабосвязанных состояний, так называемых дипольно-связанных состояний, должно усиливать присоединение свободных электронов к линейным молекулам. Такие молекулы обладают постоянным дипольным моментом, который усиливает взаимодействие на относительно большом расстоянии от нейтрального ядра и увеличивает скорость захвата свободных электронов.
Наблюдение дипольно-связанных состояний в лаборатории
В своем эксперименте физики из Инсбрука создали молекулы, состоящие из трех атомов углерода и одного атома азота, ионизировали их и обстреляли их лазерным светом в ионной ловушке при чрезвычайно низких температурах. Они непрерывно меняли частоту света, пока энергия не стала достаточно большой, чтобы выбросить электрон из молекулы. Альберт Эйнштейн описал этот так называемый фотоэлектрический эффект 100 лет назад.Углубленный анализ данных измерений, проведенный ранним исследователем Малкольмом Симпсоном из программы докторской подготовки, атомы, свет и молекулы в Университете Инсбрука, наконец, пролил свет на это трудно поддающееся наблюдению явление. Сравнение данных с теоретической моделью, наконец, дало четкое свидетельство существования дипольно-связанных состояний. «Наша интерпретация состоит в том, что эти дипольные связанные состояния представляют собой своего рода открывающую дверь для связывания свободных электронов с молекулами, тем самым способствуя созданию отрицательных ионов в космосе», — говорит Роланд Вестер.«Без этого промежуточного шага было бы очень маловероятно, что электроны действительно свяжутся с молекулами».
Работа поддержана австрийским научным фондом FWF, который также финансирует докторскую программу «Атомы, свет и молекулы» (ALM) в Университете Инсбрука.
История Источник:
Материалы предоставлены Университетом Инсбрука . Примечание. Содержимое можно редактировать по стилю и длине.
ионных соединений | Маноа.hawaii.edu/ExploringOurFluidEarth
Электронные оболочки
Электроны находятся в постоянном движении вне ядра атома. Электронная оболочка — это область, в которой движутся электроны (см. Рис. 2.21). Электронные оболочки обозначены номерами от 1 до 7. Каждая оболочка содержит все большее количество электронов, начиная с электронной оболочки 1, которая содержит максимум два электрона (см. Таблицу 2.6).
| Электронная оболочка | Число электронов в оболочке |
|---|---|
| 1 | 2 |
| 2 | 8 |
| 3 | 18 |
| 4 | 32 |
| 5 | 50 |
| 6 | 50 |
| 7 | 50 |
Теоретически электронные оболочки 6 и 7 могут содержать больше электронов, но в известных элементах 50 — это максимальное количество электронов в этих оболочках.
Когда одна оболочка заполняется до предела, электроны добавляются к следующей оболочке. В нейтральном атоме количество отрицательно заряженных электронов равно количеству положительно заряженных протонов.
- Водород (H) с атомным номером один имеет один электрон в оболочке 1 (рис. 2.21 A).
- Кислород (O) с атомным номером восемь имеет в общей сложности восемь электронов, два в оболочке 1 и шесть в оболочке 2 (рис. 2.21 B).
- Натрий (Na) с атомным номером одиннадцать имеет два электрона в оболочке 1, восемь электронов в оболочке 2 и один электрон в оболочке 3.(Рис. 2.21 C).
По мере того, как электронные оболочки меняются от 1 до 7, они увеличиваются в размере и средней энергии. Другими словами, чем дальше оболочка от ядра, тем она больше и тем выше ее средняя энергия. Валентная оболочка — это самая внешняя электронная оболочка атома. В общем, электроны в валентных оболочках определяют, как атом ведет себя в химических реакциях. Например, атомы с полной валентной оболочкой, благородные газы, наименее химически активны.С другой стороны, электроны, у которых есть только один электрон в валентных оболочках (элементы группы 1), или элементы, у которых всего на один электрон меньше полной оболочки (группа 17), являются наиболее реактивными.
Ионы
Хотя атомный номер, число протонов в ядре, никогда не меняется, некоторые электроны легко теряются или приобретаются атомом. Когда атом получает или теряет электрон, у атома больше нет сбалансированного заряда. Следовательно, атом больше не нейтрален.Ион — заряженный атом. Атом, получивший отрицательно заряженные электроны, становится отрицательным. Отрицательный ион или анион — это атом, который приобрел электроны. Атом, потерявший отрицательно заряженные электроны, становится положительным. Положительный ион или катион — это атом, потерявший электроны.
Неметаллы имеют тенденцию приобретать электроны и становиться анионами. Например, на рис. 2.22 A нейтральный атом кислорода (O) с восемью протонами и восемью электронами получает два электрона.Это дает ему на два отрицательных заряда больше, чем положительных, а общий заряд равен 2–. Металлические элементы имеют тенденцию терять электроны и превращаться в катионы. Например, на рис. 2.22 B нейтральный атом натрия (Na) с 11 протонами и 11 электронами теряет один электрон. Это дает ему на один отрицательный заряд меньше, чем положительных, а общий заряд равен 1+.
Элементы группы 18, благородные газы, очень стабильны (инертны). Это потому, что они имеют полностью полную валентную электронную оболочку.Правило октета гласит, что независимо от того, сколько электронов потенциально может удерживать оболочка, валентная оболочка может содержать только восемь электронов. Благородные газы имеют восемь электронов в валентных оболочках. Другие элементы будут получать или терять электроны для достижения полностью полных валентных оболочек, восемь электронов в валентной оболочке, так что они также будут стабильными. На рис. 2.22 A атом кислорода получил два электрона, так что у него было восемь электронов в оболочке 2, его валентной оболочке. На рис. 2.22 B натрий потерял один электрон, так что у него было восемь электронов в оболочке 2, которая стала его валентной оболочкой.
Периодическая таблица Менделеева может помочь в прогнозировании типа иона, который образует элемент, в зависимости от того, сколько электронов необходимо получить или потерять, чтобы он стал стабильным. Элементы будут получать или терять электроны, чтобы иметь ту же конфигурацию, что и благородный газ, другими словами, чтобы иметь полный октет. Атомы имеют тенденцию набирать или терять наименьшее количество электронов для достижения полного октета. Другими словами, если атом может потерять один электрон или получить семь, чтобы получить полный октет, он потеряет один.
Модели образования ионов
Обычно атомы образуют ионы по следующей схеме:
- Металлы Группы 1 имеют только один электрон на валентной оболочке. Они могут отказаться от этого одного электрона и стать 1+. Элементы группы 2 отдают два электрона, чтобы стать 2+, а группа 3 отдают три электрона, чтобы стать 3+.
- Неметаллам Группы 17 нужен всего один электрон, чтобы завершить свою валентную оболочку. Они могут получить один электрон и стать 1–.Элементы группы 16 получают два электрона, чтобы стать 2–, а элементы группы 15 получают три электрона, чтобы стать 3–.
- Все остальные металлические элементы производят по крайней мере один ион с зарядом 2+.
Некоторые элементы могут образовывать ионы с двумя или более разными зарядами. Железо (Fe), например, может образовывать как ион железа с 2+ (Fe 2+ ), так и ион железа с 3+ (Fe 3+ ).
Ионы именования
Нейтральный атом натрия (Na) теряет один электрон с образованием иона натрия (Na + ) с зарядом 1+ (см. Таблицу 2.8). Положительный ион или катион имеет то же имя, что и элемент. Таким образом, существуют ионы натрия (Na + ), а также ионы калия (K + ), ионы кальция (Ca 2+ ) и ионы алюминия (Al 3+ ). Обратите внимание, что если заряд иона равен 1+, символ представляет собой верхний индекс плюс ( + ) без числа 1 (например, Na + ).
| Элемент | Имя элемента | Протоны в нейтральном атоме | Электроны в нейтральном атоме | Количество электронов, полученных или потерянных для достижения октета | Ион образованный | Имя иона |
|---|---|---|---|---|---|---|
| Na | Натрий | 11 | 11 | 1 потеряно | Na + (катион) | Ион натрия |
| Класс | Хлор | 17 | 17 | 1 приобретено | Cl- (анион) | Хлор ide ион |
Нейтральный атом хлора (Cl), который приобретает один электрон, превращается в хлорид-ион (Cl — ) с зарядом 1– (см. Таблицу 2.8). Чтобы назвать отрицательный ион или анион, последняя часть имени атома опускается и заменяется на -ide. Таким образом, существуют ионы хлора (Cl — ), ионы фторида (F — ), ионы сульфида (S 2-) и ионы нитрида (N 3-). Обратите внимание, что если заряд иона равен 1–, символ представляет собой верхний индекс минус (–) без цифры 1 (например, Cl –).
Ионные соединения
Ионное соединение — это соединение, образованное ионной связью.Ионная связь происходит посредством процесса, называемого переносом электронов , когда один атом отдает электроны другому. Представьте себе двух щенков. У одного из щенков есть кость (рис. 2.23 А). Щенки представляют собой атомы. Кость представляет собой электрон. Оба щенка нейтральные. Один щенок — вор и крадет кость у другого щенка. Теперь у щенка-вора есть кость (рис. 2.23 B). Щенок, у которого нет кости, потерял свой электрон и теперь заряжен положительно, будет следовать за щенком-вором, у которого есть отрицательный заряд, вокруг, образуя пару щенков.Пара щенков — это ионное соединение (рис. 2.23 C).
При переносе электрона атом одного элемента теряет один или несколько электронов, а атом другого элемента получает эти электроны. Оба атома, участвующие в переносе электрона, становятся ионами. Атом, который получает электроны, становится отрицательно измененным анионом, атом, теряющий электроны, становится положительно заряженным катионом. Противоположные заряды на ионах заставляют ионы связываться или удерживаться вместе за счет электростатических сил.Ионная связь — это связь между ионами, при которой противоположно заряженные атомы притягиваются друг к другу и нейтрализуют свои заряды с образованием нейтральных соединений.
Информация об электронных оболочках и образовании ионов может быть использована для предсказания того, как элементы будут взаимодействовать с образованием ионных соединений. Например, каждый элемент в группе 1 отдает один электрон, чтобы стать катионом 1+. Каждый элемент в Группе 17 может получить один электрон, чтобы стать анионом 1–. Элементы из групп 1 и 17 могут объединяться с образованием ионных соединений в соотношении один к одному.Следовательно, один катион лития (Li) связывается с одним анионом фтора (F) как фторид лития (LiF). Другими примерами ионных соединений, которые объединяются в соотношении один катион к одному аниону, являются хлорид натрия (NaCl) и иодид калия (KI). Для сравнения, катионы группы 1 (1+) соединяются с анионами группы 16 (2–) в соотношении два к одному. Итак, на каждый анион кислорода приходится два катиона лития, когда они связываются с образованием оксида лития (Li 2 O). Связи между другими элементами в группах 1 и 16 также образуют соотношение два к одному.Примеры из них включают оксид калия (K 2 O), сульфид лития (Li 2 S) и сульфид натрия (Na 2 S).
Пример ионной связи с соотношением один к одному показан на рис. 2.24. Атом натрия переносит электрон на атом хлора (рис. 2.24 A). Во время этого процесса натрий потерял электрон, чтобы стать положительным катионом Na + , а хлор приобрел электрон, чтобы стать анионом Cl — (рис. 2.24 B). Затем ион Na + связывается с ионом Cl — за счет электростатических сил.Заряд 1+ натрия уравновешивается зарядом 1– хлора. Полученное соединение хлорида натрия (NaCl) заряжено нейтрально (рис. 2.24 C).
Пример ионной связи с соотношением два к одному показан на рис. 2.25 для магния и хлора. Поскольку каждый атом магния может потерять два электрона, а каждый атом хлора может получить только один электрон, магний должен передать свои два электрона двум атомам хлора. Катион магния (Mg 2+ ) затем связывается с двумя хлорид-анионами (Cl —).
Соли ионные соединения
Когда большинство людей используют слово соль, они имеют в виду особый вид соли, хлорид натрия (NaCl). Хлорид натрия — это обычная поваренная соль, которую мы добавляем в пищу. Однако термин «соль» имеет более общее значение в химии; Соли представляют собой ионные соединения, образованные из катионов и анионов, удерживаемых вместе ионной связью.
В кристалле поваренной соли ионы натрия и хлора расположены очень близко друг к другу.Один крошечный кристалл поваренной соли может состоять из миллиарда триллионов ионов. Ионы натрия и хлора в поваренной соли расположены очень близко друг к другу, их расположение образует кристалл в форме куба. В других солях ионы могут располагаться по-другому, образуя кристаллы различной формы (рис. 2.26).
Ионизация — Energy Education
Рис. 1. Упрощенный процесс ионизации, при котором электрон удаляется из атома. [1]Ионизация — это процесс, при котором ионы образуются в результате усиления или потери электрона атомом или молекулой. [2] Если атом или молекула приобретает электрон, они становятся отрицательно заряженными (анион ), а если они теряют электрон, они становятся заряженными положительно (катион ). Энергия может быть потеряна или получена при образовании иона.
Ионизация атомов
Когда атом получает электрон, обычно выделяется энергия. Эта энергия называется сродством к электрону этого вида атомов. Атомы с большим сродством к электрону с большей вероятностью приобретут электрон и образуют отрицательные ионы. [3]
Потеря электрона атомом требует подвода энергии. Энергия, необходимая для удаления электрона из нейтрального атома, равна энергии ионизации этого атома. Электроны из атомов легче удалить с небольшой энергией ионизации, поэтому они будут чаще образовывать катионы в химических реакциях. [4] Металлы обычно имеют меньшую энергию ионизации, а щелочные металлы (с их единственным валентным электроном) имеют самую низкую энергию ионизации как группа.Таким образом, мы чаще всего находим щелочные металлы в качестве положительных ионов в химических соединениях — например, катион натрия [math] \ ce {Na +} [/ math] в поваренной соли NaCl.
Энергия ионизации также связана с работой выхода металла — минимальной энергией, необходимой для выброса электронов с поверхности металла. Работа выхода металла важна в электронике и при создании научных инструментов, таких как электронные пушки. Подробнее о работе выхода и фотоэлектрическом эффекте на металлах читайте здесь.
Тенденции энергии ионизации и сродства к электрону в сочетании с эффектами электронной структуры атома влияют на тип и силу химических связей, которые образуются между атомами. [5]
Ионизирующее излучение
- Главная страница
Излучение можно классифицировать как «ионизирующее», если оно имеет достаточно энергии для выброса электрона из атома. Энергии альфа- и бета-частиц распада и гамма-фотонов выше, чем энергии ионизации большинства атомов и молекул, поэтому, когда эти типы излучения сталкиваются с атомом или молекулой, электроны удаляются, создавая положительный ион (катион).Что касается молекул, воздействие ионизирующего излучения может также разрушить химические связи, фрагментируя молекулу. [6] Поскольку эти типы излучения ионизируют атомы и молекулы, с которыми они взаимодействуют, они все вместе известны как ионизирующее излучение . Ионизирующее излучение используется для создания ионов, используемых в масс-спектрометрии, [6] — мощный метод идентификации химических соединений. Это также основа работы счетчика Гейгера, который издает «щелчки» при каждой обнаруженной частице ионизирующего излучения. [7]
Для дополнительной информации
Список литературы
- ↑ Создано внутри компании членом группы энергетического образования.
- ↑ ИЮПАК. (14 мая 2015 г.). Сборник химической терминологии [Интернет], 2-е изд. («Золотая книга»), 2006, «Ионизация». Доступно: http://goldbook.iupac.org/I03183.html
- ↑ Chemistry LibreText. (31 июля 2018 г.). Сродство к электрону [Онлайн]. Доступно: https: //chem.libretexts.org / Учебные_карты / Физические_и_теоретическая_химия_Карты_ учебника / Дополнительные_модули_ (Физические_и_теоретическая_химия) / Физические_свойства_материны / Атомные_и_молекулярные_свойства / Сродство электронов
- ↑ Chemistry LibreText. (31 июля 2018 г.). Энергия ионизации [Онлайн]. Доступно: https://chem.libretexts.org/Textbook_Maps/Physical_and_Theoretical_Chemistry_Textbook_Maps/Supplemental_Modules_(Physical_and_Theoretical_Chemistry)/Physical_Properties_of_Matter/Atomic_and_Enerties/Iolecular_Matter/Atomic_and_Molecular_Maps
- ↑ Гиперфизика.(19 мая 2015 г.). Энергия ионизации [Онлайн]. Доступно: http://hyperphysics.phy-astr.gsu.edu/hbase/chemical/ionize.html
- ↑ 6,0 6,1 Дэниел К. Харрис, Количественный химический анализ, 8-е издание. Нью-Йорк, США: W.H. Фримен и компания, 2010, стр. 504
- ↑ Питер Сигел. (31 июля 2018 г.). «Введение в счетчики Гейгера», Phy432 Lab Manual, [Online]. Калифорнийский государственный политехнический университет. Доступно: https: // www.cpp.edu/~pbsiegel/phy432/labman/geiger.pdf
еженедельной работы в сети
Еженедельная работа в Интернете # 6:
Ионы и ионные соединения
Это задание было сдано к полудню во вторник, 18 февраля 2003 г.
Материалы больше не принимаются.
Пожалуйста, введите свою фамилию, имя имя:
Пожалуйста, введите последние пять цифр из ваш идентификационный номер:
Пожалуйста, введите ник:
(на случай, если ваш ответ будет использоваться в классе).
Вы можете менять свое мнение сколь угодно часто. Когда вы будете удовлетворены своими ответами, нажмите кнопку ОТПРАВИТЬ. внизу этой страницы.
Цель задания на этой неделе — предсказать заряды ионов и начать писать химические формулы для ионных соединения.
Электронные конфигурации благородных газов чрезвычайно стабильны.Когда атом претерпевает химическое изменение чтобы стать ионом, атом будет набирать или терять электроны, пока не изоэлектронен (имеет такую же электронную конфигурацию) с ближайший благородный газ. Металлы склонны терять электроны и образовывать положительные заряженные ионы, называемые катионами. Неметаллы склонны приобретать электроны и образуют отрицательно заряженные ионы, называемые анионами.
Например, металлический натрий, Na, [Ne] 3s 1 , теряет один электрон с образованием иона Na + , который является изоэлектронным с неоном.(Все щелочные металлы имеют один валентный электрон и образуют катионы 1+.) Хлор, [Ne] 3s 1 3p 5 , получает один электрон с образованием иона Cl — , который является изоэлектронным с аргоном. (Все галогены имеют 7 валентных электронов и образуют 1- анионы.)
Ионные соединения состоят из катиона (ов) металлов и неметаллический анион (ы) и имеют нулевой чистый заряд.Натрия хлорид, NaCl, состоит из Na + и Cl — в соотношение один к одному, что дает формулу нулевой заряд. При написании формула ионного соединения, символ катиона написано первым.
Обратите внимание, что образование ионов из нейтральных атомов — это химическая реакция. Нажмите здесь, чтобы увидеть, как металлический натрий и газообразный хлор реагируют с образованием натрия хлористый.Этот видеоклип взят из учебника Макмерри. веб-сайт (http://cwx.prenhall.com/bookbind/pubbooks/mcmurrygob/). Если вы не можете увидеть реакцию, на странице есть ее изображение. 74 в вашем тексте.
Следующие вопросы призваны помочь вам начать думать об ионах и ионных соединениях. Вы можете пожелать см. главу 4, раздел 7 (стр. 79-81) и раздел 10 (внизу стр. 84-87) в вашем учебнике.
При написании формулы для ионных соединений, общий положительный заряд от катионов плюс общий отрицательный заряд анионов должен в сумме равняться нулю, чтобы формула иметь нулевой чистый заряд. При написании формул для щелочного металла при взаимодействии с галогеном соотношение ионов составляет один к одному. Помнить наш пример NaCl выше? NaCl состоит из Na + и Cl — ионов.Итак, 1 (1+) + 1 (1-) = 0
А как насчет соединения, которое образует кальций? реагирует с бромом? Кальций образует ион 2+, Ca 2+ , потому что он должен потерять 2 электрона, чтобы быть изоэлектронным с аргон. Бром образует 1-ион, Br — . Формула для бромида кальция — CaBr 2 . Вам нужно два бромида ионы, чтобы сбалансировать заряд 2+ иона кальция так, чтобы формула будет бесплатно.1 (2+) + 2 (1-) = 0
Вы можете редактировать свои ответы до вы довольны своими ответами. Помните, цель задание — помочь вам задуматься над темой. Ваши ответы не обязательно быть «правильным», чтобы получить кредит, вам просто нужно чтобы ответить на вопросы изо всех сил.
Помните, поскольку этот файл находится в архиве, вы больше не можете его отправить.
