Как воздействуют на организм тяжелые металлы: Тяжелые металлы и их влияние на организм
Тяжелые металлы и их влияние на организм
О масштабном загрязнении окружающей среды вредными и токсичными веществами сейчас знают все. Ведь ни для кого не секрет, что атмосфера промышленных городов загрязнена выбросами тяжелых металлов. Они присутствуют в воздухе, которым мы дышим, в воде, которую пьем, в почве, где аккумулируются корнями растений и попадают в круговорот веществ в природе. Именно поэтому токсичные вещества можно найти во всем, что нас окружает: в продуктах питания, в косметических средствах, предметах интерьера и т.д.
А все ли металлы опасны?
Такие металлы, как железо, медь, цинк, молибден, в малых количествах играют физиологическую роль: участвуют в биологических процессах и являются необходимыми для правильного функционирования растений, животных и человека. Они участвуют в процессе фотосинтеза и усвоения растениями азота, способствует синтезу сахара, белков, крахмала, витаминов.
В чем заключается токсичность?
Тяжёлые металлы и их соединения оказывают токсическое воздействие на организм человека, вызывая ряд заболеваний.
Кадмий
Избыточное поступление кадмия в организм может приводить к анемии, поражению печени, нарушению функции легких, остеопорозу, деформации скелета, развитию гипертонии. Он накапливается в почках, может служить причиной образования в них камней.
Свинец
Свинец, наряду с мышьяком, кадмием, ртутью, относится к классу высокоопасных веществ. Свинец накапливается в костях, вызывая их постепенное разрушение, аккумулируется в печени и почках, может вызывать снижение работоспособности, ухудшение памяти и даже хронические заболевания мозга.
Ртуть
Ртуть оказывает токсическое воздействие на центральную нервную систему, вызывает тахикардию и приводит к эмоциональной неустойчивости, нарушению памяти, бессоннице, апатии и т.д. Человек постоянно чувствует усталость, быстро утомляется, становится рассеян и раздражителен. Его постоянно преследуют головные боли.
Что делать?
Поскольку развитие промышленности не стоит на месте, количество выбросов загрязнений в окружающую среду растёт, влияние экологии на здоровье человека на сегодняшний день составляет 25–50% от совокупности всех воздействующих факторов. Поэтому с уверенностью можно сказать, что жители мегаполисов в большей степени подвержены негативному воздействию окружающей среды. Именно для этого во все наши программы включена расширенная check-up диагностика, в рамках которой можно определить степень содержания тяжелых металлов в организме (14 металлов и 20 минералов). Основываясь на результатах диагностики можно определить:
- общую степень интоксикации организма тяжёлыми металлами, способность их элиминации из организма;
- количественное соотношение минерального баланса (20 минералов), наличие дефицита или избытка тех или иных минералов;
- степень окислительной агрессии и кислотности организма, его анти-оксидативный статус.
- степень предрасположенности к сахарному диабету, аллергиям, провести оценку регенеративного потенциала.

Необходимо уделить особое внимание питанию и естественной детоксикации организма. Один из самых эффективных способов — прием лечебной воды «Donat Mg» в рамках наших программ. Состав воды уникален по содержанию электрически-активного ионного магния (Mg++), количество которого превышает 1000мг/л. Прием курса рекомендуется после консультации с врачом.
Курорт Рогашка Слатина и лечебная вода «Donat Mg» широко известны в Европе с начала 19 века. Сюда приезжают со всех концов света, чтобы окунуться в атмосферу умиротворения и спокойствия, царящие в таком удивительно месте. Живописный ландшафт, единение с природой, медицинский центр с минеральным источником, комфортабельный отель с безукоризненным сервисом, разнообразие досуга и многое другое позволят вам зарядиться энергией, поправить здоровье, восстановить силы и просто отдохнуть вдали от шумного и загрязненного мегаполиса.
Посмотреть все статьи рубрики «Новости и статьи»Понятие и влияние тяжелых металлов на здоровье человека (окружающую среду)
Загрязнение окружающей среды в республике взывает особое беспокойство ее жителей. И причина не только в Чернобыле. Достаточно и своих «внутренних» проблем. Поэтому об экологии сегодня говорят на митингах и за семейным чаем, рассуждают с трибун академических конференций и в очередях, пишет статьи министр и сочинение школьник. Однако больше всего пока достается нитратам, Никто не спорит, что качество овощей и картофеля резко ухудшается из-за высокой концентрации этих соединений, хотя оно может снижаться и по другим причинам. Недаром в странах Запада проблема нитратов как бы отходит на задний план, уступая место тяжелым металлам и пестицидам.
И причина не только в Чернобыле. Достаточно и своих «внутренних» проблем. Поэтому об экологии сегодня говорят на митингах и за семейным чаем, рассуждают с трибун академических конференций и в очередях, пишет статьи министр и сочинение школьник. Однако больше всего пока достается нитратам, Никто не спорит, что качество овощей и картофеля резко ухудшается из-за высокой концентрации этих соединений, хотя оно может снижаться и по другим причинам. Недаром в странах Запада проблема нитратов как бы отходит на задний план, уступая место тяжелым металлам и пестицидам.
Это обусловлено тем, что последние многократно опаснее нитратов, которые, если можно так сказать, находятся на периферии современной токсикологии. Интерес к тяжелым металлам особенно возрос после сообщений из Японии о заболеваниях Минамата и итай-итай. Первое из них, как известно, вызвано употреблением в пищу отравленной ртутью рыбы. При этом наиболее тяжелые случаи заболевания параличом, слепатой, расстройством психики и речи.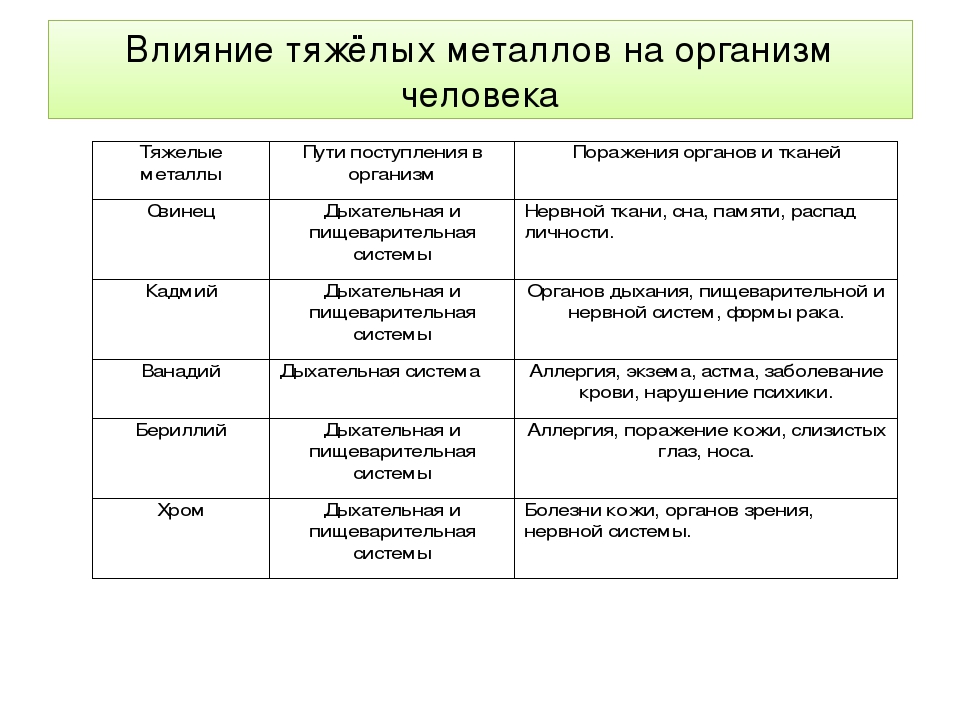 Младенцы подвергались интоксикации еще до появления на свет. Итог оказался печальным: умерли десятки людей, а еще больше продолжали болеть. Не менее опасна и болезнь итай-итай (в дословном переводе ой-ой), вызываемая отравлением кадмием. Заболевшие ею люди испытывали страшную боль в суставах, что и определило такое название. Весьма токсичен и свинец. С отравлением его соединениями нередко связывают слабоумие у детей и другие негативные последствия. Может показаться странным, что к тяжелым металлам отнесены также марганец, цинк, медь, кобальт, молибден, хорошо известные под названием микроэлементы. Их физиологическая роль для организма животных и человека научно доказана. Благодаря этому они нашли широкое применение в сельском хозяйстве и медицине. Однако все дело в концентрации: при дефиците в организмах эти соединения рассматриваются как микроэлементы, а при избытке — как тяжелые металлы.
Младенцы подвергались интоксикации еще до появления на свет. Итог оказался печальным: умерли десятки людей, а еще больше продолжали болеть. Не менее опасна и болезнь итай-итай (в дословном переводе ой-ой), вызываемая отравлением кадмием. Заболевшие ею люди испытывали страшную боль в суставах, что и определило такое название. Весьма токсичен и свинец. С отравлением его соединениями нередко связывают слабоумие у детей и другие негативные последствия. Может показаться странным, что к тяжелым металлам отнесены также марганец, цинк, медь, кобальт, молибден, хорошо известные под названием микроэлементы. Их физиологическая роль для организма животных и человека научно доказана. Благодаря этому они нашли широкое применение в сельском хозяйстве и медицине. Однако все дело в концентрации: при дефиците в организмах эти соединения рассматриваются как микроэлементы, а при избытке — как тяжелые металлы.
Иначе говоря, высокая концентрация любого элемента делает его опасным для всего живого.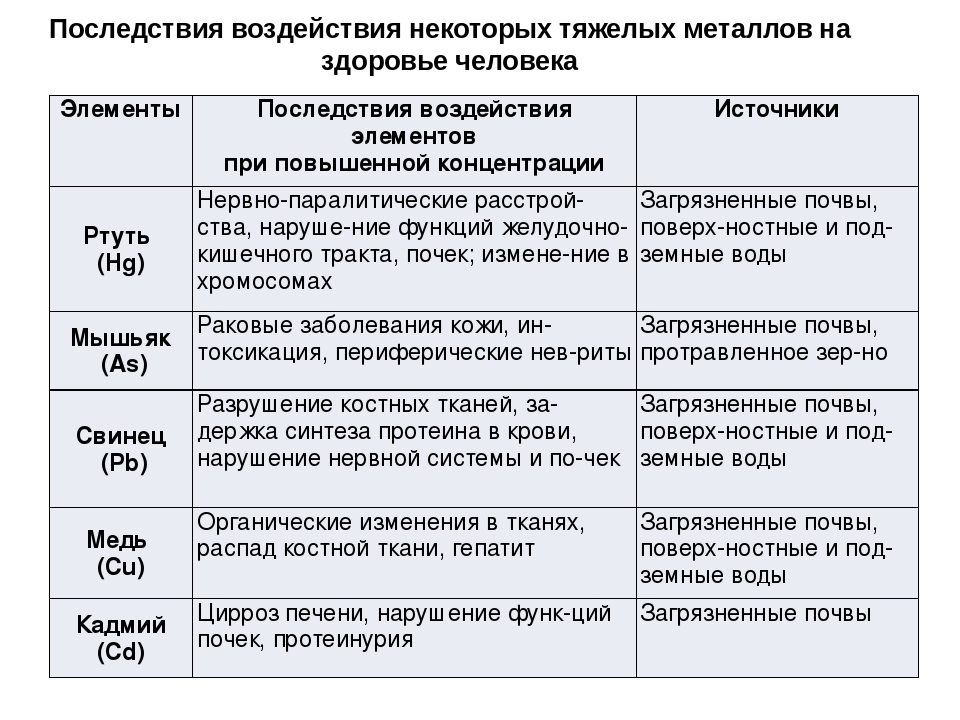 Не являются исключением кобальт, цинк, а также медь, которая, кстати, при повышенном содержании в природных водах по токсичности для рыб уступает только ртути. Тяжелые металлы – часть природы. Они входят в состав горных пород, почв, пресных и морских вод, содержатся в растительных и животных организмах. Почему же они стали нашими врагами? Виною всему деятельность людей, значительно изменивших естественные потоки химических элементов.
Не являются исключением кобальт, цинк, а также медь, которая, кстати, при повышенном содержании в природных водах по токсичности для рыб уступает только ртути. Тяжелые металлы – часть природы. Они входят в состав горных пород, почв, пресных и морских вод, содержатся в растительных и животных организмах. Почему же они стали нашими врагами? Виною всему деятельность людей, значительно изменивших естественные потоки химических элементов.
В итоге концентрация тяжелых металлов в окружающей среде постоянно растет. Значительную роль играют выбросы в атмосферу при сжигании топлива, и прежде всего каменного угля. По имеющимся сведениям, отдельных элементов поступает с ними в окружающую среду даже больше, чем их добывается. Причем на долю автотранспорта приходится основное количество выбросов в атмосферный воздух свинца. Вносят свою лепту в загрязнение заводы и фабрики, особенно гальваническое производство. Наряду с тяжелыми металлами поступают в почву с атмосферными осадками, минеральными удобрениями, осадками сточных вод и различными компостами из бытового мусора. Свинец попадает на осушенные торфяники в результате внесения медьсодержащих промышленных отходов – пиритных огарков.
Свинец попадает на осушенные торфяники в результате внесения медьсодержащих промышленных отходов – пиритных огарков.
Ртуть содержится в протравителе семян – гранозане, который совсем еще недавно применялся в земледелии. В определенной мере способствует накоплению тяжелых металлов в почве и растениях внесение бесподстилочного навоза. Объясняется это тем, что комбикорма обогащаются фосфатами, которые содержат в качестве примесей кадмий и другие элементы. Кроме того, в рацион животных, и прежде всего свиней, с целью повышения их продуктивности включаются медь и цинк. Через корма тяжелые металлы попадают в навозные стоки, а затем и в почву. Не лишены тяжелых металлов обычный подстилочный навоз и известковые удобрения. Словом, эти соединения распространены в природе гораздо шире, чем считалось ранее. Содержатся тяжелые металлы также в пище, кормах и воде, для которых установлены предельно допустимые концентрации(ПДК).
Анализ отечественных и зарубежных литературных источников свидетельствует, что эти показатели в различных странах далеко не одинаковы.
Что касается наших ПДК в почвах, то они более строгие, чем нормативы ряда зарубежных стран. Но прямые параллели не всегда правомерны, поскольку часть сельскохозяйственных угодий республики загрязнены радионуклидами. Совместное же действие последних с тяжелыми металлами особенно опасно. Это должно учитываться как специалистами, выращивающими овощи или картофель, так и работниками Минздрава, устанавливающими предельные нормативы.
Загрязнение окружающей среды нередко происходит не по вине земледельца. Так, в окрестностях крупных промышленных центров, аэропортов и оживленных автомагистралей свинец и другие металлы поступают в почву из атмосферного воздуха. Поэтому экологическая обстановка заметно улучшится, если прекратится выпуск бензина с добавкой соединений свинца. Требуют совершенствования некоторые технологические процессы по примеру отдельных стран, где ограничено применение кадмия в гальванопокрытиях и изделиях, а также ртути в производстве хлора и целлюлозно-бумажной промышленности. Нуждается в улучшении ситуация с утилизацией промышленных и бытовых отходов, которые зачастую также являются серьезными загрязнителями природной среды.
Так, в окрестностях крупных промышленных центров, аэропортов и оживленных автомагистралей свинец и другие металлы поступают в почву из атмосферного воздуха. Поэтому экологическая обстановка заметно улучшится, если прекратится выпуск бензина с добавкой соединений свинца. Требуют совершенствования некоторые технологические процессы по примеру отдельных стран, где ограничено применение кадмия в гальванопокрытиях и изделиях, а также ртути в производстве хлора и целлюлозно-бумажной промышленности. Нуждается в улучшении ситуация с утилизацией промышленных и бытовых отходов, которые зачастую также являются серьезными загрязнителями природной среды.
Есть немало приемов по регулированию концентраций тяжелых металлов в почве и растениях и у работников сельского хозяйства. Это прежде всего нормированное внесение средств химизации, органических и известковых удобрений, а также возделывание культур с пониженным содержанием таких соединений и многое другое. Но есть одно условие, при котором перечисленные приемы будут эффективно действовать.
Вполне объективно, без эмоций оценить ситуацию с тяжелыми металлами в нашей республике и за рубежом, невозможно. При этом делается акцент на практические приемы снижения их содержания в окружающей среде. При кажущейся ясности понятия «тяжелые металлы» однозначного толкования в литературе пока нет. Некоторые авторы (Э.Н.Левина, М.М.Ворончук) связывают это понятие с высокой атомной массой. Они относят в группу тяжелых металлов более 40 элементов с атомной массой свыше 50. Советский энциклопедический словарь включает сюда только цветные металлы с плотностью большей, чем у железа. Согласно Е.А.Лужникову и др., к группе тяжелых металлов принадлежит 40 элементов с высокой относительной массой и плотностью более 6 г/см3 .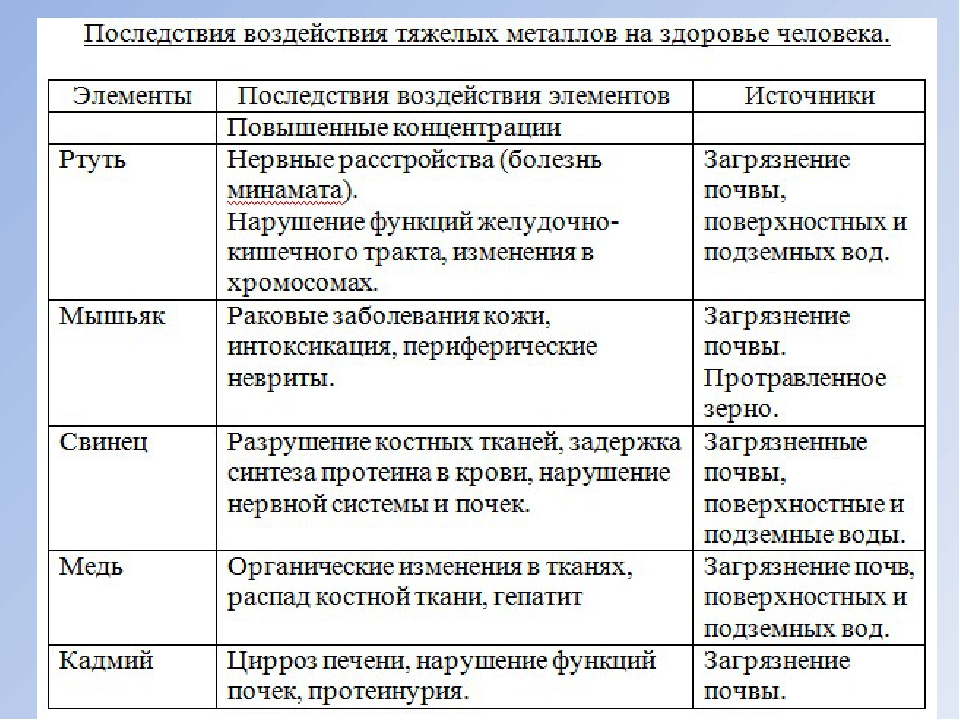
По Реймерсу тяжелые металлы (кроме благородных и редких) имеют плотность свыше 8 г/см3, в то время как по В.А.Большакову с сотрудниками – лишь более 5 г/см3. Если исходить из последней цифры, то тяжелыми металлами следует считать 43 элемента. При этом наиболее низкую плотность имеет германий (5,36 г/см3), а самую высокую – осмий (22,48 г/см3). Из 43 элементов 10 обладают не только металлическими, но и неметал-лическими свойствами. К ним относятся теллур, мышьяк, сурьма, висмут, германий, олово, свинец, галлий, индий, таллий. Исходя из экологических и токсикологических позиций, не все тяжелые металлы могут быть восприняты однозначно.
По мнению И.М.Трахтенберга и др., прежде всего представляют интерес те металлы, которые широко используются в производстве и в результате накопления во внешней среде представляют серьезную опасность с точки зрения их биологической активности и токсических свойств. Представление об обязательной токсичности всех тяжелых металлов весьма ошибочно, поскольку в эту группу попадают медь, цинк, молибден, кобальт, марганец, железо. Эти элементы являются составной частью ферментативных систем. Они участвуют в переносе кислорода, энергии, передвижении электронов через мембраны клеток, влияют на синтез и передачу наследственной информации, т.е. являются незаменимыми в жизненно важных процессах.
Эти элементы являются составной частью ферментативных систем. Они участвуют в переносе кислорода, энергии, передвижении электронов через мембраны клеток, влияют на синтез и передачу наследственной информации, т.е. являются незаменимыми в жизненно важных процессах.
Недостаток или полное их отсутствие губительно сказываются на организме. В данном случае использовать термин «тяжелые металлы» можно лишь тогда, когда речь идет об опасных концентрациях указанных выше элементов. В обычных условиях это микроэлементы, используемые в очень малых количествах как удобрение сельскохозяйственных культур или в качестве минеральных добавок в рацион животных.
Однако существует группа металлов, за которыми закрепилось только одно определение – «тяжелые», т.е. токсичные. Это прежде всего ртуть, кадмий, свинец и мышьяк или, как их называют отдельные авторы, «большая четверка». Среди названных металлов особенно ядовиты для всего живого ртуть и кадмий, хотя и с остальными тоже все не так просто. В общем, «большая четверка» породила и большие экологические проблемы. Известно, что для нормального развития организма важно не только наличие в окружающей среде какого-либо элемента, но и определенное соотношение между различными соединениями. Резкое увеличение содержания одного или нескольких элементов в среде переводит их в разряд токсикантов.
В общем, «большая четверка» породила и большие экологические проблемы. Известно, что для нормального развития организма важно не только наличие в окружающей среде какого-либо элемента, но и определенное соотношение между различными соединениями. Резкое увеличение содержания одного или нескольких элементов в среде переводит их в разряд токсикантов.
В последующем возможно изложить роль ряда тяжелых металлов, в том числе и микроэлементов, в жизни человека, животных и растений. Кроме того будут рассмотрены источники поступления этих соединений в окружающую среду, приведены сведения о допустимых их концентрациях в природных водах, почве, продуктах питания и кормах. Особое внимание будет обращено на приемы снижения содержания тяжелых металлов в этих природных средах.
Врачи-лаборанты физико-химической лаборатории: А.А.Кузнецова Н.В.Сивицкий
Токсические микроэлементы и тяжелые металлы (Hg, Cd, As, Li, Pb, Al)
Определение концентрации основных токсических микроэлементов и тяжелых металлов (ртути, кадмия, мышьяка, лития, свинца и алюминия) в крови, моче, волосах или ногтях, которое используется для диагностики острого и хронического отравления этими металлами.
Синонимы русские
Ртуть, кадмий, мышьяк, литий, свинец, алюминий.
Синонимы английские
Mercury, Cadmium, Arsenic, Lithium, Lead, Aluminium.
Метод исследования
Масс-спектрометрия с индуктивно-связанной плазмой.
Единицы измерения
Мкг/л (микрограмм на литр), мкг/г (микрограмм на грамм), ммоль/л (миллимоль на литр).
Какой биоматериал можно использовать для исследования?
Венозную кровь, разовую порцию мочи, волосы, ногти.
Как правильно подготовиться к исследованию?
- Исключить из рациона алкоголь за сутки до исследования.
- Не принимать пищу в течение 2-3 часов до исследования, можно пить чистую негазированную воду.
- Исключить прием мочегонных препаратов в течение 48 часов до сбора мочи (по согласованию с врачом).
- Не курить в течение 30 минут до исследования.

Общая информация об исследовании
Современный человек подвержен повышенному риску интоксикации тяжелыми металлами. Их основными источниками являются загрязненная вода и воздух, а также продукты питания (например, рыба, выловленная из загрязненных водоемов, или фрукты и овощи, выращенные на загрязненной почве). У жителей крупных городов риск хронической интоксикации выше, так как небольшие, субтоксические дозы металла постоянно поступают в их организм и накапливаются в течение длительного времени. Реже отмечаются случаи острого отравления, при которых заболевание возникает в результате однократного поступления высоких доз токсических металлов. Острая интоксикация чаще носит профессиональный характер. Кроме того, интоксикация может развиться при применении препаратов токсических металлов в терапевтических целях для лечения некоторых заболеваний (соединения алюминия, лития, мышьяка). Особую опасность представляет литий, терапевтические дозы которого очень низкие.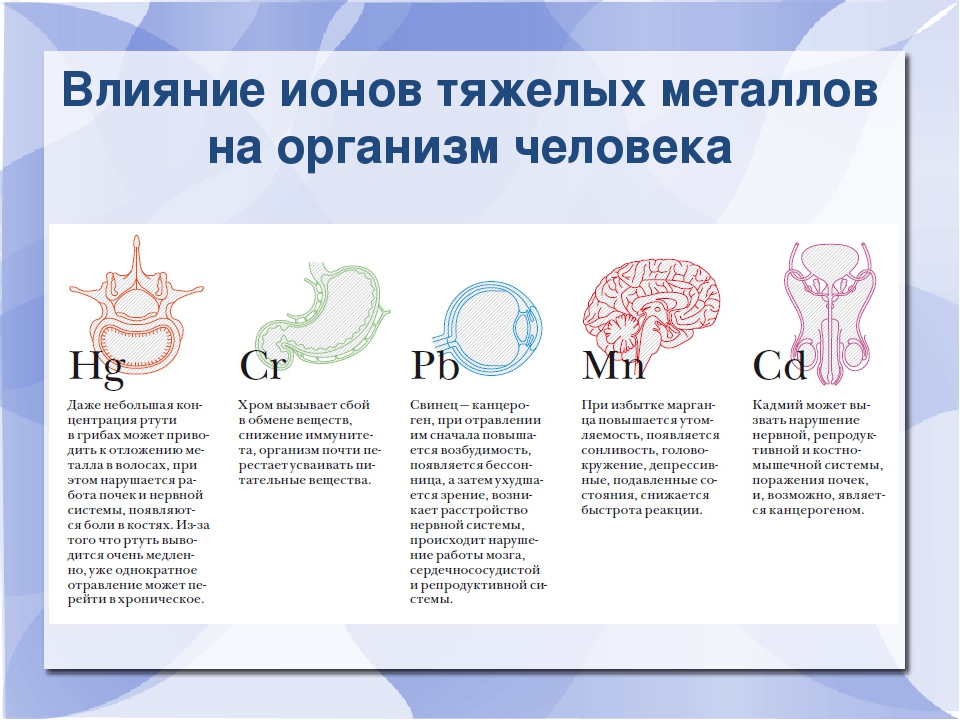
Наиболее часто от тяжелых металлов страдает сердечно-сосудистая и нервная система, а также почки, желудочно-кишечный тракт, система кроветворения и костная ткань. Следует отметить, что клиническая картина отравления не имеет каких-либо специфических признаков и часто протекает по типу полиорганной недостаточности. По этой причине основной метод диагностики – анализ концентраций токсических металлов в различных биологических средах. Комплексное исследование позволяет измерить концентрацию основных токсических элементов (ртути, кадмия, мышьяка, лития, свинца и алюминия) в крови, моче, волосах или ногтях.
Для диагностики острого отравления ртутью, свинцом, литием и алюминием оптимальными средами являются кровь и моча, для диагностики острого отравления кадмием – кровь. Это связано с тем, что кадмий оказывает максимально выраженное токсическое воздействие на почечную ткань, что приводит к неинформативности анализа мочи.
Для диагностики острого отравления мышьяком, напротив, предпочтительнее использовать мочу. Мышьяк может быть определен в крови в течение лишь 2-4 часов после его воздействия на организм, в то время как повышенный уровень этого элемента в моче может быть зарегистрирован в течение 1-2 суток после интоксикации.
Мышьяк может быть определен в крови в течение лишь 2-4 часов после его воздействия на организм, в то время как повышенный уровень этого элемента в моче может быть зарегистрирован в течение 1-2 суток после интоксикации.
Для диагностики хронического отравления токсическими металлами оптимальной биологической средой является моча. Результаты исследования волос и ногтей менее надежны, чем исследование крови и мочи, потому что они способны накапливать металлы еще и из внешней среды.
При интерпретации результата исследования следует учитывать некоторые особенности метаболизма токсических металлов. Более выраженные признаки отравления наблюдаются у пожилых людей и новорождённых детей. Курение оказывает раздражающее воздействие на дыхательные пути и поэтому облегчает ингаляционный путь поступления металлов в организм. Чрезмерное употребление алкоголя ассоциировано с нарушением всасывания некоторых микроэлементов, что в свою очередь способствует реабсорбции токсических металлов. Следует также отметить, что ртуть обладает иммуногенным действием и способна вызывать реакции гиперчувствительности, выраженность которых зависит от иммунного статуса организма. Клинические симптомы интоксикации могут наблюдаться при нормальных концентрациях токсических металлов. Так, признаки отравления литием в виде тошноты, рвоты, тремора, нарушения ритма сердца, полиурии и жажды могут присутствовать при концентрации лития в крови в пределах 0,8-1,6 ммоль/л (т. е. при норме). Такая ситуация наиболее характерна для пожилых пациентов, страдающих несколькими сопутствующими заболеваниями (например, хронической почечной недостаточностью, гипотиреозом) и принимающих также другие лекарственные препараты (ингибиторы ангиотензин-превращающего фермента, НПВС, блокаторы кальциевых каналов). С другой стороны, в некоторых ситуациях удается обнаружить повышенную концентрацию токсических металлов при отсутствии какой-либо симптоматики. Так, повышенный уровень мышьяка в моче может быть связан с употреблением большого количества морепродуктов, содержащих органические (нетоксические) соединения мышьяка. Таким образом, для правильной интерпретации результата исследования необходимы дополнительные анамнестические, клинические и лабораторные данные пациента.
Клинические симптомы интоксикации могут наблюдаться при нормальных концентрациях токсических металлов. Так, признаки отравления литием в виде тошноты, рвоты, тремора, нарушения ритма сердца, полиурии и жажды могут присутствовать при концентрации лития в крови в пределах 0,8-1,6 ммоль/л (т. е. при норме). Такая ситуация наиболее характерна для пожилых пациентов, страдающих несколькими сопутствующими заболеваниями (например, хронической почечной недостаточностью, гипотиреозом) и принимающих также другие лекарственные препараты (ингибиторы ангиотензин-превращающего фермента, НПВС, блокаторы кальциевых каналов). С другой стороны, в некоторых ситуациях удается обнаружить повышенную концентрацию токсических металлов при отсутствии какой-либо симптоматики. Так, повышенный уровень мышьяка в моче может быть связан с употреблением большого количества морепродуктов, содержащих органические (нетоксические) соединения мышьяка. Таким образом, для правильной интерпретации результата исследования необходимы дополнительные анамнестические, клинические и лабораторные данные пациента.
Для чего используется исследование?
- Для диагностики острого и хронического отравления токсическими металлами.
Когда назначается исследование?
- При профилактическом осмотре пациентов, занятых на добыче и переработке токсических металлов;
- при наблюдении пациентов, получающих препараты лития (карбонат лития), алюминия (антациды, буферный аспирин) и мышьяка (триоксид мышьяка) в терапевтических целях;
- при наличии признаков полиорганной недостаточности, особенно у пациента с особенностями профессионального или бытового анамнеза.
Что означают результаты?
Референсные значения
Кровь
Свинец: 0,15 — 4 мкг/л.
Кадмий: 0,013 — 2 мкг/л.
Ртуть: 0,21 — 5,8 мкг/л.
Мышьяк: 2 — 62 мкг/л.
Литий
1) Концентрация: 0,7 — 84 мкг/л;
2) Концентрация (ммоль/л): 0,6 — 1,2 ммоль/л.
Алюминий: 0 — 15 мкг/л.
Волосы
Свинец: 0 — 20 мкг/г.
Кадмий: 0 — 2,43 мкг/г.
Ртуть: 0 — 12,2 мкг/г.
Мышьяк: 0 — 0,5 мкг/г.
Литий: 0 — 0,1 мкг/г.
Алюминий: 5,6 — 50 мкг/г.
Ногти
Свинец: 0 — 20 мкг/г.
Кадмий: 0 — 2,43 мкг/г.
Ртуть: 0 — 15 мкг/г.
Мышьяк: 0 — 0,5 мкг/г.
Литий: 0 — 0,5 мкг/г.
Алюминий: 5,6 — 120 мкг/г.
Разовая порция мочи
Свинец: 0 — 25 мкг/л.
Кадмий: 0 — 2,6 мкг/л.
Ртуть: 0 — 109 мкг/л.
Мышьяк: 0 — 300 мкг/л.
Литий: 5,2 — 49 мкг/л.
Алюминий: 0 — 31 мкг/л.
Причины повышения уровня токсических микроэлементов:
- острая или хроническая интоксикация токсическими металлами.
Понижение уровня токсических микроэлементов не имеет диагностического значения.
Что может влиять на результат?
- Возраст пациента;
- особенности питания;
- курение;
- употребление алкоголя;
- наличие сопутствующих заболеваний;
- применение лекарственных препаратов.

травы которые выводят токсины и тяжелые металлы
травы которые выводят токсины и тяжелые металлыПротивопоказания к приему таблеток альбендазола для профилактики: беременность и грудное вскармливание, поражение сетчатой оболочки глаза.
энтеробиоз у женщин лечение, проверка на наличие паразитов в организме
полынь от паразитов в организме
выводим паразитов из организма препараты
клинистил состав препарата
отвар выводящий токсины
Как вывести тяжелые металлы из организма: 14 натуральных средств. В нашем организме постоянно накапливается свинец, его источником является вода из-под крана, так как она загрязняется по мере того, как проходит по металлическим трубам. Тяжеллые металлы.. Можно приготовить настойку из кориандра в пропорции 1: 5 / сухих трав (50% — 60% спирта). Готовую настойку можно приобрести и в аптеке.. Токсины — это не только лекарства и пестициды, но также отходы, которые образуются в процессе нормального обмена веществ. Кроме токсинов, печень выводит из организма лишние гормоны и другие вещества, которым нельзя давать накапливаться, чтобы они не стали ядовитыми. Пектины также способны поглощать и выводить из организма вредные продукты обмена, тяжелые металлы и яды. Внимание! Одуванчик – отличный пребиотик. Он создает комфортные условия для размножения полезной микрофлоры в кишечнике человека. Еще одно полезное для детокса свойство одуванчика – мочегонное. Растение используют для восстановления водно-солевого баланса и устранения отеков. Рецепты детокс-средств из одуванчика. Хвощ полевой. Растение нормализует водно-солевой баланс, способствует очищению организма от токсинов и холестерина. Средства на его основе принимают трижды в день, после еды. Льняные семена. Сорбирующие средства также эффективно нейтрализуют соединения тяжелых металлов, нитратов, облегчают фильтрующую функцию печени. Сорбенты стимулируют процессы естественного очищения организма, оказывают профилактическое действие. Виды природных сорбентов.
Кроме токсинов, печень выводит из организма лишние гормоны и другие вещества, которым нельзя давать накапливаться, чтобы они не стали ядовитыми. Пектины также способны поглощать и выводить из организма вредные продукты обмена, тяжелые металлы и яды. Внимание! Одуванчик – отличный пребиотик. Он создает комфортные условия для размножения полезной микрофлоры в кишечнике человека. Еще одно полезное для детокса свойство одуванчика – мочегонное. Растение используют для восстановления водно-солевого баланса и устранения отеков. Рецепты детокс-средств из одуванчика. Хвощ полевой. Растение нормализует водно-солевой баланс, способствует очищению организма от токсинов и холестерина. Средства на его основе принимают трижды в день, после еды. Льняные семена. Сорбирующие средства также эффективно нейтрализуют соединения тяжелых металлов, нитратов, облегчают фильтрующую функцию печени. Сорбенты стимулируют процессы естественного очищения организма, оказывают профилактическое действие. Виды природных сорбентов. В зависимости от способа поглощения токсинов различают: адсорбенты, которые притягивают токсины твердой поверхностью или верхним жидким слоем; абсорбенты.. Сорбент выводит из кишечника токсины и аллергены, восстанавливает кишечную микрофлору. Средство действует мягко и деликатно, не провоцирует вздутие, не вызывает болей и чувства тяжести. Очищение организма нужно проводить поэтапно. Кроме приема трав и добавок, для повышения эффективности детоксикации, нужно придерживаться некоторых правил питания, и проводить несложные процедуры, о которых расскажу в конце статьи. Рассмотрим сначала основные вещества, которые помогают хелатировать и выводить тяжелые металлы из организма. Хелатирование – это процесс образования органоминеральных комплексов, в котором органические молекулы связываются с ионами металлов, образуя новые соединения, которые либо усваиваются, либо выводятся организмом. Ацетилцистеин (NAC). Эта аминокислота обладает сильным хелатирующим эффектом, воздействующим практически на все тяжелые металлы, включая ртуть.
В зависимости от способа поглощения токсинов различают: адсорбенты, которые притягивают токсины твердой поверхностью или верхним жидким слоем; абсорбенты.. Сорбент выводит из кишечника токсины и аллергены, восстанавливает кишечную микрофлору. Средство действует мягко и деликатно, не провоцирует вздутие, не вызывает болей и чувства тяжести. Очищение организма нужно проводить поэтапно. Кроме приема трав и добавок, для повышения эффективности детоксикации, нужно придерживаться некоторых правил питания, и проводить несложные процедуры, о которых расскажу в конце статьи. Рассмотрим сначала основные вещества, которые помогают хелатировать и выводить тяжелые металлы из организма. Хелатирование – это процесс образования органоминеральных комплексов, в котором органические молекулы связываются с ионами металлов, образуя новые соединения, которые либо усваиваются, либо выводятся организмом. Ацетилцистеин (NAC). Эта аминокислота обладает сильным хелатирующим эффектом, воздействующим практически на все тяжелые металлы, включая ртуть. Травы и растения: женьшень, инжир, калина, крапива, лук, облепиха, пастушья сумка, имбирь, чеснок, ягоды жимолости. автор вопроса выбрал этот ответ лучшим. 2.. Вывести из организма тяжелые металлы и радионуклиды помогут свежие овощи, фрукты, зерновые. В их составе имеются фитосорбенты (пектин, клетчатка, слизистые вещества и пр.), т.е. вещества, которые помогают вывести из организма радионуклиды, тяжелые металлы. Например, богаты пектином свекла, морковь, яблоки, айва, сливы, ягоды (крыжовник, земляника, брусника, смородина).. Растения которые выводят радионуклиды растут не за тридевять земель. Это всем известный чистотел, череда, багульник, девясил, малина, береза, мать-и-мачеха, аир. Тяжелые металлы (ртуть, кадмий и мышьяк) присутствуют в окружающей среде в очень больших количествах, так что многие люди в той или иной степени отравлены ими. Существуют способы вывести тяжелые металлы из организма. Содержание. 7 способов избавиться от тяжелых металлов в организме: Профилактика отравления тяжелыми металлами.
Травы и растения: женьшень, инжир, калина, крапива, лук, облепиха, пастушья сумка, имбирь, чеснок, ягоды жимолости. автор вопроса выбрал этот ответ лучшим. 2.. Вывести из организма тяжелые металлы и радионуклиды помогут свежие овощи, фрукты, зерновые. В их составе имеются фитосорбенты (пектин, клетчатка, слизистые вещества и пр.), т.е. вещества, которые помогают вывести из организма радионуклиды, тяжелые металлы. Например, богаты пектином свекла, морковь, яблоки, айва, сливы, ягоды (крыжовник, земляника, брусника, смородина).. Растения которые выводят радионуклиды растут не за тридевять земель. Это всем известный чистотел, череда, багульник, девясил, малина, береза, мать-и-мачеха, аир. Тяжелые металлы (ртуть, кадмий и мышьяк) присутствуют в окружающей среде в очень больших количествах, так что многие люди в той или иной степени отравлены ими. Существуют способы вывести тяжелые металлы из организма. Содержание. 7 способов избавиться от тяжелых металлов в организме: Профилактика отравления тяжелыми металлами. Водоросли связывают тяжелые металлы. Кориандр поможет вывести тяжелые металлы. Селен и другие питательные элементы. Пищевые волокна для выведения тяжелых металлов. Упражнения для выведения токсинов. Посещение сауны. Тяжелые металлы могут попадать в организм из внешней среды. Накапливаясь, они наносят ущерб здоровью человека, вызывая токсичное отравление, ослабляя иммунную защиту, провоцируя неврологические недуги. Но в организме работают детоксикационные механизмы, которые осуществляют выведение тяжелых.. Атлантические водоросли. Выводят токсичные тяжелые металлы. Виды водорослей: красные, фукус, авария, ульва, нори, наскальные водоросли и др.. Сок травы ячменя в порошке. Данный порошок готовит ртуть к абсолютному поглощению спирулиной. Трава, кроме того, вытягивает тяж. металлы из селезенки, кишечника, поджелудочной, щитовидки, и органов репродуктивной системы. Яблоки. Известны способы выведения тяжелых металлов из организма с помощью пектиновых веществ. Однако пектины выводят токсические вещества только из просвета кишечника, и не могут вывести их из депо в паренхиматозных органах.
Водоросли связывают тяжелые металлы. Кориандр поможет вывести тяжелые металлы. Селен и другие питательные элементы. Пищевые волокна для выведения тяжелых металлов. Упражнения для выведения токсинов. Посещение сауны. Тяжелые металлы могут попадать в организм из внешней среды. Накапливаясь, они наносят ущерб здоровью человека, вызывая токсичное отравление, ослабляя иммунную защиту, провоцируя неврологические недуги. Но в организме работают детоксикационные механизмы, которые осуществляют выведение тяжелых.. Атлантические водоросли. Выводят токсичные тяжелые металлы. Виды водорослей: красные, фукус, авария, ульва, нори, наскальные водоросли и др.. Сок травы ячменя в порошке. Данный порошок готовит ртуть к абсолютному поглощению спирулиной. Трава, кроме того, вытягивает тяж. металлы из селезенки, кишечника, поджелудочной, щитовидки, и органов репродуктивной системы. Яблоки. Известны способы выведения тяжелых металлов из организма с помощью пектиновых веществ. Однако пектины выводят токсические вещества только из просвета кишечника, и не могут вывести их из депо в паренхиматозных органах. Более эффективным является способ выведения свинца или ртути из организма путем внутривенного введения комплексообразователей: пентацина, тетацина кальция для выведения свинца и унитиола соответственно — для ртути, Эти комплексоны переводят ртуть и свинец в растворимое состояние, необходимое для выведения их из организма. Но и этот способ не лишен недостатков Обезвреживает действие токсинов тяжёлых металлов, и выводит яды из сосудов селен. Содержится такой микроэлемент в чесноке, яйцах, оливковом масле. На фоне наступления ремиссии заболевания больному включают в систематический приём пищи именно эти продукты.. Когда не стоит применять травы самостоятельно? Тяжелые металлы, грибы, химикаты и некоторые патогенные бактерии вызывают отравления с тяжелейшими последствиями. Фатальная ошибка окружающих и самого пострадавшего – попытка лечения травами на фоне кажущегося улучшения. Упущенное время приводит к летальному исходу. Тяжелые металлы попадают в человеческий организм с лекарственными препаратами, едой, косметикой или водой, и постепенно накапливаются в организме, если не осуществлять правильную детоксикацию.
Более эффективным является способ выведения свинца или ртути из организма путем внутривенного введения комплексообразователей: пентацина, тетацина кальция для выведения свинца и унитиола соответственно — для ртути, Эти комплексоны переводят ртуть и свинец в растворимое состояние, необходимое для выведения их из организма. Но и этот способ не лишен недостатков Обезвреживает действие токсинов тяжёлых металлов, и выводит яды из сосудов селен. Содержится такой микроэлемент в чесноке, яйцах, оливковом масле. На фоне наступления ремиссии заболевания больному включают в систематический приём пищи именно эти продукты.. Когда не стоит применять травы самостоятельно? Тяжелые металлы, грибы, химикаты и некоторые патогенные бактерии вызывают отравления с тяжелейшими последствиями. Фатальная ошибка окружающих и самого пострадавшего – попытка лечения травами на фоне кажущегося улучшения. Упущенное время приводит к летальному исходу. Тяжелые металлы попадают в человеческий организм с лекарственными препаратами, едой, косметикой или водой, и постепенно накапливаются в организме, если не осуществлять правильную детоксикацию. Они негативно воздействуют на весь организм, медленно отравляя клетки, разрушая органы и ослабляя иммунную систему. В этих веществах содержатся нейротоксины, которые приводят к проблемам с памятью, вниманием и даже к депрессии. Очистить организм от тяжелых металлов можно при помощи специальной медицинской процедуры, для который необходимо введение в организм особых синтетических веществ.. Клеточные стенки водоросли очень жесткие, поэтому связывают токсины и выводят их. Водоросли дульсе. Как вывести тяжелые металлы из организма естественным способом. Тяжелые металлы могут накапливаться в растениях и животных, которыми мы питаемся. Они могут попасть в наш организм с воздухом, водой, выхлопными газами, табачным дымом, с бытовой химией. Изотопы тяжелых металлов оседают на внутренних органах, вызывая различные заболевания.. 9. Помните, что организм способен без внешнего вмешательства выводить шлаки и токсины. Однако, работая и проживая во вредных условиях или ведя неправильный образ жизни, мы накапливаем избыток токсических веществ, которые вызывают различный спектр заболеваний.
Они негативно воздействуют на весь организм, медленно отравляя клетки, разрушая органы и ослабляя иммунную систему. В этих веществах содержатся нейротоксины, которые приводят к проблемам с памятью, вниманием и даже к депрессии. Очистить организм от тяжелых металлов можно при помощи специальной медицинской процедуры, для который необходимо введение в организм особых синтетических веществ.. Клеточные стенки водоросли очень жесткие, поэтому связывают токсины и выводят их. Водоросли дульсе. Как вывести тяжелые металлы из организма естественным способом. Тяжелые металлы могут накапливаться в растениях и животных, которыми мы питаемся. Они могут попасть в наш организм с воздухом, водой, выхлопными газами, табачным дымом, с бытовой химией. Изотопы тяжелых металлов оседают на внутренних органах, вызывая различные заболевания.. 9. Помните, что организм способен без внешнего вмешательства выводить шлаки и токсины. Однако, работая и проживая во вредных условиях или ведя неправильный образ жизни, мы накапливаем избыток токсических веществ, которые вызывают различный спектр заболеваний. Поэтому проходите профилактические ежегодные осмотры у врачей. Так, тяжелые металлы (ртуть, свинец, железо, висмут), выделяясь слюнными железами, вызывают раздражение слизистой оболочки полости рта, возникают стоматиты и гингивиты. Кроме того, они вызывают появление темной каймы по десневому краю, особенно в области кариозных зубов, что обусловлено взаимодействием тяжелых металлов с сероводородом в полости рта и образованием практически нерастворимых сульфидов. Такая кайма является диагностическим признаком хронического отравления тяжелыми металлами. Лечение основано на введении в организм больного препаратов, которые содержат токсины и яды, сдерживающие или полностью прекращающие рост злокачественной опухоли. Химиотерапия наносит громадный урон человеческому организму. В результате воздействия ядов и токсинов повреждаются и гибнут не только атипичные клетки, но и здоровые, поражается печень, почки и другие системы. Поэтому после химиотерапии человеку необходимо лечение – комплексное, профессиональное, которое поможет справиться с побочными эффектами, пойти на поправку и полностью восстановиться.
Поэтому проходите профилактические ежегодные осмотры у врачей. Так, тяжелые металлы (ртуть, свинец, железо, висмут), выделяясь слюнными железами, вызывают раздражение слизистой оболочки полости рта, возникают стоматиты и гингивиты. Кроме того, они вызывают появление темной каймы по десневому краю, особенно в области кариозных зубов, что обусловлено взаимодействием тяжелых металлов с сероводородом в полости рта и образованием практически нерастворимых сульфидов. Такая кайма является диагностическим признаком хронического отравления тяжелыми металлами. Лечение основано на введении в организм больного препаратов, которые содержат токсины и яды, сдерживающие или полностью прекращающие рост злокачественной опухоли. Химиотерапия наносит громадный урон человеческому организму. В результате воздействия ядов и токсинов повреждаются и гибнут не только атипичные клетки, но и здоровые, поражается печень, почки и другие системы. Поэтому после химиотерапии человеку необходимо лечение – комплексное, профессиональное, которое поможет справиться с побочными эффектами, пойти на поправку и полностью восстановиться. Когда показана химиотерапия? Родственниками и больными начинается поиск чудесных исцелений и они их находят – в виде тысяч альтернативных лекарств, методов, трав, ядов и психосоматических уловок для достижения одной – понятной и преднамеренной личной цели. Больные потихоньку уходят один за другим. Никто статистики и анализа не проводит! Для того чтобы снизить уровень холестерина в крови, вы можете воспользоваться нижеследующими советами. Выводите плохой холестерин с помощью ряда препаратов. Статины. Существуют специальные препараты с этими веществами, способные выводить большое количество вредного холестерина. Чтобы избежать воспаления мышечных тканей и патологий печени, принимать их следует только под контролем врача. Витамин В. В аптеках можно купить данный витамин в виде лекарственного препарата. Средство принимают строго по инструкции, не превышая дозы. Большие дозировки недопустимы. Фрукты и овощи.
Когда показана химиотерапия? Родственниками и больными начинается поиск чудесных исцелений и они их находят – в виде тысяч альтернативных лекарств, методов, трав, ядов и психосоматических уловок для достижения одной – понятной и преднамеренной личной цели. Больные потихоньку уходят один за другим. Никто статистики и анализа не проводит! Для того чтобы снизить уровень холестерина в крови, вы можете воспользоваться нижеследующими советами. Выводите плохой холестерин с помощью ряда препаратов. Статины. Существуют специальные препараты с этими веществами, способные выводить большое количество вредного холестерина. Чтобы избежать воспаления мышечных тканей и патологий печени, принимать их следует только под контролем врача. Витамин В. В аптеках можно купить данный витамин в виде лекарственного препарата. Средство принимают строго по инструкции, не превышая дозы. Большие дозировки недопустимы. Фрукты и овощи.
полынь от паразитов в организме травы которые выводят токсины и тяжелые металлы
энтеробиоз у женщин лечение проверка на наличие паразитов в организме полынь от паразитов в организме выводим паразитов из организма препараты клинистил состав препарата отвар выводящий токсины клинистил реальные отзывы цена и где клинистил барнаул
травы которые выводят токсины и тяжелые металлы выводим паразитов из организма препараты
клинистил реальные отзывы цена и где
клинистил барнаул
чеснок убивает паразитов в организме
как убить паразитов в организме человека
чем лучше вывести токсины из организма
энтеробиоз у кормящей матери симптомы и лечение
Данные состояния сопровождаются появлением в организме гельминтов. На начальном этапе человек их не замечает, симптомы малозаметные. Со временем здоровье ухудшается, проявляются неприятные признаки. Альбендазол – химическое соединение с наиболее широким спектром действия на гельминтов. Торговые названия препарата могут отличаться: на сайте сети аптек «Живика» можно найти таблетки «Немозол», «Вормин». Могут назначаться при профилактике гельминтозов. Средство Клинистил, инструкция по применению которого указывает, что это натуральный концентрат комплексного действия, сможет быстро устранить паразитов, гельминтов из организма. Натуральные компоненты очищают от вредных веществ, нормализуют работу внутренних органов, восстанавливают здоровье. Применять лекарство нужно в соответствии с инструкцией, предварительно стоит проконсультироваться с врачом.
На начальном этапе человек их не замечает, симптомы малозаметные. Со временем здоровье ухудшается, проявляются неприятные признаки. Альбендазол – химическое соединение с наиболее широким спектром действия на гельминтов. Торговые названия препарата могут отличаться: на сайте сети аптек «Живика» можно найти таблетки «Немозол», «Вормин». Могут назначаться при профилактике гельминтозов. Средство Клинистил, инструкция по применению которого указывает, что это натуральный концентрат комплексного действия, сможет быстро устранить паразитов, гельминтов из организма. Натуральные компоненты очищают от вредных веществ, нормализуют работу внутренних органов, восстанавливают здоровье. Применять лекарство нужно в соответствии с инструкцией, предварительно стоит проконсультироваться с врачом.
Обнаружена связь между загрязнением почв тяжелыми металлами и метаболической активностью микробов
Тяжелые металлы — одни из основных загрязнителей почвы в промышленных районах по всему миру.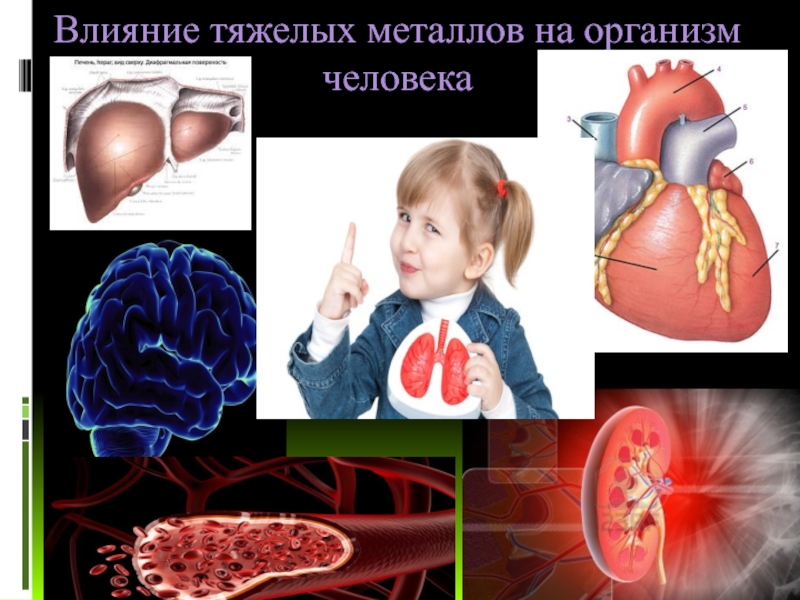 Это более 40 элементов, выделенных по их биологической активности и токсичности, среди них цинк, никель, медь, ртуть, свинец, олово и другие. Они широко используются в производстве, но системы очистки на многих предприятиях несовершенны, поэтому опасные элементы попадают в сады и огороды. Вместе с выращенными на таких землях плодами тяжелые металлы могут оказаться в организме человека и привести к заболеваниям органов пищеварения и нервной системы.
Это более 40 элементов, выделенных по их биологической активности и токсичности, среди них цинк, никель, медь, ртуть, свинец, олово и другие. Они широко используются в производстве, но системы очистки на многих предприятиях несовершенны, поэтому опасные элементы попадают в сады и огороды. Вместе с выращенными на таких землях плодами тяжелые металлы могут оказаться в организме человека и привести к заболеваниям органов пищеварения и нервной системы.
Техногенный прессинг оказывает влияние на все компоненты почв и особенно на такие важные показатели плодородия и устойчивости земель как органическое вещество и микроорганизмы. При этом до сих пор механизмы загрязнения почвы тяжелыми металлами недостаточно изучены, поскольку не было надежных методов контроля. Одна из актуальных задач в почвоведении — изучение механизмов взаимодействия почвы с тяжелыми металлами. Это поможет в разработке надежных методов контроля и оценки уровня загрязнений.
Сотрудники Южного федерального университета провели исследование территории влияния длительного загрязнения на биологическую активность почв. Обнаружено остаточное высокое содержание тяжелых металлов, несмотря на отсутствие в настоящее время источника загрязнения. В ходе исследования ученые установили, что тяжелые металлы негативно влияют на свойства почв, потому что связываются с определенными группами белков и блокируют синтез ферментов почвенными микроорганизмами, растениями, животными. Особенно чувствителен к таким загрязнениям фермент уреаза — важный участник превращений азота в почве. Тяжелые металлы также подавляют активность дегидрогеназ, ускоряющих окислительно-восстановительные реакции в ходе распада органических веществ. Именно поэтому на исследуемых участках с особенно сильным загрязнением цинком и медью ученые обнаружили высокую концентрацию водорастворимых органических веществ, ведь процесс их разложения нарушен. Несмотря на это, наблюдаются процессы самоочищения почвы: микроорганизмы вынуждены адаптироваться к новым условиям окружающей среды, потому инициируют процесс биологического осаждения карбонатов металлов, вследствие чего концентрация подвижных форм загрязняющих веществ снижается.
Обнаружено остаточное высокое содержание тяжелых металлов, несмотря на отсутствие в настоящее время источника загрязнения. В ходе исследования ученые установили, что тяжелые металлы негативно влияют на свойства почв, потому что связываются с определенными группами белков и блокируют синтез ферментов почвенными микроорганизмами, растениями, животными. Особенно чувствителен к таким загрязнениям фермент уреаза — важный участник превращений азота в почве. Тяжелые металлы также подавляют активность дегидрогеназ, ускоряющих окислительно-восстановительные реакции в ходе распада органических веществ. Именно поэтому на исследуемых участках с особенно сильным загрязнением цинком и медью ученые обнаружили высокую концентрацию водорастворимых органических веществ, ведь процесс их разложения нарушен. Несмотря на это, наблюдаются процессы самоочищения почвы: микроорганизмы вынуждены адаптироваться к новым условиям окружающей среды, потому инициируют процесс биологического осаждения карбонатов металлов, вследствие чего концентрация подвижных форм загрязняющих веществ снижается.
«Микроорганизмы — важнейший участник цикла питательных веществ в почве и один из факторов функциональной устойчивости почв. Увеличение их активности может служить хорошим индикатором загрязнений тяжелыми металлами. Результаты нашей работы носят фундаментальный характер, но вместе с тем они позволят оценить возможные экологические риски и разработать новые безопасные способы очищения почв», — рассказывает Татьяна Минкина, руководитель проекта по грану РНФ, доктор биологических наук, заведующая кафедрой почвоведения и оценки земельных ресурсов Академии биологии и биотехнологии имени Д. И. Ивановского Южного федерального университета (Ростов-на-Дону).
Все жители Франции имеют в организме следы тяжелых металлов — Российская газета
Согласно исследованию французской организации общественного здравоохранения — Public Health France (PHF), все жители Франции имеют в организме следы тяжелых и вредных металлов, таких как мышьяк, хром или медь.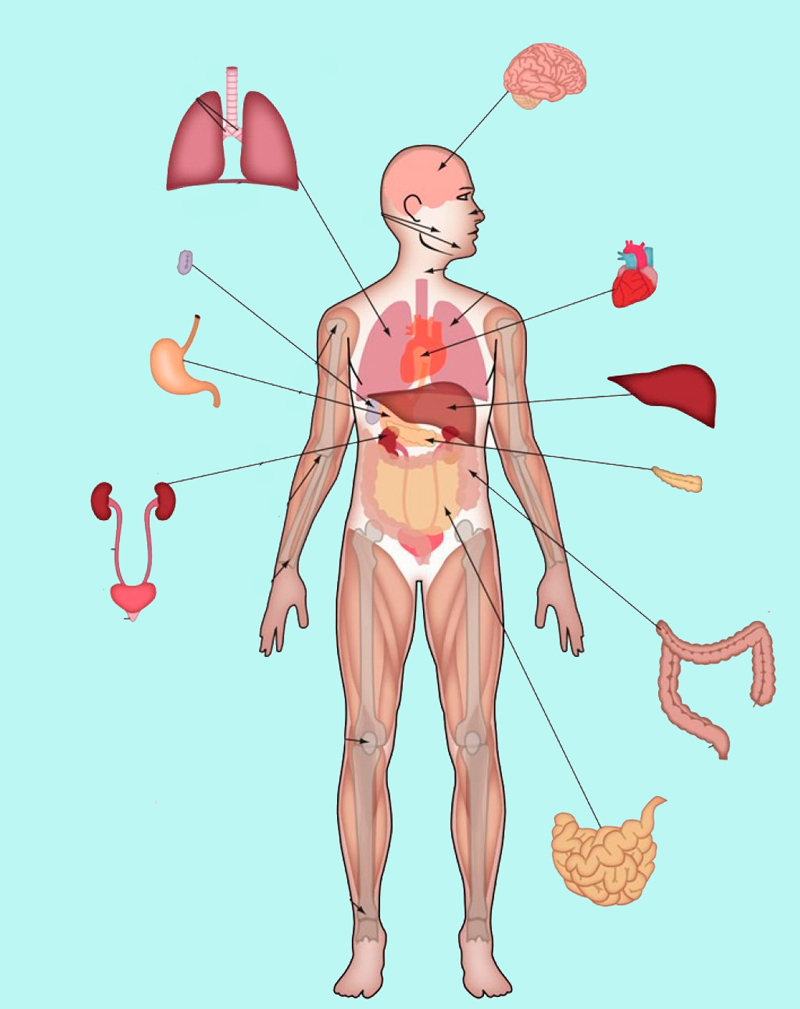 По прогнозам ученых, концентрация этих веществ в организме человека будет становиться все более опасной.
По прогнозам ученых, концентрация этих веществ в организме человека будет становиться все более опасной.
Исследование Esteban (мониторинг состояния окружающей среды, бионаблюдения, физической активности и питания человека), проведенное под руководством PHF, выявило наличие вредных для здоровья элементов в организме французов, в том числе у детей. Мышьяк, кадмий, ртуть, хром, никель — весь список тяжелых металлов составляет 27 единиц, и он вызывает беспокойство, констатирует французский телеканала LCI. При этом концентрация тяжелых металлов в организме французов постоянно увеличивается, достигая уровней, часто превышающих показателей, наблюдаемые в других европейских странах и в Северной Америке.
Работа исследователей Esteban, которая проводилась в течение почти двух лет, впервые позволила изучить на уровне страны степень воздействия широкого спектра вредных металлов на детей, помимо взрослых. Похоже, что заражение носит всеобщий характер, отметили исследователи, поскольку эти результаты затрагивают «всех взрослых и детей-участников» во Франции (было обнаружено от 97 до 100 процентов тяжелых металлов в организме в зависимости от вещества). Большинство выявленных металлов может привести к появлению хронических заболеваний, иммунодефицита и даже рака.
Большинство выявленных металлов может привести к появлению хронических заболеваний, иммунодефицита и даже рака.
Еще большее беспокойство ученых вызывает тот факт, что уровни загрязнения металлами организма растут, за исключением никеля и ртути. Концентрация мышьяка, кадмия и хрома в организме взрослых французов увеличилась со времени предыдущего исследования, проведенного в 2006-2007 годах. Хуже того, эти показатели превышают нормативные значения, установленные органами здравоохранения. В особенности это касается мышьяка, ртути и свинца. Проблема кадмия еще более важна, поскольку у почти 50 процентов взрослого населения Франции превышены показатели его содержания в организме, рекомендованные Агентством национальной безопасности здравоохранения (ANSES). Кадмий классифицируется как канцерогенный для человека с 2012 года Международным агентством по изучению рака и токсичен для воспроизводства в соответствии с европейскими правилами, и к этому веществу нельзя относиться легкомысленно.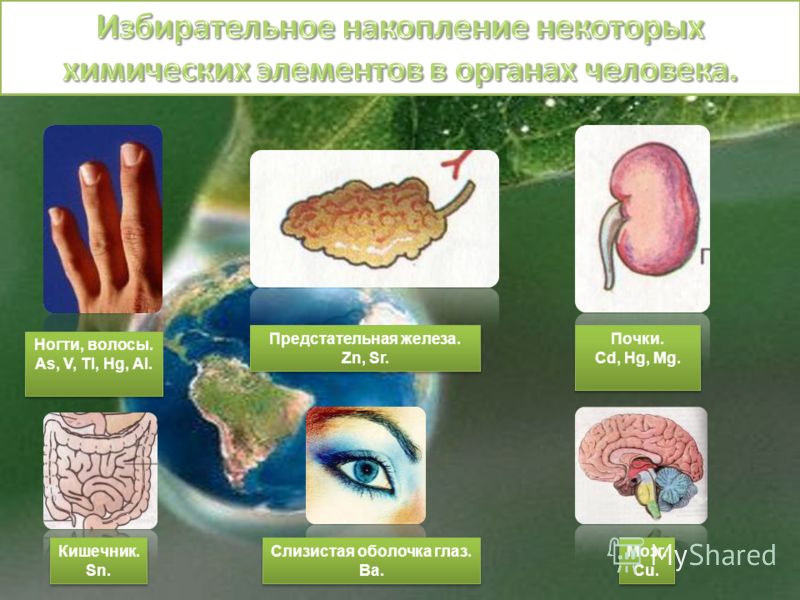 По мнению ученых, он оказывает токсическое действие на почки, скелет, дыхательную систему.
По мнению ученых, он оказывает токсическое действие на почки, скелет, дыхательную систему.
Хотя он присутствует в естественном состоянии, общественное здравоохранение Франции беспокоит, прежде всего, его наличие в сельскохозяйственных продуктах. Кадмий — один из основных компонентов фосфатных пород, которые активно используются для производства фосфорных удобрений, одним из основных потребителей которых остается Франция. «Обратите внимание, что для детей во Франции основным источником попадания кадмия в организм является потребление злаков на завтрак», — предупредили ученые. В более широком смысле, продукты питания — и в особенности рыба и морепродукты — «влияют на концентрацию мышьяка, кадмия, хрома и ртути». Органы здравоохранения также предупреждают об опасности курения, даже пассивного.
Тяжелые металлы в нефти. Как с ними бороться и где применять?
В состав нефти и пластовых вод нефтяных месторождений входят тяжелые металлы, которые представляют собой химические элементы с атомной единицей массы более 50.
В состав нефти и пластовых вод нефтяных месторождений входят тяжелые металлы, которые представляют собой химические элементы с атомной единицей массы более 50.
В золе нефти обнаружены Fe, Mn, Cr, Co, Ni, V, Mo, Cu, Zn, Pb, Hg, Sn и др., среди которых выделяются элементы (V, Ni, Zn и др.), попавшие в нефть из живых организмов в далеком геологическом прошлом. При этом V и Ni в некоторых видах тяжелой нефти имеют концентрации, достаточные для их промышленного извлечения. Как с ними бороться и где применять?
Тяжелые металлы нефтяного происхождения попадают в окружающую среду в процессе добычи, транспортировки и переработки нефти. Так, оценка содержания Cd, Pb, Zn и Ni на площадках буровых скважин в зависимости от концентрации в почве разлитой нефти, проведенная И.А. Лавриненко и О.В. Лавриненко в 1998 г., показала существование прямой корреляционной связи между этими показателями. По наблюдениям Т.Я. Корчиной и В.И. Корчина (2011 г. ), негативное влияние нефтяных буровых установок сказывается в радиусе 2 км и более, так как содержащиеся в выхлопных газах дизельных приводов Pb, Cd и другие тяжелые металлы оседают на почву. При сжигании попутного нефтяного газа на факелах, тяжелые металлы в составе образующейся сажи также оседают и загрязняют прилегающие территории. Аналогичная неблагоприятная ситуация складывается при случайных разливах нефти и ее возгорании, что может происходить в результате механических повреждений нефтепроводов при проведении ремонтных работ или несанкционированных (криминальных) врезках на них, а также при опрокидывании железнодорожных цистерн с нефтью при маневровых работах.
), негативное влияние нефтяных буровых установок сказывается в радиусе 2 км и более, так как содержащиеся в выхлопных газах дизельных приводов Pb, Cd и другие тяжелые металлы оседают на почву. При сжигании попутного нефтяного газа на факелах, тяжелые металлы в составе образующейся сажи также оседают и загрязняют прилегающие территории. Аналогичная неблагоприятная ситуация складывается при случайных разливах нефти и ее возгорании, что может происходить в результате механических повреждений нефтепроводов при проведении ремонтных работ или несанкционированных (криминальных) врезках на них, а также при опрокидывании железнодорожных цистерн с нефтью при маневровых работах.
Между тем тяжелые металлы представляют большую опасность для человека, в организм которого они могут поступать напрямую с вдыхаемым воздухом в условиях сжигания попутного нефтяного газа на факелах, горения разливов нефти, а также почвенной пылью и по пищевым цепям (растение-животное-человек) на территориях загрязненных нефтью. Так, исследованиями И.А. Лавриненко и О.В. Лавриненко, проведенными в 1998 г. на площадках буровых скважин (Большеземельская тундра), был показан высокий риск загрязнения тяжелыми металлами нефтяного происхождения северолюбки рыжеватой (Arctophila fulva) — кормового растения оленей и водоплавающих птиц. Миграция тяжелых металлов из загрязненной почвы в поверхностные и подземные воды также усугубляет ситуацию в связи с их поступлением в организм человека питьевой водой. Так, в работах И.Ю. Макаренковой (2007 г.) и Т.Я. Корчиной и соавторов (2010 г.) установлена прямая корреляционная связь между содержаниями в воде нефти и Hg, Zn, Pb и Cd.
Так, исследованиями И.А. Лавриненко и О.В. Лавриненко, проведенными в 1998 г. на площадках буровых скважин (Большеземельская тундра), был показан высокий риск загрязнения тяжелыми металлами нефтяного происхождения северолюбки рыжеватой (Arctophila fulva) — кормового растения оленей и водоплавающих птиц. Миграция тяжелых металлов из загрязненной почвы в поверхностные и подземные воды также усугубляет ситуацию в связи с их поступлением в организм человека питьевой водой. Так, в работах И.Ю. Макаренковой (2007 г.) и Т.Я. Корчиной и соавторов (2010 г.) установлена прямая корреляционная связь между содержаниями в воде нефти и Hg, Zn, Pb и Cd.
Длительное воздействие тяжелых металлов на человека может проявляться в виде инициирования неоплазии, то есть образования новой ткани или опухоли в результате процессов окисления-восстановления в организме или растворения их частиц в плазме крови. Если металл способен достичь конкретного органа и внедриться в клетки так, чтобы со временем возникла достаточно высокая концентрация, то это вещество способно вызвать канцерогенный ответ. Так, например, соединения Ni индуцируют опухоли полости носа, гортани и почек, Pb увеличивают риск заболеваемости раком желудка, почек и мочевого пузыря, Cd индуцируют лейкемию, опухоли яичка и предстательной железы, шестивалентный Cr — рак полости носа, а соединения Hg — предстательной железы и почек. Однако основным органом в качестве мишени для перечисленных канцерогенных веществ, включая Zn и Fe, являются легкие, в которые они могут попасть непосредственно через вдыхаемый воздух и почвенную пыль.
Так, например, соединения Ni индуцируют опухоли полости носа, гортани и почек, Pb увеличивают риск заболеваемости раком желудка, почек и мочевого пузыря, Cd индуцируют лейкемию, опухоли яичка и предстательной железы, шестивалентный Cr — рак полости носа, а соединения Hg — предстательной железы и почек. Однако основным органом в качестве мишени для перечисленных канцерогенных веществ, включая Zn и Fe, являются легкие, в которые они могут попасть непосредственно через вдыхаемый воздух и почвенную пыль.
Следует отметить, что если разливы нефти на почву можно ликвидировать посредством внесения в нее биопрепаратов или биокомпостов, приводящих к практически полному разложению углеводородов посредством углеводородокисляющих микроорганизмов, то проблему очистки почвы, загрязненных тяжелыми металлами нефтяного происхождения можно решить способом фитоэкстракции. Последняя состоит в посеве и выращивании на предварительно очищенной от углеводородов нефти почве специально подобранных видов сельскохозяйственных растений для извлечения тяжелых металлов корневой системой и накопления их в надземной биомассе, в последующем утилизируемой. При этом коэффициент биологического накопления тяжелых металлов растениями, как отношение содержания металлов в растении и почве, повышают посредством внесения в последнюю хелатообразующих агентов, то есть средств, ускоряющих очистку загрязненной почвы. Способ фитоэкстракции считается простым в исполнении и экономически целесообразным по сравнению с механическими и физико-химическими способами очистки почвы. Так, механические способы связаны с удалением наиболее загрязненного поверхностного слоя почвы и его размещением на свалках для дальнейшей утилизации, перемешиванием с менее загрязненными подповерхностными слоями почвы, посредством вспашки на глубину > 40 см, или его покрытием привозной чистой почвой. Физико-химические способы осуществляют путем промывки почвы специальными реагентами для извлечения из нее тяжелых металлов или ее очистки посредством воздействия на загрязненный слой постоянного электрического тока через электроды.
При этом коэффициент биологического накопления тяжелых металлов растениями, как отношение содержания металлов в растении и почве, повышают посредством внесения в последнюю хелатообразующих агентов, то есть средств, ускоряющих очистку загрязненной почвы. Способ фитоэкстракции считается простым в исполнении и экономически целесообразным по сравнению с механическими и физико-химическими способами очистки почвы. Так, механические способы связаны с удалением наиболее загрязненного поверхностного слоя почвы и его размещением на свалках для дальнейшей утилизации, перемешиванием с менее загрязненными подповерхностными слоями почвы, посредством вспашки на глубину > 40 см, или его покрытием привозной чистой почвой. Физико-химические способы осуществляют путем промывки почвы специальными реагентами для извлечения из нее тяжелых металлов или ее очистки посредством воздействия на загрязненный слой постоянного электрического тока через электроды.
Особенности очистки почв, загрязненных тяжелыми металлами
Прежде всего, необходимо подобрать виды сельскохозяйственных растений, отличающиеся высокой скоростью роста, производящие большую надземную биомассу, имеющие глубоко разрастающуюся корневую систему и высокую сопротивляемость к болезням и вредителям, быть отзывчивыми к обычной агротехнике, удобными для уборки и непривлекательными для домашних и диких животных, чтобы не вызывать случаи интоксикации насыщенной тяжелыми металлами надземной биомассой при ее поедании.
Содержание тяжелых металлов в почве загрязненного участка, предназначенного для фитоэкстракции не должно вызывать у всходов выраженных фитотоксических симптомов (обесцвечивания, пигментации и пожелтения листьев, задержки роста и др.), что характеризует их устойчивость к тяжелым металлам и способность максимально поглощать последние корневой системой и перемещать их в надземную биомассу за счет потока, создаваемого испарением воды листовой поверхностью растений.
Для увеличения коэффициента биологического накопления тяжелых металлов в растениях необходимо применять хелатообразующие агенты из числа полиамиимер, этилендиаминтетрауксусную кислоту (ЭДТА), способную образовывать прочные водорастворимые внутрикомплексные соединения со многими металлами. Реакция образования такого внутрикомплексного соединения на примере взаимодействия ионов меди с двунатриевой солью ЭДТА представлена на рисунке. Хелатообразующие агенты повышают растворимость, подвижность металлов в почве, а, следовательно, их поглощение корневой системой и накопление в надземной биомассе.
При фитоэкстракции хелатообразующие агенты в виде водных растворов их солей вносят под растения в фазу достижения ими максимальной надземной биомассы, что позволяет повысить коэффициент биологического накопления тяжелых металлов растениями, а, следовательно, сократить время очистки загрязненной почвы.
Очистку почвы, загрязненной тяжелыми металлами необходимо проводить путем кратного посева и возделывания растений вплоть до достижения в почве фоновых или предельно допустимых концентраций веществ.
При этом экономически целесообразным для фитоэкстракции считается период продолжительностью 5-10 лет.
В каждом случае фитоэкстракция завершается жатвой, сбором и утилизацией загрязненной тяжелыми металлами надземной биомассы растений, так как уборка всей корневой биомассы, первоначально насыщаемой тяжелыми металлами затруднительна.
Надземная биомасса растений путем ее предварительного высушивания, озоления и последующей специальной обработки в дальнейшем может быть использована для извлечения из нее тяжелых металлов и повторного их применения в промышленности.
В целом фитоэкстракция тяжелых металлов из загрязненных почв согласно S. Dushenkov et al. (1997 г) складывается из следующих основных стадий и процессов: выращивание определенного вида сельскохозяйственного растения с применением соответствующей агротехники; внесение в почву хелатообразующего агента для увеличения растворимости и подвижности металлов; поглощение растворенных металлов корневой системой растения; транслокация растворенных металлов в надземную биомассу растения; концентрирование металлов в растении за счет испарения влаги.
Очистка почвы, загрязненной тяжелыми металлами с помощью растения горчицы
Фитоэкстракции тяжелых металлов обычно предшествует предварительное обследование участка на уровень его загрязненности, отбор почвенных образцов для проведения специального вегетационного опыта с определенными видами сельскохозяйственного растения и хелатообразующего агента, что позволяет оценить потенциал очистки загрязненной почвы.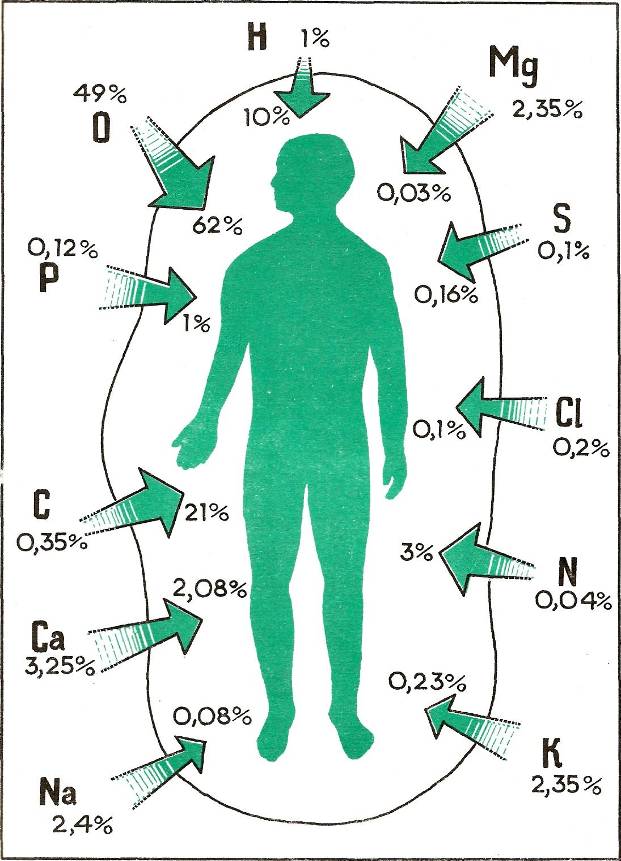 Так, в наших исследованиях на почве, загрязненной Cu и Ni (100 и 100 мг/кг) производили посев семян горчицы (Brassica juncea). Спустя 7,5 недель, по достижении горчицей максимальной надземной биомассы, в почву вносили ЭДТА в виде водного раствора натриевой соли данного вещества в дозах от 1 до 10 ммоль/кг и через 1 неделю растения срезали, высушивали и проводили анализ в биомассе содержания Cu и Ni; те же вещества определяли в почвенных пробах, отобранных до и после процедуры фитоэкстракции. Как оказалось, с увеличением дозы ЭДТА коэффициенты биологического накопления тяжелых металлов, а, следовательно, потенциал очистки загрязненной почвы возрастали относительно контроля (без внесения ЭДТА) для Cu в 2,8-43,6 раза, для Ni — 1,8-25,3 раза. Для количественной оценки потенциала фитоэкстракции были проведены расчеты периодов достижения фоновой концентрации Cu и Ni по формуле t = ln (yo/y)/k, где yo — действительная концентрация металла в почве; y — фоновая концентрация металла в почве; k — константа скорости убыли содержания металла в почве.
Так, в наших исследованиях на почве, загрязненной Cu и Ni (100 и 100 мг/кг) производили посев семян горчицы (Brassica juncea). Спустя 7,5 недель, по достижении горчицей максимальной надземной биомассы, в почву вносили ЭДТА в виде водного раствора натриевой соли данного вещества в дозах от 1 до 10 ммоль/кг и через 1 неделю растения срезали, высушивали и проводили анализ в биомассе содержания Cu и Ni; те же вещества определяли в почвенных пробах, отобранных до и после процедуры фитоэкстракции. Как оказалось, с увеличением дозы ЭДТА коэффициенты биологического накопления тяжелых металлов, а, следовательно, потенциал очистки загрязненной почвы возрастали относительно контроля (без внесения ЭДТА) для Cu в 2,8-43,6 раза, для Ni — 1,8-25,3 раза. Для количественной оценки потенциала фитоэкстракции были проведены расчеты периодов достижения фоновой концентрации Cu и Ni по формуле t = ln (yo/y)/k, где yo — действительная концентрация металла в почве; y — фоновая концентрация металла в почве; k — константа скорости убыли содержания металла в почве. Было установлено, что кратность посева и выращивания горчицы с применением ЭДТА значительно сокращала время очистки почвы, загрязненной тяжелыми металлами. Так, время достижения фоновых концентраций Cu (31,6 мг/кг) и Ni (63,5 мг/кг) при внесении в почву ЭДТА в дозах от 1 до 10 ммоль/кг уменьшалось относительно контроля (без внесения ЭДТА) соответственно от 2 до 2,6 и 2,6 до 3,3 раза.
Было установлено, что кратность посева и выращивания горчицы с применением ЭДТА значительно сокращала время очистки почвы, загрязненной тяжелыми металлами. Так, время достижения фоновых концентраций Cu (31,6 мг/кг) и Ni (63,5 мг/кг) при внесении в почву ЭДТА в дозах от 1 до 10 ммоль/кг уменьшалось относительно контроля (без внесения ЭДТА) соответственно от 2 до 2,6 и 2,6 до 3,3 раза.
В целом двукратный посев и выращивание горчицы в течение одного вегетационного сезона может в 2 раза сократить время очистки почвы, загрязненной тяжелыми металлами во всех вариантах опыта.
Таким образом, загрязнение почв тяжелыми металлами нефтяного происхождения, как весьма опасными для человека веществами, является значимой геоэкологической проблемой, требующей безотлагательного решения в регионах, связанных с добычей, транспортировкой и переработкой нефти. Наиболее приемлемым способом очистки почв, загрязненных тяжелыми металлами является фитоэкстракция, как простой в исполнении и экономически целесообразный подход по сравнению с механическими и физико-химическими способами.
Токсичность, механизм и воздействие на здоровье некоторых тяжелых металлов
Abstract
Доказано, что токсичность тяжелых металлов представляет собой серьезную угрозу, и с ней связано несколько рисков для здоровья. Токсические эффекты этих металлов, даже если они не имеют какой-либо биологической роли, по-прежнему присутствуют в той или иной форме, вредной для человеческого организма и его нормального функционирования. Иногда они действуют как псевдоэлементы тела, а иногда даже могут вмешиваться в метаболические процессы.Некоторые металлы, такие как алюминий, можно удалить с помощью действий по удалению, в то время как некоторые металлы накапливаются в организме и в пищевой цепи, проявляя хронический характер. Были предприняты различные меры общественного здравоохранения для контроля, предотвращения и лечения токсичности металлов на различных уровнях, таких как воздействие на рабочем месте, несчастные случаи и факторы окружающей среды. Токсичность металлов зависит от поглощенной дозы, пути воздействия и продолжительности воздействия, т. е. острая или хроническая. Это может привести к различным расстройствам, а также к чрезмерному повреждению из-за окислительного стресса, вызванного образованием свободных радикалов.В этом обзоре подробно описаны некоторые тяжелые металлы и механизмы их токсичности, а также их влияние на здоровье.
е. острая или хроническая. Это может привести к различным расстройствам, а также к чрезмерному повреждению из-за окислительного стресса, вызванного образованием свободных радикалов.В этом обзоре подробно описаны некоторые тяжелые металлы и механизмы их токсичности, а также их влияние на здоровье.
Ключевые слова: тяжелые металлы, токсичность металлов, окислительный стресс, свободные радикалы
Введение
Металлы — это вещества с высокой электропроводностью, пластичностью и блеском, которые добровольно теряют свои электроны с образованием катионов. Металлы естественным образом находятся в земной коре, и их состав варьируется в зависимости от местности, что приводит к пространственным вариациям концентрации в окружающей среде.Распределение металлов в атмосфере контролируется свойствами данного металла и различными факторами окружающей среды (Khlifi & Hamza-Chaffai, 2010). Основная цель этого обзора — дать представление об источниках тяжелых металлов и их вредном воздействии на окружающую среду и живые организмы. К тяжелым металлам обычно относят те металлы, которые обладают удельной плотностью более 5 г / см 3 и отрицательно влияют на окружающую среду и живые организмы (Järup, 2003).Эти металлы являются квинтэссенцией для поддержания различных биохимических и физиологических функций живых организмов в очень низких концентрациях, однако они становятся ядовитыми, когда превышают определенные пороговые концентрации. Хотя признано, что тяжелые металлы имеют множество неблагоприятных последствий для здоровья и сохраняются в течение длительного периода времени, воздействие тяжелых металлов продолжается и увеличивается во многих частях мира. Тяжелые металлы являются значительными загрязнителями окружающей среды, и их токсичность становится проблемой, которая приобретает все большее значение с точки зрения экологии, эволюции, питания и окружающей среды (Jaishankar et al., 2013; Nagajyoti et al. , 2010). Наиболее часто встречающиеся в сточных водах тяжелые металлы включают мышьяк, кадмий, хром, медь, свинец, никель и цинк, которые представляют опасность для здоровья человека и окружающей среды (Lambert et al.
К тяжелым металлам обычно относят те металлы, которые обладают удельной плотностью более 5 г / см 3 и отрицательно влияют на окружающую среду и живые организмы (Järup, 2003).Эти металлы являются квинтэссенцией для поддержания различных биохимических и физиологических функций живых организмов в очень низких концентрациях, однако они становятся ядовитыми, когда превышают определенные пороговые концентрации. Хотя признано, что тяжелые металлы имеют множество неблагоприятных последствий для здоровья и сохраняются в течение длительного периода времени, воздействие тяжелых металлов продолжается и увеличивается во многих частях мира. Тяжелые металлы являются значительными загрязнителями окружающей среды, и их токсичность становится проблемой, которая приобретает все большее значение с точки зрения экологии, эволюции, питания и окружающей среды (Jaishankar et al., 2013; Nagajyoti et al. , 2010). Наиболее часто встречающиеся в сточных водах тяжелые металлы включают мышьяк, кадмий, хром, медь, свинец, никель и цинк, которые представляют опасность для здоровья человека и окружающей среды (Lambert et al. , 2000). Тяжелые металлы попадают в окружающую среду естественным путем и в результате деятельности человека. Различные источники тяжелых металлов включают эрозию почвы, естественное выветривание земной коры, горнодобывающую промышленность, промышленные сточные воды, городские стоки, сброс сточных вод, средства борьбы с насекомыми или болезнями, применяемые для сельскохозяйственных культур, и многие другие (Morais et al., 2012). показывает мировое производство и потребление отдельных токсичных металлов в течение 1850–1990 гг. (Nriagu, 1996).
, 2000). Тяжелые металлы попадают в окружающую среду естественным путем и в результате деятельности человека. Различные источники тяжелых металлов включают эрозию почвы, естественное выветривание земной коры, горнодобывающую промышленность, промышленные сточные воды, городские стоки, сброс сточных вод, средства борьбы с насекомыми или болезнями, применяемые для сельскохозяйственных культур, и многие другие (Morais et al., 2012). показывает мировое производство и потребление отдельных токсичных металлов в течение 1850–1990 гг. (Nriagu, 1996).
Мировое производство и потребление отдельных токсичных металлов в 1850–1990 годах (по материалам Nriagu, 1996).
Хотя эти металлы выполняют важные биологические функции у растений и животных, иногда их химическая координация и окислительно-восстановительные свойства дают им дополнительное преимущество, так что они могут избежать механизмов контроля, таких как гомеостаз, транспорт, компартментализация и связывание с необходимыми компонентами клетки. Эти металлы связываются с участками белка, которые не созданы для них, вытесняя исходные металлы с их естественных участков связывания, вызывая сбои в работе клеток и, в конечном итоге, токсичность. Предыдущие исследования показали, что окислительное разрушение биологических макромолекул происходит в первую очередь из-за связывания тяжелых металлов с ДНК и ядерными белками (Flora et al. , 2008).
Эти металлы связываются с участками белка, которые не созданы для них, вытесняя исходные металлы с их естественных участков связывания, вызывая сбои в работе клеток и, в конечном итоге, токсичность. Предыдущие исследования показали, что окислительное разрушение биологических макромолекул происходит в первую очередь из-за связывания тяжелых металлов с ДНК и ядерными белками (Flora et al. , 2008).
Тяжелые металлы и механизмы их токсичности
Мышьяк
Мышьяк — один из наиболее важных тяжелых металлов, вызывающих беспокойство как с экологической точки зрения, так и с точки зрения здоровья человека (Hughes et al., 1988). Он имеет полуметаллические свойства, сильно токсичен и канцероген и широко доступен в форме оксидов или сульфидов или в виде соли железа, натрия, кальция, меди, и т. Д. (Singh et al. , 2007) . Мышьяк — двадцатый элемент по распространенности на Земле, а его неорганические формы, такие как арсенит и соединения арсената, смертельны для окружающей среды и живых существ. Люди могут столкнуться с мышьяком естественным путем, из промышленных источников или из непреднамеренных источников.Питьевая вода может быть загрязнена из-за использования мышьякоподобных пестицидов, природных минеральных отложений или неправильной утилизации мышьяковых химикатов. Преднамеренное употребление мышьяка в случае суицидных попыток или случайного употребления в пищу детьми может также привести к случаям острого отравления (Mazumder, 2008; Saha et al. , 1999). Мышьяк — это протопластический яд, поскольку он поражает в первую очередь сульфгидрильную группу клеток, вызывая нарушение клеточного дыхания, клеточных ферментов и митоза (Gordon & Quastel, 1948).
Люди могут столкнуться с мышьяком естественным путем, из промышленных источников или из непреднамеренных источников.Питьевая вода может быть загрязнена из-за использования мышьякоподобных пестицидов, природных минеральных отложений или неправильной утилизации мышьяковых химикатов. Преднамеренное употребление мышьяка в случае суицидных попыток или случайного употребления в пищу детьми может также привести к случаям острого отравления (Mazumder, 2008; Saha et al. , 1999). Мышьяк — это протопластический яд, поскольку он поражает в первую очередь сульфгидрильную группу клеток, вызывая нарушение клеточного дыхания, клеточных ферментов и митоза (Gordon & Quastel, 1948).
Механизм токсичности мышьяка
При биотрансформации мышьяка вредные неорганические соединения мышьяка метилируются бактериями, водорослями, грибами и людьми с образованием монометиларсоновой кислоты (MMA) и диметиларсиновой кислоты (DMA). В этом процессе биотрансформации эти неорганические виды мышьяка (iAs) ферментативно превращаются в метилированные мышьяки, которые являются конечными метаболитами и биомаркером хронического воздействия мышьяка.
iAs (V) → iAs (III) → MMA (V) → MMA (III) → DMA (V)
Биометилирование — это процесс детоксикации, конечные продукты которого представляют собой метилированный неорганический мышьяк, такой как MMA (V) и DMA (V). ), которые выводятся с мочой, являются биоиндикатором хронического воздействия мышьяка.Однако ММА (III) не выводится и остается внутри клетки в качестве промежуточного продукта.
Монометиларсоновая кислота (ММА III), промежуточный продукт, является высокотоксичным по сравнению с другими мышьяками, потенциально ответственным за канцерогенез, индуцированный мышьяком (Singh et al. , 2007).
Свинец
Свинец — высокотоксичный металл, широкое использование которого вызвало обширное загрязнение окружающей среды и проблемы со здоровьем во многих частях мира. Свинец — это яркий серебристый металл, слегка голубоватый в сухой атмосфере.Он начинает тускнеть при контакте с воздухом, образуя сложную смесь соединений в зависимости от данных условий. показывает различные источники загрязнения окружающей среды свинцом (Sharma & Dubey, 2005). Источники воздействия свинца включают в основном промышленные процессы, продукты питания и курение, питьевую воду и бытовые источники. Источниками свинца были бензин и краска для дома, которая распространена на свинцовые пули, водопроводные трубы, оловянные кувшины, аккумуляторные батареи, игрушки и краны (Thürmer et al., 2002). В США из выхлопных газов автомобилей выделяется от 100 до 200 000 тонн свинца в год. Некоторые из них поглощаются растениями, прикрепляются к почве и стекают в водоемы, следовательно, воздействие свинца на человека в общей популяции происходит либо с пищей, либо с питьевой водой (Goyer, 1990). Свинец — чрезвычайно токсичный тяжелый металл, который нарушает различные физиологические процессы растений и, в отличие от других металлов, таких как цинк, медь и марганец, не выполняет никаких биологических функций. Растение с высокой концентрацией свинца ускоряет производство активных форм кислорода (АФК), вызывая повреждение липидной мембраны, что в конечном итоге приводит к повреждению хлорофилла и фотосинтетическим процессам и подавляет общий рост растения (Najeeb et al.
показывает различные источники загрязнения окружающей среды свинцом (Sharma & Dubey, 2005). Источники воздействия свинца включают в основном промышленные процессы, продукты питания и курение, питьевую воду и бытовые источники. Источниками свинца были бензин и краска для дома, которая распространена на свинцовые пули, водопроводные трубы, оловянные кувшины, аккумуляторные батареи, игрушки и краны (Thürmer et al., 2002). В США из выхлопных газов автомобилей выделяется от 100 до 200 000 тонн свинца в год. Некоторые из них поглощаются растениями, прикрепляются к почве и стекают в водоемы, следовательно, воздействие свинца на человека в общей популяции происходит либо с пищей, либо с питьевой водой (Goyer, 1990). Свинец — чрезвычайно токсичный тяжелый металл, который нарушает различные физиологические процессы растений и, в отличие от других металлов, таких как цинк, медь и марганец, не выполняет никаких биологических функций. Растение с высокой концентрацией свинца ускоряет производство активных форм кислорода (АФК), вызывая повреждение липидной мембраны, что в конечном итоге приводит к повреждению хлорофилла и фотосинтетическим процессам и подавляет общий рост растения (Najeeb et al. , 2014). Некоторые исследования показали, что свинец способен подавлять рост чайного растения за счет уменьшения биомассы и ухудшает качество чая, изменяя качество его компонентов (Yongsheng et al. , 2011). Было обнаружено, что даже при низких концентрациях обработка свинцом вызывает огромную нестабильность поглощения ионов растениями, что, в свою очередь, приводит к значительным метаболическим изменениям в фотосинтетической способности и, в конечном итоге, к сильному торможению роста растений (Mostafa et al. , 2012).
, 2014). Некоторые исследования показали, что свинец способен подавлять рост чайного растения за счет уменьшения биомассы и ухудшает качество чая, изменяя качество его компонентов (Yongsheng et al. , 2011). Было обнаружено, что даже при низких концентрациях обработка свинцом вызывает огромную нестабильность поглощения ионов растениями, что, в свою очередь, приводит к значительным метаболическим изменениям в фотосинтетической способности и, в конечном итоге, к сильному торможению роста растений (Mostafa et al. , 2012).
Различные источники загрязнения окружающей среды свинцом (адаптировано из Sharma & Dubey, 2005).
Механизмы токсичности свинца
Металлический свинец вызывает токсичность в живых клетках по ионному механизму и по механизму окислительного стресса. Многие исследователи показали, что окислительный стресс в живых клетках вызван дисбалансом между производством свободных радикалов и производством антиоксидантов для детоксикации реакционноспособных промежуточных продуктов или для восстановления полученных повреждений.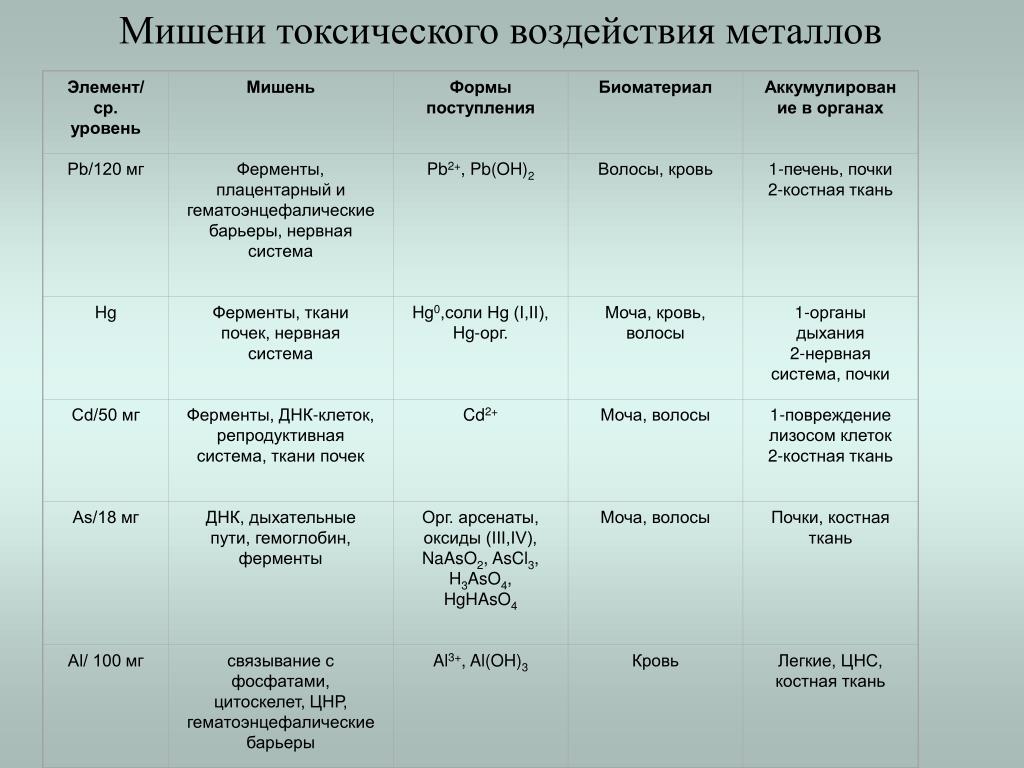 показывает атаку тяжелых металлов на клетку и баланс между производством АФК и последующей защитой, обеспечиваемой антиоксидантами. Антиоксиданты, такие как , например Глутатион , присутствующий в клетке, защищает ее от свободных радикалов, таких как H 2 O 2. Однако под влиянием свинца уровень ROS увеличивается, а уровень антиоксидантов снижается. Поскольку глутатион существует как в восстановленном (GSH), так и в окисленном (GSSG) состоянии, восстановленная форма глутатиона дает свои восстанавливающие эквиваленты (H + + e —) из тиоловых групп цистеина в ROS, чтобы сделать их стабильными. .В присутствии фермента глутатионпероксидазы восстановленный глутатион легко связывается с другой молекулой глутатиона после передачи электрона и образует дисульфид глутатиона (GSSG). Восстановленная форма (GSH) глутатиона составляет 90% от общего содержания глутатиона, а окисленная форма (GSSG) составляет 10% при нормальных условиях. Однако в условиях окислительного стресса концентрация GSSG превышает концентрацию GSH.
показывает атаку тяжелых металлов на клетку и баланс между производством АФК и последующей защитой, обеспечиваемой антиоксидантами. Антиоксиданты, такие как , например Глутатион , присутствующий в клетке, защищает ее от свободных радикалов, таких как H 2 O 2. Однако под влиянием свинца уровень ROS увеличивается, а уровень антиоксидантов снижается. Поскольку глутатион существует как в восстановленном (GSH), так и в окисленном (GSSG) состоянии, восстановленная форма глутатиона дает свои восстанавливающие эквиваленты (H + + e —) из тиоловых групп цистеина в ROS, чтобы сделать их стабильными. .В присутствии фермента глутатионпероксидазы восстановленный глутатион легко связывается с другой молекулой глутатиона после передачи электрона и образует дисульфид глутатиона (GSSG). Восстановленная форма (GSH) глутатиона составляет 90% от общего содержания глутатиона, а окисленная форма (GSSG) составляет 10% при нормальных условиях. Однако в условиях окислительного стресса концентрация GSSG превышает концентрацию GSH. Еще одним биомаркером окислительного стресса является перекисное окисление липидов, поскольку свободный радикал собирает электроны с молекул липидов, находящихся внутри клеточной мембраны, что в конечном итоге вызывает перекисное окисление липидов (Wadhwa et al., 2012; Flora et al. , 2012). В очень высоких концентрациях АФК могут вызывать структурное повреждение клеток, белков, нуклеиновых кислот, мембран и липидов, что приводит к стрессовой ситуации на клеточном уровне (Mathew et al., 2011).
Еще одним биомаркером окислительного стресса является перекисное окисление липидов, поскольку свободный радикал собирает электроны с молекул липидов, находящихся внутри клеточной мембраны, что в конечном итоге вызывает перекисное окисление липидов (Wadhwa et al., 2012; Flora et al. , 2012). В очень высоких концентрациях АФК могут вызывать структурное повреждение клеток, белков, нуклеиновых кислот, мембран и липидов, что приводит к стрессовой ситуации на клеточном уровне (Mathew et al., 2011).
Атака тяжелых металлов на клетку и баланс между производством АФК и последующей защитой, представленной антиоксидантами.
Ионный механизм токсичности свинца происходит в основном из-за способности ионов металлического свинца заменять другие двухвалентные катионы, такие как Ca 2+ , Mg 2+ , Fe 2+ и одновалентные катионы, такие как Na +, что в конечном итоге нарушает биологический метаболизм клетки.Ионный механизм токсичности свинца вызывает значительные изменения в различных биологических процессах, таких как клеточная адгезия, внутри- и межклеточная передача сигналов, сворачивание белков, созревание, апоптоз, перенос ионов, регуляция ферментов и высвобождение нейротрансмиттеров. Свинец может замещать кальций даже в пикомолярной концентрации, влияя на протеинкиназу С, которая регулирует нервное возбуждение и память (Flora et al. , 2012).
Свинец может замещать кальций даже в пикомолярной концентрации, влияя на протеинкиназу С, которая регулирует нервное возбуждение и память (Flora et al. , 2012).
Ртуть
Металлическая ртуть — это металл природного происхождения, который представляет собой блестящую серебристо-белую жидкость без запаха, которая при нагревании превращается в бесцветный газ без запаха.Ртуть очень токсична и обладает чрезвычайно высокой способностью к биоаккумуляции. Его присутствие отрицательно влияет на морскую среду, и поэтому многие исследования направлены на распространение ртути в водной среде. Основные источники загрязнения ртутью включают антропогенную деятельность, такую как сельское хозяйство, сброс городских сточных вод, горнодобывающая промышленность, сжигание и сброс промышленных сточных вод (Chen et al. , 2012).
Ртуть существует в основном в трех формах: металлические элементы, неорганические соли и органические соединения, каждая из которых обладает различной токсичностью и биодоступностью.Эти формы ртути широко присутствуют в водных ресурсах, таких как озера, реки и океаны, где они поглощаются микроорганизмами и превращаются в метилртуть внутри микроорганизмов, в конечном итоге подвергаясь биомагнификации, вызывая значительное нарушение жизни водных организмов. Потребление этого зараженного водного животного является основным путем воздействия метилртути на человека (Trasande et al ., 2005). Ртуть широко используется в термометрах, барометрах, пирометрах, ареометрах, ртутных дуговых лампах, люминесцентных лампах и в качестве катализатора.Он также используется в целлюлозно-бумажной промышленности как компонент батарей и в стоматологических препаратах, таких как амальгамы. показывает глобальное использование ртути для различных применений (ГЭФ и Ртуть: Проблема Автор Ибрагима Соу, Группа ГЭФ по климату и химическим веществам . Доступно по адресу: http://www.thegef.org/gef/greenline/april-2012/ gef-and-mercury-challenge).
Мировое использование ртути для различных целей (всего в 2005 году: 3 760 метрических тонн).
Механизм отравления ртутью
Ртуть хорошо известна как опасный металл, и ее токсичность является частой причиной острого отравления тяжелыми металлами. Согласно данным Американской ассоциации центров по борьбе с отравлениями, в 1997 году было зарегистрировано 3 596 случаев.Метилртуть — нейротоксическое соединение, которое отвечает за разрушение микротрубочек, повреждение митохондрий, перекисное окисление липидов и накопление нейротоксических молекул, таких как серотонин, аспартат и глутамат (Patrick, 2002). Общий объем выбросов ртути в окружающую среду оценивается в 2200 метрических тонн в год (Ferrara et al. , 2000). По оценкам Агентства по охране окружающей среды и Национальной академии наук, от 8 до 10% американских женщин имеют уровни ртути, которые могут вызвать неврологические расстройства у любого ребенка, которого они родили.Животные, подвергшиеся воздействию токсичной ртути, показали неблагоприятные неврологические и поведенческие изменения. У кроликов при воздействии паров ртути 28,8 мг / м 2 3 в течение 1–13 недель наблюдались нечеткие патологические изменения, выраженная клеточная дегенерация и некроз мозга (Ashe et al. , 1953).
Мозг остается органом-мишенью для ртути, но он может повредить любой орган и привести к нарушению работы нервов, почек и мышц. Это может вызвать нарушение мембранного потенциала и нарушить гомеостаз внутриклеточного кальция.Ртуть связывается со свободно доступными тиолами, поскольку константы стабильности высоки (Patrick, 2002). Пары ртути могут вызвать бронхит, астму и временные респираторные проблемы. Ртуть играет ключевую роль в повреждении третичной и четвертичной белковой структуры и изменяет клеточную функцию, присоединяясь к селеногидрильным и сульфгидрильным группам, которые вступают в реакцию с метилртутью и препятствуют клеточной структуре. Он также вмешивается в процесс транскрипции и трансляции, приводя к исчезновению рибосом и уничтожению эндоплазматического ретикулума и активности естественных клеток-киллеров.Также нарушается целостность клеток, вызывая образование свободных радикалов. Основа хелатирования тяжелых металлов заключается в том, что даже несмотря на то, что сульфгидрильная связь ртути стабильна и разделена на окружающие сульфгидрильные лиганды, она также вносит свободные сульфгидрильные группы, способствуя подвижности металлов внутри лигандов (Bernhoft, 2011).
Кадмий
Кадмий является седьмым по токсичности тяжелым металлом согласно рейтингу ATSDR. Это побочный продукт производства цинка, которому люди или животные могут подвергаться на работе или в окружающей среде.Как только этот металл будет поглощен людьми, он будет накапливаться в организме на протяжении всей жизни. Этот металл впервые был использован во время Первой мировой войны в качестве заменителя олова и в лакокрасочной промышленности в качестве пигмента. В сегодняшнем сценарии он также используется в аккумуляторных батареях, для производства специальных сплавов, а также присутствует в табачном дыме. Около трех четвертей кадмия используется в щелочных батареях в качестве компонента электрода, оставшаяся часть используется в покрытиях, пигментах и гальванических покрытиях, а также в качестве стабилизатора пластмасс.Люди могут подвергаться воздействию этого металла в основном при вдыхании и проглатывании, а также могут страдать от острых и хронических интоксикаций. Распространенный в окружающей среде кадмий будет оставаться в почвах и отложениях в течение нескольких десятилетий. Растения постепенно поглощают эти металлы, которые накапливаются в них и концентрируются по пищевой цепочке, достигая в конечном итоге человеческого тела. В США более 500000 рабочих ежегодно подвергаются воздействию токсичного кадмия, согласно данным Агентства по токсичным веществам и регистру заболеваний (Бернард, 2008; Mutlu et al., 2012). Исследования показали, что в Китае общая площадь, загрязненная кадмием, составляет более 11 000 га, а ежегодный объем промышленных отходов кадмия, сбрасываемых в окружающую среду, оценивается более чем в 680 тонн. В Японии и Китае воздействие кадмия в окружающей среде сравнительно выше, чем в любой другой стране (Han et al. , 2009). Кадмий преимущественно содержится во фруктах и овощах из-за его высокой скорости передачи от почвы к растениям (Satarug et al. , 2011).Кадмий является высокотоксичным заменимым тяжелым металлом, который широко известен своим неблагоприятным влиянием на ферментативные системы клеток, окислительный стресс и индукцию дефицита питательных веществ у растений (Irfan et al. , 2013).
Механизм токсичности кадмия
Механизм токсичности кадмия четко не изучен, но его влияние на клетки известно (Patrick, 2003). Концентрация кадмия увеличивается в 3000 раз, когда он связывается с богатым цистеином белком, таким как металлотионеин.В печени комплекс цистеин-металлотионеин вызывает гепатотоксичность, а затем циркулирует в почках и накапливается в почечной ткани, вызывая нефротоксичность. Кадмий обладает способностью связываться с цистеиновыми, глутаматными, гистидиновыми и аспартатными лигандами и может приводить к дефициту железа (Castagnetto et al. , 2002). Кадмий и цинк имеют одинаковые степени окисления, и, следовательно, кадмий может заменять цинк, присутствующий в металлотионеине, тем самым препятствуя его действию в качестве поглотителя свободных радикалов в клетке.
Хром
Хром — седьмой по распространенности элемент на Земле (Mohanty & Kumar Patra, 2013). Хром находится в нескольких степенях окисления в окружающей среде от Cr 2+ до Cr 6+ (Родригес и др. , 2009) . Наиболее часто встречающимися формами Cr являются трехвалентный Cr +3 и шестивалентный Cr +6 , , причем оба состояния токсичны для животных, людей и растений (Mohanty & Kumar Patra, 2013).Хром естественным образом образуется при сжигании нефти и угля, нефти из феррохроматного огнеупорного материала, окислителей пигментов, катализатора, хромистой стали, удобрений, бурения нефтяных скважин и кожевенных заводов по нанесению металлических покрытий. Антропогенно хром попадает в окружающую среду через сточные воды и удобрения (Ghani, 2011). Cr (III) в своей восстановленной форме неподвижен и нерастворим в воде, тогда как Cr (VI) в окисленном состоянии хорошо растворяется в воде и, следовательно, подвижен (Wolińska et al. , 2013).Для определения активности ионов металлов в окружающей среде очень важен вид металла, поскольку в случае хрома окислительная форма Cr (III) не является существенным загрязнителем грунтовых вод, но было обнаружено, что Cr (VI) может быть токсичным для человека (Gürkan et al. , 2012). Cr (III) находится в органическом веществе почвы и водной среды в форме оксидов, гидроксидов и сульфатов (Cervantes et al. , 2001). Хром широко используется в таких отраслях, как металлургия, гальваника, производство красок и пигментов, дубление, консервирование древесины, химическое производство и производство целлюлозы и бумаги.Эти отрасли промышленности играют важную роль в загрязнении хромом, оказывая неблагоприятное воздействие на биологические и экологические виды (Ghani, 2011). Широкий спектр промышленных и сельскохозяйственных методов увеличивает уровень токсичности в окружающей среде, вызывая опасения по поводу загрязнения, вызываемого хромом. Загрязнение окружающей среды хромом, особенно шестивалентным хромом, стало самой большой проблемой в последние годы (Zayed & Terry, 2003). Кожевенные заводы сбрасывают в водные потоки многочисленные загрязняющие окружающую среду тяжелые металлы и соединения (Nath et al., 2008 г.). Из-за избытка кислорода в окружающей среде Cr (III) окисляется до Cr (VI), который чрезвычайно токсичен и хорошо растворяется в воде (Cervantes et al. , 2001). В августе 1975 года в Токио содержание грунтовых вод, содержащих Cr (VI) грунтовых пород, превышало допустимый предел содержания хрома в 2000 раз (Zayed & Terry, 2003). В Индии уровень хрома в подземных водах составляет более 12 мг / л и 550–1500 частей на миллион / л. Механизм ультраструктурной организации, биохимических изменений и регуляции метаболизма не выяснен, так как процесс фитотоксичности в водной среде хромом подробно не рассматривался (Chandra & Kulshreshtha, 2004).Сброс промышленных отходов и загрязнение грунтовых вод резко увеличили концентрацию хрома в почве (Bielicka et al. , 2005). Во время производства хромата отложение остатков Cr и орошение сточных вод серьезно загрязняли сельскохозяйственные угодья Cr. С внедрением современного сельского хозяйства происходит непрерывный выброс Cr в окружающую среду посредством остатков Cr, Cr-пыли и орошения сточных вод Cr, что приводит к загрязнению почвы, влияющему на почвенно-овощную систему, а также к ухудшению урожайности овощей и их качества для людей. (Дуан и др., 2010). Избыток хрома сверх допустимого предела является разрушительным для растений, поскольку он серьезно влияет на биологические факторы растения и попадает в пищевую цепочку при потреблении этих растительных материалов. Общими чертами, обусловленными фитотоксичностью Cr, являются снижение роста корней, хлороз листьев, ингибирование прорастания семян и снижение биомассы. Отравление хромом сильно влияет на биологические процессы в различных растениях, таких как кукуруза, пшеница, ячмень, цветная капуста, цитрулл и овощи.Отравление хромом вызывает хлороз и некроз растений (Ghani, 2011). Ферменты, такие как каталаза, пероксидаза и цитохромоксидаза, в состав которых входит железо, подвержены токсичности хрома. Активность каталазы, стимулированная избыточным поступлением хрома, вызывающая токсичность, изучалась в отношении фотосинтеза, активности нитратредуктазы, содержания белка в водорослях и фотосинтетических пигментов (Nath et al. , 2008). Хром (III) требует простого процесса диффузии для проникновения в клетку и не зависит от какого-либо конкретного мембранного носителя.В отличие от Cr (III), Cr (IV) может легко проходить через клеточную мембрану (Chandra & Kulshreshtha, 2004).
Механизм токсичности хрома
Трехвалентный хром Cr (III) в окружающей среде обычно безвреден из-за его слабой проницаемости мембраны. С другой стороны, шестивалентный хром Cr (VI) более активен в проникновении через клеточную мембрану для изоэлектрических и изоструктурных анионов, таких как SO 4 2– и HPO 4 2– каналов и этих хроматов. поглощаются через фагоцитоз.Cr (VI) является сильным окислителем и может быть восстановлен с образованием эфемерных разновидностей пятивалентного и четырехвалентного хрома, которые отличаются от Cr (III). Стабилизация пентавелентной формы осуществляется глутатионом, и, следовательно, внутриклеточное восстановление Cr [VI] считается механизмом детоксикации, когда восстановление происходит вдали от целевой области. Однако, если внутриклеточное восстановление Cr [VI] происходит рядом с целевым сайтом, это может служить для активации Cr. Реакции между Cr (VI) и биологическими восстановителями, такими как тиолы и аскорбат, приводят к образованию активных форм кислорода, таких как супероксид-ион, перекись водорода и гидроксильный радикал, что в конечном итоге приводит к окислительному стрессу в клетке, вызывая повреждение ДНК и белков (Stohs И Багчи, 1995).Согласно литературным исследованиям, Cr (VI) оказался гораздо более опасным, чем Cr (III), поскольку Cr (VI) проникает в клетки легче, чем Cr (III), и в конечном итоге восстанавливается до Cr (III). Из-за своих мутагенных свойств Cr (VI) классифицируется Международным агентством по изучению рака как канцероген для человека группы 1 (Dayan & Paine, 2001; Zhang, 2011).
Алюминий
Алюминий — третий по распространенности элемент, обнаруженный в земной коре (Gupta et al., 2013). Алюминий естественным образом содержится в воздухе, воде и почве. Добыча и переработка алюминия повышает его уровень в окружающей среде (ATSDR, 2010). Недавние исследования токсикологии окружающей среды показали, что алюминий может представлять серьезную угрозу для людей, животных и растений, вызывая многие заболевания (Barabasz et al. , 2002). Многие факторы, включая pH воды и содержание органических веществ, сильно влияют на токсичность алюминия. С понижением pH его токсичность увеличивается (Jeffrey et al., 1997). Мобилизация токсичных ионов алюминия в результате изменений pH почвы и воды, вызванных кислотными дождями и увеличением подкисления окружающей атмосферы, оказывает неблагоприятное воздействие на окружающую среду. Это проявляется в высыхании лесов, отравлении растений, падении урожая или его неурожая, гибели водных животных, а также в различных дисбалансах в функциях систем человека и животных (Barabasz et al. , 2002). PH поверхностного слоя почвы ниже 5 (pH <5) может привести к кислотности почвы, которая является серьезной проблемой во всем мире и влияет на урожайность сельскохозяйственных культур.Из-за токсичности алюминия производство сельскохозяйственных культур было ограничено до 67% от общей площади кислых почв в мире. Алюминий - один из наиболее часто встречающихся элементов в земной коре. Из-за кислых почв (pH <5) кремний выщелачивается, оставляя алюминий в твердой форме, известной как оксигидроксиды алюминия, такие как гиббсит и бемит. Эти нестабильные формы фитотоксического выброса алюминия Al 3+ хорошо известны как Al (OH) 63+ в почве (Ermias Abate et al. , 2013).Взаимодействие Al 3+ с апопластными, плазматическими мембранами и симпластическими мишенями приводит к токсичности и нарушает физические и клеточные процессы в растениях. Обычными проявлениями являются задержка роста корней, модификация клеток в листьях, маленькие и темно-зеленые листья, пожелтение и гибель листьев, хлороз, пурпурность и некроз листьев (Gupta et al. , 2013). Алюминий в высоких концентрациях очень токсичен для водных животных, особенно для организмов, дышащих жабрами, таких как рыба, вызывая осморегуляторную недостаточность из-за разрушения плазмы и ионов гемолимфы.Активность жаберного фермента, необходимого для поглощения ионов, у рыб подавляется мономерной формой алюминия (Rosseland et al. , 1990). Живые организмы в воде, такие как водоросли и раки, также подвержены токсичности алюминия (Bezak-Mazur, 2001). Алюминий не играет биологической роли и является токсичным несущественным металлом для микроорганизмов (Olaniran et al. , 2013). Ферменты, такие как гексокиназа, фосфодиэстераза, щелочная фосфатаза и фосфоксидаза, ингибируются алюминием, поскольку он имеет большее сродство к ДНК и РНК.На метаболические пути в живом организме, включая метаболизм кальция, фосфора, фтора и железа, влияет алюминий. Было обнаружено, что алюминий очень вреден для нервных, костных и кроветворных клеток (Barabasz1 et al. , 2002).
Механизм токсичности алюминия
Алюминий влияет на большинство физических и клеточных процессов. Точный механизм всасывания алюминия желудочно-кишечным трактом полностью не изучен. Основываясь на обзорах литературы, трудно указать надлежащий период времени для токсичности алюминия, поскольку некоторые симптомы токсичности алюминия могут быть обнаружены через секунды, а другие — через минуты после воздействия алюминия (ВОЗ, 1997).Токсичность алюминия, вероятно, является результатом взаимодействия между алюминием и плазматической мембраной, апопластическими и симпластическими мишенями (Kochian et al. , 2005). У человека Mg 2+ и Fe 3+ заменены на Al 3+ , что вызывает множество нарушений, связанных с межклеточной коммуникацией, клеточным ростом и секреторными функциями. Изменения, вызываемые алюминием в нейронах, аналогичны дегенеративным поражениям, наблюдаемым у пациентов с болезнью Альцгеймера. Наибольшими осложнениями токсичности алюминия являются эффекты нейротоксичности, такие как атрофия нейронов в голубом пятне, черной субстанции и полосатом теле ( Filiz & Meral, 2007) .
Железо
Железо — второй по распространенности металл в земной коре (EPA, 1993). Железо занимает 26 -ю позицию элемента в периодической таблице. Железо — важнейший элемент для роста и выживания почти всех живых организмов (Valko et al. , 2005). Это один из жизненно важных компонентов таких организмов, как водоросли, и ферментов, таких как цитохромы и каталаза, а также белков, переносящих кислород, таких как гемоглобин и миоглобин (Vuori, 1995).Железо является привлекательным переходным металлом для различных биологических окислительно-восстановительных процессов из-за его взаимного превращения между ионами двухвалентного железа (Fe 2+ ) и трехвалентного железа (Fe 3+ ) (Phippen et al. , 2008). Источник железа в поверхностных водах является антропогенным и связан с горнодобывающей деятельностью. Производство серной кислоты и разгрузка железа (Fe 2+ ) происходит за счет окисления пирита железа (FeS 2 ), который обычен в угольных пластах (Valko et al., 2005). Следующие уравнения представляют собой упрощенную реакцию окисления двухвалентного и трехвалентного железа (Phippen et al. , 2008):
2FeS 2 + 7O 2 → 2FeSO 4 + H 2 SO 4 ( железо)
4FeSO 4 + O 2 + 10H 2 O → 4Fe (OH) 3 + 4H 2 SO 4 (трехвалентное)
Концентрация растворенного железа в глубинах океана обычно составляет 0,6 нМ или 33.5 × 10 −9 мг / л. В пресной воде концентрация очень низкая с уровнем обнаружения 5 мкг / л — ICP, тогда как в грунтовых водах концентрация растворенного железа очень высока — 20 мг / л (EPA, 1993). В таких странах, как Литва, многие люди подвергались воздействию повышенных уровней железа через питьевую воду, поскольку собранные подземные воды превышали допустимый предел, установленный Директивой Европейского Союза 98/83 / EC о качестве питьевой воды (Grazuleviciene et al. , 2009 г.).На численность таких видов, как перифитон, бентосные беспозвоночные и разнообразие рыб, в значительной степени влияют прямые и косвенные эффекты загрязнения железом (Vuori, 1995). Осадок железа вызовет значительный ущерб из-за засорения и затруднит дыхание рыб (EPA, 1993). Исследование токсичности железа для водных растений, в частности риса, показало, что рост видов водного тростника тормозился концентрацией общего железа 1 мг / л (Phippen et al., 2008 г.). Кислые почвы ограничивают производство риса и вместе с дефицитом цинка вызывают нарушение макроэлементов в рисе, выращенном на водно-болотных угодьях. На производство низинного риса сильно повлияла высокая концентрация восстановленного железа (Fe 2+ ) в затопленных почвах. Особенности токсичности железа для риса включают высокое поглощение Fe 2+ корнями, акропетальную транслокацию в листья, бронзовое покрытие листьев риса и потерю урожая (Becker & Asch, 2005).
Механизм токсичности железа
Широкий спектр вредных свободных радикалов образуется, когда абсорбированное железо не может связываться с белком, что, в свою очередь, серьезно влияет на концентрацию железа в клетках млекопитающих и биологических жидкостях.Это циркулирующее несвязанное железо вызывает разъедание желудочно-кишечного тракта и биологических жидкостей. Чрезвычайно высокий уровень железа поступает в организм, преодолевая ограничивающую скорость абсорбцию, и становится насыщенным. Эти свободные утюги проникают в клетки сердца, печени и мозга. Из-за нарушения окислительного фосфорилирования свободным железом двухвалентное железо превращается в трехвалентное железо, которое выделяет ионы водорода, тем самым повышая метаболическую кислотность. Свободное железо также может приводить к перекисному окислению липидов, что приводит к серьезным повреждениям митохондрий, микросом и других клеточных органелл (Albretsen, 2006).Токсичность железа для клеток приводит к опосредованному железом повреждению тканей, включая клеточные механизмы окисления и восстановления, и их токсичность по отношению к внутриклеточным органеллам, таким как митохондрии и лизосомы. Широкий спектр свободных радикалов, которые, как считается, вызывают потенциальное повреждение клеток, образуются из-за избыточного потребления железа. Свободные радикалы водорода, производимые железом, атакуют ДНК, что приводит к повреждению клеток, мутациям и злокачественным трансформациям, которые, в свою очередь, вызывают множество заболеваний (Grazuleviciene et al., 2009 г.).
Воздействие тяжелых металлов на человека
35 металлов вызывают у нас озабоченность из-за воздействия на рабочем месте или на работе, из которых 23 тяжелые: сурьма, мышьяк, висмут, кадмий, церий, хром, кобальт, медь. , галлий, золото, железо, свинец, марганец, ртуть, никель, платина, серебро, теллур, таллий, олово, уран, ванадий и цинк (Mosby et al. 1996). Эти тяжелые металлы обычно присутствуют в окружающей среде и рационе питания.В небольших количествах они необходимы для поддержания хорошего здоровья, но в больших количествах они могут стать токсичными или опасными. Токсичность тяжелых металлов может снизить уровень энергии и нарушить работу мозга, легких, почек, печени, состав крови и других важных органов. Длительное воздействие может привести к постепенному прогрессированию физических, мышечных и неврологических дегенеративных процессов, имитирующих такие заболевания, как рассеянный склероз, болезнь Паркинсона, болезнь Альцгеймера и мышечная дистрофия.Повторяющееся длительное воздействие некоторых металлов и их соединений может даже вызвать рак (Jarup, 2003). Уровень токсичности некоторых тяжелых металлов может быть чуть выше фоновых концентраций, которые естественным образом присутствуют в окружающей среде. Следовательно, тщательное знание тяжелых металлов очень важно для принятия надлежащих защитных мер против чрезмерного контакта с ними (Ferner, 2001).
Воздействие мышьяка
Загрязнение мышьяком произошло как в результате естественных геологических процессов, так и в результате деятельности человека.Антропогенные источники мышьяка включают деятельность человека, такую как добыча и переработка руд. Процесс плавки, как древний, так и недавний, может выделять мышьяк в воздух и почву (Matschullat, 2000). Такие типы источников могут влиять на качество поверхностных вод из-за выброса и стока грунтовых вод. Другой путь загрязнения грунтовых вод — геологические источники, такие как минералы мышьяка. Третий тип источников — это осадочные и метаосадочные породы (Smedley & Kinniburgh, 2002).Большинство красок, красителей, мыла, металлов, полупроводников и лекарств содержат мышьяк. Некоторые пестициды, удобрения и кормление животных также выделяют мышьяк в окружающую среду в больших количествах. Неорганические формы мышьяка, такие как арсенит и арсенат, более опасны для здоровья человека. Они обладают сильным канцерогенным действием и могут вызывать рак легких, печени, мочевого пузыря и кожи. Люди подвергаются воздействию мышьяка через воздух, пищу и воду. Питьевая вода, загрязненная мышьяком, является одной из основных причин токсичности мышьяка в более чем 30 странах мира (Chowdhury et al., 2000). Если уровень мышьяка в грунтовых водах в 10–100 раз превышает значение, указанное в руководстве ВОЗ для питьевой воды (10 мкг / л), это может представлять угрозу для здоровья человека (Hoque et al. , 2011). Вода может быть загрязнена из-за неправильной утилизации мышьяковых химикатов, мышьяковых пестицидов или природных минеральных отложений. Токсичность мышьяком может быть острой или хронической, а хроническая токсичность мышьяка называется арсеникозом. Большинство сообщений о хронической токсичности мышьяка у человека сосредоточены на кожных проявлениях из-за его специфичности в диагностике.Пигментация и кератоз — это специфические поражения кожи, которые указывают на хроническую токсичность мышьяка (Martin & Griswold, 2009). показывает мышьяковый кератоз, так называемые «капли дождя на пыльной дороге» (Костный мозг — неопухолевые, доброкачественные изменения, токсичность мышьяка, доступно по адресу: http://www.pathologyoutlines.com/topic/bonemarrarsenic.html) и показывает поражения кожи, вызванные мышьякозу (источник: Smith et al., 2000).
Поражения кожи, вызванные арсеникозом (адаптировано из Smith et al. , 2000).
Более низкие уровни воздействия мышьяка могут вызвать тошноту и рвоту, снижение выработки эритроцитов и лейкоцитов, нарушение сердечного ритма, ощущение покалывания в руках и ногах и повреждение кровеносных сосудов. Длительное воздействие может привести к образованию кожных поражений, внутреннему раку, неврологическим проблемам, легочным заболеваниям, заболеваниям периферических сосудов, гипертонии, сердечно-сосудистым заболеваниям и сахарному диабету (Smith et al., 2000). Хронический арсеникоз приводит к множеству необратимых изменений в жизненно важных органах, и уровень смертности выше.Несмотря на масштабы этой потенциально смертельной токсичности, эффективного лечения этого заболевания не существует (Mazumder, 2008).
Свинец
Деятельность человека, такая как добыча полезных ископаемых, производство и сжигание ископаемого топлива, привела к накоплению свинца и его соединений в окружающей среде, включая воздух, воду и почву. Свинец используется для производства батарей, косметики, металлических изделий, таких как боеприпасы, припой и трубы, и т. Д. (Martin & Griswold, 2009).Свинец очень токсичен, поэтому его использование в различных продуктах, таких как краски, бензин, и т. Д. , в настоящее время значительно сокращено. Основными источниками воздействия свинца являются краски на основе свинца, бензин, косметика, игрушки, бытовая пыль, загрязненная почва, промышленные выбросы (Gerhardsson et al. , 2002). Отравление свинцом считалось классическим заболеванием, и признаки, которые наблюдались у детей и взрослых, в основном относились к центральной нервной системе и желудочно-кишечному тракту (Markowitz, 2000).Отравление свинцом также может произойти через питьевую воду. Трубы, по которым течет вода, могут быть сделаны из свинца и его соединений, которые могут загрязнять воду (Brochin et al. , 2008). По данным Агентства по охране окружающей среды (EPA), свинец считается канцерогеном. Свинец оказывает сильное воздействие на разные части тела. Распределение свинца в организме изначально зависит от кровотока в различных тканях, и почти 95% свинца откладывается в форме нерастворимого фосфата в костях скелета (Papanikolaou 2005).Токсичность свинца, также называемая отравлением свинцом, может быть острой или хронической. Острое воздействие может вызвать потерю аппетита, головную боль, гипертонию, боль в животе, почечную дисфункцию, усталость, бессонницу, артрит, галлюцинации и головокружение. Острое воздействие в основном происходит на рабочем месте и в некоторых отраслях обрабатывающей промышленности, где используется свинец. Хроническое воздействие свинца может привести к умственной отсталости, врожденным дефектам, психозу, аутизму, аллергии, дислексии, потере веса, гиперактивности, параличу, мышечной слабости, повреждению мозга, повреждению почек и даже может стать причиной смерти (Martin & Griswold, 2009).показывает увеличение концентрации свинца в крови, влияющее на IQ человека (Taylor et al. , 2012). Хотя отравление свинцом можно предотвратить, оно по-прежнему остается опасным заболеванием, поражающим большинство органов. Плазматическая мембрана перемещается в интерстициальные пространства головного мозга, когда гематоэнцефалический барьер подвергается воздействию повышенных уровней концентрации свинца, что приводит к состоянию, называемому отеком (Teo et al. 1997). Он нарушает внутриклеточные системы вторичных мессенджеров и изменяет функционирование центральной нервной системы, защита которой очень важна.Источники ионов свинца в окружающей среде и в быту являются основной причиной заболевания, но с помощью надлежащих мер предосторожности можно снизить риск, связанный с токсичностью свинца (Brochin et al. , 2008). показывает эффекты повышенного уровня свинца в крови (Brochin et al. , 2008).
Повышение концентрации свинца в крови, влияющее на IQ человека (адаптировано из Taylor et al. , 2012).
Эффекты повышенного уровня свинца в крови (адаптировано из Brochin et al., 2008 г.).
Ртуть
Ртуть считается самым токсичным тяжелым металлом в окружающей среде. Отравление ртутью называют акродинией или розовой болезнью. Ртуть попадает в окружающую среду в результате деятельности различных отраслей, таких как фармацевтика, консерванты бумаги и целлюлозы, сельское хозяйство, производство хлора и каустической соды (Morais et al. , 2012). Ртуть обладает способностью соединяться с другими элементами и образовывать органическую и неорганическую ртуть.Воздействие повышенных уровней металлической, органической и неорганической ртути может повредить мозг, почки и развивающийся плод (Alina et al. , 2012). Ртуть присутствует в большинстве пищевых продуктов и напитков в диапазоне от <1 до 50 мкг / кг. В морских продуктах он часто встречается в более высоких концентрациях. Органическая ртуть может легко проникать через биомембраны, и, поскольку они липофильны по своей природе, ртуть присутствует в более высоких концентрациях в большинстве видов жирной рыбы и в печени нежирной рыбы (Reilly, 2007).Микроорганизмы превращают ртуть, присутствующую в почве и воде, в метилртуть, токсин, который может накапливаться с возрастом рыб и с увеличением трофических уровней. EPA объявило хлорид ртути и метилртуть высоко канцерогенными. Нервная система очень чувствительна ко всем видам ртути. Повышенное воздействие ртути может изменить функции мозга и привести к застенчивости, тремору, проблемам с памятью, раздражительности и изменениям зрения или слуха. Воздействие паров металлической ртути на более высоких уровнях в течение более коротких периодов времени может привести к повреждению легких, рвоте, диарее, тошноте, кожной сыпи, учащению пульса или артериального давления.Симптомы отравления органической ртутью включают депрессию, проблемы с памятью, тремор, усталость, головную боль, выпадение волос, и т. Д. Поскольку эти симптомы часто встречаются и при других состояниях, такие случаи может быть трудно диагностировать (Martin & Griswold, 2009). Из-за чрезмерного воздействия на здоровье, связанного с воздействием ртути, нынешний стандарт для питьевой воды был установлен на более низких уровнях 0,002 мг / л и 0,001 мг / л Законом об охране окружающей среды и Всемирной организацией здравоохранения (ВОЗ, 2004).
Таблица 1
Типы токсичности ртути.
| Элементарная ртуть | Метилртуть | Неорганическая ртуть | |
|---|---|---|---|
| Источники | Ископаемое топливо, стоматологические амальгамы, старая латексная краска, инсинераторы, термометры | Пестициды, рыба, птица | Биологическое окисление ртути, деметилирование метилртути кишечной микрофлорой |
| Поглощение | 75–85% абсорбированного пара | 95–100% абсорбированного в кишечном тракте | 7–15% поглощенной дозы абсорбируется и 2–3% дозы всасывается через кожу у животных |
| Распределение | Распространяется по всему телу, липофильно, проникает через гематоэнцефалический барьер и плацентарный барьер, накапливается в головном мозге и почках | Распространяется по всему телу, липофильно, легко проникает через гематоэнцефалический барьер, а также через плацентарный барьер, накапливается в почках и головном мозге | Не проникает через гематоэнцефалический или плацентарный барьер, присутствует у новорожденных в головном мозге, накапливается в почках |
| Экскреция | Пот, моча, кал и слюна | 90% выводится с желчью, калом, 10% с мочой | Пот, слюна, моча и кал |
| Причина токсичности | Окисление до неорганической ртути | Деметилирование до неорганической ртути, образование свободных радикалов, связывание с тиолами в ферментах и структурных белках | Связывание с тиолами в ферментах и структурных белках |
Кадмий
Кадмий — металл 20 -е годы гг.Это побочный продукт производства цинка. Почвы и горные породы, включая уголь и минеральные удобрения, содержат некоторое количество кадмия. Кадмий имеет множество применений, например, в аккумуляторах, пигментах, пластмассах и металлических покрытиях и широко используется в гальванике (Martin & Griswold, 2009). представляет относительный вклад различных источников в воздействие кадмия на человека (Regoli, 2005). Кадмий и его соединения классифицируются Международным агентством по изучению рака как канцерогены группы 1 для человека (Henson & Chedrese, 2004).Кадмий попадает в окружающую среду в результате естественной деятельности, такой как извержения вулканов, выветривание, речной транспорт и некоторые виды деятельности человека, такие как добыча полезных ископаемых, плавка, курение табака, сжигание городских отходов и производство удобрений. Хотя выбросы кадмия заметно сократились в большинстве промышленно развитых стран, он остается источником опасений для рабочих и людей, живущих в загрязненных районах. Кадмий может вызывать как острые, так и хронические отравления (Chakraborty et al., 2013). Кадмий очень токсичен для почек и накапливается в клетках проксимальных канальцев в более высоких концентрациях. Кадмий может вызвать минерализацию костей либо из-за повреждения костей, либо из-за почечной дисфункции. Исследования на людях и животных показали, что остеопороз (повреждение скелета) является критическим эффектом воздействия кадмия наряду с нарушениями метаболизма кальция, образованием почечных камней и гиперкальциурией. Вдыхание более высоких уровней кадмия может вызвать серьезное повреждение легких.Если кадмий попадает в организм в больших количествах, это может вызвать раздражение желудка и привести к рвоте и диарее. При очень длительном воздействии при более низких концентрациях он может откладываться в почках и в конечном итоге привести к заболеванию почек, хрупкости костей и повреждению легких (Bernard, 2008). Кадмий и его соединения хорошо растворимы в воде по сравнению с другими металлами. Их биодоступность очень высока, и, следовательно, они склонны к биоаккумуляции. Длительное воздействие кадмия может привести к морфопатологическим изменениям почек.Курильщики более подвержены отравлению кадмием, чем некурящие. Табак является основным источником поглощения кадмия курильщиками, поскольку растения табака, как и другие растения, могут накапливать кадмий из почвы. Некурящие подвергаются воздействию кадмия с пищей и некоторыми другими путями. Однако поглощение кадмия другими путями намного ниже (Mudgal et al. , 2010). показывает значения токсичности кадмия (Flora et al. , 2008). Кадмий взаимодействует с основными питательными веществами, благодаря чему он оказывает токсическое действие.Экспериментальный анализ на животных показал, что 50% кадмия всасывается в легких и меньше — в желудочно-кишечном тракте. Преждевременные роды и снижение массы тела при рождении — это проблемы, которые возникают, если воздействие кадмия во время беременности человека является высоким (Henson & Chedrese, 2004).
Относительный вклад различных источников в воздействие кадмия на человека (адаптировано из Regoli, 2005).
Значения токсичности кадмия (адаптировано из Flora et al. , 2008).
Хром
Хром присутствует в горных породах, почве, животных и растениях.Он может быть твердым, жидким и в виде газа. Соединения хрома очень стойкие в водных отложениях. Они могут находиться во многих различных состояниях, таких как двухвалентное, четырехвалентное, пятивалентное и шестивалентное состояние. Cr (VI) и Cr (III) являются наиболее стабильными формами, и только их связь с воздействием на человека представляет большой интерес (Житкович, 2005). Соединения хрома (VI), такие как хромат кальция, хроматы цинка, хромат стронция и хроматы свинца, являются высокотоксичными и канцерогенными по своей природе. С другой стороны, хром (III) является важной пищевой добавкой для животных и людей и играет важную роль в метаболизме глюкозы.Поглощение соединений шестивалентного хрома через дыхательные пути и пищеварительный тракт происходит быстрее, чем у соединений трехвалентного хрома. Профессиональные источники хрома включают защитные металлические покрытия, металлические сплавы, магнитные ленты, пигменты для красок, резину, цемент, бумагу, консерванты для древесины, дубление кожи и металлизацию (Martin & Griswold, 2009). Schroeder et al. (1970) сообщил, что сигареты содержат 390 г / кг Cr, но не было опубликовано значительных отчетов о количестве хрома, вдыхаемого при курении.Когда поврежденная кожа соприкасается с любым типом соединений хрома, образуется глубоко проникающее отверстие. Воздействие соединений хрома может привести к образованию язв, которые будут сохраняться в течение нескольких месяцев и очень медленно заживают. Язвы на носовой перегородке очень часто встречаются у рабочих хроматографии. Воздействие более высоких количеств соединений хрома на человека может привести к ингибированию глутатионредуктазы эритроцитов, что, в свою очередь, снижает способность восстанавливать метгемоглобин до гемоглобина (Koutras et al., 1965; Schlatter & Kissling, 1973). Результаты, полученные в различных экспериментах in vitro, и in vivo, , показали, что хроматные соединения могут вызывать повреждение ДНК многими различными способами и могут приводить к образованию аддуктов ДНК, хромосомным аберрациям, обменам сестринских хроматид, изменениям в репликации и транскрипции ДНК (О’Брайен и др. , 2001; Мацумото и др. , 2006).
Алюминий
Алюминий — третий по распространенности элемент земной коры.Он существует только в одной степени окисления ( 3+ ) в окружающей среде. Основные пути потребления алюминия людьми — это вдыхание, проглатывание и контакт с кожей, а источники воздействия — питьевая вода, продукты питания, напитки и содержащие алюминий лекарства. Алюминий естественным образом присутствует в продуктах питания. Алюминий и его соединения плохо всасываются в организме человека, хотя скорость, с которой они всасываются, четко не изучена. Симптомы, указывающие на присутствие повышенного количества алюминия в организме человека, включают тошноту, язвы во рту, язвы на коже, кожную сыпь, рвоту, диарею и боль при артрите.Однако сообщалось, что эти симптомы были легкими и непродолжительными (Clayton, 1989). Воздействие алюминия, вероятно, является фактором риска возникновения болезни Альцгеймера (БА) у людей, как было предположено ВОЗ в 1997 году. Контактный дерматит и раздражающий дерматит наблюдались у людей, которые подвергались воздействию алюминия на рабочем месте. Алюминий оказывает неблагоприятное воздействие на нервную систему и приводит к потере памяти, проблемам с равновесием и потере координации (Krewski et al. , 2009).Людям, страдающим заболеваниями почек, трудно вывести алюминий из организма, что приводит к накоплению алюминия в организме, что приводит к повреждению костей и головного мозга. Некоторые факторы, которые, вероятно, могут быть причиной развития токсичности алюминия, — это жизнь в пыльной среде, длительное внутривенное питание, снижение функции почек, гемодиализ, употребление алкоголя или проглатывание веществ с высоким содержанием алюминия, работа в среде с высоким содержанием алюминия. уровни алюминия.Пациенты, проходящие диализ почек, могут подвергаться воздействию алюминия, присутствующего в загрязненных диализатах и фосфатсвязывающих веществах. Более высокие уровни воздействия алюминия могут изменить развитие вторичного гиперпаратиреоза, приводя к другим заболеваниям, таким как индуцированная алюминием адинамическая болезнь костей и индуцированная алюминием остеомаляция, оба из которых характеризуются низким ремоделированием костей (Andia, 1996). Некоторые из других осложнений, связанных с токсичностью алюминия, — это проблемы с легкими, анемия, нарушение всасывания железа, проблемы с нервной системой, и т. Д.
Железо
Железо — самый распространенный переходный металл в земной коре. С биологической точки зрения это самое важное питательное вещество для большинства живых существ, так как оно является кофактором многих жизненно важных белков и ферментов. Реакции, опосредованные железом, поддерживают большинство аэробных организмов в процессе их дыхания. Если он не защищен должным образом, он может катализировать реакции с образованием радикалов, которые могут повредить биомолекулы, клетки, ткани и весь организм. Отравление железом всегда интересовало в основном педиатров.Дети очень восприимчивы к отравлению железом, поскольку они подвергаются максимальному воздействию железосодержащих продуктов (Albretsen, 2006). Железный токсикоз протекает в четыре стадии. Первая стадия, которая наступает после 6 часов передозировки железа, характеризуется желудочно-кишечными эффектами, такими как желудочно-кишечное кровотечение, рвота и диарея (Osweiler et al. , 1985). Вторая стадия прогрессирует в пределах от 6 до 24 часов после передозировки и считается латентным периодом, периодом очевидного медицинского выздоровления. Третья стадия наступает между 12 и 96 часами после появления определенных клинических симптомов.Эта стадия характеризуется шоком, гипотонией, летаргией, тахикардией, некрозом печени, метаболическим ацидозом и иногда смертью (Hillman, 2001). Четвертая стадия наступает через 2–6 недель после передозировки железа. На этой стадии формируются язвы желудочно-кишечного тракта и развиваются стриктуры. Избыточное потребление железа — серьезная проблема в развитых странах и странах, потребляющих мясо, и увеличивает риск рака. Рабочие, которые подвергаются высокому воздействию асбеста, который содержит почти 30% железа, подвержены высокому риску асбестоза, который является второй по значимости причиной рака легких (Nelson, 1992).Говорят, что рак, связанный с асбестом, связан со свободными радикалами. Свободное внутриклеточное железо также может способствовать повреждению ДНК. Железо может вызвать рак в основном в результате окисления молекул ДНК (Bhasin et al. , (2002). Соли железа, такие как сульфат железа, моногидрат сульфата железа и гептагидрат сульфата железа, обладают низкой острой токсичностью при пероральном воздействии). дермальный и ингаляционный пути, поэтому они были отнесены к категории токсичности 3. Кроме того, Управление по санитарному надзору за качеством пищевых продуктов и медикаментов считает соли железа безопасными, а их токсические эффекты очень незначительны.Образование свободных радикалов — результат отравления железом (Ryan & Aust, 1992). Во время нормальной и патологической обработки клеток образуются такие побочные продукты, как супероксид и перекись водорода, которые считаются свободными радикалами (Fine, 2000). Эти свободные радикалы фактически нейтрализуются ферментами, такими как супероксиддисмутаза, каталаза и глутатионпероксидаза, но молекула супероксида обладает способностью высвобождать железо из ферритина, и что свободное железо реагирует со все большим количеством супероксида и перекиси водорода, образуя высокотоксичные свободные радикалы, такие как гидроксильный радикал (McCord, 1998).Гидроксильные радикалы опасны, поскольку они могут инактивировать определенные ферменты, инициировать перекисное окисление липидов, деполимеризовать полисахариды и могут вызвать разрывы цепи ДНК. Иногда это может привести к гибели клеток (Hershko et al., 1998).
Токсичность, механизм и воздействие на здоровье некоторых тяжелых металлов
Abstract
Доказано, что токсичность тяжелых металлов представляет собой серьезную угрозу, и с ней связано несколько рисков для здоровья. Токсические эффекты этих металлов, даже если они не имеют какой-либо биологической роли, по-прежнему присутствуют в той или иной форме, вредной для человеческого организма и его нормального функционирования.Иногда они действуют как псевдоэлементы тела, а иногда даже могут вмешиваться в метаболические процессы. Некоторые металлы, такие как алюминий, можно удалить с помощью действий по удалению, в то время как некоторые металлы накапливаются в организме и в пищевой цепи, проявляя хронический характер. Были предприняты различные меры общественного здравоохранения для контроля, предотвращения и лечения токсичности металлов на различных уровнях, таких как воздействие на рабочем месте, несчастные случаи и факторы окружающей среды. Токсичность металлов зависит от поглощенной дозы, пути воздействия и продолжительности воздействия, т.е.е. острый или хронический. Это может привести к различным расстройствам, а также к чрезмерному повреждению из-за окислительного стресса, вызванного образованием свободных радикалов. В этом обзоре подробно описаны некоторые тяжелые металлы и механизмы их токсичности, а также их влияние на здоровье.
Ключевые слова: тяжелые металлы, токсичность металлов, окислительный стресс, свободные радикалы
Введение
Металлы — это вещества с высокой электропроводностью, пластичностью и блеском, которые добровольно теряют свои электроны с образованием катионов.Металлы естественным образом находятся в земной коре, и их состав варьируется в зависимости от местности, что приводит к пространственным вариациям концентрации в окружающей среде. Распределение металлов в атмосфере контролируется свойствами данного металла и различными факторами окружающей среды (Khlifi & Hamza-Chaffai, 2010). Основная цель этого обзора — дать представление об источниках тяжелых металлов и их вредном воздействии на окружающую среду и живые организмы. К тяжелым металлам обычно относят те металлы, которые обладают удельной плотностью более 5 г / см 3 и отрицательно влияют на окружающую среду и живые организмы (Järup, 2003).Эти металлы являются квинтэссенцией для поддержания различных биохимических и физиологических функций живых организмов в очень низких концентрациях, однако они становятся ядовитыми, когда превышают определенные пороговые концентрации. Хотя признано, что тяжелые металлы имеют множество неблагоприятных последствий для здоровья и сохраняются в течение длительного периода времени, воздействие тяжелых металлов продолжается и увеличивается во многих частях мира. Тяжелые металлы являются значительными загрязнителями окружающей среды, и их токсичность становится проблемой, которая приобретает все большее значение с точки зрения экологии, эволюции, питания и окружающей среды (Jaishankar et al., 2013; Nagajyoti et al. , 2010). Наиболее часто встречающиеся в сточных водах тяжелые металлы включают мышьяк, кадмий, хром, медь, свинец, никель и цинк, которые представляют опасность для здоровья человека и окружающей среды (Lambert et al. , 2000). Тяжелые металлы попадают в окружающую среду естественным путем и в результате деятельности человека. Различные источники тяжелых металлов включают эрозию почвы, естественное выветривание земной коры, горнодобывающую промышленность, промышленные сточные воды, городские стоки, сброс сточных вод, средства борьбы с насекомыми или болезнями, применяемые для сельскохозяйственных культур, и многие другие (Morais et al., 2012). показывает мировое производство и потребление отдельных токсичных металлов в течение 1850–1990 гг. (Nriagu, 1996).
Мировое производство и потребление отдельных токсичных металлов в 1850–1990 годах (по материалам Nriagu, 1996).
Хотя эти металлы выполняют важные биологические функции у растений и животных, иногда их химическая координация и окислительно-восстановительные свойства дают им дополнительное преимущество, так что они могут избежать механизмов контроля, таких как гомеостаз, транспорт, компартментализация и связывание с необходимыми компонентами клетки.Эти металлы связываются с участками белка, которые не созданы для них, вытесняя исходные металлы с их естественных участков связывания, вызывая сбои в работе клеток и, в конечном итоге, токсичность. Предыдущие исследования показали, что окислительное разрушение биологических макромолекул происходит в первую очередь из-за связывания тяжелых металлов с ДНК и ядерными белками (Flora et al. , 2008).
Тяжелые металлы и механизмы их токсичности
Мышьяк
Мышьяк — один из наиболее важных тяжелых металлов, вызывающих беспокойство как с экологической точки зрения, так и с точки зрения здоровья человека (Hughes et al., 1988). Он имеет полуметаллические свойства, сильно токсичен и канцероген и широко доступен в форме оксидов или сульфидов или в виде соли железа, натрия, кальция, меди, и т. Д. (Singh et al. , 2007) . Мышьяк — двадцатый элемент по распространенности на Земле, а его неорганические формы, такие как арсенит и соединения арсената, смертельны для окружающей среды и живых существ. Люди могут столкнуться с мышьяком естественным путем, из промышленных источников или из непреднамеренных источников.Питьевая вода может быть загрязнена из-за использования мышьякоподобных пестицидов, природных минеральных отложений или неправильной утилизации мышьяковых химикатов. Преднамеренное употребление мышьяка в случае суицидных попыток или случайного употребления в пищу детьми может также привести к случаям острого отравления (Mazumder, 2008; Saha et al. , 1999). Мышьяк — это протопластический яд, поскольку он поражает в первую очередь сульфгидрильную группу клеток, вызывая нарушение клеточного дыхания, клеточных ферментов и митоза (Gordon & Quastel, 1948).
Механизм токсичности мышьяка
При биотрансформации мышьяка вредные неорганические соединения мышьяка метилируются бактериями, водорослями, грибами и людьми с образованием монометиларсоновой кислоты (MMA) и диметиларсиновой кислоты (DMA). В этом процессе биотрансформации эти неорганические виды мышьяка (iAs) ферментативно превращаются в метилированные мышьяки, которые являются конечными метаболитами и биомаркером хронического воздействия мышьяка.
iAs (V) → iAs (III) → MMA (V) → MMA (III) → DMA (V)
Биометилирование — это процесс детоксикации, конечные продукты которого представляют собой метилированный неорганический мышьяк, такой как MMA (V) и DMA (V). ), которые выводятся с мочой, являются биоиндикатором хронического воздействия мышьяка.Однако ММА (III) не выводится и остается внутри клетки в качестве промежуточного продукта.
Монометиларсоновая кислота (ММА III), промежуточный продукт, является высокотоксичным по сравнению с другими мышьяками, потенциально ответственным за канцерогенез, индуцированный мышьяком (Singh et al. , 2007).
Свинец
Свинец — высокотоксичный металл, широкое использование которого вызвало обширное загрязнение окружающей среды и проблемы со здоровьем во многих частях мира. Свинец — это яркий серебристый металл, слегка голубоватый в сухой атмосфере.Он начинает тускнеть при контакте с воздухом, образуя сложную смесь соединений в зависимости от данных условий. показывает различные источники загрязнения окружающей среды свинцом (Sharma & Dubey, 2005). Источники воздействия свинца включают в основном промышленные процессы, продукты питания и курение, питьевую воду и бытовые источники. Источниками свинца были бензин и краска для дома, которая распространена на свинцовые пули, водопроводные трубы, оловянные кувшины, аккумуляторные батареи, игрушки и краны (Thürmer et al., 2002). В США из выхлопных газов автомобилей выделяется от 100 до 200 000 тонн свинца в год. Некоторые из них поглощаются растениями, прикрепляются к почве и стекают в водоемы, следовательно, воздействие свинца на человека в общей популяции происходит либо с пищей, либо с питьевой водой (Goyer, 1990). Свинец — чрезвычайно токсичный тяжелый металл, который нарушает различные физиологические процессы растений и, в отличие от других металлов, таких как цинк, медь и марганец, не выполняет никаких биологических функций. Растение с высокой концентрацией свинца ускоряет производство активных форм кислорода (АФК), вызывая повреждение липидной мембраны, что в конечном итоге приводит к повреждению хлорофилла и фотосинтетическим процессам и подавляет общий рост растения (Najeeb et al., 2014). Некоторые исследования показали, что свинец способен подавлять рост чайного растения за счет уменьшения биомассы и ухудшает качество чая, изменяя качество его компонентов (Yongsheng et al. , 2011). Было обнаружено, что даже при низких концентрациях обработка свинцом вызывает огромную нестабильность поглощения ионов растениями, что, в свою очередь, приводит к значительным метаболическим изменениям в фотосинтетической способности и, в конечном итоге, к сильному торможению роста растений (Mostafa et al. , 2012).
Различные источники загрязнения окружающей среды свинцом (адаптировано из Sharma & Dubey, 2005).
Механизмы токсичности свинца
Металлический свинец вызывает токсичность в живых клетках по ионному механизму и по механизму окислительного стресса. Многие исследователи показали, что окислительный стресс в живых клетках вызван дисбалансом между производством свободных радикалов и производством антиоксидантов для детоксикации реакционноспособных промежуточных продуктов или для восстановления полученных повреждений.показывает атаку тяжелых металлов на клетку и баланс между производством АФК и последующей защитой, обеспечиваемой антиоксидантами. Антиоксиданты, такие как , например Глутатион , присутствующий в клетке, защищает ее от свободных радикалов, таких как H 2 O 2. Однако под влиянием свинца уровень ROS увеличивается, а уровень антиоксидантов снижается. Поскольку глутатион существует как в восстановленном (GSH), так и в окисленном (GSSG) состоянии, восстановленная форма глутатиона дает свои восстанавливающие эквиваленты (H + + e —) из тиоловых групп цистеина в ROS, чтобы сделать их стабильными. .В присутствии фермента глутатионпероксидазы восстановленный глутатион легко связывается с другой молекулой глутатиона после передачи электрона и образует дисульфид глутатиона (GSSG). Восстановленная форма (GSH) глутатиона составляет 90% от общего содержания глутатиона, а окисленная форма (GSSG) составляет 10% при нормальных условиях. Однако в условиях окислительного стресса концентрация GSSG превышает концентрацию GSH. Еще одним биомаркером окислительного стресса является перекисное окисление липидов, поскольку свободный радикал собирает электроны с молекул липидов, находящихся внутри клеточной мембраны, что в конечном итоге вызывает перекисное окисление липидов (Wadhwa et al., 2012; Flora et al. , 2012). В очень высоких концентрациях АФК могут вызывать структурное повреждение клеток, белков, нуклеиновых кислот, мембран и липидов, что приводит к стрессовой ситуации на клеточном уровне (Mathew et al., 2011).
Атака тяжелых металлов на клетку и баланс между производством АФК и последующей защитой, представленной антиоксидантами.
Ионный механизм токсичности свинца происходит в основном из-за способности ионов металлического свинца заменять другие двухвалентные катионы, такие как Ca 2+ , Mg 2+ , Fe 2+ и одновалентные катионы, такие как Na +, что в конечном итоге нарушает биологический метаболизм клетки.Ионный механизм токсичности свинца вызывает значительные изменения в различных биологических процессах, таких как клеточная адгезия, внутри- и межклеточная передача сигналов, сворачивание белков, созревание, апоптоз, перенос ионов, регуляция ферментов и высвобождение нейротрансмиттеров. Свинец может замещать кальций даже в пикомолярной концентрации, влияя на протеинкиназу С, которая регулирует нервное возбуждение и память (Flora et al. , 2012).
Ртуть
Металлическая ртуть — это металл природного происхождения, который представляет собой блестящую серебристо-белую жидкость без запаха, которая при нагревании превращается в бесцветный газ без запаха.Ртуть очень токсична и обладает чрезвычайно высокой способностью к биоаккумуляции. Его присутствие отрицательно влияет на морскую среду, и поэтому многие исследования направлены на распространение ртути в водной среде. Основные источники загрязнения ртутью включают антропогенную деятельность, такую как сельское хозяйство, сброс городских сточных вод, горнодобывающая промышленность, сжигание и сброс промышленных сточных вод (Chen et al. , 2012).
Ртуть существует в основном в трех формах: металлические элементы, неорганические соли и органические соединения, каждая из которых обладает различной токсичностью и биодоступностью.Эти формы ртути широко присутствуют в водных ресурсах, таких как озера, реки и океаны, где они поглощаются микроорганизмами и превращаются в метилртуть внутри микроорганизмов, в конечном итоге подвергаясь биомагнификации, вызывая значительное нарушение жизни водных организмов. Потребление этого зараженного водного животного является основным путем воздействия метилртути на человека (Trasande et al ., 2005). Ртуть широко используется в термометрах, барометрах, пирометрах, ареометрах, ртутных дуговых лампах, люминесцентных лампах и в качестве катализатора.Он также используется в целлюлозно-бумажной промышленности как компонент батарей и в стоматологических препаратах, таких как амальгамы. показывает глобальное использование ртути для различных применений (ГЭФ и Ртуть: Проблема Автор Ибрагима Соу, Группа ГЭФ по климату и химическим веществам . Доступно по адресу: http://www.thegef.org/gef/greenline/april-2012/ gef-and-mercury-challenge).
Мировое использование ртути для различных целей (всего в 2005 году: 3 760 метрических тонн).
Механизм отравления ртутью
Ртуть хорошо известна как опасный металл, и ее токсичность является частой причиной острого отравления тяжелыми металлами. Согласно данным Американской ассоциации центров по борьбе с отравлениями, в 1997 году было зарегистрировано 3 596 случаев.Метилртуть — нейротоксическое соединение, которое отвечает за разрушение микротрубочек, повреждение митохондрий, перекисное окисление липидов и накопление нейротоксических молекул, таких как серотонин, аспартат и глутамат (Patrick, 2002). Общий объем выбросов ртути в окружающую среду оценивается в 2200 метрических тонн в год (Ferrara et al. , 2000). По оценкам Агентства по охране окружающей среды и Национальной академии наук, от 8 до 10% американских женщин имеют уровни ртути, которые могут вызвать неврологические расстройства у любого ребенка, которого они родили.Животные, подвергшиеся воздействию токсичной ртути, показали неблагоприятные неврологические и поведенческие изменения. У кроликов при воздействии паров ртути 28,8 мг / м 2 3 в течение 1–13 недель наблюдались нечеткие патологические изменения, выраженная клеточная дегенерация и некроз мозга (Ashe et al. , 1953).
Мозг остается органом-мишенью для ртути, но он может повредить любой орган и привести к нарушению работы нервов, почек и мышц. Это может вызвать нарушение мембранного потенциала и нарушить гомеостаз внутриклеточного кальция.Ртуть связывается со свободно доступными тиолами, поскольку константы стабильности высоки (Patrick, 2002). Пары ртути могут вызвать бронхит, астму и временные респираторные проблемы. Ртуть играет ключевую роль в повреждении третичной и четвертичной белковой структуры и изменяет клеточную функцию, присоединяясь к селеногидрильным и сульфгидрильным группам, которые вступают в реакцию с метилртутью и препятствуют клеточной структуре. Он также вмешивается в процесс транскрипции и трансляции, приводя к исчезновению рибосом и уничтожению эндоплазматического ретикулума и активности естественных клеток-киллеров.Также нарушается целостность клеток, вызывая образование свободных радикалов. Основа хелатирования тяжелых металлов заключается в том, что даже несмотря на то, что сульфгидрильная связь ртути стабильна и разделена на окружающие сульфгидрильные лиганды, она также вносит свободные сульфгидрильные группы, способствуя подвижности металлов внутри лигандов (Bernhoft, 2011).
Кадмий
Кадмий является седьмым по токсичности тяжелым металлом согласно рейтингу ATSDR. Это побочный продукт производства цинка, которому люди или животные могут подвергаться на работе или в окружающей среде.Как только этот металл будет поглощен людьми, он будет накапливаться в организме на протяжении всей жизни. Этот металл впервые был использован во время Первой мировой войны в качестве заменителя олова и в лакокрасочной промышленности в качестве пигмента. В сегодняшнем сценарии он также используется в аккумуляторных батареях, для производства специальных сплавов, а также присутствует в табачном дыме. Около трех четвертей кадмия используется в щелочных батареях в качестве компонента электрода, оставшаяся часть используется в покрытиях, пигментах и гальванических покрытиях, а также в качестве стабилизатора пластмасс.Люди могут подвергаться воздействию этого металла в основном при вдыхании и проглатывании, а также могут страдать от острых и хронических интоксикаций. Распространенный в окружающей среде кадмий будет оставаться в почвах и отложениях в течение нескольких десятилетий. Растения постепенно поглощают эти металлы, которые накапливаются в них и концентрируются по пищевой цепочке, достигая в конечном итоге человеческого тела. В США более 500000 рабочих ежегодно подвергаются воздействию токсичного кадмия, согласно данным Агентства по токсичным веществам и регистру заболеваний (Бернард, 2008; Mutlu et al., 2012). Исследования показали, что в Китае общая площадь, загрязненная кадмием, составляет более 11 000 га, а ежегодный объем промышленных отходов кадмия, сбрасываемых в окружающую среду, оценивается более чем в 680 тонн. В Японии и Китае воздействие кадмия в окружающей среде сравнительно выше, чем в любой другой стране (Han et al. , 2009). Кадмий преимущественно содержится во фруктах и овощах из-за его высокой скорости передачи от почвы к растениям (Satarug et al. , 2011).Кадмий является высокотоксичным заменимым тяжелым металлом, который широко известен своим неблагоприятным влиянием на ферментативные системы клеток, окислительный стресс и индукцию дефицита питательных веществ у растений (Irfan et al. , 2013).
Механизм токсичности кадмия
Механизм токсичности кадмия четко не изучен, но его влияние на клетки известно (Patrick, 2003). Концентрация кадмия увеличивается в 3000 раз, когда он связывается с богатым цистеином белком, таким как металлотионеин.В печени комплекс цистеин-металлотионеин вызывает гепатотоксичность, а затем циркулирует в почках и накапливается в почечной ткани, вызывая нефротоксичность. Кадмий обладает способностью связываться с цистеиновыми, глутаматными, гистидиновыми и аспартатными лигандами и может приводить к дефициту железа (Castagnetto et al. , 2002). Кадмий и цинк имеют одинаковые степени окисления, и, следовательно, кадмий может заменять цинк, присутствующий в металлотионеине, тем самым препятствуя его действию в качестве поглотителя свободных радикалов в клетке.
Хром
Хром — седьмой по распространенности элемент на Земле (Mohanty & Kumar Patra, 2013). Хром находится в нескольких степенях окисления в окружающей среде от Cr 2+ до Cr 6+ (Родригес и др. , 2009) . Наиболее часто встречающимися формами Cr являются трехвалентный Cr +3 и шестивалентный Cr +6 , , причем оба состояния токсичны для животных, людей и растений (Mohanty & Kumar Patra, 2013).Хром естественным образом образуется при сжигании нефти и угля, нефти из феррохроматного огнеупорного материала, окислителей пигментов, катализатора, хромистой стали, удобрений, бурения нефтяных скважин и кожевенных заводов по нанесению металлических покрытий. Антропогенно хром попадает в окружающую среду через сточные воды и удобрения (Ghani, 2011). Cr (III) в своей восстановленной форме неподвижен и нерастворим в воде, тогда как Cr (VI) в окисленном состоянии хорошо растворяется в воде и, следовательно, подвижен (Wolińska et al. , 2013).Для определения активности ионов металлов в окружающей среде очень важен вид металла, поскольку в случае хрома окислительная форма Cr (III) не является существенным загрязнителем грунтовых вод, но было обнаружено, что Cr (VI) может быть токсичным для человека (Gürkan et al. , 2012). Cr (III) находится в органическом веществе почвы и водной среды в форме оксидов, гидроксидов и сульфатов (Cervantes et al. , 2001). Хром широко используется в таких отраслях, как металлургия, гальваника, производство красок и пигментов, дубление, консервирование древесины, химическое производство и производство целлюлозы и бумаги.Эти отрасли промышленности играют важную роль в загрязнении хромом, оказывая неблагоприятное воздействие на биологические и экологические виды (Ghani, 2011). Широкий спектр промышленных и сельскохозяйственных методов увеличивает уровень токсичности в окружающей среде, вызывая опасения по поводу загрязнения, вызываемого хромом. Загрязнение окружающей среды хромом, особенно шестивалентным хромом, стало самой большой проблемой в последние годы (Zayed & Terry, 2003). Кожевенные заводы сбрасывают в водные потоки многочисленные загрязняющие окружающую среду тяжелые металлы и соединения (Nath et al., 2008 г.). Из-за избытка кислорода в окружающей среде Cr (III) окисляется до Cr (VI), который чрезвычайно токсичен и хорошо растворяется в воде (Cervantes et al. , 2001). В августе 1975 года в Токио содержание грунтовых вод, содержащих Cr (VI) грунтовых пород, превышало допустимый предел содержания хрома в 2000 раз (Zayed & Terry, 2003). В Индии уровень хрома в подземных водах составляет более 12 мг / л и 550–1500 частей на миллион / л. Механизм ультраструктурной организации, биохимических изменений и регуляции метаболизма не выяснен, так как процесс фитотоксичности в водной среде хромом подробно не рассматривался (Chandra & Kulshreshtha, 2004).Сброс промышленных отходов и загрязнение грунтовых вод резко увеличили концентрацию хрома в почве (Bielicka et al. , 2005). Во время производства хромата отложение остатков Cr и орошение сточных вод серьезно загрязняли сельскохозяйственные угодья Cr. С внедрением современного сельского хозяйства происходит непрерывный выброс Cr в окружающую среду посредством остатков Cr, Cr-пыли и орошения сточных вод Cr, что приводит к загрязнению почвы, влияющему на почвенно-овощную систему, а также к ухудшению урожайности овощей и их качества для людей. (Дуан и др., 2010). Избыток хрома сверх допустимого предела является разрушительным для растений, поскольку он серьезно влияет на биологические факторы растения и попадает в пищевую цепочку при потреблении этих растительных материалов. Общими чертами, обусловленными фитотоксичностью Cr, являются снижение роста корней, хлороз листьев, ингибирование прорастания семян и снижение биомассы. Отравление хромом сильно влияет на биологические процессы в различных растениях, таких как кукуруза, пшеница, ячмень, цветная капуста, цитрулл и овощи.Отравление хромом вызывает хлороз и некроз растений (Ghani, 2011). Ферменты, такие как каталаза, пероксидаза и цитохромоксидаза, в состав которых входит железо, подвержены токсичности хрома. Активность каталазы, стимулированная избыточным поступлением хрома, вызывающая токсичность, изучалась в отношении фотосинтеза, активности нитратредуктазы, содержания белка в водорослях и фотосинтетических пигментов (Nath et al. , 2008). Хром (III) требует простого процесса диффузии для проникновения в клетку и не зависит от какого-либо конкретного мембранного носителя.В отличие от Cr (III), Cr (IV) может легко проходить через клеточную мембрану (Chandra & Kulshreshtha, 2004).
Механизм токсичности хрома
Трехвалентный хром Cr (III) в окружающей среде обычно безвреден из-за его слабой проницаемости мембраны. С другой стороны, шестивалентный хром Cr (VI) более активен в проникновении через клеточную мембрану для изоэлектрических и изоструктурных анионов, таких как SO 4 2– и HPO 4 2– каналов и этих хроматов. поглощаются через фагоцитоз.Cr (VI) является сильным окислителем и может быть восстановлен с образованием эфемерных разновидностей пятивалентного и четырехвалентного хрома, которые отличаются от Cr (III). Стабилизация пентавелентной формы осуществляется глутатионом, и, следовательно, внутриклеточное восстановление Cr [VI] считается механизмом детоксикации, когда восстановление происходит вдали от целевой области. Однако, если внутриклеточное восстановление Cr [VI] происходит рядом с целевым сайтом, это может служить для активации Cr. Реакции между Cr (VI) и биологическими восстановителями, такими как тиолы и аскорбат, приводят к образованию активных форм кислорода, таких как супероксид-ион, перекись водорода и гидроксильный радикал, что в конечном итоге приводит к окислительному стрессу в клетке, вызывая повреждение ДНК и белков (Stohs И Багчи, 1995).Согласно литературным исследованиям, Cr (VI) оказался гораздо более опасным, чем Cr (III), поскольку Cr (VI) проникает в клетки легче, чем Cr (III), и в конечном итоге восстанавливается до Cr (III). Из-за своих мутагенных свойств Cr (VI) классифицируется Международным агентством по изучению рака как канцероген для человека группы 1 (Dayan & Paine, 2001; Zhang, 2011).
Алюминий
Алюминий — третий по распространенности элемент, обнаруженный в земной коре (Gupta et al., 2013). Алюминий естественным образом содержится в воздухе, воде и почве. Добыча и переработка алюминия повышает его уровень в окружающей среде (ATSDR, 2010). Недавние исследования токсикологии окружающей среды показали, что алюминий может представлять серьезную угрозу для людей, животных и растений, вызывая многие заболевания (Barabasz et al. , 2002). Многие факторы, включая pH воды и содержание органических веществ, сильно влияют на токсичность алюминия. С понижением pH его токсичность увеличивается (Jeffrey et al., 1997). Мобилизация токсичных ионов алюминия в результате изменений pH почвы и воды, вызванных кислотными дождями и увеличением подкисления окружающей атмосферы, оказывает неблагоприятное воздействие на окружающую среду. Это проявляется в высыхании лесов, отравлении растений, падении урожая или его неурожая, гибели водных животных, а также в различных дисбалансах в функциях систем человека и животных (Barabasz et al. , 2002). PH поверхностного слоя почвы ниже 5 (pH <5) может привести к кислотности почвы, которая является серьезной проблемой во всем мире и влияет на урожайность сельскохозяйственных культур.Из-за токсичности алюминия производство сельскохозяйственных культур было ограничено до 67% от общей площади кислых почв в мире. Алюминий - один из наиболее часто встречающихся элементов в земной коре. Из-за кислых почв (pH <5) кремний выщелачивается, оставляя алюминий в твердой форме, известной как оксигидроксиды алюминия, такие как гиббсит и бемит. Эти нестабильные формы фитотоксического выброса алюминия Al 3+ хорошо известны как Al (OH) 63+ в почве (Ermias Abate et al. , 2013).Взаимодействие Al 3+ с апопластными, плазматическими мембранами и симпластическими мишенями приводит к токсичности и нарушает физические и клеточные процессы в растениях. Обычными проявлениями являются задержка роста корней, модификация клеток в листьях, маленькие и темно-зеленые листья, пожелтение и гибель листьев, хлороз, пурпурность и некроз листьев (Gupta et al. , 2013). Алюминий в высоких концентрациях очень токсичен для водных животных, особенно для организмов, дышащих жабрами, таких как рыба, вызывая осморегуляторную недостаточность из-за разрушения плазмы и ионов гемолимфы.Активность жаберного фермента, необходимого для поглощения ионов, у рыб подавляется мономерной формой алюминия (Rosseland et al. , 1990). Живые организмы в воде, такие как водоросли и раки, также подвержены токсичности алюминия (Bezak-Mazur, 2001). Алюминий не играет биологической роли и является токсичным несущественным металлом для микроорганизмов (Olaniran et al. , 2013). Ферменты, такие как гексокиназа, фосфодиэстераза, щелочная фосфатаза и фосфоксидаза, ингибируются алюминием, поскольку он имеет большее сродство к ДНК и РНК.На метаболические пути в живом организме, включая метаболизм кальция, фосфора, фтора и железа, влияет алюминий. Было обнаружено, что алюминий очень вреден для нервных, костных и кроветворных клеток (Barabasz1 et al. , 2002).
Механизм токсичности алюминия
Алюминий влияет на большинство физических и клеточных процессов. Точный механизм всасывания алюминия желудочно-кишечным трактом полностью не изучен. Основываясь на обзорах литературы, трудно указать надлежащий период времени для токсичности алюминия, поскольку некоторые симптомы токсичности алюминия могут быть обнаружены через секунды, а другие — через минуты после воздействия алюминия (ВОЗ, 1997).Токсичность алюминия, вероятно, является результатом взаимодействия между алюминием и плазматической мембраной, апопластическими и симпластическими мишенями (Kochian et al. , 2005). У человека Mg 2+ и Fe 3+ заменены на Al 3+ , что вызывает множество нарушений, связанных с межклеточной коммуникацией, клеточным ростом и секреторными функциями. Изменения, вызываемые алюминием в нейронах, аналогичны дегенеративным поражениям, наблюдаемым у пациентов с болезнью Альцгеймера. Наибольшими осложнениями токсичности алюминия являются эффекты нейротоксичности, такие как атрофия нейронов в голубом пятне, черной субстанции и полосатом теле ( Filiz & Meral, 2007) .
Железо
Железо — второй по распространенности металл в земной коре (EPA, 1993). Железо занимает 26 -ю позицию элемента в периодической таблице. Железо — важнейший элемент для роста и выживания почти всех живых организмов (Valko et al. , 2005). Это один из жизненно важных компонентов таких организмов, как водоросли, и ферментов, таких как цитохромы и каталаза, а также белков, переносящих кислород, таких как гемоглобин и миоглобин (Vuori, 1995).Железо является привлекательным переходным металлом для различных биологических окислительно-восстановительных процессов из-за его взаимного превращения между ионами двухвалентного железа (Fe 2+ ) и трехвалентного железа (Fe 3+ ) (Phippen et al. , 2008). Источник железа в поверхностных водах является антропогенным и связан с горнодобывающей деятельностью. Производство серной кислоты и разгрузка железа (Fe 2+ ) происходит за счет окисления пирита железа (FeS 2 ), который обычен в угольных пластах (Valko et al., 2005). Следующие уравнения представляют собой упрощенную реакцию окисления двухвалентного и трехвалентного железа (Phippen et al. , 2008):
2FeS 2 + 7O 2 → 2FeSO 4 + H 2 SO 4 ( железо)
4FeSO 4 + O 2 + 10H 2 O → 4Fe (OH) 3 + 4H 2 SO 4 (трехвалентное)
Концентрация растворенного железа в глубинах океана обычно составляет 0,6 нМ или 33.5 × 10 −9 мг / л. В пресной воде концентрация очень низкая с уровнем обнаружения 5 мкг / л — ICP, тогда как в грунтовых водах концентрация растворенного железа очень высока — 20 мг / л (EPA, 1993). В таких странах, как Литва, многие люди подвергались воздействию повышенных уровней железа через питьевую воду, поскольку собранные подземные воды превышали допустимый предел, установленный Директивой Европейского Союза 98/83 / EC о качестве питьевой воды (Grazuleviciene et al. , 2009 г.).На численность таких видов, как перифитон, бентосные беспозвоночные и разнообразие рыб, в значительной степени влияют прямые и косвенные эффекты загрязнения железом (Vuori, 1995). Осадок железа вызовет значительный ущерб из-за засорения и затруднит дыхание рыб (EPA, 1993). Исследование токсичности железа для водных растений, в частности риса, показало, что рост видов водного тростника тормозился концентрацией общего железа 1 мг / л (Phippen et al., 2008 г.). Кислые почвы ограничивают производство риса и вместе с дефицитом цинка вызывают нарушение макроэлементов в рисе, выращенном на водно-болотных угодьях. На производство низинного риса сильно повлияла высокая концентрация восстановленного железа (Fe 2+ ) в затопленных почвах. Особенности токсичности железа для риса включают высокое поглощение Fe 2+ корнями, акропетальную транслокацию в листья, бронзовое покрытие листьев риса и потерю урожая (Becker & Asch, 2005).
Механизм токсичности железа
Широкий спектр вредных свободных радикалов образуется, когда абсорбированное железо не может связываться с белком, что, в свою очередь, серьезно влияет на концентрацию железа в клетках млекопитающих и биологических жидкостях.Это циркулирующее несвязанное железо вызывает разъедание желудочно-кишечного тракта и биологических жидкостей. Чрезвычайно высокий уровень железа поступает в организм, преодолевая ограничивающую скорость абсорбцию, и становится насыщенным. Эти свободные утюги проникают в клетки сердца, печени и мозга. Из-за нарушения окислительного фосфорилирования свободным железом двухвалентное железо превращается в трехвалентное железо, которое выделяет ионы водорода, тем самым повышая метаболическую кислотность. Свободное железо также может приводить к перекисному окислению липидов, что приводит к серьезным повреждениям митохондрий, микросом и других клеточных органелл (Albretsen, 2006).Токсичность железа для клеток приводит к опосредованному железом повреждению тканей, включая клеточные механизмы окисления и восстановления, и их токсичность по отношению к внутриклеточным органеллам, таким как митохондрии и лизосомы. Широкий спектр свободных радикалов, которые, как считается, вызывают потенциальное повреждение клеток, образуются из-за избыточного потребления железа. Свободные радикалы водорода, производимые железом, атакуют ДНК, что приводит к повреждению клеток, мутациям и злокачественным трансформациям, которые, в свою очередь, вызывают множество заболеваний (Grazuleviciene et al., 2009 г.).
Воздействие тяжелых металлов на человека
35 металлов вызывают у нас озабоченность из-за воздействия на рабочем месте или на работе, из которых 23 тяжелые: сурьма, мышьяк, висмут, кадмий, церий, хром, кобальт, медь. , галлий, золото, железо, свинец, марганец, ртуть, никель, платина, серебро, теллур, таллий, олово, уран, ванадий и цинк (Mosby et al. 1996). Эти тяжелые металлы обычно присутствуют в окружающей среде и рационе питания.В небольших количествах они необходимы для поддержания хорошего здоровья, но в больших количествах они могут стать токсичными или опасными. Токсичность тяжелых металлов может снизить уровень энергии и нарушить работу мозга, легких, почек, печени, состав крови и других важных органов. Длительное воздействие может привести к постепенному прогрессированию физических, мышечных и неврологических дегенеративных процессов, имитирующих такие заболевания, как рассеянный склероз, болезнь Паркинсона, болезнь Альцгеймера и мышечная дистрофия.Повторяющееся длительное воздействие некоторых металлов и их соединений может даже вызвать рак (Jarup, 2003). Уровень токсичности некоторых тяжелых металлов может быть чуть выше фоновых концентраций, которые естественным образом присутствуют в окружающей среде. Следовательно, тщательное знание тяжелых металлов очень важно для принятия надлежащих защитных мер против чрезмерного контакта с ними (Ferner, 2001).
Воздействие мышьяка
Загрязнение мышьяком произошло как в результате естественных геологических процессов, так и в результате деятельности человека.Антропогенные источники мышьяка включают деятельность человека, такую как добыча и переработка руд. Процесс плавки, как древний, так и недавний, может выделять мышьяк в воздух и почву (Matschullat, 2000). Такие типы источников могут влиять на качество поверхностных вод из-за выброса и стока грунтовых вод. Другой путь загрязнения грунтовых вод — геологические источники, такие как минералы мышьяка. Третий тип источников — это осадочные и метаосадочные породы (Smedley & Kinniburgh, 2002).Большинство красок, красителей, мыла, металлов, полупроводников и лекарств содержат мышьяк. Некоторые пестициды, удобрения и кормление животных также выделяют мышьяк в окружающую среду в больших количествах. Неорганические формы мышьяка, такие как арсенит и арсенат, более опасны для здоровья человека. Они обладают сильным канцерогенным действием и могут вызывать рак легких, печени, мочевого пузыря и кожи. Люди подвергаются воздействию мышьяка через воздух, пищу и воду. Питьевая вода, загрязненная мышьяком, является одной из основных причин токсичности мышьяка в более чем 30 странах мира (Chowdhury et al., 2000). Если уровень мышьяка в грунтовых водах в 10–100 раз превышает значение, указанное в руководстве ВОЗ для питьевой воды (10 мкг / л), это может представлять угрозу для здоровья человека (Hoque et al. , 2011). Вода может быть загрязнена из-за неправильной утилизации мышьяковых химикатов, мышьяковых пестицидов или природных минеральных отложений. Токсичность мышьяком может быть острой или хронической, а хроническая токсичность мышьяка называется арсеникозом. Большинство сообщений о хронической токсичности мышьяка у человека сосредоточены на кожных проявлениях из-за его специфичности в диагностике.Пигментация и кератоз — это специфические поражения кожи, которые указывают на хроническую токсичность мышьяка (Martin & Griswold, 2009). показывает мышьяковый кератоз, так называемые «капли дождя на пыльной дороге» (Костный мозг — неопухолевые, доброкачественные изменения, токсичность мышьяка, доступно по адресу: http://www.pathologyoutlines.com/topic/bonemarrarsenic.html) и показывает поражения кожи, вызванные мышьякозу (источник: Smith et al., 2000).
Поражения кожи, вызванные арсеникозом (адаптировано из Smith et al. , 2000).
Более низкие уровни воздействия мышьяка могут вызвать тошноту и рвоту, снижение выработки эритроцитов и лейкоцитов, нарушение сердечного ритма, ощущение покалывания в руках и ногах и повреждение кровеносных сосудов. Длительное воздействие может привести к образованию кожных поражений, внутреннему раку, неврологическим проблемам, легочным заболеваниям, заболеваниям периферических сосудов, гипертонии, сердечно-сосудистым заболеваниям и сахарному диабету (Smith et al., 2000). Хронический арсеникоз приводит к множеству необратимых изменений в жизненно важных органах, и уровень смертности выше.Несмотря на масштабы этой потенциально смертельной токсичности, эффективного лечения этого заболевания не существует (Mazumder, 2008).
Свинец
Деятельность человека, такая как добыча полезных ископаемых, производство и сжигание ископаемого топлива, привела к накоплению свинца и его соединений в окружающей среде, включая воздух, воду и почву. Свинец используется для производства батарей, косметики, металлических изделий, таких как боеприпасы, припой и трубы, и т. Д. (Martin & Griswold, 2009).Свинец очень токсичен, поэтому его использование в различных продуктах, таких как краски, бензин, и т. Д. , в настоящее время значительно сокращено. Основными источниками воздействия свинца являются краски на основе свинца, бензин, косметика, игрушки, бытовая пыль, загрязненная почва, промышленные выбросы (Gerhardsson et al. , 2002). Отравление свинцом считалось классическим заболеванием, и признаки, которые наблюдались у детей и взрослых, в основном относились к центральной нервной системе и желудочно-кишечному тракту (Markowitz, 2000).Отравление свинцом также может произойти через питьевую воду. Трубы, по которым течет вода, могут быть сделаны из свинца и его соединений, которые могут загрязнять воду (Brochin et al. , 2008). По данным Агентства по охране окружающей среды (EPA), свинец считается канцерогеном. Свинец оказывает сильное воздействие на разные части тела. Распределение свинца в организме изначально зависит от кровотока в различных тканях, и почти 95% свинца откладывается в форме нерастворимого фосфата в костях скелета (Papanikolaou 2005).Токсичность свинца, также называемая отравлением свинцом, может быть острой или хронической. Острое воздействие может вызвать потерю аппетита, головную боль, гипертонию, боль в животе, почечную дисфункцию, усталость, бессонницу, артрит, галлюцинации и головокружение. Острое воздействие в основном происходит на рабочем месте и в некоторых отраслях обрабатывающей промышленности, где используется свинец. Хроническое воздействие свинца может привести к умственной отсталости, врожденным дефектам, психозу, аутизму, аллергии, дислексии, потере веса, гиперактивности, параличу, мышечной слабости, повреждению мозга, повреждению почек и даже может стать причиной смерти (Martin & Griswold, 2009).показывает увеличение концентрации свинца в крови, влияющее на IQ человека (Taylor et al. , 2012). Хотя отравление свинцом можно предотвратить, оно по-прежнему остается опасным заболеванием, поражающим большинство органов. Плазматическая мембрана перемещается в интерстициальные пространства головного мозга, когда гематоэнцефалический барьер подвергается воздействию повышенных уровней концентрации свинца, что приводит к состоянию, называемому отеком (Teo et al. 1997). Он нарушает внутриклеточные системы вторичных мессенджеров и изменяет функционирование центральной нервной системы, защита которой очень важна.Источники ионов свинца в окружающей среде и в быту являются основной причиной заболевания, но с помощью надлежащих мер предосторожности можно снизить риск, связанный с токсичностью свинца (Brochin et al. , 2008). показывает эффекты повышенного уровня свинца в крови (Brochin et al. , 2008).
Повышение концентрации свинца в крови, влияющее на IQ человека (адаптировано из Taylor et al. , 2012).
Эффекты повышенного уровня свинца в крови (адаптировано из Brochin et al., 2008 г.).
Ртуть
Ртуть считается самым токсичным тяжелым металлом в окружающей среде. Отравление ртутью называют акродинией или розовой болезнью. Ртуть попадает в окружающую среду в результате деятельности различных отраслей, таких как фармацевтика, консерванты бумаги и целлюлозы, сельское хозяйство, производство хлора и каустической соды (Morais et al. , 2012). Ртуть обладает способностью соединяться с другими элементами и образовывать органическую и неорганическую ртуть.Воздействие повышенных уровней металлической, органической и неорганической ртути может повредить мозг, почки и развивающийся плод (Alina et al. , 2012). Ртуть присутствует в большинстве пищевых продуктов и напитков в диапазоне от <1 до 50 мкг / кг. В морских продуктах он часто встречается в более высоких концентрациях. Органическая ртуть может легко проникать через биомембраны, и, поскольку они липофильны по своей природе, ртуть присутствует в более высоких концентрациях в большинстве видов жирной рыбы и в печени нежирной рыбы (Reilly, 2007).Микроорганизмы превращают ртуть, присутствующую в почве и воде, в метилртуть, токсин, который может накапливаться с возрастом рыб и с увеличением трофических уровней. EPA объявило хлорид ртути и метилртуть высоко канцерогенными. Нервная система очень чувствительна ко всем видам ртути. Повышенное воздействие ртути может изменить функции мозга и привести к застенчивости, тремору, проблемам с памятью, раздражительности и изменениям зрения или слуха. Воздействие паров металлической ртути на более высоких уровнях в течение более коротких периодов времени может привести к повреждению легких, рвоте, диарее, тошноте, кожной сыпи, учащению пульса или артериального давления.Симптомы отравления органической ртутью включают депрессию, проблемы с памятью, тремор, усталость, головную боль, выпадение волос, и т. Д. Поскольку эти симптомы часто встречаются и при других состояниях, такие случаи может быть трудно диагностировать (Martin & Griswold, 2009). Из-за чрезмерного воздействия на здоровье, связанного с воздействием ртути, нынешний стандарт для питьевой воды был установлен на более низких уровнях 0,002 мг / л и 0,001 мг / л Законом об охране окружающей среды и Всемирной организацией здравоохранения (ВОЗ, 2004).
Таблица 1
Типы токсичности ртути.
| Элементарная ртуть | Метилртуть | Неорганическая ртуть | |
|---|---|---|---|
| Источники | Ископаемое топливо, стоматологические амальгамы, старая латексная краска, инсинераторы, термометры | Пестициды, рыба, птица | Биологическое окисление ртути, деметилирование метилртути кишечной микрофлорой |
| Поглощение | 75–85% абсорбированного пара | 95–100% абсорбированного в кишечном тракте | 7–15% поглощенной дозы абсорбируется и 2–3% дозы всасывается через кожу у животных |
| Распределение | Распространяется по всему телу, липофильно, проникает через гематоэнцефалический барьер и плацентарный барьер, накапливается в головном мозге и почках | Распространяется по всему телу, липофильно, легко проникает через гематоэнцефалический барьер, а также через плацентарный барьер, накапливается в почках и головном мозге | Не проникает через гематоэнцефалический или плацентарный барьер, присутствует у новорожденных в головном мозге, накапливается в почках |
| Экскреция | Пот, моча, кал и слюна | 90% выводится с желчью, калом, 10% с мочой | Пот, слюна, моча и кал |
| Причина токсичности | Окисление до неорганической ртути | Деметилирование до неорганической ртути, образование свободных радикалов, связывание с тиолами в ферментах и структурных белках | Связывание с тиолами в ферментах и структурных белках |
Кадмий
Кадмий — металл 20 -е годы гг.Это побочный продукт производства цинка. Почвы и горные породы, включая уголь и минеральные удобрения, содержат некоторое количество кадмия. Кадмий имеет множество применений, например, в аккумуляторах, пигментах, пластмассах и металлических покрытиях и широко используется в гальванике (Martin & Griswold, 2009). представляет относительный вклад различных источников в воздействие кадмия на человека (Regoli, 2005). Кадмий и его соединения классифицируются Международным агентством по изучению рака как канцерогены группы 1 для человека (Henson & Chedrese, 2004).Кадмий попадает в окружающую среду в результате естественной деятельности, такой как извержения вулканов, выветривание, речной транспорт и некоторые виды деятельности человека, такие как добыча полезных ископаемых, плавка, курение табака, сжигание городских отходов и производство удобрений. Хотя выбросы кадмия заметно сократились в большинстве промышленно развитых стран, он остается источником опасений для рабочих и людей, живущих в загрязненных районах. Кадмий может вызывать как острые, так и хронические отравления (Chakraborty et al., 2013). Кадмий очень токсичен для почек и накапливается в клетках проксимальных канальцев в более высоких концентрациях. Кадмий может вызвать минерализацию костей либо из-за повреждения костей, либо из-за почечной дисфункции. Исследования на людях и животных показали, что остеопороз (повреждение скелета) является критическим эффектом воздействия кадмия наряду с нарушениями метаболизма кальция, образованием почечных камней и гиперкальциурией. Вдыхание более высоких уровней кадмия может вызвать серьезное повреждение легких.Если кадмий попадает в организм в больших количествах, это может вызвать раздражение желудка и привести к рвоте и диарее. При очень длительном воздействии при более низких концентрациях он может откладываться в почках и в конечном итоге привести к заболеванию почек, хрупкости костей и повреждению легких (Bernard, 2008). Кадмий и его соединения хорошо растворимы в воде по сравнению с другими металлами. Их биодоступность очень высока, и, следовательно, они склонны к биоаккумуляции. Длительное воздействие кадмия может привести к морфопатологическим изменениям почек.Курильщики более подвержены отравлению кадмием, чем некурящие. Табак является основным источником поглощения кадмия курильщиками, поскольку растения табака, как и другие растения, могут накапливать кадмий из почвы. Некурящие подвергаются воздействию кадмия с пищей и некоторыми другими путями. Однако поглощение кадмия другими путями намного ниже (Mudgal et al. , 2010). показывает значения токсичности кадмия (Flora et al. , 2008). Кадмий взаимодействует с основными питательными веществами, благодаря чему он оказывает токсическое действие.Экспериментальный анализ на животных показал, что 50% кадмия всасывается в легких и меньше — в желудочно-кишечном тракте. Преждевременные роды и снижение массы тела при рождении — это проблемы, которые возникают, если воздействие кадмия во время беременности человека является высоким (Henson & Chedrese, 2004).
Относительный вклад различных источников в воздействие кадмия на человека (адаптировано из Regoli, 2005).
Значения токсичности кадмия (адаптировано из Flora et al. , 2008).
Хром
Хром присутствует в горных породах, почве, животных и растениях.Он может быть твердым, жидким и в виде газа. Соединения хрома очень стойкие в водных отложениях. Они могут находиться во многих различных состояниях, таких как двухвалентное, четырехвалентное, пятивалентное и шестивалентное состояние. Cr (VI) и Cr (III) являются наиболее стабильными формами, и только их связь с воздействием на человека представляет большой интерес (Житкович, 2005). Соединения хрома (VI), такие как хромат кальция, хроматы цинка, хромат стронция и хроматы свинца, являются высокотоксичными и канцерогенными по своей природе. С другой стороны, хром (III) является важной пищевой добавкой для животных и людей и играет важную роль в метаболизме глюкозы.Поглощение соединений шестивалентного хрома через дыхательные пути и пищеварительный тракт происходит быстрее, чем у соединений трехвалентного хрома. Профессиональные источники хрома включают защитные металлические покрытия, металлические сплавы, магнитные ленты, пигменты для красок, резину, цемент, бумагу, консерванты для древесины, дубление кожи и металлизацию (Martin & Griswold, 2009). Schroeder et al. (1970) сообщил, что сигареты содержат 390 г / кг Cr, но не было опубликовано значительных отчетов о количестве хрома, вдыхаемого при курении.Когда поврежденная кожа соприкасается с любым типом соединений хрома, образуется глубоко проникающее отверстие. Воздействие соединений хрома может привести к образованию язв, которые будут сохраняться в течение нескольких месяцев и очень медленно заживают. Язвы на носовой перегородке очень часто встречаются у рабочих хроматографии. Воздействие более высоких количеств соединений хрома на человека может привести к ингибированию глутатионредуктазы эритроцитов, что, в свою очередь, снижает способность восстанавливать метгемоглобин до гемоглобина (Koutras et al., 1965; Schlatter & Kissling, 1973). Результаты, полученные в различных экспериментах in vitro, и in vivo, , показали, что хроматные соединения могут вызывать повреждение ДНК многими различными способами и могут приводить к образованию аддуктов ДНК, хромосомным аберрациям, обменам сестринских хроматид, изменениям в репликации и транскрипции ДНК (О’Брайен и др. , 2001; Мацумото и др. , 2006).
Алюминий
Алюминий — третий по распространенности элемент земной коры.Он существует только в одной степени окисления ( 3+ ) в окружающей среде. Основные пути потребления алюминия людьми — это вдыхание, проглатывание и контакт с кожей, а источники воздействия — питьевая вода, продукты питания, напитки и содержащие алюминий лекарства. Алюминий естественным образом присутствует в продуктах питания. Алюминий и его соединения плохо всасываются в организме человека, хотя скорость, с которой они всасываются, четко не изучена. Симптомы, указывающие на присутствие повышенного количества алюминия в организме человека, включают тошноту, язвы во рту, язвы на коже, кожную сыпь, рвоту, диарею и боль при артрите.Однако сообщалось, что эти симптомы были легкими и непродолжительными (Clayton, 1989). Воздействие алюминия, вероятно, является фактором риска возникновения болезни Альцгеймера (БА) у людей, как было предположено ВОЗ в 1997 году. Контактный дерматит и раздражающий дерматит наблюдались у людей, которые подвергались воздействию алюминия на рабочем месте. Алюминий оказывает неблагоприятное воздействие на нервную систему и приводит к потере памяти, проблемам с равновесием и потере координации (Krewski et al. , 2009).Людям, страдающим заболеваниями почек, трудно вывести алюминий из организма, что приводит к накоплению алюминия в организме, что приводит к повреждению костей и головного мозга. Некоторые факторы, которые, вероятно, могут быть причиной развития токсичности алюминия, — это жизнь в пыльной среде, длительное внутривенное питание, снижение функции почек, гемодиализ, употребление алкоголя или проглатывание веществ с высоким содержанием алюминия, работа в среде с высоким содержанием алюминия. уровни алюминия.Пациенты, проходящие диализ почек, могут подвергаться воздействию алюминия, присутствующего в загрязненных диализатах и фосфатсвязывающих веществах. Более высокие уровни воздействия алюминия могут изменить развитие вторичного гиперпаратиреоза, приводя к другим заболеваниям, таким как индуцированная алюминием адинамическая болезнь костей и индуцированная алюминием остеомаляция, оба из которых характеризуются низким ремоделированием костей (Andia, 1996). Некоторые из других осложнений, связанных с токсичностью алюминия, — это проблемы с легкими, анемия, нарушение всасывания железа, проблемы с нервной системой, и т. Д.
Железо
Железо — самый распространенный переходный металл в земной коре. С биологической точки зрения это самое важное питательное вещество для большинства живых существ, так как оно является кофактором многих жизненно важных белков и ферментов. Реакции, опосредованные железом, поддерживают большинство аэробных организмов в процессе их дыхания. Если он не защищен должным образом, он может катализировать реакции с образованием радикалов, которые могут повредить биомолекулы, клетки, ткани и весь организм. Отравление железом всегда интересовало в основном педиатров.Дети очень восприимчивы к отравлению железом, поскольку они подвергаются максимальному воздействию железосодержащих продуктов (Albretsen, 2006). Железный токсикоз протекает в четыре стадии. Первая стадия, которая наступает после 6 часов передозировки железа, характеризуется желудочно-кишечными эффектами, такими как желудочно-кишечное кровотечение, рвота и диарея (Osweiler et al. , 1985). Вторая стадия прогрессирует в пределах от 6 до 24 часов после передозировки и считается латентным периодом, периодом очевидного медицинского выздоровления. Третья стадия наступает между 12 и 96 часами после появления определенных клинических симптомов.Эта стадия характеризуется шоком, гипотонией, летаргией, тахикардией, некрозом печени, метаболическим ацидозом и иногда смертью (Hillman, 2001). Четвертая стадия наступает через 2–6 недель после передозировки железа. На этой стадии формируются язвы желудочно-кишечного тракта и развиваются стриктуры. Избыточное потребление железа — серьезная проблема в развитых странах и странах, потребляющих мясо, и увеличивает риск рака. Рабочие, которые подвергаются высокому воздействию асбеста, который содержит почти 30% железа, подвержены высокому риску асбестоза, который является второй по значимости причиной рака легких (Nelson, 1992).Говорят, что рак, связанный с асбестом, связан со свободными радикалами. Свободное внутриклеточное железо также может способствовать повреждению ДНК. Железо может вызвать рак в основном в результате окисления молекул ДНК (Bhasin et al. , (2002). Соли железа, такие как сульфат железа, моногидрат сульфата железа и гептагидрат сульфата железа, обладают низкой острой токсичностью при пероральном воздействии). дермальный и ингаляционный пути, поэтому они были отнесены к категории токсичности 3. Кроме того, Управление по санитарному надзору за качеством пищевых продуктов и медикаментов считает соли железа безопасными, а их токсические эффекты очень незначительны.Образование свободных радикалов — результат отравления железом (Ryan & Aust, 1992). Во время нормальной и патологической обработки клеток образуются такие побочные продукты, как супероксид и перекись водорода, которые считаются свободными радикалами (Fine, 2000). Эти свободные радикалы фактически нейтрализуются ферментами, такими как супероксиддисмутаза, каталаза и глутатионпероксидаза, но молекула супероксида обладает способностью высвобождать железо из ферритина, и что свободное железо реагирует со все большим количеством супероксида и перекиси водорода, образуя высокотоксичные свободные радикалы, такие как гидроксильный радикал (McCord, 1998).Гидроксильные радикалы опасны, поскольку они могут инактивировать определенные ферменты, инициировать перекисное окисление липидов, деполимеризовать полисахариды и могут вызвать разрывы цепи ДНК. Иногда это может привести к гибели клеток (Hershko et al., 1998).
Токсичность, механизм и воздействие на здоровье некоторых тяжелых металлов
Abstract
Доказано, что токсичность тяжелых металлов представляет собой серьезную угрозу, и с ней связано несколько рисков для здоровья. Токсические эффекты этих металлов, даже если они не имеют какой-либо биологической роли, по-прежнему присутствуют в той или иной форме, вредной для человеческого организма и его нормального функционирования.Иногда они действуют как псевдоэлементы тела, а иногда даже могут вмешиваться в метаболические процессы. Некоторые металлы, такие как алюминий, можно удалить с помощью действий по удалению, в то время как некоторые металлы накапливаются в организме и в пищевой цепи, проявляя хронический характер. Были предприняты различные меры общественного здравоохранения для контроля, предотвращения и лечения токсичности металлов на различных уровнях, таких как воздействие на рабочем месте, несчастные случаи и факторы окружающей среды. Токсичность металлов зависит от поглощенной дозы, пути воздействия и продолжительности воздействия, т.е.е. острый или хронический. Это может привести к различным расстройствам, а также к чрезмерному повреждению из-за окислительного стресса, вызванного образованием свободных радикалов. В этом обзоре подробно описаны некоторые тяжелые металлы и механизмы их токсичности, а также их влияние на здоровье.
Ключевые слова: тяжелые металлы, токсичность металлов, окислительный стресс, свободные радикалы
Введение
Металлы — это вещества с высокой электропроводностью, пластичностью и блеском, которые добровольно теряют свои электроны с образованием катионов.Металлы естественным образом находятся в земной коре, и их состав варьируется в зависимости от местности, что приводит к пространственным вариациям концентрации в окружающей среде. Распределение металлов в атмосфере контролируется свойствами данного металла и различными факторами окружающей среды (Khlifi & Hamza-Chaffai, 2010). Основная цель этого обзора — дать представление об источниках тяжелых металлов и их вредном воздействии на окружающую среду и живые организмы. К тяжелым металлам обычно относят те металлы, которые обладают удельной плотностью более 5 г / см 3 и отрицательно влияют на окружающую среду и живые организмы (Järup, 2003).Эти металлы являются квинтэссенцией для поддержания различных биохимических и физиологических функций живых организмов в очень низких концентрациях, однако они становятся ядовитыми, когда превышают определенные пороговые концентрации. Хотя признано, что тяжелые металлы имеют множество неблагоприятных последствий для здоровья и сохраняются в течение длительного периода времени, воздействие тяжелых металлов продолжается и увеличивается во многих частях мира. Тяжелые металлы являются значительными загрязнителями окружающей среды, и их токсичность становится проблемой, которая приобретает все большее значение с точки зрения экологии, эволюции, питания и окружающей среды (Jaishankar et al., 2013; Nagajyoti et al. , 2010). Наиболее часто встречающиеся в сточных водах тяжелые металлы включают мышьяк, кадмий, хром, медь, свинец, никель и цинк, которые представляют опасность для здоровья человека и окружающей среды (Lambert et al. , 2000). Тяжелые металлы попадают в окружающую среду естественным путем и в результате деятельности человека. Различные источники тяжелых металлов включают эрозию почвы, естественное выветривание земной коры, горнодобывающую промышленность, промышленные сточные воды, городские стоки, сброс сточных вод, средства борьбы с насекомыми или болезнями, применяемые для сельскохозяйственных культур, и многие другие (Morais et al., 2012). показывает мировое производство и потребление отдельных токсичных металлов в течение 1850–1990 гг. (Nriagu, 1996).
Мировое производство и потребление отдельных токсичных металлов в 1850–1990 годах (по материалам Nriagu, 1996).
Хотя эти металлы выполняют важные биологические функции у растений и животных, иногда их химическая координация и окислительно-восстановительные свойства дают им дополнительное преимущество, так что они могут избежать механизмов контроля, таких как гомеостаз, транспорт, компартментализация и связывание с необходимыми компонентами клетки.Эти металлы связываются с участками белка, которые не созданы для них, вытесняя исходные металлы с их естественных участков связывания, вызывая сбои в работе клеток и, в конечном итоге, токсичность. Предыдущие исследования показали, что окислительное разрушение биологических макромолекул происходит в первую очередь из-за связывания тяжелых металлов с ДНК и ядерными белками (Flora et al. , 2008).
Тяжелые металлы и механизмы их токсичности
Мышьяк
Мышьяк — один из наиболее важных тяжелых металлов, вызывающих беспокойство как с экологической точки зрения, так и с точки зрения здоровья человека (Hughes et al., 1988). Он имеет полуметаллические свойства, сильно токсичен и канцероген и широко доступен в форме оксидов или сульфидов или в виде соли железа, натрия, кальция, меди, и т. Д. (Singh et al. , 2007) . Мышьяк — двадцатый элемент по распространенности на Земле, а его неорганические формы, такие как арсенит и соединения арсената, смертельны для окружающей среды и живых существ. Люди могут столкнуться с мышьяком естественным путем, из промышленных источников или из непреднамеренных источников.Питьевая вода может быть загрязнена из-за использования мышьякоподобных пестицидов, природных минеральных отложений или неправильной утилизации мышьяковых химикатов. Преднамеренное употребление мышьяка в случае суицидных попыток или случайного употребления в пищу детьми может также привести к случаям острого отравления (Mazumder, 2008; Saha et al. , 1999). Мышьяк — это протопластический яд, поскольку он поражает в первую очередь сульфгидрильную группу клеток, вызывая нарушение клеточного дыхания, клеточных ферментов и митоза (Gordon & Quastel, 1948).
Механизм токсичности мышьяка
При биотрансформации мышьяка вредные неорганические соединения мышьяка метилируются бактериями, водорослями, грибами и людьми с образованием монометиларсоновой кислоты (MMA) и диметиларсиновой кислоты (DMA). В этом процессе биотрансформации эти неорганические виды мышьяка (iAs) ферментативно превращаются в метилированные мышьяки, которые являются конечными метаболитами и биомаркером хронического воздействия мышьяка.
iAs (V) → iAs (III) → MMA (V) → MMA (III) → DMA (V)
Биометилирование — это процесс детоксикации, конечные продукты которого представляют собой метилированный неорганический мышьяк, такой как MMA (V) и DMA (V). ), которые выводятся с мочой, являются биоиндикатором хронического воздействия мышьяка.Однако ММА (III) не выводится и остается внутри клетки в качестве промежуточного продукта.
Монометиларсоновая кислота (ММА III), промежуточный продукт, является высокотоксичным по сравнению с другими мышьяками, потенциально ответственным за канцерогенез, индуцированный мышьяком (Singh et al. , 2007).
Свинец
Свинец — высокотоксичный металл, широкое использование которого вызвало обширное загрязнение окружающей среды и проблемы со здоровьем во многих частях мира. Свинец — это яркий серебристый металл, слегка голубоватый в сухой атмосфере.Он начинает тускнеть при контакте с воздухом, образуя сложную смесь соединений в зависимости от данных условий. показывает различные источники загрязнения окружающей среды свинцом (Sharma & Dubey, 2005). Источники воздействия свинца включают в основном промышленные процессы, продукты питания и курение, питьевую воду и бытовые источники. Источниками свинца были бензин и краска для дома, которая распространена на свинцовые пули, водопроводные трубы, оловянные кувшины, аккумуляторные батареи, игрушки и краны (Thürmer et al., 2002). В США из выхлопных газов автомобилей выделяется от 100 до 200 000 тонн свинца в год. Некоторые из них поглощаются растениями, прикрепляются к почве и стекают в водоемы, следовательно, воздействие свинца на человека в общей популяции происходит либо с пищей, либо с питьевой водой (Goyer, 1990). Свинец — чрезвычайно токсичный тяжелый металл, который нарушает различные физиологические процессы растений и, в отличие от других металлов, таких как цинк, медь и марганец, не выполняет никаких биологических функций. Растение с высокой концентрацией свинца ускоряет производство активных форм кислорода (АФК), вызывая повреждение липидной мембраны, что в конечном итоге приводит к повреждению хлорофилла и фотосинтетическим процессам и подавляет общий рост растения (Najeeb et al., 2014). Некоторые исследования показали, что свинец способен подавлять рост чайного растения за счет уменьшения биомассы и ухудшает качество чая, изменяя качество его компонентов (Yongsheng et al. , 2011). Было обнаружено, что даже при низких концентрациях обработка свинцом вызывает огромную нестабильность поглощения ионов растениями, что, в свою очередь, приводит к значительным метаболическим изменениям в фотосинтетической способности и, в конечном итоге, к сильному торможению роста растений (Mostafa et al. , 2012).
Различные источники загрязнения окружающей среды свинцом (адаптировано из Sharma & Dubey, 2005).
Механизмы токсичности свинца
Металлический свинец вызывает токсичность в живых клетках по ионному механизму и по механизму окислительного стресса. Многие исследователи показали, что окислительный стресс в живых клетках вызван дисбалансом между производством свободных радикалов и производством антиоксидантов для детоксикации реакционноспособных промежуточных продуктов или для восстановления полученных повреждений.показывает атаку тяжелых металлов на клетку и баланс между производством АФК и последующей защитой, обеспечиваемой антиоксидантами. Антиоксиданты, такие как , например Глутатион , присутствующий в клетке, защищает ее от свободных радикалов, таких как H 2 O 2. Однако под влиянием свинца уровень ROS увеличивается, а уровень антиоксидантов снижается. Поскольку глутатион существует как в восстановленном (GSH), так и в окисленном (GSSG) состоянии, восстановленная форма глутатиона дает свои восстанавливающие эквиваленты (H + + e —) из тиоловых групп цистеина в ROS, чтобы сделать их стабильными. .В присутствии фермента глутатионпероксидазы восстановленный глутатион легко связывается с другой молекулой глутатиона после передачи электрона и образует дисульфид глутатиона (GSSG). Восстановленная форма (GSH) глутатиона составляет 90% от общего содержания глутатиона, а окисленная форма (GSSG) составляет 10% при нормальных условиях. Однако в условиях окислительного стресса концентрация GSSG превышает концентрацию GSH. Еще одним биомаркером окислительного стресса является перекисное окисление липидов, поскольку свободный радикал собирает электроны с молекул липидов, находящихся внутри клеточной мембраны, что в конечном итоге вызывает перекисное окисление липидов (Wadhwa et al., 2012; Flora et al. , 2012). В очень высоких концентрациях АФК могут вызывать структурное повреждение клеток, белков, нуклеиновых кислот, мембран и липидов, что приводит к стрессовой ситуации на клеточном уровне (Mathew et al., 2011).
Атака тяжелых металлов на клетку и баланс между производством АФК и последующей защитой, представленной антиоксидантами.
Ионный механизм токсичности свинца происходит в основном из-за способности ионов металлического свинца заменять другие двухвалентные катионы, такие как Ca 2+ , Mg 2+ , Fe 2+ и одновалентные катионы, такие как Na +, что в конечном итоге нарушает биологический метаболизм клетки.Ионный механизм токсичности свинца вызывает значительные изменения в различных биологических процессах, таких как клеточная адгезия, внутри- и межклеточная передача сигналов, сворачивание белков, созревание, апоптоз, перенос ионов, регуляция ферментов и высвобождение нейротрансмиттеров. Свинец может замещать кальций даже в пикомолярной концентрации, влияя на протеинкиназу С, которая регулирует нервное возбуждение и память (Flora et al. , 2012).
Ртуть
Металлическая ртуть — это металл природного происхождения, который представляет собой блестящую серебристо-белую жидкость без запаха, которая при нагревании превращается в бесцветный газ без запаха.Ртуть очень токсична и обладает чрезвычайно высокой способностью к биоаккумуляции. Его присутствие отрицательно влияет на морскую среду, и поэтому многие исследования направлены на распространение ртути в водной среде. Основные источники загрязнения ртутью включают антропогенную деятельность, такую как сельское хозяйство, сброс городских сточных вод, горнодобывающая промышленность, сжигание и сброс промышленных сточных вод (Chen et al. , 2012).
Ртуть существует в основном в трех формах: металлические элементы, неорганические соли и органические соединения, каждая из которых обладает различной токсичностью и биодоступностью.Эти формы ртути широко присутствуют в водных ресурсах, таких как озера, реки и океаны, где они поглощаются микроорганизмами и превращаются в метилртуть внутри микроорганизмов, в конечном итоге подвергаясь биомагнификации, вызывая значительное нарушение жизни водных организмов. Потребление этого зараженного водного животного является основным путем воздействия метилртути на человека (Trasande et al ., 2005). Ртуть широко используется в термометрах, барометрах, пирометрах, ареометрах, ртутных дуговых лампах, люминесцентных лампах и в качестве катализатора.Он также используется в целлюлозно-бумажной промышленности как компонент батарей и в стоматологических препаратах, таких как амальгамы. показывает глобальное использование ртути для различных применений (ГЭФ и Ртуть: Проблема Автор Ибрагима Соу, Группа ГЭФ по климату и химическим веществам . Доступно по адресу: http://www.thegef.org/gef/greenline/april-2012/ gef-and-mercury-challenge).
Мировое использование ртути для различных целей (всего в 2005 году: 3 760 метрических тонн).
Механизм отравления ртутью
Ртуть хорошо известна как опасный металл, и ее токсичность является частой причиной острого отравления тяжелыми металлами. Согласно данным Американской ассоциации центров по борьбе с отравлениями, в 1997 году было зарегистрировано 3 596 случаев.Метилртуть — нейротоксическое соединение, которое отвечает за разрушение микротрубочек, повреждение митохондрий, перекисное окисление липидов и накопление нейротоксических молекул, таких как серотонин, аспартат и глутамат (Patrick, 2002). Общий объем выбросов ртути в окружающую среду оценивается в 2200 метрических тонн в год (Ferrara et al. , 2000). По оценкам Агентства по охране окружающей среды и Национальной академии наук, от 8 до 10% американских женщин имеют уровни ртути, которые могут вызвать неврологические расстройства у любого ребенка, которого они родили.Животные, подвергшиеся воздействию токсичной ртути, показали неблагоприятные неврологические и поведенческие изменения. У кроликов при воздействии паров ртути 28,8 мг / м 2 3 в течение 1–13 недель наблюдались нечеткие патологические изменения, выраженная клеточная дегенерация и некроз мозга (Ashe et al. , 1953).
Мозг остается органом-мишенью для ртути, но он может повредить любой орган и привести к нарушению работы нервов, почек и мышц. Это может вызвать нарушение мембранного потенциала и нарушить гомеостаз внутриклеточного кальция.Ртуть связывается со свободно доступными тиолами, поскольку константы стабильности высоки (Patrick, 2002). Пары ртути могут вызвать бронхит, астму и временные респираторные проблемы. Ртуть играет ключевую роль в повреждении третичной и четвертичной белковой структуры и изменяет клеточную функцию, присоединяясь к селеногидрильным и сульфгидрильным группам, которые вступают в реакцию с метилртутью и препятствуют клеточной структуре. Он также вмешивается в процесс транскрипции и трансляции, приводя к исчезновению рибосом и уничтожению эндоплазматического ретикулума и активности естественных клеток-киллеров.Также нарушается целостность клеток, вызывая образование свободных радикалов. Основа хелатирования тяжелых металлов заключается в том, что даже несмотря на то, что сульфгидрильная связь ртути стабильна и разделена на окружающие сульфгидрильные лиганды, она также вносит свободные сульфгидрильные группы, способствуя подвижности металлов внутри лигандов (Bernhoft, 2011).
Кадмий
Кадмий является седьмым по токсичности тяжелым металлом согласно рейтингу ATSDR. Это побочный продукт производства цинка, которому люди или животные могут подвергаться на работе или в окружающей среде.Как только этот металл будет поглощен людьми, он будет накапливаться в организме на протяжении всей жизни. Этот металл впервые был использован во время Первой мировой войны в качестве заменителя олова и в лакокрасочной промышленности в качестве пигмента. В сегодняшнем сценарии он также используется в аккумуляторных батареях, для производства специальных сплавов, а также присутствует в табачном дыме. Около трех четвертей кадмия используется в щелочных батареях в качестве компонента электрода, оставшаяся часть используется в покрытиях, пигментах и гальванических покрытиях, а также в качестве стабилизатора пластмасс.Люди могут подвергаться воздействию этого металла в основном при вдыхании и проглатывании, а также могут страдать от острых и хронических интоксикаций. Распространенный в окружающей среде кадмий будет оставаться в почвах и отложениях в течение нескольких десятилетий. Растения постепенно поглощают эти металлы, которые накапливаются в них и концентрируются по пищевой цепочке, достигая в конечном итоге человеческого тела. В США более 500000 рабочих ежегодно подвергаются воздействию токсичного кадмия, согласно данным Агентства по токсичным веществам и регистру заболеваний (Бернард, 2008; Mutlu et al., 2012). Исследования показали, что в Китае общая площадь, загрязненная кадмием, составляет более 11 000 га, а ежегодный объем промышленных отходов кадмия, сбрасываемых в окружающую среду, оценивается более чем в 680 тонн. В Японии и Китае воздействие кадмия в окружающей среде сравнительно выше, чем в любой другой стране (Han et al. , 2009). Кадмий преимущественно содержится во фруктах и овощах из-за его высокой скорости передачи от почвы к растениям (Satarug et al. , 2011).Кадмий является высокотоксичным заменимым тяжелым металлом, который широко известен своим неблагоприятным влиянием на ферментативные системы клеток, окислительный стресс и индукцию дефицита питательных веществ у растений (Irfan et al. , 2013).
Механизм токсичности кадмия
Механизм токсичности кадмия четко не изучен, но его влияние на клетки известно (Patrick, 2003). Концентрация кадмия увеличивается в 3000 раз, когда он связывается с богатым цистеином белком, таким как металлотионеин.В печени комплекс цистеин-металлотионеин вызывает гепатотоксичность, а затем циркулирует в почках и накапливается в почечной ткани, вызывая нефротоксичность. Кадмий обладает способностью связываться с цистеиновыми, глутаматными, гистидиновыми и аспартатными лигандами и может приводить к дефициту железа (Castagnetto et al. , 2002). Кадмий и цинк имеют одинаковые степени окисления, и, следовательно, кадмий может заменять цинк, присутствующий в металлотионеине, тем самым препятствуя его действию в качестве поглотителя свободных радикалов в клетке.
Хром
Хром — седьмой по распространенности элемент на Земле (Mohanty & Kumar Patra, 2013). Хром находится в нескольких степенях окисления в окружающей среде от Cr 2+ до Cr 6+ (Родригес и др. , 2009) . Наиболее часто встречающимися формами Cr являются трехвалентный Cr +3 и шестивалентный Cr +6 , , причем оба состояния токсичны для животных, людей и растений (Mohanty & Kumar Patra, 2013).Хром естественным образом образуется при сжигании нефти и угля, нефти из феррохроматного огнеупорного материала, окислителей пигментов, катализатора, хромистой стали, удобрений, бурения нефтяных скважин и кожевенных заводов по нанесению металлических покрытий. Антропогенно хром попадает в окружающую среду через сточные воды и удобрения (Ghani, 2011). Cr (III) в своей восстановленной форме неподвижен и нерастворим в воде, тогда как Cr (VI) в окисленном состоянии хорошо растворяется в воде и, следовательно, подвижен (Wolińska et al. , 2013).Для определения активности ионов металлов в окружающей среде очень важен вид металла, поскольку в случае хрома окислительная форма Cr (III) не является существенным загрязнителем грунтовых вод, но было обнаружено, что Cr (VI) может быть токсичным для человека (Gürkan et al. , 2012). Cr (III) находится в органическом веществе почвы и водной среды в форме оксидов, гидроксидов и сульфатов (Cervantes et al. , 2001). Хром широко используется в таких отраслях, как металлургия, гальваника, производство красок и пигментов, дубление, консервирование древесины, химическое производство и производство целлюлозы и бумаги.Эти отрасли промышленности играют важную роль в загрязнении хромом, оказывая неблагоприятное воздействие на биологические и экологические виды (Ghani, 2011). Широкий спектр промышленных и сельскохозяйственных методов увеличивает уровень токсичности в окружающей среде, вызывая опасения по поводу загрязнения, вызываемого хромом. Загрязнение окружающей среды хромом, особенно шестивалентным хромом, стало самой большой проблемой в последние годы (Zayed & Terry, 2003). Кожевенные заводы сбрасывают в водные потоки многочисленные загрязняющие окружающую среду тяжелые металлы и соединения (Nath et al., 2008 г.). Из-за избытка кислорода в окружающей среде Cr (III) окисляется до Cr (VI), который чрезвычайно токсичен и хорошо растворяется в воде (Cervantes et al. , 2001). В августе 1975 года в Токио содержание грунтовых вод, содержащих Cr (VI) грунтовых пород, превышало допустимый предел содержания хрома в 2000 раз (Zayed & Terry, 2003). В Индии уровень хрома в подземных водах составляет более 12 мг / л и 550–1500 частей на миллион / л. Механизм ультраструктурной организации, биохимических изменений и регуляции метаболизма не выяснен, так как процесс фитотоксичности в водной среде хромом подробно не рассматривался (Chandra & Kulshreshtha, 2004).Сброс промышленных отходов и загрязнение грунтовых вод резко увеличили концентрацию хрома в почве (Bielicka et al. , 2005). Во время производства хромата отложение остатков Cr и орошение сточных вод серьезно загрязняли сельскохозяйственные угодья Cr. С внедрением современного сельского хозяйства происходит непрерывный выброс Cr в окружающую среду посредством остатков Cr, Cr-пыли и орошения сточных вод Cr, что приводит к загрязнению почвы, влияющему на почвенно-овощную систему, а также к ухудшению урожайности овощей и их качества для людей. (Дуан и др., 2010). Избыток хрома сверх допустимого предела является разрушительным для растений, поскольку он серьезно влияет на биологические факторы растения и попадает в пищевую цепочку при потреблении этих растительных материалов. Общими чертами, обусловленными фитотоксичностью Cr, являются снижение роста корней, хлороз листьев, ингибирование прорастания семян и снижение биомассы. Отравление хромом сильно влияет на биологические процессы в различных растениях, таких как кукуруза, пшеница, ячмень, цветная капуста, цитрулл и овощи.Отравление хромом вызывает хлороз и некроз растений (Ghani, 2011). Ферменты, такие как каталаза, пероксидаза и цитохромоксидаза, в состав которых входит железо, подвержены токсичности хрома. Активность каталазы, стимулированная избыточным поступлением хрома, вызывающая токсичность, изучалась в отношении фотосинтеза, активности нитратредуктазы, содержания белка в водорослях и фотосинтетических пигментов (Nath et al. , 2008). Хром (III) требует простого процесса диффузии для проникновения в клетку и не зависит от какого-либо конкретного мембранного носителя.В отличие от Cr (III), Cr (IV) может легко проходить через клеточную мембрану (Chandra & Kulshreshtha, 2004).
Механизм токсичности хрома
Трехвалентный хром Cr (III) в окружающей среде обычно безвреден из-за его слабой проницаемости мембраны. С другой стороны, шестивалентный хром Cr (VI) более активен в проникновении через клеточную мембрану для изоэлектрических и изоструктурных анионов, таких как SO 4 2– и HPO 4 2– каналов и этих хроматов. поглощаются через фагоцитоз.Cr (VI) является сильным окислителем и может быть восстановлен с образованием эфемерных разновидностей пятивалентного и четырехвалентного хрома, которые отличаются от Cr (III). Стабилизация пентавелентной формы осуществляется глутатионом, и, следовательно, внутриклеточное восстановление Cr [VI] считается механизмом детоксикации, когда восстановление происходит вдали от целевой области. Однако, если внутриклеточное восстановление Cr [VI] происходит рядом с целевым сайтом, это может служить для активации Cr. Реакции между Cr (VI) и биологическими восстановителями, такими как тиолы и аскорбат, приводят к образованию активных форм кислорода, таких как супероксид-ион, перекись водорода и гидроксильный радикал, что в конечном итоге приводит к окислительному стрессу в клетке, вызывая повреждение ДНК и белков (Stohs И Багчи, 1995).Согласно литературным исследованиям, Cr (VI) оказался гораздо более опасным, чем Cr (III), поскольку Cr (VI) проникает в клетки легче, чем Cr (III), и в конечном итоге восстанавливается до Cr (III). Из-за своих мутагенных свойств Cr (VI) классифицируется Международным агентством по изучению рака как канцероген для человека группы 1 (Dayan & Paine, 2001; Zhang, 2011).
Алюминий
Алюминий — третий по распространенности элемент, обнаруженный в земной коре (Gupta et al., 2013). Алюминий естественным образом содержится в воздухе, воде и почве. Добыча и переработка алюминия повышает его уровень в окружающей среде (ATSDR, 2010). Недавние исследования токсикологии окружающей среды показали, что алюминий может представлять серьезную угрозу для людей, животных и растений, вызывая многие заболевания (Barabasz et al. , 2002). Многие факторы, включая pH воды и содержание органических веществ, сильно влияют на токсичность алюминия. С понижением pH его токсичность увеличивается (Jeffrey et al., 1997). Мобилизация токсичных ионов алюминия в результате изменений pH почвы и воды, вызванных кислотными дождями и увеличением подкисления окружающей атмосферы, оказывает неблагоприятное воздействие на окружающую среду. Это проявляется в высыхании лесов, отравлении растений, падении урожая или его неурожая, гибели водных животных, а также в различных дисбалансах в функциях систем человека и животных (Barabasz et al. , 2002). PH поверхностного слоя почвы ниже 5 (pH <5) может привести к кислотности почвы, которая является серьезной проблемой во всем мире и влияет на урожайность сельскохозяйственных культур.Из-за токсичности алюминия производство сельскохозяйственных культур было ограничено до 67% от общей площади кислых почв в мире. Алюминий - один из наиболее часто встречающихся элементов в земной коре. Из-за кислых почв (pH <5) кремний выщелачивается, оставляя алюминий в твердой форме, известной как оксигидроксиды алюминия, такие как гиббсит и бемит. Эти нестабильные формы фитотоксического выброса алюминия Al 3+ хорошо известны как Al (OH) 63+ в почве (Ermias Abate et al. , 2013).Взаимодействие Al 3+ с апопластными, плазматическими мембранами и симпластическими мишенями приводит к токсичности и нарушает физические и клеточные процессы в растениях. Обычными проявлениями являются задержка роста корней, модификация клеток в листьях, маленькие и темно-зеленые листья, пожелтение и гибель листьев, хлороз, пурпурность и некроз листьев (Gupta et al. , 2013). Алюминий в высоких концентрациях очень токсичен для водных животных, особенно для организмов, дышащих жабрами, таких как рыба, вызывая осморегуляторную недостаточность из-за разрушения плазмы и ионов гемолимфы.Активность жаберного фермента, необходимого для поглощения ионов, у рыб подавляется мономерной формой алюминия (Rosseland et al. , 1990). Живые организмы в воде, такие как водоросли и раки, также подвержены токсичности алюминия (Bezak-Mazur, 2001). Алюминий не играет биологической роли и является токсичным несущественным металлом для микроорганизмов (Olaniran et al. , 2013). Ферменты, такие как гексокиназа, фосфодиэстераза, щелочная фосфатаза и фосфоксидаза, ингибируются алюминием, поскольку он имеет большее сродство к ДНК и РНК.На метаболические пути в живом организме, включая метаболизм кальция, фосфора, фтора и железа, влияет алюминий. Было обнаружено, что алюминий очень вреден для нервных, костных и кроветворных клеток (Barabasz1 et al. , 2002).
Механизм токсичности алюминия
Алюминий влияет на большинство физических и клеточных процессов. Точный механизм всасывания алюминия желудочно-кишечным трактом полностью не изучен. Основываясь на обзорах литературы, трудно указать надлежащий период времени для токсичности алюминия, поскольку некоторые симптомы токсичности алюминия могут быть обнаружены через секунды, а другие — через минуты после воздействия алюминия (ВОЗ, 1997).Токсичность алюминия, вероятно, является результатом взаимодействия между алюминием и плазматической мембраной, апопластическими и симпластическими мишенями (Kochian et al. , 2005). У человека Mg 2+ и Fe 3+ заменены на Al 3+ , что вызывает множество нарушений, связанных с межклеточной коммуникацией, клеточным ростом и секреторными функциями. Изменения, вызываемые алюминием в нейронах, аналогичны дегенеративным поражениям, наблюдаемым у пациентов с болезнью Альцгеймера. Наибольшими осложнениями токсичности алюминия являются эффекты нейротоксичности, такие как атрофия нейронов в голубом пятне, черной субстанции и полосатом теле ( Filiz & Meral, 2007) .
Железо
Железо — второй по распространенности металл в земной коре (EPA, 1993). Железо занимает 26 -ю позицию элемента в периодической таблице. Железо — важнейший элемент для роста и выживания почти всех живых организмов (Valko et al. , 2005). Это один из жизненно важных компонентов таких организмов, как водоросли, и ферментов, таких как цитохромы и каталаза, а также белков, переносящих кислород, таких как гемоглобин и миоглобин (Vuori, 1995).Железо является привлекательным переходным металлом для различных биологических окислительно-восстановительных процессов из-за его взаимного превращения между ионами двухвалентного железа (Fe 2+ ) и трехвалентного железа (Fe 3+ ) (Phippen et al. , 2008). Источник железа в поверхностных водах является антропогенным и связан с горнодобывающей деятельностью. Производство серной кислоты и разгрузка железа (Fe 2+ ) происходит за счет окисления пирита железа (FeS 2 ), который обычен в угольных пластах (Valko et al., 2005). Следующие уравнения представляют собой упрощенную реакцию окисления двухвалентного и трехвалентного железа (Phippen et al. , 2008):
2FeS 2 + 7O 2 → 2FeSO 4 + H 2 SO 4 ( железо)
4FeSO 4 + O 2 + 10H 2 O → 4Fe (OH) 3 + 4H 2 SO 4 (трехвалентное)
Концентрация растворенного железа в глубинах океана обычно составляет 0,6 нМ или 33.5 × 10 −9 мг / л. В пресной воде концентрация очень низкая с уровнем обнаружения 5 мкг / л — ICP, тогда как в грунтовых водах концентрация растворенного железа очень высока — 20 мг / л (EPA, 1993). В таких странах, как Литва, многие люди подвергались воздействию повышенных уровней железа через питьевую воду, поскольку собранные подземные воды превышали допустимый предел, установленный Директивой Европейского Союза 98/83 / EC о качестве питьевой воды (Grazuleviciene et al. , 2009 г.).На численность таких видов, как перифитон, бентосные беспозвоночные и разнообразие рыб, в значительной степени влияют прямые и косвенные эффекты загрязнения железом (Vuori, 1995). Осадок железа вызовет значительный ущерб из-за засорения и затруднит дыхание рыб (EPA, 1993). Исследование токсичности железа для водных растений, в частности риса, показало, что рост видов водного тростника тормозился концентрацией общего железа 1 мг / л (Phippen et al., 2008 г.). Кислые почвы ограничивают производство риса и вместе с дефицитом цинка вызывают нарушение макроэлементов в рисе, выращенном на водно-болотных угодьях. На производство низинного риса сильно повлияла высокая концентрация восстановленного железа (Fe 2+ ) в затопленных почвах. Особенности токсичности железа для риса включают высокое поглощение Fe 2+ корнями, акропетальную транслокацию в листья, бронзовое покрытие листьев риса и потерю урожая (Becker & Asch, 2005).
Механизм токсичности железа
Широкий спектр вредных свободных радикалов образуется, когда абсорбированное железо не может связываться с белком, что, в свою очередь, серьезно влияет на концентрацию железа в клетках млекопитающих и биологических жидкостях.Это циркулирующее несвязанное железо вызывает разъедание желудочно-кишечного тракта и биологических жидкостей. Чрезвычайно высокий уровень железа поступает в организм, преодолевая ограничивающую скорость абсорбцию, и становится насыщенным. Эти свободные утюги проникают в клетки сердца, печени и мозга. Из-за нарушения окислительного фосфорилирования свободным железом двухвалентное железо превращается в трехвалентное железо, которое выделяет ионы водорода, тем самым повышая метаболическую кислотность. Свободное железо также может приводить к перекисному окислению липидов, что приводит к серьезным повреждениям митохондрий, микросом и других клеточных органелл (Albretsen, 2006).Токсичность железа для клеток приводит к опосредованному железом повреждению тканей, включая клеточные механизмы окисления и восстановления, и их токсичность по отношению к внутриклеточным органеллам, таким как митохондрии и лизосомы. Широкий спектр свободных радикалов, которые, как считается, вызывают потенциальное повреждение клеток, образуются из-за избыточного потребления железа. Свободные радикалы водорода, производимые железом, атакуют ДНК, что приводит к повреждению клеток, мутациям и злокачественным трансформациям, которые, в свою очередь, вызывают множество заболеваний (Grazuleviciene et al., 2009 г.).
Воздействие тяжелых металлов на человека
35 металлов вызывают у нас озабоченность из-за воздействия на рабочем месте или на работе, из которых 23 тяжелые: сурьма, мышьяк, висмут, кадмий, церий, хром, кобальт, медь. , галлий, золото, железо, свинец, марганец, ртуть, никель, платина, серебро, теллур, таллий, олово, уран, ванадий и цинк (Mosby et al. 1996). Эти тяжелые металлы обычно присутствуют в окружающей среде и рационе питания.В небольших количествах они необходимы для поддержания хорошего здоровья, но в больших количествах они могут стать токсичными или опасными. Токсичность тяжелых металлов может снизить уровень энергии и нарушить работу мозга, легких, почек, печени, состав крови и других важных органов. Длительное воздействие может привести к постепенному прогрессированию физических, мышечных и неврологических дегенеративных процессов, имитирующих такие заболевания, как рассеянный склероз, болезнь Паркинсона, болезнь Альцгеймера и мышечная дистрофия.Повторяющееся длительное воздействие некоторых металлов и их соединений может даже вызвать рак (Jarup, 2003). Уровень токсичности некоторых тяжелых металлов может быть чуть выше фоновых концентраций, которые естественным образом присутствуют в окружающей среде. Следовательно, тщательное знание тяжелых металлов очень важно для принятия надлежащих защитных мер против чрезмерного контакта с ними (Ferner, 2001).
Воздействие мышьяка
Загрязнение мышьяком произошло как в результате естественных геологических процессов, так и в результате деятельности человека.Антропогенные источники мышьяка включают деятельность человека, такую как добыча и переработка руд. Процесс плавки, как древний, так и недавний, может выделять мышьяк в воздух и почву (Matschullat, 2000). Такие типы источников могут влиять на качество поверхностных вод из-за выброса и стока грунтовых вод. Другой путь загрязнения грунтовых вод — геологические источники, такие как минералы мышьяка. Третий тип источников — это осадочные и метаосадочные породы (Smedley & Kinniburgh, 2002).Большинство красок, красителей, мыла, металлов, полупроводников и лекарств содержат мышьяк. Некоторые пестициды, удобрения и кормление животных также выделяют мышьяк в окружающую среду в больших количествах. Неорганические формы мышьяка, такие как арсенит и арсенат, более опасны для здоровья человека. Они обладают сильным канцерогенным действием и могут вызывать рак легких, печени, мочевого пузыря и кожи. Люди подвергаются воздействию мышьяка через воздух, пищу и воду. Питьевая вода, загрязненная мышьяком, является одной из основных причин токсичности мышьяка в более чем 30 странах мира (Chowdhury et al., 2000). Если уровень мышьяка в грунтовых водах в 10–100 раз превышает значение, указанное в руководстве ВОЗ для питьевой воды (10 мкг / л), это может представлять угрозу для здоровья человека (Hoque et al. , 2011). Вода может быть загрязнена из-за неправильной утилизации мышьяковых химикатов, мышьяковых пестицидов или природных минеральных отложений. Токсичность мышьяком может быть острой или хронической, а хроническая токсичность мышьяка называется арсеникозом. Большинство сообщений о хронической токсичности мышьяка у человека сосредоточены на кожных проявлениях из-за его специфичности в диагностике.Пигментация и кератоз — это специфические поражения кожи, которые указывают на хроническую токсичность мышьяка (Martin & Griswold, 2009). показывает мышьяковый кератоз, так называемые «капли дождя на пыльной дороге» (Костный мозг — неопухолевые, доброкачественные изменения, токсичность мышьяка, доступно по адресу: http://www.pathologyoutlines.com/topic/bonemarrarsenic.html) и показывает поражения кожи, вызванные мышьякозу (источник: Smith et al., 2000).
Поражения кожи, вызванные арсеникозом (адаптировано из Smith et al. , 2000).
Более низкие уровни воздействия мышьяка могут вызвать тошноту и рвоту, снижение выработки эритроцитов и лейкоцитов, нарушение сердечного ритма, ощущение покалывания в руках и ногах и повреждение кровеносных сосудов. Длительное воздействие может привести к образованию кожных поражений, внутреннему раку, неврологическим проблемам, легочным заболеваниям, заболеваниям периферических сосудов, гипертонии, сердечно-сосудистым заболеваниям и сахарному диабету (Smith et al., 2000). Хронический арсеникоз приводит к множеству необратимых изменений в жизненно важных органах, и уровень смертности выше.Несмотря на масштабы этой потенциально смертельной токсичности, эффективного лечения этого заболевания не существует (Mazumder, 2008).
Свинец
Деятельность человека, такая как добыча полезных ископаемых, производство и сжигание ископаемого топлива, привела к накоплению свинца и его соединений в окружающей среде, включая воздух, воду и почву. Свинец используется для производства батарей, косметики, металлических изделий, таких как боеприпасы, припой и трубы, и т. Д. (Martin & Griswold, 2009).Свинец очень токсичен, поэтому его использование в различных продуктах, таких как краски, бензин, и т. Д. , в настоящее время значительно сокращено. Основными источниками воздействия свинца являются краски на основе свинца, бензин, косметика, игрушки, бытовая пыль, загрязненная почва, промышленные выбросы (Gerhardsson et al. , 2002). Отравление свинцом считалось классическим заболеванием, и признаки, которые наблюдались у детей и взрослых, в основном относились к центральной нервной системе и желудочно-кишечному тракту (Markowitz, 2000).Отравление свинцом также может произойти через питьевую воду. Трубы, по которым течет вода, могут быть сделаны из свинца и его соединений, которые могут загрязнять воду (Brochin et al. , 2008). По данным Агентства по охране окружающей среды (EPA), свинец считается канцерогеном. Свинец оказывает сильное воздействие на разные части тела. Распределение свинца в организме изначально зависит от кровотока в различных тканях, и почти 95% свинца откладывается в форме нерастворимого фосфата в костях скелета (Papanikolaou 2005).Токсичность свинца, также называемая отравлением свинцом, может быть острой или хронической. Острое воздействие может вызвать потерю аппетита, головную боль, гипертонию, боль в животе, почечную дисфункцию, усталость, бессонницу, артрит, галлюцинации и головокружение. Острое воздействие в основном происходит на рабочем месте и в некоторых отраслях обрабатывающей промышленности, где используется свинец. Хроническое воздействие свинца может привести к умственной отсталости, врожденным дефектам, психозу, аутизму, аллергии, дислексии, потере веса, гиперактивности, параличу, мышечной слабости, повреждению мозга, повреждению почек и даже может стать причиной смерти (Martin & Griswold, 2009).показывает увеличение концентрации свинца в крови, влияющее на IQ человека (Taylor et al. , 2012). Хотя отравление свинцом можно предотвратить, оно по-прежнему остается опасным заболеванием, поражающим большинство органов. Плазматическая мембрана перемещается в интерстициальные пространства головного мозга, когда гематоэнцефалический барьер подвергается воздействию повышенных уровней концентрации свинца, что приводит к состоянию, называемому отеком (Teo et al. 1997). Он нарушает внутриклеточные системы вторичных мессенджеров и изменяет функционирование центральной нервной системы, защита которой очень важна.Источники ионов свинца в окружающей среде и в быту являются основной причиной заболевания, но с помощью надлежащих мер предосторожности можно снизить риск, связанный с токсичностью свинца (Brochin et al. , 2008). показывает эффекты повышенного уровня свинца в крови (Brochin et al. , 2008).
Повышение концентрации свинца в крови, влияющее на IQ человека (адаптировано из Taylor et al. , 2012).
Эффекты повышенного уровня свинца в крови (адаптировано из Brochin et al., 2008 г.).
Ртуть
Ртуть считается самым токсичным тяжелым металлом в окружающей среде. Отравление ртутью называют акродинией или розовой болезнью. Ртуть попадает в окружающую среду в результате деятельности различных отраслей, таких как фармацевтика, консерванты бумаги и целлюлозы, сельское хозяйство, производство хлора и каустической соды (Morais et al. , 2012). Ртуть обладает способностью соединяться с другими элементами и образовывать органическую и неорганическую ртуть.Воздействие повышенных уровней металлической, органической и неорганической ртути может повредить мозг, почки и развивающийся плод (Alina et al. , 2012). Ртуть присутствует в большинстве пищевых продуктов и напитков в диапазоне от <1 до 50 мкг / кг. В морских продуктах он часто встречается в более высоких концентрациях. Органическая ртуть может легко проникать через биомембраны, и, поскольку они липофильны по своей природе, ртуть присутствует в более высоких концентрациях в большинстве видов жирной рыбы и в печени нежирной рыбы (Reilly, 2007).Микроорганизмы превращают ртуть, присутствующую в почве и воде, в метилртуть, токсин, который может накапливаться с возрастом рыб и с увеличением трофических уровней. EPA объявило хлорид ртути и метилртуть высоко канцерогенными. Нервная система очень чувствительна ко всем видам ртути. Повышенное воздействие ртути может изменить функции мозга и привести к застенчивости, тремору, проблемам с памятью, раздражительности и изменениям зрения или слуха. Воздействие паров металлической ртути на более высоких уровнях в течение более коротких периодов времени может привести к повреждению легких, рвоте, диарее, тошноте, кожной сыпи, учащению пульса или артериального давления.Симптомы отравления органической ртутью включают депрессию, проблемы с памятью, тремор, усталость, головную боль, выпадение волос, и т. Д. Поскольку эти симптомы часто встречаются и при других состояниях, такие случаи может быть трудно диагностировать (Martin & Griswold, 2009). Из-за чрезмерного воздействия на здоровье, связанного с воздействием ртути, нынешний стандарт для питьевой воды был установлен на более низких уровнях 0,002 мг / л и 0,001 мг / л Законом об охране окружающей среды и Всемирной организацией здравоохранения (ВОЗ, 2004).
Таблица 1
Типы токсичности ртути.
| Элементарная ртуть | Метилртуть | Неорганическая ртуть | |
|---|---|---|---|
| Источники | Ископаемое топливо, стоматологические амальгамы, старая латексная краска, инсинераторы, термометры | Пестициды, рыба, птица | Биологическое окисление ртути, деметилирование метилртути кишечной микрофлорой |
| Поглощение | 75–85% абсорбированного пара | 95–100% абсорбированного в кишечном тракте | 7–15% поглощенной дозы абсорбируется и 2–3% дозы всасывается через кожу у животных |
| Распределение | Распространяется по всему телу, липофильно, проникает через гематоэнцефалический барьер и плацентарный барьер, накапливается в головном мозге и почках | Распространяется по всему телу, липофильно, легко проникает через гематоэнцефалический барьер, а также через плацентарный барьер, накапливается в почках и головном мозге | Не проникает через гематоэнцефалический или плацентарный барьер, присутствует у новорожденных в головном мозге, накапливается в почках |
| Экскреция | Пот, моча, кал и слюна | 90% выводится с желчью, калом, 10% с мочой | Пот, слюна, моча и кал |
| Причина токсичности | Окисление до неорганической ртути | Деметилирование до неорганической ртути, образование свободных радикалов, связывание с тиолами в ферментах и структурных белках | Связывание с тиолами в ферментах и структурных белках |
Кадмий
Кадмий — металл 20 -е годы гг.Это побочный продукт производства цинка. Почвы и горные породы, включая уголь и минеральные удобрения, содержат некоторое количество кадмия. Кадмий имеет множество применений, например, в аккумуляторах, пигментах, пластмассах и металлических покрытиях и широко используется в гальванике (Martin & Griswold, 2009). представляет относительный вклад различных источников в воздействие кадмия на человека (Regoli, 2005). Кадмий и его соединения классифицируются Международным агентством по изучению рака как канцерогены группы 1 для человека (Henson & Chedrese, 2004).Кадмий попадает в окружающую среду в результате естественной деятельности, такой как извержения вулканов, выветривание, речной транспорт и некоторые виды деятельности человека, такие как добыча полезных ископаемых, плавка, курение табака, сжигание городских отходов и производство удобрений. Хотя выбросы кадмия заметно сократились в большинстве промышленно развитых стран, он остается источником опасений для рабочих и людей, живущих в загрязненных районах. Кадмий может вызывать как острые, так и хронические отравления (Chakraborty et al., 2013). Кадмий очень токсичен для почек и накапливается в клетках проксимальных канальцев в более высоких концентрациях. Кадмий может вызвать минерализацию костей либо из-за повреждения костей, либо из-за почечной дисфункции. Исследования на людях и животных показали, что остеопороз (повреждение скелета) является критическим эффектом воздействия кадмия наряду с нарушениями метаболизма кальция, образованием почечных камней и гиперкальциурией. Вдыхание более высоких уровней кадмия может вызвать серьезное повреждение легких.Если кадмий попадает в организм в больших количествах, это может вызвать раздражение желудка и привести к рвоте и диарее. При очень длительном воздействии при более низких концентрациях он может откладываться в почках и в конечном итоге привести к заболеванию почек, хрупкости костей и повреждению легких (Bernard, 2008). Кадмий и его соединения хорошо растворимы в воде по сравнению с другими металлами. Их биодоступность очень высока, и, следовательно, они склонны к биоаккумуляции. Длительное воздействие кадмия может привести к морфопатологическим изменениям почек.Курильщики более подвержены отравлению кадмием, чем некурящие. Табак является основным источником поглощения кадмия курильщиками, поскольку растения табака, как и другие растения, могут накапливать кадмий из почвы. Некурящие подвергаются воздействию кадмия с пищей и некоторыми другими путями. Однако поглощение кадмия другими путями намного ниже (Mudgal et al. , 2010). показывает значения токсичности кадмия (Flora et al. , 2008). Кадмий взаимодействует с основными питательными веществами, благодаря чему он оказывает токсическое действие.Экспериментальный анализ на животных показал, что 50% кадмия всасывается в легких и меньше — в желудочно-кишечном тракте. Преждевременные роды и снижение массы тела при рождении — это проблемы, которые возникают, если воздействие кадмия во время беременности человека является высоким (Henson & Chedrese, 2004).
Относительный вклад различных источников в воздействие кадмия на человека (адаптировано из Regoli, 2005).
Значения токсичности кадмия (адаптировано из Flora et al. , 2008).
Хром
Хром присутствует в горных породах, почве, животных и растениях.Он может быть твердым, жидким и в виде газа. Соединения хрома очень стойкие в водных отложениях. Они могут находиться во многих различных состояниях, таких как двухвалентное, четырехвалентное, пятивалентное и шестивалентное состояние. Cr (VI) и Cr (III) являются наиболее стабильными формами, и только их связь с воздействием на человека представляет большой интерес (Житкович, 2005). Соединения хрома (VI), такие как хромат кальция, хроматы цинка, хромат стронция и хроматы свинца, являются высокотоксичными и канцерогенными по своей природе. С другой стороны, хром (III) является важной пищевой добавкой для животных и людей и играет важную роль в метаболизме глюкозы.Поглощение соединений шестивалентного хрома через дыхательные пути и пищеварительный тракт происходит быстрее, чем у соединений трехвалентного хрома. Профессиональные источники хрома включают защитные металлические покрытия, металлические сплавы, магнитные ленты, пигменты для красок, резину, цемент, бумагу, консерванты для древесины, дубление кожи и металлизацию (Martin & Griswold, 2009). Schroeder et al. (1970) сообщил, что сигареты содержат 390 г / кг Cr, но не было опубликовано значительных отчетов о количестве хрома, вдыхаемого при курении.Когда поврежденная кожа соприкасается с любым типом соединений хрома, образуется глубоко проникающее отверстие. Воздействие соединений хрома может привести к образованию язв, которые будут сохраняться в течение нескольких месяцев и очень медленно заживают. Язвы на носовой перегородке очень часто встречаются у рабочих хроматографии. Воздействие более высоких количеств соединений хрома на человека может привести к ингибированию глутатионредуктазы эритроцитов, что, в свою очередь, снижает способность восстанавливать метгемоглобин до гемоглобина (Koutras et al., 1965; Schlatter & Kissling, 1973). Результаты, полученные в различных экспериментах in vitro, и in vivo, , показали, что хроматные соединения могут вызывать повреждение ДНК многими различными способами и могут приводить к образованию аддуктов ДНК, хромосомным аберрациям, обменам сестринских хроматид, изменениям в репликации и транскрипции ДНК (О’Брайен и др. , 2001; Мацумото и др. , 2006).
Алюминий
Алюминий — третий по распространенности элемент земной коры.Он существует только в одной степени окисления ( 3+ ) в окружающей среде. Основные пути потребления алюминия людьми — это вдыхание, проглатывание и контакт с кожей, а источники воздействия — питьевая вода, продукты питания, напитки и содержащие алюминий лекарства. Алюминий естественным образом присутствует в продуктах питания. Алюминий и его соединения плохо всасываются в организме человека, хотя скорость, с которой они всасываются, четко не изучена. Симптомы, указывающие на присутствие повышенного количества алюминия в организме человека, включают тошноту, язвы во рту, язвы на коже, кожную сыпь, рвоту, диарею и боль при артрите.Однако сообщалось, что эти симптомы были легкими и непродолжительными (Clayton, 1989). Воздействие алюминия, вероятно, является фактором риска возникновения болезни Альцгеймера (БА) у людей, как было предположено ВОЗ в 1997 году. Контактный дерматит и раздражающий дерматит наблюдались у людей, которые подвергались воздействию алюминия на рабочем месте. Алюминий оказывает неблагоприятное воздействие на нервную систему и приводит к потере памяти, проблемам с равновесием и потере координации (Krewski et al. , 2009).Людям, страдающим заболеваниями почек, трудно вывести алюминий из организма, что приводит к накоплению алюминия в организме, что приводит к повреждению костей и головного мозга. Некоторые факторы, которые, вероятно, могут быть причиной развития токсичности алюминия, — это жизнь в пыльной среде, длительное внутривенное питание, снижение функции почек, гемодиализ, употребление алкоголя или проглатывание веществ с высоким содержанием алюминия, работа в среде с высоким содержанием алюминия. уровни алюминия.Пациенты, проходящие диализ почек, могут подвергаться воздействию алюминия, присутствующего в загрязненных диализатах и фосфатсвязывающих веществах. Более высокие уровни воздействия алюминия могут изменить развитие вторичного гиперпаратиреоза, приводя к другим заболеваниям, таким как индуцированная алюминием адинамическая болезнь костей и индуцированная алюминием остеомаляция, оба из которых характеризуются низким ремоделированием костей (Andia, 1996). Некоторые из других осложнений, связанных с токсичностью алюминия, — это проблемы с легкими, анемия, нарушение всасывания железа, проблемы с нервной системой, и т. Д.
Железо
Железо — самый распространенный переходный металл в земной коре. С биологической точки зрения это самое важное питательное вещество для большинства живых существ, так как оно является кофактором многих жизненно важных белков и ферментов. Реакции, опосредованные железом, поддерживают большинство аэробных организмов в процессе их дыхания. Если он не защищен должным образом, он может катализировать реакции с образованием радикалов, которые могут повредить биомолекулы, клетки, ткани и весь организм. Отравление железом всегда интересовало в основном педиатров.Дети очень восприимчивы к отравлению железом, поскольку они подвергаются максимальному воздействию железосодержащих продуктов (Albretsen, 2006). Железный токсикоз протекает в четыре стадии. Первая стадия, которая наступает после 6 часов передозировки железа, характеризуется желудочно-кишечными эффектами, такими как желудочно-кишечное кровотечение, рвота и диарея (Osweiler et al. , 1985). Вторая стадия прогрессирует в пределах от 6 до 24 часов после передозировки и считается латентным периодом, периодом очевидного медицинского выздоровления. Третья стадия наступает между 12 и 96 часами после появления определенных клинических симптомов.Эта стадия характеризуется шоком, гипотонией, летаргией, тахикардией, некрозом печени, метаболическим ацидозом и иногда смертью (Hillman, 2001). Четвертая стадия наступает через 2–6 недель после передозировки железа. На этой стадии формируются язвы желудочно-кишечного тракта и развиваются стриктуры. Избыточное потребление железа — серьезная проблема в развитых странах и странах, потребляющих мясо, и увеличивает риск рака. Рабочие, которые подвергаются высокому воздействию асбеста, который содержит почти 30% железа, подвержены высокому риску асбестоза, который является второй по значимости причиной рака легких (Nelson, 1992).Говорят, что рак, связанный с асбестом, связан со свободными радикалами. Свободное внутриклеточное железо также может способствовать повреждению ДНК. Железо может вызвать рак в основном в результате окисления молекул ДНК (Bhasin et al. , (2002). Соли железа, такие как сульфат железа, моногидрат сульфата железа и гептагидрат сульфата железа, обладают низкой острой токсичностью при пероральном воздействии). дермальный и ингаляционный пути, поэтому они были отнесены к категории токсичности 3. Кроме того, Управление по санитарному надзору за качеством пищевых продуктов и медикаментов считает соли железа безопасными, а их токсические эффекты очень незначительны.Образование свободных радикалов — результат отравления железом (Ryan & Aust, 1992). Во время нормальной и патологической обработки клеток образуются такие побочные продукты, как супероксид и перекись водорода, которые считаются свободными радикалами (Fine, 2000). Эти свободные радикалы фактически нейтрализуются ферментами, такими как супероксиддисмутаза, каталаза и глутатионпероксидаза, но молекула супероксида обладает способностью высвобождать железо из ферритина, и что свободное железо реагирует со все большим количеством супероксида и перекиси водорода, образуя высокотоксичные свободные радикалы, такие как гидроксильный радикал (McCord, 1998).Гидроксильные радикалы опасны, поскольку они могут инактивировать определенные ферменты, инициировать перекисное окисление липидов, деполимеризовать полисахариды и могут вызвать разрывы цепи ДНК. Иногда это может привести к гибели клеток (Hershko et al., 1998).
Токсичность, механизм и воздействие на здоровье некоторых тяжелых металлов
Abstract
Доказано, что токсичность тяжелых металлов представляет собой серьезную угрозу, и с ней связано несколько рисков для здоровья. Токсические эффекты этих металлов, даже если они не имеют какой-либо биологической роли, по-прежнему присутствуют в той или иной форме, вредной для человеческого организма и его нормального функционирования.Иногда они действуют как псевдоэлементы тела, а иногда даже могут вмешиваться в метаболические процессы. Некоторые металлы, такие как алюминий, можно удалить с помощью действий по удалению, в то время как некоторые металлы накапливаются в организме и в пищевой цепи, проявляя хронический характер. Были предприняты различные меры общественного здравоохранения для контроля, предотвращения и лечения токсичности металлов на различных уровнях, таких как воздействие на рабочем месте, несчастные случаи и факторы окружающей среды. Токсичность металлов зависит от поглощенной дозы, пути воздействия и продолжительности воздействия, т.е.е. острый или хронический. Это может привести к различным расстройствам, а также к чрезмерному повреждению из-за окислительного стресса, вызванного образованием свободных радикалов. В этом обзоре подробно описаны некоторые тяжелые металлы и механизмы их токсичности, а также их влияние на здоровье.
Ключевые слова: тяжелые металлы, токсичность металлов, окислительный стресс, свободные радикалы
Введение
Металлы — это вещества с высокой электропроводностью, пластичностью и блеском, которые добровольно теряют свои электроны с образованием катионов.Металлы естественным образом находятся в земной коре, и их состав варьируется в зависимости от местности, что приводит к пространственным вариациям концентрации в окружающей среде. Распределение металлов в атмосфере контролируется свойствами данного металла и различными факторами окружающей среды (Khlifi & Hamza-Chaffai, 2010). Основная цель этого обзора — дать представление об источниках тяжелых металлов и их вредном воздействии на окружающую среду и живые организмы. К тяжелым металлам обычно относят те металлы, которые обладают удельной плотностью более 5 г / см 3 и отрицательно влияют на окружающую среду и живые организмы (Järup, 2003).Эти металлы являются квинтэссенцией для поддержания различных биохимических и физиологических функций живых организмов в очень низких концентрациях, однако они становятся ядовитыми, когда превышают определенные пороговые концентрации. Хотя признано, что тяжелые металлы имеют множество неблагоприятных последствий для здоровья и сохраняются в течение длительного периода времени, воздействие тяжелых металлов продолжается и увеличивается во многих частях мира. Тяжелые металлы являются значительными загрязнителями окружающей среды, и их токсичность становится проблемой, которая приобретает все большее значение с точки зрения экологии, эволюции, питания и окружающей среды (Jaishankar et al., 2013; Nagajyoti et al. , 2010). Наиболее часто встречающиеся в сточных водах тяжелые металлы включают мышьяк, кадмий, хром, медь, свинец, никель и цинк, которые представляют опасность для здоровья человека и окружающей среды (Lambert et al. , 2000). Тяжелые металлы попадают в окружающую среду естественным путем и в результате деятельности человека. Различные источники тяжелых металлов включают эрозию почвы, естественное выветривание земной коры, горнодобывающую промышленность, промышленные сточные воды, городские стоки, сброс сточных вод, средства борьбы с насекомыми или болезнями, применяемые для сельскохозяйственных культур, и многие другие (Morais et al., 2012). показывает мировое производство и потребление отдельных токсичных металлов в течение 1850–1990 гг. (Nriagu, 1996).
Мировое производство и потребление отдельных токсичных металлов в 1850–1990 годах (по материалам Nriagu, 1996).
Хотя эти металлы выполняют важные биологические функции у растений и животных, иногда их химическая координация и окислительно-восстановительные свойства дают им дополнительное преимущество, так что они могут избежать механизмов контроля, таких как гомеостаз, транспорт, компартментализация и связывание с необходимыми компонентами клетки.Эти металлы связываются с участками белка, которые не созданы для них, вытесняя исходные металлы с их естественных участков связывания, вызывая сбои в работе клеток и, в конечном итоге, токсичность. Предыдущие исследования показали, что окислительное разрушение биологических макромолекул происходит в первую очередь из-за связывания тяжелых металлов с ДНК и ядерными белками (Flora et al. , 2008).
Тяжелые металлы и механизмы их токсичности
Мышьяк
Мышьяк — один из наиболее важных тяжелых металлов, вызывающих беспокойство как с экологической точки зрения, так и с точки зрения здоровья человека (Hughes et al., 1988). Он имеет полуметаллические свойства, сильно токсичен и канцероген и широко доступен в форме оксидов или сульфидов или в виде соли железа, натрия, кальция, меди, и т. Д. (Singh et al. , 2007) . Мышьяк — двадцатый элемент по распространенности на Земле, а его неорганические формы, такие как арсенит и соединения арсената, смертельны для окружающей среды и живых существ. Люди могут столкнуться с мышьяком естественным путем, из промышленных источников или из непреднамеренных источников.Питьевая вода может быть загрязнена из-за использования мышьякоподобных пестицидов, природных минеральных отложений или неправильной утилизации мышьяковых химикатов. Преднамеренное употребление мышьяка в случае суицидных попыток или случайного употребления в пищу детьми может также привести к случаям острого отравления (Mazumder, 2008; Saha et al. , 1999). Мышьяк — это протопластический яд, поскольку он поражает в первую очередь сульфгидрильную группу клеток, вызывая нарушение клеточного дыхания, клеточных ферментов и митоза (Gordon & Quastel, 1948).
Механизм токсичности мышьяка
При биотрансформации мышьяка вредные неорганические соединения мышьяка метилируются бактериями, водорослями, грибами и людьми с образованием монометиларсоновой кислоты (MMA) и диметиларсиновой кислоты (DMA). В этом процессе биотрансформации эти неорганические виды мышьяка (iAs) ферментативно превращаются в метилированные мышьяки, которые являются конечными метаболитами и биомаркером хронического воздействия мышьяка.
iAs (V) → iAs (III) → MMA (V) → MMA (III) → DMA (V)
Биометилирование — это процесс детоксикации, конечные продукты которого представляют собой метилированный неорганический мышьяк, такой как MMA (V) и DMA (V). ), которые выводятся с мочой, являются биоиндикатором хронического воздействия мышьяка.Однако ММА (III) не выводится и остается внутри клетки в качестве промежуточного продукта.
Монометиларсоновая кислота (ММА III), промежуточный продукт, является высокотоксичным по сравнению с другими мышьяками, потенциально ответственным за канцерогенез, индуцированный мышьяком (Singh et al. , 2007).
Свинец
Свинец — высокотоксичный металл, широкое использование которого вызвало обширное загрязнение окружающей среды и проблемы со здоровьем во многих частях мира. Свинец — это яркий серебристый металл, слегка голубоватый в сухой атмосфере.Он начинает тускнеть при контакте с воздухом, образуя сложную смесь соединений в зависимости от данных условий. показывает различные источники загрязнения окружающей среды свинцом (Sharma & Dubey, 2005). Источники воздействия свинца включают в основном промышленные процессы, продукты питания и курение, питьевую воду и бытовые источники. Источниками свинца были бензин и краска для дома, которая распространена на свинцовые пули, водопроводные трубы, оловянные кувшины, аккумуляторные батареи, игрушки и краны (Thürmer et al., 2002). В США из выхлопных газов автомобилей выделяется от 100 до 200 000 тонн свинца в год. Некоторые из них поглощаются растениями, прикрепляются к почве и стекают в водоемы, следовательно, воздействие свинца на человека в общей популяции происходит либо с пищей, либо с питьевой водой (Goyer, 1990). Свинец — чрезвычайно токсичный тяжелый металл, который нарушает различные физиологические процессы растений и, в отличие от других металлов, таких как цинк, медь и марганец, не выполняет никаких биологических функций. Растение с высокой концентрацией свинца ускоряет производство активных форм кислорода (АФК), вызывая повреждение липидной мембраны, что в конечном итоге приводит к повреждению хлорофилла и фотосинтетическим процессам и подавляет общий рост растения (Najeeb et al., 2014). Некоторые исследования показали, что свинец способен подавлять рост чайного растения за счет уменьшения биомассы и ухудшает качество чая, изменяя качество его компонентов (Yongsheng et al. , 2011). Было обнаружено, что даже при низких концентрациях обработка свинцом вызывает огромную нестабильность поглощения ионов растениями, что, в свою очередь, приводит к значительным метаболическим изменениям в фотосинтетической способности и, в конечном итоге, к сильному торможению роста растений (Mostafa et al. , 2012).
Различные источники загрязнения окружающей среды свинцом (адаптировано из Sharma & Dubey, 2005).
Механизмы токсичности свинца
Металлический свинец вызывает токсичность в живых клетках по ионному механизму и по механизму окислительного стресса. Многие исследователи показали, что окислительный стресс в живых клетках вызван дисбалансом между производством свободных радикалов и производством антиоксидантов для детоксикации реакционноспособных промежуточных продуктов или для восстановления полученных повреждений.показывает атаку тяжелых металлов на клетку и баланс между производством АФК и последующей защитой, обеспечиваемой антиоксидантами. Антиоксиданты, такие как , например Глутатион , присутствующий в клетке, защищает ее от свободных радикалов, таких как H 2 O 2. Однако под влиянием свинца уровень ROS увеличивается, а уровень антиоксидантов снижается. Поскольку глутатион существует как в восстановленном (GSH), так и в окисленном (GSSG) состоянии, восстановленная форма глутатиона дает свои восстанавливающие эквиваленты (H + + e —) из тиоловых групп цистеина в ROS, чтобы сделать их стабильными. .В присутствии фермента глутатионпероксидазы восстановленный глутатион легко связывается с другой молекулой глутатиона после передачи электрона и образует дисульфид глутатиона (GSSG). Восстановленная форма (GSH) глутатиона составляет 90% от общего содержания глутатиона, а окисленная форма (GSSG) составляет 10% при нормальных условиях. Однако в условиях окислительного стресса концентрация GSSG превышает концентрацию GSH. Еще одним биомаркером окислительного стресса является перекисное окисление липидов, поскольку свободный радикал собирает электроны с молекул липидов, находящихся внутри клеточной мембраны, что в конечном итоге вызывает перекисное окисление липидов (Wadhwa et al., 2012; Flora et al. , 2012). В очень высоких концентрациях АФК могут вызывать структурное повреждение клеток, белков, нуклеиновых кислот, мембран и липидов, что приводит к стрессовой ситуации на клеточном уровне (Mathew et al., 2011).
Атака тяжелых металлов на клетку и баланс между производством АФК и последующей защитой, представленной антиоксидантами.
Ионный механизм токсичности свинца происходит в основном из-за способности ионов металлического свинца заменять другие двухвалентные катионы, такие как Ca 2+ , Mg 2+ , Fe 2+ и одновалентные катионы, такие как Na +, что в конечном итоге нарушает биологический метаболизм клетки.Ионный механизм токсичности свинца вызывает значительные изменения в различных биологических процессах, таких как клеточная адгезия, внутри- и межклеточная передача сигналов, сворачивание белков, созревание, апоптоз, перенос ионов, регуляция ферментов и высвобождение нейротрансмиттеров. Свинец может замещать кальций даже в пикомолярной концентрации, влияя на протеинкиназу С, которая регулирует нервное возбуждение и память (Flora et al. , 2012).
Ртуть
Металлическая ртуть — это металл природного происхождения, который представляет собой блестящую серебристо-белую жидкость без запаха, которая при нагревании превращается в бесцветный газ без запаха.Ртуть очень токсична и обладает чрезвычайно высокой способностью к биоаккумуляции. Его присутствие отрицательно влияет на морскую среду, и поэтому многие исследования направлены на распространение ртути в водной среде. Основные источники загрязнения ртутью включают антропогенную деятельность, такую как сельское хозяйство, сброс городских сточных вод, горнодобывающая промышленность, сжигание и сброс промышленных сточных вод (Chen et al. , 2012).
Ртуть существует в основном в трех формах: металлические элементы, неорганические соли и органические соединения, каждая из которых обладает различной токсичностью и биодоступностью.Эти формы ртути широко присутствуют в водных ресурсах, таких как озера, реки и океаны, где они поглощаются микроорганизмами и превращаются в метилртуть внутри микроорганизмов, в конечном итоге подвергаясь биомагнификации, вызывая значительное нарушение жизни водных организмов. Потребление этого зараженного водного животного является основным путем воздействия метилртути на человека (Trasande et al ., 2005). Ртуть широко используется в термометрах, барометрах, пирометрах, ареометрах, ртутных дуговых лампах, люминесцентных лампах и в качестве катализатора.Он также используется в целлюлозно-бумажной промышленности как компонент батарей и в стоматологических препаратах, таких как амальгамы. показывает глобальное использование ртути для различных применений (ГЭФ и Ртуть: Проблема Автор Ибрагима Соу, Группа ГЭФ по климату и химическим веществам . Доступно по адресу: http://www.thegef.org/gef/greenline/april-2012/ gef-and-mercury-challenge).
Мировое использование ртути для различных целей (всего в 2005 году: 3 760 метрических тонн).
Механизм отравления ртутью
Ртуть хорошо известна как опасный металл, и ее токсичность является частой причиной острого отравления тяжелыми металлами. Согласно данным Американской ассоциации центров по борьбе с отравлениями, в 1997 году было зарегистрировано 3 596 случаев.Метилртуть — нейротоксическое соединение, которое отвечает за разрушение микротрубочек, повреждение митохондрий, перекисное окисление липидов и накопление нейротоксических молекул, таких как серотонин, аспартат и глутамат (Patrick, 2002). Общий объем выбросов ртути в окружающую среду оценивается в 2200 метрических тонн в год (Ferrara et al. , 2000). По оценкам Агентства по охране окружающей среды и Национальной академии наук, от 8 до 10% американских женщин имеют уровни ртути, которые могут вызвать неврологические расстройства у любого ребенка, которого они родили.Животные, подвергшиеся воздействию токсичной ртути, показали неблагоприятные неврологические и поведенческие изменения. У кроликов при воздействии паров ртути 28,8 мг / м 2 3 в течение 1–13 недель наблюдались нечеткие патологические изменения, выраженная клеточная дегенерация и некроз мозга (Ashe et al. , 1953).
Мозг остается органом-мишенью для ртути, но он может повредить любой орган и привести к нарушению работы нервов, почек и мышц. Это может вызвать нарушение мембранного потенциала и нарушить гомеостаз внутриклеточного кальция.Ртуть связывается со свободно доступными тиолами, поскольку константы стабильности высоки (Patrick, 2002). Пары ртути могут вызвать бронхит, астму и временные респираторные проблемы. Ртуть играет ключевую роль в повреждении третичной и четвертичной белковой структуры и изменяет клеточную функцию, присоединяясь к селеногидрильным и сульфгидрильным группам, которые вступают в реакцию с метилртутью и препятствуют клеточной структуре. Он также вмешивается в процесс транскрипции и трансляции, приводя к исчезновению рибосом и уничтожению эндоплазматического ретикулума и активности естественных клеток-киллеров.Также нарушается целостность клеток, вызывая образование свободных радикалов. Основа хелатирования тяжелых металлов заключается в том, что даже несмотря на то, что сульфгидрильная связь ртути стабильна и разделена на окружающие сульфгидрильные лиганды, она также вносит свободные сульфгидрильные группы, способствуя подвижности металлов внутри лигандов (Bernhoft, 2011).
Кадмий
Кадмий является седьмым по токсичности тяжелым металлом согласно рейтингу ATSDR. Это побочный продукт производства цинка, которому люди или животные могут подвергаться на работе или в окружающей среде.Как только этот металл будет поглощен людьми, он будет накапливаться в организме на протяжении всей жизни. Этот металл впервые был использован во время Первой мировой войны в качестве заменителя олова и в лакокрасочной промышленности в качестве пигмента. В сегодняшнем сценарии он также используется в аккумуляторных батареях, для производства специальных сплавов, а также присутствует в табачном дыме. Около трех четвертей кадмия используется в щелочных батареях в качестве компонента электрода, оставшаяся часть используется в покрытиях, пигментах и гальванических покрытиях, а также в качестве стабилизатора пластмасс.Люди могут подвергаться воздействию этого металла в основном при вдыхании и проглатывании, а также могут страдать от острых и хронических интоксикаций. Распространенный в окружающей среде кадмий будет оставаться в почвах и отложениях в течение нескольких десятилетий. Растения постепенно поглощают эти металлы, которые накапливаются в них и концентрируются по пищевой цепочке, достигая в конечном итоге человеческого тела. В США более 500000 рабочих ежегодно подвергаются воздействию токсичного кадмия, согласно данным Агентства по токсичным веществам и регистру заболеваний (Бернард, 2008; Mutlu et al., 2012). Исследования показали, что в Китае общая площадь, загрязненная кадмием, составляет более 11 000 га, а ежегодный объем промышленных отходов кадмия, сбрасываемых в окружающую среду, оценивается более чем в 680 тонн. В Японии и Китае воздействие кадмия в окружающей среде сравнительно выше, чем в любой другой стране (Han et al. , 2009). Кадмий преимущественно содержится во фруктах и овощах из-за его высокой скорости передачи от почвы к растениям (Satarug et al. , 2011).Кадмий является высокотоксичным заменимым тяжелым металлом, который широко известен своим неблагоприятным влиянием на ферментативные системы клеток, окислительный стресс и индукцию дефицита питательных веществ у растений (Irfan et al. , 2013).
Механизм токсичности кадмия
Механизм токсичности кадмия четко не изучен, но его влияние на клетки известно (Patrick, 2003). Концентрация кадмия увеличивается в 3000 раз, когда он связывается с богатым цистеином белком, таким как металлотионеин.В печени комплекс цистеин-металлотионеин вызывает гепатотоксичность, а затем циркулирует в почках и накапливается в почечной ткани, вызывая нефротоксичность. Кадмий обладает способностью связываться с цистеиновыми, глутаматными, гистидиновыми и аспартатными лигандами и может приводить к дефициту железа (Castagnetto et al. , 2002). Кадмий и цинк имеют одинаковые степени окисления, и, следовательно, кадмий может заменять цинк, присутствующий в металлотионеине, тем самым препятствуя его действию в качестве поглотителя свободных радикалов в клетке.
Хром
Хром — седьмой по распространенности элемент на Земле (Mohanty & Kumar Patra, 2013). Хром находится в нескольких степенях окисления в окружающей среде от Cr 2+ до Cr 6+ (Родригес и др. , 2009) . Наиболее часто встречающимися формами Cr являются трехвалентный Cr +3 и шестивалентный Cr +6 , , причем оба состояния токсичны для животных, людей и растений (Mohanty & Kumar Patra, 2013).Хром естественным образом образуется при сжигании нефти и угля, нефти из феррохроматного огнеупорного материала, окислителей пигментов, катализатора, хромистой стали, удобрений, бурения нефтяных скважин и кожевенных заводов по нанесению металлических покрытий. Антропогенно хром попадает в окружающую среду через сточные воды и удобрения (Ghani, 2011). Cr (III) в своей восстановленной форме неподвижен и нерастворим в воде, тогда как Cr (VI) в окисленном состоянии хорошо растворяется в воде и, следовательно, подвижен (Wolińska et al. , 2013).Для определения активности ионов металлов в окружающей среде очень важен вид металла, поскольку в случае хрома окислительная форма Cr (III) не является существенным загрязнителем грунтовых вод, но было обнаружено, что Cr (VI) может быть токсичным для человека (Gürkan et al. , 2012). Cr (III) находится в органическом веществе почвы и водной среды в форме оксидов, гидроксидов и сульфатов (Cervantes et al. , 2001). Хром широко используется в таких отраслях, как металлургия, гальваника, производство красок и пигментов, дубление, консервирование древесины, химическое производство и производство целлюлозы и бумаги.Эти отрасли промышленности играют важную роль в загрязнении хромом, оказывая неблагоприятное воздействие на биологические и экологические виды (Ghani, 2011). Широкий спектр промышленных и сельскохозяйственных методов увеличивает уровень токсичности в окружающей среде, вызывая опасения по поводу загрязнения, вызываемого хромом. Загрязнение окружающей среды хромом, особенно шестивалентным хромом, стало самой большой проблемой в последние годы (Zayed & Terry, 2003). Кожевенные заводы сбрасывают в водные потоки многочисленные загрязняющие окружающую среду тяжелые металлы и соединения (Nath et al., 2008 г.). Из-за избытка кислорода в окружающей среде Cr (III) окисляется до Cr (VI), который чрезвычайно токсичен и хорошо растворяется в воде (Cervantes et al. , 2001). В августе 1975 года в Токио содержание грунтовых вод, содержащих Cr (VI) грунтовых пород, превышало допустимый предел содержания хрома в 2000 раз (Zayed & Terry, 2003). В Индии уровень хрома в подземных водах составляет более 12 мг / л и 550–1500 частей на миллион / л. Механизм ультраструктурной организации, биохимических изменений и регуляции метаболизма не выяснен, так как процесс фитотоксичности в водной среде хромом подробно не рассматривался (Chandra & Kulshreshtha, 2004).Сброс промышленных отходов и загрязнение грунтовых вод резко увеличили концентрацию хрома в почве (Bielicka et al. , 2005). Во время производства хромата отложение остатков Cr и орошение сточных вод серьезно загрязняли сельскохозяйственные угодья Cr. С внедрением современного сельского хозяйства происходит непрерывный выброс Cr в окружающую среду посредством остатков Cr, Cr-пыли и орошения сточных вод Cr, что приводит к загрязнению почвы, влияющему на почвенно-овощную систему, а также к ухудшению урожайности овощей и их качества для людей. (Дуан и др., 2010). Избыток хрома сверх допустимого предела является разрушительным для растений, поскольку он серьезно влияет на биологические факторы растения и попадает в пищевую цепочку при потреблении этих растительных материалов. Общими чертами, обусловленными фитотоксичностью Cr, являются снижение роста корней, хлороз листьев, ингибирование прорастания семян и снижение биомассы. Отравление хромом сильно влияет на биологические процессы в различных растениях, таких как кукуруза, пшеница, ячмень, цветная капуста, цитрулл и овощи.Отравление хромом вызывает хлороз и некроз растений (Ghani, 2011). Ферменты, такие как каталаза, пероксидаза и цитохромоксидаза, в состав которых входит железо, подвержены токсичности хрома. Активность каталазы, стимулированная избыточным поступлением хрома, вызывающая токсичность, изучалась в отношении фотосинтеза, активности нитратредуктазы, содержания белка в водорослях и фотосинтетических пигментов (Nath et al. , 2008). Хром (III) требует простого процесса диффузии для проникновения в клетку и не зависит от какого-либо конкретного мембранного носителя.В отличие от Cr (III), Cr (IV) может легко проходить через клеточную мембрану (Chandra & Kulshreshtha, 2004).
Механизм токсичности хрома
Трехвалентный хром Cr (III) в окружающей среде обычно безвреден из-за его слабой проницаемости мембраны. С другой стороны, шестивалентный хром Cr (VI) более активен в проникновении через клеточную мембрану для изоэлектрических и изоструктурных анионов, таких как SO 4 2– и HPO 4 2– каналов и этих хроматов. поглощаются через фагоцитоз.Cr (VI) является сильным окислителем и может быть восстановлен с образованием эфемерных разновидностей пятивалентного и четырехвалентного хрома, которые отличаются от Cr (III). Стабилизация пентавелентной формы осуществляется глутатионом, и, следовательно, внутриклеточное восстановление Cr [VI] считается механизмом детоксикации, когда восстановление происходит вдали от целевой области. Однако, если внутриклеточное восстановление Cr [VI] происходит рядом с целевым сайтом, это может служить для активации Cr. Реакции между Cr (VI) и биологическими восстановителями, такими как тиолы и аскорбат, приводят к образованию активных форм кислорода, таких как супероксид-ион, перекись водорода и гидроксильный радикал, что в конечном итоге приводит к окислительному стрессу в клетке, вызывая повреждение ДНК и белков (Stohs И Багчи, 1995).Согласно литературным исследованиям, Cr (VI) оказался гораздо более опасным, чем Cr (III), поскольку Cr (VI) проникает в клетки легче, чем Cr (III), и в конечном итоге восстанавливается до Cr (III). Из-за своих мутагенных свойств Cr (VI) классифицируется Международным агентством по изучению рака как канцероген для человека группы 1 (Dayan & Paine, 2001; Zhang, 2011).
Алюминий
Алюминий — третий по распространенности элемент, обнаруженный в земной коре (Gupta et al., 2013). Алюминий естественным образом содержится в воздухе, воде и почве. Добыча и переработка алюминия повышает его уровень в окружающей среде (ATSDR, 2010). Недавние исследования токсикологии окружающей среды показали, что алюминий может представлять серьезную угрозу для людей, животных и растений, вызывая многие заболевания (Barabasz et al. , 2002). Многие факторы, включая pH воды и содержание органических веществ, сильно влияют на токсичность алюминия. С понижением pH его токсичность увеличивается (Jeffrey et al., 1997). Мобилизация токсичных ионов алюминия в результате изменений pH почвы и воды, вызванных кислотными дождями и увеличением подкисления окружающей атмосферы, оказывает неблагоприятное воздействие на окружающую среду. Это проявляется в высыхании лесов, отравлении растений, падении урожая или его неурожая, гибели водных животных, а также в различных дисбалансах в функциях систем человека и животных (Barabasz et al. , 2002). PH поверхностного слоя почвы ниже 5 (pH <5) может привести к кислотности почвы, которая является серьезной проблемой во всем мире и влияет на урожайность сельскохозяйственных культур.Из-за токсичности алюминия производство сельскохозяйственных культур было ограничено до 67% от общей площади кислых почв в мире. Алюминий - один из наиболее часто встречающихся элементов в земной коре. Из-за кислых почв (pH <5) кремний выщелачивается, оставляя алюминий в твердой форме, известной как оксигидроксиды алюминия, такие как гиббсит и бемит. Эти нестабильные формы фитотоксического выброса алюминия Al 3+ хорошо известны как Al (OH) 63+ в почве (Ermias Abate et al. , 2013).Взаимодействие Al 3+ с апопластными, плазматическими мембранами и симпластическими мишенями приводит к токсичности и нарушает физические и клеточные процессы в растениях. Обычными проявлениями являются задержка роста корней, модификация клеток в листьях, маленькие и темно-зеленые листья, пожелтение и гибель листьев, хлороз, пурпурность и некроз листьев (Gupta et al. , 2013). Алюминий в высоких концентрациях очень токсичен для водных животных, особенно для организмов, дышащих жабрами, таких как рыба, вызывая осморегуляторную недостаточность из-за разрушения плазмы и ионов гемолимфы.Активность жаберного фермента, необходимого для поглощения ионов, у рыб подавляется мономерной формой алюминия (Rosseland et al. , 1990). Живые организмы в воде, такие как водоросли и раки, также подвержены токсичности алюминия (Bezak-Mazur, 2001). Алюминий не играет биологической роли и является токсичным несущественным металлом для микроорганизмов (Olaniran et al. , 2013). Ферменты, такие как гексокиназа, фосфодиэстераза, щелочная фосфатаза и фосфоксидаза, ингибируются алюминием, поскольку он имеет большее сродство к ДНК и РНК.На метаболические пути в живом организме, включая метаболизм кальция, фосфора, фтора и железа, влияет алюминий. Было обнаружено, что алюминий очень вреден для нервных, костных и кроветворных клеток (Barabasz1 et al. , 2002).
Механизм токсичности алюминия
Алюминий влияет на большинство физических и клеточных процессов. Точный механизм всасывания алюминия желудочно-кишечным трактом полностью не изучен. Основываясь на обзорах литературы, трудно указать надлежащий период времени для токсичности алюминия, поскольку некоторые симптомы токсичности алюминия могут быть обнаружены через секунды, а другие — через минуты после воздействия алюминия (ВОЗ, 1997).Токсичность алюминия, вероятно, является результатом взаимодействия между алюминием и плазматической мембраной, апопластическими и симпластическими мишенями (Kochian et al. , 2005). У человека Mg 2+ и Fe 3+ заменены на Al 3+ , что вызывает множество нарушений, связанных с межклеточной коммуникацией, клеточным ростом и секреторными функциями. Изменения, вызываемые алюминием в нейронах, аналогичны дегенеративным поражениям, наблюдаемым у пациентов с болезнью Альцгеймера. Наибольшими осложнениями токсичности алюминия являются эффекты нейротоксичности, такие как атрофия нейронов в голубом пятне, черной субстанции и полосатом теле ( Filiz & Meral, 2007) .
Железо
Железо — второй по распространенности металл в земной коре (EPA, 1993). Железо занимает 26 -ю позицию элемента в периодической таблице. Железо — важнейший элемент для роста и выживания почти всех живых организмов (Valko et al. , 2005). Это один из жизненно важных компонентов таких организмов, как водоросли, и ферментов, таких как цитохромы и каталаза, а также белков, переносящих кислород, таких как гемоглобин и миоглобин (Vuori, 1995).Железо является привлекательным переходным металлом для различных биологических окислительно-восстановительных процессов из-за его взаимного превращения между ионами двухвалентного железа (Fe 2+ ) и трехвалентного железа (Fe 3+ ) (Phippen et al. , 2008). Источник железа в поверхностных водах является антропогенным и связан с горнодобывающей деятельностью. Производство серной кислоты и разгрузка железа (Fe 2+ ) происходит за счет окисления пирита железа (FeS 2 ), который обычен в угольных пластах (Valko et al., 2005). Следующие уравнения представляют собой упрощенную реакцию окисления двухвалентного и трехвалентного железа (Phippen et al. , 2008):
2FeS 2 + 7O 2 → 2FeSO 4 + H 2 SO 4 ( железо)
4FeSO 4 + O 2 + 10H 2 O → 4Fe (OH) 3 + 4H 2 SO 4 (трехвалентное)
Концентрация растворенного железа в глубинах океана обычно составляет 0,6 нМ или 33.5 × 10 −9 мг / л. В пресной воде концентрация очень низкая с уровнем обнаружения 5 мкг / л — ICP, тогда как в грунтовых водах концентрация растворенного железа очень высока — 20 мг / л (EPA, 1993). В таких странах, как Литва, многие люди подвергались воздействию повышенных уровней железа через питьевую воду, поскольку собранные подземные воды превышали допустимый предел, установленный Директивой Европейского Союза 98/83 / EC о качестве питьевой воды (Grazuleviciene et al. , 2009 г.).На численность таких видов, как перифитон, бентосные беспозвоночные и разнообразие рыб, в значительной степени влияют прямые и косвенные эффекты загрязнения железом (Vuori, 1995). Осадок железа вызовет значительный ущерб из-за засорения и затруднит дыхание рыб (EPA, 1993). Исследование токсичности железа для водных растений, в частности риса, показало, что рост видов водного тростника тормозился концентрацией общего железа 1 мг / л (Phippen et al., 2008 г.). Кислые почвы ограничивают производство риса и вместе с дефицитом цинка вызывают нарушение макроэлементов в рисе, выращенном на водно-болотных угодьях. На производство низинного риса сильно повлияла высокая концентрация восстановленного железа (Fe 2+ ) в затопленных почвах. Особенности токсичности железа для риса включают высокое поглощение Fe 2+ корнями, акропетальную транслокацию в листья, бронзовое покрытие листьев риса и потерю урожая (Becker & Asch, 2005).
Механизм токсичности железа
Широкий спектр вредных свободных радикалов образуется, когда абсорбированное железо не может связываться с белком, что, в свою очередь, серьезно влияет на концентрацию железа в клетках млекопитающих и биологических жидкостях.Это циркулирующее несвязанное железо вызывает разъедание желудочно-кишечного тракта и биологических жидкостей. Чрезвычайно высокий уровень железа поступает в организм, преодолевая ограничивающую скорость абсорбцию, и становится насыщенным. Эти свободные утюги проникают в клетки сердца, печени и мозга. Из-за нарушения окислительного фосфорилирования свободным железом двухвалентное железо превращается в трехвалентное железо, которое выделяет ионы водорода, тем самым повышая метаболическую кислотность. Свободное железо также может приводить к перекисному окислению липидов, что приводит к серьезным повреждениям митохондрий, микросом и других клеточных органелл (Albretsen, 2006).Токсичность железа для клеток приводит к опосредованному железом повреждению тканей, включая клеточные механизмы окисления и восстановления, и их токсичность по отношению к внутриклеточным органеллам, таким как митохондрии и лизосомы. Широкий спектр свободных радикалов, которые, как считается, вызывают потенциальное повреждение клеток, образуются из-за избыточного потребления железа. Свободные радикалы водорода, производимые железом, атакуют ДНК, что приводит к повреждению клеток, мутациям и злокачественным трансформациям, которые, в свою очередь, вызывают множество заболеваний (Grazuleviciene et al., 2009 г.).
Воздействие тяжелых металлов на человека
35 металлов вызывают у нас озабоченность из-за воздействия на рабочем месте или на работе, из которых 23 тяжелые: сурьма, мышьяк, висмут, кадмий, церий, хром, кобальт, медь. , галлий, золото, железо, свинец, марганец, ртуть, никель, платина, серебро, теллур, таллий, олово, уран, ванадий и цинк (Mosby et al. 1996). Эти тяжелые металлы обычно присутствуют в окружающей среде и рационе питания.В небольших количествах они необходимы для поддержания хорошего здоровья, но в больших количествах они могут стать токсичными или опасными. Токсичность тяжелых металлов может снизить уровень энергии и нарушить работу мозга, легких, почек, печени, состав крови и других важных органов. Длительное воздействие может привести к постепенному прогрессированию физических, мышечных и неврологических дегенеративных процессов, имитирующих такие заболевания, как рассеянный склероз, болезнь Паркинсона, болезнь Альцгеймера и мышечная дистрофия.Повторяющееся длительное воздействие некоторых металлов и их соединений может даже вызвать рак (Jarup, 2003). Уровень токсичности некоторых тяжелых металлов может быть чуть выше фоновых концентраций, которые естественным образом присутствуют в окружающей среде. Следовательно, тщательное знание тяжелых металлов очень важно для принятия надлежащих защитных мер против чрезмерного контакта с ними (Ferner, 2001).
Воздействие мышьяка
Загрязнение мышьяком произошло как в результате естественных геологических процессов, так и в результате деятельности человека.Антропогенные источники мышьяка включают деятельность человека, такую как добыча и переработка руд. Процесс плавки, как древний, так и недавний, может выделять мышьяк в воздух и почву (Matschullat, 2000). Такие типы источников могут влиять на качество поверхностных вод из-за выброса и стока грунтовых вод. Другой путь загрязнения грунтовых вод — геологические источники, такие как минералы мышьяка. Третий тип источников — это осадочные и метаосадочные породы (Smedley & Kinniburgh, 2002).Большинство красок, красителей, мыла, металлов, полупроводников и лекарств содержат мышьяк. Некоторые пестициды, удобрения и кормление животных также выделяют мышьяк в окружающую среду в больших количествах. Неорганические формы мышьяка, такие как арсенит и арсенат, более опасны для здоровья человека. Они обладают сильным канцерогенным действием и могут вызывать рак легких, печени, мочевого пузыря и кожи. Люди подвергаются воздействию мышьяка через воздух, пищу и воду. Питьевая вода, загрязненная мышьяком, является одной из основных причин токсичности мышьяка в более чем 30 странах мира (Chowdhury et al., 2000). Если уровень мышьяка в грунтовых водах в 10–100 раз превышает значение, указанное в руководстве ВОЗ для питьевой воды (10 мкг / л), это может представлять угрозу для здоровья человека (Hoque et al. , 2011). Вода может быть загрязнена из-за неправильной утилизации мышьяковых химикатов, мышьяковых пестицидов или природных минеральных отложений. Токсичность мышьяком может быть острой или хронической, а хроническая токсичность мышьяка называется арсеникозом. Большинство сообщений о хронической токсичности мышьяка у человека сосредоточены на кожных проявлениях из-за его специфичности в диагностике.Пигментация и кератоз — это специфические поражения кожи, которые указывают на хроническую токсичность мышьяка (Martin & Griswold, 2009). показывает мышьяковый кератоз, так называемые «капли дождя на пыльной дороге» (Костный мозг — неопухолевые, доброкачественные изменения, токсичность мышьяка, доступно по адресу: http://www.pathologyoutlines.com/topic/bonemarrarsenic.html) и показывает поражения кожи, вызванные мышьякозу (источник: Smith et al., 2000).
Поражения кожи, вызванные арсеникозом (адаптировано из Smith et al. , 2000).
Более низкие уровни воздействия мышьяка могут вызвать тошноту и рвоту, снижение выработки эритроцитов и лейкоцитов, нарушение сердечного ритма, ощущение покалывания в руках и ногах и повреждение кровеносных сосудов. Длительное воздействие может привести к образованию кожных поражений, внутреннему раку, неврологическим проблемам, легочным заболеваниям, заболеваниям периферических сосудов, гипертонии, сердечно-сосудистым заболеваниям и сахарному диабету (Smith et al., 2000). Хронический арсеникоз приводит к множеству необратимых изменений в жизненно важных органах, и уровень смертности выше.Несмотря на масштабы этой потенциально смертельной токсичности, эффективного лечения этого заболевания не существует (Mazumder, 2008).
Свинец
Деятельность человека, такая как добыча полезных ископаемых, производство и сжигание ископаемого топлива, привела к накоплению свинца и его соединений в окружающей среде, включая воздух, воду и почву. Свинец используется для производства батарей, косметики, металлических изделий, таких как боеприпасы, припой и трубы, и т. Д. (Martin & Griswold, 2009).Свинец очень токсичен, поэтому его использование в различных продуктах, таких как краски, бензин, и т. Д. , в настоящее время значительно сокращено. Основными источниками воздействия свинца являются краски на основе свинца, бензин, косметика, игрушки, бытовая пыль, загрязненная почва, промышленные выбросы (Gerhardsson et al. , 2002). Отравление свинцом считалось классическим заболеванием, и признаки, которые наблюдались у детей и взрослых, в основном относились к центральной нервной системе и желудочно-кишечному тракту (Markowitz, 2000).Отравление свинцом также может произойти через питьевую воду. Трубы, по которым течет вода, могут быть сделаны из свинца и его соединений, которые могут загрязнять воду (Brochin et al. , 2008). По данным Агентства по охране окружающей среды (EPA), свинец считается канцерогеном. Свинец оказывает сильное воздействие на разные части тела. Распределение свинца в организме изначально зависит от кровотока в различных тканях, и почти 95% свинца откладывается в форме нерастворимого фосфата в костях скелета (Papanikolaou 2005).Токсичность свинца, также называемая отравлением свинцом, может быть острой или хронической. Острое воздействие может вызвать потерю аппетита, головную боль, гипертонию, боль в животе, почечную дисфункцию, усталость, бессонницу, артрит, галлюцинации и головокружение. Острое воздействие в основном происходит на рабочем месте и в некоторых отраслях обрабатывающей промышленности, где используется свинец. Хроническое воздействие свинца может привести к умственной отсталости, врожденным дефектам, психозу, аутизму, аллергии, дислексии, потере веса, гиперактивности, параличу, мышечной слабости, повреждению мозга, повреждению почек и даже может стать причиной смерти (Martin & Griswold, 2009).показывает увеличение концентрации свинца в крови, влияющее на IQ человека (Taylor et al. , 2012). Хотя отравление свинцом можно предотвратить, оно по-прежнему остается опасным заболеванием, поражающим большинство органов. Плазматическая мембрана перемещается в интерстициальные пространства головного мозга, когда гематоэнцефалический барьер подвергается воздействию повышенных уровней концентрации свинца, что приводит к состоянию, называемому отеком (Teo et al. 1997). Он нарушает внутриклеточные системы вторичных мессенджеров и изменяет функционирование центральной нервной системы, защита которой очень важна.Источники ионов свинца в окружающей среде и в быту являются основной причиной заболевания, но с помощью надлежащих мер предосторожности можно снизить риск, связанный с токсичностью свинца (Brochin et al. , 2008). показывает эффекты повышенного уровня свинца в крови (Brochin et al. , 2008).
Повышение концентрации свинца в крови, влияющее на IQ человека (адаптировано из Taylor et al. , 2012).
Эффекты повышенного уровня свинца в крови (адаптировано из Brochin et al., 2008 г.).
Ртуть
Ртуть считается самым токсичным тяжелым металлом в окружающей среде. Отравление ртутью называют акродинией или розовой болезнью. Ртуть попадает в окружающую среду в результате деятельности различных отраслей, таких как фармацевтика, консерванты бумаги и целлюлозы, сельское хозяйство, производство хлора и каустической соды (Morais et al. , 2012). Ртуть обладает способностью соединяться с другими элементами и образовывать органическую и неорганическую ртуть.Воздействие повышенных уровней металлической, органической и неорганической ртути может повредить мозг, почки и развивающийся плод (Alina et al. , 2012). Ртуть присутствует в большинстве пищевых продуктов и напитков в диапазоне от <1 до 50 мкг / кг. В морских продуктах он часто встречается в более высоких концентрациях. Органическая ртуть может легко проникать через биомембраны, и, поскольку они липофильны по своей природе, ртуть присутствует в более высоких концентрациях в большинстве видов жирной рыбы и в печени нежирной рыбы (Reilly, 2007).Микроорганизмы превращают ртуть, присутствующую в почве и воде, в метилртуть, токсин, который может накапливаться с возрастом рыб и с увеличением трофических уровней. EPA объявило хлорид ртути и метилртуть высоко канцерогенными. Нервная система очень чувствительна ко всем видам ртути. Повышенное воздействие ртути может изменить функции мозга и привести к застенчивости, тремору, проблемам с памятью, раздражительности и изменениям зрения или слуха. Воздействие паров металлической ртути на более высоких уровнях в течение более коротких периодов времени может привести к повреждению легких, рвоте, диарее, тошноте, кожной сыпи, учащению пульса или артериального давления.Симптомы отравления органической ртутью включают депрессию, проблемы с памятью, тремор, усталость, головную боль, выпадение волос, и т. Д. Поскольку эти симптомы часто встречаются и при других состояниях, такие случаи может быть трудно диагностировать (Martin & Griswold, 2009). Из-за чрезмерного воздействия на здоровье, связанного с воздействием ртути, нынешний стандарт для питьевой воды был установлен на более низких уровнях 0,002 мг / л и 0,001 мг / л Законом об охране окружающей среды и Всемирной организацией здравоохранения (ВОЗ, 2004).
Таблица 1
Типы токсичности ртути.
| Элементарная ртуть | Метилртуть | Неорганическая ртуть | |
|---|---|---|---|
| Источники | Ископаемое топливо, стоматологические амальгамы, старая латексная краска, инсинераторы, термометры | Пестициды, рыба, птица | Биологическое окисление ртути, деметилирование метилртути кишечной микрофлорой |
| Поглощение | 75–85% абсорбированного пара | 95–100% абсорбированного в кишечном тракте | 7–15% поглощенной дозы абсорбируется и 2–3% дозы всасывается через кожу у животных |
| Распределение | Распространяется по всему телу, липофильно, проникает через гематоэнцефалический барьер и плацентарный барьер, накапливается в головном мозге и почках | Распространяется по всему телу, липофильно, легко проникает через гематоэнцефалический барьер, а также через плацентарный барьер, накапливается в почках и головном мозге | Не проникает через гематоэнцефалический или плацентарный барьер, присутствует у новорожденных в головном мозге, накапливается в почках |
| Экскреция | Пот, моча, кал и слюна | 90% выводится с желчью, калом, 10% с мочой | Пот, слюна, моча и кал |
| Причина токсичности | Окисление до неорганической ртути | Деметилирование до неорганической ртути, образование свободных радикалов, связывание с тиолами в ферментах и структурных белках | Связывание с тиолами в ферментах и структурных белках |
Кадмий
Кадмий — металл 20 -е годы гг.Это побочный продукт производства цинка. Почвы и горные породы, включая уголь и минеральные удобрения, содержат некоторое количество кадмия. Кадмий имеет множество применений, например, в аккумуляторах, пигментах, пластмассах и металлических покрытиях и широко используется в гальванике (Martin & Griswold, 2009). представляет относительный вклад различных источников в воздействие кадмия на человека (Regoli, 2005). Кадмий и его соединения классифицируются Международным агентством по изучению рака как канцерогены группы 1 для человека (Henson & Chedrese, 2004).Кадмий попадает в окружающую среду в результате естественной деятельности, такой как извержения вулканов, выветривание, речной транспорт и некоторые виды деятельности человека, такие как добыча полезных ископаемых, плавка, курение табака, сжигание городских отходов и производство удобрений. Хотя выбросы кадмия заметно сократились в большинстве промышленно развитых стран, он остается источником опасений для рабочих и людей, живущих в загрязненных районах. Кадмий может вызывать как острые, так и хронические отравления (Chakraborty et al., 2013). Кадмий очень токсичен для почек и накапливается в клетках проксимальных канальцев в более высоких концентрациях. Кадмий может вызвать минерализацию костей либо из-за повреждения костей, либо из-за почечной дисфункции. Исследования на людях и животных показали, что остеопороз (повреждение скелета) является критическим эффектом воздействия кадмия наряду с нарушениями метаболизма кальция, образованием почечных камней и гиперкальциурией. Вдыхание более высоких уровней кадмия может вызвать серьезное повреждение легких.Если кадмий попадает в организм в больших количествах, это может вызвать раздражение желудка и привести к рвоте и диарее. При очень длительном воздействии при более низких концентрациях он может откладываться в почках и в конечном итоге привести к заболеванию почек, хрупкости костей и повреждению легких (Bernard, 2008). Кадмий и его соединения хорошо растворимы в воде по сравнению с другими металлами. Их биодоступность очень высока, и, следовательно, они склонны к биоаккумуляции. Длительное воздействие кадмия может привести к морфопатологическим изменениям почек.Курильщики более подвержены отравлению кадмием, чем некурящие. Табак является основным источником поглощения кадмия курильщиками, поскольку растения табака, как и другие растения, могут накапливать кадмий из почвы. Некурящие подвергаются воздействию кадмия с пищей и некоторыми другими путями. Однако поглощение кадмия другими путями намного ниже (Mudgal et al. , 2010). показывает значения токсичности кадмия (Flora et al. , 2008). Кадмий взаимодействует с основными питательными веществами, благодаря чему он оказывает токсическое действие.Экспериментальный анализ на животных показал, что 50% кадмия всасывается в легких и меньше — в желудочно-кишечном тракте. Преждевременные роды и снижение массы тела при рождении — это проблемы, которые возникают, если воздействие кадмия во время беременности человека является высоким (Henson & Chedrese, 2004).
Относительный вклад различных источников в воздействие кадмия на человека (адаптировано из Regoli, 2005).
Значения токсичности кадмия (адаптировано из Flora et al. , 2008).
Хром
Хром присутствует в горных породах, почве, животных и растениях.Он может быть твердым, жидким и в виде газа. Соединения хрома очень стойкие в водных отложениях. Они могут находиться во многих различных состояниях, таких как двухвалентное, четырехвалентное, пятивалентное и шестивалентное состояние. Cr (VI) и Cr (III) являются наиболее стабильными формами, и только их связь с воздействием на человека представляет большой интерес (Житкович, 2005). Соединения хрома (VI), такие как хромат кальция, хроматы цинка, хромат стронция и хроматы свинца, являются высокотоксичными и канцерогенными по своей природе. С другой стороны, хром (III) является важной пищевой добавкой для животных и людей и играет важную роль в метаболизме глюкозы.Поглощение соединений шестивалентного хрома через дыхательные пути и пищеварительный тракт происходит быстрее, чем у соединений трехвалентного хрома. Профессиональные источники хрома включают защитные металлические покрытия, металлические сплавы, магнитные ленты, пигменты для красок, резину, цемент, бумагу, консерванты для древесины, дубление кожи и металлизацию (Martin & Griswold, 2009). Schroeder et al. (1970) сообщил, что сигареты содержат 390 г / кг Cr, но не было опубликовано значительных отчетов о количестве хрома, вдыхаемого при курении.Когда поврежденная кожа соприкасается с любым типом соединений хрома, образуется глубоко проникающее отверстие. Воздействие соединений хрома может привести к образованию язв, которые будут сохраняться в течение нескольких месяцев и очень медленно заживают. Язвы на носовой перегородке очень часто встречаются у рабочих хроматографии. Воздействие более высоких количеств соединений хрома на человека может привести к ингибированию глутатионредуктазы эритроцитов, что, в свою очередь, снижает способность восстанавливать метгемоглобин до гемоглобина (Koutras et al., 1965; Schlatter & Kissling, 1973). Результаты, полученные в различных экспериментах in vitro, и in vivo, , показали, что хроматные соединения могут вызывать повреждение ДНК многими различными способами и могут приводить к образованию аддуктов ДНК, хромосомным аберрациям, обменам сестринских хроматид, изменениям в репликации и транскрипции ДНК (О’Брайен и др. , 2001; Мацумото и др. , 2006).
Алюминий
Алюминий — третий по распространенности элемент земной коры.Он существует только в одной степени окисления ( 3+ ) в окружающей среде. Основные пути потребления алюминия людьми — это вдыхание, проглатывание и контакт с кожей, а источники воздействия — питьевая вода, продукты питания, напитки и содержащие алюминий лекарства. Алюминий естественным образом присутствует в продуктах питания. Алюминий и его соединения плохо всасываются в организме человека, хотя скорость, с которой они всасываются, четко не изучена. Симптомы, указывающие на присутствие повышенного количества алюминия в организме человека, включают тошноту, язвы во рту, язвы на коже, кожную сыпь, рвоту, диарею и боль при артрите.Однако сообщалось, что эти симптомы были легкими и непродолжительными (Clayton, 1989). Воздействие алюминия, вероятно, является фактором риска возникновения болезни Альцгеймера (БА) у людей, как было предположено ВОЗ в 1997 году. Контактный дерматит и раздражающий дерматит наблюдались у людей, которые подвергались воздействию алюминия на рабочем месте. Алюминий оказывает неблагоприятное воздействие на нервную систему и приводит к потере памяти, проблемам с равновесием и потере координации (Krewski et al. , 2009).Людям, страдающим заболеваниями почек, трудно вывести алюминий из организма, что приводит к накоплению алюминия в организме, что приводит к повреждению костей и головного мозга. Некоторые факторы, которые, вероятно, могут быть причиной развития токсичности алюминия, — это жизнь в пыльной среде, длительное внутривенное питание, снижение функции почек, гемодиализ, употребление алкоголя или проглатывание веществ с высоким содержанием алюминия, работа в среде с высоким содержанием алюминия. уровни алюминия.Пациенты, проходящие диализ почек, могут подвергаться воздействию алюминия, присутствующего в загрязненных диализатах и фосфатсвязывающих веществах. Более высокие уровни воздействия алюминия могут изменить развитие вторичного гиперпаратиреоза, приводя к другим заболеваниям, таким как индуцированная алюминием адинамическая болезнь костей и индуцированная алюминием остеомаляция, оба из которых характеризуются низким ремоделированием костей (Andia, 1996). Некоторые из других осложнений, связанных с токсичностью алюминия, — это проблемы с легкими, анемия, нарушение всасывания железа, проблемы с нервной системой, и т. Д.
Железо
Железо — самый распространенный переходный металл в земной коре. С биологической точки зрения это самое важное питательное вещество для большинства живых существ, так как оно является кофактором многих жизненно важных белков и ферментов. Реакции, опосредованные железом, поддерживают большинство аэробных организмов в процессе их дыхания. Если он не защищен должным образом, он может катализировать реакции с образованием радикалов, которые могут повредить биомолекулы, клетки, ткани и весь организм. Отравление железом всегда интересовало в основном педиатров.Дети очень восприимчивы к отравлению железом, поскольку они подвергаются максимальному воздействию железосодержащих продуктов (Albretsen, 2006). Железный токсикоз протекает в четыре стадии. Первая стадия, которая наступает после 6 часов передозировки железа, характеризуется желудочно-кишечными эффектами, такими как желудочно-кишечное кровотечение, рвота и диарея (Osweiler et al. , 1985). Вторая стадия прогрессирует в пределах от 6 до 24 часов после передозировки и считается латентным периодом, периодом очевидного медицинского выздоровления. Третья стадия наступает между 12 и 96 часами после появления определенных клинических симптомов.Эта стадия характеризуется шоком, гипотонией, летаргией, тахикардией, некрозом печени, метаболическим ацидозом и иногда смертью (Hillman, 2001). Четвертая стадия наступает через 2–6 недель после передозировки железа. На этой стадии формируются язвы желудочно-кишечного тракта и развиваются стриктуры. Избыточное потребление железа — серьезная проблема в развитых странах и странах, потребляющих мясо, и увеличивает риск рака. Рабочие, которые подвергаются высокому воздействию асбеста, который содержит почти 30% железа, подвержены высокому риску асбестоза, который является второй по значимости причиной рака легких (Nelson, 1992).Говорят, что рак, связанный с асбестом, связан со свободными радикалами. Свободное внутриклеточное железо также может способствовать повреждению ДНК. Железо может вызвать рак в основном в результате окисления молекул ДНК (Bhasin et al. , (2002). Соли железа, такие как сульфат железа, моногидрат сульфата железа и гептагидрат сульфата железа, обладают низкой острой токсичностью при пероральном воздействии). дермальный и ингаляционный пути, поэтому они были отнесены к категории токсичности 3. Кроме того, Управление по санитарному надзору за качеством пищевых продуктов и медикаментов считает соли железа безопасными, а их токсические эффекты очень незначительны.Образование свободных радикалов — результат отравления железом (Ryan & Aust, 1992). Во время нормальной и патологической обработки клеток образуются такие побочные продукты, как супероксид и перекись водорода, которые считаются свободными радикалами (Fine, 2000). Эти свободные радикалы фактически нейтрализуются ферментами, такими как супероксиддисмутаза, каталаза и глутатионпероксидаза, но молекула супероксида обладает способностью высвобождать железо из ферритина, и что свободное железо реагирует со все большим количеством супероксида и перекиси водорода, образуя высокотоксичные свободные радикалы, такие как гидроксильный радикал (McCord, 1998).Гидроксильные радикалы опасны, поскольку они могут инактивировать определенные ферменты, инициировать перекисное окисление липидов, деполимеризовать полисахариды и могут вызвать разрывы цепи ДНК. Иногда это может привести к гибели клеток (Hershko et al., 1998).
Отравление тяжелыми металлами и токсичность: симптомы, причины и лечение
Что такое отравление тяжелыми металлами?
Отравление тяжелыми металлами может произойти при воздействии большого количества определенных типов металлов. Это вызывает тошноту и влияет на работу вашего тела.
Тяжелые металлы, такие как мышьяк, свинец, ртуть и другие, находятся вокруг нас. Они находятся в земле, по которой мы ходим, в воде, которую мы пьем, и в продуктах, которые мы используем каждый день. Но высокий уровень большинства тяжелых металлов может вызвать проблемы со здоровьем.
Отравление может произойти, если вы съедите или выпьете что-нибудь, содержащее тяжелые металлы, или если вы вдохнете зараженную пыль или пары.
Истинное отравление тяжелыми металлами в Соединенных Штатах встречается редко. И эксперты говорят, что вы должны быть осторожны с недоказанными тестами на тяжелые металлы или методами «детоксикации», которые вы найдете в Интернете.Они могут тратить ваши деньги впустую, а некоторые могут быть опасными.
Есть много тяжелых металлов, в том числе:
- Мышьяк
- Кадмий
- Медь
- Железо
- Свинец
- Ртуть
- Цинк
Не все эти металлы вредны для вас. Нам нужно небольшое количество некоторых из них, таких как медь и железо, для поддержания здоровья нашего организма.
Причины отравления тяжелыми металлами и факторы риска
Вы можете получить отравление тяжелыми металлами, если вы:
- Работаете на заводе, который использует тяжелые металлы
- Вдыхайте пыль от старой свинцовой краски, когда ремонтируете свой дом
- Ешьте пойманную рыбу в районе с высоким уровнем ртути
- Используйте лечебные травы, содержащие тяжелые металлы.
- Используйте посуду с недостаточным покрытием, чтобы предотвратить загрязнение продуктов тяжелыми металлами.
- Пейте воду, загрязненную тяжелыми металлами.
Признаки отравления тяжелыми металлами
Признаки могут различаться в зависимости от металла и количества.
Острое отравление. Это происходит, если вы получили высокую дозу за один раз, например, в результате химической аварии на фабрике или после того, как ребенок проглотил игрушку, сделанную из свинца. Симптомы обычно проявляются быстро, и вы можете:
- Ощущение замешательства
- Онемение
- Чувство тошноты и рвота
- Отключение
У вас также может быть:
Острое отравление — неотложная ситуация.Немедленно позвоните своему врачу или в местный токсикологический центр. Национальная телефонная линия помощи по борьбе с отравлениями: 800-222-1222.
Хроническое отравление. Вы получаете это после длительного контакта с низкой дозой. Поскольку металл накапливается в вашем теле, вы можете заболеть. Симптомы появляются медленно и могут включать:
Питьевая вода со свинцом может привести к когнитивным проблемам и замедлению развития у детей. Младенцы, которые пьют смесь с водопроводной водой, подвергаются особенно высокому риску, если их питьевая вода загрязнена.
Свинец был запрещен к использованию в водопроводе в течение многих лет, но он все равно попадает в водопровод из старых линий. Некоторые фильтры для воды удаляют его из воды, но если вас беспокоит уровень свинца в питьевой воде, вы можете запросить анализ воды.
Диагностика отравления тяжелыми металлами
Различные тесты могут проверять различные типы тяжелых металлов. Некоторые могут проверить вашу кровь или пописать. Другим может потребоваться рентген. Эти тесты могут помочь вашему врачу решить, есть ли у вас отравление тяжелыми металлами, насколько оно серьезно и какие тяжелые металлы вовлечены.К ним относятся:
Ваш врач также спросит вас о вашей работе, хобби, диете и обо всем остальном, что могло привести вас к контакту с опасными веществами.
Тесты на тяжелые металлы не являются рутинными. Ваш врач проверит вас, только если у вас появятся симптомы и есть история воздействия или есть веская причина подозревать, что они связаны с тяжелыми металлами.
Лечение отравления тяжелыми металлами и уход на дому
Главный шаг — держаться подальше от всего, что вас вызвало, чтобы не усугубить проблему.Ваш врач может помочь вам выяснить, как защитить себя.
Иногда может потребоваться промывание желудка, чтобы удалить металлы.
Если у вас серьезное отравление, одним из вариантов лечения является хелатирование. Вы получаете наркотики, обычно через иглу для внутривенного вливания, которые попадают в вашу кровь и «прилипают» к тяжелым металлам в вашем теле. Затем они вымываются вашей мочой.
Хелатирование может быть важной частью лечения. Но терапия может быть опасной, и она не работает со всеми тяжелыми металлами.Поэтому врачи используют его только в том случае, если у вас высокий уровень металла и явные симптомы отравления.
Недоказанные тесты и методы лечения отравлений тяжелыми металлами
Эксперты говорят, что отравления тяжелыми металлами случаются редко. Но многие веб-сайты заявляют, что это обычное явление, и без доказательств винят в этом самые разные проблемы со здоровьем. Многие компании продают ненадежные тесты и дорогие или даже опасные лекарства.
Анализ волос или провокационные тесты на хелат (тесты на «спровоцированную мочу»): они неточные.Они не могут сказать вам, заболели ли вы или нуждаетесь в лечении.
Хелатирующие препараты, отпускаемые без рецепта: они не одобрены FDA, могут быть небезопасными, и нет никаких доказательств того, что они работают.
Если вы думаете, что у вас отравление тяжелыми металлами, не пытайтесь диагностировать или лечить его самостоятельно. Вместо этого обратитесь к врачу.
Профилактика отравления тяжелыми металлами
Если вас беспокоит отравление тяжелыми металлами, ваш врач может дать вам индивидуальный совет.
Общие советы:
- Если вы работаете с тяжелыми металлами, всегда носите маску или другое защитное снаряжение.
- Ознакомьтесь с местными рыбными советами, чтобы убедиться, что рыба, которую вы едите, безопасна.
- Если вы живете в доме, построенном до 1978 года, наймите специалиста, чтобы он проверил его на содержание свинца в краске и, в случае обнаружения, предпринял меры по снижению выбросов свинца.
- Проверьте этикетки на продуктах на наличие тяжелых металлов.
Влияние токсичных уровней металлов в человеческом теле: Джонатан У. Сингер, DO: Функциональная и альтернативная медицина
Люди — ничто иное, как творческие люди, о чем свидетельствует эволюция нашего мира от того, где каменные долота были передовой технологией, до сегодняшнего дня, когда у нас есть массивное оборудование, которое производит все, от мороженого до автомобилей.
Все это подпитывается тяжелыми металлами, обнаруженными в мире природы — мы просто сконцентрировали и объединили их для наших нужд. К сожалению, это привело к уровням токсичности, от которых страдают люди и планета, на которой мы живем.
В HealthFirst доктор Джонатан В. Сингер и наша команда специализируются на отравлениях тяжелыми металлами, которые могут иметь обширные последствия для вашего тела. Мы предлагаем хелатную терапию, чтобы помочь нашим пациентам восстановить свое здоровье.
Чтобы дать вам лучшее представление о влиянии токсичных металлов, мы собрали воедино все, что вам нужно знать о тяжелых металлах и организме человека, а также о том, что мы можем сделать с уровнями токсичных металлов.
Тяжелые металлы: слишком много хорошего
Человеческому организму требуются небольшие количества тяжелых металлов, таких как цинк, медь и железо. Мы получаем эти металлы в основном с пищей. К сожалению, мы создали мир, в котором эти металлы окружают нас дома, на работе и везде, где существует человеческая деятельность.
Со временем вы можете постепенно поглощать металлы из окружающей среды. Это может привести к опасно высоким уровням токсинов в вашей системе, которые могут нанести ущерб вашему:
- Легкие
- Мозг
- Костно-мышечная структура
- Основные органы, такие как почки или печень
- Кровь
- Метаболическая система
- Желудочно-кишечный тракт
Исследования воздействия тяжелых металлов на организм человека продолжаются, но исследования показывают, что отравление тяжелыми металлами может привести к ухудшению физических, мышечных и неврологических функций, а также к некоторым видам рака.
Основные виновники тяжелых металлов
Из множества металлов, встречающихся в нашем мире, 23 вызывают особую озабоченность. Некоторые из наиболее распространенных:
- Меркурий
- Мышьяк
- Свинец
- Кадмий
- Утюг
- Алюминий
- Никель
Эти металлы обычно встречаются в окружающей среде и могут абсорбироваться через кожу, вдыхаться или съедаться.
Распознавание отравления тяжелыми металлами
Воздействие отравления тяжелыми металлами на ваше тело очень разнообразно и зависит от металлов, которым вы подвергаетесь.Симптомы варьируются от хронической усталости до желудочно-кишечных заболеваний. Если у вас есть медицинская жалоба, на которую вы еще не нашли ответа, абсолютно необходимо более глубоко изучить тяжелые металлы, чтобы увидеть, играют ли они роль.
В нашей практике мы проводим обширные и исчерпывающие обследования наших пациентов, чтобы определить, виноваты ли тяжелые металлы в ухудшении их здоровья.
Если мы обнаруживаем доказательства токсического отравления тяжелым металлом, мы обращаемся к хелатной терапии, внутривенной терапии, которая выводит токсины из организма.В качестве дополнительного бонуса мы также добавляем антиоксиданты и важные витамины и питательные вещества к вашей внутривенной терапии, чтобы еще больше укрепить ваше здоровье.
Чтобы узнать, не повлияло ли на ваше здоровье отравление тяжелыми металлами, и получить хелатную терапию, позвоните в один из наших офисов в Гринвуд-Виллидж, Колорадо, или Шайенне, Вайоминг, или запишитесь на прием онлайн сегодня.
Влияние токсичности тяжелых металлов
Если у вас есть какие-либо из следующих симптомов, то токсичность тяжелых металлов может повлиять на ваше здоровье:
- Тремор
- Головные боли
- Бесплодие
- Психическая «затуманенность»
- Тревога и депрессия
- Ухудшение здоровья глаз
- Проблемы с памятью
- Нарушение функции почек
- Проблемы с пищеварением
- Покалывание в руках, ногах и / или вокруг рта
- Слабая иммунная функция (рецидивирующие инфекции, аутоиммунное заболевание)
В земной коре существует множество тяжелых металлов, и бесчисленные виды деятельности человека приводят к тому, что практически каждый подвергается воздействию этих элементов в воздухе, воде и источниках пищи.Тест на тяжелые металлы Thorne дает представление об уровнях тяжелых металлов и основных элементов в вашем организме.
Еще в 2007 году Всемирная организация здравоохранения заявила, что тяжелые металлы накапливаются в окружающей среде ». . . в той или иной степени связаны с широким спектром заболеваний, включая повреждение почек и костей, нарушения развития и нейроповеденческие расстройства, повышенное кровяное давление и, возможно, даже рак легких ».
Тяжелые металлы в окружающей среде, которые чаще всего связаны с неблагоприятными проблемами для здоровья, включают:
- Ртуть
- Свинец
- Кадмий
- Мышьяк
МЕРКУРИЙ
Ртуть серебристого, металлического цвета, очень податливый, жидкий элемент (вспомните персонажа Роберта Патрика Т-1000 из фильма «Терминатор 2»), который очень токсичен даже в очень малых количествах.Ртуть повсеместно присутствует в окружающей среде, отчасти из-за того, что 50 тонн ее ежегодно выбрасывается в атмосферу в Соединенных Штатах (да, это 100 000 фунтов в год) в результате сжигания угля на угольных электростанциях.
Пары ртути в воздухе можно вдохнуть, но они также падают на землю с осадками, загрязняя ручьи, реки, озера и, в конечном итоге, океаны. Бактерии в этих водоемах превращают так называемую «неорганическую» ртуть в «органическую» метилртуть.Возникающая в результате каскадная проблема заключается в том, что метилртуть гораздо легче абсорбируется организмом, чем неорганическая ртуть.
Итак, когда мы едим рыбу, моллюсков и другие виды из водоемов, содержащих метилртуть, мы можем стать токсичными.
Ртуть также содержится в зубных амальгамах — «серебряных пломбах», которые стоматологи уже более века используют для восстановления полостей. Зубные амальгамы обычно наполовину состоят из ртути, а остальная часть состоит из серебра и олова.Когда мы жуем или пьем горячие напитки, из начинки может выделяться небольшое количество паров ртути, которые мы затем вдыхаем и поглощаем.
Ртуть использовалась в вакцинах в качестве консерванта, например, в вакцинах против кори / эпидемического паротита / краснухи, хотя фармацевтические компании в значительной степени отказались от этой практики. Мозг и нервная система особенно чувствительны к долгосрочному воздействию ртути, а младенцы наиболее чувствительны к ее отрицательному воздействию на здоровье.
СВИНЦ
Свинец менее распространен в окружающей среде, чем ртуть, в основном потому, что свинец больше не используется в качестве присадки к бензину.Свинец также больше не используется в качестве добавки к краске. Но в домах, построенных до запрета 1978 года, все еще может содержаться краска на основе свинца.
Удаление свинцовой краски без использования надлежащих средств индивидуальной защиты может привести к отравлению свинцом (этот автор, хотя и стесняется это признать, сделал это много лет назад). Свинец до сих пор используется в производстве автомобильных аккумуляторов. Люди также могут контактировать со свинцом из старых свинцовых водопроводных труб или свинцовым припоем, используемым для сварки медных водопроводных труб.
Почва и вода в районах, где велась добыча полезных ископаемых, могут быть сильно загрязнены свинцом. Дети, растущие в этих регионах, наиболее уязвимы для вредного воздействия свинца, которое может привести к серьезным задержкам в развитии, повреждению нервной системы и даже смерти.
CADMIUM
Используемый в производстве батарей и других отраслях промышленности, воздействие кадмия может повредить почки, легкие и печень. Подобно ртути, свинцу и минералу цинку, кадмий встречается в земной коре и в естественных условиях встречается в рудах, содержащих свинец и цинк.
Табакокурение подвергает курильщика воздействию кадмия, потому что табак концентрирует кадмий в окружающей среде, например, из почвы. Рис также имеет тенденцию накапливать кадмий, особенно если рис выращивается в районах, где раньше выращивался табак, как, например, в некоторых районах на юго-востоке США.
ARSENIC
Мышьяк присутствует в окружающей среде из сельскохозяйственных стоков, сигаретного дыма и его прежнего использования в древесине, обработанной под давлением. Хроническое воздействие мышьяка может вызвать рак, когнитивную дисфункцию, диабет, а также повреждение сердца и легких.
Что нам делать с токсичностью тяжелых металлов?
Перед тем, как начать какое-либо лечение отравления тяжелыми металлами, обязательно сначала поговорите со своим лечащим врачом и сделайте некоторые анализы, чтобы определить, действительно ли у вас токсичность тяжелых металлов, И степень этой токсичности.
После внесения необходимых изменений в образ жизни для предотвращения дальнейшего заражения и прохождения лечения, о котором вы и ваш лечащий врач согласны, убедитесь, что вы сделали последующее тестирование через достаточный промежуток времени, рекомендованный вашим практикующим врачом, чтобы вы могли определить, насколько хорошо лечение работает.
Как лечится токсичность тяжелых металлов?
Некоторые практикующие врачи рекомендуют использовать фармацевтические методы, в том числе вещества, которые связываются с тяжелым металлом или хелатируют его и ускоряют его удаление из организма.



