Какова роль белков в организме биология 5 класс: Какова роль белков в организме?
§ 7. Состав и строение белков. Биология 9 класс Пасечник
1. Какова роль белков в организме?
Белки выполняют несколько основных ролей в нашем организме:
• являются материалом для построения всех клеток, тканей и органов;
• обеспечивают иммунитет организма и выступают в качества антител;
• участвуют в пищеварительном процессе и энергетическом обмене.
2. Какие продукты богаты белками?
Мясо, птица, рыба и морепродукты, молоко и молочные продукты, сыр, яйца, фрукты (яблоки, груши и ананасы, киви, манго, маракуйа, личи и др.).
Вопросы
1. Какие вещества называются белками или протеинами?
Белки — это природные органические вещества, состоящие из аминокислот и играющие фундаментальную роль в жизнедеятельности организма.
2. Что такое первичная структура белка?
Последовательность аминокислот в составе полипептидной цепи представляет первичную структуру белка.
3. Как образуются вторичная, третичная и четвертичная структуры белка?
В результате образования водородных связей между СО и NН-группами разных аминокислотных остатков полипептидной цепи образуется спираль. Водородные связи слабые, но в комплексе они обеспечивают довольно прочную структуру. Эта спираль — вторичная структура белка.
Третичная структура — трёхмерная пространственная «упаковка» полипептидной цепи. В результате возникает причудливая, но для каждого белка специфическая конфигурация — глобула. Прочность третичной структуры обеспечивается разнообразными связями, возникающими между радикалами аминокислот.
Четвертичная структура возникает в результате соединения нескольких макромолекул (глобул) с третичной структурой в сложный комплекс. Например, гемоглобин крови человека представляет комплекс из четырёх макромолекул белка.
4. Что такое денатурация белка?
Что такое денатурация белка?
Нарушение природной структуры белка называют денатурацией. Она может происходить под воздействием температуры, химических веществ, лучистой энергии и других факторов.
5. По какому признаку белки делятся на простые и сложные?
Простые белки состоят только из аминокислот. Сложные белки в своем составе имеют еще и углеводы (гликопротеины), жиры (липопротеины), нуклеиновые кислоты (нуклеопротеины) и др.
Задания
Вы знаете, что белок куриного яйца состоит в основном из протеинов. Подумайте, чем объясняется изменение структуры белка у варёного яйца. Приведите другие известные вам примеры, когда структура белка может измениться.
В результате воздействия высоких температур на яйцо происходит денатурация белка. В результате этого белок теряет свои свойства (прозрачность и др.).Любая термообработкка пищи (варка, жаренье, запекание) ведёт к денатурации белков. В результате белки становятся более доступны действию пищеварительных ферментов, сами же теряют функциональную активность.
В результате белки становятся более доступны действию пищеварительных ферментов, сами же теряют функциональную активность.
Конспект урока по биологии на тему «Строение и функции белков» (10 класс)
Игнатьева Н. А.
Учитель биологии
МОУ «Средняя школа № 37» г. Саранск
Тема урока: «Строение и функции белков»
Слайд2
Цель: продолжить расширение и углубление знаний об органических веществах клетки на основе изучения строения и функций белков;
Задачи:
Познакомиться с ведущей ролью белков в строении и жизнедеятельности клетки.
Изучить строение макромолекул белка, имеющих характер информационных биополимеров.
Изучить свойства и функции белков.
Углубить знания о связи строения молекул веществ и их функции на примере белков
Ход урока
I.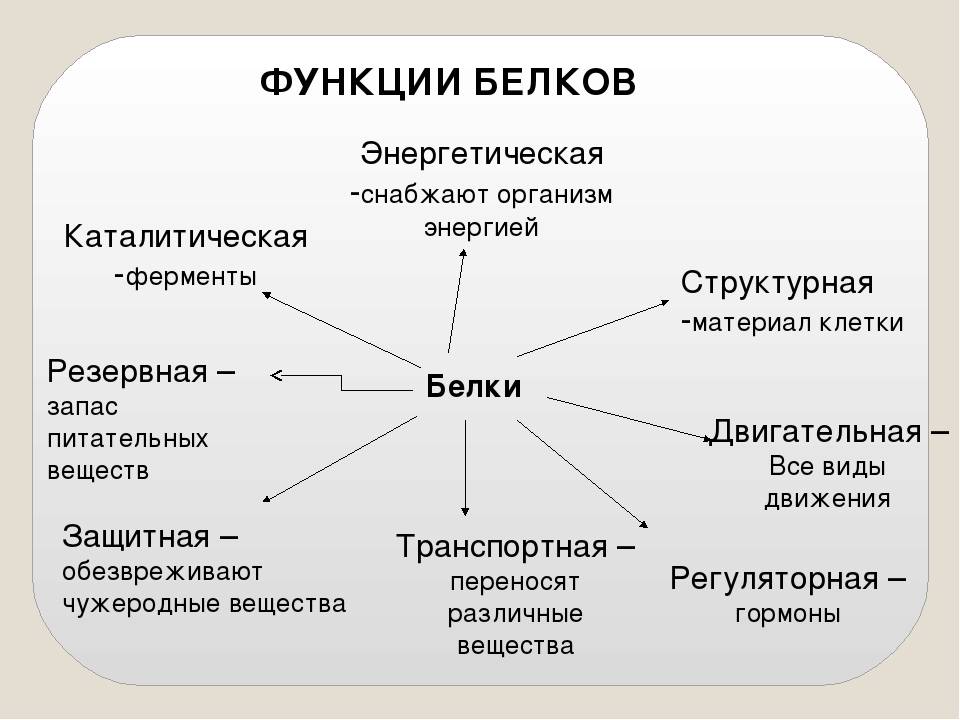 Организационный момент.
Организационный момент.
II. Изучение нового материала.
Слайд3
Жизнь – есть способ существования белковых, существенным моментом которого является постоянный обмен веществ с окружающей их внешней природой, причем с прекращением этого обмена веществ прекращается и жизнь, что приводит к разложению белка….
Ф.Энгельс
Изучая химический состав клетки, вы знаете, что все вещества входящие в ее состав делятся на две групп. Назовите эти группы. Сегодня на уроке мы продолжим изучать органические вещества – белки. Знания о белках имеют особенно важное значение для понимания всех процессов, происходящих в клетке. Белки лежат в основе всего живого. Поэтому эпиграфом нашего урока будет высказывание Энгельса:
Вопрос.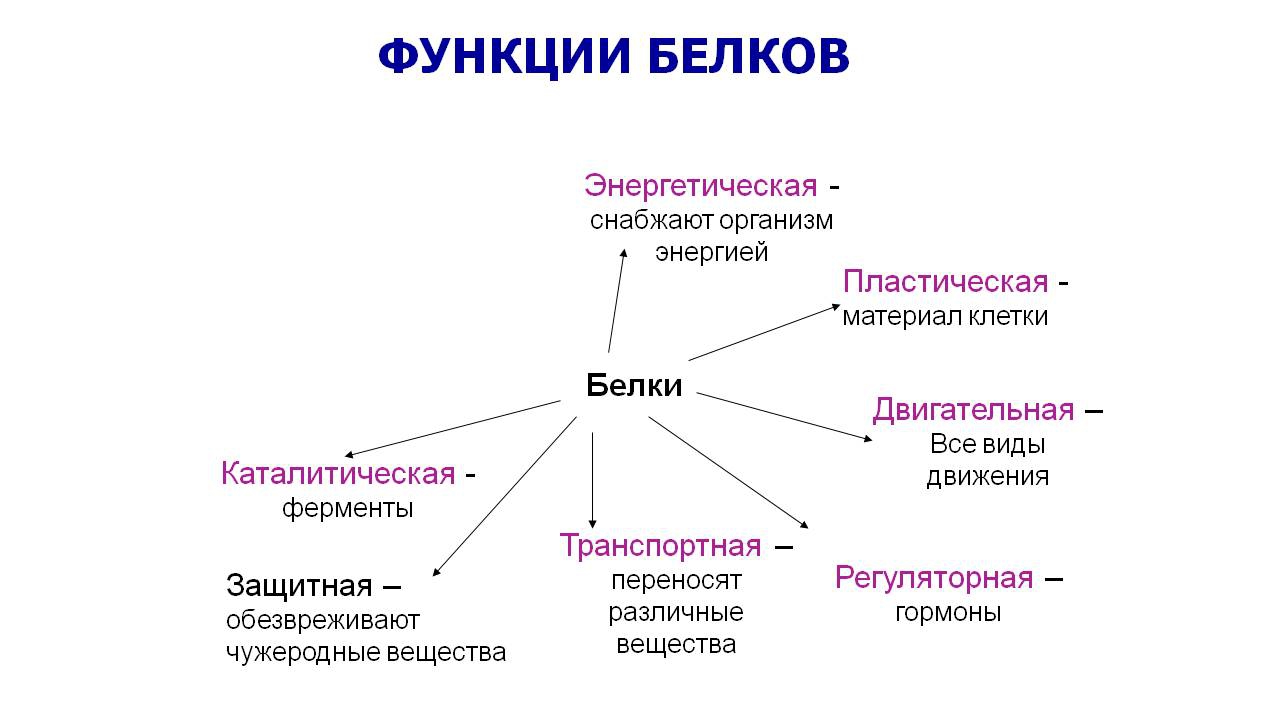 Какова роль белков в строении и жизнедеятельности клетки?
Какова роль белков в строении и жизнедеятельности клетки?
(В беседе учащиеся вспоминают известный из курса 8 – 9 классов материал о белках).
Среди органических компонентов клетки самыми важными являются белки. Они очень разнообразны и по строению, и по функциям. После удаления воды из клетки в сухом остатке на первом месте по содержанию стоят белки. Они составляют 10 – 20 % от сырой массы и от 50 до 80% от сухой массы клетки. Белки называют также протеинами (греч. hrоtos – первый, главный). Этим названием хотели подчеркнуть первостепенное значение белков для жизненного процесса.
Белки представляют собой высокомолекулярные (молекулярная масса до 1,5 млн углеродных единиц) органические соединения. Кроме С, О, Н, N. в состав белков могут входить S, Р, Fе. Белки построены из мономеров, которыми являются аминокислоты. Поскольку в состав молекул белков может входить большое число аминокислот, то их молекулярная масса бывает очень большой. Так, молекулярная масса инсулина – 5700, белка – фермента рибонуклеазы – 12 700, яичного альбумина – 36 00, гемоглобина – 65 000. Для сравнения: молекулярная масса спирта – 46, уксусной кислоты 60, бензола 78.
Так, молекулярная масса инсулина – 5700, белка – фермента рибонуклеазы – 12 700, яичного альбумина – 36 00, гемоглобина – 65 000. Для сравнения: молекулярная масса спирта – 46, уксусной кислоты 60, бензола 78.
Белки являются нерегулярными полимерами.
Вопрос. Что является мономером белков?
В клетках разных живых организмов встречается свыше 170 различных аминокислот, но бесконечное разнообразие белков создается за счет различного сочетания всего 20 аминокислот. Из них может быть образовано ими 2∙ 1018 комбинаций, т. е. различных белков, которые будут обладать совершенно одинаковым составом, но различным строением. Но и это огромное число не предел — белок может состоять и из большего числа аминокислотных остатков, и, кроме того, каждая аминокислота может встречаться в белке несколько раз.
Слайд 4
Молекула аминокислоты состоит из двух одинаковых для всех аминокислот частей, одна из которых является аминогруппой (— NН2 с основными свойствами, другая — карбоксильной группой (—СООН) с кислотными свойствами.
Нейтральные аминокислоты, имеющие одну карбоксильную группу и одну аминогруппу.
Кислые аминокислоты, имеющие более одной карбоксильной группы.
Основные аминокислоты, имеющие более одной карбоксильной группы.
Слайд 5
Наличие в одной молекуле аминокислоты и основной, и кислотной групп обусловливает их амфотерность и высокую реактивность. Через эти группы происходят соединения аминокислот при образовании белка. Связь образуется при взаимодействии аминогруппы одной аминокислоты с карбоксильной группой другой. Реакция, идущая с выделением воды, называется
 рерtos — сваренный). К свободным карбоксильной и аминогруппе могут присоединяться другие аминокислоты, удлиняя «цепь», называющуюся полипептидной. На одном конце такой цепи всегда будет группа NH2 (этот конец называется N-концом), а на другом конце — группа СООН (этот конец получил название С-конца)
рерtos — сваренный). К свободным карбоксильной и аминогруппе могут присоединяться другие аминокислоты, удлиняя «цепь», называющуюся полипептидной. На одном конце такой цепи всегда будет группа NH2 (этот конец называется N-концом), а на другом конце — группа СООН (этот конец получил название С-конца)Полипептидные цепи белков бывают очень длинными и включают самые различные комбинации аминокислот. В состав белка может входить не одна, а две полипептидные цепи и более. Так, в молекуле инсулина — две цепи, а иммуноглобулины состоят из четырех цепей.
Вопрос. На какие группы можно разделить аминокислоты в зависимости от того, могут ли они синтезироваться в организме?
Бактерии и растения могут синтезировать все необходимые им аминокислоты из более простых веществ. Многие животные, в том числе и человек, способны синтезировать не все аминокислоты, поэтому так называемые незаменимые аминокислоты (лизин, валин, лейцин, изолейцин, треонин, фенилаланин, триптофан, тирозин, метионин) они должны получать с пищей в готовом виде. Заменимые аминокислоты – аминокислоты, которые в организме синтезируются.
Заменимые аминокислоты – аминокислоты, которые в организме синтезируются.
В зависимости от аминокислотного состава белки бывают:
Слайд 6
Самостоятельная работа(1 минута)
Прочитайте статью «Классификация белков» на 42 стр. и ответе на вопросы:
Какие группы белков выделяют?
Какие характеристики лежат в основе данной классификация?
Среди белков различают протеины, состоящие только из белков, и протеиды — содержащие небелковую часть (например, гемоглобин).
Кроме простых белков, состоящих только из аминокислот, есть еще и сложные, в состав которых могут входить углеводы (гликопротеиды), жиры (липопротеиды), нуклеиновые кислоты (нуклеопротеиды) и др.
I. Классификация белков по их составу.
II. Классификация белков по их структуре.
Фибриллярные: наиболее важна вторичная структура (третичная почти или совсем не выражена). Нерастворимы в воде. Выполняют в клетке и в органах структурные функции, например в составе соединительной ткани (коллаген, миозин, кератин)
Глобулярные: наиболее важна третичная структура. Растворимы – легко образуют коллоидные суспензии. Выполняют функции ферментов, антител и др.
Промежуточные: фибриллярной природы, но растворимые.
 Примером может служить фибриноген, превращающийся в нерастворимый фибрин при свертывании крови.
Примером может служить фибриноген, превращающийся в нерастворимый фибрин при свертывании крови.
Слайд7
III. Классификация белков по их функциям.
Уровни организации белковой молекулы. Молекулы белков могут принимать различные пространственные формы — конформации, которые представляют собой четыре уровня их организации.
Слайд 8
Под первичной структурой белка понимают число и последовательность аминокислот, соединенных друг с другом пептидными связями в полипептидной цепи. Первые исследования по выяснению аминокислотной последовательности белков были выполнены в Кембриджском университете Ф. Сэнгером, дважды удостоенным за свои работы Нобелевской премии. Сэнгер работал с гормоном инсулином. Это был первый белок, для которого удалось выяснить аминокислотную последовательность. Работа заняла ровно 10 лет (1944 – 1954гг.) В молекуле инсулина входит 51 аминокислота, а молекулярная масса этого белка равна 5733. Молекула состоит из двух полипептидных цепей. Удерживаемых вместе дисульфидными мостиками
Работа заняла ровно 10 лет (1944 – 1954гг.) В молекуле инсулина входит 51 аминокислота, а молекулярная масса этого белка равна 5733. Молекула состоит из двух полипептидных цепей. Удерживаемых вместе дисульфидными мостиками
Первичная структура уникальна для любого белка и определяет его форму, свойства и функции.
В организме человека свыше 10 000 различных белков, и все они построены из одних и тех же 20 станрдантных аминокислот. Аминокислотная последовательность белка определяет его биологическую функцию. В свою очередь эта аминокислотная последовательность однозначно определяется нуклеотидной последовательностью.
Слайд 9
Вторичная структура белков возникает в результате образования водородных связей между группами — СООН и — NН2 — разных аминокислотных остатков полипептидной цепи. Хотя водородные связи малопрочные, но благодаря их значительному количеству в комплексе они обеспечивают довольно прочную структуру.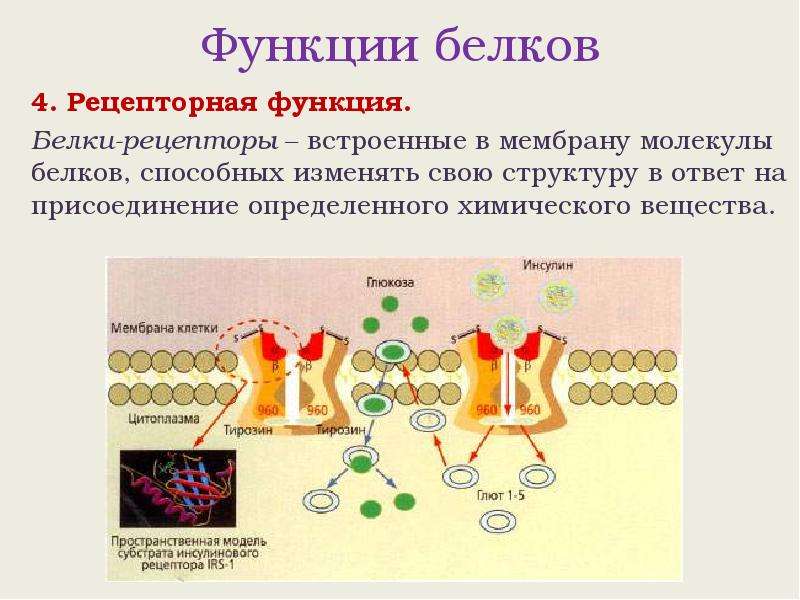 Белковая молекула напоминает растянутую пружину. Ренгено – структурный анализ показывает, что на один виток спирали приходится 3,6 аминокислотного остатка.
Белковая молекула напоминает растянутую пружину. Ренгено – структурный анализ показывает, что на один виток спирали приходится 3,6 аминокислотного остатка.
Слайд 10
Третичная структура представляет собой причудливую, но для каждого белка специфическую конфигурацию, имеющую вид клубка (глобулу). Прочность третичной структуры обеспечивается ионными, водородными и дисульфидными (—S—S—) связями между остатками цистеина, а также гидрофобным взаимодействием.
Слайд 11
Четвертичная структура характерна не для всех белков. Она возникает в результате соединения нескольких глобул в сложный комплекс. Полипептидные цепи удерживаются в молекуле вместе за счет гидрофобных взаимодействий, а также при помощи водородных и ионных связей Например, гемоглобин крови человека представляет комплекс из четырех таких субъединиц: из двух α — цепей и двух β-цепей. Две α — цепи содержат по 141 аминокислотному остатку, а две β-цепи – по 146 остатков. Полную структуру гемоглобина определили Кендрью и Перуц.
Две α — цепи содержат по 141 аминокислотному остатку, а две β-цепи – по 146 остатков. Полную структуру гемоглобина определили Кендрью и Перуц.
Некоторые вирусы, например вирус мозаики табака, имеют белковую оболочку, состоящую из многих полипептидных цепей, упакованных высокоупорядочным образом.
Слайд12
Свойства белков.
Белки обладают рядом физико – химических свойств, вытекающих из их структурной организации. Это во многом обуславливает функциональную активность каждой молекулы.
Во — первых, белки – преимущественно водорастворимые молекулы и, следовательно, могут проявлять свою функциональную активность только в водных растворах.
Во – вторых, белковые молекулы несут большой поверхностный заряд. Это определяет целый ряд электрохимических эффектов, например изменение проницаемости мембран каталитической активности и других функций.
В – третьих, белки термолабильны, т. е. проявляют свою активности в узких температурных рамках.
Утрата белковой молекулой своей природной структуры называется денатурацией. Она может возникать под воздействием температуры, химических веществ, обезвоживания, облучения и других факторов. Если при денатурации не нарушена первичная структура, то при восстановлении нормальных условий белок способен воссоздавать свою структуру. Этот процесс называется ренатурацией. Отсюда следует, что все особенности строения макромолекулы белка определяются его первичной структурой.
Слайд13
Функции белков. Белки выполняют целый ряд функций как в каждой клетке, так и в целом организме. Функции белков многообразны.
Белки являются основой всех биологических мембран, всех органоидов клетки, таким образом они выполняют структурную (строительную) функцию. Так, коллаген является важным составным компонентом соединительной ткани, кератин — компонент перьев, волос, рогов, ногтей, эластин — эластичный компонент связок, стенок кровеносных сосудов.
Так, коллаген является важным составным компонентом соединительной ткани, кератин — компонент перьев, волос, рогов, ногтей, эластин — эластичный компонент связок, стенок кровеносных сосудов.
Слайд14
Очень важна ферментативная функция белков. Белковые молекулы ферментов способны ускорять течение биохимических реакций в клетке в сотни миллионов раз. К настоящему времени выделено и изучено более тысячи ферментов, каждый из которых способен влиять на скорость течения той или иной биохимической реакции.
Молекулы одних ферментов состоят только из белков, другие включают белок и небелковое соединение, или кофермент. В качестве коферментов выступают различные вещества, как правило, витамины и неорганические — ионы различных металлов.
Ферменты участвуют как в процессах синтеза, так и распада. При этом ферменты действуют в строго определенной последовательности, они специфичны для каждого вещества и ускоряют только определенные реакции. Встречаются ферменты, которые катализируют несколько реакций. Избирательность действия ферментов на разные химические вещества связана с их строением. Каталитическая активность фермента определяется не всей его молекулой, а определенным участком молекулы фермента, который называется его активным центром. Субстрат взаимодействует с ферментом, причем связывание субстрата осуществляется именно в активном центре. Форма и химическое строение активного центра таковы, что с ним могут связываться только определенные молекулы в силу их пространственного соответствия, они подходят друг к другу, «как ключ к замку».
Встречаются ферменты, которые катализируют несколько реакций. Избирательность действия ферментов на разные химические вещества связана с их строением. Каталитическая активность фермента определяется не всей его молекулой, а определенным участком молекулы фермента, который называется его активным центром. Субстрат взаимодействует с ферментом, причем связывание субстрата осуществляется именно в активном центре. Форма и химическое строение активного центра таковы, что с ним могут связываться только определенные молекулы в силу их пространственного соответствия, они подходят друг к другу, «как ключ к замку».
Рассмотрете рис. 16 « Схема образования комплекса «фермент—субстрат»
На заключительном этапе химической реакции комплекс «фермент—субстрат» распадается с образованием конечных продуктов и свободного фермента. Освободившийся при этом активный центр фермента может снова принимать новые молекулы вещества-субстрата.
Важное значение имеет транспортная функция белков. Так, гемоглобин переносит кислород из легких к клеткам других тканей. В мышцах эту функцию выполняет белок миоглобин. Сывороточный альбумин крови способствует переносу липидов и жирных кислот, различных биологически активных веществ. Белки-переносчики осуществляют перенос веществ через клеточные мембраны.
Слайд15
Специфические белки выполняют защитную функцию. Они предохраняют организм от вторжения чужеродных организмов и от повреждения. Так, антитела, вырабатываемые лимфоцитами, блокируют чужеродные белки; интерфероны — универсальные противовирусные белки; фибриноген, тромбин и другие предохраняют организм от кровопотери, образуя тромб.
Многие живые существа для обеспечения защиты выделяют белки, называемые токсинами, которые в большинстве случаев являются сильными ядами. В свою очередь, некоторые организмы способны вырабатывать антитоксины, которые подавляют действие этих ядов.
Регуляторная функция присуща белкам-гормонам (регуляторам). Они регулируют различные физиологические процессы. Например, наиболее известным гормоном является инсулин, регулирующий содержание глюкозы в крови. При недостатке инсулина в организме возникает заболевание, известное как сахарный диабет.
Белки могут выполнять энергетическую функцию, являясь одним из источников энергии в клетке. При полном расщеплении 1 г белка до конечных продуктов выделяется 17,6 кДж энергии. Но в качестве источника энергии белки используются крайне редко. Аминокислоты, высвобождающиеся при расщеплении белковых молекул, используются для построения новых белков.
Роль белка в жизни клетки огромна. Современная биология показала, что сходство и различие организмов определяются, в конечном счете набором белков. Чем ближе организмы друг к другу в систематическом положении, тем более сходны их белки.
Слайд16
Выводы:
Белки как макромолекулы – основа жизни.
Мономерами белков являются аминокислоты.
Первичная структура белка определяется генотипом.
Вторичная, третичная и четвертичная структурная организация зависят от первичной структуры.
Все биологические катализаторы – ферменты – имеют белковую природу.
Белковые молекулы обеспечивают иммунологическую защиту организма от чужеродных веществ.
Слайд17
Проверьте себя
Каким образом происходит соединение двух аминокислот, приводящих к образованию дипептида?
Каков характер связей в первичной, самой простой структуре молекулы белка?
Как называется структура молекулы белка, возникающая путем образования водородных связей между остатками карбоксильных и аминогрупп разных аминокислот одной молекулы белка?
Каким образом третичная структура превращается в четвертичную?
Что такое антитела?
Слайд18
Каждому термину, указанному в левой колонке. Подберите соответствующее ему определение, приведенное в правой колонке.
ТерминОпределение
Первичная структура белка
Процесс утраты белковой молекулой своей структурной организации.
2. Денатурация
Б. Часть молекулы фермента, ответственная за присоединение и преобразование веществ.
3. Ренатурация
В. Последовательность аминокислотных остатков в полипептидной цепи, определенная генотипом.
4. Активный центр фермента
Г. Низкомолекулярные органические соединения различной природы, многие из которых являются предшественниками активных центров ферментов.
5. Витамины
Д. Процесс восстановления структурной организации белковой молекулы.
Слайд19
Домашнее задание: Изучить §11, ответить на вопросы на с. 46, заполнить таблицу, повторить § 9 -10. Подготовить сообщения или рефераты на темы: «Белки – биополимеры жизни», «Функции белков – основа жизнедеятельности каждого организма на Земле», «Многообразие ферментов, их роль в жизнедеятельности клеток и организмов».
1.3. Биологическая роль белка и его важнейшие источники
1.3. Биологическая роль белка и его важнейшие источники
Белки – жизненно необходимые и незаменимые вещества, без которых невозможны не только рост и развитие организма, но и сама жизнь. Они являются основным пластическим материалом для построения всех клеток, тканей и органов тела человека, образования ферментов, гормонов и других соединений, выполняющих в организме особо важные и сложные функции.
Белки составляют 54 % массы тела человека. Все ферменты, участвующие в превращениях и усвоении белков и других пищевых веществ, имеют белковую природу, поэтому при недостатке белка в пище снижается ферментативная активность организма и развиваются нарушения как в переваривании, так и в обмене всех веществ – белков, жиров и углеводов. При дефиците белка нарушается образование гормонов и, как следствие, работа сердечно-сосудистой системы, опорно-двигательного аппарата, мочеполовой и других систем организма.
Кроме того, белок в организме играет большую защитную роль. Из особого белка глобулина формируются антитела – вещества, определяющие защитные силы организма, невосприимчивость человека к инфекциям. Белки обезвреживают попавшие в организм человека яды и токсины, выполняют антитоксическую роль. Достаточное количество белка в пище повышает устойчивость к стрессам, которые могут быть причиной многих заболеваний. Помимо перечисленных, белок выполняет много других функций: обеспечение процессов свертывания крови, перенос кислорода с кровью, мышечное сокращение, передача наследственных признаков, транспорт различных веществ в организме, образование макроэргических соединений (АТФ) и т. д.
Как источник энергии, белки имеют второстепенное значение, так как могут быть заменены жирами и углеводами. При окислении в организме 1 г белка дает 4 ккал (16,7 кДж). Именно многообразие свойств белка, его участие в основных жизненных процессах подтверждают, что белок является основой жизни. Этот факт отмечали еще древние греки: другое название белков – протеины (от слова «протос», что означает «главный, единственный»).
Для того чтобы обеспечить все важнейшие жизненные процессы, необходимо достаточное поступление белка в организм. При этом белок, в отличие, например, от жиров и углеводов, не может синтезироваться в организме, не заменяется другими пищевыми веществами, не накапливается про запас. В то же время он частично расходуется на образование жира и углеводов при их дефиците в пищевом рационе. Единственным источником белков служит пища, поэтому белки пищи являются абсолютно необходимой составной частью рациона человека.
Белки пищи – сложные органические соединения, состоящие из большого количества аминокислот (более 20). Не все аминокислоты равноценны по своему значению для организма. Они делятся на заменимые и незаменимые (или жизненно необходимые). Заменимые аминокислоты названы так потому, что они могут синтезироваться в организме из других, незаменимые – в организме не синтезируются и обязательно должны содержаться в пище в достаточном количестве. Незаменимые аминокислоты (валин, метионин, лейцин, триптофан, лизин и др.) содержатся в наибольшем количестве и наилучших соотношениях в белках животного происхождения (яйца, молоко, мясо, рыба и т. д.), то есть в белках высокой биологической ценности, отличающихся сбалансированностью аминокислот, легкой перевариваемостью и хорошей усвояемостью. Заменимые аминокислоты содержатся преимущественно в белке растительных продуктов (хлеб, крупа, бобовые), и в случае дефицита этих продуктов в рационе на синтез незаменимых аминокислот в организме расходуются заменимые аминокислоты.
Чтобы обеспечить организм достаточным количеством незаменимых и заменимых аминокислот, в состав пищевого рациона должны входить как более полноценные (животные) белки, содержащие все незаменимые аминокислоты, так и менее полноценные (растительные). Наиболее благоприятно соотношение животного и растительного белка в рационе 1:1.
Чтобы избежать дефицита тех или других аминокислот, рекомендуется сочетать в каждом приеме пищи менее ценные растительные белки (хлеб, крупы, бобовые) с белками животного происхождения (молоко, творог, сыр, мясо, рыба, яйца) – это могут быть каши на молоке, хлеб с молоком, мучные изделия с творогом, вареники, мучные изделия с мясом, котлеты с макаронами и т. п. В то же время сочетание круп и злаковых продуктов с капустой, картофелем менее оправданно, так как не улучшает аминокислотного состава рациона. Важен тот факт, что при правильном сочетании растительного и животного белка улучшается усвоение растительных белков, из которых в кишечнике всасывается 60-80 % аминокислот, тогда как из белков животных продуктов – более 90 %.
Наиболее быстро перевариваются белки молочных продуктов и рыбы, затем мяса (белки говядины быстрее, чем свинины и баранины), хлеба и круп (быстрее – белки пшеничного хлеба из муки высших сортов и манной крупы). Нарушают переваривание белка некоторые содержащиеся в горохе, фасоли, сое вещества, которые снижают переваривающую активность пищеварительных ферментов. Тепловая обработка, длительное разваривание, измельчение, протирание улучшают переваривание белков.
Потребность человека в пищевом белке может изменяться в зависимости от пола, возраста, уровня физической активности, интенсивности труда, при некоторых заболеваниях.
В среднем потребность взрослого человека в белке составляет 80-100 г в сутки, или 1,1-1,3 г белка на 1 кг массы тела, что обеспечивает 10-15 % энергетических потребностей организма за счет белка. Потребность растущего организма в белке выше и зависит от возраста. Если на первом году жизни ребенок должен получать более 4 г белка на 1 кг массы тела, то в последующие годы потребность в белке снижается. Так, потребность в белке для девушек составляет в среднем 90 г, для юношей – 100 г в сутки.
Высокая потребность в белке у детей и подростков объясняется тем, что в растущем организме преобладают синтетические процессы и белок пищи необходим не только для поддержания азотистого равновесия, но и для обеспечения роста, увеличения массы тела, формирования скелета и мускулатуры. Количество белков животного происхождения, содержащих незаменимые аминокислоты, которые особенно необходимы для растущего организма, должно составлять не менее 60 % от общего количества белка в рационе.
Химический состав продуктов, используемых в качестве основных источников белка, представлен в таблице 1.
emp1
Таблица 1
Химический состав продуктов, используемых в качестве основных источников белка (в 100 г продукта), и их энергетическая ценность[1]
Необходимо отметить, что однообразное питание, состоящее преимущественно из растительных белков или только из белков животного происхождения, значительно ухудшает усвоение и использование белка в организме. Важны не только общее количество и качество белка в суточном рационе, но и обязательно разнообразие пищи, ежедневное употребление таких источников белка, как молоко, рыба, крупы, зерновые продукты, яйца, мясо.
Белковая недостаточность возникает от резкого уменьшения белков в пище при полном или частичном голодании, систематическом поступлении в организм белков низкой биологической ценности, длительном ограничении приема пищи (у алкоголиков, наркоманов, при болезнях желудочно-кишечного тракта), ведущих к недостаточному перевариванию и всасыванию пищевых белков, потере белков и нарушению их синтеза в организме при различных болезнях (активный туберкулез, заболевания органов пищеварения, инфекции и др.). Белковая недостаточность ведет к ухудшению функций пищеварительной, эндокринной, кроветворной и других систем организма, атрофии мышц. Снижается работоспособность, сопротивляемость к инфекциям, замедляется выздоровление при различных заболеваниях. Избыточное поступление пищевых белков также сказывается на организме. Оно ведет к перегрузке печени и почек продуктами распада белка, перенапряжению секреторной функции пищеварительного аппарата, накоплению в организме продуктов азотистого обмена и др.
Данный текст является ознакомительным фрагментом.
Продолжение на ЛитРесБелки, жиры, углеводы. Справка — РИА Новости, 23.08.2010 — КРАЕВОЕ ГОСУДАРСТВЕННОЕ БЮДЖЕТНОЕ УЧРЕЖДЕНИЕ ЗДРАВООХРАНЕНИЯ
Роль белка — Exponenta
Только полноценный высококачественный белок содержит все незаменимые аминокислоты, которые не синтезирует наш организм. В каждой из них важные свойства, которые определяют качество нашей жизни и состояние здоровья:
Изолейцин играет важную роль в формировании мышечной ткани, служит источником энергии для ее клеток. Способствует увеличению выносливости, восполнению затраченной при физической нагрузке энергии, восстановлению мышц, синтезу наружного слоя кожи, регулированию уровня сахара в крови. Дефицит изолейцина выражается в потере мышечной массы, может развиться гипогликемия.
Лейцин предотвращает усталость, способствует укреплению иммунной системы, повышению работоспособности, увеличению мышечной массы. Понижает содержание сахара в крови и способствует быстрейшему заживлению ран и костей. Недостаток лейцина является причиной нарушения обмена веществ, ослабления иммунитета, быстрого утомления, патологических процессов почках и щитовидной железе.
Лизин – участвует в образовании коллагена и восстановлении тканей, а также выработке антител, гормонов и ферментов. Имеет противовирусное действие, способствует повышению иммунитета. Дефицит приводит к утомляемости, усталости и слабости, неспособности к концентрации, раздражительности, потере волос, головокружение.
Метионин способствует укреплению структуры ногтей и волос, укреплению иммунитета, предотвращению жировых отложений в печени. Ускоряет регенеративные процессы, участвует в выводе тяжелых металлов из организма. Недостаток метионина сопровождается серьезным нарушением обмена веществ, является причиной поражения печени.
Валин служит источником энергии в мышечных клетках, препятствует снижению уровня серотонина. Используется для лечения депрессий и множественного склероза.
Треонин участвует в синтезе иммуноглобулинов и антител, способствует ускорению метаболических процессов в организме, выработке антител, прочности и упругости соединительных тканей и мышц, принимает участие в создании коллагена, эластина и мышечной ткани. Недостаток треонина в организме человека может проявляться такими симптомами, как мышечная слабость, нарушение концентрации внимания, потеря мышечной массы, задержка роста и развития, депрессия.
Фенилаланин способствует регулированию скорости обмена веществ, улучшению ментальной концентрации, регуляции аппетита. Недостаток фенилаланина в организме может привести к потере мышечной массы, гормональным сбоям, нарушению работы щитовидной железы и надпочечников, понижению умственной способности.
Аргинин — частично незаменимая аминокислота, которая играет важную роль в улучшении обменных процессов, стимулирует синтез соматотропного гормона, ускоряет метаболизм жиров и снижает концентрацию холестерина в крови. Недостаток приводит к возрастанию риска развития тромбов, нарушению мозговой деятельности, раннему старению, ожирению, атеросклерозам и гипертонии.
Гистидин — частично незаменимая аминокислота, которая играет важную роль в метаболизме белков, синтезе гемоглобина, красных и белых кровяных телец, является одним из регуляторов свертывания крови. Используется при лечении аллергий, предотвращает псориаз, экзему, нейродермиты. Недостаток приводит к нарушению обмена веществ, торможению синтеза гемоглобина, ослаблению слуха.
Триптофан в организме человека непосредственно преобразуется в серотонин, соединение, которое вызывает умственное расслабление и создает ощущение эмоционального благополучия. Триптофан способен уменьшать болевую чувствительность, стимулирует выработку гормона роста, который необходим для увеличения мышечной массы и уменьшения массы жира. Низкое содержание триптофана в организме вызывает депрессию, тревожность, бессонницу, расстройства внимания, гиперактивность, головные боли.
Какие функции выполняет белок в организме человека – блог justfood
Роль белков для организма человека
Для начала следует пояснить: все живое во Вселенной состоит из протеина (он же – белок). Не просто так, пытаясь обнаружить признаки жизни где-то еще, кроме Земли, ученые в первую очередь ищут молекулы воды и белка. Именно белок в составе организмов свидетельствует о том, что они живые.
Одним словом, белки – это основа жизни. Проникая внутрь вместе с едой, он проходит длинный и удивительный процесс всевозможных преобразований: последовательное расщепление на полипептиды и олигопептиды, а уже в конце мы получаем давно знакомые нам аминокислоты.
Ещё недавно ученые знали о 150 видах аминокислот, но ежегодно их перечень растёт. Вариации столь неповторимы и разнообразны, что в нашем теле невозможно найти две идентичных молекулы.
Белки – основополагающий стройматериал для женского тела. Они сохраняют упругость и здоровье кожи, ногтей и волос. Вдобавок, белковый рацион помогает при создании желаемой фигуры: именно на их основе формируется мускулатура, а на стадии их переваривания происходит интенсивный расход калорий, что также способствует похудению. Однако полезные свойства этим не ограничиваются. Что же еще они умеют?
Защищают
Для свертывания крови задействованы специальные белки, имеющие названия фибриноген и тромбин. Благодаря им осуществляется защита кожи (дермы) и предотвращается кровопотеря при повреждениях капилляров и сосудов. Одновременно, они предоставляют нам защиту на химическом уровне, непосредственно принимая участие в генерировании важнейших нам антител.
Регулируют
Существует ряд белков, не представляющих собой энергетический источник и их нельзя назвать «строительным материалом». Они призваны выполнять регулирующую функцию во внутриклеточных процессах. В этом и заключается их основная задача.
Сигнализируют
Белок передает сигналы между тканями, внутренними органами и на клеточном уровне и сообщает о подступающей опасности. Яркая иллюстрация этому – инсулин, который оповещает печень и кишечник о том, что сейчас не требуется перерабатывать белки, поступившие внутрь, в глюкозу.
Помогают нам двигаться
Актин и миозин — эти белки при соединении образуют актомиозин – ключевой элемент сократительных мышц. Нельзя не упомянуть про ключевой компонент хрящей и сухожилий – белок коллаген, который славится своей сверхвысокой прочностью.
Участвуют в производстве потомства.
Гены и хромосомы – вы не поверите, но и это — белок, принимающий активное участие в создании новых форм жизни. А ведь для этого требуется колоссальное количество белка в сочетании с непрерывным притоком свободных аминокислот. В случае, если эти поступления нерегулярны, функция продолжения рода становится невозможной.
Способствуют выработке энергии
В ситуации голодания роль белков резко увеличивается. Их запас обеспечивает нас столь необходимой человеку энергией.
Строят
Белки – это первостепенный клеточный строительный материал. Большинство плотных тканей – мышечная, волосы, опорные – состоят именно из них. При образовании мембран клеток также всегда используются белки.
Продукты, с высоким белковым содержанием
Куриную грудку недаром называют главным блюдом в холодильнике спортсмена. В одной порции содержится примерно 200 ккал, 40 г белка и всего лишь 2 г жира. К её неоспоримым достоинствам можно отнести быстрое время приготовления и универсальность: на основе куриной грудки можно приготовить множество интересных блюд и закусок.
Еще один продукт, насыщенный белком – это обычное яйцо. Употреблять его без желтка нет смысла: именно желток даёт возможность белку хорошо и быстро усваиваться. Всегда держите в холодильнике упаковку яиц на случай, если нет времени готовить, а безвредный и сытный перекус желателен.
Лосось – тот самый случай, когда вкусное сочетается с полезным. В филе лосося в среднем присутствует примерно 370 ккал, 40 грамм белка и 28 – жиров. Ну и, конечно, огромное количество необходимых кислот Омега-3.
Признаки нехватка белка
В первую очередь их поможет установить врач: анализ крови расскажет, какой из показателей выбивается из нормы и нуждается в коррекции. Так, о нехватке могут сигнализировать заниженные показатели гемоглобина: нарушается транспортная функция этого вещества, происходит кислородное голодание, может развиться анемия. Кроме того, вычислить недостаток можно и по косвенным критериям: состоянию ногтей, зубов и волосяного покрова. Если оно сильно испортилось в последнее время, есть смысл сдать анализы и произвести над этим работу.
Если хотите готовый рацион питания, наши специалисты по правильному питанию подготовят для вас готовую сбалансированную еду и доставят в любую точку Москвы.
Роль белков, жиров и углеводов в организме человека
2 Видеолекторий на тему: «Роль белков, жиров и углеводов в организме человека»
Белки, жиры и углеводы играют важную роль в организме человека.
Белки—сложные вещества, состоящие из аминокислот. Являются неизменной составляющей частью рациона. Это главный строительный материал, без которого невозможен рост мускулатуры и тканей в целом. Белки подразделяются на 2 категории:
Животный, который поступает из продуктов животного происхождения. К этой категории можно отнести мясо, птицу, рыбу, молоко, творог и яйца.
Растительный, который организм получает из растений. Здесь стоит выделить рожь, овсянку, грецкие орехи, чечевицу, фасоль, сою и морские водоросли.
Жиры — это органические соединения, отвечающие за «резервный фонд» энергии в организме, главные поставщики энергии в периоды дефицита пищи и болезней, когда организм получает малый объем питательных элементов или же не получает их вовсе. Жиры необходимы для эластичности кровеносных сосудов, благодаря чему полезные элементы быстрее проникают к тканям и клеткам, способствуют нормализации состояния кожных покровов, ногтевых пластин и волос. Жиры в больших количествах содержатся в орехах, масле сливочном, маргарине, жире свином, сыре твердом.
Углеводы — это главный источник энергии для людей. В зависимости от количества структурных единиц углеводы делятся на простые и сложные. Углеводы, называемые простыми или «быстрыми», легко усваиваются организмом и повышают уровень сахара в крови, что может повлечь набор лишнего веса и ухудшение метаболизма.
Сложные углеводы состоят из множества связанных сахаридов, включая в себя от десятков до сотен элементов. Подобные углеводы считаются полезными, поскольку при переваривании в желудке они отдают свою энергию постепенно, обеспечивая стабильное и долговременное чувство насыщения.
Также важную роль в организме играют витамины и микроэлементы, которые не включены в структуру тканей, однако без их участия не выполнялись бы многие жизненно важные функции, происходящие в человеческом организме.
Практически все жизненные процессы в нашем теле находятся в зависимости от того, что мы употребляем в пищу. Достаточно богаты углеводами свежие фрукты. Необходимо избегать чрезмерного употребления сладостей, мучных изделий, сахара. Рациональное питание имеет существенное значение – и это подразумевает не только своевременное употребление вкусно приготовленной еды, но и включение в ежедневный рацион оптимального соотношения таких важных для правильной жизнедеятельности веществ, как белки, жиры, углеводы, витамины и микроэлементы. От гармоничного сочетания всех этих веществ зависит поддержание нормальной жизнедеятельности человека.
Функции белка в организме
☰
Белки в живых организмах выполняют множество важных функций. Поэтому в организмах существует множество различных белков.
Ферментативная функция белков заключается в том, что они служат катализаторами различных химических реакций, протекающих в организме. Ферментативную функцию по-другому называют каталитической. При катализе происходит ускорение химических реакций, причем это ускорение может быть даже в миллионы раз.
Белков-ферментов тысячи, каждый из них обслуживает свою химическую реакции или группу схожих реакций. По типу обслуживаемых реакций ферменты делят на классы. Например, оксидоредуктазы катализируют окислительно-восстановительные реакции, гидролазы обеспечивают гидролиз химических связей и т. д. Реакцию катализирует не вся молекула фермента, а только ее так называемый активный центр. Он включает часть молекулы, которая связывает субстрат (молекулу, которая подвергается превращению), и несколько аминокислот (часто не вместе расположенных), которые обеспечивают саму реакцию.
Белки выполняют структурную функцию. Они входят в состав клеточных мембран и органоидов, межклеточного вещества (белки коллаген и эластин), волос, ногтей и т. п. (кератин).
Двигательная функция белков заключается в сокращении мышц (актин и миозин), обеспечении движения клеток, их ресничек и жгутиков.
Существуют белки, которые обеспечивают перенос различных веществ как внутри клетки, так и по всему организму. Такие белки обеспечивают транспортную функцию. Они легко связываются с субстратом, когда его концентрация высока, и легко высвобождают его при низкой концентрации. К транспортным белкам относится гемоглобин. В легких он связывает кислород и высвобождает углекислый газ, а в тканях наоборот.
Ряд белков, входящих в состав мембран клеток, обеспечивают транспорт малых молекул через мембрану. Такой транспорт может быть как пассивным (белки-каналы), так и активным (белки-переносчики).
Регуляторная и сигнальная функции белков разнообразны. Многие внутриклеточные процессы (клеточный цикл, транскрипция и трансляция, активация или подавление активности других белков и т. д.) регулируются белками.
Многие гормоны — это белки, переносимые кровью. Когда гормон связывается с определенным рецептором, то клетка получает сигнал, в результате чего в ней запускается ответная реакция. Гормоны регулируют концентрации веществ, процесс роста, период размножения и др.
Клетки взаимодействуют между собой посредством сигнальных белков, которые передаются через межклеточное вещество. Например, такие сигналы могут стимулировать или подавлять рост клеток. Таким образом обеспечивается согласованность работы клеток той или иной системы органов.
Выделяют рецепторную функцию белков. Белки-рецепторы могут находиться как в цитоплазме, так и в мембранах. Когда на рецептор действует химическое вещество или физический стимул (свет, давление и др), то он изменяется. Это изменение молекулы передается в другие части клетки, посредством катализа определенной реакции, прохождения ионов или связывания молекул-посредников.
Защитная функция белков также весьма разнообразна. Коллаген и кератин обеспечивают не только структурную функцию, но и физическую защиту организма. Также физически организм защищают фибриногены и тромбины, свертывающие кровь в местах ранения (контакта с воздухом).
Белки обеспечивают химическую защиту, связывая и расщепляя чужеродные токсины или вырабатывая свои (для защиты от других организмов).
Защитными белками являются антитела, которые обезвреживают микроорганизмы и чужеродные белки. Так белки обеспечивают иммунную защита.
Если в организме возникает дефицит углеводов и жиров, то белки, распадаясь до конечных продуктов, могут выполнять энергетическую функцию.
Белки могут запасаться как источник энергии и источник аминокислот (например, в яйцеклетках). Это запасающая функция белков.
Белки — ФГБУ «НМИЦ ТПМ» Минздрава России
Белки представляют основу структурных элементов клеток и тканей. Функции их разнообразны, они принимают участие в обмене веществ, сократимости, росте, размножении, мышлении.
Еще одна функция белков — транспортировка необходимых соединений или химических элементов. Гемоглобин, например, переносит кислород, он же транспортирует углекислый газ.
При попадании в организм чужих белков или клеток вырабатываются особые белки — антитела, которые связывают и обеззараживают чужеродные вещества.
И наконец, белки могут служить источником энергии. Но это самое невыгодное «топливо». В сутки в организме человека расщепляется около 400 г белка. Две трети образовавшихся при этом аминокислот идут на восстановление белка, и одна треть расходуется на образование энергии.
В раннем детстве потребность в белке максимальная. С возрастом она уменьшается, так как ткани наращиваются медленнее. К моменту зрелости главной становится не строительная функция, а энергетическая.
Организм не может принять белка больше, чем ему необходимо, и если потребление белка с возрастом не уменьшается, то образуются конечные продукты белкового обмена: мочевая кислота, мочевина, аммиак, креатинин, креатин и др. При избытке этих соединений выведение их затруднено, и они задерживаются в организме, постепенно накапливаясь и нарушая обменные процессы.
Все огромное множество белков — это комбинации 20 аминокислот, из них 10 аминокислот не синтезируются организмом и могут быть получены только из продуктов питания. Эти незаменимые аминокислоты должны поступать в составе потребляемых нами белков.
Белки пищи могут быть животного и растительного происхождения. Ценность пищевого рациона определяется наличием в белке незаменимых аминокислот.
К полезным животным белкам относятся постная говядина, курятина и индюшатина без кожи, яйца, молочные и кисломолочные продукты.
Рыба является не только источником белка, но и обеспечивает нас полезными омега-3-жирными кислотами.
Белки растительного происхождения (фасоль, соя, горох, чечевица) сочетают в себе высококачественный белок и растворимое волокно, которое очищает организм от холестерина.
Орехи и семена богаты не только белками, но и мононенасыщенными жирами.
Грецкие орехи содержат еще и омега-3-жирные кислоты. Это делает их особенно полезными, однако они содержат много калорий, поэтому потреблять их в большом количестве не следует.
Функции белков в организме | Химия онлайн
Функции белков в природе универсальны. Белки входят в состав всех живых организмов. Мышцы, кости, покровные ткани, внутренние органы, хрящи, шерсть, кровь — все это белковые вещества.
Растения синтезируют белки из углекислого газа и воды за счет фотосинтеза. Животные организмы получают, в основном, готовые аминокислоты с пищей и на их базе строят белки своего организма.
Ни один из известных нам живых организмов не обходится без белков. Белки служат питательными веществами, они регулируют обмен веществ, исполняя роль ферментов – катализаторов обмена веществ, способствуют переносу кислорода по всему организму и его поглощению, играют важную роль в функционировании нервной системы, являются механической основой мышечного сокращения, участвуют в передаче генетической информации и т.д.
Видеофильм «Функции белков»
Разнообразные функции белков определяются a-аминокислотным составом и строением их высокоорганизованных макромолекул.
1. Каталитическая (ферментативная) функция
Каталитическая функция — одна из основных функций белков. Абсолютно все биохимические процессы в организме протекают в присутствии катализаторов – ферментов. Все известные ферменты представляют собой белковые молекулы.
Белки – это очень мощные катализаторы. Они ускоряют реакции в миллионы раз, причем для каждой реакции существует свой фермент.
В настоящее время известно свыше 2000 различных ферментов, которые являются биологическими катализаторами.
Например, фермент пепсин расщепляет белки в процессе пищеварения.
Даже такая простая реакция как гидратация углекислого газа катализируется ферментом карбоангидразой.
Ферменты катализируют реакции расщепления сложных молекул (катаболизм) и их синтеза (анаболизм), а также репликации ДНК и матричного синтеза РНК.
2. Транспортная функция
Некоторые белки способны присоединять и переносить (транспортировать) различные вещества по крови от одного органа к другому и в пределах клетки.
Белки транспортируют липиды (липопротеиды), углеводы (гликопротеиды), ионы металлов (глобулины), кислород и углекислый газ (гемоглобин), некоторые витамины, гормоны и др.
Например, альбумины крови транспортируют липиды и высшие жирные кислоты (ВЖК), лекарственные вещества, билирубин.
Белок эритроцитов крови гемоглобин соединяется в легких с кислородом, превращаясь в оксигемоглобин. Достигая с током крови органов и тканей, оксигемоглобин расщепляется и отдает кислород, необходимый для обеспечения окислительных процессов в тканях.
Белок миоглобин запасает кислород в мышцах.
Специфические белки-переносчики обеспечивают проникновение минеральных веществ и витаминов через мембраны клеток и субклеточных структур.
3. Защитная функция
Защитную функцию выполняют специфические белки (антитела — иммуноглобулины), которые вырабатываются иммунной системой организма. Они обеспечивают физическую, химическую и иммунную защиту организма путем связывания и обезвреживания веществ, поступающих в организм или появляющихся в результате жизнедеятельности бактерий и вирусов.
Например, белок плазмы крови фибриноген участвует в свертывании крови (образовывает сгусток). Это защищает организм от потери крови при ранениях.
Альбумины обезвреживают ядовитые вещества (ВЖК и билирубин) в крови.
Антитела, вырабатываемые лимфоцитами, блокируют чужеродные белки. Интерфероны — универсальные противовирусные белки.
Многие живые существа для обеспечения защиты выделяют белки, называемые токсинами, которые в большинстве случаев являются сильными ядами. В свою очередь, некоторые организмы способны вырабатывать антитоксины, которые подавляют действие этих ядов.
4. Сократительная (двигательная) функция
Важным признаком жизни является подвижность, в основе которой лежит данная функция белков, таких как актин и миозин – белки мышц. Кроме мышечных сокращений к этой функции относят изменение форм клеток и субклеточных частиц.
B результате взаимодействия белков происходит передвижение в пространстве, сокращение и расслабление сердца, движение других внутренних органов.
5. Структурная функция
Структурная функция — одна из важнейших функций белков. Белки играют большую роль в формировании всех клеточных структур.
Белки – это строительный материал клеток. Из них построены опорные, мышечные, покровные ткани.
Некоторые из них (коллаген соединительной ткани, кератин волос, ногтей, эластин стенок кровеносных сосудов, фиброин шелка и др.) выполняют почти исключительно структурную функцию.
Кератин синтезируется кожей. Волосы и ногти – это производные кожи.
В комплексе с липидами белки участвуют в построении мембран клеток и внутриклеточных образований.
6. Гормональная (регуляторная) функция
Регуляторная функция присуща белкам-гормонам (регуляторам). Они регулируют различные физиологические процессы.
Например, наиболее известным гормоном является инсулин, регулирующий содержание глюкозы в крови. При недостатке инсулина в организме возникает заболевание, известное как сахарный диабет.
Интересно знать!
В плазме некоторых антарктических рыб содержатся белки со свойствами антифриза, предохраняющие рыб от замерзания, а у ряда насекомых в местах прикрепления крыльев находится белок резилин, обладающий почти идеальной эластичностью. В одном из африканских растений синтезируется белок монеллин с очень сладким вкусом.
7. Питательная (запасная) функция
Питательная функция осуществляется резервными белками, которые запасаются в качестве источника энергии и вещества.
Например: казеин, яичный альбумин, белки яйца обеспечивают рост и развитие плода, а белки молока служат источником питания для новорожденного.
8. Рецепторная (сигнальная) функция
Некоторые белки (белки-рецепторы), встроенные в клеточную мембрану, способны изменять свою структуру под воздействием внешней среды. Так происходит прием сигналов извне и передача информации в клетку.
Например, действие света на сетчатку глаза воспринимается фоторецептором родопсином.
Рецепторы, активизируемые низкомолекулярными веществами типа ацетилхолина, передают нервные импульсы в местах соединения нервных клеток.
9. Энергетическая функция
Белки могут выполнять энергетическую функцию, являясь одним из источников энергии в клетке (после их гидролиза). Обычно белки расходуются на энергетические нужды в крайних случаях, когда исчерпаны запасы углеводов и жиров.
При полном расщеплении 1 г белка до конечных продуктов выделяется 17,6 кДж энергии. Но в качестве источника энергии белки используются крайне редко. Аминокислоты, высвобождающиеся при расщеплении белковых молекул, используются для построения новых белков.
Белки
Белки | Tervisliku toitumise informatsioon
Белки составляют примерно 15–20% массы тела человека, что при весе в 70 кг дает около 12 кг. Основные задачи белков – обеспечение роста, построения и развития организма. Белковый состав имеют почти все энзимы и часть гормонов. Белки активно участвуют в производстве антител и обеспечивают крепость и активность иммунной системы, а также участвуют в транспортировке многих соединений.
Белки состоят из аминокислот, подразделяемых на незаменимые, которые нужно получать с пищей, и заменимые, которые организм способен синтезировать самостоятельно. Незаменимыми для человека аминокислотами являются изолейцин, лейцин, лизин, метионин, фенилаланин, треонин, триптофан, валин и гистидин. Заменимыми для человека аминокислотами являются аланин, аспарагин, аспарагиновая кислота, цистеин, глютамин, глютаминовая кислота, глицин, пролин, серин и тирозин. Разные продукты содержат разные сочетания и количества аминокислот.
Белки животного происхождения (белки яиц, молока, рыбы и мяса) содержат больше незаменимых аминокислот по сравнению с белками растительного происхождения. К сожалению, источники многих незаменимых животных белков слишком насыщены жиром. Довольно хороший аминокислотный состав имеют также белки, содержащиеся в сое, рисе, орехах и семенах.
В части белков (например, белках зерновых растений) недостает некоторых незаменимых аминокислот. Их дефицит можно компенсировать небольшим количеством белков животного происхождения, например, приготовить манную кашу на молоке, добавить в макароны сыр и т.д.
Белки выполняют в организме множество функций:
- они необходимы для роста и строительства клеток организма,
- почти все энзимы и часть гормонов имеют белковый состав,
- активно участвуют в производстве антител и обеспечивают крепость и активность иммунной системы,
- участвуют в транспортировке многих соединений,
- дают пищевую энергию: 1 г = 4 ккал.
Рекомендуется покрывать белками 10–20 % суточной потребности в энергии. Человеку с потребностью в энергии 2000 ккал в сутки следует употреблять: от 0,1 x 2000 ккал / 4 ккал = 50 г до 0,20 x 2000 ккал/ 4 ккал = 100 г белков.
Лучшими источниками белков животного происхождения являются яйца, молочные продукты (например, творог, сыр, зернистый творог), рыба, птица, мясо. Лучшими источниками белков растительного происхождения являются бобовые, орехи, семена и зерновые продукты. Серьезный недостаток белка приводит к отекам и мышечной слабости, изменениям волос и кожи. Белковый дефицит часто возникает вместе с дефицитом энергии, обусловленным недостатком белков и других питательных веществ в результате общего дефицита питательных веществ.
Длительное питание продуктами с чрезмерным содержанием белка вредно, поскольку нагружает почки и печень, может вызвать подагру и повышает риск возникновения аллергии. Энергия, получаемая с белками, в долгосрочной перспективе не должна превышать 20 % суточной пищевой энергии.
Что такое белки и для чего они нужны ?: MedlinePlus Genetics
Белки — это большие сложные молекулы, которые играют важную роль в организме. Они выполняют большую часть работы в клетках и необходимы для структуры, функции и регулирования тканей и органов тела.
Белки состоят из сотен или тысяч более мелких единиц, называемых аминокислотами, которые связаны друг с другом длинными цепями. Существует 20 различных типов аминокислот, которые можно комбинировать для получения белка.Последовательность аминокислот определяет уникальную трехмерную структуру каждого белка и его конкретную функцию. Аминокислоты кодируются комбинациями трех строительных блоков ДНК (нуклеотидов), определяемых последовательностью генов.
Белки можно описать в соответствии с их широким спектром функций в организме, перечисленных в алфавитном порядке:
Функция | Описание | Пример |
|---|---|---|
Антитело | Антитела связываются с определенными инородными частицами, такими как вирусы и бактерии, чтобы защитить организм. | Иммуноглобулин G (IgG) |
Фермент | Ферменты осуществляют почти все тысячи химических реакций, протекающих в клетках. Они также помогают формированию новых молекул, считывая генетическую информацию, хранящуюся в ДНК. | Фенилаланингидроксилаза |
Посланник | Белки-мессенджеры, такие как некоторые типы гормонов, передают сигналы для координации биологических процессов между различными клетками, тканями и органами. | Гормон роста |
Компонент конструкции | Эти белки обеспечивают структуру и поддержку клеток. В большем масштабе они также позволяют телу двигаться. | Актин |
Транспортировка / хранение | Эти белки связывают и переносят атомы и небольшие молекулы внутри клеток и по всему телу. | Ферритин |
Что такое белки и каковы их функции в организме?
Последнее обновление: 16 декабря 2019 г.
Белки состоят из многих строительных блоков, известных как аминокислоты.Нашему организму нужен диетический белок, чтобы поставлять аминокислоты для роста и поддержания наших клеток и тканей. Наши диетические потребности в белке меняются на протяжении всей жизни. Европейское управление по безопасности пищевых продуктов (EFSA) рекомендует взрослым потреблять не менее 0,83 г белка на кг массы тела в день (например, 58 г в день для взрослого человека весом 70 кг). Белки растительного и животного происхождения различаются по качеству и усвояемости, но обычно это не вызывает беспокойства у большинства людей, если их общий белок соответствует их потребностям. Мы должны стремиться потреблять белок из различных источников, который приносит пользу как нашему здоровью, так и планетам.
Из чего состоят белки?
Белки состоят из множества различных аминокислот, связанных вместе. Существует двадцать различных строительных блоков из этих аминокислот, которые обычно встречаются в растениях и животных. Типичный белок состоит из 300 или более аминокислот, и конкретное количество и последовательность аминокислот уникальны для каждого белка. Подобно алфавиту, «буквы» аминокислот могут быть расположены миллионами различных способов для создания «слов» и целого белкового «языка».В зависимости от количества и последовательности аминокислот полученный белок будет принимать определенную форму. Эта форма очень важна, поскольку она будет определять функцию белка (например, мышц или ферментов). У каждого вида, включая человека, есть свои характерные белки.
Аминокислоты подразделяются на незаменимые и несущественные. Как следует из названия, незаменимые аминокислоты не могут вырабатываться организмом и, следовательно, должны поступать из нашего рациона. Принимая во внимание, что незаменимые аминокислоты могут вырабатываться организмом и, следовательно, не должны поступать с пищей.
Таблица 1. Незаменимые и незаменимые аминокислоты.
Незаменимые аминокислоты | Незаменимые аминокислоты |
Гистидин Изолейцин Лейцин Лизин метионин Фенилаланин Треонин Триптофан Валин | Аланин Аргинин * Аспарагин Аспартат Цистеин * Глутамат Глютамин * Глицин * Пролин * Серин Таурин * Тирозин * |
* это условно незаменимые аминокислоты, что означает, что они необходимы только при определенных условиях (например,грамм. для новорожденных). 1
Что белки делают для организма?
Наши тела состоят из тысяч различных белков, каждый из которых выполняет определенную функцию. Они составляют структурные компоненты наших клеток и тканей, а также многие ферменты, гормоны и активные белки, секретируемые иммунными клетками (рис. 1).
Эти белки организма постоянно восстанавливаются и заменяются на протяжении всей нашей жизни. Этот процесс (известный как «синтез белка») требует постоянного поступления аминокислот.Хотя некоторые аминокислоты могут быть переработаны в результате распада старых белков организма, этот процесс несовершенен. Это означает, что мы должны потреблять диетический белок, чтобы удовлетворить потребности нашего организма в аминокислотах.
Поскольку белок необходим для роста клеток и тканей, адекватное потребление белка особенно важно в периоды быстрого роста или повышенной потребности, таких как детство, подростковый возраст, беременность и грудное вскармливание. 1
Рисунок 1. Функции белков в организме.
Какие продукты содержат много белка?
Белок содержится как в растительной, так и в животной пище. На рисунке 2 показано содержание белка в типичной порции обычных продуктов животного и растительного происхождения. Дополнительную информацию о том, как оценить размер здоровых порций, см. В разделе Измерение размеров порций руками.
Рис. 2. Продукты с высоким содержанием белка. 2
Есть ли разница между белками животного и растительного происхождения?
Как видно из рисунка 2, продукты животного и растительного происхождения могут быть богатыми источниками белка.Но одинаковы ли они по качеству?
Качество протеина можно определить по-разному; однако все определения относятся к распределению и соотношению незаменимых и заменимых аминокислот, которые они содержат. В целом белки животного происхождения имеют более высокое качество, поскольку они содержат более высокие пропорции незаменимых аминокислот по сравнению с белками растительного происхождения.
Существует распространенное заблуждение, что в растительных белках полностью отсутствуют некоторые незаменимые аминокислоты. Фактически, большинство растительных белков будут содержать все 20 аминокислот, но, как правило, имеют ограниченное количество определенных незаменимых аминокислот, известных как их ограничивающие аминокислоты.Это означает, что если небольшое количество растительных продуктов потребляется в качестве единственных источников белка, они вряд ли обеспечат достаточное количество незаменимых аминокислот для удовлетворения наших потребностей. Для людей, которые практически не потребляют продукты животного происхождения, таких как веганы или вегетарианцы, важно, чтобы они потребляли белок из источников с дополнительными ограничивающими аминокислотами. Например, потребление риса (с ограниченным содержанием лизина и тиамина, но с высоким содержанием метионина) и бобов (с ограниченным содержанием метионина, но с высоким содержанием лизина и тиамина) обеспечит дополнительные аминокислоты, которые могут помочь удовлетворить потребности в незаменимых аминокислотах.
Белки животного и растительного происхождения также различаются по своей биодоступности и усвояемости. Оценка усвояемых незаменимых аминокислот (DIAAS) является рекомендуемым методом для определения перевариваемости диетического белка и выражается в значениях ниже или иногда даже выше 100. 3 DIAAS более 100 указывает на то, что белок имеет очень высокую усвояемость и качество и является хороший комплемент протеинов с более низкими качествами. Белки животного происхождения, как правило, имеют более высокие баллы DIAAS по сравнению с белками растительного происхождения (таблица 2).Поскольку большинство людей потребляют белок из различных источников, качество и усвояемость белка обычно не вызывает беспокойства.
Таблица 2. DIAAS и качество различных типов протеина на 100 г пищи. 3, 4
Тип белка | DIAAS | Качество |
Пшеница | 40 | Низкий |
Миндаль | 40 | Низкий |
Рис | 59 | Низкий |
Горох | 64 | Низкий |
Нут | 83 | средний |
Куриная грудка | 108 | Высокая |
Яйцо | 113 | Высокая |
Цельное молоко | 114 | Высокая |
Сколько белка мы должны есть каждый день?
EFSA разработало диетические контрольные значения (DRV) для белка.DRV для белка на разных этапах жизни сведены в таблицу 3. Для среднего взрослого рекомендуется потреблять не менее 0,83 г белка на каждый килограмм веса тела в день. 1 Другими словами, взрослый человек весом 70 кг должен стремиться съедать не менее 58 г белка в день. Это эквивалентно белку, содержащемуся примерно в 200 г куриной грудки или 240 г ореховой смеси.
В периоды роста, например в детстве, беременности и кормлении грудью, потребности в белке относительно высоки.Кроме того, в пожилом возрасте соотношение белков и энергии начинает увеличиваться. Это означает, что нам требуется такое же количество белка, но меньше энергии (или калорий) из-за снижения скорости метаболизма и более малоподвижного образа жизни. 1
Таблица 3. Диетические контрольные значения для стадий жизни. 1 BW: масса тела.
Справочное значение | г / сутки 70 кг взрослые | |
Детство (12 мес — 17 лет) | 1.14 — 0,83 г / кг BW | – |
Взрослые (18-65 лет) | 0,83 г / кг BW | 58 г |
Пожилые (> 65 лет) | 1 г / кг BW | 70 г |
Беременность | 0,83 г / кг BW | 58 г |
+ 1г в сутки | 59 г | |
+ 9 г в сутки | 67 г | |
+ 28 г в сутки | 86 г | |
Грудное вскармливание (0-6 месяцев) | + 19 г в сутки | 77 г |
Грудное вскармливание (> 6 месяцев) | +13 г в сутки | 71 г |
Сколько белка мы едим каждый день?
В целом европейцы потребляют достаточно белка, а дефицит белка в большинстве развитых стран встречается редко (рис. 3).Поскольку диета европейцев уже превышает требуемый уровень, EFSA не рекомендует увеличивать текущее потребление белка. 1
Рисунок 3. Потребление белка в европейских странах. 1
Какова польза белка для здоровья?
Потребление достаточного количества белка для удовлетворения потребностей нашего организма важно для многих функций организма. Однако есть данные, позволяющие предположить, что в определенных ситуациях увеличение потребления белка выше требуемого уровня может принести дополнительную пользу для здоровья.
Белок и контроль веса
Было показано, что употребление в пищу продуктов, богатых белком, усиливает чувство сытости (также известное как сытость) больше, чем продукты с высоким содержанием жиров или углеводов. Краткосрочные исследования показали, что диета с высоким содержанием белка (например, 1,2 — 1,6 г / кг в день; 84-112 г в день для взрослого человека весом 70 кг) может помочь снизить общее потребление калорий и ускорить потерю веса. 5 Однако доказательства долгосрочного поддержания веса менее очевидны. 5 Как и все диеты, диета с высоким содержанием белка эффективна только в том случае, если ее придерживаются, что может быть трудным для некоторых людей, а низкая приверженность может частично объяснить ограниченную пользу, наблюдаемую при долгосрочном поддержании веса. 5
Белок и саркопения
Саркопения — это заболевание, характеризующееся прогрессирующей потерей мышечной массы и физических функций, которое обычно ассоциируется у пожилых людей. Саркопения связана с повышенной слабостью, риском падений, функциональным снижением и даже ранней смертью. 6 Поскольку белок необходим для восстановления и поддержания мышечной массы, неудивительно, что низкое потребление белка связано с повышенным риском развития саркопении. 6 Точно так же увеличение потребления белка, а также увеличение физической активности может помочь сохранить мышечную массу и силу с возрастом, снижая риск саркопении и заболеваний скелета.
Белок и спортивные результаты
Белок уже давно ассоциируется со спортивной продуктивностью.Белок играет ключевую роль в восстановлении и укреплении мышечной ткани после тренировки. Хотя белок имеет решающее значение для наращивания мышечной массы, для получения максимальной пользы его следует рассматривать в контексте всей диеты, которая включает правильное количество углеводов, жиров, витаминов и минералов. Оптимальное потребление белка будет зависеть от типа (например, тренировка на выносливость или сопротивление), продолжительности и интенсивности упражнений, причем большее количество не всегда означает лучший результат. Потребление белка 1,4–2,0 г на кг массы тела в день (например,грамм. 98 — 140 г в день для взрослого весом 70 кг) считается достаточным для удовлетворения потребностей большинства людей, занимающихся физическими упражнениями. 7 Спортсмены должны стремиться к потреблению белка за счет сбалансированной диеты, при этом белковые добавки используются для людей, которым необходимо поддерживать высокий уровень белка, но ограничивать общее потребление калорий.
Что произойдет, если вы съедите слишком много белка?
Недостаточно доказательств для установления порога потребления белка, и EFSA заявило, что потребление белка в два раза превышает DRV (1.7 г / кг в день или 119 г в день для взрослого весом 70 кг) по-прежнему считается безопасным при нормальных условиях. 1 Для людей с заболеванием почек избыток белка может быть проблемой, и этим людям следует проконсультироваться с диетологом или терапевтом, прежде чем повышать уровень белка.
Увеличение веса
Существует распространенное заблуждение, что нельзя набрать вес, употребляя белок. Это неправда, так же, как углеводы и жиры, когда они потребляются во время избытка калорий, избыток белка может превращаться в жировые отложения, что приводит к увеличению веса.Когда дело доходит до поддержания веса, самое главное — сохранять энергетический баланс.
Красное и обработанное мясо и риск рака
Белок необходим для хорошего здоровья, но некоторые продукты с высоким содержанием белка могут быть лучше для нашего здоровья, чем другие. В частности, потребление большого количества красного и обработанного мяса связано с повышенным риском некоторых видов рака. 8 Красное мясо является хорошим источником белка, а также многих других важных питательных веществ, таких как железо, витамин B 12 и цинк, и его не обязательно полностью избегать, чтобы снизить риск.Всемирный фонд исследования рака рекомендует нам стараться потреблять не более трех порций (около 350-500 г вареной массы) красного мяса в неделю и очень мало обработанного мяса. 8
Устойчивость белка
Выбор продуктов питания, который мы делаем, влияет не только на наше здоровье, но и на окружающую среду. В целом, белки животного происхождения, такие как говядина, молочные продукты и баранина, оказывают более сильное воздействие на окружающую среду (т. Е. Используют больше ресурсов и производят больше парниковых газов) по сравнению с растительными источниками, такими как соя, горох и чечевица (рисунок 4). 9 Хотя нет необходимости или рекомендуется полностью избегать продуктов животного происхождения, изменение рациона питания с включением большего количества источников белка растительного происхождения может принести пользу нашему здоровью и планете. 10 Устойчивое питание — это больше, чем просто выбор экологически чистых продуктов, богатых белком. Дополнительные советы о том, как вести более устойчивый образ жизни, см. В советах по здоровому и рациональному питанию и советах по сокращению пищевых отходов.
Рисунок 4 . Содержание белка и выбросы парниковых газов (ПГ) в различных пищевых продуктах. 9
Заключение
Белок необходим для жизни; он поставляет незаменимые аминокислоты, необходимые для роста и поддержания наших клеток и тканей. Наша потребность в белке зависит от нашего жизненного цикла, и большинство европейцев потребляют достаточно, чтобы удовлетворить свои потребности. Поскольку большинство людей придерживаются разнообразной диеты, качество и усвояемость белков, которые они едят, не должны вызывать беспокойства, если общее количество белка удовлетворяет их ежедневные потребности. Поскольку мы едим продукты, а не питательные вещества, мы должны выбирать продукты, богатые белком, которые не только содержат незаменимые аминокислоты, но и поддерживают здоровую и устойчивую диету.
Список литературы
- EFSA (2012). Европейское агентство по безопасности пищевых продуктов, Научное заключение о диетических референсных значениях белка. EFSA Journal 2012; 10 (2): 2557
- База данных Великобритании по составу пищевых продуктов.
- Консультация, F.E., 2011. Оценка качества диетического белка в питании человека. FAO Food Nutr. Пап, 92, стр. 1-66.
- Филлипс, С.М., 2017. Современные концепции и нерешенные вопросы в отношении диетических белков и добавок у взрослых.Границы питания, 4, с.13.
- Leidy, H.J., Clifton, P.M., Astrup, A., Wycherley, T.P., Westerterp-Plantenga, M.S., Luscombe-Marsh, N.D., Woods, S.C. и Mattes, R.D., 2015. Роль белка в потере и поддержании веса. Американский журнал клинического питания, 101 (6), стр.132
- Cruz-Jentoft AJ, Sayer AA (2019). Саркопения. Ланцет. 393 (10191): 2636-2646.
- Jager R., Kerksick, C.M., Campbell, B.I., Cribb, P.J., Wells, S.Д., Сквиат, Т.М., Пурпура, М., Зигенфус, Т.Н., Феррандо, А.А., Арент, С.М. и Смит-Райан, A.E., 2017. Позиция Международного общества спортивного питания: белок и упражнения. Журнал
- Всемирный фонд исследований рака / Американский институт исследований рака. Постоянное обновление отчета экспертов проекта за 2018 год. Мясо, рыба и молочные продукты и риск рака.
- Пур Дж., Немечек Т. (2018) Снижение воздействия пищевых продуктов на окружающую среду за счет производителей и потребителей.Science Vol. 360, Issue 6392, pp. 987-992
- ФАО и ВОЗ. 2019. Устойчивое здоровое питание — Руководящие принципы. Рим
Функция белков | Биология для майоров I
Результаты обучения
- Определить несколько основных функций белков
Основные типы и функции белков перечислены в таблице 1.
| Таблица 1. Типы и функции белков | ||
|---|---|---|
| Тип | Примеры | Функции |
| Пищеварительные ферменты | Амилаза, липаза, пепсин, трипсин | Помощь в переваривании пищи за счет катаболизма питательных веществ до мономерных единиц |
| Транспорт | Гемоглобин, альбумин | Переносит вещества в крови или лимфе по всему телу |
| Строительный | Актин, тубулин, кератин | Создавать различные структуры, такие как цитоскелет |
| Гормоны | Инсулин, тироксин | Координировать деятельность различных систем организма |
| Оборона | Иммуноглобулины | Защитить организм от инородных патогенов |
| Сокращение | Актин, миозин | Эффект сокращения мышц |
| Хранилище | Запасные белки бобовых, яичный белок (альбумин) | Обеспечить питание на ранних этапах развития зародыша и проростка |
Два специальных и распространенных типа белков — это ферменты и гормоны. Ферменты , которые вырабатываются живыми клетками, являются катализаторами биохимических реакций (например, пищеварения) и обычно представляют собой сложные или конъюгированные белки. Каждый фермент специфичен для субстрата (реагента, который связывается с ферментом), на который он действует. Фермент может помочь в реакциях разложения, перегруппировки или синтеза. Ферменты, которые расщепляют свои субстраты, называются катаболическими ферментами, ферменты, которые строят более сложные молекулы из своих субстратов, называются анаболическими ферментами, а ферменты, влияющие на скорость реакции, называются каталитическими ферментами.Следует отметить, что все ферменты увеличивают скорость реакции и, следовательно, считаются органическими катализаторами. Примером фермента является амилаза слюны, которая гидролизует свою субстратную амилозу, компонент крахмала.
Гормоны представляют собой химические сигнальные молекулы, обычно небольшие белки или стероиды, секретируемые эндокринными клетками, которые действуют, чтобы контролировать или регулировать определенные физиологические процессы, включая рост, развитие, метаболизм и размножение. Например, инсулин — это белковый гормон, который помогает регулировать уровень глюкозы в крови.
Белки имеют разную форму и молекулярную массу; некоторые белки имеют глобулярную форму, тогда как другие имеют волокнистую природу. Например, гемоглобин — это глобулярный белок, а коллаген, обнаруженный в нашей коже, — это волокнистый белок. Форма белка имеет решающее значение для его функции, и эта форма поддерживается многими различными типами химических связей. Изменения температуры, pH и воздействие химикатов могут привести к необратимым изменениям формы белка, что приведет к потере функции, известной как денатурация.Все белки содержат разные расположения одних и тех же 20 типов аминокислот. Недавно были открыты две редкие новые аминокислоты (селеноцистеин и пирролизин), и к этому списку могут быть добавлены дополнительные новые открытия.
Резюме: Функция белков
Белки — это класс макромолекул, которые выполняют широкий спектр функций для клетки. Они помогают метаболизму, обеспечивая структурную поддержку и действуя как ферменты, переносчики или гормоны. Строительными блоками белков (мономеров) являются аминокислоты.Каждая аминокислота имеет центральный углерод, связанный с аминогруппой, карбоксильной группой, атомом водорода и R-группой или боковой цепью. Существует 20 обычно встречающихся аминокислот, каждая из которых отличается по группе R. Каждая аминокислота связана со своими соседями пептидной связью. Длинная цепь аминокислот известна как полипептид.
Белки подразделяются на четыре уровня: первичный, вторичный, третичный и (необязательно) четвертичный. Первичная структура — это уникальная последовательность аминокислот.Локальное сворачивание полипептида с образованием таких структур, как α спираль и β -складчатый лист, составляет вторичную структуру. Общая трехмерная структура — это третичная структура. Когда два или более полипептида объединяются, чтобы сформировать полную структуру белка, такая конфигурация известна как четвертичная структура белка. Форма и функция белка неразрывно связаны; любое изменение формы, вызванное изменениями температуры или pH, может привести к денатурации белка и потере функции.
Внесите свой вклад!
У вас была идея улучшить этот контент? Нам очень понравится ваш вклад.
Улучшить эту страницуПодробнее
6.3: Функции белков — Medicine LibreTexts
Цели обучения
- Опишите различные функции белка в организме.
Белки укрепляют мышцы и все ткани тела. Белки играют решающую роль в обеспечении структуры практически всех тканей организма. У некоторых белков есть другая «работа».Другими словами, они не являются частью структуры тела, но выполняют определенные задачи, например, действуют как переносчики, антитела, ферменты и многое другое. Вы уже узнали о некоторых из этих важных белков. Когда вы узнали о диабете, вы изучали гормоны инсулин и глюкагон. Это примеры двух белковых молекул, которые действуют как гормоны с очень специфической и важной «работой», связанной с метаболизмом углеводов.
Ферменты
Некоторые белки действуют как ферменты.Ферменты — это белки, которые проводят определенные химические реакции. Задача фермента — обеспечить место для химической реакции и снизить количество энергии и время, необходимое для того, чтобы эта химическая реакция произошла (Рисунок \ (\ PageIndex {1} \)). Вот почему ферменты иногда называют катализаторами. В среднем каждую секунду в клетках происходит более ста химических реакций, и для большинства из них требуются ферменты. Одна только печень содержит более тысячи ферментных систем. Ферменты специфичны и будут использовать только определенные субстраты (или вещества на рисунке \ (\ PageIndex {1} \)), которые подходят их активному сайту, подобно тому, как замок может быть открыт только с помощью определенного ключа.Почти каждая химическая реакция требует определенного фермента. К счастью, фермент может снова и снова выполнять свою роль катализатора, хотя в конечном итоге он разрушается и восстанавливается. Все функции организма, включая расщепление питательных веществ в желудке и тонком кишечнике, преобразование питательных веществ в молекулы, которые клетка может использовать, и построение всех макромолекул, включая сам белок, включают ферменты.
Рисунок \ (\ PageIndex {1} \): Ферменты — это белки. Задача фермента — обеспечить место для веществ, чтобы химически реагировать и образовывать продукт, а также уменьшать количество энергии и время, необходимое для этого.
Гормоны
Белки отвечают за синтез гормонов. Гормоны — это химические посредники, вырабатываемые в одной части тела, а затем переносящиеся с кровью в другие части тела. Когда гормон попадает в ткань-мишень / часть тела, он передает сообщение, чтобы инициировать определенную реакцию или клеточный процесс. Например, после еды уровень глюкозы в крови повышается. В ответ на повышение уровня глюкозы в крови поджелудочная железа выделяет гормон инсулин.Инсулин сообщает клеткам организма, что глюкоза доступна и может забирать ее из крови и хранить или использовать для производства энергии или создания макромолекул. Основная функция гормонов — включать и выключать ферменты, поэтому некоторые белки могут даже регулировать действие других белков. Хотя не все гормоны состоят из белков, многие из них таковы. Другие примеры гормонов, состоящих из белков, включают глюкагон, мелатонин и гормон щитовидной железы.
Баланс жидкости и электролита
Правильное потребление белка позволяет основным биологическим процессам организма поддерживать статус-кво в изменяющейся окружающей среде.Баланс жидкости относится к поддержанию распределения воды в организме. Если слишком много воды в крови внезапно попадает в ткань, это приводит к отеку и, возможно, к гибели клеток. Вода всегда течет из области с высокой концентрацией в область с низкой концентрацией. В результате вода перемещается в области с более высокими концентрациями других растворенных веществ, таких как белки и глюкоза. Белки притягивают жидкость, поэтому для равномерного распределения воды между кровью и клетками белки постоянно циркулируют в крови в высоких концентрациях.Недостаток белка может вызвать отек (опухоль). Самый распространенный белок в крови — это альбумин. Присутствие альбумина в крови делает концентрацию белка в крови похожей на таковую в клетках. Таким образом, обмен жидкости между кровью и клетками не является экстремальным, а скорее сводится к минимуму, чтобы сохранить статус-кво. Транспортные белки (обсуждаемые ниже) в клеточной мембране помогают поддерживать правильный баланс электролитов (таких как натрий и калий) внутри и вне клетки.
Кислотно-щелочной баланс (pH)
Белок также необходим для поддержания правильного баланса pH (мера того, насколько кислым или основным является вещество) в крови. Шкала pH варьируется от 0 (сильно кислая) до 14 (сильно щелочная / щелочная). PH крови поддерживается между 7,35 и 7,45, что является слегка щелочным. Если кровь становится слишком кислой (состояние, известное как ацидоз), это означает, что уровень водорода (H + ) в крови чрезмерен. Если кровь становится слишком щелочной / щелочной (состояние, известное как алкалоз), это означает, что уровень H + в крови недостаточен.Даже небольшое изменение pH крови может повлиять на функции организма. Два примера этого включают:
- Когда белки подвергаются действию кислот или оснований, белки меняют форму и перестают функционировать должным образом. Этот процесс разматывания белков и потери их формы и функции известен как денатурация. Денатурация белков также происходит при воздействии тепла, тяжелых металлов, алкоголя и других повреждающих веществ.
- В главе 4 вы узнали, что кислая кровь (от кетоацидоза) в крайних случаях может привести к коме и / или смерти.
В организме есть несколько систем, которые поддерживают уровень pH крови в пределах нормы для предотвращения проблем. Некоторые белки действуют как буферы и выделяют водород (H + ) в кровь, если он становится слишком щелочным. Белки также могут забирать водород из крови, если она становится слишком кислой. Выделяя и принимая водород, когда это необходимо, белки поддерживают кислотно-щелочной баланс и поддерживают pH крови в пределах нормы.
Транспорт
Белки также играют роль в транспорте питательных веществ.Мембрана клетки обычно непроницаема для больших молекул. Чтобы доставить необходимые питательные вещества и молекулы в клетку, в клеточной мембране существует множество транспортных белков. Некоторые из этих белков действуют как каналы, которые позволяют определенным молекулам входить и выходить из клеток. Другие действуют как такси с односторонним движением и требуют энергии для работы (Рисунок \ (\ PageIndex {2} \)).
Рисунок \ (\ PageIndex {2} \): Молекулы входят и выходят из клеток через транспортные белки, которые являются либо каналами, либо переносчиками. Облегченная диффузия в клеточной мембране, показаны ионные каналы (слева) и белки-носители (три справа).(CC0; от LadyofHats через Wikimedia Commons)
.
Антитела
Наша иммунная система предназначена для атаки и уничтожения посторонних веществ. Когда инородное вещество атакует организм, иммунная система вырабатывает антитела (Рисунок \ (\ PageIndex {3} \)) для защиты от него. Антитела — это особые белки, которые распознают уникальную молекулу вредоносных бактерий и вирусов, известную как антиген. Антитела связываются с антигеном и разрушают его. Антитела также запускают другие факторы иммунной системы для поиска и уничтожения нежелательных злоумышленников.
Рисунок \ (\ PageIndex {3} \): Антитела — это белки, которые окружают чужеродные вещества и атакуют их, прикрепляясь к антигенам на поверхности чужеродного вещества. Каждое антитело связывается с определенным антигеном; взаимодействие, подобное замку и ключу. (общественное достояние; Фвасконселлос через Wikimedia Commons)
Заживление ран, регенерация тканей и функция нервов
Белки участвуют во всех аспектах заживления ран, процесса, который проходит в три фазы: воспаление, разрастание и ремоделирование.Например, если у вас есть небольшой порез, ваша кожа покраснеет и воспаляется. Процесс заживления начинается с белков, таких как брадикинин, которые расширяют кровеносные сосуды в месте повреждения. Дополнительный белок, называемый фибрином, помогает защитить тромбоциты, которые образуют сгусток, чтобы остановить кровотечение. Затем, в фазе пролиферации, клетки перемещаются и восстанавливают поврежденную ткань, устанавливая новые коллагеновые (белковые) волокна. Волокна коллагена помогают сблизить края раны. В фазе ремоделирования откладывается больше коллагена, образуя рубец.Рубцовая ткань только на 80 процентов функциональна, чем нормальная неповрежденная ткань. Если в диете недостаточно белка, процесс заживления ран заметно замедляется.
В то время как заживление ран происходит только после получения травмы, в организме продолжается другой процесс, называемый регенерацией тканей. Во время регенерации ткани создается точная структурная и функциональная копия старой ткани. В конце концов, старая ткань заменяется новой, полностью функциональной тканью. Ячейки постоянно ломаются, ремонтируются и заменяются.Когда белки в клетках расщепляются, аминокислоты перерабатываются в новые белки. Некоторые клетки (например, клетки кожи, волос, ногтей и кишечника) имеют очень высокую скорость регенерации, в то время как другие (например, клетки сердечной мышцы и нервные клетки) не регенерируют на каких-либо заметных уровнях. Регенерация тканей — это создание новых клеток (деление клеток), для которого требуется множество различных белков, включая ферменты, транспортные белки, гормоны и коллаген. Клетки, выстилающие кишечник, восстанавливаются каждые три-пять дней.Неадекватные белковые диеты ухудшают регенерацию тканей, вызывая множество проблем со здоровьем, включая нарушение переваривания и усвоения питательных веществ.
Аминокислоты могут использоваться для создания нейромедиаторов (например, адреналина), которые передают сообщения от одной нервной клетки к другой.
Источник энергии
Некоторые аминокислоты в белках можно разобрать и использовать для производства энергии. У здоровых людей белок мало способствует удовлетворению потребностей в энергии. Если диета человека не содержит достаточного количества углеводов и жиров, его организм будет использовать аминокислоты для производства энергии.Когда белки необходимы для получения энергии, они берутся из крови и тканей тела (например, мышц). Чтобы использовать белки для получения энергии, требуется дезаминирование. Дезаминирование — это процесс, при котором аминогруппа удаляется из аминокислоты, а азот транспортируется в почки для экскреции. Остальные компоненты метаболизируются для получения энергии. Чтобы защитить ткани нашего организма от расщепления для получения энергии, важно потреблять достаточное количество жиров и углеводов. Также важно отметить, что наш организм не может накапливать избыток белка.Избыточное потребление белка приводит к выведению азота; остальные компоненты используются для получения энергии или превращаются в жир для дальнейшего использования.
Основные выводы
- Белки выполняют множество функций, в том числе: действуют как ферменты и гормоны, поддерживают надлежащий водный и кислотно-щелочной баланс, обеспечивают транспорт питательных веществ, вырабатывают антитела, обеспечивают заживление ран и регенерацию тканей, а также обеспечивают энергией при недостаточном потреблении углеводов и жиров.
- Без адекватного потребления белка, содержащего все незаменимые аминокислоты, функции белков будут нарушены.
Роль белков в организме — Science Learning Hub
Белки — это молекулы, состоящие из аминокислот. Они кодируются нашими генами и составляют основу живых тканей. Они также играют центральную роль в биологических процессах. Например, белки катализируют реакции в нашем организме, транспортируют молекулы, такие как кислород, поддерживают наше здоровье как часть иммунной системы и передают сообщения от клетки к клетке.
Синтез белка
Ген — это сегмент молекулы ДНК, который содержит инструкции, необходимые для создания уникального белка.Все наши клетки содержат одни и те же молекулы ДНК, но каждая клетка использует различную комбинацию генов для создания определенных белков, необходимых для выполнения своих специализированных функций.
Синтез белка имеет 2 основных этапа. 1-й этап известен как транскрипция, когда образуется молекула-мессенджер (мРНК). Эта молекула транскрибируется с молекулы ДНК и несет копию информации, необходимой для создания белка. На 2-м этапе молекула мРНК покидает ядро в цитоплазму, где рибосомы клетки считывают информацию и начинают сборку белка в процессе, называемом трансляцией.
Во время трансляции рибосомы считывают последовательность мРНК из 3 оснований за раз.Каждая из этих трехбуквенных комбинаций (называемых кодонами) кодирует определенную аминокислоту. Например, последовательность оснований ТТТ кодирует аминокислоту лизин.
Существует 4 основания (аденин, тимин, гуанин и цитозин) и, следовательно, 64 (4 3 ) возможных кодонов, определенных с использованием некоторой комбинации 3 оснований. Однако для построения всех белков в нашем организме требуется всего 20 аминокислот (для некоторых аминокислот требуется более 1 кодона). Именно конкретная последовательность аминокислот определяет форму и функцию белка.
На синтез белка, как и на многие другие биологические процессы, могут влиять факторы окружающей среды. К ним относятся питание матери, температурный стресс, уровень кислорода и воздействие химикатов.
Различные типы белков
В нашем организме существует много разных типов белков. Все они играют важную роль в нашем росте, развитии и повседневном функционировании. Вот несколько примеров:
- Ферменты — это белки, которые облегчают биохимические реакции, например, пепсин — это пищеварительный фермент в желудке, который помогает расщеплять белки в пище.
- Антитела — это белки, вырабатываемые иммунной системой для удаления посторонних веществ и борьбы с инфекциями.
- ДНК-ассоциированные белки регулируют структуру хромосом во время деления клеток и / или играют роль в регуляции экспрессии генов, например, гистоны и белки когезина
- Сократительные белки участвуют в сокращении и движении мышц, например, актин и миозин
- Структурные белки обеспечивают поддержку в нашем организме, например, белки в наших соединительных тканях, такие как коллаген и эластин.
- Гормональные белки координируют функции организма, например, инсулин контролирует концентрацию сахара в крови, регулируя поглощение глюкозы клетками.
- Транспортные белки перемещают молекулы по нашему телу, например, гемоглобин переносит кислород по крови.
Альтернативные роли белков
Каждый белок играет определенную роль в нашем организме. Однако ученые обнаружили, что некоторые белки выполняют более одной роли.
Например, д-р Джулия Хорсфилд возглавляет группу по структуре и развитию хромосом в Университете Отаго.Ее лаборатория исследует, как белки когезина, которые регулируют структуру хромосом во время деления клеток, также участвуют в обеспечении того, чтобы гены включались или выключались в нужное время во время развития. Джулия и ее коллеги сосредотачиваются на влиянии снижения содержания белков когезина на экспрессию генов у рыбок данио и используют эти результаты для лучшего понимания конкретных заболеваний человека
Полезная ссылка
Посетите веб-сайт Learn Genetics, чтобы отправиться в анимированные туры по ДНК, генам и т. Д. хромосомы, белки, наследственность и признаки.
Белок: источники, дефицит и потребности
Белок — важная часть любой диеты. Количество белка, необходимое человеку, зависит от его возраста и пола.
Белок является частью каждой клетки тела. Он помогает организму строить и восстанавливать клетки и ткани. Белок является основным компонентом кожи, мышц, костей, органов, волос и ногтей.
По данным Управления по санитарному надзору за качеством пищевых продуктов и медикаментов (FDA), большинство людей в Соединенных Штатах получают достаточно белка из своего рациона для удовлетворения своих потребностей.
В этой статье рассматривается белок, его функции, источники и количество белка, необходимое разным группам людей каждый день.
Белок — один из трех макроэлементов, которые необходимы организму в больших количествах. Другие макроэлементы — это жиры и углеводы.
Белок состоит из длинных цепочек аминокислот. Всего 20 аминокислот. Определенный порядок аминокислот определяет структуру и функцию каждого белка.
20 аминокислот, которые организм использует для создания белка:
- аланин
- аргинин
- аспарагин
- аспарагиновая кислота
- цистеин
- глутаминовая кислота
- глютамин
- лизин
- метионин
- фенилаланин
- пролин
- серин
- треонин
- триптофан
- тирозин
- девяти валин
1 гистицин
1 глютамин
1 лейцин
диета.
Белки могут быть полными или неполными. Полноценные белки — это белки, содержащие все незаменимые аминокислоты. Продукты животного происхождения, соя и киноа являются полноценными белками.
Неполные белки — это белки, не содержащие всех незаменимых аминокислот. Большинство растительных продуктов содержат неполные белки, включая бобы, орехи и злаки.
Люди могут комбинировать неполные источники белка, чтобы приготовить еду, которая содержит все незаменимые аминокислоты. Примеры включают рис и бобы или арахисовое масло на цельнозерновом хлебе.
Что делает белок в организме?
Белок присутствует в каждой клетке организма, и его адекватное потребление важно для поддержания здоровья мышц, костей и тканей.
Белок играет роль во многих процессах организма, включая:
- свертывание крови
- баланс жидкости
- ответы иммунной системы
- зрение
- гормоны
- ферменты
Белок важен для роста и развития, особенно в период
детство, юность и беременность.
Согласно Руководству по питанию для американцев на 2015–2020 гг., Здоровый режим питания включает в себя разнообразные продукты, содержащие белок. И животные, и растительные продукты могут быть отличными источниками белка.
Руководящие принципы классифицируют следующие продукты как белковые:
- морепродукты
- нежирное мясо и птица
- яйца
- бобовые, в том числе фасоль и горох
- орехи
- семена
- соевые продукты
такие как молоко, сыр и йогурт, также содержат белок.Цельнозерновые и овощи содержат некоторое количество белка, но обычно меньше, чем другие источники.
Продукты животного происхождения, как правило, содержат больше белка, чем продукты растительного происхождения, поэтому людям, придерживающимся вегетарианской или веганской диеты, может потребоваться спланировать свое питание, чтобы обеспечить удовлетворение своих потребностей в белке.
Прочтите здесь о растительных источниках белка.
FDA сообщает, что люди могут определить, содержит ли пищевой продукт большое или низкое содержание белка, по этикетке.
Продукты, обеспечивающие 5% или менее дневной нормы человека, считаются продуктами с низким содержанием белка.
Продукты с содержанием белка 20% или более считаются продуктами с высоким содержанием белка.
Человеку не нужно употреблять продукты, содержащие все незаменимые аминокислоты, при каждом приеме пищи, потому что его организм может использовать аминокислоты из недавних приемов пищи для образования полноценного белка. Употребление разнообразных белковых продуктов в течение дня — лучший способ удовлетворить свои ежедневные потребности в белке.
Прочтите здесь о некоторых полезных для здоровья продуктах с высоким содержанием белка.
FDA рекомендует взрослым потреблять 50 граммов (г) белка в день в рамках диеты на 2000 калорий.Суточная норма человека может быть выше или ниже в зависимости от количества потребляемых калорий.
Рекомендации по питанию для американцев на 2015–2020 годы содержат следующие рекомендуемые суточные количества (RDA) белка по полу и возрастным группам:
На количество белка, необходимое человеку, могут влиять многие факторы, включая уровень активности, вес, рост и беременны ли они.
Другие переменные включают долю аминокислот, доступных в определенных белковых продуктах, и усвояемость отдельных аминокислот.
Министерство сельского хозяйства США предоставляет калькулятор, чтобы помочь людям определить, сколько белка и других питательных веществ им нужно.
Белок и калории
Белок — это источник калорий. Как правило, белки и углеводы содержат 4 калории на грамм. Жиры содержат 9 калорий на грамм.
В соответствии с рекомендациями по питанию для американцев от 10 до 35% ежедневных калорий взрослого человека должны поступать из белков. Для детей это 10–30%.
Большинство людей в США удовлетворяют свои ежедневные потребности в белке.В среднем мужчины получают 16,3% калорий из белков, а женщины — 15,8%.
Некоторые диеты рекомендуют употреблять больше белка, чтобы похудеть.
Aa 2015 обзор показывает, что соблюдение определенного типа высокобелковой диеты может способствовать снижению веса, но исследователям необходимо провести дополнительные исследования, чтобы установить, как эффективно применять такую диету.
Увеличивая потребление белка, важно убедиться, что в рационе все еще содержится достаточное количество клетчатки, такой как фрукты, овощи и цельнозерновые продукты.
Замена обработанных пищевых продуктов и источников нездоровых жиров или сахара в рационе белком может способствовать здоровому питанию.
Прежде чем вносить существенные изменения в свой рацион, человеку рекомендуется поговорить со своим врачом о лучших стратегиях и советах.
О диетах с высоким содержанием белка читайте здесь.
Дефицит белка из-за низкого потребления белка с пищей необычен для США
Однако нехватка белка в других странах вызывает серьезную озабоченность, особенно у детей.Дефицит белка может привести к недоеданию, например квашиоркору и маразму, которые могут быть опасными для жизни.
Дефицит белка может возникнуть, если у человека есть состояние здоровья, в том числе:
Очень низкое потребление белка может привести к:
- слабому мышечному тонусу
- отеку или отеку из-за задержки жидкости
- тонких, ломких волос
- кожи поражения
- у взрослых, потеря мышечной массы
- у детей, дефицит роста
- дисбаланс гормонов
Протеиновые коктейли и протеиновые порошки содержат большое количество протеина.Протеиновые порошки могут содержать 10–30 г белка на мерную ложку. Они также могут содержать добавленный сахар, ароматизаторы, витамины и минералы.
Белок в протеиновых коктейлях или порошках может поступать из:
- растений, таких как горох или соевые бобы
- молоко, такое как казеин или сывороточный протеин
- яйца
Для наращивания и восстановления мышц необходим белок. Многие спортсмены и бодибилдеры используют белковые продукты для ускорения роста мышц.
В настоящее время доступен широкий спектр протеиновых добавок, многие утверждают, что они способствуют снижению веса и увеличению мышечной массы и силы.
В обзоре 2018 года сообщается, что прием белковых добавок значительно улучшает размер и силу мышц у здоровых взрослых, которые выполняют упражнения с отягощениями, такие как поднятие тяжестей.
Однако протеиновые коктейли и порошки считаются диетическими добавками, поэтому они не регулируются Управлением по санитарному надзору за качеством пищевых продуктов и медикаментов (FDA). Это означает, что люди не могут гарантировать, что продукты содержат то, что заявляет производитель.
Некоторые добавки могут также содержать запрещенные или вредные для здоровья вещества, такие как тяжелые металлы или пестициды.
Многие белковые продукты содержат много добавленного сахара и калорий, что может привести к скачкам сахара в крови и увеличению веса, поэтому важно проверять этикетки.
Большинство людей, включая спортсменов, могут получать достаточное количество белка из сбалансированной диеты без добавок. Постоянный прием слишком большого количества белка может вызвать серьезные проблемы со здоровьем.
Некоторым людям может быть полезно использовать протеиновый порошок для решения проблем со здоровьем, в том числе тех, у кого:
- снижение аппетита, которое может быть результатом пожилого возраста или лечения рака
- рана, которая плохо заживает, поскольку белок может помочь восстановление организма и замена клеток
- заболевание, такое как серьезный ожог, которое требует дополнительных калорий и белка
Для большинства людей разнообразная и здоровая диета обеспечит достаточным количеством белка.Для максимальной пользы для здоровья люди могут получать белок из различных источников. К ним относятся рыба, мясо, соя, бобы, тофу, орехи и семена.
Вот несколько советов по добавлению большего количества белка в рацион:
- Замените обычные закуски закусками с высоким содержанием белка, такими как орехи, жареный нут и арахисовое масло.
- Добавляйте фасоль и горох в супы, гарниры или салаты. Из них также получаются отличные основные блюда.
- Включайте один продукт с высоким содержанием белка в каждый прием пищи.
- Замените источник углеводов источником белка, например, заменив утром кусок тоста на яйцо.
- Прежде чем добавлять протеиновые батончики в рацион, проверьте этикетки, так как они могут содержать большое количество сахара.
Чтобы ограничить потребление жиров при увеличении потребления белка, выбирайте нежирное мясо, птицу и молочные продукты или обрезайте жир перед едой. Попробуйте использовать методы приготовления, при которых не добавляется лишний жир, например приготовление на гриле.
Избегайте обработанного мяса и других обработанных пищевых продуктов, так как они могут иметь негативные последствия для здоровья.По возможности выбирайте продукты, богатые питательными веществами, а не обработанные.
Белок — важная часть любой диеты. FDA рекомендует взрослым потреблять 50 граммов (г) белка в день в рамках диеты, состоящей из 2000 калорий, хотя конкретные потребности человека зависят от его возраста, пола, уровня активности и других факторов.
Большинство людей в США удовлетворяют свои ежедневные потребности в белке. Если человек хочет увеличить потребление белка, он может сделать это, добавляя здоровую пищу с высоким содержанием белка в каждый прием пищи.
Структура и функции белка — Биохимия
Белки являются наиболее универсальными
макромолекул в живых системах и выполняют важные функции практически во всех биологических
процессы. Они действуют как катализаторы, они переносят и хранят другие молекулы, такие как кислород, они
обеспечивают механическую поддержку и иммунную защиту, они генерируют движение, передают нервы
импульсы, и они контролируют рост и дифференциацию. Действительно, большая часть этого текста будет посвящена
понимание того, что делают белки и как они выполняют эти функции.
Несколько ключевых свойств
позволяют белкам участвовать в таком широком спектре функций.
- 1.
Белки представляют собой линейные полимеры
построен из мономерных единиц, называемых аминокислотами . Строительство огромного множества
макромолекулы из ограниченного числа строительных блоков мономеров — повторяющаяся тема в
биохимия. Зависит ли функция белка от линейной последовательности аминокислот? Функция
белок напрямую зависит от его трехмерной структуры ().Примечательно, что белки спонтанно складываются в трехмерные объекты.
структуры, которые определяются последовательностью аминокислот в белковом полимере. Таким образом,
Белки являются воплощением перехода от одномерного мира последовательностей к
трехмерный мир молекул, способных к разнообразным
деятельность .- 2.
Белки содержат
широкий спектр функциональных групп . Эти функциональные группы включают спирты, тиолы,
тиоэфиры, карбоновые кислоты, карбоксамиды и различные основные группы.В сочетании с различными
последовательности, этот набор функциональных групп отвечает за широкий спектр функций белка. Для
Например, химическая реакционная способность, связанная с этими группами, важна для функции
ферментов, белков, катализирующих определенные химические реакции в биологических
системы (см. главы 8–10).- 3.
Белки могут взаимодействовать друг с другом и с другими биологическими макромолекулами с образованием сложных ансамблей .Белки в этих сборках могут действовать синергетически, генерируя возможности, не предоставляемые отдельными составляющими белками (). Эти сборки включают макромолекулярные машины, которые выполняют точную репликацию ДНК, передачу сигналов внутри клеток и многие другие важные процессы.
- 4.
Некоторые белки довольно жесткие, тогда как другие обладают ограниченной гибкостью . Жесткие единицы могут функционировать как структурные элементы в цитоскелете (внутреннем каркасе внутри клеток) или в соединительной ткани.Части белков с ограниченной гибкостью могут действовать как шарниры, пружины и рычаги, которые имеют решающее значение для функции белков, для сборки белков друг с другом и с другими молекулами в сложные единицы, а также для передачи информации внутри и между клетками () .
Рисунок
Кристаллы человеческого инсулина. Инсулин — это белковый гормон, имеющий решающее значение для поддержания необходимого уровня сахара в крови. (Ниже) Цепочки аминокислот в определенной последовательности (первичная структура) определяют такой белок, как инсулин.Эти цепочки складываются в четко определенные (подробнее …)
Рисунок 3.1
Структура определяет функцию. Белковый компонент механизма репликации ДНК окружает часть двойной спирали ДНК. Структура белка позволяет копировать большие сегменты ДНК без отделения репликационного аппарата от (подробнее …)
Рисунок 3.2
Комплексный белковый узел. Электронная микрофотография ткани полета насекомого в поперечном сечении показывает гексагональный массив из двух видов белковых нитей.[Любезно предоставлено доктором Майклом Риди.]
Рис. 3.3
Гибкость и функциональность. Связывая железо, белок лактоферрин претерпевает конформационные изменения, которые позволяют другим молекулам различать формы, не содержащие железа, и связанные с железом.
Свойства и функции белков (открытый урок) — Свойства и функции белков (открытый урок)
Муниципальное общеобразовательное
учреждение лицей №32 г. Белгород
Открытый урок по биологии
10 «а» класс
(с углубленным изучением биологии)
Тема: «Свойства и функции белков»
Учитель биологии:
Тарасова Валентина
Михайловна
Белгород 2012
Урок
Тема: Свойства и функции белков.
Цели:
1. Познавательные:
-сформировать знания о свойствах и функциях белков;
-углубить и расширить знания о важнейшей роли белков в жизнедеятельности живых организмов на основе изучения их свойств и функций;
-сформировать понятие о ферментах;
-продолжить формирование умения выявлять взаимосвязь строения и функций веществ.
2. Развивающие:
-развивать умение работать с микроскопом, проводить эксперимент, анализировать результат лабораторных опытов, устанавливать причинно-следственные связи между явлениями живой и неживой природы;
-развивать познавательный интерес учащихся на основе использования межпредметных связей;
-развивать умение применять знания, полученные на уроках биологии, к анализу явлений или процессов, изучаемых другими науками;
-совершенствовать навыки учащихся работы с учебником.
3. Воспитательные:
-формирование научного мировоззрения, чёткого представления о роли естественных наук в современном обществе;
-создание в представлении учащихся общей, целостной картины мира с его единством и многообразием свойств живой и неживой природы;
-воспитывать культуру труда, осуществлять формирование гигиенических навыков учащихся, заботы о здоровье.
Оборудование:
микроскопы, предметные и покровные стёкла, штативы с пробирками, реактивы для проведения лабораторной работы, мультимедийная презентация.
План урока.
I. Актуализация опорных знаний.
II. Изучение темы урока..Постановка познавательной задачи.
1.Свойства белков: физические, химические.
2.Функции белков.
-Лабораторная работа.
«Наблюдение расщепления пероксида водорода ферментом каталазой».
-Работа учащихся в бригадах по изучению функций белков. Решение биологических задач.
-Мозговой штурм. Обсуждение результатов работы учащихся в бригадах.
— III. Закрепление знаний по изученной теме.
Заполнение схемы «Функции белков».
IV. Итог урока.
Тестовый контроль по изученной теме.
V. Домашнее задание.
I Организационный момент.
ВНИМАНИЕ! Ребята, начинаем урок.
Выделяйте главное, проводите анализ взаимосвязи строения и функций биологических структур, молекул органических соединений.
II Актуализация опорных знаний
Учитель: Эпиграфом урока станут высказывания Ф.Энгельса о том, что такое жизнь;
« Жизнь есть способ существования белковых тел, существенным моментом которого является постоянный обмен веществ с окружающей их внешней природой…».
Учитель: Выделите ключевые слова в этом определении понятия «жизнь»?
«Жизнь есть способ существования белковых тел…»
Ф.Энгельс.
Учитель: Как вы понимаете эту фразу?
Ни одно из веществ не выполняет столь специфических и разнообразных функций в организме, как белок, в организме до 100 000 видов белков.
В состав клеток организма входят не только белки, но и жиры, углеводы, нуклеиновые кислоты, вода, минеральные соли. Но именно ”белки являются основой жизни ”. Справедливо ли это?
Учитель: Ребята, продолжим изучение темы ”Белки”
(Демонстрация 1 слайда)
Сегодня подробно изучим “свойства и функции белков”.
Запись темы урока учащихся в тетрадь.
Результатом работы станет схема “функции белков”, которую вы видите на опорном конспекте.
Давайте вместе подумаем над целью урока, чтобы разрешить проблему:
”Белки являются основой жизни, справедливо ли это?”
Цель урока:
(Демонстрация 2 слайда)
1.Выяснить, действительно ли белки являются “основой жизни”;
2.Доказать, что белки это “основа жизни” на основе изучения свойств и функций белков.
Учитель: Чтобы достичь цели урока нужно составить план мыслительной деятельности.
План
мыслительной деятельности.
(Демонстрация 3 слайда)
1.Структура белковой молекулы
2.Многообразие и классификация белков
3.Свойства белков
4.Функции белков
Учитель: Чем определяется основное значение белков для живых организмов?
Чтобы ответить на этот вопрос проведём биологическую разминку.
Биологическая разминка.
(Демонстрация 4 слайда)
1. Какие соединения называют белками?
2. Что такое первичная структура белковой молекулы.
3. Как образуется вторичная, третичная, четвертичная структура белковой молекулы?
4. Какая структура белковой молекулы обеспечивает свойства белка и её пространственную конфигурацию?
Учитель: Ребята, чем глубже учёные познают природу и строение белковых тел, тем более они убеждаются в исключительном значении установления связи между структурой и функцией белковых молекул для раскрытия одной из важнейших тайн природы — тайны жизни.
Итак, что вы знаете о белках, что хотите узнать о белках?
|
Что мы знаем о белках |
Что хотим узнать |
Что узнали
|
|
1) состоят из аминокислот 2) уровни организации Первичная Вторичная Третичная Четвертичная
|
Классификация свойства
функции
|
|
Учитель: Сложность строения белков молекул, а также чрезвычайное разнообразие их функций затрудняют создание единой классификации на одной основе.
(Демонстрация 5 слайда)
(Демонстрация 6 слайда)
(Демонстрация 7 слайда
Учитель: Ребята выполнили самостоятельное исследовательское задание и расскажут о результатах.
Ученик:
1)Физико-химические свойства белков определяются их высокомолекулярной природой, укладкой полипептидной цепи и взаимным расположением остатков аминокислот. Молекулярная масса от 5000 до 1мнл.
Белки преимущественно растворимы в воде и проявляют функциональную активность в растворах.
2)Они несут большой поверхностный заряд, что определяет изменение проницаемости мембраны клетки, каталитической активности.
3)Белки термолабильны т.е проявляют активность в узких температурных рамках.
4)При повышенной температуре, изменении рН среды происходит денатурация т.е разрушения четвертичной , третичной и даже вторичной структуры.
5)Если не разрушена первичная структура, то при восставлении нормальных условий воссоздаётся структура белка и функциональная активность т.е. ренатурация. Это свойство используют в медицине для приготовления вакцин.
6)Белки с солями лёгких металлов образуют осадок, который можно растворить вновь, но при действии солей тяжелых металлов (Pb, Hg) происходит необратимое свёртывание.
Ученик. Демонстрация опыта.
7)Для белков характерны цветные реакции:
1. К 2 мл. раствора белка добавили Na OH и по каплям CuSO4 пробирку встряхнуть, наблюдаем красно-фиолетовое окрашивание — это биуретовая реакция на пептидную связь.
2.К 2мл. раствора белка добавили HNO3 осторожно подогрели — наблюдаем жёлтое окрашивание- это реакция на ароматические аминокислоты.(триптофан, тирозин, фенилаланин.)Это реакция ксантопротеиновая.
3.К раствору белка прилили ацетат свинца и NaOH подогрели выпавший осадок чёрного цвета, что указывает на содержание S (сульфид свинца).
Ученик. Демонстрация опыта.
8)Гидролиз белка. Опыт выполняется заранее. В две пробирки прилили по 2мл. раствора белка куриного яйца, затем в 1- добавить насыщенный раствор фестала. Это лекарственный препарат, содержащий ферменты, облегчающие пищеварение, в том числе и протеазу, которая гидролизует белки. Затем на 30 минут поместили водяную баню при t-37oC. По окончании «переваривания белка» добавили в обе раствор сульфата аммония. В 1-осадка нет, белок подвергается гидролизу, во 2-контрольной образуется обильный осадок-произошла денатурация.
Гидролиз белка при переваривании заключается в том, что они гидролизуются до аминокислот, которые хорошо растворимы, и проникают в кровь, затем в клетки и используются на синтез белков свойственных данному организму.
Учитель.
Биологическая задача
1.Почему врачи рекомендуют принимать жаропонижающие лекарства, если у больного температура превышает 38оC?
2.Почему из сваренного яйца никогда не появится цыплёнок?
3.Почему работникам химических производств, при отравлениях солями тяжелых металлов (Cu,Pb,Ng) пострадавшим дают молоко? Дайте гигиеническое обоснование для изучений функций белка?
Учитель: Ребята, для дальнейшего изучения функций белка
выполните самостоятельно поисковое задание на стр.96-97. учебника.
Ответьте на вопросы:
Поисковое задание
(Демонстрация 8 слайда)
1.Что представляют ферменты?
2.Каковы их функции?
3.В чём сущность каталитической реакции?
4.Чем отличается фермент от катализатора?
5.Как факторы влияют на работу фермента?
6. Что вы узнали о ферменте каталаза?
(Демонстрация 9 слайда)
Учитель: Сущность каталитической реакции сводится к тому, что исходное вещество образует с катализаторами промежуточные соединения. Они быстро превращаются в конечные продукты реакции, а катализаторы восстанавливаются.
Ферменты имеют белковую природу; функционируют в клетке. Неорганические катализаторы применяются в различных реакциях.
Фермент специфичен, катализирует один вид реакции, активен при t = 35 — 38oC, (при высокой происходит денатурация), при физиологических значениях PH совместимых с жизнью и нормальном атмосферном давлении.
Учитель: В чём сущность каталитической активности фермента?
В молекуле ферменты есть активный центр, он состоит из двух участков — сорбционного и каталитического. Первый отвечает за связывание фермента с молекулой субстрата, второй за протекание собственно катализа.
Молекулы ферментов имеют третичную или четвертичную структуру. Их каталитическая функция обусловлена особой частью их поверхности- активным центром он представляет собой углубление, которое образуется при укладке белковой структуры (третичной или четвертичной). Это сочетание радикалов расположенных на соседних полипептидных цепях в 3 или 4 структуре.
Оно в точности соответствует молекуле участвующей в реакции, катализатором которой служит фермент. Подобно тому, как ключ к замку, так активный центр фермента соответствует субстрату. Продукты реакции не подходят и быстро отделяются от молекулы. При воздействиях t, PH происходит утрата функции денатурации.
Учитель: Чтобы познакомиться с функцией фермента каталаза выполним
Исследовательское задание
Инструктивная
карточка
«Наблюдение расщепления пероксида
водорода ферментом каталазой»
(Демонстрация 10 слайда)
ЦЕЛЬ: закрепить умения учащихся проводить опыты, готовить микропрепараты и рассматривать их под микроскопом;
— убедиться в наличии каталазы в растительной и животной клетках;
Оборудование: микроскопы, предметные и покровные стекла, вода, пипетки, элодея, пероксид водорода, таблицы по общей биологии, иллюстрирующие строение и функции белков.
Ход работы
1. Прилейте по 2 мл Н2О2 (пероксида водорода) в пробирки с кусочком почки млекопитающего, с сырым картофелем, с кусочком вареного картофеля.
2. Запишите наблюдаемые вами явления при действии пероксида водорода на живые клетки растительной и животной ткани и на мертвые клетки (в пробирке с вареным картофелем).
3. Приготовьте микропрепарат листа элодеи и рассмотрите под микроскопом, зарисуйте состояние клеток листа.
4. Нанесите на микропрепарат пероксид водорода и наблюдайте за изменением состояния клеток элодеи;
5. Нанесите каплю пероксида на пустое предметное стекло, отметьте, что будет происходить. Сравните состояние пероксида водорода на чистом предметном стекле и на листе элодеи;
6.Сделайте вывод о наличии в растительных и животных клетках особого фермента и его роли.
u Ответьте на вопросы:
— Какова цель предложенной вам лабораторной работы.
— Объясните свои наблюдения.
— Почему в опыте в пробирках с кусочками сырого картофеля и кусочком почками млекопитающего, а также при действии пероксида водорода на клетку листа элодеи происходит бурное выделение пузырьков газа?
— Почему не выделяются пузырьки газа в том случае, если капнуть пероксидом водорода в пробирку с варёным картофелем или на пустое предметное стекло.
Учитель: Ребята, для дальнейшего изучения функции белков разделитесь на бригады по 4 человека. Решим биологические задачи.
(Демонстрация 11 слайда)
Биологические задачи
1.Многие гормоны имеют белковую природу. Какова роль инсулина и глюкагона? Дайте название функции белка?
(Регуляторная функция)
2.Единицей мышечного волокна является саркомер, образованный толстыми и тонкими нитями. Толстые из белка – миозина, тонкие из белка актина. При сокращении мышцы, «головки» выступающие из молекул миозина, прикрепляются к актиновым нитям и начинает вращаться обеспечивая движения толстых нитей относительно друг друга. Исходя из сведений назовите ещё одну функцию белка.
(Двигательная функция.)
3. В пробирку с мясным бульоном добавьте 2-3 мл раствора Na OH и 2 мл раствора Cu SO4. Какие вы наблюдали изменения? О чём они свидетельствуют? Из чего построены мышечные ткани? Какую функцию выполняют белки в живом организме?
(Строительная функция.)
4.Вспомните какой белок ходит в состав эритроцитов. Какова функция эритроцитов. Назовите функцию этого белка? Приведите примеры белков выполняющих транспортную.
5.Сравните по калорийности продукты питания
|
Продукты |
Белки |
Жиры |
Углеводы |
Калорийность |
|
Говядина отварная |
35 |
10 |
|
216 |
|
Растительное масло |
0 |
100 |
0 |
899 |
|
Сахар рафинад |
0 |
0 |
100 |
394 |
Какие из продуктов питания являются более энергетически выгодными?
Какие вы выберите и почему?
Назовите ещё одну функцию белка?
Если энергетическая функция для белков не является самой важной, то почему наша должна содержать белки?
6. При повреждении ткани из неё вытекает кровь, которая вскоре свёртывается, образуется кровяной сгусток. Он препятствует потере крови, и проникновению в организм болезненных бактерий. Кровяной сгусток- тромб. Он образован перепутанными нитями фибрина, нерастворимого фибриллярного белка и форменными элементами крови, запутавшимися в них исходя из полученных сведений, назовите ещё одну функцию белков.
(Защитная функция.)
7. Для предупреждения инфекционных заболеваний людям вводят вакцину. Что такое вакцина? Дайте биологическое обоснование вакцинации?
Учитель. Ребята проведём мозговой штурм.
Результаты решения биологических задач.
Учитель. Зашитая функция белков связанна с выработкой антител – особых белковых веществ в ответ на проникновение чужеродных белков или микро- организмов, антитела обладают специфичностью распознавать различные виды чужеродных веществ. Такие антитела называют иммуноглобулинами. Чужеродные белки узнаваемые антителами называются антигенами, ими являются бактерии, вирусы и их токсины. Антитела присоединяются к ним привлекая особые ферменты, которые растворяют оболочки и уничтожают их. Лимфоциты обладают способностью синтезировать одну разновидность иммуноглобулинов.
Чтобы предупредить инфекционные болезни людям вводят вакцину это ослабление бактерии или вируса, которые стимулируют синтез лимфоцитами антител. При попадании неослабленных бактерий или вирусов они встречают прочный барьер из антител.
Что такое вакцина? Для чего используется?
Учитель. В клетках также синтезируются интерферон — специальный противовирусный белок, который блокирует синтез вирусных белков.
В организме человека постоянно работает иммунная система.
(Демонстрация 12 слайда)
Фагоциты буквально набрасываются на проникшие в организм вирусы и бактерии, затем подключаются и гигантские фагоциты, они способны захватывать и погашать пришельцев. Наиболее действенное орудие иммунной системы — небольшие тела в форме (игрека «у»), они прилипают к бактериям и вирусам, маркирующих для фагоцитоза.
Закрепление знаний по изученной теме
Обсуждение результатов работы в группах
Заполнение схемы «Функции белков»
(Демонстрация 13 слайда)
Учитель Вернёмся к проблеме урока
«Белки являются основой жизни» справедливо ли это?
Ответы учащихся.
Итог урока. Рефлексия.
1) Что вы считаете для себя главным на уроке?
2) Что наиболее запомнилось?
3) Что было трудным?
4) Как вы себя чувствовали на уроке?
5) Если вы были внимательны и уверенны в себе что все изученные вопросы усвоили поставьте себе «5»
6) Если вы были внимательными, усвоили материал в целом, но на вопросы ответить можете поставьте «4»
7) Кто сомневается поставьте себе «3»
8) Поднимите руку, кто поставил «5» «4»
Тестовый контроль знаний
(Демонстрация 14 слайда)
Д/З: Выучить опорный конспект, дайте определение словарным терминам, используя конспект урока, материал учебника § 3.2.1.
Инструктивная
карточка
«Наблюдение расщепления пероксида
водорода ферментом каталазой»
ЦЕЛЬ: закрепить умения учащихся проводить опыты, готовить микропрепараты и рассматривать их под микроскопом;
- убедиться в наличии каталазы в растительной и животной клетках;
Оборудование: микроскопы, предметные и покровные стекла, вода, пипетки, элодея, пероксид водорода, таблицы по общей биологии, иллюстрирующие строение и функции белков.
Ход работы
1. Прилейте по 2 мл Н2О2 (пероксида водорода) в пробирки с кусочком почки млекопитающего, с сырым картофелем, с кусочком вареного картофеля.
2. Запишите наблюдаемые вами явления при действии пероксида водорода на живые клетки растительной и животной ткани и на мертвые клетки (в пробирке с вареным картофелем).
3. Приготовьте микропрепарат листа элодеи и рассмотрите под микроскопом, зарисуйте состояние клеток листа.
4. Нанесите на микропрепарат пероксид водорода и наблюдайте за изменением состояния клеток элодеи;
5. Нанесите каплю пероксида на пустое предметное стекло, отметьте, что будет происходить. Сравните состояние пероксида водорода на чистом предметном стекле и на листе элодеи;
6.Сделайте вывод о наличии в растительных и животных клетках особого фермента и его роли.
Ответьте на вопросы:
- Какова цель предложенной вам лабораторной работы.
- Объясните свои наблюдения.
- Почему в опыте в пробирках с кусочками сырого картофеля и кусочком почками млекопитающего, а также при действии пероксида водорода на клетку листа элодеи происходит бурное выделение пузырьков газа?
- Почему не выделяются пузырьки газа в том случае, если капнуть пероксидом водорода в пробирку с варёным картофелем или на пустое предметное стекло.
ТЕСТ ПО ТЕМЕ «БЕЛКИ»
/ вариант
1. Выбери схему, соответствующую первичной структуре белка.
2. Определи термин, не подходящий по смыслу к слову «полимер»:
а) нуклеотид; б) мономер; в) дипептид.
3. Процесс утраты белковой молекулой своей структурной организации — это:
а) гидролиз; б) коагуляция; в) денатурация.
4. Какие структуры реализуют биологическую активность молекулы белка:
а) радикалы; б) полипептид; в) химические связи.
5. В образовании какой структуры принимают участие дисульфидные мостики:
а) вторичной; б) первичной; в) третичной.
ТЕСТ ПО ТЕМЕ «БЕЛКИ»
// вариант
Каких составных частей недостает в формуле аминокислоты:
2. В данной цепочке функциональных групп есть одна лишняя, определяющая иные свойства. Найди ее:
а)-NН2; б) — R; в)-СООН.
3. Процесс восстановления структурной организации белковой молекулы — это:
а) гидролиз; б) денатурация; в) ренатурация.
4. Какой уровень организации опосредованно определяет биологическую активность белка:
а) третичная; б) первичная;
в) вторичная структуры.
5. При денатурации происходит
разрушение структуры:
а) вторичной; б) первичной; в) третичной.
Опорный конспект по теме: « Белки».
«Жизнь есть способ существования белковых тел» Ф. Энгельс
Классификация белков по составу
Классификация белков по структуре
Классификация белков по структуре
|
Свойства белков
Свойства белков
Денатурация
Ренатурация
Гидролиз
Качественные реакции:
Биуретовая
Ксантопротеиновая
Функции белков
6 Основные функции белков | Здоровое питание
Эллен Суонсон Topness Обновлено 20 декабря 2018 г.
Белок — важное вещество, которое содержится в каждой клетке человеческого тела. На самом деле, за исключением воды, белок является самым распространенным веществом в вашем теле. Этот белок вырабатывается вашим организмом с использованием потребляемых вами пищевых белков. Он используется во многих жизненно важных процессах и поэтому требует постоянной замены. Вы можете добиться этого, регулярно употребляя продукты, содержащие белок.
Ремонт и обслуживание
Белок называют строительным блоком организма. Это называется так, потому что белок жизненно важен для поддержания тканей тела, включая развитие и восстановление. Волосы, кожа, глаза, мышцы и органы состоят из белка. Вот почему детям нужно больше белка на фунт веса тела, чем взрослым; они растут и развивают новые белковые ткани.
Энергия
Белок является основным источником энергии. Если вы потребляете больше белка, чем нужно для поддержания тканей тела и других необходимых функций, ваше тело будет использовать его для получения энергии.Если в этом нет необходимости из-за достаточного потребления других источников энергии, таких как углеводы, белок будет использоваться для создания жира и становится частью жировых клеток.
Гормоны
Белок участвует в выработке некоторых гормонов. Эти вещества помогают контролировать функции организма, связанные с взаимодействием нескольких органов. Инсулин, небольшой белок, является примером гормона, регулирующего уровень сахара в крови. Он предполагает взаимодействие таких органов, как поджелудочная железа и печень.Секретин — еще один пример белкового гормона. Это вещество помогает в процессе пищеварения, стимулируя поджелудочную железу и кишечник, чтобы вырабатывать необходимые пищеварительные соки.
Ферменты
Ферменты — это белки, которые увеличивают скорость химических реакций в организме. Фактически, большинство необходимых химических реакций в организме не могло бы происходить эффективно без ферментов. Например, один тип ферментов помогает переваривать большие молекулы белка, углеводов и жиров в более мелкие молекулы, а другой помогает создавать ДНК.
Транспортировка и хранение молекул
Белок является основным элементом транспортировки определенных молекул. Например, гемоглобин — это белок, который переносит кислород по всему телу. Белок также иногда используется для хранения определенных молекул. Ферритин — это пример белка, который соединяется с железом и хранится в печени.
Антитела
Белок образует антитела, которые помогают предотвратить инфекции, болезни и болезни. Эти белки идентифицируют и помогают уничтожить антигены, такие как бактерии и вирусы.Они часто работают вместе с другими клетками иммунной системы. Например, эти антитела идентифицируют, а затем окружают антигены, чтобы удерживать их, пока они не будут уничтожены лейкоцитами.
3.4 Белки — Биология для курсов AP®
Цели обучения
В этом разделе вы исследуете следующие вопросы:
- Каковы функции белков в клетках и тканях?
- Какая связь между аминокислотами и белками?
- Каковы четыре уровня белковой организации?
- Какая связь между формой и функцией белка?
Соединение для AP
® КурсыБелки представляют собой длинные цепи различных последовательностей из 20 аминокислот, каждая из которых содержит аминогруппу (-NH 2 ), карбоксильную группу (-COOH) и вариабельную группу.(Подумайте, сколько белковых «слов» можно составить из 20 «букв» аминокислот). Каждая аминокислота связана со своим соседом пептидной связью, образованной в результате реакции дегидратации. Длинная цепь аминокислот известна как полипептид. Белки выполняют в клетках множество функций. Они действуют как ферменты, которые катализируют химические реакции, обеспечивают структурную поддержку, регулируют прохождение веществ через клеточную мембрану, защищают от болезней и координируют сигнальные пути клетки. Структура белка организована на четырех уровнях: первичном, вторичном, третичном и четвертичном.Первичная структура — это уникальная последовательность аминокислот. Изменение только одной аминокислоты может изменить структуру и функцию белка. Например, серповидно-клеточная анемия возникает в результате замены одной аминокислоты в молекуле гемоглобина, состоящей из 574 аминокислот. Вторичная структура состоит из локального сворачивания полипептида за счет образования водородной связи; приводящие к конформациям α-спирали и β-складчатого листа. В третичной структуре различные взаимодействия, например водородные связи, ионные связи, дисульфидные связи и гидрофобные взаимодействия между группами R, способствуют укладке полипептида в различные трехмерные конфигурации.Большинство ферментов имеют третичную конфигурацию. Если белок денатурируется, теряет свою трехмерную форму, он может больше не функционировать. Условия окружающей среды, такие как температура и pH, могут денатурировать белки. Некоторые белки, такие как гемоглобин, образуются из нескольких полипептидов, и взаимодействия этих субъединиц образуют четвертичную структуру белков.
Представленная информация и примеры, выделенные в разделе, вспомогательные концепции и цели обучения, изложенные в Большой идее 4 Структуры учебной программы по биологии AP ® .Цели обучения, перечисленные в структуре учебной программы, обеспечивают прозрачную основу для курса биологии AP ® , лабораторного опыта на основе запросов, учебных мероприятий и экзаменационных вопросов AP ® . Цель обучения объединяет требуемый контент с одной или несколькими из семи научных практик.
| Большая идея 4 | Биологические системы взаимодействуют, и эти системы и их взаимодействия обладают сложными свойствами. |
| Постоянное понимание 4.A | Взаимодействия внутри биологических систем приводят к появлению сложных свойств. |
| Основные знания | 4.A.1 Компоненты биологических молекул и их последовательность определяют свойства этой молекулы. |
| Научная практика | 7,1 Учащийся может связывать явления и модели в пространственных и временных масштабах. |
| Цель обучения | 4,1 Учащийся может объяснить связь между последовательностью и подкомпонентами биологического полимера и его свойствами. |
| Основные знания | 4.A.1 Компоненты биологических молекул и их последовательность определяют свойства этой молекулы. |
| Научная практика | 1.3 Студент может уточнить представления и модели природных или антропогенных явлений и систем в предметной области. |
| Цель обучения | 4,2 Учащийся может уточнить представления и модели, чтобы объяснить, как субкомпоненты биологического полимера и их последовательность определяют свойства этого полимера. |
| Основные знания | 4.A.1 Компоненты биологических молекул и их последовательность определяют свойства этой молекулы. |
| Научная практика | 6,1 Студент может обосновать свои претензии доказательствами. |
| Научная практика | 6,4 Студент может делать утверждения и предсказания о природных явлениях на основе научных теорий и моделей. |
| Цель обучения | 4,3 Учащийся может использовать модели для прогнозирования и обоснования того, что изменения в подкомпонентах биологического полимера влияют на функциональность молекул. |
Поддержка учителей
Двадцать аминокислот могут быть преобразованы в практически неограниченное количество различных белков. Последовательность аминокислот в конечном итоге определяет окончательную конфигурацию белковой цепи, придавая молекуле ее специфическую функцию.
Поддержка учителей
Подчеркните, что белки выполняют в организме множество функций. Таблица 3.1 содержит несколько примеров этих функций. Обратите внимание, что не все ферменты работают в одинаковых условиях.Амилаза работает только в щелочной среде, такой как слюна, в то время как пепсин действует в кислой среде желудка. Обсудите другие материалы, которые могут переноситься белками в жидкостях организма в дополнение к веществам, перечисленным в тексте для транспортировки. Белки также переносят нерастворимые липиды в организме и заряженные ионы, такие как кальций, магний и цинк. Обсудите еще один важный структурный белок, коллаген, который содержится во всем теле, в том числе в большинстве соединительных тканей. Подчеркните, что не все гормоны являются белками и что гормоны на основе стероидов обсуждались в предыдущем разделе.
Аминогруппа аминокислоты теряет электрон и становится положительно заряженной. Карбоксильная группа легко получает электрон, становясь отрицательно заряженным. Это приводит к амфипатическим характеристикам аминокислот и придает соединениям растворимость в воде. Присутствие обеих функциональных групп также позволяет дегидратационному синтезу объединять отдельные аминокислоты в пептидную цепь.
Структура белка объясняется так, как будто она состоит из трех-четырех дискретных этапов.В действительности структурные изменения, в результате которых образуется функциональный белок, происходят непрерывно. Поскольку первичная структура формируется из рибосом, полипептидная цепь претерпевает изменения, пока не будет достигнута окончательная конфигурация. Предложите учащимся представить себе нитку спагетти, готовящуюся в прозрачной посуде. Изначально прядь прямая (в этом примере не учитывайте жесткость). Пока он готовится, нить будет изгибаться, скручиваться и (опять же, в этом примере) складываться в неплотный клубок, состоящий из нити макаронных изделий.Полученная прядь имеет особую форму. Спросите студентов, какие типы химических связей или сил могут влиять на структуру белка. Эти формы продиктованы положением аминокислот вдоль нити. Другие силы завершат складывание и поддержат конструкцию.
Проблемные вопросы по научной практике содержат дополнительные тестовые вопросы для этого раздела, которые помогут вам подготовиться к экзамену AP. Эти вопросы касаются следующих стандартов:
[APLO 1.14] [APLO 2.12] [APLO 4.1] [APLO 4.3] [APLO 4.15] [APLO 4.22]
Типы и функции белков
Белки являются одними из наиболее распространенных органических молекул в живых системах и обладают самым разнообразным набором функций среди всех макромолекул. Белки могут быть структурными, регуляторными, сократительными или защитными; они могут служить для транспортировки, хранения или перепонки; или они могут быть токсинами или ферментами. Каждая клетка в живой системе может содержать тысячи белков, каждый из которых выполняет уникальную функцию. Их структуры, как и их функции, сильно различаются.Однако все они представляют собой полимеры аминокислот, расположенных в линейной последовательности.
Ферменты, которые вырабатываются живыми клетками, являются катализаторами биохимических реакций (например, пищеварения) и обычно представляют собой сложные или конъюгированные белки. Каждый фермент специфичен для субстрата (реагента, который связывается с ферментом), на который он действует. Фермент может помочь в реакциях разложения, перегруппировки или синтеза. Ферменты, которые расщепляют свои субстраты, называются катаболическими ферментами, ферменты, которые строят более сложные молекулы из своих субстратов, называются анаболическими ферментами, а ферменты, влияющие на скорость реакции, называются каталитическими ферментами.Следует отметить, что все ферменты увеличивают скорость реакции и, следовательно, считаются органическими катализаторами. Примером фермента является амилаза слюны, которая гидролизует свою субстратную амилозу, компонент крахмала.
Гормоны — это химические сигнальные молекулы, обычно небольшие белки или стероиды, секретируемые эндокринными клетками, которые контролируют или регулируют определенные физиологические процессы, включая рост, развитие, метаболизм и размножение. Например, инсулин — это белковый гормон, который помогает регулировать уровень глюкозы в крови.Основные типы и функции белков перечислены в таблице 3.1.
Типы и функции белков
| Тип | Примеры | Функции |
|---|---|---|
| Пищеварительные ферменты | Амилаза, липаза, пепсин, трипсин | Помощь в переваривании пищи путем катаболизма питательных веществ до мономерных единиц |
| Транспорт | Гемоглобин, альбумин | Переносит вещества в крови или лимфе на протяжении всего организма тело |
| Структурный | Актин, тубулин, кератин | Создание различных структур, таких как цитоскелет |
| Гормоны | Инсулин, тироксин | Координировать деятельность различных систем организма |
| Защита | Иммуноглобулины | Защитить организм от чужеродных патогенов |
| Сократимость | Актин, миозин | Эффект сокращения мышц |
| Хранение | Запасные белки бобовых, яичный белок (альбумин) | Обеспечить питание в раннем развитии эмбриона и саженец 9 0072 |
Таблица 3.1
Белки имеют разную форму и молекулярную массу; некоторые белки имеют глобулярную форму, тогда как другие имеют волокнистую природу. Например, гемоглобин — это глобулярный белок, а коллаген, обнаруженный в нашей коже, — это волокнистый белок. Форма белка имеет решающее значение для его функции, и эта форма поддерживается многими различными типами химических связей. Изменения температуры, pH и воздействие химикатов могут привести к необратимым изменениям формы белка, что приведет к потере функции, известной как денатурация.Все белки состоят из 20 наиболее распространенных типов аминокислот.
Аминокислоты
Аминокислоты — это мономеры, из которых состоят белки. Каждая аминокислота имеет одинаковую фундаментальную структуру, которая состоит из центрального атома углерода, также известного как альфа ( α ) углерода, связанного с аминогруппой (NH 2 ), карбоксильной группой (COOH) и атом водорода. У каждой аминокислоты также есть другой атом или группа атомов, связанных с центральным атомом, известная как группа R (Рисунок 3.24).
Рис. 3.24. Аминокислоты имеют центральный асимметричный атом углерода, к которому присоединены аминогруппа, карбоксильная группа, атом водорода и боковая цепь (группа R).
Название «аминокислоты» происходит от того факта, что они содержат как аминогруппу, так и карбоксильно-кислотную группу в своей основной структуре. Как уже упоминалось, в белках присутствует 20 общих аминокислот. Девять из них считаются незаменимыми аминокислотами для человека, потому что человеческий организм не может их производить, и они получают с пищей.Для каждой аминокислоты группа R (или боковая цепь) отличается (рис. 3.25).
Визуальное соединение
Рис. 3.25. Обычно в белках содержится 20 общих аминокислот, каждая из которых имеет свою группу R (группа вариантов), которая определяет его химическую природу.
Какие категории аминокислот вы ожидаете найти на поверхности растворимого белка, а какие — внутри?
- Полярные и заряженные аминокислоты будут обнаружены на поверхности.Неполярные аминокислоты можно найти в интерьере.
- Полярные и заряженные аминокислоты будут найдены в интерьере. Неполярные аминокислоты будут обнаружены на поверхности.
- Неполярные и незаряженные белки могут быть найдены как на поверхности, так и внутри.
Химическая природа боковой цепи определяет природу аминокислоты (то есть, является ли она кислотной, основной, полярной или неполярной). Например, аминокислота глицин имеет атом водорода в качестве группы R.Аминокислоты, такие как валин, метионин и аланин, неполярны или гидрофобны по природе, тогда как аминокислоты, такие как серин, треонин и цистеин, полярны и имеют гидрофильные боковые цепи. Боковые цепи лизина и аргинина заряжены положительно, поэтому эти аминокислоты также известны как основные аминокислоты. Пролин имеет группу R, которая связана с аминогруппой, образуя кольцеобразную структуру. Пролин является исключением из стандартной структуры анимокислоты, поскольку его аминогруппа не отделена от боковой цепи (Рисунок 3.25).
Аминокислоты обозначаются одной заглавной буквой или трехбуквенным сокращением. Например, валин обозначается буквой V или трехбуквенным символом val. Так же, как некоторые жирные кислоты необходимы для диеты, некоторые аминокислоты также необходимы. Они известны как незаменимые аминокислоты, а у людей они включают изолейцин, лейцин и цистеин. Незаменимые аминокислоты относятся к тем, которые необходимы для построения белков в организме, но не производятся организмом; Какие аминокислоты являются незаменимыми, варьируется от организма к организму.
Последовательность и количество аминокислот в конечном итоге определяют форму, размер и функцию белка. Каждая аминокислота присоединена к другой аминокислоте ковалентной связью, известной как пептидная связь, которая образуется в результате реакции дегидратации. Карбоксильная группа одной аминокислоты и аминогруппа входящей аминокислоты объединяются, высвобождая молекулу воды. Образовавшаяся связь представляет собой пептидную связь (рис. 3.26).
Рис. 3.26. Образование пептидной связи — это реакция синтеза дегидратации.Карбоксильная группа одной аминокислоты связана с аминогруппой входящей аминокислоты. При этом выделяется молекула воды.
Продукты, образованные такими связями, называются пептидами. Чем больше аминокислот присоединяется к этой растущей цепи, полученная цепь известна как полипептид. Каждый полипептид имеет свободную аминогруппу на одном конце. Этот конец называется N-концом или амино-концом, а другой конец имеет свободную карбоксильную группу, также известную как C или карбоксильный конец.Хотя термины полипептид и белок иногда используются взаимозаменяемо, полипептид технически представляет собой полимер аминокислот, тогда как термин белок используется для полипептида или полипептидов, которые объединились вместе, часто имеют связанные непептидные простетические группы, имеют различную форму. , и имеют уникальную функцию. После синтеза (трансляции) белков большинство белков модифицируются. Они известны как посттрансляционные модификации. Они могут подвергаться расщеплению или фосфорилированию или могут потребовать добавления других химических групп.Только после этих модификаций белок становится полностью функциональным.
Ссылка на обучение
Просмотрите этапы синтеза белка в этом интерактивном руководстве.
Почему процесс синтеза белка так важен для жизни?
- Белок является предпочтительным источником энергии для организма для быстрого производства энергии.
- Белок хранится в печени и мышцах, обеспечивая энергию для использования в будущем.
- Белок необходим для образования тканей и состоит из гормонов и ферментов.
- Белки необходимы для усвоения всех жирорастворимых витаминов.
Evolution Connection
Цитохром c является важным компонентом цепи переноса электронов, частью клеточного дыхания, и обычно он находится в клеточной органелле, митохондрии. Этот белок имеет простетическую группу гема, а центральный ион гема попеременно восстанавливается и окисляется во время переноса электрона. Поскольку роль этого важного белка в производстве клеточной энергии имеет решающее значение, за миллионы лет он очень мало изменился.Секвенирование белков показало, что существует значительная гомология аминокислотных последовательностей цитохрома с среди различных видов; другими словами, эволюционное родство можно оценить путем измерения сходства или различий между последовательностями ДНК или белков различных видов.
Ученые определили, что цитохром с человека содержит 104 аминокислоты. Для каждой молекулы цитохрома с из разных организмов, которая была секвенирована на сегодняшний день, 37 из этих аминокислот появляются в одном и том же положении во всех образцах цитохрома с.Это указывает на то, что, возможно, был общий предок. При сравнении последовательностей белков человека и шимпанзе различий в последовательностях не обнаружено. Когда сравнивали последовательности человека и макаки-резуса, единственное различие было обнаружено в одной аминокислоте. В другом сравнении секвенирование человека и дрожжей показывает разницу в 44-м положении.
Белковая последовательность цитохрома с шимпанзе и человека идентична. Белковая последовательность цитохрома с макак-резусов отличается от последовательности человека на одну аминокислоту.Что предлагают эти сравнения?
- Обезьяны-резус более близки к людям, чем шимпанзе.
- Шимпанзе более тесно связаны с макаками-резусами, чем с людьми.
- Люди родственны шимпанзе, но не связаны с макаками-резусами.
- Шимпанзе более близки к людям, чем макаки-резусы.
Структура белка
Как обсуждалось ранее, форма белка имеет решающее значение для его функции.Например, фермент может связываться со специфическим субстратом в сайте, известном как активный сайт. Если этот активный сайт изменен из-за локальных изменений или изменений в общей структуре белка, фермент может быть неспособен связываться с субстратом. Чтобы понять, как белок приобретает свою окончательную форму или конформацию, нам необходимо понять четыре уровня структуры белка: первичный, вторичный, третичный и четвертичный.
Первичная структура
Уникальная последовательность аминокислот в полипептидной цепи — это ее первичная структура.Например, гормон поджелудочной железы инсулин имеет две полипептидные цепи, А и В, и они связаны между собой дисульфидными связями. N-концевой аминокислотой A-цепи является глицин, а C-концевой аминокислотой — аспарагин (рис. 3.27). Последовательности аминокислот в цепях A и B уникальны для инсулина.
Рис. 3.27. Инсулин бычьей сыворотки — это белковый гормон, состоящий из двух пептидных цепей: A (длиной 21 аминокислота) и B (длиной 30 аминокислот). В каждой цепи первичная структура обозначена трехбуквенными сокращениями, которые представляют названия аминокислот в порядке их присутствия.Аминокислота цистеин (cys) имеет сульфгидрильную (SH) группу в качестве боковой цепи. Две сульфгидрильные группы могут реагировать в присутствии кислорода с образованием дисульфидной (S-S) связи. Две дисульфидные связи соединяют цепи A и B вместе, а третья помогает цепи A свернуться в правильную форму. Обратите внимание, что все дисульфидные связи имеют одинаковую длину, но для ясности показаны разные размеры.
Уникальная последовательность каждого белка в конечном итоге определяется геном, кодирующим этот белок. Изменение нуклеотидной последовательности кодирующей области гена может привести к добавлению другой аминокислоты к растущей полипептидной цепи, вызывая изменение структуры и функции белка.При серповидно-клеточной анемии цепь гемоглобина β (небольшая часть которой показана на рис. 3.28) имеет единственную аминокислотную замену, вызывающую изменение структуры и функции белка. В частности, аминокислота глутаминовая кислота заменена валином в цепи β . Что наиболее примечательно, так это то, что молекула гемоглобина состоит из двух альфа-цепей и двух бета-цепей, каждая из которых состоит примерно из 150 аминокислот. Таким образом, молекула содержит около 600 аминокислот.Структурное различие между нормальной молекулой гемоглобина и молекулой серповидно-клеточных клеток — что резко снижает продолжительность жизни — состоит в одной из 600 аминокислот. Что еще более примечательно, так это то, что эти 600 аминокислот кодируются тремя нуклеотидами каждая, и мутация вызвано одним изменением основания (точечной мутацией), 1 из 1800 оснований.
Рис. 3.28. Бета-цепь гемоглобина имеет длину 147 остатков, однако единственная аминокислотная замена приводит к серповидно-клеточной анемии.В нормальном гемоглобине аминокислота в седьмом положении — глутамат. В серповидно-клеточном гемоглобине этот глутамат заменен валином.
Из-за этого изменения одной аминокислоты в цепи молекулы гемоглобина образуют длинные волокна, которые искажают двояковогнутые или дискообразные красные кровяные тельца и заставляют их принимать серповидную или серповидную форму, что закупоривает кровеносные сосуды ( Рисунок 3.29). Это может привести к множеству серьезных проблем со здоровьем, таких как одышка, головокружение, головные боли и боли в животе у людей, страдающих этим заболеванием.
Рис. 3.29. В этом мазке крови, визуализированном при 535-кратном увеличении с помощью светлопольной микроскопии, серповидные клетки имеют форму полумесяца, тогда как нормальные клетки имеют форму диска. (кредит: модификация работы Эда Усмана; данные шкалы от Мэтта Рассела)
Вторичная структура
Локальное сворачивание полипептида в некоторых областях приводит к вторичной структуре белка. Наиболее распространены α -спиральные и β -гофрированные листовые структуры (Рисунок 3.30). Обе структуры удерживаются вместе водородными связями. В структуре α -спирали водородные связи образуются между атомом кислорода в карбонильной группе в одной аминокислоте и другой аминокислотой, которая находится на четыре аминокислоты дальше по цепи.
Рис. 3.30. Спираль α и складчатый лист β являются вторичными структурами белков, которые образуются из-за водородных связей между карбонильными и аминогруппами в основе пептида. Некоторые аминокислоты имеют склонность образовывать α -спираль, в то время как другие имеют склонность образовывать складчатый лист β .
Каждый виток в альфа-спирали содержит 3,6 аминокислотных остатка. Группы R (вариантные группы) полипептида выступают из -спиральной цепи . В листе с складками β «складки» образованы водородными связями между атомами в основной цепи полипептидной цепи. Группы R прикреплены к атомам углерода и проходят выше и ниже складок складки. Складчатые сегменты выстраиваются параллельно или антипараллельно друг другу, а водородные связи образуются между частично положительным атомом водорода в аминогруппе и частично отрицательным атомом кислорода в карбонильной группе основной цепи пептида.Спирали α, и складки β обнаруживаются в большинстве глобулярных и волокнистых белков, и они играют важную структурную роль.
Третичная структура
Уникальная трехмерная структура полипептида — это его третичная структура (рис. 3.31). Эта структура частично обусловлена химическими взаимодействиями в полипептидной цепи. В первую очередь, взаимодействия между группами R создают сложную трехмерную третичную структуру белка.Природа групп R, присутствующих в задействованных аминокислотах, может противодействовать образованию водородных связей, описанных для стандартных вторичных структур. Например, группы R с одинаковыми зарядами отталкиваются друг от друга, а группы с разными зарядами притягиваются друг к другу (ионные связи). Когда происходит сворачивание белка, гидрофобные группы R неполярных аминокислот лежат внутри белка, тогда как гидрофильные группы R лежат снаружи. Первые типы взаимодействий также известны как гидрофобные взаимодействия.Взаимодействие между боковыми цепями цистеина образует дисульфидные связи в присутствии кислорода, единственную ковалентную связь, образующуюся во время сворачивания белка.
Рис. 3.31. Третичная структура белков определяется множеством химических взаимодействий. К ним относятся гидрофобные взаимодействия, ионные связи, водородные связи и дисульфидные связи.
Все эти взаимодействия, сильные и слабые, определяют окончательную трехмерную форму белка. Когда белок теряет свою трехмерную форму, он может больше не функционировать.
Четвертичная структура
В природе некоторые белки образованы из нескольких полипептидов, также известных как субъединицы, и взаимодействие этих субъединиц образует четвертичную структуру. Слабые взаимодействия между субъединицами помогают стабилизировать общую структуру. Например, инсулин (глобулярный белок) имеет комбинацию водородных и дисульфидных связей, из-за которых он в основном собирается в шар. Инсулин начинается как отдельный полипептид и теряет некоторые внутренние последовательности в присутствии посттрансляционной модификации после образования дисульфидных связей, которые удерживают вместе оставшиеся цепи.Шелк (волокнистый белок), однако, имеет складчатую листовую структуру β , которая является результатом водородных связей между различными цепями.
Четыре уровня структуры белка (первичный, вторичный, третичный и четвертичный) показаны на рис. 3.32.
Рис. 3.32 На этих иллюстрациях можно увидеть четыре уровня белковой структуры. (кредит: модификация работы Национального исследовательского института генома человека)
Денатурация и сворачивание белка
Каждый белок имеет свою уникальную последовательность и форму, которые удерживаются вместе за счет химических взаимодействий.Если белок подвержен изменениям температуры, pH или воздействию химикатов, структура белка может измениться, потеряв свою форму без потери своей первичной последовательности в так называемой денатурации. Денатурация часто обратима, поскольку первичная структура полипептида сохраняется в процессе, если денатурирующий агент удаляется, позволяя белку возобновить свою функцию. Иногда денатурация необратима, что приводит к потере функции. Одним из примеров необратимой денатурации белка является жарение яйца.Белок альбумина в жидком яичном белке денатурируется при помещении на горячую сковороду. Не все белки денатурируются при высоких температурах; например, бактерии, которые выживают в горячих источниках, содержат белки, которые функционируют при температурах, близких к температуре кипения. Желудок также очень кислый, имеет низкий pH и денатурирует белки как часть процесса пищеварения; однако пищеварительные ферменты желудка в этих условиях сохраняют свою активность.
Сворачивание белка имеет решающее значение для его функции.Первоначально считалось, что сами белки несут ответственность за процесс сворачивания. Только недавно было обнаружено, что часто они получают помощь в процессе сворачивания от белков-помощников, известных как шапероны (или шаперонины), которые связываются с целевым белком во время процесса сворачивания. Они действуют, предотвращая агрегацию полипептидов, составляющих полную структуру белка, и отделяются от белка, как только целевой белок сворачивается.
Ссылка на обучение
Чтобы получить дополнительную информацию о белках, просмотрите этот анимационный ролик под названием «Биомолекулы: белки.”
Веганы — это люди, которые не употребляют в пищу продукты животного происхождения. Почему веганам нужно уделять особое внимание белку, который они едят?
- Растительные белки содержат все незаменимые и заменимые аминокислоты.
- Сложнее получить все незаменимые аминокислоты из отдельных растительных источников.
- Растительные белки содержат только заменимые аминокислоты.
- Белки растений не содержат всех незаменимых аминокислот, но содержат незаменимые аминокислоты.
Подключение к научной практике для курсов AP®
Подумай об этом
- Предскажите, что произойдет, если даже одна аминокислота будет заменена в полипептиде, и представьте конкретный пример.
- Какие категории аминокислот вы ожидаете найти на поверхности растворимого белка, а какие — внутри? Какое распределение аминокислот вы ожидаете найти в белке, встроенном в липидный бислой мембраны плазматической клетки?
Активность
Сворачивание — важное свойство белков, особенно ферментов.Белки имеют узкий диапазон условий, в которых они правильно сворачиваются; вне этого диапазона белки могут разворачиваться (денатурироваться) и часто не могут складываться заново и снова становиться функциональными. Изучите одно заболевание, которое возникает из-за неправильного сворачивания белка. Опишите причины разворачивания и последствия молекулярной структуры полипептида, которые приводят к заболеванию.
Поддержка учителей
Первый вопрос «Подумай об этом» — это применение цели обучения 4.3 и научных практик 6.1 и 6.4, потому что студенты предсказывают, как изменение подкомпонентов молекулы может повлиять на свойства молекулы.
Второй вопрос «Подумай об этом» — это применение Задачи обучения 4.2 и Практики 1.3, потому что студенты используют представления молекул вместе с моделью клеточной мембраны, чтобы описать, как молекулярная структура аминокислот определяет их расположение с белком или другим. структура, такая как бислой фосфолипидов.
Это упражнение является применением Задачи обучения 4.1 и научная практика 7.1, цель обучения 4.2 и научная практика 1.3, а также цель обучения 4.3 и научная практика 6.1 и 6.4, потому что студентов просят объяснить, как факторы окружающей среды могут изменить молекулярную структуру белка и как это изменение может привести к изменению в функции, то есть болезни.
Базовый
Структура Гли к Leu Asp к Gln Ала к Трп Тест
себя Автор
односимвольные коды | The Химия аминокислот Введение Аминокислоты играют центральную роль как строительные блоки белков и как промежуточные звенья в метаболизме. 20 аминокислот, которые содержатся в белки обладают широким спектром химической универсальности. В точное содержание аминокислот и последовательность этих аминокислот конкретный белок, определяется последовательностью оснований в ген, кодирующий этот белок.Химические свойства аминокислот белков определяют биологическую активность белка. Белки не только катализируют все (или большую часть) реакций в живых клетках, они контролировать практически все клеточные процессы. Кроме того, белки содержат в их аминокислотных последовательностях необходимая информация для определения как этот белок сворачивается в трехмерную структуру, и устойчивость полученной конструкции.Поле сворачивания белка и стабильность была критически важной областью исследований в течение многих лет, и остается сегодня одной из величайших неразгаданных загадок. Однако это активно исследуются, и прогресс наблюдается каждый день. Когда мы узнаем об аминокислотах, важно помнить, что из наиболее важных причин для понимания структуры и свойств аминокислот уметь понимать структуру и свойства протеина.Мы будем увидеть, что чрезвычайно сложные характеристики даже небольшого, относительно Простые белки — это совокупность свойств аминокислот, которые содержат белок. Верх 10 аминокислот, которые мы можем производить, это аланин, аспарагин, аспарагиновая кислота. кислота, цистеин, глутаминовая кислота, глутамин, глицин, пролин, серин и тирозин. Тирозин вырабатывается из фенилаланина, поэтому при недостаточном рационе в фенилаланине также потребуется тирозин.Незаменимая аминокислота кислоты — аргинин (необходим молодым, но не взрослым), гистидин, изолейцин, лейцин, лизин, метионин, фенилаланин, треонин, триптофан, и валин. Эти аминокислоты необходимы в рационе. Растения, конечно, должен уметь производить все аминокислоты. С другой стороны, люди делают не иметь всех ферментов, необходимых для биосинтеза всех аминокислоты. Зачем изучать эти структуры
и свойства? | Атомы
в аминокислотах |
Что такое ферменты, поджелудочная железа, пищеварение и функция печени
Что такое ферменты?
Ферменты — это белки, которые помогают ускорить метаболизм или химические реакции в нашем организме.Они создают одни вещества и разрушают другие. Все живые существа имеют ферменты.
Наши тела естественным образом вырабатывают ферменты. Но ферменты также присутствуют в промышленных продуктах и продуктах питания.
Что делают ферменты?
Одна из самых важных функций ферментов — способствовать пищеварению. Пищеварение — это процесс превращения пищи, которую мы едим, в энергию. Например, ферменты есть в нашей слюне, поджелудочной железе, кишечнике и желудке. Они расщепляют жиры, белки и углеводы.Ферменты используют эти питательные вещества для роста и восстановления клеток.
Ферменты также помогают с:
- Дыхание.
- Наращивание мышц.
- Нервная функция.
- Избавляем наш организм от токсинов.
Какие бывают типы ферментов?
В организме тысячи отдельных ферментов. У каждого типа ферментов есть только одна работа. Например, фермент сахараза расщепляет сахар, называемый сахарозой. Лактаза расщепляет лактозу, разновидность сахара, содержащегося в молочных продуктах.
Некоторые из наиболее распространенных пищеварительных ферментов:
- Карбогидраза расщепляет углеводы на сахара.
- Липаза расщепляет жиры на жирные кислоты.
- Протеаза расщепляет белок на аминокислоты.
Части ферментов
Что входит в состав фермента?
У каждого фермента есть «активный сайт». Эта территория имеет уникальную форму. Вещество, над которым работает фермент, является субстратом.Подложка также имеет уникальную форму. Фермент и субстрат должны работать вместе.
Как температура и pH влияют на ферменты?
Для работы ферментов необходимы правильные условия. Если условия неподходящие, ферменты могут изменить форму. Затем они перестают подходить к подложкам, поэтому не работают должным образом.
Каждый фермент имеет идеальную температуру и pH:
.- pH: Ферменты чувствительны к кислотности и щелочности. Они не работают должным образом, если среда слишком кислая или щелочная.Например, фермент в желудке, называемый пепсином, расщепляет белки. Если в желудке недостаточно кислоты, пепсин не может функционировать оптимально.
- Температура: Ферменты работают лучше всего при нормальной температуре тела, около 98,6 ° F (37 ° C). При повышении температуры усиливаются ферментативные реакции. Но если температура становится слишком высокой, фермент перестает работать. Вот почему высокая температура может нарушить функции организма.
Общие состояния и расстройства
Какие состояния здоровья могут вызывать проблемы с ферментами?
Нарушения обмена веществ часто являются результатом недостатка определенного фермента.Родители могут передать их своим детям через гены (по наследству). Некоторые примеры наследственных нарушений обмена веществ включают:
- Болезнь Фабри препятствует выработке организмом ферментов (альфа-галактозидаза А), расщепляющих жир (липиды).
- Болезнь Краббе (лейкодистрофия глобоидных клеток) влияет на ферменты, необходимые для защитного покрытия (миелин) нервных клеток (центральная нервная система).
- Болезнь мочи кленового сиропа влияет на ферменты, необходимые для расщепления определенных аминокислот разветвленной цепи.
Другие состояния здоровья, связанные с дисбалансом ферментов, включают:
- Болезнь Крона дисбаланс бактерий в кишечнике (микробиом кишечника) может влиять на аутоиммунный ответ кишечного тракта. Это может сыграть роль в проявлении и тяжести болезни Крона.
- Внешнесекреторная недостаточность поджелудочной железы (EPI) — это состояние, при котором в поджелудочной железе не хватает пищеварительных ферментов. Вы не можете расщеплять пищу или усваивать питательные вещества.Хронический панкреатит, рак поджелудочной железы, диабет или муковисцидоз могут привести к EPI.
- Непереносимость лактозы — это недостаток фермента, необходимого для переваривания сахаров в молоке (лактозе) и молочных продуктах.
Как тесты на ферменты используются для диагностики состояния здоровья?
Ваш лечащий врач может использовать различные анализы крови на ферменты и белки для проверки определенных заболеваний. Например, повышенный уровень ферментов печени может быть признаком заболевания печени.
Уход за ферментами
Нужно ли мне принимать ферментные добавки?
Люди без хронических заболеваний обычно могут получать необходимые им ферменты из здорового питания.Но если у вас есть определенные проблемы со здоровьем, ваш лечащий врач может порекомендовать принимать ферментные добавки. Например, многие люди с EPI могут принимать пищеварительный фермент перед едой. Это помогает их телу усваивать питательные вещества из пищи. Поговорите со своим врачом, прежде чем принимать какие-либо ферментные добавки.
Могут ли лекарства влиять на уровень ферментов?
Некоторые лекарства влияют на уровень ферментов. Например, антибиотики могут убить определенные бактерии, необходимые для того, чтобы некоторые ферменты работали наилучшим образом.Это причина того, что антибиотики могут вызвать диарею. Чтобы убить бактерии, вызывающие заболевание, они также уничтожают важные полезные бактерии, которые помогают пищеварению.
Статины (лекарства, снижающие уровень холестерина) могут повышать ферменты печени и мышечные ферменты. Они могут увеличить риск повреждения печени или мышц.
Когда звонить врачу
Когда мне следует обращаться к врачу по поводу проблемы с ферментами?
Вы не узнаете, есть ли у вас проблемы с ферментами, без анализа крови.Обратитесь к врачу, если у вас возникнут следующие проблемы:
Записка из клиники Кливленда
Ферменты помогают облегчить биохимические реакции в нашем организме. Они помогают во всем, от дыхания до пищеварения. Слишком мало или слишком много определенного фермента может привести к проблемам со здоровьем. Некоторым людям с хроническими заболеваниями может потребоваться прием ферментных добавок, чтобы помочь своему организму работать должным образом. Принимайте ферментные добавки только под наблюдением врача.
Метаболизм (для подростков) — Nemours KidsHealth
Что такое метаболизм?
Метаболизм (произносится: meh-TAB-uh-liz-um) — это химические реакции в клетках организма, которые превращают пищу в энергию. Нашему телу нужна эта энергия, чтобы делать все — от движения к мышлению до роста.
Определенные белки в организме контролируют химические реакции обмена веществ. Одновременно происходят тысячи метаболических реакций, которые регулируются организмом, чтобы наши клетки оставались здоровыми и работающими.
Как работает метаболизм?
После того, как мы едим, пищеварительная система использует ферменты для:
- расщепляет белки на аминокислоты
- превращают жиры в жирные кислоты
- превращают углеводы в простые сахара (например, глюкозу)
При необходимости организм может использовать сахар, аминокислоты и жирные кислоты в качестве источников энергии. Эти соединения всасываются в кровь, которая переносит их в клетки.
После того, как они попадают в клетки, другие ферменты ускоряют или регулируют химические реакции, участвующие в «метаболизме» этих соединений.Во время этих процессов энергия этих соединений может высвобождаться для использования организмом или накапливаться в тканях организма, особенно в печени, мышцах и жировых тканях.
Метаболизм — это балансирующее действие, включающее два вида деятельности, которые происходят одновременно:
- наращивание тканей тела и запасов энергии (так называемый анаболизм)
- разрушает ткани тела и запасы энергии, чтобы получить больше топлива для функций организма (так называемый катаболизм)
Анаболизм (произносится: uh-NAB-uh-liz-um), или конструктивный метаболизм, заключается в построении и хранении.Он поддерживает рост новых клеток, поддержание состояния тканей тела и накопление энергии для использования в будущем. При анаболизме маленькие молекулы превращаются в более крупные и сложные молекулы углеводов, белков и жиров.
Катаболизм (произносится: kuh-TAB-uh-liz-um), или деструктивный метаболизм, это процесс, который производит энергию, необходимую для всей активности клеток. Клетки расщепляют большие молекулы (в основном углеводы и жиры), чтобы высвободить энергию. Это обеспечивает топливо для анаболизма, нагревает тело и позволяет мышцам сокращаться, а тело двигаться.
По мере того как сложные химические соединения распадаются на более простые вещества, организм выделяет продукты жизнедеятельности через кожу, почки, легкие и кишечник.
Что контролирует метаболизм?
Некоторые гормоны эндокринной системы помогают контролировать скорость и направление метаболизма. Тироксин, гормон, вырабатываемый и выделяемый щитовидной железой, играет ключевую роль в определении того, насколько быстро или медленно протекают химические реакции метаболизма в организме человека.
Другая железа, поджелудочная железа, выделяет гормоны, которые помогают определить, является ли основная метаболическая активность организма анаболической (произносится: ан-э-бол-ик) или катаболической (произносится: кат-э-бол-ик).Например, большая анаболическая активность обычно происходит после еды. Это потому, что еда увеличивает уровень глюкозы в крови — самого важного топлива для организма. Поджелудочная железа ощущает этот повышенный уровень глюкозы и выделяет гормон инсулин, который сигнализирует клеткам об увеличении их анаболической активности.
Метаболизм — сложный химический процесс. Поэтому неудивительно, что многие люди думают об этом в самом простом смысле: как о чем-то, что влияет на то, насколько легко наше тело набирает или теряет вес.Вот где нужны калории. Калория — это единица измерения, которая измеряет, сколько энергии конкретная пища дает организму. Плитка шоколада содержит больше калорий, чем яблоко, поэтому она дает организму больше энергии, а иногда это может быть слишком хорошо. Точно так же, как автомобиль хранит бензин в бензобаке до тех пор, пока он не понадобится для заправки двигателя, тело накапливает калории — в основном в виде жира. Если вы переполните бензобак автомобиля, он выльется на тротуар. Точно так же, если человек ест слишком много калорий, они «выливаются» в виде лишнего жира.
Количество калорий, сжигаемых за день, зависит от того, сколько человек тренируется, количества жира и мышц в его или ее теле и базальной скорости обмена веществ (BMR) . BMR — это мера скорости, с которой тело человека «сжигает» энергию в виде калорий в состоянии покоя.
BMR может влиять на склонность человека к полноте. Например, человек с низким BMR (который, следовательно, сжигает меньше калорий в состоянии покоя или во сне), как правило, со временем набирает больше фунтов жира, чем человек такого же роста со средним BMR, который ест такое же количество пищи и получает такое же количество упражнений.
НаBMR могут влиять гены человека и некоторые проблемы со здоровьем. На это также влияет состав тела — люди с большей мышечной массой и меньшим количеством жира обычно имеют более высокий BMR. Но люди могут изменить свой BMR определенным образом. Например, человек, который больше тренируется, не только сжигает больше калорий, но и становится более физически здоровым, что увеличивает его или ее BMR.
Белковый синтез — обзор
Механизм действия ингибиторов белкового синтеза
Белковый синтез происходит в цитоплазме на рибонуклеопротеиновых частицах, рибосомах.Информационная РНК, которая содержит в своей нуклеотидной последовательности код, управляющий синтезом одной или нескольких полипептидных цепей, синтезируется РНК-полимеразой на матрице ДНК и транспортируется в цитоплазму, где она связывается с рибосомами и направляет размещение РНК для переноса аминоацила в правильной последовательности. Аминокислота, которая была активирована и этерифицирована до определенного вида тРНК, связана с рибосомным акцепторным сайтом благодаря взаимодействиям кодон-антикодон.Пептидилтрансфераза, неотъемлемая часть рибосомы, катализирует образование пептидной связи между карбоксильной группой растущего пептида (связанной как пептидил-тРНК с сайтом донора рибосомы) и аминогруппой новой аминокислоты. Образовавшаяся пептидил-тРНК перемещается к донорному сайту с помощью GTP-требующего фермента, освобождая акцепторный сайт для присоединения следующей аминоацил-тРНК (Watson, 1970).
Взаимосвязь между синтезом белка и физиологическим проявлением радиационного поражения исследовалась в первую очередь с использованием ингибиторов синтеза белка.Выводы, сделанные на основе этих исследований, основаны на двух предположениях: во-первых, ингибирование влияет на одну и только одну биохимическую реакцию, а во-вторых, что эта конкретная биохимическая реакция не имеет быстрых косвенных эффектов на общий метаболизм клетки.
Пуромицин, который действует как аналог аминоацил-тРНК (Morris and Schweet, 1961; Rabinovitz and Fisher, 1962), по-видимому, ингибирует синтез белка в прокариотических и эукариотических клетках, высвобождая неполные полипептидные цепи из рибосомы (Allen and Zamecnik , 1962; Натанс, 1964). Циклогексимид может ингибировать инициирование, удлинение или прекращение синтеза белка в эукариотических клетках путем блокирования транслокации, тем самым предотвращая дальнейшее движение рибосомы по матричной РНК (Obrig et al., 1971; Rajalakshmi et al., 1971). Хлорамфеникол подавляет синтез белка в бактериях и избирательно подавляет синтез белка в митохондриях и хлоропластах изученных эукариотических клеток (Sager, 1972).Этот антибиотик связывается с большой субъединицей рибосомы (Vazquez, 1965) и препятствует образованию пептидной связи (например, Traut and Monro, 1964). Стрептомицин специфически подавляет синтез микробных и митохондриальных белков, связываясь с малой рибосомной субъединицей (Davies, 1964; Cox et al., 1964) и вызывая неправильное считывание генетического кода (Davies et al., 1964).
Сворачивание белков: хорошее, плохое и уродливое
Мы часто думаем о белках как о питательных веществах в пище, которые мы едим, или как о главном компоненте мышц, но белки также представляют собой микроскопические молекулы внутри клеток, которые выполняют разнообразные и жизненно важные функции.Завершив проект «Геном человека», ученые обращают внимание на «протеом» человека — каталог всех человеческих белков. Эта работа показала, что мир белков увлекателен, он полон молекул с такими замысловатыми формами и точными функциями, что они кажутся почти фантастическими.
Функция белка зависит от его формы, и когда образование белка идет не так, образующиеся в результате деформированные белки вызывают проблемы, которые варьируются от плохих, когда белки пренебрегают своей важной работой, до уродливых, когда они образуют липкую комковатую массу внутри клеток.Текущие исследования показывают, что мир белков далек от первозданного. Образование белка — это процесс, подверженный ошибкам, и ошибки на этом пути были связаны с рядом заболеваний человека.
Мир белков:
В типичной человеческой клетке содержится от 20 000 до более чем 100 000 уникальных типов белков. Почему так много? Белки — это рабочие лошадки клетки. Каждый мастерски выполняет конкретную задачу. Некоторые из них являются структурными, например, придают жесткость мышечным клеткам или длинным тонким нейронам.Другие связываются с определенными молекулами и доставляют их в новые места, а третьи катализируют реакции, которые позволяют клеткам делиться и расти. Такое разнообразие и специфичность функций стало возможным благодаря, казалось бы, простому свойству белков: они сворачиваются.
Белки складываются в функциональную форму
Белок начинается в клетке как длинная цепочка, состоящая в среднем из 300 строительных блоков, называемых аминокислотами. Существует 22 различных типа аминокислот, и их порядок определяет, как белковая цепь будет складываться сама по себе.При складывании первыми обычно образуются конструкции двух типов. Некоторые области белковой цепи сворачиваются в тонкие образования, называемые «альфа-спиралями», в то время как другие области складываются в зигзагообразные узоры, называемые «бета-листами», которые напоминают складки бумажного веера. Эти две структуры могут взаимодействовать с образованием более сложных структур. Например, в одной структуре белка несколько бета-листов обвиваются вокруг себя, образуя полую трубку с несколькими альфа-спиралями, выступающими из одного конца. Трубка короткая и приземистая, так что общая структура напоминает змей (альфа-спирали), выходящих из банки (бета-листовая трубка).Несколько других белковых структур с описательными названиями включают «бета-ствол», «бета-пропеллер», «альфа / бета-подкову» и «складку желе-ролла».
Эти сложные структуры позволяют белкам выполнять свою разнообразную работу в клетке. Белок «змеи в банке», когда он встроен в клеточную мембрану, создает туннель, который позволяет входить и выходить из клеток. Другие белки образуют формы с карманами, называемыми «активными центрами», которые идеально подходят для связывания с определенной молекулой, например, с замком и ключом.Сворачиваясь в различные формы, белки могут выполнять очень разные роли, несмотря на то, что они состоят из одних и тех же основных строительных блоков. Чтобы провести аналогию, все автомобили сделаны из стали, но обтекаемая форма гоночного автомобиля побеждает в гонках, в то время как автобус, самосвал, кран или дзамбони имеют форму для выполнения своих уникальных задач.
Почему иногда происходит сбой сворачивания белка?
Сворачивание позволяет белку принимать функциональную форму, но это сложный процесс, который иногда терпит неудачу. Сворачивание белков может пойти не так по трем основным причинам:
1: Человек может обладать мутацией, которая изменяет аминокислоту в белковой цепи, что затрудняет поиск конкретным белком его предпочтительной складки или «нативного» состояния.Это касается наследственных мутаций, например, приводящих к муковисцидозу или серповидно-клеточной анемии. Эти мутации расположены в последовательности ДНК или «гене», кодирующем один конкретный белок. Следовательно, эти типы унаследованных мутаций влияют только на этот конкретный белок и связанные с ним функции.
2: С другой стороны, нарушение сворачивания белков можно рассматривать как продолжающийся и более общий процесс, который влияет на многие белки. Когда создаются белки, машина, считывающая указания ДНК для создания длинных цепочек аминокислот, может делать ошибки.Ученые подсчитали, что эта машина, рибосома, допускает ошибки в 1 из каждых 7 белков! Эти ошибки могут снизить вероятность правильного сворачивания полученных белков.
3: Даже если аминокислотная цепь не имеет мутаций или ошибок, она все равно может не достичь своей предпочтительной складчатой формы просто потому, что белки не складываются правильно в 100% случаев. Сворачивание белка становится еще более трудным, если условия в клетке, такие как кислотность и температура, изменяются от тех, к которым привык организм.
Нарушение сворачивания белка вызывает несколько известных заболеваний, и ученые предполагают, что многие другие болезни могут быть связаны с проблемами сворачивания. Есть две совершенно разные проблемы, которые возникают в клетках, когда их белки не складываются должным образом.
Один тип проблемы, называемый «потеря функции», возникает, когда недостаточное количество определенного белка сворачивается должным образом, вызывая нехватку «специализированных работников», необходимых для выполнения конкретной работы. Например, представьте, что правильно свернутый белок имеет идеальную форму, чтобы связывать токсин и расщеплять его на менее токсичные побочные продукты.Без достаточного количества правильно сложенного белка токсин будет накапливаться до разрушительного уровня. В качестве другого примера, белок может отвечать за метаболизм сахара, так что клетка может использовать его для получения энергии. Клетка будет расти медленно из-за недостатка энергии, если в ее функциональном состоянии будет недостаточно белка. Причина, по которой клетка заболевает, в этих случаях связана с нехваткой одного специфического, правильно сложенного, функционального белка. Муковисцидоз, болезнь Тея-Сакса, синдром Марфана и некоторые формы рака являются примерами заболеваний, которые возникают, когда один тип белка не может выполнять свою работу.Кто знал, что один тип белка из десятков тысяч может быть настолько важен?
Белки, которые сворачиваются неправильно, также могут повлиять на здоровье клетки независимо от функции белка. Когда белки не могут свернуться в свое функциональное состояние, полученные неправильно свернутые белки могут принимать форму, неблагоприятную для переполненной клеточной среды. Большинство белков содержат липкие, «ненавидящие воду» аминокислоты, которые они закапывают глубоко внутри своего ядра. Неправильно свернутые белки изнашиваются этими внутренними частями снаружи, как леденцы в шоколаде, раздавленные, чтобы обнажить липкую карамельную серединку.Эти неправильно свернутые белки часто слипаются, образуя сгустки, называемые «агрегатами». Ученые предполагают, что накопление неправильно свернутых белков играет роль в нескольких неврологических заболеваниях, включая болезнь Альцгеймера, Паркинсона, Хантингтона и болезнь Лу Герига (БАС), но ученые все еще работают над тем, чтобы точно определить, как эти неправильно свернутые липкие молекулы наносят ущерб клеткам. .
Один неправильно свернутый белок выделяется среди остальных и заслуживает особого внимания. «Прионный» белок при болезни Крейтцфельдта-Якоба, также известной как болезнь коровьего бешенства, является примером неправильно свернутого белка.Этот белок не только необратимо неправильно свернут, но и превращает другие функциональные белки в свое скрученное состояние.
Как наши клетки защищаются от неправильно свернутых белков?
Недавние исследования показывают, что неправильная укладка белков часто происходит внутри клеток. К счастью, клетки привыкли справляться с этой проблемой и имеют несколько систем для повторного укладки или разрушения аберрантных белковых образований.
Шапероны — одна из таких систем. Правильно названные, они сопровождают белки в процессе сворачивания, улучшая шансы белка на правильное сворачивание и даже позволяя некоторым неправильно свернутым белкам возможность повторно укладываться.Интересно, что шапероны сами по себе являются белками! Есть много разных типов шаперонов. Некоторые специально предназначены для того, чтобы помочь одному типу белка сворачиваться, в то время как другие действуют в более общем плане. Некоторые шапероны имеют форму больших полых камер и обеспечивают белкам безопасное пространство, изолированное от других молекул, в котором они могут складываться. Производство нескольких шаперонов увеличивается, когда клетка сталкивается с высокими температурами или другими условиями, затрудняющими сворачивание белка, таким образом, эти шапероны получили прозвище «белки теплового шока».”
Другая линия защиты клеток от неправильно свернутых белков называется протеасомой. Если неправильно свернутые белки задерживаются в клетке, они будут уничтожены этой машиной, которая пережевывает белки и выплевывает их в виде небольших фрагментов аминокислот. Протеасома похожа на центр переработки, позволяя клетке повторно использовать аминокислоты для производства большего количества белков. Сама протеасома — это не один белок, а множество действующих вместе. Белки часто взаимодействуют с образованием более крупных структур с важными клеточными функциями.Например, хвост спермы человека представляет собой структуру, состоящую из многих типов белков, которые работают вместе, образуя сложный роторный двигатель, который продвигает сперму вперед.
Будущие исследования сворачивания и неправильного сворачивания белков:
Почему некоторые неправильно свернутые белки способны уклоняться от таких систем, как шапероны и протеасома? Как липкие неправильно свернутые белки могут вызывать перечисленные выше нейродегенеративные заболевания? Некоторые белки неправильно складываются чаще, чем другие? Эти вопросы находятся в авангарде текущих исследований, направленных на понимание основ биологии белков и болезней, которые возникают в результате неправильного сворачивания белка.
Обширный мир белков с большим разнообразием форм наделяет клетки способностями, которые позволяют жизни существовать и допускают ее разнообразие (например, различия между клетками глаза, кожи, легких или сердца, а также различия между видами) . Возможно, по этой причине слово «белок» происходит от греческого слова «протас», что означает «первостепенное значение».
— Предоставлено Керри Гейлер, аспирантом 4-го курса Гарвардского факультета органической и эволюционной биологии
.
 Примером может служить фибриноген, превращающийся в нерастворимый фибрин при свертывании крови.
Примером может служить фибриноген, превращающийся в нерастворимый фибрин при свертывании крови.