Левомицетин спирт: Левомицетина раствор спиртовой инструкция по применению: показания, противопоказания, побочное действие – описание LevomycetIn solution In ethanol р-р д/наружн. прим. (спиртовой) 3%: 25 мл или 40 мл фл. (31127)
Левомицетин 0,25% 25мл — Кировская фармацевтическая фабрика
Фармакологическое действие:
Активным веществом препарата является хлорамфеникол — антибиотик широкого спектра действия. Хлорамфеникол – бактериостатический антибиотик, нарушает процесс синтеза белка в микробной клетке (обладая хорошей липофильностью, проникает через клеточную мембрану бактерий и обратно связывается с субъединицей 5OS бактериальных рибосом, в которых задерживается перемещение аминокислот к растущим пептидным цепям, что ведет к нарушению синтеза белка). Активен в отношении большинства штаммов грамположительных и грамотрицательных микроорганизмов, устойчивых к пенициллину, тетрациклинам, сульфаниламидам.
Упаковка:
25мл
Показания:
Фурункулезы, гнойничковые заболевания кожи.
Противопоказания:
Индивидуальная непереносимость, беременность и лактация, угнетение костно-мозгового кроветворения, острая интермиттирующая порфирия, дефицит глюкозо-6-фосфатдегидрогеназы, выраженные нарушения функции почек и печени, заболевания кожи (грибковые заболевания, псориаз, экзема), период новорожденности (до 4-х недель).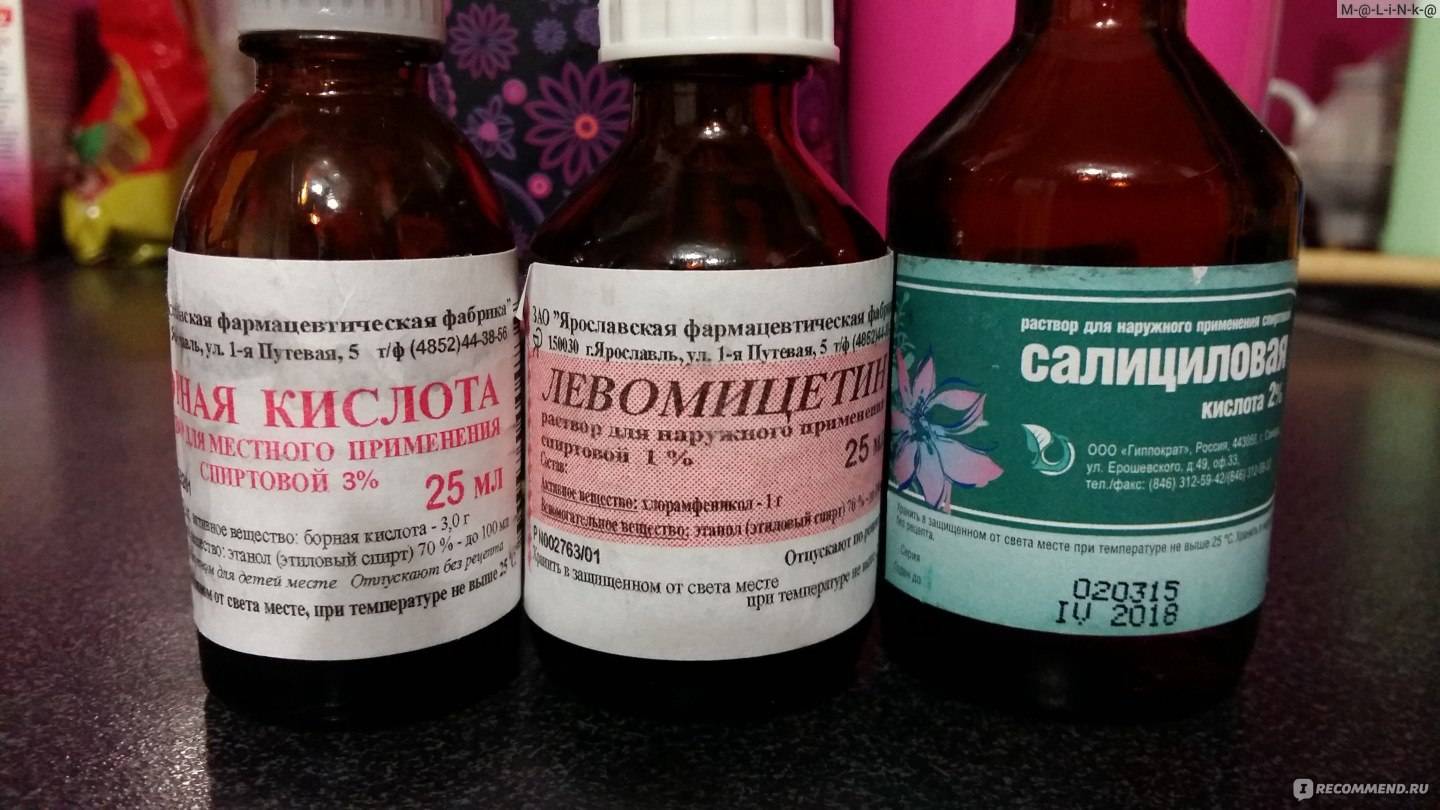
С ОСТОРОЖНОСТЬЮ: Ранний детский возраст.
Способ применения и дозы:
Наружно, поврежденные участки обрабатывают ватным тампоном, смоченным в растворе, несколько раз в сутки.
Побочные действия:
Аллергические реакции: кожная сыпь, ангионевротический отек. Со стороны органов кроветворения: редко – тромбоцитопения, эритропения, апластическая анемия.
Передозировка:
При правильном применении препарата (местно) случаев передозировки не отмечено.
Особые указания:
Детям первых 4 недель жизни назначают только в случаях острой необходимости.
При нанесении на обширные поверхности с одновременным приемом этанола возможно развитие дисульфирамоподобных реакций (гиперемия кожных покровов, тахикардия, тошнота, рвота, рефлекторный кашель, судороги).
Лекарственное взаимодействие:
При одновременном применении с эритромицином, клиндамицином, линкомицином отмечается взаимное ослабление действия за счет того, что хлорамфеникол может вытеснять эти препараты из связанного состояния или препятствовать их связыванию с субъединицей 5OS бактериальных рибосом.
Форма выпуска:
Раствор для наружного применения спиртовой 0,25 %.
По 25 мл или 40 мл во флаконы оранжевого стекла, укупоренные пробками полиэтиленовыми, пробками и крышками пластмассовыми из полимерных материалов.
По 25 мл во флаконы-капельницы оранжевого стекла в комплекте с пробкой-капельницей и крышкой полиэтиленовой или укупоренные пробками-капельницами; пробками и крышками навинчиваемыми пластмассовыми или крышками.
На флакон наклеивают этикетку из бумаги этикеточной, писчей или самоклеящуюся этикетку.
Каждый флакон вместе с инструкцией по медицинскому применению помещают в пачку из картона.
Допускается текст инструкции по медицинскому применению наносить на картонную пачку.
Флаконы с соответствующим количеством инструкций по медицинскому применению помещают в групповую тару.
Условия хранения:
Препарат относится к списку Б.
Хранить в защищенном от света месте, при температуре от 12 до 15 ºС.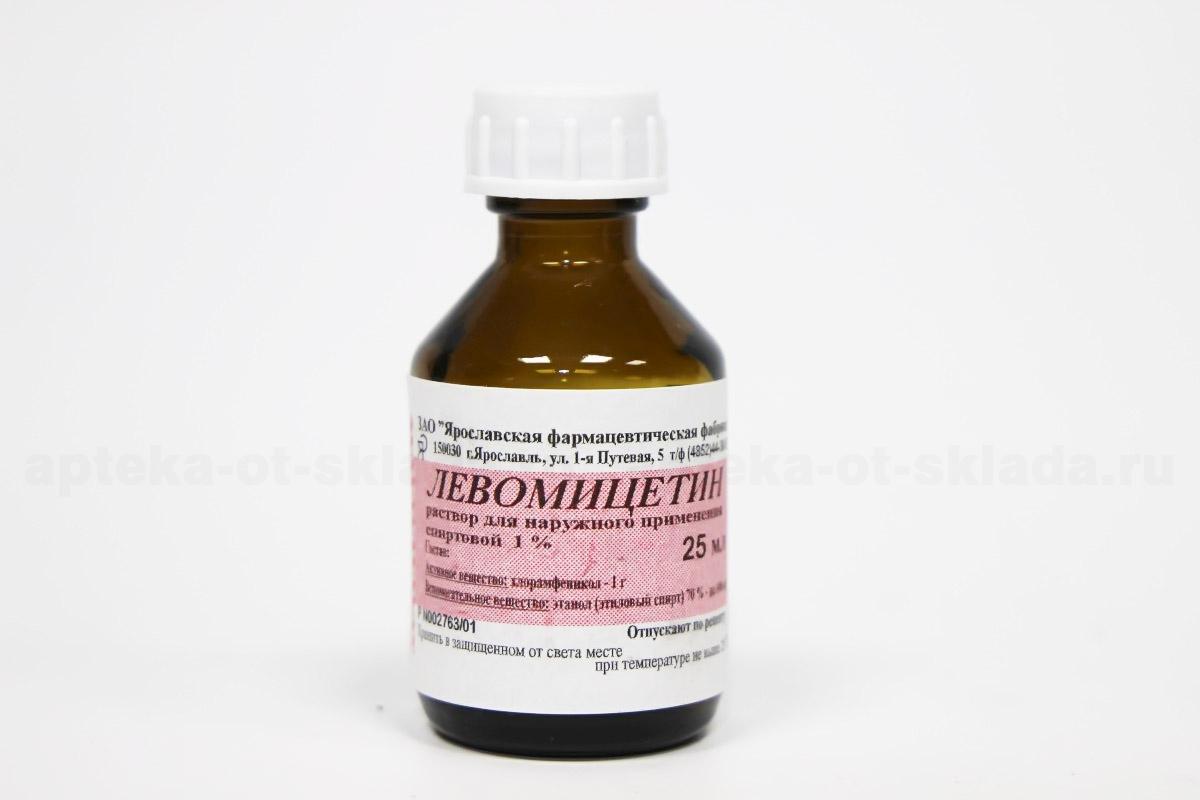
Хранить в недоступном для детей месте
Срок годности:
2 года. Не использовать препарат по истечении срока годности, указанного на упаковке.
Условия отпуска из аптек:
Без рецепта.
| 00:00-24:00 | +7 (343) 289-00-30 | 26.00 ₽ 17-09-2021 (ЦФИ) |
8 800 700-88-88 (звонки по России беспл. | 32. 00 ₽ 00 ₽17-09-2021 (ЦФИ) | |
+7 (343) 289-00-00 | 33.00 ₽ 17-09-2021 (ЦФИ) | |
| 08:00-17:00 | ул. Волгоградская, д. 185 (ОКБ №1) (Предварительное бронирование) (343) 383-14-78 | 34.00 ₽ 17-09-2021 (ЦФИ) |
| 09:00-21:00 | ул. +7 (343) 214-46-46 | 34.00 ₽ 17-09-2021 (ЦФИ) |
| 08:00-17:00 | ул. Шварца, д. 14г (предварительное бронирование.) (сб. — вс. выходные) (343) 218-02-62 | 34.00 ₽ 17-09-2021 (ЦФИ) |
| 8:00-21:00 | г. Заречный, ул.Таховская, д. 4 (предварительное бронирование) +7 (34377) 7-27-35 | 34. 00 ₽ 00 ₽17-09-2021 (ЦФИ) |
| 08:00-16:00 | Арамиль, Садовая,10, 1-ый этаж +7 (34374) 2-42-21 | 34.00 ₽ 17-09-2021 (ЦФИ) |
| 08:00-18:00 | ул. Старых большевиков, д. 9 (ЦГБ №23, центральный вход поликлиники, 2-ой этаж, Предварительное бронирование.) (Выходной: СБ,ВС ) (343) 380-21-51 | 34.00 ₽ 17-09-2021 (ЦФИ) |
| 08:00-21:00 | ул. 8 800 200-05-00 | 34.00 ₽ 17-09-2021 (ЦФИ) |
| 8:00-21:00 | Березовский, Косых, 5 8 (34369) 4-75-40 | 34.00 ₽ 17-09-2021 (ЦФИ) |
| 8:00-18:00 | пер. Суворовский, д. 5б (Предварительное бронирование) +7 (343) 338-16-86 | 34. 00 ₽ 00 ₽17-09-2021 (ЦФИ) |
ул. Волгоградская, д. 190 (круглосуточно) +7 (343) 289-00-00 | 36.00 ₽ 17-09-2021 (ЦФИ) | |
ул.Уральская, д. 75 (круглосуточно) +7 (343) 289-00-00 | 36.00 ₽ 17-09-2021 (ЦФИ) | |
| 08:00-21:00 | ул. Латвийская, д. +7 (343) 273-01-95 | 37.00 ₽ 14-09-2021 (ЦФИ) |
| 8:00-22:00 | Ильича, 28 325 15 07 | 37.00 ₽ 17-09-2021 (ЦФИ) |
| 08:00-22:00 | ул. Заводская, д. 11 +7 (343) 289-00-00 | 38.00 ₽ 17-09-2021 (ЦФИ) |
| 08:00-19:00 | пер. +7 (343) 270-94-61 | 39.00 ₽ 17-09-2021 (ЦФИ) |
| 09:00-23:00 | ул. Победы, д. 38 +7 (343) 289-00-00 | 39.00 ₽ 17-09-2021 (ЦФИ) |
| 08:00-17:00 | Соболева, 29 (в здании поликлиники) (343) 383-63-72 | 39.00 ₽ 17-09-2021 (ЦФИ) |
ул. +7 (343) 289-00-00 | 39.00 ₽ 17-09-2021 (ЦФИ) | |
ул. Вильгельма де Геннина, д. 45 (круглосуточно) +7 (343) 289-00-00 | 40.00 ₽ 17-09-2021 (ЦФИ) | |
| 00:00-24:00 | ул. Вильгельма де Геннина, д. 34 (круглосуточно) +7 (343) 289-00-00 | 42.00 ₽ 17-09-2021 (ЦФИ) |
ул. +7 (343) 289-00-00 | 44.00 ₽ 17-09-2021 (ЦФИ) | |
ул. Стахановская, д. 45 (режим работы круглосуточно) +7 (343) 289-00-00 | 44.00 ₽ 17-09-2021 (ЦФИ) | |
| 07:00-23:00 | Родонитовая, 3/1 381-27-56 | 45.00 ₽ 17-09-2021 (ЦФИ) |
ул. +7 (343) 289-00-00 | 45.00 ₽ 17-09-2021 (ЦФИ) | |
| 09:00-22:00 | ул. Луначарского, д. 136 (Широкий ассортимент лекарст.препаратов, сопутс.товаров и лечебной косметики, скидки по дисконт.картам.) +7 (343) 289-00-00 | 46.00 ₽ 17-09-2021 (ЦФИ) |
ул. Родонитовая, д. 23 (круглосуточно) +7 (343) 289-00-00 | 47.00 ₽ 17-09-2021 (ЦФИ) | |
ул. 8 Марта, д. 188 (круглосуточно) +7 (343) 289-00-00 | 47.00 ₽ 17-09-2021 (ЦФИ) | |
| 08:00-20:00 | ул. Начдива Васильева , д. 1/4 (скидка 5% в суб. и воск. для всех) / ул. Волгоградская, д. 193 (скидка 5% в субботу и воскресенье для всех) +7 (343) 380-51-89 | 49.00 ₽ 17-09-2021 (ЦФИ) |
| 8:00-21:00 | проспект Ленина, д. 54/5 350-20-31, 350-41-69 | 50.00 ₽ 16-09-2021 (ЦФИ) |
ул. Челюскинцев, д. 21 (круглосуточно) +7 (343) 289-00-00 | 51.00 ₽ 17-09-2021 (ЦФИ) | |
ул. Вильгельма де Геннина, д. 31 (круглосуточно) +7 (343) 289-00-00 | 52.00 ₽ 17-09-2021 (ЦФИ) | |
ул. 8 Марта, д. 118 (круглосуточно) +7 (343) 289-00-00 | 52.00 ₽ 17-09-2021 (ЦФИ) | |
| 8:00-21:00 | Амундсена, 61 267-03-70 | 52.00 ₽ 16-09-2021 (ЦФИ) |
| 07:00-22:00 | ул. Куйбышева, д. 57 +7 (343) 289-00-00 | 53.00 ₽ 17-09-2021 (ЦФИ) |
| 08:00-22:00 | проспект Ленина, д. 38а +7 (343) 289-00-00 | 56.00 ₽ 17-09-2021 (ЦФИ) |
проспект Ленина, д. 24 +7 (343) 289-00-00 | 61.00 ₽ 17-09-2021 (ЦФИ) | |
| 08:00-22:00 | мкр. Светлый, д. 2 (Уктус) +7 (434) 381-24-75 | 64.00 ₽ 17-09-2021 (ЦФИ) |
Спирт левомицетиновый в ухо при отите у взрослых и детей
Отит является достаточно серьезным воспалительным заболеванием, возникающим в ушной раковине на фоне бактериальной инфекции. Чаще всего встречается у детей до трех лет, что связано с анатомическими особенностями ушных проходов: инфекция легко проникает из верхних дыхательных путей в ушную полость. Существует множество антибактериальных средств для лечения отита, одним из которых является Левомицетин – препарат, активно используемый в практике ЛОР-врача.
Основные сведения
Левомицетин, основным компонентом которого является хлорамфеникол, обладает высокой противомикробной активностью в отношении большинства бактерий. Препарат подавляет склонность возбудителей к размножению, а также препятствует продукции белка в бактериальных клетках. Выпускается в форме таблеток и порошка (для приготовления инъекционных растворов) для системного воздействия, а также в виде капель для ушей и глаз с целью местного влияния на возбудителя.
Левомицетин при отите достаточно часто используется во врачебной практике и назначается в виде спиртового раствора. Выпускается во флаконах в виде бесцветной жидкости, обладающей резким спиртовым запахом.
Левомицетиновые капли, помимо воздействия на возбудителя, уменьшают активность воспалительного процесса, оказывают обезболивающее и дезинфицирующее действие.
Использование препарата у детей
Несмотря на распространенное использование данного средства для взрослых, родители часто задаются вопросом: «Можно ли капать левомицетиновый спирт при отите детям? Безопасно ли использование средства?».
Необходимо знать, что препарат допустим к применению детьми, достигшими двенадцати лет, но только по назначению лечащего врача. Перед назначением лекарственного средства следует пройти обследование у специалиста, для исключения вероятности повреждения барабанной перепонки. Если в ее структуре все же выявляется повреждение, закапывать левомицетиновый спирт в ухо ребенку категорично запрещено.
При первых проявлениях заболевания, а именно при боли в ухе резкого характера, повышении общей температуры тела или же появлении гнойного выделения из уха, стоит незамедлительно обратиться к врачу, и ни в коем случае не заниматься самолечением.
Подготовка к проведению процедуры
Перед тем как закапать Левомицетин в ухо, важно избавить пациента от наличия гноя в ушах. Для этого используют ватную палочку, которую предварительно смачивают в перекиси водорода.
Голову пациента наклоняют в сторону, противоположную больному уху, и, оттягивая ушную раковину кверху и назад, очищают слуховой проход.
Неправильное проведение подобной манипуляции может привести к развитию серьезного осложнения, а именно к абсцессу, который возникает в результате глубокого проникновения гноя и препарата в ушной проход.
Правила использования
На протяжении многих лет лекарственное средство закапывали в уши и закрывали ватой для создания сухого тепла. Но часто после такого способа проведения процедуры были заметны осложнения: у пациентов возникал ожог в области слухового прохода, также часто наблюдалась полная утрата слуха. В связи с этим процесс закапывания в уши Левомицетина был полностью пересмотрен.
В настоящее время используют один из двух вариантов:
- Применение спиртовой турунды. Левомицетиновый спирт разводят в теплой воде в соотношении 1:1. Раствор должен быть доведен до температуры 35–37 градусов. Затем вату, смоченную в полученном составе, вставляют детям в ухо на 20–30 минут, этого вполне достаточно для наступления клинического эффекта и мало для термического повреждения.
- Использование компресса. Раствор точно также разводят с теплой водой, затем в нем смачивают марлю, которую помещают вокруг ушной раковины пациента. Чтобы достичь теплового эффекта, сверху помещают вату и фиксируют бинтом. Накладывают компресс максимум на 3 часа, после его снятия кожные покровы вокруг ушной раковины обрабатывают детским кремом.
В целом процедуру проводят 2–4 раза на день, но длительность курса должна составлять не более 5–7 дней.
Не при всех видах отита можно прибегать к тепловому эффекту, поэтому перед тем как его использовать, следует проконсультироваться со специалистом. Также необходимо помнить, что в неразбавленном состоянии спирт Левомицетиновый в ухо ни в коем случае не капается.
Противопоказания к приему
Левомицетин, как и многие другие препараты, не лишен ограничений к применению при некоторых состояниях, а именно:
- Возраст пациента. Состав можно применять детям только с 12-ти лет.
- Заболевания кожных покровов – экзема, псориаз.
- Наличие повреждений в самой барабанной перепонке или в слуховом проходе (раны, язвы).
- Нарушения функциональной способности со стороны печени и почек.
- Повышенная чувствительность к активным компонентам препарата.
Поскольку капли спиртового раствора Левомицетина содержат этанол, данное лекарственное средство запрещено к приему беременным и женщинам в период кормления.
Побочные реакции
При превышении допустимой дозировки препарата, у пациента могут наблюдаться аллергические проявления со стороны кожных покровов по типу крапивницы, которые сопровождаются зудом, отеком слизистых и покраснением кожных покровов в месте контакта.
Для того чтобы устранить подобные явления, иногда достаточно снизить дозу лекарственного средства. Если такой метод не приводит к исчезновению симптомов, тогда должен решаться вопрос об отмене препарата.
Не стоит забывать, что спиртовой раствор Левомицетина проявляет свою максимальную эффективность в составе комплексной терапии. Данный препарат хорошо взаимодействует с другими лекарственными средствами. Благодаря комплексной терапии, можно добиться быстрого исчезновения симптоматики и ускорить процесс выздоровления. Но приступать к такому лечению следует только после детального осмотра у отоларинголога, согласно его рекомендациям.
Вконтакте
Google+
Левомицетиновый спирт в уши: инструкция, применение, отзывы
Левомицетиновый спирт при отите использовать можно лишь для лечения воспаления наружного уха. Причем делать это надо очень осторожно: действующее вещество этого лекарства – антибиотик. А потому при неумелом пользовании он может оказать на орган слуха ототоксическое действие. То есть, стать причиной тугоухости и даже полной глухоты. Поэтому левомицетиновый спирт в уши надо капать осторожно, в точности соблюдая дозировку, назначенную врачом, не превышая рекомендованные сроки.
Что такое левомицетин?
Левомицетин – это синтетический антибиотик, который обладает хорошим антимикробным действием, поскольку эффективно уничтожает грамположительные и грамотрицательные бактерии. Причем он хорошо справляется как с активными микробами, что находятся в стадии размножения, так и с теми, что пребывают в состоянии покоя. Плюсом действующего вещества является то, что привыкание микробов к Левомицетину происходит очень медленно.
При этом Левомицетин неэффективен против грибков и простейших микроорганизмов. Он плохо справляется с кислотоустойчивыми бактериями, синегнойной палочкой и некоторыми другими патогенами.
Несмотря на способность успешно подавлять развитие вредоносных микробов, врачи использовать Левомицетин капли не спешат: он обладает ототоксическим влиянием на слух, поэтому способен спровоцировать тугоухость. Особенно это надо учитывать, если произошла перфорация барабанной перепонки (обычно это бывает при гнойном отите). Если лекарство после закапывания попадет в среднее ухо, оно станет причиной настолько сильных деструктивных изменений, что человек может оглохнуть.
Также следует сказать про другой компонент лекарства – этиловый спирт различной концентрации. С одной стороны, этанол обладает дезинфицирующим действием. С другой – орган слуха находится очень близко к головному мозгу. Поэтому даже несколько капель могут стать причиной опьянения, головокружения которое может длиться до пятнадцати минут. Эта особенность характерна для всех ушных капель, что содержат спирт, поэтому водители должны учитывать этот момент.
Лечение наружного отита
Если вы все-таки решились капать левомицетиновый спирт в уши, нужно иметь в виду, что он может помочь только при воспалении наружного уха (наружный отит). Если воспалительные процессы вызвали чувствительные к антибиотику бактерии, Левомицетин вызовет в патогенах процессы, из-за которых они прекратят свой рост и погибнут.
Дозировку при этом должен определить лечащий врач. Обычно он назначает две-три капли трижды в день. Перед этим флакончик с лекарством надо согреть в ладонях, чтобы левомицитиновые капли не были холодными. Еще один способ – смочить вату в растворе, сделать турундочку и заложить в ухо на указанное врачом время. После этой процедуры нужно быть готовым к тому, что может появиться головокружение и некоторые другие неприятные симптомы.
Левомицетина инструкция по применению капли в уши запрещает закапывать в следующих ситуациях:
- для лечения детей до 12 лет;
- беременным, кормящим матерям;
- людям, у которых аллергия на Левомицетин или этанол;
- перфорация барабанной перепонки;
- если из ушей течет гной или любая другая жидкость: это свидетельствует о разрыве барабанной перепонки;
- наличие ран в ушных проходах;
- при наличии грибка, экземы.
Обязательно надо прокапать весь назначенный врачом курс, даже если симптомы болезни уйдут. В противном случае выжившие патогены могут воспрянуть спустя некоторое время, – и болезнь вернется.
Но и нельзя применять препарат дольше назначенного срока. Обычно курс лечения составляет 7-10 дней, не более. После этого срока у бактерий может выработаться устойчивость к антибиотику, а на коже – появиться грибок (отомикоз). Кроме того, если болезненные симптомы во время лечения длятся так долго, это означает, что применяемое лекарство неэффективно, и его надо заменить.
Левомицетин и средний отит
Если при лечении воспаления наружного уха спиртовой раствор Левомицетина еще может помочь, при воспалительных процессах среднего уха (средний отит) он абсолютно неэффективен. Дело в том, что наружное ухо состоит из ушной раковины и костно-хрящевого канала, по которому звуковые волны попадают в орган слуха и упираются в барабанную перепонку. Она начинает вибрировать под их воздействием и передает сигналы слуховым косточкам, которые находятся в полости среднего уха. По ним сигнал идет дальше во внутреннее ухо, где преобразовывается в понятный для головного мозга сигнал и поступает по слуховому нерву к звуковым анализаторам.
Барабанная перепонка – очень прочная мембрана, непроницаемая для воздуха и воды. В том числе – для любых капель, что поступают к ней по ушному каналу. Вот почему левомицетиновый спирт в ухо при среднем отите попросту не сможет добраться до бактерий и уничтожить их.
Поэтому при среднем отите главной задачей является разблокировать евстахиевы каналы, которые связывают среднее ухо с носоглоткой. Именно они являются основным путем, по которому в ушную полость проникают вирусы и бактерии во время простудных и других заболеваний, что поражают верхние дыхательные пути.
Эти сначала приводит к отеку слизистой носоглотки, затем – евстахиевых каналов. Из-за этого гной и другая жидкость, что образовались в ушной полости под влиянием вирусов и бактерий, неспособна покинуть среднее ухо по евстахиевым трубам и выйти наружу. Тогда экссудат начинает скапливаться, давить на стенки ушной полости, барабанную перепонку. И если его станет слишком много – мембрана прорвется и гной вытечет наружу. В худшем случае могут пойти осложнения на внутреннее ухо, что приведет к развитию опасных не только для слуха, но и для жизни болезней.
Чтобы этого не допустить и разблокировать евстахиевы каналы, надо закапывать в нос сосудосуживающие капли трижды в день. Также хорошо помогут противоотечные средства. При этом следует помнить, что нельзя закапывать Левомицетин в нос при поражениях верхних дыхательных путей. Для снятия боли подойдут таблетки (например, парацетамол). Кроме того, чтобы лечение было успешным, обязательно надо вылечить спровоцировавшее его заболевание. Обычно после этого боль в ухе проходит самостоятельно.
Перепрофилирование хлорамфениколацетилтрансферазы для создания надежной и эффективной платформы для биосинтеза сложных эфиров
Аннотация
Надежные и эффективные ферменты являются важными модулями для метаболической инженерии и стратегий синтетической биологии в биологических системах для создания цельноклеточных биокатализаторов. Конденсируя ацил-КоА и спирт, спиртовые ацилтрансферазы (ААТ) могут служить в качестве взаимозаменяемого метаболического модуля для микробного биосинтеза разнообразного класса молекул сложных эфиров с широким применением в качестве ароматизаторов, ароматизаторов, растворителей и биотоплива.Однако текущая нехватка надежных и эффективных ААТ значительно ограничивает их совместимость с гетерологичными путями-предшественниками и микробными хозяевами. Посредством биоразведки и рациональной белковой инженерии мы идентифицировали и перепрофилировали хлорамфениколацетилтрансферазы (CAT) мезофильных прокариот, чтобы они функционировали как надежные и эффективные ААТ, совместимые как минимум с 21 спиртом и 8 ацил-КоА субстратами для микробного биосинтеза линейных, разветвленных, насыщенных, ненасыщенных и ненасыщенных. / или ароматические сложные эфиры.Подключив лучший сконструированный CAT (CATec3 Y20F) к грамотрицательной мезофильной бактерии Escherichia coli , мы продемонстрировали, что рекомбинантный штамм может эффективно преобразовывать различные спирты в желаемые сложные эфиры, например, достигая титра 13,9 г / л изоамилацетата. с конверсией 95% при периодической ферментации с подпиткой. Рекомбинантная E. coli также была способна моделировать сложноэфирный профиль роз с высокой конверсией (> 97%) и титром (> 1 г / л) ферментируемых сахаров при 37 ° C.Точно так же рекомбинантная грамположительная целлюлолитическая термофильная бактерия Clostridium thermocellum , несущая CATec3 Y20F, может производить многие из этих сложных эфиров из устойчивой целлюлозной биомассы при повышенных температурах (> 50 ° C) благодаря замечательной термостабильности сконструированного фермента. В целом, сконструированные CAT могут служить надежной и эффективной платформой для биосинтеза сложных эфиров из возобновляемых и устойчивых источников сырья.
Введение
Метаболическая инженерия и подходы к синтетической биологии позволяют управлять цельноклеточными биокатализаторами для быстрого и эффективного производства ценных химикатов из возобновляемых и экологически чистых источников сырья и органических отходов, помогая снизить нашу зависимость от обычного химического синтеза на основе нефти (1–3).Ферменты являются важными модулями, которые облегчают взаимозаменяемую структуру метаболических путей для выполнения желаемых функций среди микробов-хозяев (4, 5). Критически важным для оптимального дизайна гетерологичных путей является наличие надежных и эффективных ферментов, совместимых с различными эндогенными путями и микробными хозяевами, чтобы обеспечить комбинаторный биосинтез желаемых молекул.
Одним из важных примеров, требующих широкой ферментативной совместимости, устойчивости и эффективности, является разработка микробных систем для производства разнообразных классов сложных эфиров.В промышленности сложные эфиры находят разнообразное применение в качестве ароматизаторов (6, 7), ароматизаторов (8), растворителей (9) и топлива (10–13). В природе летучие сложные эфиры образуются с помощью спиртовой ацилтрансферазы (AAT, EC 2.3.1.84), которая конденсирует спирт и ацил-КоА в термодинамически благоприятной реакции, обеспечивая ароматизаторы и ароматизаторы созревающим фруктам (14) и ферментирующим дрожжам (7) и играет экологическую роль в опылении (15). Вдохновленные природой, большинство стратегий метаболической инженерии и синтетической биологии использовали эукариотические ААТ, происходящие из растений или дрожжей, для микробного биосинтеза целевых сложных эфиров (8, 9, 16, 17).Однако этим эукариотическим ААТ не хватает устойчивости, эффективности и совместимости, поскольку они обычно демонстрируют плохую экспрессию ферментов (18), растворимость (19) и термостабильность (20) в микробах, что ограничивает оптимальное микробное производство сложных эфиров. Кроме того, ограниченные знания о профилях субстратов и специфических особенностях AAT часто требуют трудоемких биологических исследований AAT на предмет индивидуальных эфиров-мишеней (8, 9, 13, 17, 18). Следовательно, разработка надежных и эффективных ААТ, совместимых с множественными путями и микробными хозяевами, имеет решающее значение для расширения биологических путей биосинтеза созданных сложных эфиров.
Хлорамфеникол-О-ацетилтрансфераза (CAT, EC 2.3.1.28) представляет собой фермент устойчивости к антибиотикам, который выводит токсины на хлорамфеникол и производные антибиотики, которые ингибируют удлинение белка в организмах и вызывают гибель клеток путем ацетилирования (21). Организмы сопротивляются этому сильнодействующему препарату, укрывая CATs, которые демонстрируют почти идеальную каталитическую эффективность при привлечении ацетил-КоА (ов) для детоксикации хлорамфеникола (22, 23). В природе ген cat является одним из наиболее распространенных генетических элементов (24), экспрессирующим функциональный фермент в широком спектре организмов, включая растения (25), животных (26) и бактерии (27).Интересно, что при использовании в качестве селекции антибиотиков в рекомбинантной Escherichia coli некоторые CAT проявляли беспорядочную связь с субстратом, что приводило к неожиданному образованию сложных эфиров (8, 28). Недавно сконструированный целлюлолитический термофил Clostridium thermocellum (Hungateiclostridium thermocellum) , несущий CAT, полученный из мезофила Staphylococcus aureus (CATsa), был способен производить изобутилацетат из целлюлозы при повышенных температурах (29, 30). Здесь мы исследовали, могут ли новые CATs быть идентифицированы и перепрофилированы для функционирования в качестве надежных и эффективных AAT, совместимых с широким спектром путей и микробных хозяев, для обеспечения биосинтеза сложных эфиров.
Результаты и обсуждение
Идентификация полезных мутаций для перепрофилирования CAT в надежные и эффективные AAT
Сначала мы исследовали, можно ли сконструировать CAT для повышения устойчивости и эффективности по отношению к спиртам с меньшей цепью, отличным от нативного субстрата хлорамфеникола (рис. 1A). Для руководства CAT-инженерией мы создали модель гомологии белков термостабильного и беспорядочного CATsa S. aureus из доступных белковых структур (29, 31–33) и проанализировали его стабильность и сродство связывания со спиртами с меньшей цепью и ацетил-КоА. необходимые для биосинтеза эфиров (рис.1Б, 1С). В качестве типичного спирта изобутанол был выбран для моделирования стыковки и экспериментальной характеристики вариантов CAT на надежность и эффективность, поскольку этот спирт намного меньше по размеру и сильно отличается от хлорамфеникола и может эффективно продуцироваться организмами (34, 35). Скрининг сродства и стабильности с помощью мутагенеза in silico выбранных остатков связывающего кармана CATsa позволил предположить, что некоторые кандидаты потенциально изменяют связывание изобутанола (рис. S1). Путем экспериментального конструирования и характеристики 26 лучших вариантов CATsa с использованием микробного скринингового анализа in vivo (36, 37) мы определили вариант CATsa Y20F, демонстрирующий наиболее значительное увеличение конверсии изобутанола в изобутилацетат, примерно в 43 раза выше чем его дикий тип (Таблица S1).
Рисунок 1.Белковая инженерия CAT, полученная из Staphylococcus aureus (CATsa), для повышения эффективности и устойчивости к изобутанолу. (A) Схема рабочего процесса инженерии белков CATsa. (B) Модель гомологии белков CATsa. (C) Предлагаемый механизм реакции биосинтеза сложного эфира из спирта и ацетил-КоА. (D) Температуры плавления CATsa и его вариантов. (E) Каталитическая эффективность CATsa и его вариантов по отношению к изобутанолу.В панелях D-E каждое значение представляет собой среднее ± 1 стандартное отклонение по меньшей мере из трех биологических повторов. Для каждого анализа in vitro 2 мМ ацетил-КоА использовали в качестве вспомогательного субстрата. (F-H) Взаимодействие аминокислотного остатка 20 (т.е. Y20 или Y20F), His-189 и спирта (т.е. хлорамфеникола или изобутанола) в переходном состоянии. На панели F активный сайт His-189 взаимодействует с нативным остатком Y20 и хлорамфениколом. В панели G природный субстрат хлорамфеникол в панели F заменен изобутанолом.В панели H Y20 в панели G заменяется на Y20F.
Далее мы охарактеризовали надежность и эффективность CATsa Y20F in vitro . Поскольку предыдущие исследования продемонстрировали, что CATsa F97W улучшает активность по отношению к изобутанолу (29), а CATsa A138T повышает термостабильность (38), мы также исследовали, увеличивает ли комбинаторный мутагенез этих отдельных полезных вариантов CATsa производительность фермента (рис. 1D, 1E). Мы обнаружили, что CATsa Y20F улучшил каталитическую эффективность по сравнению с CATsa F97W дикого типа и CATsa F97W на 5.0- и 2,5 раза соответственно (рис. 1E), а температура плавления незначительно снизилась с 71,2 до 69,3 ° C (рис. 1D). Среди комбинаторного мутагенеза CATsa Y20F A138T показал как самую высокую температуру плавления (76 ± 0,0 ° C), так и каталитическую эффективность по отношению к изобутанолу (10,3 ± 1,2, 1 / M / s), соответственно. Было высказано предположение, что водородные связи между хлорамфениколом, каталитическим центром His-189 и Tyr-20 в переходном состоянии имеют решающее значение для высокой каталитической эффективности CAT, в частности, ограничивая связывание хлорамфеникола в правильной ориентации (39). (Инжир.1F). Поскольку мутация Y20F сохраняет ароматическое кольцо, которое способствует таутомерной стабилизации His-189, каталитический имидазол все еще может гибко взаимодействовать со спиртами с меньшей цепью (рис. 1G, 1H), вероятно, способствуя повышенной ферментативной активности, наблюдаемой при биосинтезе изобутилацетата. (Рис. 1E).
Биоразведка CATs
Чтобы выяснить, имеют ли место в природе высокая термостабильность и алкогольная неразборчивость CATs, мы использовали биоинформатический анализ, чтобы выбрать библиотеку из 27 CAT, представляющих тип-A и тип-B, которые структурно различимы (24) и производны от разных организмов (рис.2А, таблица S2). Мы синтезировали эти CAT, экспрессировали, очистили и охарактеризовали их температуры плавления и беспорядочную активность по отношению к изобутанолу (рис. 2A, S2). Большинство CATs показали температуру плавления выше 60 ° C, за исключением CAT_GEO (T m = 43,5 ° C) (Таблица S2). Среди этих кошек CAT1_ECOLIX (CATec1), CAT3_ECOLIX (CATec3), CATsa, CAT_KLEPS (CATkl), CAT2_ECOLIX (CATec2), CAT_HAEIF (CATha) и CAT_CLOBU (CATcb) проявили самую высокую специфическую активность в отношении изобутанола при 50 ° C (фиг.S2B). Пять из этих семи CAT с наибольшей изобутанол-активностью были эволюционно родственны, что позволяет предположить, что на их активность по отношению к изобутанолу могут влиять их уникальные структурные особенности. Далее мы оценили кинетическую термостабильность этих семи наиболее изобутанол-активных КАТ, измерив их потерю активности после часовой инкубации при повышенных температурах 50, 55, 60, 65 и 70 ° C (рис. S3). Примечательно, что CATec3 и CATec2, полученные из мезофильного E. coli , могли сохранять более 95% активности при 70 ° C, в то время как остаточная активность CATsa быстро снижалась.Структурный анализ показал, что CATec3 имеет более сильную энергию взаимодействия, чем CATsa (Fig. S4).
Рисунок 2.Биоразведка и белковая инженерия CATs. (A) Филогенетическое дерево 28 CAT и тепловая карта их температур плавления (Tm) и активности по отношению к изобутанолу (IBOH). Числа в филогенетическом дереве представляют значения начальной загрузки (%) из 1000 повторений начальной загрузки. (B) Температуры плавления вариантов CAT3_ECOLIX (CATec3). (C) Каталитическая эффективность CATec3 и его вариантов по отношению к изобутанолу. (DH) Сравнение каталитической эффективности CATec3 и CATec3 Y20F по отношению к (D) бутанолу, (E) пентанолу, (F) бензиловому спирту, (G) 2-фенилэтиловому спирту и ( H) хлорамфеникол. В панелях B-H каждое значение представляет собой среднее ± 1 стандартное отклонение по меньшей мере из трех биологических повторов. (I) Относительная активность CATec3 Y20F в отношении ацил-КоА по сравнению с ацетил-КоА. Изобутанол (400 мМ) был добавлен в качестве вспомогательного субстрата.Каждое значение представляет собой среднее ± 1 стандартное отклонение для шести биологических повторов. (J) Повышение температуры плавления и каталитической эффективности сконструированных CAT по отношению к изобутанолу. Каждое значение представляет собой среднее значение ± 1 стандартное отклонение по крайней мере из трех биологических повторов.
Engineering CAT для повышенной надежности, эффективности и совместимости
Обнаружение высокой термостабильности и беспорядочной активности CATec3 в отношении гораздо меньшего количества спирта (например, изобутанола) (рис. S2, S3) побудило нас исследовать, есть ли полезные мутации, обнаруженные в CATsa может быть введена в CATec3 для дальнейшего улучшения ее производительности.Мы сконструировали варианты CATec3, несущие одиночные и комбинаторные мутации F97W и Y20F. Поскольку остаток гомолога Ala-138 не существует в CATec3, его мутация не была сконструирована и охарактеризована. Интересно, что результаты показали, что вариант CATec3 Y20F улучшил не только каталитическую эффективность (13,0 ± 0,2, 1 / M / с), примерно в 3,3 раза выше, чем его дикий тип, но и температуру плавления (87,5 ± 0,5 ° C). Среди всех охарактеризованных CATec3 Y20F является наиболее термостабильным и изобутанол-активным (Таблица S3).
Мотивированные гибкой структурой, введенной мутацией Y20F по отношению к различным спиртам (рис. 1H, S5), мы дополнительно исследовали, проявляет ли CATec3 Y20F повышенную эффективность и совместимость с библиотекой из 16 линейных, разветвленных, насыщенных, ненасыщенных и ароматических спиртов. с ацетил-КоА в качестве дополнительного субстрата (таблица 1). Мы обнаружили, что CATec3 Y20F был более эффективен в отношении объемных и длинноцепочечных спиртов, которые более гидрофобны, чем короткоцепочечные спирты (таблица 1), вероятно, из-за более сильного сродства связывания (рис.S5D). По сравнению с CATec3 дикого типа против репрезентативного набора из шести спиртов, которые могут быть синтезированы в естественных условиях организмами (рис. S6), мы обнаружили, что вариант CATec3 Y20F продемонстрировал гораздо более высокую каталитическую эффективность по отношению к бутанолу в 4,0 раза (рис. 2D). , пентанол в 8,8 раза (рис. 2E), бензиловый спирт в 6,9 раза (рис. 2F) и фенилэтиловый спирт в 6,2 раза (рис. 2G), соответственно. Напротив, каталитическая активность CATec3 Y20F в отношении нативного субстрата хлорамфеникола снизилась примерно на 3.В 2 раза по сравнению с активностью дикого типа (рис. 2Н).
Таблица 1.Каталитическая эффективность CATec3 Y20F по отношению к нескольким спиртовым субстратам. Каталитическую эффективность измеряли по кинетическим реакциям, проводимым при 50 ° C. Дополнительный субстрат, ацетил-КоА, добавляли в насыщенной концентрации 2 мМ. Значения представляют собой среднее значение ± стандартное отклонение по крайней мере для трех биологических повторов. * Расчет параметров относительно этанола не был статистически практичным из-за низкого сродства.
Кроме того, мы обнаружили ацетилирование жирных спиртов, таких как октанол и деканол, с образованием длинноцепочечных сложных эфиров (рис. S6B, S6C), которые потенциально могут быть использованы для биодизельного топлива. Спиртовая совместимость CATec3 Y20F расширилась от этанола до терпеноидных спиртов, таких как гераниол и нерол. Из-за высокого значения K M (> 1M) по отношению к этанолу, CATec3 Y20F более благоприятно применяется для биосинтеза сложных эфиров спирта с более высокой цепью (рис. S6A). Эта характеристика потенциально полезна для получения в организмах сложных эфиров, а не этиловых эфиров, поскольку этанол является обычным побочным продуктом ферментации, который может выступать в качестве конкурентного субстрата.По сравнению с CATsa Y20F A138T, CATec3 Y20F проявлял более высокую активность не только в отношении изобутанола, но и большинства других спиртов (рис. S7). Примечательно, что эти сконструированные CAT проявляли различную алкогольную специфичность (Таблица S3). Например, CATsa Y20F A138T был относительно более специфичным для фенилэтилового спирта, чем терпеноидные спирты, по сравнению с CATec3 Y20F (фиг. S7).
Затем мы исследовали, совместим ли CATec3 Y20F также с длинноцепочечными ацил-КоА. Мы проанализировали относительную активность CATec3 Y20F против набора из 10 линейных, разветвленных и ароматических ацил-КоА, которые могут быть синтезированы в организмах вместе с изобутанолом в качестве вспомогательного субстрата (рис.2I). CATec3 Y20F обладает наивысшей активностью по отношению к природному субстрату ацетил-КоА, который является наиболее распространенным и критическим метаболитом-предшественником для биосинтеза клетки. По сравнению с ацетил-КоА, CATec3 Y20F достиг 46%, 28%, 15%, 12%, 11% и 9% активности в отношении изобутил-КоА, пропионил-КоА, бутирил-КоА, валерил-КоА, фенилэтил-КоА. , и изовалерил-КоА соответственно. Не было обнаружено активности против линейных жирных ацил-КоА, более длинных, чем валерил-КоА (фиг. 2I). Интересно, что CATec3 Y20F также проявлял активность в отношении необычного лактил-КоА для биосинтеза лактатного эфира.Поскольку лактил-КоА не коммерчески доступен для анализа in vitro , мы определили активность in vivo с использованием рекомбинантной E. coli , коэкспрессирующей CATec3 Y20F и пропионил-КоА трансферазы (ПКТ), полученной из разных микробов. включая Thermus thermophilus (PCTtt), который переносит КоА из ацетил-КоА в лактат (40, 41) (рис. S8). Путем совместного кормления рекомбинантной E. coli с 2 г / л изоамилового спирта и лактата можно было получить изоамиллактат на уровне примерно 66.6 мг / л (рис. S8B), что по крайней мере в 2,5 раза выше, чем при использовании эукариотических ААТ, о которых сообщалось ранее (9). Поскольку PCTtt происходит от термофила, путь биосинтеза лактатного эфира, вероятно, устойчив и совместим с термофильными хозяевами. Взятые вместе, мы недвусмысленно показали, что CATs можно перепрофилировать для de novo термостабильных AAT (рис. 2J). Разработанный CATec3 Y20F демонстрирует исключительную надежность, эффективность и совместимость с различными спиртами и фрагментами ацил-КоА, что делает его идеальной платформой для синтеза дизайнерских биоэфиров в нескольких организмах.
Повторное использование сконструированной CAT для биосинтеза дизайнерских сложных эфиров в мезофильных
E. coliКонверсия микробов представляет собой возобновляемый и устойчивый способ синтеза химикатов. Здесь мы охарактеризовали, насколько эффективен и совместим сконструированный CATec3 Y20F для обеспечения биосинтеза дизайнерских сложных эфиров в мезофильной E. coli , рабочей лошадке для промышленной биотехнологии. Чтобы продемонстрировать биосинтез дизайнерских эфиров ацетата, мы сконструировали HSEC01, рекомбинантный белок E.coli BL21 (DE3), несущий CATec3 Y20F под контролем промотора T7lac, который использует свой собственный метаболизм для преобразования ферментируемых сахаров в предшественник ацетил-КоА, и охарактеризовал сконструированный штамм в среде для выращивания, дополненной типичными линейными, разветвленными, насыщенными, ненасыщенные и / или ароматические спирты и с гексадеканом для in situ экстракции сложного эфира (фиг. 3A). Результат показал, что рекомбинантный CATec3 Y20F-экспрессирующий E. coli может продуцировать все ожидаемые эфиры ацетата с относительно высокой эффективностью и совместимостью.В периодических культурах преобразование всех спиртов в их соответствующие эфиры ацетата достигало выхода более 50% (моль / моль) в течение 24 часов (рис. 3B). Примечательно, что выходы фенилэтила и геранилацетата могут достигать 80% (моль / моль). Рекомбинант E. coli продуцировал и секретировал дизайнерские биоэфиры с конечными титрами 2,6 г / л бутилацетата, 2,3 г / л изобутилацетата, 3,1 г / л пентилацетата, 2,9 г / л изоамилацетата, 2,6 г / л 3. -гексенилацетат, 0,9 г / л бензилацетата, 1,2 г / л 2-фенилэтилацетата и 0.3 г / л геранилацетата (рис. S9). Чтобы еще больше увеличить производство сложного эфира, мы выполнили периодическую ферментацию с подпиткой, используя типичный разветвленный изоамиловый спирт и ароматический фенилэтиловый спирт. При периодической подаче спиртов до 10 г / л рекомбинантная E. coli могла производить ожидаемые эфиры с относительно высокой эффективностью, достигая титров 13,9 г / л и 10,7 г / л и выходов 95% (моль / моль) и 80% (моль / моль) для изоамилацетата и фенилэтилацетата соответственно (рис.3С). Мы не наблюдали какого-либо заметного ингибирования роста при таком высоком уровне образования сложного эфира в периодическом режиме с подпиткой из-за экстракции эфира in situ гексадеканом (рис. S10), хотя как спирты, так и сложные эфиры, как известно, токсичны для микробов. здоровье при относительно низких концентрациях (<2 г / л) (42, 43). Поскольку гетерологичные пути высших спиртов были метаболически сконструированы в рекомбинантных организмах (например, E. coli ) (34, 44–46), дизайнерские биоэфиры могут быть произведены с использованием сконструированного CAT и совместного кормления ферментируемых сахаров и спиртов. как показано здесь, или с помощью естественных ферментативных процессов, которые производят спирты.
Рисунок 3. Биосинтезсложного эфира мезофильными и термофильными организмами, несущими надежный и эффективный CATec3 Y20F. (A) Биосинтез сконструированного сложного эфира при 37 ° C путем совместного кормления штамма E. coli , экспрессирующего CATec3 Y20F, глюкозой и различными спиртами. (B) Эффективность конверсии спирта. Каждый спирт добавляли в среду из расчета 3 г / л для н-бутанола, изобутанола, н-пентанола и изоамилового спирта, 1 г / л для бензилового спирта и фенилэтилового спирта и 0.3 г / л для гераниола. (C) Преобразование изоамилового спирта в изоамилацетат с подпиткой изоамилового спирта с помощью CATec3 Y20F-экспрессирующей E.coli HSEC01. (D) Биосинтез сложного эфира в развивающихся лепестках розы. Розы (Rosa hybrida) синтезируют летучие эфиры с помощью спиртовых ацилтрансфераз (ААТ), что придает уникальный аромат. (E) Смоделированный эфирный профиль розы по HSEC01. (F) Биосинтез дизайнерского сложного эфира при 55 ° C путем совместного кормления CATec3 Y20F-экспрессирующего ° C.thermocellum штамм HSCT2108 с целлюлозой и различными спиртами. (G) Эффективность конверсии спирта. Каждый спирт добавляли в среду в количестве 3 г / л н-бутанола, 3 г / л изобутанола, 3 г / л н-пентанола, 3 г / л изоамилового спирта и 0,3 г / л гераниола. (H) Производство изобутилового эфира HSCT2108 с различными добавками концентраций изобутанола. На панелях B-C, E и G-H каждое значение представляет собой среднее ± 1 стандартное отклонение для трех биологических повторов.
Естественное воссоздание сложноэфирного профиля роз в
E. coliБлагодаря высокой эффективности и совместимости сконструированного CAT для биосинтеза дизайнерского сложного эфира в рекомбинантном CATec3 Y20F-экспрессирующем E. coli HSEC01, мы дополнительно исследовали, является ли CATec3 Y20F можно использовать в качестве эффективного ААТ для создания профилей сложных эфиров, проявляемых цветочными растениями. В природе эукариотические ААТ в цветочных растениях образуют смесь летучих сложных эфиров, которые способствуют их полезному взаимодействию с окружающей средой.Например, розы (Rosa hybrida) используют ААТ, регулируемые на стадиях их развития (47), для синтеза и выделения летучих сложных эфиров для привлечения опылителей (рис. 3D). Чтобы имитировать сложноэфирный профиль Rosa hybrida , мы скармливали HSEC01 смесь спиртов с общей рабочей концентрацией 1 г / л, состоящую из 0,2 г / л гексанола, 0,2 г / л 0,15 г / л 3-цис- гексен-1-ол, бензиловый спирт, 0,15 г / л фенилэтилового спирта, 0,1 г / л гераниола, 0,1 г / л нерола и 0,1 г / л цитронеллола в средней логарифмической фазе (OD 600 нм ~ 1.0). Рекомбинант E. coli был способен быстро и полностью преобразовывать спиртовую смесь в желаемые профили ацетатного эфира с выходом 97,1 ± 0,7% (моль / моль) и титром ~ 1,5 г / л в течение 12 часов (рис. . 3E, S11A). Для высокого производства сложных эфиров экстракция in situ с использованием наложения гексадекана очень важна для снижения токсичности сложных эфиров (рис. 3E, S11B).
Обеспечение биосинтеза созданного сложного эфира в целлюлолитическом термофиле
C. thermocellumУчитывая природную метаболическую способность эффективно разлагать устойчивую целлюлозную биомассу при повышенных температурах (≥ 50 ° C), C.thermocellum , целлюлолитическая, термофильная, облигатно-анаэробная, грамположительная бактерия, превратилась в микробную платформу для консолидированной биопереработки (CBP), где синтез целлюлолитических ферментов, гидролиз биомассы и ферментация могут происходить за один этап для получения желаемых химических веществ. Используя высокую термостабильность CATec3 Y20F, мы исследовали, может ли CATec3 Y20F, содержащий C. thermocellum , катаболизировать целлюлозу и эффективно преобразовывать различные спирты в дизайнерские биоэфиры при повышенной температуре 55 ° C (рис.3F). Мы выбрали сконструированный C. thermocellum Δ clo1313_0613 , Δ clo1313_0693 в качестве хозяина, потому что его две углеводные эстеразы были разрушены, чтобы облегчить деградацию сложного эфира (30). Путем совместного кормления целлюлозой и каждым высшим спиртом рекомбинантный C. thermocellum мог производить все соответствующие эфиры ацетата (фиг. 3G, фиг. S12A). Поскольку C. thermocellum имеет эндогенный путь изобутил-КоА (48), мы также наблюдали образование сложных эфиров изобутирата, таких как бутилизобутират и изобутилизобутират, в качестве побочных продуктов (рис.S12B). Многие из этих сложных эфиров, такие как н-бутиловый, н-пентиловый, изоамиловый и гераниловый сложные эфиры, никогда не сообщалось о возможности синтеза в термофиле. Среди сложных эфиров изоамилацетат был получен с наивысшим выходом конверсии> 30% (моль / моль) и титром 1,2 г / л. Продукция сложного эфира в C. thermocellum была не такой высокой, как наблюдаемая в E. coli , вероятно, из-за метаболической нагрузки, необходимой для выработки целлюлолитических ферментов для разложения целлюлозы вместе со сверхэкспрессией гетерологичного гена.Повышенный титр изобутиловых эфиров был достигнут при кормлении более высокой концентрацией изобутанола (рис. 3H) ниже летальной концентрации (рис. S13), что указывает на то, что экспрессия фермента и / или доступность спирта, вероятно, были ненасыщенными в C. thermocellum . Дальнейшая инженерия штаммов и / или оптимизация среды и рабочих условий могут помочь увеличить производство дизайнерских биоэфиров по технологии CBP.
Термостабильность сконструированного CAT играет решающую роль в эффективном биосинтезе сложных эфиров при повышенных температурах до
° C.thermocellumФункциональная экспрессия гетерологичного белка в термофилах требует высокой термостабильности, которая не совсем понятна и часто представляет собой значительное узкое место в метаболической инженерии этих организмов. Вдохновленные различиями в каталитической эффективности и температурах плавления между разработанными CAT (Таблица S3), мы исследовали, как термостабильность CATs влияет на выработку сложного эфира в C. thermocellum . Мы охарактеризовали рекомбинантный C.thermocellum Δ clo1313_0613 Δ clo1313_0693 , несущие различные CATs с отличительными температурами плавления и каталитической эффективностью для производства in vivo изобутилового эфира путем совместной подачи целлюлозы и изобутанола при 55 ° C (рис. 4A). Среди рекомбинантных штаммов C. thermocellum HSCT2108, несущий CATec3 Y20F, который имеет наивысшую каталитическую эффективность и температуру плавления, продуцировал самый высокий уровень изобутиловых эфиров (892 мг / л), что примерно в 14 раз выше, чем у CATsa F97W-экспрессирующих. С.термоцелл HSCT2105. Несмотря на то, что CATsa Y20F A138T имеет аналогичную каталитическую эффективность, но более высокую температуру плавления по сравнению с CATsa Y20F, штамм HSCT2113, экспрессирующий CATsa Y20F A138T, продуцировал на 46% больше эфиров, чем штамм HSCT2106, экспрессирующий CATsa Y20F. Точно так же мы также наблюдали более высокую продукцию сложного эфира в штамме HSCT2107, экспрессирующем CATec3, чем в штамме HSCT2105, экспрессирующем CATsa F97W, где CATec3 имеет аналогичную каталитическую эффективность, но более высокую температуру плавления. Примечательно, что и HSCT2107, и HSCT2113 продуцировали сложные эфиры на очень похожем уровне, хотя CATsa Y20F A138T имеет более высокую каталитическую эффективность, но температуру плавления примерно на 10 ° C ниже, чем CATec3.Эти результаты убедительно свидетельствуют о том, что надежность CAT с повышенной термостабильностью играет решающую роль для эффективного производства сложного эфира в ° C. Thermocellum при повышенных температурах.
Рисунок 4.Влияние термостабильности CAT на устойчивый и эффективный микробный биосинтез сложных эфиров при повышенных температурах. (A) Производство изобутилового эфира рекомбинантных штаммов C. thermocellum , несущих различные CAT. (B-C) Влияние температуры на продукцию изобутилового эфира штаммом (B) CATec3-экспрессирующим HSCT2107 и (C) CATec3-экспрессирующим Y20F штаммом HSCT2108.На панелях A-C , каждые данные представляют собой среднее ± 1 стандартное отклонение для трех биологических повторов. Изобутанол (5 г / л) подавали на ранней стационарной фазе культуры, чтобы избежать ингибирования роста клеток (фиг. S13). (D) Сравнение различий в содержании триптических пептидов CAT между HSCT2108 и HSCT2107 на пептидной основе (n = 6 пептидов). Средняя («x») и медиана («-») log2 различия пептидов составляли 1,1 и 1,0 соответственно. Данные представлены в виде квартилей из трех биологических повторов (значение p <0.005, см. Также рис. S14B).
Для дальнейшего выяснения влияния термостабильности CAT на продукцию сложных эфиров, мы охарактеризовали производительность HSCT2113 и HSCT2108 при различных повышенных температурах (рис. 4B, 4C), совместимых с ростом C. thermocellum . Интересно, что HSCT2113 увеличивал выработку сложного эфира до 220 мг / л при 50 ° C, что примерно в 2 раза выше, чем 55 ° C (фиг. 4B). Напротив, HSCT2108 продуцировал сложные эфиры с относительно аналогичным уровнем около 1 г / л при 50 и 55 ° C, в то время как продукция снижалась до 74 мг / л при 60 ° C (рис.4С). Протеолиз — это распространенный клеточный процесс разрушения и удаления денатурированных или неправильно свернутых белков (49). Если температура роста клеток повлияет на целостность CATs, их внутриклеточная численность изменится. Чтобы исследовать изменения внутриклеточной численности CAT, мы проанализировали и сравнили протеомы двух репрезентативных штаммов, экспрессирующих CATec3, дикого типа (HSCT2107) по сравнению с мутантом Y20F (HSCT2108). Поскольку единственное различие между этими двумя штаммами заключается в замене одной аминокислоты, мы могли надежно количественно оценить относительную численность каждого CAT, сравнивая фрагменты триптических пептидов (рис.S14A). Результат показал, что CATec3 Y20F был в 2,2 раза (средняя разница между содержаниями пептидов) более распространенным, чем CATec3 (фиг. 4D). Поскольку CATec3 Y20F имеет температуру плавления на 7 ° C выше, чем CATec3 (Таблица S3), изменение внутриклеточного содержания белка может означать меньшую степень денатурации или неправильного свертывания из-за более высокой термостабильности белка. В целом термостабильность CAT имеет решающее значение для устойчивого и эффективного производства сложного эфира у термофилов за счет поддержания внутриклеточного обилия белка.
Материалы и методы
Моделирование гомологии белков CATs,
in silico мутагенез и анализ контакта с белкамиМы использовали инструменты Swiss-Model (50) и «Builder» коммерческого программного обеспечения MOE (Molecular Operating Environment software). , версия 2019.01) (51) для создания трехмерных (3D) структур CAT, спиртов, ацил-CoAs и их комплексов, как описано ранее (29). Чтобы выполнить моделирование стыковки в MOE, мы начали с поиска потенциального связывающего кармана с помощью инструмента Site Finder и выбора сайта с наилучшей оценкой, который согласуется с указанными каталитическими сайтами (52).Затем мы выполнили моделирование стыковки ацил-КоА и спирта с CAT, используя протокол индуцированной подгонки с методом размещения Triangle Matcher и функцией оценки London ΔG. Мы выбрали позу связывания с наилучшей оценкой, демонстрирующую взаимодействие между остатком и субстратом при среднеквадратичном отклонении (RMSD) <2,3 Å. Мы использовали инструменты MOE «сканирование аланина» и «сканирование остатков» для идентификации потенциальных остатков-кандидатов для мутагенеза комплекса ацил-CoA-спирт-CAT, на основании рассчитанных значений ΔStability и / или ΔAffinity.Кандидаты-мутанты с небольшими значениями ΔStability и / или ΔAffinity выбираются для экспериментального тестирования. Для проведения анализа контакта с белками мы использовали инструмент «Контакты с белками» компании MOE.
Филогенетическое дерево CATs
Множественное выравнивание последовательностей выполняли с использованием MEGA7 (53), как описано ранее (29). Филогенетическое дерево CAT было построено на основе выровненных последовательностей с использованием метода максимального правдоподобия с 1000 повторениями начальной загрузки. Было выбрано ограничение уровня достоверности начальной загрузки 40%.
Молекулярное клонирование и сайт-направленный мутагенез
Праймеры, использованные в этом исследовании, перечислены в таблице S5. Плазмиды конструировали сборкой ДНК Гибсона с использованием продуктов ПЦР, амплифицированных праймерами. Все сконструированные плазмиды были проверены с помощью ПЦР-амплификации и секвенирования по Сэнгеру. Сайт-направленный мутагенез выполняли с использованием протокола сайт-направленного мутагенеза QuikChange ™ с использованием ДНК-полимеразы Phusion (Thermo Fisher Scientific, Массачусетс, США) и перечисленных праймеров (54, 55).
Характеристика ферментов
Для определения in vitro температур плавления и каталитической эффективности, CAT с меткой His были очищены и охарактеризованы, как описано ранее (29). В анализе 5,5’-дитиобис-2-нитробензойной кислоты (DTNB) конечные концентрации ферментов 0,05-0,1 мкг / мл и 5-10 мкг / мл использовали для реакций с хлорамфениколом и спиртами, соответственно. Для экспериментов по тепловой инактивации 50 мкл очищенных CAT инкубировали при температуре от 50 до 70 ° C в термоциклере в течение часа с температурой крышки 70 ° C.Остаточную активность измеряли при 37 ° C с использованием хлорамфеникола и ацетил-КоА в качестве субстратов и нормализовали по активности образцов, инкубированных при 50 ° C. Для определения кинетики Михаэлиса-Ментен концентрации спиртовых субстратов варьировались следующим образом: (i) 0-400 мМ для этанола, бутанола и изобутанола, (ii) 0-100 мМ для пентанола, изоамилового спирта, 3-цис-гексена. 1-ол, пренол и фурфуриловый спирт, (iii) 0-2 мМ для октанола, (iv) 0-0,2 мМ для деканола, (v) 0-50 мМ для гексанола, цитронеллола, фарнезола и нерола, (vi) 0-40 мМ для 3-метоксибензилового спирта, бензилового спирта и гераниола и (vii) 0-20 мМ 2-фенилэтилового спирта.Для спиртов с низкой растворимостью в реакционный раствор добавляли 10% (мас. / Об.) ДМСО. Ферментные реакции проводили при 50 ° C в считывающем устройстве для микропланшетов BioTek в течение не менее 30 минут с измерениями каждые одну минуту. Кинетические параметры были рассчитаны с использованием метода нелинейной регрессии, как описано ранее (29).
Штаммы и плазмиды
E. coli BL21 (DE3) использовали для экспериментов по экспрессии и очистке белка, а также в экспериментах по конверсии спирта. Плазмиды, использованные в этом исследовании, перечислены в таблице S6.Для экспериментов C. thermocellum использовали штамм HSCT2005, лишенный Clo1313_0613 и Clo1313_0693 (30).
Среда и культивирование клеток
Штаммы E. coli выращивали в среде лизогенического бульона (LB) или гибридной среде M9, содержащей глюкозу в качестве источника углерода и 5 г / л дрожжевого экстракта с добавлением 100 мкг / мл ампициллина и / или 50 мкг / мл канамицина при необходимости. C. thermocellum штаммов культивировали в анаэробной камере (производство Sheldon, OR, США) с анаэробной газовой смесью (90% N 2 , 5% CO 2 , 5% H 2 ) или резиновой пробкой. запаянные анаэробные пробирки Балча вне камеры.Для трансформации C. thermocellum использовали среду CTFuD или CTFuD-NY (56). Среда CTFuD содержала 2 г / л дрожжевого экстракта, в то время как CTFuD-NY использовала витамины и микроэлементы вместо дрожжевого экстракта. Для поддержания плазмид в C. thermocellum добавляли 10 мкг / мл тиамфеникола. Для экспериментов по конверсии спирта с C. thermocellum штаммы выращивали в определенной среде C-MTC, как описано ранее (30, 57)
C. thermocellum трансформацияC.Клетки thermocellum трансформировали электропорацией, как описано ранее (29, 56). Применяли серию из двух последовательных экспоненциальных импульсов с использованием системы электропорации (каталожный номер 45-0651, BTX Technologies Inc., Массачусетс, США), установленной на 1,8 кВ, 25 мкФ и 350 Ом, что обычно приводило к длительности импульса 7,0 -8,0 мс.
Скрининг вариантов CATSa in vivoДля приготовления прекультур отдельные колонии из чашек с агаром LB сначала инокулировали в 100 мкл LB в 96-луночных микропланшетах с использованием стерильных наконечников для пипеток.Затем прекультуры выращивали в течение ночи при 37 ° C и 400 об / мин в инкубирующем шейкере для микропланшетов (Fisher Scientific, PA, USA). Затем 5% (об. / Об.) Прекультур инокулировали в 100 мкл гибридной среды M9, содержащей 20 г / л глюкозы, 0,1 мМ IPTG и 2 г / л изобутанола, в 96-луночный микропланшет с гексадекановый слой, содержащий изоамиловый спирт в качестве внутреннего стандарта в соотношении 1: 1 (об. / об.). Микропланшеты закрывали пластиковой клейкой герметизирующей пленкой SealPlate ® (EXCEL Scientific, Inc., CA, США) и инкубировали при 37 ° C и 400 об / мин в течение 24 ч в инкубирующем шейкере для микропланшетов. Образцы из слоя гексадекана собирали и подвергали ГХ / МС для идентификации сложных эфиров и количественного определения.
Преобразование спиртов в сложные эфиры в
E. coliДля периодических культур преобразование спирта в пробирке проводили в 4 мл среды M9, содержащей 10 г / л глюкозы, с добавлением 1 мл гексадекана для экстракции in situ при 37 ° С. Первоначально добавляли 0,1 мМ изопропил-β-D-1-тиогалактопиранозид (IPTG), чтобы вызвать экспрессию CATec3 Y20F.В исходную среду добавляли спирты, и выход продукта и титр измеряли через 12, 24 и 48 часов. Для периодических культур с подпиткой, предназначенных для достижения высокого уровня конверсии спиртов (т. Е. Изоамилового спирта, фенилэтилового спирта), клетки выращивали микроаэробно во встряхиваемой колбе с завинчивающейся крышкой объемом 125 мл с рабочим объемом 20 мл среды M9, содержащей 25 г / л глюкозы и 10 мл гексадекана. Объем 25-50 мкл спиртов (чистота ≥98%) добавляли к культуре через 6, 9, 12, 15 и 24 часа с рабочей концентрацией 2 г / л на добавление.
Превращение спиртов в сложные эфиры при температуре
° C. ThermocellumФерментация целлюлозы в трубочном масштабе была выполнена в периодическом режиме, как описано ранее (29). Вкратце, 19 г / л Avicel PH-101 использовали в качестве единственного источника углерода в объеме культивирования 16 мл. 0,8 мл ночной культуры клеток инокулировали в 15,2 мл среды C-MTC и добавляли 4 мл гексадекана в анаэробную камеру. Каждая пробирка содержала небольшую магнитную мешалку для гомогенизации целлюлозы, и культуру инкубировали в водяной бане, соединенной с регулятором температуры и системой магнитной мешалки.Спирты вводили в культуру через 36 часов, когда клетки вступали в раннюю стационарную фазу роста. pH доводили до 6,4-7,8 с помощью впрыскивания 5 М КОН.
Анализ с помощью высокоэффективной жидкостной хроматографии (ВЭЖХ).
Систему ВЭЖХ (Shimadzu Inc., Мэриленд, США) использовали для количественного определения внеклеточных метаболитов. 800 мкл образцов центрифугировали при 17000 x g в течение 3 минут с последующей фильтрацией через 0,2-микронные фильтры. Образцы были обработаны с 5 мМ H 2 SO 4 при 0.6 мл / мин на колонке Aminex HPX-87H (Biorad Inc., Калифорния, США) при 50 ° C. Детектор показателя преломления (RID) и ультрафиолетовый детектор (UVD) при 220 нм использовались для определения концентраций сахаров, органических кислот и спиртов.
Газовая хроматография в сочетании с анализом масс-спектроскопии (ГХ / МС).
ГХ (HP 6890, Agilent, CA, USA), оборудованный МС (HP 5973, Agilent, CA, USA), использовали для количественного определения сложных эфиров. Капиллярная колонка Zebron ZB-5 (Phenomenex, CA, USA) (30 м x 0,25 мм x 0,25 мкм) использовалась с гелием в качестве газа-носителя при скорости потока 0.5 мл / мин. Температурная программа печи была установлена следующим образом: начальная температура 50 ° C, линейное изменение 1 ° C / мин до 58 ° C, увеличение 25 ° C / мин до 235 ° C, увеличение 50 ° C / мин до 300 ° C. , и 2-х минутный отжиг при 300 ° C. В колонку в режиме без разделения вводили 1 мкл образца при температуре инжектора 280 ° C. Для системы МС выбранный ионный режим (SIM) использовался для обнаружения и количественного определения сложных эфиров. В качестве внутреннего стандарта к исходному слою гексадекана добавляли 10 мг / л н-декана и определяли с m / z 85, 99 и 113 в диапазоне времени удерживания от 12 до 15 минут.
Протеомика
Для протеомики культуры клеток отбирали через 48 часов в середине стационарной фазы роста и хранили при -80 ° C перед анализом. Два миллилитра суспензии, содержащей клеток C. thermocellum , растущих на Avicel, осаждали центрифугированием (5000 мкг в течение 10 мин), супернатант удаляли и осадок ресуспендировали в 350 мкл буфера для лизиса (4% SDS, 5 мМ DTT, 100 мМ Трис-HCl, pH 8,0). Клетки лизировали ультразвуком (Branson Sonifier; амплитуда 20%, импульсы 2 с, всего 30 с), предварительно очищали центрифугированием (21000 x g в течение 10 минут) и супернатантом сырого протеина с помощью спектрофотометра Nanodrop OneC (Thermo Scientific).Затем образцы доводили до 15 мМ йодацетамида (20 мин при комнатной температуре в темноте) и 300 мкг очищали с помощью захвата агрегации белка (58). Агрегированный белок (на магнитных шариках Sera-Mag размером 1 микрон; GE Healthcare) затем расщепляли трипсином протеомического класса (1:75 по массе; Promega) в 100 мМ трис-HCl, pH 8,0, в течение ночи при 37 ° C и снова. в течение 3 часов при 37 ° C на следующий день. Высвободившиеся триптические пептиды затем подкисляли до 0,5% муравьиной кислоты, фильтровали через центробежный фильтр MWCO 10 кДа (Vivaspin 2; Sartorius) и количественно определяли с помощью Nanodrop OneC.Затем три микрограмма пептидов анализировали с помощью 1D LC-MS / MS с использованием Vanquish uHPLC, соединенного непосредственно с масс-спектрометром Orbitrap Q Exactive (Thermo Scientific), как описано ранее (59). Пептиды разделяли с помощью 180-минутного органического градиента с использованием вытягиваемого наноразмерного распылителя собственного производства, заполненного 15 см 1,7-микронной обращенно-фазовой смолой Kinetex (Phenomenex). Спектры фрагментации пептидов анализировали / секвенировали с помощью программного обеспечения Proteome Discoverer (Thermo Scientific), а количество пептидов определяли по хроматографической площади под кривой.Содержание пептидов было преобразовано в log2, распределение нормализовано с помощью LOESS и сведено к их соответствующим белкам с помощью RRollup InfernoRDN (60). Затем распределение содержания белка было центрировано по медиане, и статистический анализ был выполнен в Perseus (61). Ручное определение содержания CATec3 в разных штаммах было выполнено путем сравнения тенденций содержания пептида log2 по ортологам, поскольку только одно различие AA различает две формы белка. Все необработанные данные ЖХ-МС / МС были депонированы в репозитории MassIVE и ProteomeXchange со следующими номерами доступа: MSV000086201 (MassIVE) и PXD021695 (ProteomeXchange).Данные могут быть загружены непосредственно через ftp://massive.ucsd.edu/MSV000086201/
Единичная мутация в высококонсервативной области хлорамфениколацетилтрансферазы позволяет Clostridium thermocellum производить изобутилацетат непосредственно из целлюлозы с помощью Clostridium thermocellum при повышенных температурах | Биотехнология для производства биотоплива
Бактериальные штаммы и плазмиды
Бактериальные штаммы и плазмиды, использованные в этом исследовании, перечислены в таблице 2. Clostridium thermocellum DSM1313 ∆ hpt (M1354) штамм использовался в качестве хозяина для производства сложного эфира при повышенных температурах. .Следует отметить, что делеция гена гипоксантинфосфорибозилтрансферазы ( hpt, , Clo1313_2927) в DSM1313 дикого типа позволяет проводить генную инженерию путем счетного отбора 8-азагипоксантина (8-AZH); эта делеция не оказывает какого-либо известного вредного воздействия на рост и метаболизм клеток [37, 38]. Плазмида pNW33N, содержащая CAT Sa , является термостабильной и была использована для экспрессии различных CAT в C. thermocellum . Плазмиды pET использовали для молекулярного клонирования и экспрессии ферментов в E.coli .
Таблица 2 Плазмиды и штаммы, использованные в этом исследованииХимические вещества и реагенты
Все химические вещества были приобретены у Sigma-Aldrich (Миссури, США) и / или Thermo Fisher Scientific (Массачусетс, США), если не указано иное. Для молекулярного клонирования рестрикционные ферменты и лигаза Т4 были получены от New England Biolabs (Массачусетс, США). ДНК-полимеразу Phusion Hot Start II использовали для полимеразной цепной реакции (ПЦР).
Среда и культивирование
Для молекулярного клонирования и экспрессии белков E.coli выращивали в лизогенном бульоне (LB), содержащем соответствующие антибиотики, если не указано иное. Для характеристики in vivo CAT Sa в E. coli использовали гибридную среду M9 [5] с 20 г / л глюкозы. Для культуры C. thermocellum использовали минимальную среду MTC или среду CTFuD-NY [38], как указано в экспериментах. Оптическую плотность (OD) измеряли на спектрофотометре при длине волны 600 нм (Spectronic 200+, Thermo Fisher Scientific, MA, США).
Анализ множественного выравнивания последовательностей
Анализ множественного выравнивания последовательностей (MSA) выполняли с использованием MEGA7 [39]. Последовательности белков были выровнены с помощью ClustalW [40] и визуализированы с помощью ESPript 3.0 (http://espript.ibcp.fr) [41]. Ключевые особенности белковых структур 3U9F [42], 4CLA [43] и 2XAT [44] были извлечены из CAT_SALTI, CAT3_ECOLIX и CAT4_PSEAE, соответственно.
Молекулярное моделирование и имитация стыковки
Трехмерные (3D) структуры
Трехмерная структура CAT Sa и представляющих интерес спиртов была впервые создана с использованием Swiss-Model [45] и инструментов «Builder» компании MOE (Molecular Программное обеспечение операционной среды, версия 2019.01) соответственно. Трехмерная структура связанного с двойным субстратом комплекса CAT Sa (т.е. ацетил-CoA-изобутанол-CAT Sa ) была получена экстракцией изобутанола из комплекса изобутанол-CAT Sa и последующим добавлением его к ацетилу. -CoA – CAT Sa комплекс. Все структуры были подготовлены с помощью инструмента «QuickPrep» MOE с параметрами по умолчанию и дополнительно оптимизированы путем минимизации энергии с помощью силового поля Amber10: EHT.
Моделирование стыковки
Для моделирования стыковки был проведен поиск потенциального кармана для привязки с помощью инструмента «Site Finder» Министерства энергетики США.Сайт с наилучшей оценкой, соответствующий заявленным каталитическим сайтам [46], был выбран для дальнейших исследований. Моделирование стыковки выполнялось, как описано ранее [47]. Вкратце, ацетил-КоА и каждый спирт стыковали с использованием протокола индуцированной подгонки с методом размещения Triangle Matcher и оценочной функцией London ΔG . После моделирования стыковки была выбрана поза связывания с наилучшей оценкой, показывающая решающее взаимодействие между остатком и субстратом при среднеквадратичном отклонении (RMSD) <2 Å.В качестве примера для докинга ацетил-КоА была выбрана поза связывания, демонстрирующая водородную связь между гидроксилом Ser-148 и N 71 КоА [48]. Для стыковки спирта была выбрана поза связывания, показывающая водородную связь между N 3 His-189 и гидроксилом спирта [26].
Анализ мутагенеза in silico
Анализ мутагенеза in silico комплекса ацетил-КоА-изобутанол-CAT Sa проводили, как описано ранее [47].В частности, инструменты MOE «сканирование аланина» и «сканирование остатков» использовали для идентификации потенциальных остатков-кандидатов для мутагенеза.
Молекулярное клонирование
Конструирование плазмиды
Плазмиды конструировали стандартным методом молекулярного клонирования лигазозависимым методом и / или сборкой Гибсона [49] с использованием праймеров, перечисленных в Дополнительном файле 1: Таблица S1. Сконструированные плазмиды были введены в E.coli TOP10 путем трансформации тепловым шоком.Колонии, выделенные на селективном планшете, подвергали скринингу с помощью ПЦР и очищали плазмиду. Очищенные плазмиды проверяли секвенированием по Сэнгеру перед трансформацией в E. coli BL21 (DE3). Сайт-направленный мутагенез выполняли с использованием протокола сайт-направленного мутагенеза QuickChange ™ с уменьшенной длиной перекрытия [50] или методом сборки Гибсона [49]. Для конструирования C. thermocellum сначала была сконструирована плазмида pHS005, а затем модифицирована до pHS0024. pHS0024 не имеет hpt ниже оперона, тогда как другие последовательности плазмиды идентичны pHS005.
Трансформация
Обычные методы химической трансформации и электропорации были использованы для трансформации E. coli [51] и C. thermocellum [38], соответственно. Однако для C. thermocellum метод был немного изменен, как описано здесь. Сначала C. thermocellum M1354 (таблица 2) культивировали в 50 мл среды CTFuD-NY при 50 ° C внутри анаэробной камеры (Bactron300, Sheldon Manufacturing Inc., OR, США). Культура клеток с OD в диапазоне 0.8–1.0 охлаждали при комнатной температуре в течение 20 мин. За пределами этой точки все шаги выполнялись за пределами камеры. Охлажденные клетки собирали при 6500 × g и 4 ° C в течение 20 мин. Осадки клеток дважды промывали охлажденной льдом водой Milli-Q и ресуспендировали в 200 мкл буфера для трансформации, состоящего из 250 мМ сахарозы и 10% (об. / Об.) Глицерина. Несколько 30 мкл аликвот электрокомпетентных клеток немедленно хранили при -80 ° C для дальнейшего использования. Для электропорации электрокомпетентные клетки размораживали на льду и инкубировали с 500–1000 нг метилированных плазмид [52] в течение 10 мин.Затем клетки переносили в охлаждаемую льдом кювету для электропорации с зазором 1 мм (BTX Harvard Apparatus, Массачусетс, США) с последующими двумя последовательными импульсами экспоненциального затухания с 1,8 кВ, 350 Ом и 25 мкФ. Импульсы обычно давали постоянную времени 7,0–8,0 мс. Клетки немедленно ресуспендировали в предварительно нагретом свежем CTFuD-NY и восстанавливали при 50 ° C в анаэробных условиях (90% N 2 , 5% H 2 и 5% CO 2 ) внутри резинового колпачка Balch. трубка. Через 0–12 ч восстановления клетки смешивали с расплавленной агаровой средой CTFuD-NY с добавлением 15 мкг / мл тиамфеникола.Наконец, смесь клеток среды была вылита в чашку Петри и затвердела внутри анаэробной камеры. Планшет инкубировали при 50 ° C в течение 1 недели до появления колоний. Эффективность трансформации составляла 2–100 колониеобразующих единиц на мкг плазмиды (КОЕ / мкг плазмиды).
Характеристика in vivo CAT
Sa и его вариантов в E. coliДля характеристики in vivo CAT Sa и его вариантов в E. coli , культуры с высокой плотностью клеток были выполнены, как описано ранее [53], с добавлением 2 г / л различных спиртов.Для экстракции сложных эфиров in situ каждую пробирку покрывали 25% (об. / Об.) Гексадеканом. Чтобы подтвердить экспрессию белка CAT Sa и его вариантов, 1% (об. / Об.) Исходных клеток выращивали в течение ночи при 37 ° C и 200 об / мин в 15 мл культуральных пробирках, содержащих 5 мл среды LB и антибиотик. Затем 4% (об. / Об.) Ночных культур переносили в 1 мл среды LB, содержащей антибиотик, в 24-луночный микропланшет. Культуры выращивали при 37 ° C и 350 об / мин, используя шейкер для инкубационных микропланшетов (Fisher Scientific, PA, USA), пока OD не достигала 0.4–0,6, а затем индуцировали 0,1 мМ изопропил-β-d-1-тиогалактопиранозидом (IPTG) в течение 4 часов с помощью герметичной мембраны Breathe-Easy для предотвращения испарения и перекрестного загрязнения (номер по каталогу 50-550-304, Research Products International Corp. , Иллинойс, США). Образцы белка получали с использованием полного реагента B-PER (каталожный № 89822, Thermo Scientific, Массачусетс, США) в соответствии с инструкциями производителя и анализировали с помощью SDS-PAGE.
Характеристика фермента
Очистка His-tag
Для экспрессии фермента ночную культуру инокулировали в соотношении 1:50 в свежую среду LB, содержащую 1 мМ IPTG и антибиотик, с последующей инкубацией в течение ночи при 18 ° C (до 20 часов ) во встряхиваемом инкубаторе при 200 об / мин.Индуцированные клетки собирали центрифугированием при 4 ° C и 4700 × g в течение 10 мин. Затем осадок клеток промывали один раз водой Millipore и ресуспендировали в реагенте B-PER Complete. После 30 мин инкубации при комнатной температуре смесь центрифугировали при 17000 × g в течение 2 мин. Супернатант собирали и обозначали как неочищенный экстракт. Для очистки His-tag неочищенный экстракт инкубировали с HisPur Ni – NTA суперпоточной агарозой в партии, как рекомендует производитель.Затем смолу промывали, по крайней мере, тремя объемами промывочного буфера, состоящего из 50 мМ Трис-HCl (pH 8,0), 300 мМ NaCl, 10 мМ имидазола и 0,1 мМ EDTA. Связанные со смолой белки элюировали 300 мкл элюирующего буфера, содержащего 50 мМ Трис-HCl (pH 8,0), 50 мМ NaCl, 300 мМ имидазол и 0,1 мМ EDTA. Затем элюированный образец обессоливали и концентрировали через колонку с фильтром Amicon с отсечкой по молекулярной массе 10 кДа. Наконец, образец белка суспендировали в 200 мкл 20 мМ трис-HCl буфера (pH 8.0). Концентрацию белка измеряли методом Брэдфорда [54] с использованием бычьего сывороточного альбумина (БСА) в качестве контрольного белка.
Анализ теплового сдвига
Для измерения температуры плавления белка (Tm) с помощью SYPRO Orange был использован термофлюоресцентный анализ [55]. Около 10–250 мкг очищенного белка His-tag смешивали с 5 × SYPRO Orange в конечном объеме 50 мкл в 96-луночном планшете для кПЦР. Планшет закрывали крышками для ПЦР перед проведением анализа. Аппарат для ПЦР в реальном времени StepOne (Applied Biosystems, Калифорния, США) использовался для запуска анализа со следующими параметрами: репортер ROX, приращение 1 ° C за цикл, выдержка 1 мин в каждом цикле и диапазон температур от 20 до 98 ° С.Данные были собраны, экспортированы и обработаны для расчета Tm.
Анализ 5,5′-дитиобис- (2-нитробензойной кислоты) (DTNB)
Скорость реакции для каждой CAT определяли с помощью анализа DTNB [56] в 384-луночном планшете. Общий реакционный объем составлял 50 мкл с реакционным буфером, содержащим 50 мМ Трис-HCl (pH 8,0). Концентрации ацетил-КоА (CoALA Biosciences, Техас, США) и спиртов варьировали, как указано в каждом эксперименте. Конечные концентрации фермента 0,05 мкг / мл и 10 мкг / мл использовали для реакций по отношению к хлорамфениколу и спиртам, соответственно.Кинетику реакции собирали путем измерения оптической плотности при 412 нм каждую минуту в течение 1 ч при 50 ° C в считывающем устройстве для микропланшетов (Synergy HTX microplate reader, BioTek). Скорость реакции рассчитывали с использованием коэффициента экстинкции по стандартной кривой для свободного кофермента А (MP Biomedicals, OH, USA) в тех же условиях. Следует отметить, что, поскольку максимальная рабочая температура, рекомендованная для планшет-ридера, составляет 50 ° C, высокопроизводительный ферментный анализ на CAT при повышенных температурах проводился только для определения параметров кинетики ферментов.
Расчет кинетических параметров для скоростей реакции
Параметры закона скорости Михаэлиса – Ментен (уравнение 1) были рассчитаны для каждого фермента следующим образом. Сначала была проведена линейная регрессия данных, собранных с микропланшетного ридера, чтобы определить начальные скорости реакции, \ (y_ {i} \), при различных начальных концентрациях субстрата, \ (s_ {i} \), где i = {1 , 2,…, n } — количество собранных точек данных. Затем эти начальные скорости реакции и связанные с ними начальные концентрации субстрата для всех повторов были одновременно подогнаны к модели Михаэлиса-Ментен (уравнение.{2}}}} \ right) $$
(2)
$$ \ rho \ left (z \ right) = 2 \ left ({\ sqrt {1 + z}} \ right) — 1. $$
(3)
Задача наименьших квадратов определяет параметры \ (K _ {\ text {M}} \) и \ (v_ {\ text {max}} \) путем минимизации разницы между скоростями реакции, предсказанными моделью \ (v_ {i} \) и измеренные скорости реакции \ (y_ {i} \) (уравнение 2). Функция сглаживания \ (\ rho \ left (z \ right) \) используется, чтобы сделать задачу наименьших квадратов устойчивой к выбросам (уравнение.3). Благодаря непредвзятому сопротивлению выбросам и избежанию ошибок, возникающих при использовании традиционных методов линеаризации, надежная нелинейная регрессия обеспечивает наиболее точную оценку параметров для модели Михаэлиса – Ментен [59].
Производство изобутилацетата в
C. thermocellumФерментация целлобиозы
Получение изобутилацетата из целлобиозы в штаммах C. thermocellum осуществляли с помощью конфигурации двухстадийной биоконверсии.Сначала клетки культивировали в минимальной среде MTC [38], содержащей 5 г / л целлобиозы, в пробирке Балча с резиновым колпачком до достижения OD 0,8–1,0. Клетки охлаждали при комнатной температуре в течение 20 минут и центрифугировали при 4700 × g и 4 ° C в течение 20 минут. После удаления супернатанта клетки ресуспендировали в том же объеме свежей минимальной среды MTC, содержащей 2 г / л изобутанола, в анаэробной камере. Затем клеточную суспензию делили на 800 мкл в микроцентрифужной пробирке на 2,0 мл с завинчивающейся крышкой, покрытой 200 мкл гексадекана.Клетки инкубировали при 55 ° C в течение 24 часов с последующим анализом газовой хроматографии в сочетании с масс-спектрометром (ГХ / МС) для количественного определения количества продуцируемого изобутилацетата.
Ферментация целлюлозы
Для ферментации целлюлозы использовали модифицированную среду MTC (среда C-MTC). 20 г / л Avicel PH-101 использовали в качестве единственного источника углерода вместо целлобиозы и добавляли 10 г / л MOPS для увеличения буферной емкости. Начальный pH доводили до 7,5 с помощью 5 М КОН и автоклавировали.В анаэробной камере 0,8 мл ночной культуры клеток инокулировали в 15,2 мл среды C-MTC (соотношение инокуляции 1:20) с 4 мл наложенного гексадекана. Каждая пробирка содержала небольшую магнитную мешалку для гомогенизации целлюлозы. Пробирку Бальча с резиновым колпачком инкубировали в водяной бане, соединенной с регулятором температуры, установленным на 55 ° C, и системой магнитного перемешивания. После корректировки pH с помощью инъекции 70 мкл 5 М КОН, каждые 12 часов отбирали 800 мкл культуры клеток и 200 мкл слоя гексадекана.Во время ферментации pH культуры поддерживался в пределах 6,4–7,8.
Рост клеток контролировали путем измерения белка в осадке. Осадок клетка-целлюлоза из 800 мкл образцов дважды промывали водой Milli-Q и суспендировали в 200 мкл лизирующего буфера (0,2 М NaOH, 1% SDS) с последующей часовой инкубацией при комнатной температуре. Затем раствор нейтрализовали 50 мкл 0,8 М HCl и разбавили 550 мкл воды. Смесь центрифугировали при 17000 × g в течение 3 мин. Концентрацию белка в супернатанте анализировали с помощью совместимого с детергентом анализа Брэдфорда (Thermo Scientific, Вашингтон, США).Остаточный осадок кипятили в печи при 98 ° C в течение часа перед количественным определением остаточной целлюлозы.
Остаточная целлюлоза была определена количественно фенол-сернокислотным методом [60] с некоторыми модификациями. Кипяченный образец дважды промывали водой Milli-Q и суспендировали в 800 мкл воды до объема, эквивалентного исходному. Образец гомогенизировали пипетированием и встряхиванием в течение 10 с, и 20 мкл гомогенизированного образца переносили в новую микроцентрифужную пробирку объемом 2,0 мл или 96-луночный планшет и сушили в течение ночи в печи при 55 ° C.Высушенный осадок суспендировали в 200 мкл 95% -ной серной кислоты и инкубировали в течение часа при комнатной температуре. После полного растворения осадка добавляли 20 мкл 5% фенола и смешивали с раствором серной кислоты. После 30 мин инкубации при комнатной температуре 100 мкл образца переносили в новый 96-луночный планшет и измеряли оптическую плотность при 490 нм. Поглощение переводили в концентрацию целлюлозы по стандартной кривой Avicel PH-101, обработанной той же процедурой.
Аналитические методы
Высокоэффективная жидкостная хроматография (ВЭЖХ)
Количественное определение внеклеточных метаболитов проводили с использованием системы высокоэффективной жидкостной хроматографии (ВЭЖХ) (Shimadzu Inc., Мэриленд, США). 800 мкл образцов культуры центрифугировали при 17000 × g в течение 3 мин, а затем супернатанты фильтровали через фильтры 0,2 мкм и прогоняли с подвижной фазой 10 мН H 2 SO 4 со скоростью 0,6 мл / мин на Aminex HPX. -87H (Biorad Inc., Калифорния, США) при 50 ° C. Детектор показателя преломления (RID) и ультрафиолетовый детектор (UVD) при 220 нм использовались для контроля концентраций сахаров, органических кислот и спиртов.
Газовая хроматография в сочетании с масс-спектроскопией (ГХ / МС)
Сложные эфиры измеряли с помощью ГХ (HP 6890, Agilent, Калифорния, США), снабженной МС (HP 5973, Agilent, CA, США).В системе ГХ для разделения аналитов использовали капиллярную колонку Zebron ZB-5 (Phenomenex, Калифорния, США) (30 м × 0,25 мм × 0,25 мкм), а в качестве носителя — гелий со скоростью потока 0,5 мл / мин. Температурная программа печи была установлена следующим образом: начальная температура 50 ° C, линейное изменение 1 ° C / мин до 58 ° C, увеличение 25 ° C / мин до 235 ° C, увеличение 50 ° C / мин до 300 ° C. , и 2-х минутный отжиг при 300 ° C. 1 мкл отобранного слоя гексадекана вводили в колонку в режиме без деления с температурой инжектора 280 ° C.Для системы МС выбранный ионный режим (SIM) использовался для обнаружения и количественного определения сложных эфиров со следующими параметрами: (i) этилацетат, m / z 45,00 и 61,00 от 4,2 до 4,6 мин, время удерживания (RT), (ii) изопропилацетат, m / z 45 и 102 от 4,7 до 5,0 мин RT, (iii) пропилацетат, m / z 59 и 73 от 5,2 до 5,8 мин RT, (iv) этил изобутират, m / z 73 и 116 от 6,1 до 6,6 мин RT, (v) изобутилацетат, m / z 61 и 101 из 6.RT от 6 до 7,6 мин, (vi) бутилацетат, m / z 61 и 116 от 7,7 до 9,2 мин RT, (vii) изобутилизобутират, m / z 89 и 129 от 10,1 до 12,5 мин RT, (viii) бензилацетат, m / z , 108 и 150 от 13,1 до 13,8 мин RT, и (ix) 2-фенэтилацетат, m / z , 104 и 121 от 13,8 до 15,5 минут RT . Изоамиловый спирт и изоамилацетат использовали в качестве аналитов внутреннего стандарта. Сложные эфиры идентифицировали RT и количественно определяли по площадям пиков и стандартным кривым.Стандартные кривые были определены с использованием чистых сложных эфиров, разбавленных гексадеканом при концентрациях 0,01 г / л, 0,05 г / л, 0,1 г / л, 0,5 г / л и 1 г / л.
Хлорамфеникол — Онлайн-служба врача
Глазные капли и мазь с хлорамфениколом борются с бактериальными инфекциями глаз. Действующее вещество — антибиотик под названием левомицетин. Этот препарат убивает все виды бактерий, которые могут вызвать глазную инфекцию. В результате симптомы инфекции уменьшаются, а глаз выздоравливает. Вы можете заказать Хлорамфеникол онлайн в аптеках, сотрудничающих с Dokteronline.com.
Что такое хлорамфеникол?
Глазные капли и мазь с хлорамфениколом борются с бактериальными инфекциями глаз. Действующее вещество — антибиотик под названием левомицетин. Этот препарат убивает все виды бактерий, которые могут вызвать глазную инфекцию. В результате симптомы инфекции уменьшаются, а глаз выздоравливает. Вы можете заказать Хлорамфеникол онлайн в аптеках, сотрудничающих с Dokteronline.com.
Для чего используется это лекарство?
Врачи назначают Хлорамфеникол против различных видов глазных инфекций, вызываемых бактериями, таких как конъюнктивит, воспаление роговицы или воспаление век или глазных желез.Симптомы глазной инфекции включают:
- Красный раздраженный глаз;
- Болезненный глаз;
- Плачущий глаз;
- Гной в глазу. Крышки могут слипаться.
Хлорамфеникол быстро уничтожает патогенные бактерии, что позволяет уменьшить симптомы.
Как применять Хлорамфеникол?
Хлорамфеникол выпускается в виде глазных капель и глазных мазей. Перед использованием вымойте руки. Выполняйте дропы следующим образом:
- Наклоните голову назад;
- слегка потяните нижнее веко вниз;
- Нанесите каплю в желоб;
- Закройте глаз и осторожно надавите пальцем на слезный проток в углу глаза в течение двух минут.Это предотвращает слишком быстрое течение офтальмологической жидкости.
Офтальмологическая мазь также наносится, слегка оттягивая нижнее веко вниз. Используйте полоску мази примерно 1 сантиметр, а затем закройте глаз. Вам не нужно прижимать слезный проток. Сразу после этого вымойте руки. После нанесения мази зрение может на время затуманиться. Это пройдет. В листовке содержится дополнительная информация об использовании Хлорамфеникола.
Дозировка
Аптеки-партнеры предлагают Хлорамфеникол онлайн.Если врач не посоветует иное, обычная дозировка следующая: Хлорамфеникол капли:
- Взрослые и дети: каждые два-три часа по 1-2 капли в пораженный глаз.
Мазь с хлорамфениколом:
- Взрослые и дети: три-четыре раза в день наносите мазь мазью 1 см на пораженный глаз.
Продолжайте прием хлорамфеникола до тех пор, пока симптомы не исчезнут через три дня. Не принимайте это лекарство более десяти дней.Если вы не заметили улучшения через три дня, обратитесь к врачу. Перед использованием прочтите инструкцию.
Побочные эффекты
Хлорамфеникол иногда может вызывать побочные эффекты, включая:
- раздражение (покраснение, зуд или жжение) в обработанном глазу;
- помутнение зрения после использования глазной мази.
Если вы страдаете серьезными побочными эффектами или побочными эффектами, не указанными в данном информационном листке, обратитесь к врачу.
Когда лучше не принимать это лекарство?
Хлорамфеникол не всем подходит.Не используйте это лекарство, если вы:
- сверхчувствительны к хлорамфениколу или любому из используемых вспомогательных веществ;
- страдают нарушениями функции печени или кроветворения.
Если вы страдаете какими-либо другими проблемами со здоровьем или принимаете какие-либо другие глазные препараты, укажите это в своем заказе. Врач знает, можно ли безопасно использовать Хлорамфеникол.
Беременность / вождение автомобиля / алкоголь
Используйте это лекарство только после консультации с врачом, если вы беременны или кормите грудью.Офтальмологическая мазь может временно помутнуть ваше зрение. Не участвуйте в трафике, пока не видите резко. Нет никаких предупреждений относительно употребления алкоголя.
Композитные пленки на основе ксантана и поли (винилового спирта) в качестве носителей для иммобилизации хлорамфеникола — DOAJ
Композитные пленки на основе ксантана и поли (винилового спирта) в качестве носителей для иммобилизации хлорамфеникола — DOAJЕвразийский химико-технологический журнал (Декабрь 2001 г.)
- Алупей Юлиан Корнелиу,
- Попа Марсель,
- Hamcerencu Mihaela,
- Савин Александр,
- Абади Марк Жан
Принадлежности
- Алупей Юлиан Корнелиу
- “Gr.Медицинский и фармацевтический университет им. Т. Попа, факультет медицинской биоинженерии, ул. 16, 6600 Яссы, Румыния
- Попа Марсель
- Gh. Asachi »Технический университет, факультет химического машиностроения, Bd. D. Mangeron, nr. 71, 6600 Яссы, Румыния
- Hamcerencu Mihaela
- Gh.Asachi »Технический университет, факультет химического машиностроения, Bd. D. Mangeron, nr. 71, 6600 Яссы, Румыния
- Савин Александр
- Gh. Asachi »Технический университет, факультет химического машиностроения, Bd. D. Mangeron, nr. 71, 6600 Яссы, Румыния
- Абади Марк Жан
- LEMP / MAO, Университет Монпелье II, Place Eugène Bataillon, 34095 Montpellier Cedex 05, France
- DOI
- https: // doi.org / 10.18321 / ectj566
- Том и выпуск журнала
- Vol. 3,
нет. 3
с. 195 — 200
Аннотация
Читать онлайн
В статье обсуждается метод реализации некоторых систем полимер — лекарство, в которых макромолекулярный носитель представлен трехмерной сеткой на основе ксантана и поливинилового спирта.Зная, что лекарство (хлорамфеникол) должно вводиться посредством процесса диффузии, носитель, выбранный в соответствии с экспериментальной программой, имел самую высокую степень набухания. Несколько вариантов включения левомицетина в синтезированный носитель проанализированы путем изучения кинетики процесса. Исследование высвобождения левомицетина из продуктов включения в виде пленок показало установку кинетики «нулевого порядка». Тесты, посвященные антимикробной активности системы, подтвердили их биологическое действие.
Опубликовано в
Евразийском химико-технологическом журнале- ISSN
- 1562-3920 (Печать)
- 2522-4867 (онлайн)
- Издатель
- Казахский национальный университет им. Аль-Фараби
- Страна издателя
- Казахстан
- Субъектов LCC
- Наука: химия
- Сайт
- http: // ect-journal.kz
О журнале
| Запись информации | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| Версия | 5.0 | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Статус | Ожидаемая, но не определенная дата | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Дата обновления | 2021-09-14 15:43:43 UTC | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Идентификатор HMDB | HMDB0014589 | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Вторичные номера доступа | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Хлорамфеникол | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Описание | Хлорамфеникол, также известный как хлоромицетин или хлорамекс, относится к классу органических соединений, известных как нитробензолы.Нитробензолы — это соединения, содержащие нитробензольный фрагмент, который состоит из бензольного кольца с углеродом, несущим нитрогруппу. Хлорамфеникол — это лекарственное средство. Хлорамфеникол — чрезвычайно слабое основное (по существу нейтральное) соединение (на основе его pKa). Хлорорганическое соединение, представляющее собой дихлорзамещенный ацетамид, содержащий нитробензольное кольцо, амидную связь и две спиртовые группы. Хлорамфеникол присутствует во всех живых организмах, от бактерий до людей. У человека левомицетин участвует в пути действия левомицетина.Хлорамфеникол официально признан канцерогеном (согласно IARC 2A), а также потенциально токсичным соединением. | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Структура | OC [C @@ H] (NC (= O) C (Cl) Cl) [C @ H] (O) C1 = CC = C (C = C1) [N +] ([ O -]) = O InChI = 1S / C11h22Cl2N2O5 / c12-10 (13) 11 (18) 14-8 (5-16) 9 (17) 6-1-3-7 (4-2-6) 15 (19) 20 / h2-4,8-10,16-17H, 5h3, (H, 14,18) / t8-, 9- / m1 / s1https: //cactus.nci.nih. gov / химический / структура / OC% 5BC @@ H% 5D (NC (= O) C (Cl) Cl)% 5BC … OpenBabel0 | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Синонимы |
| |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Химическая формула | C 11 H 12 N 9005 2 0 90 9 | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Средний молекулярный вес | 323.129 | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Моноизотопная молекулярная масса | 322,012326918 | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Название IUPAC | 2,2-дихлор-N — [(1R, 2R) -1,3-дигидрокси-1- (4-нитрофенил) пропан-2 -yl] ацетамид | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Традиционное название | хлорамфеникол | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Регистрационный номер CAS | 56-75-7 | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| SMILES | OC [C @@ H] (NC (= O) C (NC (= O) C Cl) Cl) [C @ H] (O) C1 = CC = C (C = C1) [N +] ([O -]) = O | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Идентификатор InChI | InChI = 1S / C11h22Cl2N2O5 / c12 -10 (13) 11 (18) 14-8 (5-16) 9 (17) 6-1-3-7 (4-2-6) 15 (19) 20 / ч2-4,8-10,16 -17H, 5h3, (H, 14,18) / t8-, 9- / m1 / s1 | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Ключ InChI | WIIZWVCIJKGZOK-RKDXNWHRSA-N | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Описание | к классу органических соединений, известных как нитробензолы.Нитробензолы — это соединения, содержащие нитробензольный фрагмент, который состоит из бензольного кольца с углеродом, несущим нитрогруппу.||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Kingdom | Органические соединения | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Суперкласс | Бензоиды | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Класс | Бензол и замещенные производные | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Подкласс | Нитробензолы Нитробензолы 9097Альтернативные источники | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Заместители |
| |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Молекулярный каркас | Ароматические гомомоноциклические соединения | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Внешние дескрипторы | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Онтология | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Процесс | Естественный процесс: | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Роль | Биологическая роль: Промышленное применение: | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 800 Физические свойства | Состояние | Твердое тело | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Экспериментальные свойства |
| |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Прогнозируемые свойства | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Spectra | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Биологические свойства | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Клеточные местоположения | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Расположение биопроб | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Нормальные концентрации | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Ненормальные концентрации | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Недоступно | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 0.000 мкМ | Взрослый (> 18 лет) | Оба | Нормальный | Прогноз на основе качества препарата | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Кровь | 0,000 мкмоль / ммоль креатинина | Взрослый (> 18 лет) | Оба | Оба | Нормальный | Прогнозируется на основе качества лекарства | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
- Wali SS, Macfarlane JT, Weir WR, Cleland PA, Hassan-King M, Whittle HC, Greenwood BM: S однократное инъекционное лечение менингококкового менингита.2. Левомицетин пролонгированного действия. Trans R Soc Trop Med Hyg. 1979; 73 (6): 698-702. [PubMed: 538813]
- Бхутта З.А., Ниази С.К., Сурия А: Клиренс хлорамфеникола при брюшном тифе: значение для терапии. Индийский J Pediatr. 1992 март-апрель; 59 (2): 213-9. [PubMed: 1398851]
- Pecoul B, Varaine F, Keita M, Soga G, Djibo A, Soula G, Abdou A, Etienne J, Rey M: хлорамфеникол длительного действия по сравнению с внутривенным ампициллином для лечения бактериального менингита. Ланцет. 1991, 5 октября; 338 (8771): 862-6.[PubMed: 1681224]
- Puddicombe JB, Wali SS, Greenwood BM: Полевое испытание однократной внутримышечной инъекции хлорамфеникола длительного действия при лечении менингококкового менингита. Trans R Soc Trop Med Hyg. 1984; 78 (3): 399-403. [PubMed: 6464136]
- Натан Н., Борел Т., Джибо А., Эванс Д., Джибо С., Корти Дж. Ф., Гильерм М., Альберти К. П., Пиногес Л., Герен П. Дж., Легрос Д.: короче говоря, цефтриаксон столь же эффективен, как и хлорамфеникол длительного действия. -курсовое лечение менингококкового менингита во время эпидемий: рандомизированное исследование не меньшей эффективности.Ланцет. 2005 г., 23-29 июля; 366 (9482): 308-13. [PubMed: 16039333]
Инженерная неразборчивость хлорамфениколацетилтрансферазы для биосинтеза сложного эфира микробного дизайнера
Публикация
к Хёнмин Со, Чон-Вон Ли, Ричард Дж. Джанноне, Ной Данлэп, Конг Трин
Тип публикации
Журнал
Название журнала
Метаболическая инженерия
Дата публикации
Номера страниц
179 к 190
Объем
66
Аннотация
Надежные и эффективные ферменты являются важными модулями для метаболической инженерии и стратегий синтетической биологии в биологических системах для создания цельноклеточных биокатализаторов.Конденсируя ацил-КоА и спирт, спиртовые ацилтрансферазы (ААТ) могут служить в качестве взаимозаменяемых метаболических модулей для микробного биосинтеза разнообразного класса молекул сложных эфиров с широким применением в качестве ароматизаторов, ароматизаторов, растворителей и биотоплива. Однако текущая нехватка надежных и эффективных ААТ значительно ограничивает их совместимость с гетерологичными путями-предшественниками и микробными хозяевами. Посредством биоразведки и рациональной инженерии белков мы идентифицировали и сконструировали беспорядочную связь хлорамфениколацетилтрансфераз (CAT) от мезофильных прокариот, чтобы они функционировали как надежные и эффективные ААТ, совместимые как минимум с 21 спиртом и 8 ацил-КоА субстратом для микробного биосинтеза линейных, разветвленных, насыщенные, ненасыщенные и / или ароматические сложные эфиры.Подключив лучший сконструированный CAT (CATec3 Y20F) к грамотрицательной мезофильной бактерии Escherichia coli, мы продемонстрировали, что рекомбинантный штамм может эффективно превращать различные спирты в желаемые сложные эфиры, например, достигая титра 13,9 г / л изоамилацетата. с конверсией 95% при периодической ферментации с подпиткой. Рекомбинантная кишечная палочка также была способна моделировать сложноэфирный профиль роз с высокой конверсией (> 97%) и титром (> 1 г / л) ферментируемых сахаров при 37 ° C. Точно так же рекомбинантная грамположительная целлюлолитическая термофильная бактерия Clostridium ther-mocellum, несущая CATec3 Y20F, может производить многие из этих сложных эфиров из устойчивой целлюлозной биомассы при повышенных температурах (> 50 ° C) благодаря замечательной термостабильности сконструированного фермента.В целом, сконструированные CAT могут служить надежной и эффективной платформой для биосинтеза сложных эфиров из возобновляемых и устойчивых источников сырья.
Новые бифункциональные органокатализаторы на основе хлорамфеникола, функционализированные амидами, для энантиоселективного алкоголиза мезоциклических ангидридов
Серия новых бифункциональных катализаторов на основе амида хлорамфеникола 7a — q (схема 1) была синтезирована из соответствующего оптически чистого (1 R , 2 R ) -диамина 6 , полученного в несколько стадий. из основы левомицетина [50].В общем, синтез прост и хорошо совместим с электронно-диверсифицированными амидами. В частности, лучше работали электронодефицитные амиды. С 3,5- (CF 3 ) 2 -дизамещенным амидом соответствующий продукт 7i был получен с выходом 90%. Различные защитные группы для азота в положении C-2 и кислорода в положении C-3 также исследуются для получения желаемых хиральных катализаторов с использованием простой процедуры.
Схема 1: Синтез бифункциональных амидных катализаторов 7a – q .
Схема 1: Синтез бифункциональных амидных катализаторов 7a – q .
При наличии различных бифункциональных катализаторов оценку их каталитического поведения при энантиоселективном алкоголизе мезо -циклического ангидрида 8a проводили в различных условиях с 10 эквивалентами метанола.В результате, эти новые кислотно-основные катализаторы Бренстеда 7a — q оказались достаточно активными и дали моноэфирный продукт с высоким выходом и превосходной энантиоселективностью, что свидетельствует об уникальной реакционной способности этого хлорамфениколового каркаса на основе амида.
Впервые исследованы электронные эффекты. Как правило, электронодефицитные катализаторы дают лучшую реакционную способность и энантиоселективность, чем богатые электронами варианты (таблица 1, записи 1–9).Среди них 7i показал наилучшие результаты с 95% выходом и 92% ее за 17 часов (таблица 1, запись 9). Неожиданная реакционная способность с этим бедным электронами 7i предполагает, что p K a является решающим для этого катализа. Дальнейшие модификации скелета хлорамфеникола с различными защитными группами на азоте в положении C-2 и кислороде в положении C-3 не улучшали реакцию, но приводили к снижению энантиоселективности (таблица 1, позиции 10–16). Примечательно, что с метил-защищенным катализатором 7q эта реакция протекала с более длительным временем реакции, но со сниженной энантиоселективностью, что свидетельствует о влиянии объемной эфирной группы (таблица 1, запись 17).Затем оценивали действие растворителя, и апротонные растворители работали лучше, чем протонные растворители (таблица 1, позиции 18 и 19), что соответствует литературным данным [45]. Кроме того, изменение концентрации или понижение температуры реакции не повлияло на выход или энантиоселективность, что предполагает независимость этой каталитической системы от концентрации / температуры (таблица 1, записи 20–23). Эти результаты подразумевают, что в этой системе нет значительной агрегации катализаторов.
Таблица 1: Скрининг условий асимметричного метанолиза мезо -циклических ангидридов.
| Вход | Кот. | Растворитель | Конц. (М) | T (° С) | Время (ч) | Выход a (%) | ee b, c (%) |
| 1 | 7a | МТБЭ | 0.05 | 20 | 34 | 91 | 84 |
| 2 | 7b | МТБЭ | 0.05 | 20 | 36 | 94 | 80 |
| 3 | 7c | МТБЭ | 0.05 | 20 | 40 | 95 | 77 |
| 4 | 7д | МТБЭ | 0.05 | 20 | 46 | 94 | 80 |
| 5 | 7e | МТБЭ | 0.05 | 20 | 48 | 99 | 83 |
| 6 | 7f | МТБЭ | 0.05 | 20 | 58 | 100 | 78 |
| 7 | 7 г | МТБЭ | 0.05 | 20 | 96 | 99 | 72 |
| 8 | 7ч | МТБЭ | 0.05 | 20 | 48 | 100 | 76 |
| 9 | 7i | МТБЭ | 0.05 | 20 | 17 | 95 | 92 |
| 10 | 7j | МТБЭ | 0.05 | 20 | 20 | 85 | 80 |
| 11 | 7к | МТБЭ | 0.05 | 20 | 58 | 99 | 71 |
| 12 | 7л | МТБЭ | 0.05 | 20 | 216 | 100 | 58 |
| 13 | 7 мес. | МТБЭ | 0.05 | 20 | 28 год | 95 | 84 |
| 14 | 7н | МТБЭ | 0.05 | 20 | 24 | 91 | 76 |
| 15 | 7o | МТБЭ | 0.05 | 20 | 192 | 97 | 82 |
| 16 | 7п | МТБЭ | 0.05 | 20 | 240 | 98 | 68 |
| 17 | 7q | МТБЭ | 0.05 | 20 | 58 | 93 | 54 |
| 18 | 7i | Толуол | 0.05 | 20 | 14 | 96 | 79 |
| 19 | 7i | MeOH | 0.05 | 20 | 18 | 91 | 10 |
| 20 | 7i | МТБЭ | 0.0125 | 20 | 86 | 99 | 94 |
| 21 год | 7i | МТБЭ | 0.1 | 20 | 12 | 95 | 87 |
| 22 | 7i | МТБЭ | 0.05 | 0 | 120 | 99 | 95 |
| 23 | 7i | МТБЭ | 0.05 | −20 | 384 | 92 | 96 |
a Изолированный выход. b Определено с помощью ВЭЖХ после превращения в производные амида с помощью ( S ) -1-фенилэтиламина. c Абсолютная конфигурация была определена путем сравнения с литературными данными.
Этот бифункциональный кислотно-основной катализатор Бренстеда 7i оказался высокоактивным в отношении асимметричного метанолиза различных мезо -циклических ангидридов. Как показано в таблице 2, различные циклические ангидриды легко превращали в соответствующие моноэфирные продукты с высокими выходами и энантиоселективностью.Примечательно, что бициклические ангидриды (таблица 2, элементы 1 и 2) и трициклические ангидриды (таблица 2, элементы 3 и 4) были более реакционноспособными, чем моноциклические ангидриды (таблица 2, элементы 5–12). В случае монозамещенных циклических субстратов, включая алкил- (таблица 2, элементы 5–7), простой эфир (элемент 8), арильное замещение (элементы 9–11), были обнаружены умеренные энантиоселективности. Более того, хиральные монозамещенные продукты являются универсальными ключевыми строительными блоками для синтеза различных промышленно важных фармацевтических препаратов, таких как γ-аминомасляная кислота (ГАМК) и аналоги γ-амино-β-гидроксимасляной кислоты (ГАБОБ) (баклофен HCl). и прегабалин) [51-54], ингибиторы HMG-CoA редуктазы («статины») [55-57] и т. д.
Таблица 2: Асимметричный метанолиз мезо -циклических ангидридов. а, б .
a Если не указано иное, реакции проводили с ангидридом (0.5 ммоль), MeOH (5,0 ммоль) и 7i (10 мол.%) В МТБЭ (10 мл) при комнатной температуре. b Абсолютная конфигурация была определена путем сравнения с литературными данными. c Изолированный выход. d Определено с помощью ВЭЖХ после дериватизации. e В МТБЭ (40 мл) при 0 ° C.
Общность и масштаб этой методологии были дополнительно продемонстрированы при алкоголизе 8a с различными спиртами (Таблица 3).Во всех случаях были получены отличные выходы с высокой энантиоселективностью. В этой реакции хорошо проявил себя стерически более объемный 2-пропанол. Аллиловый спирт, бензиловый спирт и циннамиловый спирт также хорошо совместимы в условиях бифункционального органокатализа для получения желаемых продуктов.
Таблица 3: Асимметричный алкоголиз ангидрида 8a различными спиртами. a
| Вход | ROH | Моноэстер | Время (ч) | Доходность b (%) | ee c, d (%) |
| 1 | метанол | 9a | 17 | 98 | 95 |
| 2 | спирт этиловый | 9 мес. | 96 | 97 | 93 |
| 3 | 2-пропанол | 9н | 98 | 93 | 89 |
| 4 | аллиловый спирт | 9o | 84 | 90 | 85 |
| 5 | бензиловый спирт | 9п | 66 | 98 | 86 |
| 6 | цинамиловый спирт | 9q | 66 | 99 | 90 |
a Если не указано иное, вышеуказанные реакции проводили с ангидридом (0.5 ммоль), MeOH (5,0 ммоль) и катализатор 7i (10 мол.%) В МТБЭ (40 мл) при комнатной температуре. b Изолированный урожай. c Определено с помощью ВЭЖХ после дериватизации. d Абсолютная конфигурация была определена путем сравнения с литературными данными.
Применение этой методологии к синтезу ( S ) -ГАБОБ ( 13 ), метаболического производного нейромедиатора γ-аминобутановой кислоты, было выполнено, чтобы проиллюстрировать синтетическую полезность [58,59] (Схема 2).Из коммерчески доступного диэтил-3-гидроксиглутарата ( 10 ) в три стадии получали ангидрид 8h с общим выходом 54%. Ключевой амид основания хлорамфеникола 7i , катализируемый энантиоселективным алкоголизом, давал моноэфир 9h в масштабе нескольких граммов. Полученный моноэфир с желаемым стереоцентром при С-3 превращали в тризащищенное производное GABOB 11 посредством перегруппировки Курциуса с выходом 75% за две стадии. После катализируемого Pd / C гидрогенизирующего снятия защиты гидроксигруппы в метаноле в кислых условиях соответствующий спирт 12 был перенесен в продукт 13 посредством кислотного снятия защиты.Однократная перекристаллизация из этанола позволила выделить 13 с ее выходом 96% и выходом 73%.
Схема 2: Асимметричный синтез ( S ) -ГАБОБ ( 13 ).
Схема 2: Асимметричный синтез ( S ) -ГАБОБ ( 13 ).
.
 Библиотечная, д. 43 (предварительное бронирование) (в Екатеринбурге, за исключением удаленных микрорайонов БЕСПЛАТНО при заказе на сумму от 800 ру
Библиотечная, д. 43 (предварительное бронирование) (в Екатеринбурге, за исключением удаленных микрорайонов БЕСПЛАТНО при заказе на сумму от 800 ру Чкалова, д. 124 (предварительное бронирование, возможна доставка) (Доставка в Екатеринбурге, за исключением удаленных микрорайонов БЕСПЛАТНО при з
Чкалова, д. 124 (предварительное бронирование, возможна доставка) (Доставка в Екатеринбурге, за исключением удаленных микрорайонов БЕСПЛАТНО при з 54
54 Суворовский, д. 5в (Предварительное бронирование)
Суворовский, д. 5в (Предварительное бронирование) Малышева, д. 146 (круглосуточно)
Малышева, д. 146 (круглосуточно) Панельная, д. 9а (круглосуточно)
Панельная, д. 9а (круглосуточно) Щербакова , д. 7 (круглосуточно)
Щербакова , д. 7 (круглосуточно)