Обострение аллергии: Весеннее обострение аллергии: причины, симптомы, как избавиться?
Весеннее обострение аллергии: причины, симптомы, как избавиться?
Весной просыпается не только природа, но и аллергия, портящая жизнь и не дающая радоваться теплу и солнцу. По статистике, 85% аллергиков страдают от обострения именно в это время. Какие аллергены весной наиболее распространены, как их избежать и справиться с проявлениями этой неприятной болезни: читаем в статье.
Ослабленный иммунитет и плохая наследственность увеличивают риск обострения аллергии. Если родители аллергики, то очень большая вероятность, что и ребенок им будет. Кроме того, весной мы чаще простужаемся, иммунитет снижается и риск возникновения неприятной реакции становится больше.
Что вызывает весеннее обострение аллергии?Весной увеличивается концентрация потенциальных аллергенов в воздухе:
- плесневые грибки,
- пыльца растений,
- пыль и пылевые клещи,
- шерсть линяющих домашних животных.
Аллергия на плесневые грибки начинается ещё до сезона цветения и спорообразования, потому что аллергены находятся в оттаявшей сырой почве, прошлогодней хвое, листьях и траве.
Симптомы аллергии на грибковые споры:
- кашель,
- чихание,
- зуд,
- заложенность,
- течение из носа,
- слезотечение.
Аллергия на пыльцу растений называется поллиноз. Она возникает, когда начинается цветение, поэтому из дома сложно выйти. При поллинозе краснеют глаза и текут слезы с соплями, в тяжелых случаях появляется астма. Её симптомы: одышка, тяжесть в груди и приступы затруднённого дыхания.
Высок риск перекрестной аллергии: одна усугубляется другой. Чаще всего это реакции на аллергены в пище. В таком случае может болеть живот, бывает тошнота или рвота, на коже появляется сыпь и преследует зуд. Поэтому следует избегать опасных продуктов:
- шоколада,
- цитрусовых,
- орехов,
- рыбы,
- морепродуктов,
- незрелых и экзотических фруктов.
Контактная бытовая аллергия, к примеру, на шерсть животных, обостряется весной из-за линьки и веществ для привлечения партнера. Пылевые клещи тоже появляются весной или осенью. Кроме того, в это время начинается пора ремонтов: разбираются завалы и появляется пыль. А где пыль и бытовая химия — там и аллергия.
Пылевые клещи тоже появляются весной или осенью. Кроме того, в это время начинается пора ремонтов: разбираются завалы и появляется пыль. А где пыль и бытовая химия — там и аллергия.
- Для профилактики избегайте потенциальных аллергенов или сведите контакт с ними к минимуму.
- При поллинозе отложите на потом прогулки по паркам и поездки за город, ходите по улицам в медицинской маске.
- Используйте кондиционеры с фильтрами или очистители воздуха.
- Не сушите стираное бельё на улице.
- Заходя с улицы, сразу переодевайтесь и принимайте душ.
- При аллергии на споры грибков чаще проводите тщательную уборку, чтобы не было плесени, мойте холодильник, душ и ванную.
- Исключите из рациона аллергенные продукты, придерживайтесь диетического питания.
Для лечения симптомов аллергии необходимо провести обследование, чтобы определить вид аллергии. Для этого обратитесь к врачу-аллергологу, который назначит обследование. В таком случае назначаются кожные пробы, анализ антител lgE или провокационные стресс-тесты. После приходите на повторный прием с результатами для назначения лечения:
В таком случае назначаются кожные пробы, анализ антител lgE или провокационные стресс-тесты. После приходите на повторный прием с результатами для назначения лечения:
- от покраснения и текущих слёз помогут глазные капли;
- капли в нос для снятия отёчности и сужения сосудов;
- от общих симптомов и кожных реакций помогают антигистаминные препараты — их назначают в любом случае;
- серьёзного лечения требуют проявления аллергии со стороны горла и дыхательных путей: необходимо снять отёк, иначе человеку грозит удушье. Внутривенно вводятся гормоны-глюкокортикоиды и сульфат магния;
- при пищевой аллергии назначаются энтеросорбенты.
Полностью избавиться от болезни, к сожалению, невозможно. Вы можете только облегчить состояние и ограничить контакт с аллергеном. Если у вас сильная реакция — отёк Квинке или бронхиальная астма, возможно, лучше уехать на время в другой регион, где цветение ещё не началось. К концу весны концентрация аллергенов снизится, и вы вернетесь к привычному ритму жизни.
Летние аллергии — обсуждение проблемы с аллергологом иммунологом ЕвроМед
Летом аллергиков подстерегают свои опасности. Кандидат медицинских наук, аллерголог-иммунолог «ЕвроМед клиники» Юлия Борисовна СЕЛИХОВА рассказывает нам о самых распространенных видах летней аллергии – на пыльцу растений и укусы насекомых.
Аллергия на цветочную пыльцу
Источник пыльцевой аллергии (поллиноза) летом — это злаковые и сорные травы. Этот тип аллергии мало отличается от весенней аллергии на пыльцу деревьев.
Симптомы
- Аллергический ринит (насморк), зуд в носу
- Раздражение и покраснение глаз, слезотечение, отек
- Чихание
- Кашель, не имеющий отношения к простуде
- Першение в горле
- Затруднение дыхания
Что делать
Суть профилактики аллергии на пыльцу состоит в том, чтобы минимизировать контакт с аллергеном. То есть не стоит бывать в местах, где высокая концентрация цветочной пыльцы (леса, поля, сады, огороды, скверы), особенно утром.
То есть не стоит бывать в местах, где высокая концентрация цветочной пыльцы (леса, поля, сады, огороды, скверы), особенно утром.
Дома регулярно делайте влажную уборку, пользуйтесь очистителем воздуха, при этом окна и двери держите закрытыми. Проветривать помещение рекомендуется во время или сразу после дождя. После каждого посещения улицы принимайте душ и снимайте уличную одежду. Идеальное решение — сменить климатическую зону на период ожидаемого обострения.
Совет:
При выезде на природу обязательно возьмите с собой антигистаминное средство, а в случае уже случавшейся ранее аллергии на укусы насекомых — и более серьезные препараты для неотложной помощи, которые вам может заранее порекомендовать аллерголог.
Аллергия на укусы насекомых
Летом риск укуса насекомых максимально высок. Сильными аллергенами являются яды, слюна и другие выделения насекомых. Также аллергическую реакцию могут вызвать хитиновые волоски, кусочки внешних покровов и экскременты насекомых. Чаще всего аллергическую реакцию вызывают укусы пчел, ос, шершней, шмелей, тропических муравьев. Но бывает аллергия и на укусы мошек, комаров, блох, клопов и других насекомых.
Чаще всего аллергическую реакцию вызывают укусы пчел, ос, шершней, шмелей, тропических муравьев. Но бывает аллергия и на укусы мошек, комаров, блох, клопов и других насекомых.
Симптомы
- Значительные покраснение, отек кожи, зуд в месте укуса и на окружающих тканях
- Жгучая боль в месте укуса
- Зудящие высыпания
- Конъюнктивит
- Ринит
- Слабость
- Лихорадка
- Головокружение
- Затруднение дыхания
- Понижение артериального давления с нарушением сознания
Что делать
Избегайте мест, где вас могут укусить осы, пчелы, шершни – за городом их намного больше, чем в городе. Помните, что насекомых привлекают цветущие растения с сильным запахом, а также – некоторые парфюмерные ароматы.
Если у вас или вашего ребенка были проявления аллергической реакции на укусы насекомых – будьте особенно осторожными, и при первых, самых незначительных признаках проявления аллергии обращайтесь к врачу.
Знаете ли вы, что…
От аллергической реакции на укусы насекомых в мире умирает втрое больше людей, чем от укусов змей.
Лечение
Существует два пути лечения при аллергии. Симптоматическое направлено на то, чтобы облегчить течение аллергии в период ее обострения: врач-аллерголог может посоветовать применение солевых растворов для гигиены носа, назальных фильтров, назальных препаратов, создающих защитную пленку на слизистой и т.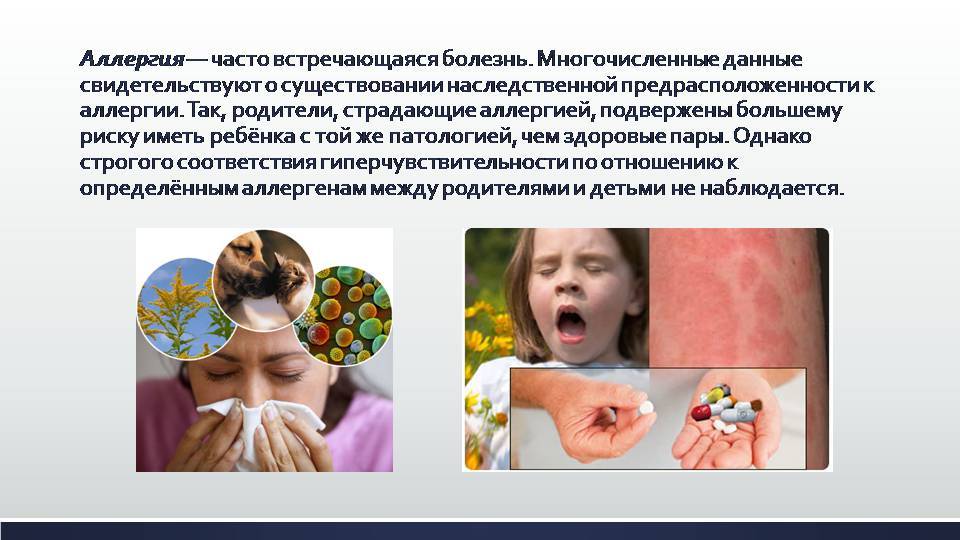
Более радикальным средством лечения аллергии является АСИТ (аллерген-специфическая иммунотерапия). Эта методика позволяет избавиться от аллергии на длительный период времени, в некоторых случаях — навсегда. Суть ее заключается в последовательном введении возрастающих доз аллергена, в результате чего снижается чувствительность к нему организма.
Аллергическое поражение желудочно-кишечного тракта у ребенка
Аллергическое поражение желудочно-кишечного тракта у ребенка
Вовлечение желудочно-кишечного тракта в аллергический процесс происходит столь часто, что его можно считать обязательным. Да это и не удивительно. Кишечник является очень важным иммунным органом, он буквально пронизан иммунными клетками, местами собирающимися в большие скопления.
Так, при сывороточной болезни, бронхиальной астме, поллинозе, крапивнице, отеке Квинке, лекарственной аллергии наблюдаются нарушения функций кишок аллергического характера. С другой стороны, воспалительные и атрофические изменения в слизистой оболочке кишок повышают вероятность всасывания пищевых и лекарственных антигенов и благоприятствуют вторичной сенсибилизации организма. При этом может играть роль снижение продукции секреторного IgA, препятствующего в норме проникновению через кишечную стенку экзоантигенов.
Аллергические энтеро- и колопатии могут развиваться вторично на почве дисбактериоза, хронических энтеритов, колитов, холециститов за счет сенсибилизации к аутомикрофлоре, тканевым антигенам, а особенно часто к пищевым антигенам и различным пищевым добавкам (консерванты, красители, антибактериальные вещества и др.).
Следовательно, кишечные дисфункции в одних случаях являются следствием и проявлением общего аллергоза, в других — аллергический компонент может быть существенным патогенетическим фактором хронического патологического процесса в органе самой различной этиологии.
На характер складывающегося заболевания влияют, в основном, три условия — возраст ребенка, отдел желудочно-кишечного тракта, который становится главным «плацдармом» для аллергической реакции, и глубина вовлечения слизистой оболочки в патологический процесс. Зависимость от возраста, в целом, можно охарактеризовать так: чем меньше ребенок, тем острее он реагирует на аллерген и тем обширнее площадь вовлечения слизистой оболочки.
Проявление аллергического поражения желудочно-кишечного тракта у ребенка.
У ребенка первых месяцев жизни употребление пищевого аллергена может вызвать обильную многократную рвоту и одновременно частый жидкий стул. Это очень напоминает симптомы острого отравления или кишечной инфекции.
В возрасте старше года, особенно после 5-6 лет, симптомы не столь остры и более отчетливо привязаны к определенному «этажу» желудочно-кишечного тракта — желудку, двенадцатиперстной, тонкой или толстой кишке. Одними из первых признаков формирующегося аллергического воспаления могут быть пищевые «капризы».
Более половины больных реагируют на употребление аллергена рвотой. Ее приближение вы заметите по изменению настроения и поведения ребенка: он хнычет, капризничает, отказывается от дальнейшего приема пищи. Рвота возникает во время еды или в пределах часа после нее. Нередко она сопровождается кишечными коликами. Маленький ребенок внезапно начинает пронзительно кричать, сучит ножками. Поглаживая его животик, вы ощутите, как он напряжен. Колики — это проявление своеобразной «моторной бури», вызываемой острой аллергической реакцией. Нередко они многократно повторяются в течение дня и приурочены к определенным часам.
Поглаживая его животик, вы ощутите, как он напряжен. Колики — это проявление своеобразной «моторной бури», вызываемой острой аллергической реакцией. Нередко они многократно повторяются в течение дня и приурочены к определенным часам.
У детей дошкольного и школьного возраста боль не обязательно возникает приступами. Она может быть тупой, продолжительной и не так явно связана с употреблением аллергенной пищи. После трех лет появляется тенденция к более узкой локализации болезненности живота, хотя сам ребенок еще не может показать это место. При вопросе «где у тебя болит?» он обычно кладет руку на пупок.
В некоторых случаях клиническая картина напоминает острый аппендицит, непроходимость кишок, тромбоз мезентериальных сосудов. Коликообразная боль в животе и болезненность при пальпации, повышение температуры тела, рвота, задержка стула или, наоборот, понос, а также тахикардия, падение АД, лейкоцитоз в крови позволяют заподозрить брюшную катастрофу. Однако быстрый эффект от приема антиаллергических средств, наличие общих аллергических симптомов (крапивница, отек Квинке, бронхоспазм, мигрень и др. ) и благополучный в большинстве случаев исход помогают поставить правильный диагноз. Алиментарная аллергическая реакция может повторяться у одного и того же больного при приеме непереносимого продукта.
) и благополучный в большинстве случаев исход помогают поставить правильный диагноз. Алиментарная аллергическая реакция может повторяться у одного и того же больного при приеме непереносимого продукта.
У многих матерей вырабатывается полезная привычка рассматривать стул своего ребенка. Основную тревогу у них может вызвать наличие слизи, иногда в значительном количестве, или прожилок крови. Такие отклонения характерны для аллергического воспаления толстой кишки. В дальнейшем на этой основе формируются серьезные хронические заболевания кишечника.
Расстройства стула — обычный признак желудочно-кишечной аллергии. Оно нарушает сложившуюся периодичность походов на горшок или ритм «грязный-чистый». У казалось бы здорового ребенка на привычной диете вдруг начинается понос, который через несколько дней сменяется запором. Такие «срывы» со временем принимают определенную регулярность. Это нарушение даже при относительно хорошем самочувствии ребенка далеко не безобидно. Оно свидетельствует о серьезных и уже далеко зашедших проблемах с кишечником.
Оно свидетельствует о серьезных и уже далеко зашедших проблемах с кишечником.
Все дело в том, насколько глубоко поражена стенка кишечника или желудка. Если срок заболевания еще короток и аллергическое воспаление захватило только поверхностные слои слизистой оболочки, — это приводит к нарушению процессов переваривания и усвоения пищи. При вовлечении более глубоких слоев возможно утолщение стенки и сужение просвета кишки. Тут уж не миновать тяжелых хронических запоров и мучительных болей в животе. Если такое сужение формируется в верхних отделах желудочно-кишечного тракта, то создаются условия для заброса кислого желудочного сока в пищевод, особенно при длительном нахождении ребенка в горизонтальном положении, например, во время ночного сна. Такие забросы могут вызвать рефлекторный спазм бронхов и приступ удушья. Почти всем современным родителям знаком специальный медицинский термин дисбактериоз. Это не что иное, как нарушение внутрикишечной экологии.
Обычно оно возникает после кишечных инфекций или длительного приема антибиотиков, но и аллергическое воспаление так же закономерно разрушает полноценное состояние естественной микробной флоры. Многие микробы, безвредные в здоровом организме, получают при пищевой аллергии возможность интенсивно размножаться и распространяться из мест своего обычного обитания в стерильные органы, вызывая болезненные процессы.
Аллергия, избирая своим плацдармом желудочно-кишечный тракт, расставляет много хитрых «ловушек», в которые попадаются как родители, так и врачи. Одна из них связана с тем, что все симптомы аллергии точно такие же, как и при других заболеваниях желудка и кишечника. Но это еще не все. Аллергическое воспаление приводит к таким серьезным тканевым нарушениям, что они оформляются в самостоятельные заболевания. Эти болезни (гастрит, гастродуоденит, ферментативная недостаточность, язвенная болезнь и др.) традиционно лечат у гастроэнтеролога.
Но все свое коварство аллергия проявляет у детей, уже страдающих хроническими заболеваниями желудочно-кишечного тракта. Ее скрытая «работа» приводит к тому, что традиционные методы лечения оказываются мало эффективными или, как это ни парадоксально, вызывают ухудшение состояния.
Вот почему все дети с аллергическими заболеваниями, имеющие желудочно-кишечные симптомы, должны проходить углубленное обследование как у аллерголога, так и у гастроэнтеролога.
Как нужно обследовать ребенка?
Специальное аллергологическое исследование с применением кожных проб с соответствующим антигеном, выявление специфических антител в сыворотке крови и сенсибилизации лимфоцитов к тому или иному аллергену позволяют установить истинную природу заболевания.
В кале иногда находят повышенное количество слизи, лейкоцитов, эозинофильных гранулоцитов. Слизистая оболочка кишки при эндоскопии может быть гиперемирована, отечна. При гистоморфо-логическом исследовании выявляют клеточную, преимущественно лимфоцитарную, эозинофильную или плазмоклеточную инфильтрацию, увеличение слизеобразующих бокаловидных клеток, иногда расширение капилляров, отек, геморрагии. В легких случаях биопсия кишок патологии не обнаруживает.
В период обострения может измениться характер электроколо-графической кривой: учащается ритм сокращений, тонические волны и участки повышения моторной функции чередуются с явлениями спазма и атонии.
Электроколограмма приобретает вид «раздраженной кишки» после приема продукта-аллергена. Рентгенологическое исследование вне периода обострения патологии не выявляет. После провокации продуктом, который, возможно, оказывает аллергизирующее воздействие, усиливается перистальтика желудка и кишок, ускоряется пассаж бария, образуются спастические перетяжки, скапливаются газы.
Дифференцировать аллергические электроколопатии необходимо от инфекционных, паразитарных, опухолевых заболеваний кишок, от острого аппендицита, тромбоза брыжеечных сосудов.
Лечение.
Рекомендуются диета, медикаментозные средства, физические факторы, лекарственные растения, минеральные воды. В зависимости от превалирования клинических симптомов (боль в животе, понос, запор) дифференцируется диета и фармакотерапия.
При запоре первостепенное значение имеет соответствующая диета, содержащая достаточное количество растительной клетчатки и других продуктов, усиливающих перистальтику. Обычно назначают диету № 3 по Певзнеру.
В рацион питания можно включать разнообразные напитки, газированные, в холодном виде; хлеб ржаной или содержащий отруби, хрустящие хлебцы с отрубями; молочнокислые продукты однодневные (кефир, ацидофильное молоко, простокваша), сметану, творог, сливки; сливочное, растительное масло; мясо и рыбу в любом виде; супы в большом количестве овощные и фруктовые, желательно в холодном виде, можно мясные, рыбные.
Крупы и мучные изделия: гречневая, ячневая, перловая, рассыпчатые каши, чечевица. Яйца вкрутую. Овощи и фрукты в большом количестве сырые, особенно морковь, чернослив, квашеная капуста, абрикосы.
Сладкие блюда: в большом количестве мед, компоты, варенье. Закуски и соусы разнообразные.
Исключаются кисели, крепкий чай, какао, шоколад, слизистые супы, протертые каши, сдобное тесто, ограничиваются блюда и напитки в горячем виде.
При поносе пищевые вещества должны минимально раздражать слизистую оболочку кишок. Из диеты исключают все продукты, стимулирующие опорожнение кишок, вводят вещества, уменьшающие перистальтику. Этим требованиям удовлетворяет диета № 4.
При назначении ее больные должны соблюдать постельный режим, пищу принимать 5—6 раз в день небольшими порциями. Химический состав диеты: белка 75 г, жира 50 г, углеводов 250—300 г, 8374—9211 Дж (калорий — 2000—2200). Поваренную соль ограничивают.
В рацион питания можно включать крепкий горячий чай, кофе, какао на воде, отвар из черники, белые сухари, сухое, несдобное печенье; молочные продукты: кефир и простоквашу трехдневную, свежий творог в протертом виде; масло сливочное в небольшом количестве; яйца и яичные блюда в ограниченном количестве; некрепкий куриный бульон, слизистые супы на воде с небольшим количеством масла, рисовый или овсяный отвар.
Мясо можно употреблять в ограниченном количестве в виде паровых котлет, кнелей и фрикаделек, в которые вместо хлеба рекомендуется добавлять рис с протертым чесноком, куры и рыбу нежирных сортов в отварном рубленом виде.
Крупы и мучные блюда: протертая каша на воде, паровой пудинг из протертой крупы.
Сладкое: кисель или желе, можно из сушеных фруктов, сахар и сахаристые вещества в ограниченном количестве.
Из рациона исключают пряности, острые и соленые приправы и блюда, овощи, фрукты, черный хлеб, молоко и свежие кислые молочные продукты, жирные сорта мяса и рыбы, холодные напитки и блюда, сдобное тесто и пироги.
Наряду с указанными общими принципами диетотерапии при составлении пищевого рациона больных необходимо исключить продукты-аллергены. Для этого на основании данных аллергологического анамнеза, кожных проб и серологических реакций выявляют продукты, которые могут быть аллергенами у данного больного. Часто наблюдается поливалентная аллергия, поэтому необходимо, по возможности, полностью прекратить контакт с соответствующими медикаментами, растениями, пылевыми, эпидермальными или другими антигенами.
Большое значение имеет исключение паразитарной инвазии как аллергизирующего фактора, для чего необходимо исследовать дуоденальное содержимое и кал на простейшие и яйца глист.
Неспецифическую сенсибилизацию проводят с помощью антигистаминных препаратов (димедрол по 0,03—0,05 г, тавегил по 0,01 г 2 раза в день, фенкарол или бикарфен по 0,025 г 3—4 раза в сутки, перитол по 0,04 г или диазолин по 0,05—0,1—0,2 г 1—2 раза в сутки). В более тяжелых случаях можно назначать глюкокортикостероидные препараты внутрь, внутримышечно, внутривенно или ректально.
При сочетании аллергической энтеропатии и аллергического колита целесообразна специфическая микробная гипосенсибилизация восходящими дозами аллергенов кишечной палочки, протея, стрептококка, стафилококка в зависимости от характера выявленной сенсибилизации.
Большое значение имеют седативная и психотерапия, ферментативные препараты (фестал, панзинорм, мексаза, панкреатин, панфермент, холензим и др.), ограничение, как правило, антибиотиков и других антибактериальных средств.
Лечение аллергического ринита
В первую очередь терапия предусматривает проведение комплекса элиминационных мероприятий по устранению контакта с аллергенами. К элиминационным мероприятиям относятся меры по снижению концентрации аэроаллергенов в жилых помещениях за счет регулярной уборки, устранению домашних животных, птиц, тараканов, очагов плесени, пищевых продуктов и лекарственных средств, уменьшению контакта с пыльцевыми аллергенами в период цветения, устранению пассивного курения.
С целью элиминации аллергенов используют промывание носовой полости с различными солевыми растворами. Однако очень важно, чтобы эти препараты не только хорошо вымывали частицы, но и увлажняли слизистую оболочку, оказывали терапевтическое, противоотечное воздействие, а по своим физико-химическим свойствам и составу были близки к назальному секрету человека.
Промывающий раствор обязательно должен быть в компактной упаковке, снабженной распылителем для удобного и быстрого использования.
Для удаления пыльцы ребенку слегка запрокидывают голову и делают по два впрыска в каждую ноздрю. Затем ребенка просят тщательно высморкаться. Процедуру следует повторить 2–4 раза для смягчения и увлажнения слизистой носа.
Препарат для промывания полости носа (например, «Хьюмер» «Аква Марис», «Ризосин», «Физиомер») рекомендуется хранить в аптечке. Родителям можно советовать снабжать им ребенка перед посещением детское учреждение.
Быстрое и своевременное промывание полости носа с помощью противоотечных препаратов приводит к эффективному удалению причинных аллергенов из полости носа, тем самым не позволяя им проникать в организм ребенка и запускать механизм аллергии. В настоящее время подобную элиминационную терапию принято рассматривать как первый этап лечения аллергического ринита.
Фармакотерапия аллергических ринитов направлена на устранение симптомов заболевания, воспаления в слизистой оболочке носа и предупреждения его возникновения необратимых изменений в виде утолщения слизистой оболочки носовых раковин и включает назначение.
С этой целью используются препараты применяемые внутрь, так и топические (местно действующие) препараты следующие лекарственные препараты.
Антигистаминные препараты.
При аллергических реакциях иммунная система объявляет ложную тревогу и на обычные вещества, такие как пыльца растений, домашняя пыль. Получив сигнал различные иммунные клетки выделяют сильные вещества – медиаторы, хранящиеся в специальных гранулах в клетках и в организме развивается бурная реакция и обострение заболевания. Одним из важных медиаторов, который вызывает симптомы аллергии – спазм бронхов, чихание, кашель, слезотечение, зуд, секрецию слюнных и бронхиальных желез — является гистамин. Действие гистамина связано с его влиянием на специфические рецепторы, расположенные на поверхности клеток различных органов и тканей. Так как эти рецепторы широко распространены в организме ( в коже, легких, слизистой желудочно-кишечного тракта), то и действие гистамина проявляется очень быстро и разнообразно. Препятствовать действию гистамина могут препараты, которые блокируют гистаминовые рецепторы, т.е. временно закрывают их и не дают соединиться с ними гистамину. Эти препараты называются антигистаминами. Они блокируют только гистаминовые рецепторы, т.е. действуют селективно, выборочно.
В терапии детей предпочтение отдается антигистаминным препаратам второго поколения. Антигистамины применяются для быстрой ликвидации аллергических проявлений при симптоматическом лечении сезонной сенной лихорадки, аллергического ринита и конъюнктивита, атопических дерматитах. “Старые” антигистамины сегодня применяются редко, так как созданы препараты, второго и третьего поколения, которые имеют высокий клинический эффект и редко побочные проявления. У маленьких детей применяют зиртек, кларитин, кетотифен. У детей старшего возраста и подростков — телфаст, кестин, кларитин, симплекс. Местные антигистаминные препараты (вибрацил, левокабастин, азеластин) назначается в виде капель в нос или назального спрея.
Кромоны
В терапии аллергического ринита, как и в случае лечения бронхиальной астмы, применяется профилактическое лечение кромогликатом натрия (кромолин, ломузол, кромоглин). Этот препарат эффективен при лечении легкого и среднетяжелого аллергического ринита. В случае регулярных сезонных обострений препараты кромогликата натрия следует назначать за 1-2 недели до предполагаемого обострения. Эффект при лечении кромогликатами в виде назальных или глазных капель наступает через несколько дней. Курс лечения продолжается от нескольких дней до 2-3 месяцев.
Для больных аллергическим конъюнктивитом, проявляющимся воспалением слизистых оболочек глаза (покраснением, отеком, зудом, слезотечением) кромогликат выпускается в виде глазных капель (Оптикром, Хай-кром).
Антихолинергические препараты
Из лекарственных средств этой группы наиболее широко используется ипратропиум бромид. Он способствует уменьшению отделяемого (ринореи) и отека слизистой оболочки носа.
Назальные кортикостероидные препараты беклометазон (альдецин) и флютиказон (фликсоназе) обладают выраженным противовоспалительным эффектом. Эти лекарственные средства назначают при тяжелом и среднетяжелом течении аллергических ринитов, при отсутствии эффекта от антигистаминные средств и кромонов. В среднем, достаточно месячного курса лечения назальными стероидами. Доза определяется врачом, частота введения — 1-2 раза в день. В случае хронического течения аллергического круглогодичного ринита после курса топических стероидов, целесообразно продолжить лечение назальными кромонами.
Для лечения сочетанной тяжелой бронхиальной астмы и аллергического ринита будет целесообразно использовать одну и ту же группу топических кортикостероидов, например беклометазон в виде дозирующего аэрозоля и в виде назального спрея. Применение назальных стероидов в этом случае приводит не только к восстановлению носового дыхание, но и к более быстрому купированию бронхиальной обструкции. Кроме того, купирование аллергического воспаления в носовой полости оказывает положительное лечебное воздействие на течение аллергического конънктивита. Необходимо учитывать общую дозу назначаемых глюкокортикостероидов.
Деконгестанты — это сосудосуживающие средства для восстановление носового дыхания. Применяют их в виде капель и назальных аэрозолей. Их действие носит исключительно симптоматический характер. Ограничением к использованию препаратов этой группы являются побочные эффекты. Одно из них – развитие, так называемого, “медикаментозного” ринита при длительном применении.
Специфическая иммунотерапия — метод лечения, направленный на снижение чувствительности организма к аллергенам. Проведение этого вида терапии показано пациентам, страдающих аллергическим ринитом, с четко установленными аллергенами, при наличии определенных показаний и отсутствии противопоказаний, определяемых аллергологом.
🧬 Сезонная аллергия: причины, лечение, профилактика
Поллиноз проявляется у детей с 3-4 лет. Об особенностях заболевания рассказывает руководитель центра педиатрии GMS Clinic Надежда Магарина дала комментарии интернет-порталу «Здоровые дети».
Сезонная аллергия — реакция организма на цветение и пыление растений. По-научному это заболевание называется «поллиноз» или «сезонный аллергический риноконъюнктивит», в народе его еще называют «сенной лихорадкой».
Наиболее частой причиной сезонной аллергии является пыльца деревьев. Объясняется это тем, что деревья растут повсеместно и пылят на более далекие расстояния. Самый распространенный аллерген среди деревьев — пыльца березы.
Первые симптомы аллергии у ребенка легко спутать с ОРВИ, особенно если до этого аллергии ни у ребенка, ни у родителей не было, и они не знакомы близко с симптомами протекания этой болезни.
Начальные проявления аллергии на пыльцу — чихание, заложенность носа, покраснение глаз, возможны сильные реакции в виде приступов бронхиальной астмы.
Как отличить аллергию от ОРВИ?
«Весной родители говорят, что ребенок простудился, потому что его рано раздели или потому что встретили болеющего друга, а на самом деле — это аллергическая реакция, и она уже запущена. Чем раньше начать компенсировать реакцию, тем выше результат. Необходимо контролировать аллергическую реакцию, чтобы ваш ребенок не сидел дома и не сопливил по ночам», — отметила Надежда Магарина.
«Чтобы держать под контролем аллергическую реакцию, необходимо следить за пылением растений, которые являются аллергенными для ребенка и заблаговременно начать прием антигистаминных средств, — продолжила доктор Магарина. — Количественное содержание пыльцы в воздухе изучается на государственном уровне. Узнать информацию о том, какие растения пылят в данный момент, можно на сайтах, которые размещают информацию о пыльцевом мониторинге, например, Пыльца CLUB. Если вы планируете поездку, например, на отдых, то можно посмотреть обстановку там».
Наследственная предрасположенность
Если в семье по материнской и по отцовской линии есть аллергики, включая второе поколение, то есть дедушек, бабушек и других родственников, то вероятность, что у ребенка будет аллергия — 70%. Если только по материнской или только по отцовской линии, то вероятность составляет 30%. При этом не имеет значения какая именно аллергия была у родственников — на пыльцу, пищевая аллергия или аллергия на кошек.
«Наследуется не конкретная аллергия, а аллергическая реакция в принципе. На что она будет реализована — зависит от жизни каждого человека. Если есть даже маленькая склонность к аллергии, появление ярко выраженной аллергической реакции может быть спровоцировано сопутствующими факторами, как то: загрязненный воздух, прием нескольких различных медикаментов во время заболеваний, употребление пищи с красителями, например, „чупа-чупсов“, а также другими факторами. При этом аллергия может вообще не реализоваться, вы можете прожить всю жизнь и не узнать, что у вас есть аллергия», — пояснила педиатр-аллерголог.
Первый период: с марта по май. Вызван цветением деревьев и кустарников.
Второй период: с июня по июль. Вызван пылением злаковых и луговых трав.
Третий период: с августа по октябрь. Вызван пылением сорных трав и спорами плесневых грибов.
Главные аллергены
Деревья и кустарники: береза, ольха, лещина или орешник, дуб, клен, тополь, ясень, вяз и другие.
Береза — наиболее частая причина появления сезонной аллергии. Имеет очень летучую пыльцу. Сезон аллергических реакций на березу начинается еще когда не сошел снег — в марте, апреле или мае, в зависимости от того, насколько холодная, долгая и снежная зима. В ветреную погоду пыльца может распространяться на десятки километров. Берез в нашей стране очень много, поэтому исключить аллерген из жизни практически не возможно.
Ольха — второй по распространённости аллерген.
Коварство кустарников заключается в том, что их сложно идентифицировать, пока не появились листики, например, трудно отличить орешник от ольхи.
Злаковые и луговые травы: рожь, пшеница, тимофеевка, овсяница, мятлик, пырей, костер, гречиха и другие.
Коварство аллергенных трав заключается в том, что не многие знают, как эти травы выглядят.
Причиной аллергии также может стать обычная газонная трава. Если вовремя не подстричь газон, то трава зацветет и начнет пылить. Газоны могут пылить несколько раз в год. Сок свежескошенной травы при попадании на кожу человека также может стать причиной аллергической реакции, которая выражается в виде крапивницы.
Сорные травы: полынь, лебеда, одуванчик, амброзия, конопля, крапива, лютик и другие.
Одуванчики — очень аллергенны. Имеют тяжелую пыльцу, поэтому чтобы началась реакция, нужен близкий контакт с аллергеном, например, надеть венок из одуванчиков себе на голову или уткнуться лицом в цветок.
Полынь — достаточно аллергенная. Растет вдоль канав и заброшенных мест.
Плесневые грибы. Водятся в прелой листве, в картофеле, во влажных помещениях. «Если у ребенка аллергическая реакция на плесневые грибы, то шуршание опавшими листиками, которое так любят дети, приведет к заложенному носу, кашлю, начнут чесаться глаза», — сообщила Надежда Магарина.
Периоды обострения заболевания
Особенно сложными для аллергиков становятся года, когда весна вначале задерживается, а потом наступает резкое потепление. Одновременно начинают пылить разные растения, накапливается большая концентрация пыльцы в воздухе, что ведет к более сильным реакциям и дает большую монологическую аллергическую память, т. е. значительно повышается вероятность того, что в следующем году аллергия повторится.
Перекрестная аллергия. Важно знать!
Перекрестная аллергия заключается в осложнении аллергической реакции при употреблении некоторых продуктов, являющихся перекрестными с аллергией на растения и грибы-микроорганизмы. В повседневной жизни эти продукты можно употреблять в привычных количествах, однако, когда начинается период пыления аллергенных растений, их стоит исключить из рациона. В противном случае может начаться сильная реакция, вплоть до отека Квинке, когда начинают отекать губы, язык, гортань, сильно раздуваются лицо и шея, иногда уши, человек опухает и начинает задыхаться. Могут начаться сильные боли в животе, вплоть до госпитализации. Самостоятельно определить, что это является следствием аллергической реакции — не просто. «Самый типичный пример — человек, который имеет небольшую аллергическую реакцию на березу, поехал на пикник, там ест, к примеру, мясо, запивает яблочным соком, ест фрукты — яблоки, персики, черешню, а потом у него, помимо кашля и соплей, возникают боли в животе. Не один раз были подобные случаи, когда к нам привозили пациентов с такими болями в животе. В данном случае необходимо использовать противоаллергические препараты и соблюдать диету», — пояснила врач-аллерголог.
Перечень продуктов, которые стоит исключить из рациона в аллергенный период можно посмотреть здесь.
Стоит отметить, что перекрестная аллергия возможна не только при наличии у человека аллергии на растения, но и при пищевой аллергии.
Аллергический марш
«Из неприятных моментов сезонной аллергии — так называемый аллергический марш. Начавшись с покраснения глаз или чихания, аллергическая реакция быстро „марширует“ по разным системам организма, и к традиционным симптомам могут добавиться покашливание, нарушение сна, неожиданные сильные отеки, также возможно появление аллергической реакции на другие травы и растения, которые начинают цвести в этот момент», — отметила Надежда Магарина.
Профилактика и лечение
Систематическая терапия — что делать, когда аллергия уже началась. Необходимо убрать аллерген или снизить контакт с ним. Начать прием антигистаминных препаратов, использовать капли в нос и глаза, спреи в горло. Такая терапия поможет снять форму остроты и тяжесть момента, но не решить проблему.
«Все зависит от конкретных случаев проявления аллергии. Одно дело, когда у ребенка только аллергия на березу, и то не ярко выраженная. И совсем другое, когда реакция на все, и у ребенка не просто заложен нос, и он чихает, а у него и конъюнктивит, и астма, и отек Квинке, и крапивница. В этом случае медицинская медикаментозная активность будет совершенно другая, вплоть до назначения гормональных препаратов, капельниц, домашнего или стационарного режима. Есть люди, у которых очень сильная реакция, и они вынуждены просто не ходить на улицу в тот момент, когда сухо, ветрено и когда теплая погода вначале задерживается, а потом резко теплеет», — сообщила руководитель центра педиатрии GMS Clinic.
Иммунотерапия — профилактика с помощью уколов, капель или капсул, содержащих аллерген. Еще когда растения не начали пылить, в организм ребенка вводится небольшое количество аллергена, например, березы. В организме образуются защитные факторы, и ребенок не проявляет аллергической реакции на данный аллерген. Считается, что три года такой терапии избавляют человека на 12 лет от сильных проявлений или, как минимум, от значимой медикаментозной агрессии.
«Если у человека не очень много аллергенов, и он в нужный момент соблюдает диету и следует рекомендациям врачей, то в скором времени он может вообще забыть, что такое аллергия, что нужно всегда носить с собой капли в нос и антигистаминные средства», — отметила педиатр-аллерголог Надежда Магарина.
Источник: healthy-kids.ru
Аллерген специфическая иммунная терапия (АСИТ)
В современной медицине понятие аллергия означает сверхчувствительность иммунной системы человека при повторных воздействиях аллергена.
Самый распространенный вид аллергии — поллиноз (сенная, или сезонная лихорадка). Наиболее часто симптомы поллиноза в средней полосе России проявляются в период с апреля по май во время цветения березовых (береза, ольха, граб, орешник) и с июня по август (пыление сорных и злаковых трав).Симптомы поллиноза:
- насморк,
- заложенность носа,
- приступы чихания,
- чувство жжения или зуда в носу и полости рта,
- стоматит,
- конъюнктивит (покраснение, ощущение песка в глазах, зуд/жжение),
- кашель, в некоторых случаях приступы удушья.
Реже встречаются расстройства сна, усталость, повышенная утомляемость. Как правило, с каждым годом симптомы становятся более интенсивными. В конечном итоге заболевание может привести к развитию бронхиальной астмы.
Лечение аллергии
Как правило, для облегчения состояния пациента, в период обострения аллергии используется симптоматическое лечение:антигистаминные препараты, местные противовоспалительные и противоаллергические средства в виде капель и спреев, а также системные антиаллергические препараты, вплоть до гормональных медикаментов в тяжелых случаях.
Эти меры являются временными и позволяют лишь уменьшить интенсивность симптомов, не влияя на причину заболевания. Зачастую симптомы аллергии возвращаются после отмены препаратов. К счастью, современная европейская медицина предлагает метод, доказавший свою эффективность,– аллерген специфическую иммунную терапию (АСИТ), которая оказывает непосредственное воздействие на причину развития аллергии. АСИТ приводит к уменьшению выраженности клинических проявлений либо помогает добиться длительной ремиссии аллергического заболевания, предотвращает развитие осложнений, а также препятствует прогрессированию аллергии в более тяжелые формы.
АСИТ показана к применению при таких аллергических заболеваниях, как:
- аллергический ринит;
- поллиноз;
- бронхиальная астма;
- в качестве профилактики полипозов носовых пазух.
Принцип действия АСИТ
АСИТ заключается в последовательном введении в организм человека возрастающих доз аллергенов для создания иммунитета к ним. Поэтому этот метод иногда называют «прививкой от аллергии». Продолжительность курса в среднем составляет 3-5 лет. По данным международных рекомендаций АСИТ разрешена к применению с 5-летнего возраста.
Как проводится АСИТ
В зависимости от времени проведения АСИТ может быть:
- Предсезонной. Показана пациентам, страдающим поллинозом, то есть аллергией на пыльцу деревьев и трав. Начинают ее за 3-4 месяца до начала цветения растений. В результате предсезонной АСИТ к началу сезона цветения достигается максимально переносимая доза аллергена, затем курс АСИТ временно приостанавливается и возобновляется на следующий год.
- Круглогодичной. Показана пациентам, страдающим аллергией на бытовые аллергены, такие как клещи домашней пыли. Курс проводится до достижения максимально переносимой дозы аллергенов с последующим введением поддерживающих доз.
И предсезонная, и круглогодичная схема АСИТ состоят из двух фаз:
- Основная. Аллерген вводится постепенно до максимально переносимой дозы.
- Поддерживающая. Во второй фазе – поддерживающей — вводятся максимально переносимые дозы аллергенов.
Существует два основных метода введения аллергена: подкожный и сублингвальный. Подкожные инъекции делает врач в область наружной поверхности плеча. До недавнего времени это был по сути единственный способ лечения. Однако в последнее время все большее распространение приобретает другая методика: препараты в виде капель или таблеток, которые принимаются под язык (сублингвально). По данным многочисленных исследований, оба способа введения обладают одинаковой эффективностью, при этом сублингвальный метод показывает большую безопасность и технически очень удобен.
АСИТ должна проводиться только в условиях специализированных аллергологических кабинетов и отделений.
Подбор препарата и схемы лечения проводит врач аллерголог-иммунолог с учетом индивидуальных особенностей после предварительного комплексного аллергологического обследования с целью выявления показаний и противопоказаний к данному методу лечения.
Обследование включает в себя:
- Анализы крови;
- Кожное «прик-тестирование»;
- Молекулярную диагностику аллергии.
Обследование проводится заблаговременно до начала лечения, обычно в осенний период.
АСИТ сегодня — единственный метод лечения аллергии с устойчивым эффектом в отношении всех симптомов, удобный и безопасный!
Клиника дерматовенерологии и аллергологии-иммунологии Европейского медицинского центра (г. Москва) предлагает современные методы лечения аллергии согласно европейским протоколам. Специалисты Европейского медицинского центра проводят все виды диагностики аллергии, так как своевременная и полная диагностика позволяет установить точный диагноз и начать лечение на ранних стадиях заболевания, когда прогноз наиболее благоприятен.Противопоказания к АСИТ
- Иммунодефицит, тяжелые нарушения иммунитета.
- Онкологические заболевания.
- Тяжелые психические заболевания.
- Сердечно-сосудистые заболевания, при которых противопоказан адреналин (тяжелая артериальная гипертензия, нарушения сердечного ритма и др.).
- Возраст до 5 лет при проведении подкожной АСИТ.
- Тяжелая аллергическая реакция при предыдущем проведении.
Сублингвальная АСИТ противопоказана:
- при язвах и эрозии полости рта;
- при заболеваниях зубов и десен;
- после недавно перенесенных операций в полости рта, в том числе удаления зуба.
Сезонные аллергии
2020.06.03
Аллергия — это преувеличенная реакция системы защиты человека на вещества, которые в целом безопасны для человека.
Аллергия вызывает реакцию организма на воздействие частиц в окружающей среде человека, таких как клещи домашней пыли, пыльца и перхоть животных. Эти частицы называются аллергенами.
Иммунная система организма распознает их как опасных злоумышленников и, когда они вступают в контакт с ними, вырабатывает специальные белки, называемые иммуноглобулинами E (IgE), антитела, которые вызывают аллергическое воспаление при взаимодействии с аллергенами. Здесь вы можете увидеть примеры пыльцы с разных растений.
Антиген — это вещество на поверхности клеток, которое запускает иммунный ответ путем активации лимфоцитов, которые вырабатывают антитела, специфичные для типа антигена. Антитела связываются с антигеном, либо нейтрализуя его как угрозу, либо маркируя его для уничтожения макрофагов. Ответ антиген-антитело представляет собой специфическое химическое взаимодействие между антителами, продуцируемыми В-клетками, и антигеном во время иммунного ответа.
Аллергия нарушает нормальный ритм жизни, доставляя много неудобств как детям, так и взрослым. Возникновение аллергической реакции вызывает ряд серьезных проблем со здоровьем или недомоганий, таких как насморк, одышка, чихание, слезотечение, сыпь. Часто может возникнуть ощущение, что аллергия продолжается в течение всего года, и такой человек будет прав, и если аллергия беспокоит человека хотя бы часть года (только весной или летом), Ян также задается вопросом, когда он сможет выздороветь. Люди, чья аллергия ухудшается весной, осенью или зимой, могут счастливо чувствовать облегчение в межсезонье, но для тех, кто испытывает симптомы аллергии круглый год, это постоянная борьба с переносимыми по воздуху аллергенами.
Сезонная аллергия на пыльцу может начаться даже у тех, кто ранее на нее не жаловался, и у людей любого возраста. Первая стадия обострения аллергии на пыльцу наступает весной, хотя эта аллергия обычно усиливается в июне и июле.
В Литве наиболее распространенными аллергиями являются береза, тис, тополь, ольха и клен, дуб, масло, яблоня и хвойные (сосна, ель). Это первая волна сезонной аллергии в марте, апреле.
Сразу после этого, в мае, июне, начинается вторая волна сезонной аллергии, когда цветут луговые растения (цветут долго, некоторые виды даже удваиваются).
Третья волна сезонной аллергии начинается в конце лета, когда зацветают семена гречихи, крапивы, подорожника.
Аллергия нарушает нормальный ритм жизни, доставляя много неудобств как детям, так и взрослым. Возникновение аллергической реакции вызывает ряд серьезных проблем со здоровьем или недомоганий, таких как насморк, одышка, чихание, слезотечение, сыпь. Часто может возникнуть ощущение, что аллергия продолжается в течение всего года, и такой человек будет прав, и если аллергия беспокоит человека хотя бы часть года (только весной или летом), Ян также задается вопросом, когда он сможет выздороветь. Люди, чья аллергия ухудшается весной, осенью или зимой, могут счастливо чувствовать облегчение в межсезонье, но для тех, кто испытывает симптомы аллергии круглый год, это постоянная борьба с переносимыми по воздуху аллергенами.
Сезонная аллергия на пыльцу может начаться даже у тех, кто ранее на нее не жаловался, и у людей любого возраста. Первая стадия обострения аллергии на пыльцу наступает весной, хотя эта аллергия обычно усиливается в июне и июле.
В Литве наиболее распространенными аллергиями являются береза, тис, тополь, ольха и клен, дуб, масло, яблоня и хвойные (сосна, ель). Это первая волна сезонной аллергии в марте, апреле.
Сразу после этого, в мае, июне, начинается вторая волна сезонной аллергии, когда цветут луговые растения (цветут долго, некоторые виды даже удваиваются).
Третья волна сезонной аллергии начинается в конце лета, когда зацветают семена гречихи, крапивы, подорожника.
Вы готовы к волне сезонной аллергии?
В организме существуют различные аллергические реакции — в зависимости от самого аллергена или пути его поступления, мы можем испытывать различные симптомы. Когда пыльца оседает на глазах или слизистой оболочке носа, вы почувствуете заложенность носа, водянистые и слизистые выделения из носа, чихание, глаз, боль в горле, одышку, сухой кашель, сыпь. Симптомы аллергии на пыльцу включают крапивницу, отек (отек), бронхиальную астму или ее обострение, приступы мигрени, аллергический ринит, воспаление глаз.
Сезонная аллергия — это аллергические заболевания, такие как аллергический ринит (также известный как аллергический ринит, сенная лихорадка) или аллергический конъюнктивит (воспаление глаз, вызванное аллергией с опухшими, красными, зудящими глазами).
Эти заболевания возникают и повторяются только в определенные периоды года: весной, летом и осенью до первых заморозков.
Возможные симптомы аллергии обычно возникают внезапно и, по-видимому, без видимой причины. Внезапная заложенность носа, насморк, приступы чихания и кашля являются основными пророками сезонной аллергии, поэтому вам следует проверить это.
Аллергия диагностируется и подтверждается аллергологом и клиническим иммунологом, который выполнил анализы крови или кожные анализы. Точные и качественные анализы, а также искренняя работа врача с вами — залог успешной диагностики. И успешный диагноз обычно становится ключом к успешному лечению.
Избегайте прогулок на свежем воздухе при пиковой концентрации пыльцы воздуха (от 10 до 20 часов).
Когда вы вернетесь с поля, измените.
Принимайте душ как минимум два раза в день.
Вымойтесь с улицы, обязательно ополосните волосы.
Не сушите стиральную одежду на улице.
Проветривайте комнаты после дождя или просто в тихий безветренный день
Это всего лишь несколько советов. Вы получите подробную информацию, советы и лечение от вашего аллерголога и клинического иммунолога. Прогресс неконтролируемой и необработанной аллергии. Наиболее опасной реакцией является анафилактический (аллергический) шок, который обычно вызывается приемом лекарств и укусами насекомых. Другие, более слабые реакции вызывают повреждение кожи и бронхов. Самолечение при аллергии невозможно, так как это может причинить вред самому себе.
Никакая аллергия не проходит сама по себе.
Пищевая аллергия. Советы врача. | Министерство здравоохранения Чувашской Республики
Скоро Новый год, самый любимый праздник детей и взрослых. Новый год – это весёлые хороводы, вкусные подарки. Но, к сожалению, зачастую, наши взрослые, увлекшись застольем, оставляют без присмотра детей, и тогда праздник превращается в кошмар.
Традиционно в праздничные дни возрастает количество больных с признаками пищевой аллергии и пищевой непереносимости (крапивница, отёк Квинке, аллергические дерматиты) и с обострением бронхиальной астмы, аллергического ринита, атопического дерматита.
1.Что такое пищевая аллергия.
Пищевая аллергия – это повышенной чувствительности организма к пищевым продуктам, которое развивается при нарушении иммунной системы.
Чаще аллергия наблюдается у детей, взрослые, как правила, страдают ею с детства.
Среди людей с заболеваниями желудочно-кишечного тракта, печени, желчевыводящих путей распространённость аллергии к продуктам питания шире, чем среди лиц, не страдающих этой патологией, и колеблется от 5 до 50%.
Также часто встречается пищевая аллергия у больных с другими аллергическими заболеваниями, в частности, при поллинозе.
Пищевую аллергию следует отличать от другого, очень похожего на неё, состояния – пищевой непереносимости.
2.Какие отличия имеют «пищевая аллергия» и «пищевая непереносимость»?
При пищевой непереносимости, в отличие от пищевой аллергии, изменений в иммунной системе нет, а причины развития реакций непереносимости часто связаны с наличием у человека разных сопутствующих заболеваний, например желудка, кишечника, печени, нервной и эндокринной системы.
Кроме того, пищевая аллергия сохраняется в течение всей жизни человека, а пищевая непереносимость может исчезать после устранения причин, её вызвавших.
3.Какие симптомы характерны для пищевой аллергии?
К наиболее частым клиническим проявлениям пищевой аллергии с преимущественным поражением желудочно-кишечного тракта относятся: рвота, колики с отсутствием аппетита, отказ от еды, запоры, жидкий стул, зуд в полости рта или горле.
Кожные проявления пищевой аллергии, или аллергодерматозы относятся к самым распространённым, как у взрослых, так и у детей. У детей до 1 года, одним из первых признаков пищевой аллергии могут служить опрелости, симптомы раздражения кожи, зуда, которые возникают после кормления.
Проявления пищевой аллергии со стороны дыхательных путей (аллергический ринит, ларингит). Аллергический ринит при пищевой аллергии характеризуется появление обильных, слизистых выделений из носа, иногда заложенностью, чиханием, зудом кожи вокруг носа или в носу.
Изменения со стороны нервной системы при пищевой аллергии – это головная боль, мигрень.
4.Какие пищевые продукты чаще вызывают пищевую аллергию?
Пищевая аллергия может развиться после приёма практически любого пищевого продукта, однако, существуют продукты питания, обладающие выраженными аллергизирующими свойствами и имеющие особую аллергенную активность:
— рыба, особенно морская
— морепродукты (устрицы, ракообразные, моллюски и т.д.)
— орехи (арахис, фундук)
— яйца
— молоко
— косточковые (абрикосы, красные сорта яблок и др.)
— овощи (морковь, томаты)
— пищевые злаки (пшеница, овёс и др.)
Наиболее часто при употреблении продуктов, богатых биологически активными веществами (гистамином, тирамином) развивается пищевая непереносимость. Это после употребления сыра, вина, кислой капусты, шпината, томатов, ветчины, сосисок, консервированных продуктов, копчёностей, маринадов, авокадо. Нередко причиной развития пищевой непереносимости является не сам продукт, а различные химические добавки (красители, ароматизаторы, аниоксиданты, эмульгаторы, ферменты)
Если вы не знаете точно (виновника аллергии), рекомендуется придерживаться общей гипоаллергеной диеты и в праздничные дни.
Общая неспецифическая гипоаллергенная диета.
Рекомендуется исключить из рациона
- Цитрусовые (апельсины, мандарины, лимоны, грейпфруты и др.)
- Орехи (фундук, миндаль, арахис и др.).
- Рыба и рыбные продукты (свежая и солена рыба, рыбные бульоны, консервы из рыб, икра и др.).
- Птица (гусь, утка, индейка, курица и др.) и изделия из них.
- Шоколад и шоколадные изделия.
- Кофе.
- Копчёные изделия.
- Уксус, горчица, майонез и прочие специи.
- Хрен, редис, редька.
- Томаты, баклажаны.
- Грибы.
- Яйца.
- Молоко пресное.
- Клубника, земляника, дыня, ананас.
- Сдобное тесто.
- Мёд.
- Категорически запрещается употреблять все алкогольные напитки.
В пищу можно употреблять
- Мясо говяжье нежирное отварное.
- Супы: крупяные, овощные:
- На вторичном говяжьем бульоне
- Вегетарианские
- Масло сливочное, оливковое, подсолнечное.
- Картофель отварной.
- Каши: гречневая, геркулесовая, рисовая.
- Молочнокислые продукты- однодневные(творог, простокваша).
- Огурцы свежие, петрушка, укроп.
- Яблоки печёные, арбуз.
- Чай, сахар.
- Компоты из яблок, слив, смородины, вишни, сухофруктов.
5.Какую помощь должны оказать родители при симптомах пищевой аллергии.
1.Элиминация (устранение) пищевого аллергена, предположительно вызвавшего реакцию.
2.Энтеросорбенты (активированный уголь, смекта, полифепан, энтеросгель, лактофильтрум)
3.Очистительная клизма.
4.Антигистаминные препараты.
5.При усиливающихся симптомах обратится к педиатру.
6.Практические советы.
Чтобы Новый год оставался самым любимым праздником, внимательно читайте этикетки на импортных и отечественных пищевых продуктах, содержащих основные сведения о количественном и качественном составе.
Не следует больным, страдающим пищевой аллергией или пищевой непереносимостью, использовать в питании генетически обработанные продукты.
Следует заранее позаботиться об обеспечении правильной диеты с исключением «виновных» пищевых аллергенов при посещении ресторана, гостей или поездки в отпуск.
Если, находясь в ресторане или в гостях, вам предлагают блюда, состав которого не известен, лучше от него отказаться.
Заведующая аллергологическим отделением
Городской детской клинической больницы
Луканова Ирина Геннадьевна
Аллергия и астма: часто встречаются вместе
Аллергия и астма: часто встречаются вместе
Аллергия и астма: Специалист клиники Мэйо объясняет связь и объясняет, что вы можете сделать, чтобы предотвратить приступы и справиться с симптомами.
Персонал клиники Мэйо Джеймс Т. К. Ли, доктор медицины, доктор философииВы можете задаться вопросом, что общего между аллергией и астмой, кроме того, что вы чувствуете себя несчастным. Оказывается, много. Аллергия и астма часто возникают вместе.
Те же вещества, которые вызывают симптомы сенной лихорадки (аллергического ринита), такие как пыльца, пылевые клещи и перхоть домашних животных, также могут вызывать признаки и симптомы астмы. У некоторых людей симптомы астмы могут вызывать кожная или пищевая аллергия. Это называется аллергической астмой или астмой, вызванной аллергией.
Джеймс Т.К. Ли, доктор медицинских наук, специалист по аллергии в клинике Мэйо, отвечает на вопросы о связи между аллергией и астмой.
Как аллергическая реакция вызывает симптомы астмы?
Аллергический ответ возникает, когда белки иммунной системы (антитела) ошибочно идентифицируют безвредное вещество, такое как пыльца деревьев, как захватчика.В попытке защитить свой организм от этого вещества антитела связываются с аллергеном.
Химические вещества, выделяемые вашей иммунной системой, вызывают признаки и симптомы аллергии, такие как заложенность носа, насморк, зуд в глазах или кожные реакции. У некоторых людей эта реакция также влияет на легкие и дыхательные пути, что приводит к симптомам астмы.
По-разному ли лечится аллергия и астма?
Большинство препаратов предназначены для лечения астмы или аллергического ринита.Но некоторые виды лечения помогают при обоих состояниях. Некоторые примеры:
- Модификатор лейкотриена. Этот тип лекарства может облегчить симптомы как аллергического ринита, так и астмы. Эта таблетка, называемая модификатором лейкотриена, помогает контролировать химические вещества иммунной системы, выделяемые во время аллергической реакции. Монтелукаст (Сингулаир) — это модификатор лейкотриенов, который может лечить как астму, так и аллергический ринит.
Уколы от аллергии (иммунотерапия). Уколы от аллергии могут помочь в лечении астмы, постепенно снижая реакцию иммунной системы на определенные триггеры аллергии.Иммунотерапия предполагает регулярные инъекции небольшого количества аллергенов, которые вызывают ваши симптомы.
Ваша иммунная система со временем вырабатывает толерантность к аллергенам, и ваши аллергические реакции уменьшаются. В свою очередь, уменьшаются и симптомы астмы. Это лечение обычно требует регулярных инъекций в течение определенного периода времени.
Анти-иммуноглобулин E (IgE) терапия. Когда у вас аллергия, ваша иммунная система ошибочно определяет конкретное вещество как нечто вредное и выделяет антитела, известные как IgE , против вызывающего аллерген.
В следующий раз, когда вы столкнетесь с этим аллергеном, антитела IgE улавливают его и сигнализируют вашей иммунной системе о выпуске химического вещества, называемого гистамином, а также других химических веществ в ваш кровоток. Лекарство омализумаб (Xolair) препятствует выработке IgE в организме и помогает предотвратить аллергическую реакцию, которая вызывает симптомы астмы. Это лечение используется при более тяжелой аллергической астме, но оно также может помочь при аллергическом рините.
Вам могут потребоваться другие лекарства для лечения аллергии или астмы, особенно если ваши симптомы временами становятся серьезными.Однако распознать и избегать веществ, вызывающих симптомы, — важный шаг, который вы можете предпринять.
Кто подвержен риску аллергической астмы?
Семейный анамнез аллергии — главный фактор риска аллергической астмы. Сенная лихорадка или другая аллергия также увеличивают риск заболевания астмой.
Всякая ли астма вызвана аллергией?
Хотя аллергическая астма очень распространена, существуют и другие типы астмы с различными типами триггеров.У некоторых людей астма может быть вызвана физическими упражнениями, инфекциями, холодным воздухом, гастроэзофагеальной рефлюксной болезнью или стрессом. Многие люди имеют более одного вида триггеров астмы.
Взять на себя ответственность: взять под контроль симптомы
Знайте, что вызывает у вас симптомы аллергии и астмы, и научитесь ограничивать их воздействие. Поработайте со своим врачом, чтобы найти лучшее лечение для лечения ваших симптомов, и регулярно проверяйте его.
Поскольку симптомы аллергии и астмы могут со временем меняться, вам может потребоваться соответствующая корректировка лечения.Изучите признаки того, что ваша астма может обостряться, и знайте, что делать, когда это произойдет.
14 мая 2021 г. Показать ссылки- Какое отношение имеет астма к вашей аллергии? Наверное, много. Американский колледж аллергии, астмы и иммунологии. https://acaai.org/news/what-does-asthma-have-do-your-allergies-probably-lot. По состоянию на 27 января 2021 г.
- Burks AW, et al. Аллергия Миддлтона: принципы и практика. 9 изд. Эльзевир; 2020. https://www.clinicalkey.com. По состоянию на 27 января 2021 г.
- Астма 101. Американский колледж аллергии, астмы и иммунологии. https://acaai.org/asthma/asthma-101. По состоянию на 27 января 2021 г.
- Венцель С. Лечение тяжелой формы астмы у подростков и взрослых. https://www.uptodate.com/contents/search. По состоянию на 27 января 2021 г.
- 2020 Целенаправленные обновления руководств по ведению астмы: отчет Рабочей группы экспертов Координационного комитета Национальной программы по обучению и профилактике астмы.Журнал аллергии и клинической иммунологии. 2020; DOI: 10.1016 / j.jaci.2020.10.003.
- Zuberi FF и др. Роль монтелукаста у больных астмой и аллергическим ринитом. Симптомы астмы. Пакистанский журнал медицинских наук. 2020; DOI: 10.12669 / pjms.36.7.2657.
- Li JTC (экспертное заключение). Клиника Майо. 8 февраля 2021 г.
Продукты и услуги
- Книга: Книга домашних средств защиты клиники Мэйо
.
Аллергическая астма: симптомы и лечение
Обновлено: октябрь 2020 г.
Июль 2015
Размещено: май 2006 г.,
Обновил:
Эшли А. Салливан, MSN FNP
Студент, Университет Сэмюэля Мерритта, Окленд, Калифорния
RN, Калифорнийский Тихоокеанский медицинский центр
Кушнир Наталья Михайловна, MD
Директор Клиники аллергии и иммунологии Ист-Бэй
Беркли, Калифорния,
Оригинальные авторы:
H.Генри Ли, доктор медицины, доктор философии
FAAAAI, FACAAI
Институт астмы и аллергии
Уитон и Чеви Чейз Мэриленд
Майкл А. Калинер, MD FAAAAI
Медицинский директор, Институт астмы и аллергии
Чеви Чейз и Уитон, Мэриленд,
Профессор медицины, Медицинский факультет Университета Джорджа Вашингтона
Вашингтон, округ Колумбия,
Определение и демографические данные
Астма — это действительно синдром, охватывающий несколько видов / эндотипов болезни.Слово астма происходит от греческого слова, означающего одышку или одышку, и, таким образом, описывает основной симптом этого заболевания. Астма считается сложным заболеванием с разной степенью тяжести, естественным течением, сопутствующими заболеваниями и ответом на лечение. Это было определено как «хроническое воспалительное заболевание, связанное с различной обструкцией дыхательных путей и гиперреактивностью бронхов. Оно проявляется повторяющимися эпизодами хрипов, кашля, одышки, стеснения в груди».
В то время как критическая роль воспаления была дополнительно подтверждена, есть доказательства значительной вариабельности в структуре воспаления, указывающие на фенотипические различия, которые могут влиять на реакцию на лечение.Взаимодействие генов с окружающей средой важно для развития и проявления астмы. Из факторов окружающей среды решающее значение имеют аллергические реакции и загрязнение, поскольку в этих процессах возрастает роль вирусных респираторных инфекций. У большинства пациентов астма начинается в раннем возрасте, при этом характер персистирования заболевания определяется ранними распознаваемыми факторами риска, включая атопическое заболевание, повторяющиеся хрипы и наличие астмы в анамнезе родителей. Текущее лечение астмы противовоспалительными средствами, по-видимому, не предотвращает прогрессирование тяжести основного заболевания.
Астма — наиболее распространенное хроническое респираторное заболевание, поражающее все возрастные группы во всем мире. Согласно последнему всестороннему анализу Глобального исследования бремени болезней (ГББ), проведенному в 2008–2010 годах, число людей, страдающих астмой, в мире достигает 334 миллионов человек. Более низкая цифра в 235 миллионов, использованная в Глобальном отчете по астме за 2011 год, была получена из самой последней доступной на тот момент информации ГББ, основанной на анализе за 2000–2002 годы. Распространенность детской астмы широко варьируется между странами и между центрами внутри стран и оценивается в 14%.Распространенность недавнего хрипа у подростков широко варьировала. Самая высокая распространенность (> 20%) обычно наблюдалась в Латинской Америке и в англоязычных странах Австралазии, Европы и Северной Америки, а также в Южной Африке. Самая низкая распространенность (<5%) наблюдалась на Индийском субконтиненте, Азиатско-Тихоокеанском регионе, Восточном Средиземноморье, а также в Северной и Восточной Европе. В Африке чаще всего наблюдалась распространенность 10-20%. В целом, 4,3% респондентов Всемирного исследования здравоохранения в возрасте 18–45 лет в 2002–2003 годах сообщили, что врач поставил диагноз астмы 4.5% сообщили либо о диагнозе врача, либо о том, что они лечились от астмы, а 8,6% сообщили, что у них были приступы хрипов или свистящего дыхания (симптомы астмы) в течение предшествующих 12 месяцев.
Установлено, что распространенность астмы среди взрослых американцев среднего и пожилого возраста выше среди женщин (9,7%) и выше среди бедных взрослых (10,6%). В старших возрастных группах труднее отличить астму от других респираторных заболеваний, таких как хроническая обструктивная болезнь легких (ХОБЛ).Гериатрическая астма может осложняться сопутствующими заболеваниями, потенциальной потерей обратимости обструкции дыхательных путей, а также нарушением восприятия одышки. Данные о клинических испытаниях гериатрической астмы остаются ограниченными, поскольку лекарства от астмы редко тестируются на пожилых людях. Из-за того, что астму обычно считают детской болезнью, пожилым людям часто не удается диагностировать и лечить.
Клиническая классификация
Становится все более очевидным, что синдром астмы подразделяется на отдельные заболевания со специфическими механизмами.Предпринята попытка новой классификации, где «эндотип» предлагается как подтип состояния, определяемого отдельным патофизиологическим механизмом. Предложены критерии определения эндотипов астмы на основе их фенотипов и предполагаемой патофизиологии.
В настоящее время астма классифицируется на атопический и неатопический типы в зависимости от появления симптомов. Атопический относится к раннему началу, тогда как неатопический относится к позднему началу. Несмотря на различие, между этими двумя типами существует значительная степень совпадения.Степень тяжести симптомов далее классифицируется в зависимости от степени тяжести по шкале GINA на легкую перемежающуюся, легкую персистирующую, умеренную стойкую и тяжелую стойкую астму. Кроме того, классификация степени тяжести астмы различна для разных возрастов.
Краткий справочник по лечению астмы
Признаки и симптомы астмы
Чтобы установить диагноз астмы, клиницист должен определить, что:
- Присутствуют эпизодические симптомы обструкции дыхательных путей или гиперчувствительности дыхательных путей.
- Препятствие воздушному потоку можно как минимум частично устранить.
- Альтернативные диагнозы исключены.
Рекомендуемые методы для установления диагноза:
- Подробный анамнез.
- Физический осмотр верхних дыхательных путей, груди и кожи.
- Спирометрия для выявления обструкции и оценки обратимости, в том числе у детей в возрасте 5 лет и старше. Обратимость определяется либо увеличением ОФВ1 на ≥12% от исходного уровня, либо увеличением ≥10% прогнозируемого ОФВ1 после ингаляции бронходилататора короткого действия.
Дополнительные исследования обычно не требуются, но могут быть полезны при рассмотрении альтернативных диагнозов:
- Могут быть показаны дополнительные исследования функции легких (например, измерение объемов легких и оценка инспираторных петель), особенно если есть вопросы о возможном сопутствующем ХОБЛ, рестриктивном дефекте, VCD или возможной обструкции центральных дыхательных путей. Тест диффузионной способности помогает различать астму и эмфизему у пациентов, таких как курильщики и пожилые пациенты, которые подвержены риску обоих заболеваний.
- Бронхопровокация с метахолином, гистамином, холодным воздухом или физической нагрузкой может быть полезна при подозрении на астму, и спирометрия в норме или близка к норме. Для безопасности
- причин, бронхопровокационное тестирование должно проводиться обученным специалистом в
- Соответствующее средство и обычно не рекомендуется, если ОФВ1 <65% от прогнозируемого. Положительный результат бронхопровокационного теста на метахолин является диагностическим признаком гиперчувствительности дыхательных путей, характерного признака астмы, который также может присутствовать при других состояниях (например,(например, аллергический ринит, муковисцидоз, ХОБЛ). Таким образом, хотя положительный тест соответствует астме, отрицательная бронхопровокация может быть более полезной для исключения астмы.
- Рентген грудной клетки может потребоваться для исключения других диагнозов.
- Тестирование на аллергию
- Биомаркеры воспаления. Полезность измерений биомаркеров воспаления (например, общего и дифференциального подсчета клеток и анализов медиатора) в мокроте, крови, моче и выдыхаемом воздухе в качестве вспомогательных средств для диагностики и оценки астмы
Важно учитывать диагноз астмы, если присутствуют определенные элементы истории болезни — они не являются диагностическими сами по себе, но увеличивают вероятность диагноза астмы:
- Свистящее дыхание — высокие свистящие звуки при выдохе, особенно у детей.(Отсутствие хрипов и нормальный осмотр грудной клетки не исключают астму.)
- История любого из следующего:
- Кашель, особенно усиливающийся ночью
- Хрип рецидивирующий
- Рецидивирующее затруднение дыхания
- Повторяющееся стеснение в груди
- Симптомы возникают или ухудшаются при наличии:
- Упражнение
- Вирусная инфекция
- Животные с мехом или шерстью
- Клещи домашней пыли (в матрасах, подушках, мягкой мебели, коврах)
- Форма
- Дым (табак, дерево)
- Пыльца
- Изменения погоды
- Сильное эмоциональное выражение (сильный смех или плач)
- Химические вещества или пыль в воздухе
- Менструальные циклы
- Симптомы возникают или усиливаются ночью, пробуждая пациента.
Спирометрия необходима для установления диагноза астмы.
При физическом осмотре следует сосредоточить внимание на верхних дыхательных путях, груди и коже. Некоторые результаты физикального обследования повышают вероятность астмы, хотя их отсутствие не исключает ее, поскольку болезнь по определению является переменной, и между приступами часто отсутствуют признаки обструкции дыхательных путей:
- Гиперрасширение грудной клетки, , особенно у детей; использование вспомогательных мышц; появление сутулых плеч; и деформация грудной клетки.
- Хрипы при нормальном дыхании или длительной фазе форсированного выдоха (типично для препятствия воздушному потоку). Свистящее дыхание можно услышать только во время форсированного выдоха, но это не является надежным индикатором ограничения воздушного потока.
- Повышенная секреция носа, отек слизистой оболочки и / или носовые полипы.
- Атопический дерматит / экзема или любое другое проявление аллергического состояния кожи.
Наличие сопутствующих заболеваний или состояний, которые могут влиять на астму, в том числе:
- Риносинусит,
- Гастроэзофагеальный рефлюкс или ларингофарингеальный рефлюкс и
- Бронхит или курение.
На ранней стадии заболевания симптомы могут включать нечеткое, тяжелое ощущение стеснения в груди, а у пациента с аллергией могут быть сопутствующие симптомы ринита и конъюнктивита. Типичные симптомы, которые испытывают пациенты, включают кашель, хрипы, стеснение в груди и одышку. Кашель при астме обычно непродуктивный, но он может прогрессировать до отхождения вязкой слизистой мокроты, которую трудно очистить. Если мокрота становится гнойной или обесцвечивается, это может означать наличие инфекции, поскольку при астме мокрота обычно прозрачная или светло-желтая.
Существует подгруппа астматиков, у которых астма характеризуется исключительно кашлем, без явных хрипов, «кашлевой вариант астмы». Мониторинг PEF или ингаляционной провокации метахолина, чтобы уточнить, есть ли гиперреактивность бронхов, совместимая с астмой, может быть полезным в диагностике. Диагноз кашлевого варианта астмы подтверждается положительным ответом на лечение астмы.
У полностью бессимптомного пациента результаты обследования грудной клетки будут нормальными, хотя обследование головы, глаз, ушей, носа и горла может выявить сопутствующий серозный средний отит, аллергический конъюнктивит, аллергический ринит, полипы носа, болезненность околоносовых пазух, признаки постназального капельная, или лимфоидная гиперплазия слизистой оболочки глотки.При неосложненной астме стук пальцев крайне редко встречается, и это открытие должно направить внимание врача на такие заболевания, как бронхоэктазы, муковисцидоз, новообразование легких или сердечные заболевания. Многие астматики с симптомами могут быть диагностированы путем тщательной аускультации грудной клетки, которая выявляет наличие хрипов на выдохе и несколько удлиненную фазу выдоха.
Обострения астмы — это острые или подострые эпизоды прогрессирующей одышки, кашля, хрипов и стеснения в груди или некоторая комбинация этих симптомов.Обострения характеризуются уменьшением потока воздуха на выдохе, которое может быть задокументировано и количественно определено простым измерением функции легких (спирометрия или PEF), может широко варьироваться у разных людей и у отдельных людей от редких до частых. Важно понимать, что тяжесть заболевания не обязательно коррелирует с интенсивностью обострений, которые могут варьироваться от легких до очень тяжелых и опасных для жизни.
У пациентов любой степени тяжести, даже с перемежающейся астмой, могут быть тяжелые обострения.Например, человек, страдающий перемежающейся астмой, может иметь тяжелое обострение во время вирусного заболевания или при воздействии аллергенов, к которым он или она чувствительны, или к ядовитым парам и раздражителям. Фактически, последняя классификация «легкой перемежающейся астмы» была изменена на «перемежающуюся астму», подчеркнув, что у пациентов любой степени тяжести, включая перемежающуюся, могут быть тяжелые обострения. Частота обострений, требующих лечения пероральными системными кортикостероидами, теперь изменилась на классификацию стойкой, а не перемежающейся астмы.Однако степень тяжести может определять продление болезни и часто характеризуется постоянными симптомами с плохой реакцией на терапию. Продолжительность обострения может варьироваться от нескольких часов до нескольких дней. Эти непредсказуемые вариации обострений могут представлять собой дилеммы лечения в клинической практике.
Оценка серьезности требует оценки следующих компонентов текущего обесценения:
- Симптомы
- Ночное пробуждение
- Необходимость в SABA для быстрого облегчения симптомов
- Пропущенные рабочие / учебные дни
- Способность заниматься обычной повседневной деятельностью или желаемой деятельностью
- Оценка качества жизни
- Функция легких, измеренная спирометрией: FEV1, FVC (или FEV6), FEV1 / FVC (или FEV6 у взрослых).Спирометрия является предпочтительным методом измерения функции легких для определения степени тяжести. Пиковая скорость потока не считается надежной переменной для классификации степени тяжести.
Оценка риска
Оценка риска будущих нежелательных явлений требует тщательного изучения истории болезни, наблюдения и заключения врача. Документирование предупреждающих знаков и нежелательных явлений будет необходимо, когда пациент окажется в группе повышенного риска. Пациенты, которые считаются подверженными повышенному риску неблагоприятных исходов, нуждаются в тщательном наблюдении и частой оценке со стороны их клиницистов.
Предикторы, которые, как сообщается, связаны с повышенным риском обострений или смерти, включают:
- Сильная обструкция воздушного потока, обнаруженная спирометрией
- Постоянная серьезная преграда для воздушного потока. Два или более визита в отделение неотложной помощи или госпитализации по поводу астмы за последний год; любая история интубации или госпитализации в ОИТ, особенно если за последние 5 лет
- Пациенты сообщают, что они чувствуют себя в опасности или напуганы астмой
- Определенные демографические характеристики или характеристики пациента: женщины, небелые, не использующие терапию ICS и курящие в настоящее время
- Психосоциальные факторы: депрессия, повышенный стресс, социально-экономические факторы
- Отношение и убеждения относительно приема лекарств
Астма у пожилых людей
Астма, поражающая людей на протяжении всей жизни.Текущие данные постоянно свидетельствуют о том, что астма распространена среди пожилых людей. Из-за увеличения продолжительности жизни во всем мире увеличивается доля людей в возрасте 65 лет и старше. К 2030 году пожилые люди будут составлять ~ 20% и ~ 36% населения США и Китая соответственно. Определение точной распространенности астмы у пожилых затруднено из-за недостаточного диагноза из-за пониженного восприятия или неполного сообщения о симптомах пациентами, неоптимального использования спирометрии, неправильной классификации астмы как хронической обструктивной болезни легких (ХОБЛ) и неспособности распознать астму. у субъектов с сопутствующими заболеваниями, такими как застойная сердечная недостаточность или ХОБЛ.По данным двух общенациональных опросов, проведенных в США, оценка распространенности текущей астмы среди пожилых людей за период 1980–2004 годов составила 5,9%. У пожилых людей астма чаще встречается у женщин, чем у мужчин. По сравнению с детьми или молодыми людьми, пожилые люди и / или пожилые люди имеют большую заболеваемость и затраты на здравоохранение из-за астмы, поэтому важно распознавать и лечить астму у пожилых людей.
Причины астмы
В раннем детстве преобладает фенотип аллергической астмы.Хотя астма имеет сильный генетический компонент, для ее проявления должны присутствовать факторы окружающей среды. Парадигма аллергической индукции астмы — воздействие аллергена → аллергическая сенсибилизация → развитие астмы. В то время как различные аллергические реакции в окружающей среде и в помещении были вовлечены в развитие и обострение детской астмы, среда в помещении оказывает наибольшее влияние на развитие астмы. Дети, сенсибилизированные к аэроаллергенам в молодом возрасте, вероятно, будут иметь стойкие симптомы астмы в позднем детстве и в зрелом возрасте, и у них будет более слабая функция легких, чем у детей без сенсибилизации.Клещ домашней пыли (HDM), домашние животные с шерстью, тараканы, грызуны и плесень, с региональными вариациями, составляют большую долю аэроаллергенов, связанных с сенсибилизацией и астмой. Во многих случаях экспозиция и чувствительность следуют за a. Доказательства, подтверждающие взаимосвязь «доза-реакция», особенно убедительны для пылевых клещей и кошек.
Тенденции устойчивого роста населения в сторону городских центров также совпадают с траекторией увеличения загрязнения воздуха. Загрязнение воздуха в помещении и окружающей среде было связано с множеством неблагоприятных сердечно-легочных последствий для здоровья, включая симптомы астмы, обострения и снижение функции легких.Наиболее изученными загрязнителями являются диоксид азота (NO2), озон (O3), летучие органические соединения (ЛОС) и твердые частицы (ТЧ), в состав которых входит сажа.
Недавние данные продемонстрировали повышенное воздействие загрязнения внутриутробно и в первый год жизни может влиять на развитие астмы у маленьких детей. Воздействие загрязненных помещений PM2,5 и ЛОС прямо коррелирует с воспалительными маркерами астмы у школьников с астмой и без нее, что указывает на потенциальную индукцию аллергического воспаления дыхательных путей при таком воздействии.
Табачный дым в окружающей среде (ETS) является независимым фактором, определяющим развитие астмы. Табачный дым содержит много летучих органических соединений и NO2, которые, вероятно, являются проводниками плохих респираторных заболеваний. Исследования in vivo также предполагают, что воздействие ETS связано с IL-13 и более высоким уровнем сывороточного IgE у детей с астмой по сравнению с детьми, не подвергавшимися воздействию астмы, и контрольной группой, что предполагает усиление иммунофенотипа Th3 с воздействием.
С начала 2000-х годов обратная связь между сельским хозяйством, особенно традиционным образом жизни в молочном животноводстве, и развитием астмы была продемонстрирована в раннем возрасте и, похоже, сохраняется и во взрослой жизни.У детей, живущих на фермах, также снизились показатели сенсибилизации и других атопических состояний. Фермерские исследования показали, что большое разнообразие микробных воздействий как в животных, так и в домашних условиях тесно и обратно связано с астмой, подразумевая, что ранняя и стойкая микробная среда влияет на развитие иммунной системы вдали от аллергической и астматической предрасположенности.
Кишечный микробиом, вероятно, влияет на иммунную систему аналогично тому, как это связано с воздействием на ферму.
Поскольку ограничение воздействия аллергенов и иммунотерапия от аллергии особенно полезны при лечении аллергических астматиков, тщательный поиск возможных аллергий показан почти всем астматикам, и конечно всем стойким астматикам.
Помимо астмы, вызванной аллергеном, астму могут также вызывать многие другие факторы и состояния, такие как физические упражнения, инфекции, воздействие профессиональных химических веществ, побочные эффекты лекарств, таких как бета-адреноблокаторы, бронхит и аллергический гранулематоз Черга-Стросса.Синусит, ГЭРБ, гипертиреоз, беременность и вирусные заболевания могут осложнять астму.
Патогенез и генетика
За последнее десятилетие исследования подтвердили важную роль воспаления при астме, но, к сожалению, конкретные процессы, связанные с передачей воспаления дыхательных путей к специфическим патофизиологическим последствиям дисфункции дыхательных путей и клиническим проявлениям астмы, еще предстоит полностью понять. Точно так же многое было изучено о факторах окружающей среды хозяина, которые определяют восприимчивость дыхательных путей к этим процессам, но трудно установить относительный вклад каждого из них и точное взаимодействие между ними, которое приводит к возникновению или сохранению заболевания.Концепции, лежащие в основе патогенеза астмы, значительно изменились за последние 25 лет и все еще проходят оценку, поскольку определены различные фенотипы этого заболевания, и более глубокое понимание связывает клинические особенности астмы с генетическими моделями.
Поскольку астма включает комплексную реакцию проводящих дыхательных путей легких на известные или неизвестные триггеры, это многоклеточное заболевание, включающее аномальные реакции многих различных типов клеток в легких.
Триггеры окружающей среды одновременно действуют на афферентные нервы дыхательных путей (которые высвобождают свои собственные пептидные медиаторы и стимулируют рефлекторное высвобождение бронхоконстриктора ацетилхолина) и эпителиальные клетки дыхательных путей, инициируя ответы в нескольких типах клеток, которые вносят вклад в метаплазию слизистой и бронхоконстрикцию гладких мышц дыхательных путей, которые характеризуют астма.
Эпителиальные клетки выделяют TSLP и IL-33, которые действуют на дендритные клетки дыхательных путей, и IL-25, который вместе с IL-33 действует на тучные клетки, базофилы и врожденные лимфоциты 2 типа.Эти секретируемые продукты стимулируют созревание дендритных клеток, что способствует образованию эффекторных Т-клеток и запускает высвобождение как прямых бронхоконстрикторов, так и цитокинов Th3 из клеток врожденного иммунитета, которые воздействуют на эпителий и гладкие мышцы дыхательных путей и дополнительно способствуют усилению воспаления дыхательных путей за счет последующего адаптивные Т-клеточные ответы.
Астма генетически неоднородна. Несколько общих аллелей связаны с риском заболевания в любом возрасте.Вовлеченные гены предполагают роль в передаче информации о повреждении эпителия адаптивной иммунной системе и активации воспаления дыхательных путей. Астма сильно передается в семье, и ее наследственность оценивается в 60%. Генетические исследования предлагают структурированные средства понимания причин астмы, а также определения целей, которые можно использовать для лечения синдрома. Недавние полногеномные исследования ассоциации начали проливать свет как на общие, так и на отдельные пути, которые способствуют развитию астмы и аллергических заболеваний.Связь с вариациями генов, кодирующих цитокины, происходящие из эпителиальных клеток, интерлейкин-33 (IL-33) и стромальный лимфопоэтин тимуса (TSLP), а также ген IL1RL1 , кодирующий рецептор IL-33, ST2, подчеркивают центральную роль врожденного пути иммунного ответа, которые способствуют активации и дифференцировке Т-хелперных 2 (Th3) клеток в патогенезе как астмы, так и аллергических заболеваний. Фактор атопии, или генетическая тенденция к развитию этого состояния, остается самым сильным предрасполагающим фактором для развития астмы.Эти и другие генетические открытия расширяют наше понимание общих и уникальных биологических путей, которые не регулируются в этих связанных состояниях, и в конечном итоге будут полезны при разработке новых методов лечения и профилактики.
Профилактика
Многофакторное заболевание требует нескольких подходов, чтобы свести к минимуму развитие или прогрессирование клинических симптомов.
- Контроль окружающей среды
Наиболее убедительные доказательства того, что воздействие окружающей среды в раннем возрасте влияет на развитие астмы, — от рандомизированных контролируемых вмешательств до конкретного воздействия на возбудителя болезни и демонстрации более низкой частоты развития астмы.Стратегии устранения аллергенов, направленные на кошек, собак, плесень, мышей и тараканов, демонстрируют существенное снижение уровней воздействия в домах. Вмешательства, направленные только на уменьшение HDM, оказались эффективными и, похоже, улучшили ранние результаты.
Недавние метаанализы показали, что комплексные программы по устранению аллергенов защищают от развития астмы с 20-50% снижением вероятности. Наибольший защитный эффект наблюдался у детей с последующим наблюдением более 5 лет, что указывает на истинное снижение риска для тех, кто предрасположен к развитию атопической астмы.
Лучшим профилактическим эффектом избегания аллергенов было исследование по первичной профилактике астмы у детей в Канаде в когорте детей из группы высокого риска. В этом исследовании вмешательство заключалось в предотвращении появления клещей домашней пыли, домашних животных и табачного дыма в окружающей среде, начиная с пренатального периода, и поощрения грудного вскармливания с отсроченным введением твердых веществ. Мероприятия HDM включали обертывание матрасов и пружинных матрасов родителей и младенцев, еженедельную стирку всех постельных принадлежностей горячей водой и нанесение бензилбензоата на ковры и обивку до рождения и в возрасте 4 и 8 месяцев.При обследовании в возрасте 7 лет у детей, которым проводилось вмешательство, было значительно реже врачи диагностировали астму, хрипы в течение последних 12 месяцев и хрипы, за исключением простуды. Другое когортное исследование новорожденных также выявило значительно меньшее количество симптомов астмы в возрасте 8 лет в группе вмешательства с высоким риском рождения, сфокусированной на HDM и избегании пищевых аллергенов в раннем возрасте, а также на значительном снижении атопии к 8-летнему периоду.
Крупные исследования, оценивающие повышенное воздействие комнатных грибов до развития симптомов астмы, показывают, что виды Penicillium, Aspergillus и Cladosporium представляют опасность для респираторного здоровья у восприимчивых популяций.Усиленное обострение текущих симптомов астмы у детей и взрослых было связано с повышенным уровнем видов Penicillium, Aspergillus, Cladosporium и Alternaria, хотя в дальнейшей работе следует учитывать роль разнообразия грибов и повышенное воздействие других видов грибов.
- Пробиотики и витамины
Ранние исследования влияния пробиотиков на развитие астмы за счет влияния на перинатальный микробиом неоднозначны. Недавнее исследование показало значительное снижение риска атопической сенсибилизации, связанного с пре- и послеродовым приемом пробиотиков, однако не оказало никакого влияния на астму или хрипы.
Витамины — важные составляющие нашего рациона, которые, как давно известно, влияют на иммунную систему. В последние годы особое внимание уделяется витаминам A и D, поскольку было показано, что эти витамины оказывают неожиданное и решающее влияние на иммунный ответ.
- Экспериментальные профилактические методы лечения
У недоношенных детей без бронхолегочной дисплазии паливизумаб, моноклональное антитело против RSV, снижает респираторную заболеваемость до 78%.Недавние исследования у недоношенных детей без БЛД предполагают, что профилактика в младенчестве может уменьшить повторяющиеся хрипы в первый год жизни на 10% и до 50% в трехлетнем возрасте. Хотя это обнадеживает, необходимы дальнейшие продольные исследования для оценки эффекта профилактики паливизумабом на снижение заболеваемости астмой в детстве.
Недавние данные свидетельствуют о том, что противоаллергенная иммунотерапия для перекрестного связывания рецептора FcέR1 может уменьшить симптомы вирусной астмы.Хотя изменения физической среды изучались, мало внимания уделялось подходу к изменению иммунной конституции людей из группы высокого риска. В этом отношении иммуномодуляторы, такие как омализумаб, могут представлять интерес в будущем.
Лечение
Лечение противовоспалительными препаратами может в значительной степени обратить вспять некоторые из этих процессов; однако для достижения успешного ответа на терапию часто требуются недели, а в некоторых ситуациях он может быть неполным.
Цели лечения астмы включают улучшение качества жизни людей, страдающих астмой, в дополнение к контролю над симптомами, снижению риска обострений и предотвращению смерти, связанной с астмой.
Недавнее крупное международное исследование продемонстрировало, что значительное снижение частоты тяжелых обострений и улучшение качества жизни были достигнуты за счет достижения установленного руководящими принципами контроля астмы и корректировки терапии для достижения этого. Поэтому важно изучить, как проявление болезни и контроль над ней влияют на качество жизни пациента.Были составлены специальные анкеты для клинической оценки, чтобы помочь практикующим врачам в оценке пациентов с астмой:
Качество жизни, связанное с астмой
- Мини-опросник качества жизни при астме (Juniper et al. 1999a)
- Анкета качества жизни при астме (Кац и др., 1999; Маркс и др., 1993)
- ITG Краткая форма астмы (Bayliss et al., 2000)
- Качество жизни детей при астме (Juniper et al. 1996)
Общее качество жизни
- SF-36 (Bousquet et al.1994)
- SF-12 (Уэр и др., 1996)
Акцент по сравнению с предыдущими практическими рекомендациями изменился на периодическую оценку контроля астмы . Для начала лечения следует классифицировать степень тяжести астмы, а начальное лечение должно соответствовать соответствующей категории тяжести. После того, как лечение установлено, основное внимание уделяется оценке контроля астмы, чтобы определить, были ли достигнуты цели терапии и будут ли уместны корректировки в терапии (повышение или понижение).
Краткий справочник по лечению астмы
Компоненты, которые считаются необходимыми для эффективного лечения астмы:
Меры оценки и мониторинга, полученные с помощью объективных тестов, физикального обследования, истории болезни и отчета пациента, для диагностики и оценки характеристик и тяжести астмы, а также для контроля за достижением и поддержанием контроля над астмой
- Партнерское образование в области лечения астмы
- Контроль факторов окружающей среды и сопутствующих заболеваний, влияющих на астму
Фармакологическая терапия
Цели терапии — достижение контроля над астмой за счет снижения нарушений и риска:
- Предотвратить хронические и неприятные симптомы (например,g., кашель или одышка днем, ночью или после нагрузки)
- Требуется нечастое использование (≤2 дней в неделю) ингаляционного SABA для быстрого облегчения симптомов
- Поддержание (почти) «нормальной» легочной функции
- Поддерживать нормальный уровень активности (включая упражнения и другую физическую активность, а также посещаемость на работе или в школе)
- Удовлетворение ожиданий пациентов и их семей от лечения астмы и их удовлетворение
- Предотвратить рецидивирующие обострения астмы и свести к минимуму необходимость посещений отделения неотложной помощи или госпитализации
- Предотвратить прогрессирующую потерю функции легких; для детей предотвращает замедление роста легких
- Обеспечить оптимальную фармакотерапию с минимальными побочными эффектами или без них
Детальные воспоминания пациентов о симптомах со временем уменьшаются; поэтому клиницист может выбрать для оценки 2-недельный, 3-недельный или 4-недельный период отзыва.Оценка симптомов для периодов более 4 недель должна отражать более глобальную оценку симптомов, например, выяснение того, улучшилась ли у пациента астма с момента последнего посещения, и выяснение, сталкивался ли пациент с какими-либо конкретными трудностями в течение определенных сезонов или событий.
Низкий ОФВ1 связан с повышенным риском тяжелых обострений астмы. Регулярный мониторинг легочной функции особенно важен для пациентов с астмой, которые не замечают своих симптомов до тех пор, пока обструкция дыхательных путей не станет серьезной.Нет доступного метода обнаружения «людей с плохим восприятием». В литературе сообщается, что пациенты с почти смертельным обострением астмы, а также пожилые пациенты чаще плохо воспринимают обструкцию дыхательных путей.
Краткий справочник по лечению астмы
Препараты длительного контроля
Кортикостероиды: Блокируют позднюю фазу реакции на аллерген, снижают гиперреактивность дыхательных путей и подавляют миграцию и активацию воспалительных клеток.Они являются наиболее сильнодействующими и эффективными противовоспалительными препаратами, доступными в настоящее время. ICS используются для длительного контроля астмы. Короткие курсы пероральных системных кортикостероидов часто используются для быстрого контроля над заболеванием при начале долгосрочной терапии; Пероральные системные кортикостероиды длительно используются при тяжелой персистирующей астме.
Кромолин натрия и недокромил: Стабилизируют тучные клетки и нарушают функцию хлоридных каналов. Они используются в качестве альтернативных, но не предпочтительных лекарств для лечения устойчивой астмы легкой степени.Их также можно использовать в качестве профилактического лечения перед физическими упражнениями или неизбежным воздействием известных аллергенов.
Иммуномодуляторы: Омализумаб (анти-IgE) представляет собой моноклональное антитело, которое предотвращает связывание IgE с высокоаффинными рецепторами на базофилах и тучных клетках. Омализумаб используется в качестве дополнительной терапии для пациентов старше 12 лет, страдающих аллергией и тяжелой персистирующей астмой. Клиницисты, применяющие омализумаб, должны быть готовы к выявлению и лечению анафилаксии, которая может возникнуть.
Модификаторы лейкотриенов: (Монтелукаст, пранлукаст, зафирлукаст и зилеутон). Нацеливаясь на одну группу медиаторов воспаления, либо блокируя рецептор лейкотриена, либо снижая активность ферментов, необходимых для синтеза лейкотриена. Доступны два LTRA: монтелукаст (для пациентов старше 1 года) и зафирлукаст (для пациентов в возрасте ≥7 лет). Ингибитор пути 5-липоксигеназы зилеутон доступен для пациентов старше 12 лет; Важное значение имеет мониторинг функции печени.LTRA являются альтернативной, но не предпочтительной терапией для лечения персистирующей астмы легкой степени (этап 2). LTRA также можно использовать в качестве дополнительной терапии с ICS, но для подростков старше 12 лет и взрослых. Зилеутон можно использовать в качестве альтернативной, но не предпочтительной дополнительной терапии у взрослых.
LABA: Салметерол и формотерол после приема однократной дозы имеют продолжительность бронходилатации не менее 12 часов. Из-за более медленного начала действия использование LABA для лечения острых симптомов или обострений в настоящее время не рекомендуется или является монотерапией для долгосрочного контроля астмы.
- LABA используются в сочетании с ICS для долгосрочного контроля и предотвращения симптомов при умеренной или тяжелой персистирующей астме (лечение ступени 3 или выше у детей ≥5 лет и взрослых)
- Из доступных дополнительных методов лечения LABA является предпочтительной терапией в сочетании с ICS у подростков ≥12 лет и взрослых
- Благоприятные эффекты LABA в комбинированной терапии для подавляющего большинства пациентов, которым для контроля астмы требуется больше терапии, чем только низкодозный ICS (т.д., требуют лечения ступени 3 или выше) следует сопоставить с повышенным риском тяжелых обострений, хотя и нечастых, связанных с ежедневным использованием LABA (см. обсуждение в тексте).
Для пациентов в возрасте ≥5 лет с умеренной персистирующей астмой или астмой, недостаточно контролируемой низкими дозами ICS, возможность увеличения дозы ICS должна иметь такой же вес, как возможность добавления LABA. Для пациентов в возрасте ≥5 лет с тяжелой персистирующей астмой или астмой, недостаточно контролируемой на этапе 3 лечения, комбинация LABA и ICS является предпочтительной терапией.
LABA можно использовать перед тренировкой, но продолжительность действия не превышает 5 часов при постоянном регулярном применении. Не рекомендуется частое и хроническое использование LABA для EIB, поскольку такое использование может скрыть плохо контролируемую стойкую астму.
Метилксантины : Теофиллин с замедленным высвобождением — это бронходилататор от слабой до умеренной, используемый в качестве альтернативной, а не предпочтительной дополнительной терапии с ИКС (уровень доказательности A). Теофиллин может оказывать легкое противовоспалительное действие.Важно контролировать концентрацию теофиллина в сыворотке крови.
Лекарства быстрого действия
Антихолинергические средства: Подавляют мускариновые холинергические рецепторы и снижают внутренний тонус блуждающего нерва дыхательных путей. Бромид ипратропия обеспечивает дополнительное преимущество SABA при обострениях астмы средней и тяжелой степени. Может использоваться в качестве альтернативного бронходилататора для пациентов, которые не переносят SABA (уровень доказательности D).
SABA: Альбутерол, левалбутерол и пирбутерол являются бронходилататорами, расслабляющими гладкие мышцы, суженные в результате воздействия окружающей среды.Терапия выбора для облегчения острых симптомов и профилактики БЭИ. SABA обеспечат быстрое облегчение симптомов, но не нацелены на основное воспаление, связанное с астмой.
Системные кортикостероиды: Хотя пероральные системные кортикостероиды не короткого действия, они используются при умеренных и тяжелых обострениях в качестве дополнения к SABA для ускорения выздоровления и предотвращения рецидивов обострений.
Краткий справочник по лечению астмы
Прочие виды лечения
Иммунотерапия аллергенами
Иммунотерапия с помощью инъекций аллергенов эффективна при аллергической астме, а также при аллергическом риноконъюнктивите и, как было показано, приводит к очень значительному улучшению симптомов, сокращению количества принимаемых спасательных препаратов и улучшению как аллерген-специфических, так и неспецифических бронхиальная гиперреактивность.Иммунотерапия особенно эффективна при сезонной астме, но менее эффективна при хронической астме. Бронхиальная астма является фактором риска системных реакций на иммунотерапию и не должна рассматриваться у плохо контролируемых астматиков. Лечение аллергии накладывается на другие методы лечения для долгосрочного контроля на всех уровнях астмы. Сопутствующее заболевание верхних дыхательных путей , например аллергический ринит, синусит, следует лечить, и необходимо контролировать общую дозу ингаляционных кортикостероидов.
Биологическое лечение: Омализумаб (моноклональные анти-IgE-антитела) можно рассматривать как дополнительную терапию на этапах 5 или 6 лечения пациентов с аллергией и тяжелой персистирующей астмой, которая неадекватно контролируется с помощью комбинации высоких доз ICS и LABA. Омализумаб эффективен для уменьшения обострений астмы и госпитализаций у пациентов с повышенным уровнем общего IgE. Он рекомендуется для пациентов с астмой средней и тяжелой степени тяжести в качестве дополнительной терапии к ингаляционным стероидам и во время постепенного снижения дозы стероидов, у пациентов с резистентной к стероидам астмой, а также у пациентов, которым необходимо уменьшить или отменить прием ингаляционных стероидов.
Бронхиальная термопластика (BT) — это новый метод лечения пациентов с тяжелой астмой. Используя радиочастотную тепловую энергию, он направлен на уменьшение массы гладких мышц дыхательных путей. Несколько клинических испытаний продемонстрировали улучшение качества жизни, связанного с астмой, и снижение количества обострений после лечения БТ. Кроме того, недавние данные продемонстрировали долгосрочную безопасность процедуры, а также устойчивое улучшение показателей обострений астмы, сокращение обращаемости за медицинской помощью и улучшение качества жизни.
За последние 10 лет были достигнуты значительные успехи в понимании генетики астмы, биологии дыхательных путей и передачи сигналов иммунных клеток. Эти достижения привели к разработке низкомолекулярных терапевтических средств и биологических агентов, которые могут улучшить лечение астмы в будущем. Несколько новых классов лекарств от астмы, включая β-агонисты сверхдлительного действия и модуляторы путей интерлейкина 4 (ИЛ-4), ИЛ-5, ИЛ-13 и ИЛ-17, оценивались в рандомизированных контролируемых исследованиях.Другие новые классы лекарств, включая диссоциированные кортикостероиды, антагонисты хемокинового рецептора 2 CXC, агонисты toll-подобного рецептора 9 и ингибиторы тирозинкиназы, находятся на более ранних этапах разработки.
Лечение других сопутствующих заболеваний
Всем пациентам также назначается симптоматическая терапия, которую можно использовать по мере необходимости. Цель всех этих пациентов — адаптировать лекарства и их дозы для контроля уровня заболевания, всегда пытаясь добиться оптимального контроля с помощью самой низкой эффективной дозы лекарств.По крайней мере, половина взрослых людей в США, страдающих астмой, страдает по крайней мере еще одним хроническим заболеванием. Наличие астмы и других хронических состояний связано с худшими исходами астмы. В нескольких исследованиях рассматривалась взаимосвязь между астмой и другими специфическими хроническими состояниями; Результаты этих исследований показали, что наличие депрессии, тревоги и / или панического расстройства связано с повышенным риском развития нового диагноза астмы и с худшими исходами астмы. Кроме того, результаты этих исследований показали, что наличие астмы связано с повышенным риском развития нового диагноза депрессии или тревоги и / или панического расстройства.
Текущие руководящие принципы NIH рекомендуют, чтобы всех пациентов, госпитализированных по поводу астмы, обследовал специалист по астме. Таким образом, пациенты могут улучшить качество жизни и снизить заболеваемость и смертность от астмы
Библиография
- Национальный институт сердца, легких и крови Национальная программа обучения и профилактики астмы Отчет 3 экспертной группы: Рекомендации по диагностике и лечению астмы, Полный отчет 2007
- Эндотипы астмы: новый подход к классификации заболеваний в рамках синдрома астмы.Lötvall J1, Akdis CA, Bacharier LB, Bjermer L, Casale TB, Custovic A, Lemanske RF Jr, Wardlaw AJ, Wenzel SE, Greenberger PA. J Allergy Clin Immunol. Февраль 2011 г .; 127 (2): 355-60. DOI: 10.1016 / j.jaci.2010.11.037
- Астма у пожилых людей: что мы знаем и что нам еще предстоит знать . Анаи Яньес, Санг-Хоэн Чо, Жоан Б. Сориано, Ланни Дж. Розенвассер, Густаво Дж. Родриго, Клаус Ф Рабе, Стивен Питерс, Акио Ниими, Деннис К. Ледфорд, Рохит Катиаль, Леонардо М. Фаббри, Хуан С. Селедон, Джорджио Вальтер Каноника, Пауль Бусс, Луи-Филипп Буле, Карлос Э. Баэна-Каньяни, Кутайба Хамид, Клаус Бахер, Руби Паванкар, Стивен Т. Холгейт.World Allergy Organ J. 2014; 7 (1): 8. Опубликовано в Интернете, 2014 г. 30 мая. Doi: 10.1186 / 1939-4551-7-8
Факторы окружающей среды в перинатальном и раннем детском возрасте, влияющие на иммунопатогенез аллергической астмы. Джонатан М. Гаффин, Watcharoot Kanchongkittiphon, Wanda Phipatanakul. Int Immunopharmacol. 2014 сентябрь; 22 (1): 21–30. Опубликовано в Интернете 19 июня 2014 г. doi: 10.1016 / j.intimp.2014.06.005 PMCID: PMC4119505 - Глобальная стратегия ведения и профилактики астмы: резюме GINA. Bateman ED, Hurd SS, Barnes PJ, Bousquet J, Drazen JM, FitzGerald M et al. Eur Respir J 31 (1): 143-78. 2008 DOI: 10.1183 / 0 36.00138707 PMID: 18166595
- Генетика астмы и аллергических заболеваний: перспектива 21 века
Кэрол Обер, Цунг-Чие Яо. Immunol Rev. Авторская рукопись; доступно в PMC 2012 1 июля. Опубликован в окончательной отредактированной форме как: Immunol Rev. 2011 июль; 242 (1): 1030. doi: 10.1111 / j.1600-065X.2011.01029.x PMCID: PMC3151648 - Международный консенсус по детской астме (ICON)
Н. Г. Пападопулос, Х. Аракава, К.-Х. Карлсен, А. Кустович, Дж. Герн, Р. Леманске, П. Ле Суеф, М. Макела, Дж. Робертс, Г. Вонг, Х. Зар, К. А. Акдис, Л. Б. Бахарьер, Э. Баральди, Х. П. ван Бевер, Дж. . de Blic, A. Boner, W. Burks, TB Casale, JA Castro-Rodriguez, YZ Chen, YM El-Gamal, ML Everard, T. Frischer, M. Geller, J. Gereda, DY Goh, TW Guilbert, G .Хедлин, П. У. Хейманн, С. Дж. Хонг, Э. М. Хоссни, Дж. Л. Хуанг, Д. Джексон, Дж. К. де Йонгсте, О. Калайчи, Н. Халед, С. Клинг, П. Куна, С. Лау, Д. К. Ледфорд, С. И. Ли, А. Х. Лю, RF Lockey, K. Lodrup-Carlsen, J. Lotvall, A. Morikawa, A. Nieto, H. Paramesh, R. Pawankar, P. Pohunek, J. Pongracic, D. Price, C. Robertson, N. Rosario, LJ Россенвассер, П.Д. Слай, Р. Штейн, С. Стик, С. Сефлер, Л. М. Тауссиг, Э. Валовирта, П. Вичьянонд, Д. Уоллес, Э. Вайнберг, Г. Веннергрен, Дж. Вильдхабер, Р.С. Зейгер. Аллергия. Авторская рукопись; доступно в PMC 2015 26 мая. В окончательной редакции опубликовано как: Allergy. 2012 август; 67 (8): 976–997. Опубликовано в Интернете 15 июня 2012 г. doi: 10.1111 / j.1398-9995.2012.02865.x PMCID: PMC4442800
Дополнительные ссылки:
Буттаро, Т.М., Полгар-Бейли, П., Сандберг-Кук, Дж. И Трибульски, Дж. (2017). Первичная помощь: совместная практика (5 th ed.) Сент-Луис, Миссури: Эльзевир.
https: // www.nhlbi.nih.gov/files/docs/guidelines/asthma_qrg.pdf
https://www.frontiersin.org/articles/10.3389/fimmu.2019.00821/full
https://www.ncbi.nlm.nih.gov/pmc/articles/PMC4818235/
Взаимодействие вирусов и аллергенов при обострении астмы
Ann Am Thorac Soc. 2015 ноя; 12 (Дополнение 2): S137 – S143.
Департамент педиатрии и Медицинский факультет Университета Висконсин-Мэдисон, Мэдисон, Висконсин
Автор, отвечающий за переписку. Переписка и запросы на перепечатку следует направлять Джеймсу Э.Герн, доктор медицины, K4 / 918 CSC, 600 Highland Avenue, Madison, WI 53792-9988. Электронная почта: ude.csiw.enicidem@nregПоступила в редакцию 16 марта 2015 г .; Принято 21 апреля 2015 г.
Авторское право © 2015 г. Американского торакального обществаAbstract
Аллергия и вирусные респираторные инфекции давно признаны двумя наиболее важными факторами риска обострений астмы. Эти наблюдения подняли вопросы относительно потенциального взаимодействия между этими двумя важными факторами риска.Например, снижает ли аллергия противовирусный ответ, способствуя тем самым обострениям астмы? С другой стороны, могут ли вирусные респираторные инфекции усиливать продолжающееся аллергическое воспаление в дыхательных путях? Ответы на эти вопросы могут иметь значение для профилактики и лечения обострений астмы. В этой статье рассматриваются клинические данные, связывающие вирусные инфекции и аллергию с обострениями астмы, рассматриваются возможные взаимодействия между этими двумя факторами риска и обсуждается возможное применение новых идей о взаимодействии вирусов и аллергенов для профилактики и лечения обострений астмы.
Ключевые слова: астма, риновирус, аллергия, интерферон
Обострения астмы составляют значительную часть заболеваемости и расходов, связанных с астмой. Обострения астмы остаются одной из наиболее частых причин госпитализации и влекут за собой дополнительные психологические и финансовые затраты, связанные с пропуском работы и учебы. В США в 2009 г. было 479 000 госпитализаций по поводу астмы, средняя продолжительность госпитализации составила 4,3 дня, а уровень смертности составил 0.77 на 100 000 населения (1). Общие расходы на лечение астмы оценивались в 20 миллиардов долларов в год, и значительная часть этих затрат приходится на обострения. Затраты на здравоохранение, связанные с обострениями астмы, были недавно подсчитаны для пациентов с умеренной и тяжелой астмой в большой базе данных здравоохранения США. Пациенты с обострениями астмы имели примерно вдвое больше общих затрат на здравоохранение (9 223 долларов США против 5 011 долларов США) и затрат, связанных с астмой (1740 долларов США против 847 долларов США), по сравнению с подобранными пациентами без обострений ( P <0.0001) (2). Эти данные показывают, что личные и социальные издержки обострений астмы огромны и служат стимулом для разработки более эффективных стратегий профилактики и улучшенного лечения.
Факторы риска обострений астмы
Большинство обострений у детей и не менее половины обострений у взрослых, страдающих астмой, связаны с вирусной респираторной инфекцией (ВРИ) (3–5). Однако исследования детей школьного возраста, которые сдали обычные образцы в месяцы с высокой распространенностью, показывают, что ВРИ почти повсеместны у детей, независимо от астмы (6, 7).Многие вирусные инфекции вызывают легкие симптомы или их отсутствие даже у детей, страдающих астмой. Таким образом, вирусные инфекции, по-видимому, способствуют большинству обострений астмы, но сами по себе обычно недостаточны, чтобы вызвать обострения астмы. Действительно, существуют факторы риска или воздействие окружающей среды, которые могут либо усилить тяжесть ВРИ, либо действовать синергетически с ВРИ, вызывая обструкцию дыхательных путей и острые симптомы нижних дыхательных путей.
Факторы риска обострения астмы включают факторы, связанные с человеком, окружающей средой и инфекционным агентом.К личным факторам риска относятся тяжесть астмы и степень контроля, приверженность медикаментозному лечению и аллергия. Воздействие окружающей среды, которое может действовать вместе с вирусной инфекцией, способствуя обострению, включает загрязняющие вещества, раздражители и, для аллергиков, аллергены (8, 9). Бактериальные инфекции также могут способствовать возникновению острых хрипов и обострений астмы (6, 10). Вероятно, что множественные факторы способствуют возникновению большинства обострений, и эти факторы риска являются аддитивными и / или синергическими.К факторам риска обострений чаще всего относятся аллергия и вирусная инфекция, которые являются предметом настоящего обзора.
Клинические исследования аллергии и обострений астмы, вызванных вирусами
Сочетание аллергической сенсибилизации и вирусных заболеваний значительно увеличивает риск обострения астмы и госпитализации. В серии исследований, проведенных в Университете Вирджинии, дети с эпизодами острого свистящего дыхания оценивались в отделениях неотложной помощи, включая отделения неотложной помощи (11, 12) и стационарное отделение больницы (4).В этих исследованиях аллергическая сенсибилизация и риновирусная (RV) инфекция были значимыми факторами риска хрипов (отношение шансов [OR], 3,2 и 4,4, соответственно). Дети, у которых была выявлена инфекция правого желудочка в сочетании либо с сенсибилизацией к обычным аэроаллергенам, либо с эозинофилией, имели самые высокие шансы на свистящее дыхание (OR, 17 и 25 соответственно) (11). Эти же отношения справедливы и для детей в Коста-Рике, у которых наибольший риск хрипов наблюдался среди детей, которые были высокочувствительны к клещу домашней пыли и дали положительный результат на RV (OR на хрипы, 31.5; 95% доверительный интервал 8,3–108; P <0,001) (13). Примечательно, что аллергическая сенсибилизация увеличивает риск одышки респираторными вирусами даже в дошкольном возрасте (14, 15). Вместе взятые, эти результаты показывают, что инфекции правого желудочка вносят вклад в большинство заболеваний свистящего дыхания в детстве и что аллергическая сенсибилизация или эозинофильное воспаление дыхательных путей дополнительно увеличивает риск заболеваний свистящего дыхания.
Другие исследования выявили взаимодействия между VRI, аллергией и воздействием аллергенов, вызывающими заболевания свистящего дыхания.В исследовании «случай-контроль» острых обострений по сравнению с пациентами со стабильной астмой и детьми, госпитализированными с диагнозом, не связанным с респираторными заболеваниями, вирусная инфекция, аллергия и воздействие соответствующего аллергена были независимо связаны с обострениями (8). Сочетание этих факторов риска привело к выраженному риску госпитализации (OR, 19,4; P <0,001). Подобные результаты были получены у взрослых с астмой (9).
Вирусные факторы
РВ наиболее тесно связаны с обострениями астмы у детей и взрослых.Грипп, коронавирусы, вирусы парагриппа и другие вирусы выявляются с меньшей частотой во время обострений. Связана ли эта тесная связь с определенным свойством ПЖ или просто отражает очень общую природу инфекций ПЖ, не совсем ясно.
RV Виды и вирулентность
RV включают три вида из рода Enterovirus . Виды A и B были впервые обнаружены в 1950-х годах, а первый вирус вида C был зарегистрирован в 2006 году после обнаружения с помощью молекулярных методов (16, 17).Дополнительные исследования с использованием подобных подходов с тех пор сообщили о более чем 50 новых типах C, а также о ряде дополнительных типов A и B (18–20). Долгая задержка в обнаружении типов C была связана с невозможностью культивировать эти вирусы, которые присутствовали так же долго, как и другие виды RV (21). Вирусы RV-C можно выращивать в органной культуре слизистой оболочки носовых пазух (22) и в первичных клетках, дифференцированных на границе раздела воздух-жидкость (23, 24). Кроме того, типы RV-C могут быть получены методами обратной генетики путем трансфекции клеток вирусной РНК, транскрибируемой с плазмид (22, 25).Моделирование структуры капсида RV предполагает, что платформа связывания рецепторов для RV-C отличается от платформы для связывания RV-A и RV-B (26), и на самом деле типы RV-C используют уникальный (и пока не идентифицированный) рецептор для войти в ячейки (22). На сегодняшний день не существует клеточных линий (кроме клеток поверхности раздела воздух-жидкость), которые поддерживают инфекцию RV-C (ссылки 23 и 24 и наши неопубликованные данные).
Заметное генетическое разнообразие типов RV предполагает, что тип или виды RV могут влиять на вирулентность. В исследованиях «случай-контроль» RV-C и в некоторых исследованиях RV-A чрезмерно представлены у детей с инфекциями нижних дыхательных путей по сравнению с детьми с инфекциями верхних дыхательных путей или без симптомов (21, 27–34).Точно так же RV-B в семь-восемь раз реже вызывает респираторное заболевание средней и тяжелой степени, чем другие виды RV у младенцев (35). Наконец, у маленьких детей, которые хрипят из-за инфекции RV-C, более вероятно развитие рецидивов хрипов, чем у детей, которые хрипят из-за других вирусов (28).
Почему вирусы RV-C и RV-A с большей вероятностью вызывают обострения астмы, чем RV-B, неясно и может быть связано с рядом генетических, структурных и функциональных различий между видами RV.Например, большинство RV лучше всего растут при температуре от 33 до 35 ° C, и это свойство может ограничивать их распространение в небольшие дыхательные пути в легких. Напротив, типы RV-C одинаково хорошо растут при 33, 35 и 37 ° C (23). Рост при более высоких температурах может способствовать ассоциации между инфекцией RV-C и заболеванием нижних дыхательных путей. Кроме того, существуют различия между типами и видами RV, связанными с функцией вирусных протеаз, которые важны для управления репликацией вируса и ингибирования ключевых метаболических процессов в клетках-хозяевах (36).Кроме того, исследований in vitro продемонстрировали, что RV-B реплицируется медленнее и связан со снижением цитопатических эффектов и индукцией секреции цитокинов, чем RV-A и RV-C (37).
В совокупности эти данные предполагают, что более низкие скорости репликации RV-B и индукции цитокинов могут способствовать снижению вирулентности. Биохимия протеазы 2А, связанная с биологическими видами, соответствует снижению репликации и воспалительной реакции. Наконец, относительная нечувствительность RV-C к температуре может дать этому вирусу преимущество в возникновении инфекций нижних дыхательных путей.
Как инфекции правого желудочка вызывают обострение астмы?
VRI могут вызывать респираторные заболевания, повреждая эпителиальные клетки и другие структурные клетки и вызывая воспалительные реакции, которые вторично вызывают дисфункцию дыхательных путей и вызывают симптомы болезни. Поскольку инфекции правого желудочка обычно поражают небольшой процент эпителиальных клеток дыхательных путей (38, 39), а лизис клеток, как правило, не является обширным, вполне вероятно, что воспалительный ответ является основным фактором, вызывающим простуду и обострение астмы, вызванной ПЖ.Несмотря на то, что лизис клеток ограничен, ПЖ может нарушать барьерную функцию эпителиальных клеток, что приводит к повышенной проницаемости для макромолекул и способствует вторичной инфекции бактериями дыхательных путей (40).
В ряде исследований были выявлены воспалительные процессы, вызванные RV, которые, вероятно, способствуют дисфункции и появлению симптомов дыхательных путей. RV индуцирует цитокины острой фазы (например, IL-1β и интерфероны I типа) и медиаторы (простагландины, кинины), которые могут вызывать недомогание и миалгию (41, 42). RV активирует нервные пути, которые способствуют чиханию и кашлю, посредством механизмов, которые могут включать клеточное воспаление и высвобождение цитокинов и медиаторов.Инфекция RV заставляет эпителиальные клетки секретировать хемокины, которые способствуют привлечению воспалительных клеток (43, 44). Секреция эпителиальных хемокинов усиливается интерферонами, происходящими из мононуклеарных клеток (45). Во время ранней фазы простуды сывороточные жидкости и белки просачиваются в дыхательные пути (46), и, в свою очередь, липопротеины низкой плотности могут стимулировать секрецию хемокинов эпителиальными клетками (47). На последних стадиях инфекции секреция слизи увеличивается (46).
Долгое время считалось, что инфекции правого желудочка ограничиваются верхними дыхательными путями, но теперь есть убедительные доказательства того, что ПЖ может также инфицировать нижние дыхательные пути.Например, RV может быть единственным патогеном, обнаруживаемым в секретах нижних дыхательных путей у детей с пневмонией (48). После экспериментальной инокуляции серонегативных добровольцев ПЖ обнаруживается в секретах нижних дыхательных путей примерно у половины участников исследования, независимо от наличия астмы (39, 49). Пики выделения вируса из верхних дыхательных путей достигаются через 2–4 дня после инокуляции, а у субъектов с инфекциями нижних дыхательных путей выделение вируса из нижних дыхательных путей обычно отстает на несколько дней (49, 51). В образцах биопсии инфицированные RV клетки могут быть обнаружены в крупных нижних дыхательных путях в виде пятен, напоминающих паттерны в верхних дыхательных путях (39).Наконец, ПЖ был обнаружен в секретах нижних дыхательных путей у детей с трахеостомией (51). Как только ПЖ поражает нижние дыхательные пути, последствия инфекции, вероятно, будут аналогичны последствиям, вызванным инфекцией верхних дыхательных путей, и включают усиление секреции дыхательных путей, отек слизистой оболочки и клеточные воспалительные реакции. В совокупности эти эффекты, вероятно, способствуют обструкции дыхательных путей.
Механизмы взаимодействия вирусов и аллергии
Уменьшает ли аллергия противовирусный ответ?
Тесная связь между аллергическим заболеванием дыхательных путей и обострениями астмы, вызванными вирусами, позволяет предположить, что респираторные аллергии каким-то образом подавляют противовирусные реакции.Интерфероны являются одним из краеугольных камней врожденной противовирусной защиты от респираторных вирусов (52, 53). Из множества источников получены данные о том, что индуцированные вирусом интерфероновые ответы мононуклеарных клеток периферической крови (54, 55), мононуклеарных клеток дыхательных путей (57) и плазмоцитоидных дендритных клеток (pDC) (57) снижаются при астме. Кроме того, некоторые исследования показывают, что астма связана со снижением индуцированной вирусом продукции IFN-β и IFN-λ эпителиальными клетками (58, 59). Недостаточный ответ эпителиального интерферона может быть свойством более тяжелой астмы (60), потому что ответы на интерферон у субъектов с легкой формой астмы кажутся нормальными (49, 61).Также имеются данные о том, что недостаточный противовирусный ответ при астме может ограничиваться легкими (55), что позволяет предположить, что воспаление 2 типа может ингибировать индуцированные вирусом ответы на интерферон. Соответственно, некоторые исследования эпителиальных клеток дыхательных путей ex vivo , исключенных из потенциальных иммуномодулирующих эффектов других клеток дыхательных путей (например, клеток ILC2 и Th3), продемонстрировали нормальный вирус-индуцированный ответ интерферона (62–65). В любом случае вполне вероятно, что ранний вирус-индуцированный интерфероновый ответ является важным фактором, определяющим последующее течение инфекции и болезни.Между прочим, кинетика индуцированного вирусом ответа интерферона, вероятно, будет иметь значение. Слишком мало интерферона на ранних этапах инфекции может привести к неограниченной репликации вируса, тогда как чрезмерная секреция интерферона во время пика болезни (в ответ на репликацию вируса высокого уровня) может усугубить бремя симптомов (66–68). Недавно были описаны два возможных механизма ингибирования противовирусного ответа аллергического воспаления, которые рассматриваются в следующих разделах.
Высокоаффинные рецепторы IgE и ответы на интерферон
Аллергическое воспаление может подавлять врожденный противовирусный иммунитет при некоторых условиях (69). Например, плазматические дендритные клетки секретируют высокие уровни интерферонов типа I и III и являются важными клетками в противовирусном ответе в легких (70) (). Интересно, что эти клетки экспрессируют высокоаффинный рецептор IgE (FcεRI), который может регулировать противовирусные ответы. Экспрессия FcεRI на поверхности клетки обратно пропорциональна вирусной индукции интерферона (57).Кроме того, перекрестное связывание FcεRI заметно ухудшает ответы интерферона типа I и типа III на вирус гриппа или RV (57, 71). Эти данные свидетельствуют о том, что IgE-опосредованное аллергическое воспаление может ингибировать противовирусные реакции в КПК, патрулирующих эпителий дыхательных путей. В свою очередь, секреция интерферона pDC во время вирусных инфекций может подавлять ответы Th3 (72) и, таким образом, выполняет как противовирусную, так и иммуномодулирующую функции.
Высокоаффинные рецепторы IgE (FcεRI) на плазматических дендритных клетках и влияние на интерфероновые ответы.В отсутствие аллергии плазмацитоидные дендритные клетки (pDC) экспрессируют низкие уровни FcεRI на клеточной поверхности, и некоторые из этих рецепторов заняты IgE. Инфекция риновирусом (RV) побуждает pDC секретировать IFN-α и IFN-λ, которые ингибируют репликацию вируса аутологичным и паракринным образом. В контексте аллергии с воздействием аллергена FcεRI и IgE увеличиваются, и перекрестное связывание рецепторов аллергеном может ингибировать секрецию интерферона. Конечным результатом астмы может быть усиление репликации вирусов, более тяжелое заболевание и повышенный риск обострения хронической астмы.Рисунок любезно предоставлен Уильямом В. Буссом, доктором медицины, Университет Висконсин-Мэдисон.
Клеточная сигнализация, аллергия и противовирусные ответы
Внутриклеточные сигнальные механизмы также могут способствовать индуцированному аллергией подавлению противовирусных ответов. Супрессор передачи сигналов цитокинов (SOCS) 1 экспрессируется эпителиальными клетками дыхательных путей и может подавлять интерферон и другие цитокины. SOCS1 повышается в ядрах эпителиальных клеток дыхательных путей при астме, и этот эффект может способствовать снижению индуцированных вирусом ответов интерферона (73).Кроме того, в эпителиальных клетках аллергическое воспаление и инфекция RV могут вызывать метаплазию слизи посредством механизмов, которые включают индукцию факторов транскрипции, белка A3 (FOXA3) и заостренного домена SAM, содержащего фактор транскрипции ETS (SPDEF) (74). Экспрессия FOXA3 в эпителиальных клетках может также ингибировать интерфероны I типа и другие противовирусные реакции и усиливать экспрессию проаллергических факторов, таких как стромальный лимфопоэтин тимуса (75). Во время острых вирусных инфекций функция FOXA3 может заключаться в ограничении воспалительных реакций по мере разрешения инфекции, но хроническая экспрессия в контексте аллергического воспаления может вместо этого подавлять противовирусные реакции, потенциально приводя к более тяжелому заболеванию (75).
Усиливают ли инфекции желудочно-кишечного тракта продолжающееся аллергическое воспаление дыхательных путей?
В продольном исследовании совместно проживающих пар, которые не были согласны по поводу астмы, астма была связана с аналогичными индуцированными RV симптомами верхних дыхательных путей, но более серьезными симптомами нижних дыхательных путей (76). Это открытие предполагает, что различия в окружающей среде нижних дыхательных путей могут быть причиной повышенной тяжести заболевания при астме. Некоторые особенности нижних дыхательных путей могут способствовать увеличению тяжести заболеваний правого желудочка.Структурные и физиологические изменения, связанные с аллергическим воспалением дыхательных путей, включают гиперплазию бокаловидных клеток, гиперемию, гиперчувствительность дыхательных путей и сужение дыхательных путей (77, 78). Соответственно, стимуляция секреции слизи при ПЖ может быть хуже в дыхательных путях с большим количеством секретирующих слизь клеток, гиперемия, связанная с астмой, может усиливать вызванный вирусом отек и транссудат, а бронхоспазм может усиливаться в гиперреактивных дыхательных путях. Эти эффекты вместе могут способствовать сужению и закрытию дыхательных путей, что приводит к уменьшению воздушного потока и увеличению риска обострения.
Эпителий имеет ряд врожденных механизмов противовирусной защиты, а интактный, хорошо дифференцированный эпителий относительно устойчив к инфекции RV (79). Аллергическое воспаление дыхательных путей при астме может нарушать функцию эпителиального барьера, и исследований in vitro показывают, что репликация правого желудочка усиливается, когда апикальные клетки хорошо дифференцированных культур эпителиальных клеток либо повреждаются, либо удаляются (80). Таким образом, снижение барьерной функции при астме может привести к более тяжелым инфекциям правого желудочка.
Значение для профилактики и лечения
Стандартные схемы лечения астмы не полностью контролируют обострения, поэтому необходимы новые подходы. В большинстве случаев обострения носят многофакторный характер, и сочетание вирусной инфекции и аллергии является двумя наиболее частыми причинами. Это наблюдение предполагает, что борьба с аллергическим воспалением и усиление противовирусных реакций могут быть эффективными подходами к снижению частоты и тяжести обострений астмы.
Омализумаб связывается с Fc-частью IgE, чтобы предотвратить связывание с клеточной поверхностью и блокировать активацию клеток через высокоаффинный рецептор IgE FcεRI. В рандомизированном плацебо-контролируемом исследовании лечения астмы на основе рекомендаций по сравнению с омализумабом, добавленным к стандартной терапии, омализумаб предотвращал сезонные пики обострений осенью и весной (81). Назальные выделения, полученные во время обострений, были проанализированы на наличие вирусов, и эти данные подтвердили, что в группе лечения было меньше вирусных, а также невирусных обострений.Результаты этого интервенционного исследования показывают, что IgE-опосредованное воспаление способствует вирус-индуцированным обострениям астмы. Полученные данные также повышают вероятность того, что другие препараты, нацеленные на воспаление 2 типа (например, меполизумаб и ИЛ-5 [82]), также могут подавлять вирус-индуцированные обострения.
Другой новый подход заключался в использовании ингаляционного IFN-β для усиления противовирусного ответа в слизистой оболочке дыхательных путей. Добровольцы со стойкой астмой и в анамнезе обострения простуды были рандомизированы для лечения либо распыленным IFN-β, либо плацебо в течение 24 часов после появления симптомов простуды (83).Лечение IFN-β не уменьшало количество симптомов астмы (первичный результат) в популяции, собирающейся лечиться; однако были отмечены три положительных результата. Во-первых, IFN-β хорошо переносился и индуцировал маркеры противовирусной защиты в крови и мокроте. Во-вторых, лечение IFN-β приводило к увеличению пикового выдоха по сравнению с плацебо. Наконец, у испытуемых с более тяжелой астмой (этапы 4 и 5 Британского торакального общества) IFN-β снижал вероятность того, что простуда приведет к обострениям. Если эти данные подтвердятся, ингаляционный IFN-β может быть полезен для предотвращения обострений астмы, вызванных простудными заболеваниями, у пациентов с более тяжелой астмой.
Выводы
Клинические исследования определили аллергию и вирусные инфекции как основные факторы риска обострения астмы. Эти результаты привели к новым подходам к профилактике обострений, основанным на блокировании аллергических механизмов, и удвоили усилия по усилению противовирусной защиты в дыхательных путях. Понимание того, как аллергия и другие факторы риска способствуют обострениям астмы, вызванным вирусами, остается важной целью. Достижения в этой области могут дать дополнительную информацию о патогенезе обострений астмы и последовательно привести к более совершенным подходам к профилактике или лечению обострений астмы.
Ссылки
1. Национальные институты здоровья / Национальный институт сердца, легких и крови. Bethesda, MD: 2012. Сборник диаграмм 2012 года по сердечно-сосудистым, легочным и кровяным заболеваниям. [Google Scholar] 2. Иванова Ю.И., Бергман Р., Бирнбаум Х.Г., Колис Г.Л., Сильверман Р.А., Маклаурин К. Влияние обострений астмы на расходы на здравоохранение среди астматических пациентов с умеренной и тяжелой персистирующей астмой. J Allergy Clin Immunol . 2012; 129: 1229–1235. [PubMed] [Google Scholar] 3. Джонстон С.Л., Паттемор П.К., Сандерсон Г., Смит С., Лампе Ф., Джозефс Л., Симингтон П., О’Тул С., Мьинт С.Х., Тиррелл Д.А. и др.Общественное исследование роли вирусных инфекций в обострениях астмы у детей 9-11 лет. BMJ . 1995; 310: 1225–1229. [Бесплатная статья PMC] [PubMed] [Google Scholar] 4. Heymann PW, Carper HT, Murphy DD, Platts-Mills TA, Patrie J, McLaughlin AP, Erwin EA, Shaker MS, Hellems M, Peerzada J, et al. Вирусные инфекции в зависимости от возраста, атопии и сезона госпитализации среди детей, госпитализированных по поводу хрипов. J Allergy Clin Immunol . 2004. 114: 239–247. [Бесплатная статья PMC] [PubMed] [Google Scholar] 6.Kloepfer KM, Lee WM, Pappas TE, Kang TJ, Vrtis RF, Evans MD, Gangnon RE, Бочков Ю.А., Джексон DJ, Lemanske RF, Jr, Gern JE. Обнаружение патогенных бактерий при риновирусной инфекции связано с усилением респираторных симптомов и обострениями астмы. J Allergy Clin Immunol . 2014; 133: 1301–1307.e1–3. [Бесплатная статья PMC] [PubMed] [Google Scholar] 7. Оленек Дж. П., Ким В. К., Ли В. М., Ван Ф., Папас Т. Е., Салазар Л. Е., Эванс М. Д., Борк Дж., Роберг К., Леманске Р. Ф. младший и др. Еженедельное наблюдение за детьми, страдающими астмой, на предмет инфекций и болезней в сезон простуд. J Allergy Clin Immunol . 2010; 125: 1001–1006, e1. [Бесплатная статья PMC] [PubMed] [Google Scholar] 8. Мюррей С.С., Полетти Г., Кебадзе Т., Моррис Дж., Вудкок А., Джонстон С.Л., Кустович А. Изучение изменяемых факторов риска обострений астмы: вирусная инфекция и воздействие аллергенов увеличивают риск госпитализации астмы у детей. Грудь . 2006. 61: 376–382. [Бесплатная статья PMC] [PubMed] [Google Scholar] 9. Грин Р.М., Кустович А., Сандерсон Дж., Хантер Дж., Джонстон С.Л., Вудкок А.Синергизм между аллергенами и вирусами и риск госпитализации с астмой: исследование случай-контроль. BMJ . 2002; 324: 763–766A. [Бесплатная статья PMC] [PubMed] [Google Scholar] 10. Бисгаард Х., Хермансен М.Н., Бённеликке К., Стокгольм Дж., Баты Ф., Скайтт Н.Л., Анищенко Дж., Кебадзе Т., Джонстон С.Л. Связь бактерий и вирусов с эпизодами свистящего дыхания у детей раннего возраста: проспективное когортное исследование при рождении. BMJ . 2010; 341: c4978. [Бесплатная статья PMC] [PubMed] [Google Scholar] 11. Грабли Г. П., Арруда Э., Инграм Дж. М., Гувер Г. Е., Замбрано Дж. К., Хайден Ф. Г., Платтс-Миллс Т. А., Хейманн П. В..Риновирус и респираторно-синцитиальный вирус у детей с затрудненным дыханием, требующих неотложной помощи: анализ IgE и эозинофилов. Am J Respir Crit Care Med . 1999; 159: 785–790. [PubMed] [Google Scholar] 12. Дафф А.Л., Померанц Э.С., Гелбер Л.Е., Прайс ГВ, Фаррис Х., Хайден Ф.Г., Platts-Mills TAE, Heymann PW. Факторы риска острого свистящего дыхания у младенцев и детей: вирусы, пассивный дым и антитела IgE к ингаляционным аллергенам. Педиатрия . 1993. 92: 535–540. [PubMed] [Google Scholar] 13. Сото-Кирос М., Авила Л., Платтс-Миллс Т.А., Хант Дж.Ф., Эрдман Д.Д., Карпер Х., Мерфи Д.Д., Одио С., Джеймс Х.Р., Патри Дж. Т. и др.Высокие титры антител IgE к аллергену пылевого клеща и риск хрипов у детей-астматиков, инфицированных риновирусом. J Allergy Clin Immunol . 2012; 129: 1499–1505.e5. [Бесплатная статья PMC] [PubMed] [Google Scholar] 14. Джартти Т., Куусипало Х., Вуоринен Т., Седерлунд-Венермо М., Алландер Т., Варис М., Хартиала Дж., Руусканен О. Аллергическая сенсибилизация связана с риновирусами, но не с другими вирусами, вызванными хрипами у детей. Pediatr Allergy Immunol . 2010; 21: 1008–1014.[Бесплатная статья PMC] [PubMed] [Google Scholar] 15. Джексон Д. Д., Эванс М. Д., Гангнон Р. Э., Тислер С. Дж., Папас Т. Е., Ли В. М., Герн Дж. Э., Леманске Р. Ф., младший. Доказательства причинной связи между аллергической сенсибилизацией и риновирусным хрипом в раннем возрасте. Am J Respir Crit Care Med . 2012; 185: 281–285. [Бесплатная статья PMC] [PubMed] [Google Scholar] 16. МакЭрлин П., Шакелтон Л.А., Ламберт С.Б., Ниссен, доктор медицины, Слоутс Т.П., Маккей И.М. Характеристика недавно идентифицированного риновируса человека, HRV-QPM, обнаруженного у младенцев с бронхиолитом. Дж. Клин Вирол . 2007; 39: 67–75. [Бесплатная статья PMC] [PubMed] [Google Scholar] 17. Арден К.Э., МакЭрлин П., Ниссен, доктор медицины, Слоутс Т.П., Маккей И.М. Частое обнаружение риновирусов, парамиксовирусов, коронавирусов и бокавирусов человека при острых инфекциях дыхательных путей. J Med Virol . 2006; 78: 1232–1240. [Бесплатная статья PMC] [PubMed] [Google Scholar] 18. Ламсон Д., Ренвик Н., Капур В., Лю З., Паласиос Дж., Джу Дж., Дин А., Сент-Джордж К., Бриз Т., Липкин В. Обнаружение респираторных патогенов с помощью полимеразной цепной реакции MassTag, включая новый генотип риновируса, которые вызвали гриппоподобное заболевание в штате Нью-Йорк в 2004–2005 годах. J Заразить Dis . 2006; 194: 1398–1402. [Бесплатная статья PMC] [PubMed] [Google Scholar] 19. Кистлер А., Авила П.С., Рускин С., Ван Д., Вард Т., Яги С., Шнурр Д., Ганем Д., ДеРизи Д. Л., Боуши Н. А.. Пановирусный скрининг инфекций дыхательных путей у взрослых с астмой и без нее выявляет неожиданное разнообразие коронавирусов человека и риновирусов человека. J Заразить Dis . 2007; 196: 817–825. [Бесплатная статья PMC] [PubMed] [Google Scholar] 20. Ли В.М., Киснер К., Паппас Т., Ли И., Гриндл К., Джартти Т., Джакиела Б., Леманске Р.Ф., мл., Шулт П.А., Герн Дж. Э.Разнообразная группа ранее нераспознанных риновирусов человека является частой причиной респираторных заболеваний у младенцев. PLoS One . 2007; 2: e966. [Бесплатная статья PMC] [PubMed] [Google Scholar] 21. Линдер Дж. Э., Крафт, округ Колумбия, Мохамед Ю., Лу З., Хейл Л., Толлефсон С., Сэвилл Б. Р., Райт П. Ф., Уильямс СП, Миллер Е. К.. Человеческий риновирус C: возраст, время года и заболевания нижних дыхательных путей за последние 3 десятилетия. J Allergy Clin Immunol . 2013; 131: 69–77.e1–6. [Бесплатная статья PMC] [PubMed] [Google Scholar] 22.Бочков Ю.А., Пальменберг А.С., Ли В.М., Рат Дж.А., Аминева С.П., Сан X, Пасич Т.Р., Джарджур Н.Н., Лиггетт С.Б., Герн Дж. Э. Молекулярное моделирование, культивирование органов и обратная генетика для недавно идентифицированного риновируса человека C. Nat Med . 2011; 17: 627–632. [Бесплатная статья PMC] [PubMed] [Google Scholar] 23. Ашраф С., Брокман-Шнайдер Р., Бочков Ю.А., Пашич Т.Р., Герн Дж. Э. Биологические характеристики и распространение человеческого риновируса-C в дифференцированных эпителиальных клетках синуса. Вирусология . 2013; 436: 143–149.[Бесплатная статья PMC] [PubMed] [Google Scholar] 24. Хао В., Бернард К., Патель Н., Ульбрандт Н., Фенг Х., Свабек С., Уилсон С., Стрейснер С., Ван К., Сузич Дж. И др. Инфекция и распространение человеческого риновируса С в эпителиальных клетках дыхательных путей человека. Дж Вирол . 2012; 86: 13524–13532. [Бесплатная статья PMC] [PubMed] [Google Scholar] 25. Григгс Т.Ф., Бочков Ю.А., Накагоме К., Пальменберг А.С., Герн Дж. Э. Производство, очистка и стабильность капсида риновирусов типа С. Дж. Вирольные методы . 2015; 217: 18–23.[Бесплатная статья PMC] [PubMed] [Google Scholar] 26. Basta HA, Sgro JY, Palmenberg AC. Моделирование капсида риновируса С человека предлагает новую топографию с пониманием предпочтения рецепторов и иммуногенности. Вирусология . 2014; 448: 176–184. [Бесплатная статья PMC] [PubMed] [Google Scholar] 27. Биззинтино Дж., Ли В.М., Лайнг И.А., Ван Ф., Паппас Т., Чжан Дж., Мартин А.С., Кху СК, Кокс Д.В., Джилхоед Г.К. и др. Связь между риновирусом С человека и тяжестью острой астмы у детей. Eur Respir J .2011; 37: 1037–1042. [Бесплатная статья PMC] [PubMed] [Google Scholar] 28. Cox DW, Bizzintino J, Ferrari G, Khoo SK, Zhang G, Whelan S, Lee WM, Bochkov YA, Geelhoed GC, Goldblatt J и др. Инфекция человеческого риновируса вида C у детей раннего возраста с острым хрипом связана с увеличением количества госпитализаций по поводу острых респираторных заболеваний. Am J Respir Crit Care Med . 2013; 188: 1358–1364. [Бесплатная статья PMC] [PubMed] [Google Scholar] 29. Iwane MK, Prill MM, Lu X, Miller EK, Edwards KM, Hall CB, Griffin MR, Staat MA, Anderson LJ, Williams JV и др.Виды человеческого риновируса, связанные с госпитализацией детей раннего возраста в США по поводу острых респираторных заболеваний. J Заразить Dis . 2011; 204: 1702–1710. [PubMed] [Google Scholar] 30. Мак Р.К., Цзе Л.Й., Лам В.Й., Вонг Г.В., Чан П.К., Люн Т.Ф. Клинический спектр риновирусных инфекций человека у госпитализированных детей Гонконга. Pediatr Infect Dis J . 2011; 30: 749–753. [PubMed] [Google Scholar] 31. Драйсдейл С.Б., Альказар М., Уилсон Т., Смит М., Цукерман М., Лауэнгер И.Л., Тонг С.Й., Бротон С., Рафферти Г.Ф., Джонстон С.Л. и др.Респираторные исходы у недоношенных детей после инфицирования риновирусом человека A и C. Eur J Pediatr . 2014; 173: 913–919. [PubMed] [Google Scholar] 32. Хецуриани Н., Лу Х, Тиг В.Г., Казеруни Н., Андерсон Л.Дж., Эрдман Д.Д. Новые риновирусы человека и обострение астмы у детей. Emerg Infect Dis . 2008; 14: 1793–1796. [Бесплатная статья PMC] [PubMed] [Google Scholar] 33. Арден К.Е., Чанг А.Б., Ламберт С.Б., Ниссен, доктор медицины, Слоутс Т.П., Маккей И.М. Недавно выявленные респираторные вирусы у детей с обострением астмы, не требующие госпитализации. J Med Virol . 2010. 82: 1458–1461. [PubMed] [Google Scholar] 34. Linsuwanon P, Payungporn S, Samransamruajkit R, Posuwan N, Makkoch J, Theanboonlers A, Poovorawan Y. Высокая распространенность инфекции человеческого риновируса C у тайских детей с острым заболеванием нижних дыхательных путей. J Заразить . 2009. 59: 115–121. [Бесплатная статья PMC] [PubMed] [Google Scholar] 35. Ли В.М., Леманске Р.Ф., младший, Эванс, доктор медицины, Ван Ф., Паппас Т., Гангнон Р., Джексон Д. Д., Герн Дж. Э. Виды риновируса человека и сезон заражения определяют тяжесть заболевания. Am J Respir Crit Care Med . 2012; 186: 886–891. [Бесплатная статья PMC] [PubMed] [Google Scholar] 36. Уоттерс К., Пальменберг А.С. Дифференциальный процессинг белков комплекса ядерных пор протеазами риновируса 2А разных видов и серотипов. Дж Вирол . 2011; 85: 10874–10883. [Бесплатная статья PMC] [PubMed] [Google Scholar] 37. Накагоме К., Бочков Ю.А., Ашраф С., Брокман-Шнайдер Р.А., Эванс М.Д., Пасич Т.Р., Герн Дж.Э. Влияние видов риновирусов на репликацию вирусов и продукцию цитокинов. J Allergy Clin Immunol . 2014. 134: 332–341. [Бесплатная статья PMC] [PubMed] [Google Scholar] 38. Mosser AG, Brockman-Schneider RA, Amineva SP, Burchell L, Sedgwick JB, Busse WW, Gern JE. Сходная частота инфицирования риновирусом клеток в эпителии верхних и нижних дыхательных путей. J Заразить Dis . 2002; 185: 734–743. [PubMed] [Google Scholar] 39. Mosser AG, Vrtis R, Burchell L, Lee WM, Dick CR, Weisshaar E, Bock D, Swenson CA, Cornwell RD, Meyer KC и др. Количественный и качественный анализ риновирусной инфекции в тканях бронхов. Am J Respir Crit Care Med . 2005; 171: 645–651. [PubMed] [Google Scholar] 40. Саджан У, Ван Кью, Чжао Й, Грюнерт, округ Колумбия, Хершенсон МБ. Риновирус нарушает барьерную функцию поляризованных эпителиальных клеток дыхательных путей. Am J Respir Crit Care Med . 2008; 178: 1271–1281. [Бесплатная статья PMC] [PubMed] [Google Scholar] 41. Наклерио Р. М., Гордый Д., Лихтенштейн Л. М., Кагей-Соботка А., Хендли Дж. О., Соррентино Дж., Гвалтни Дж. М.. Кинины образуются во время экспериментальных риновирусных простуд. J Заразить Dis .1988. 157: 133–142. [PubMed] [Google Scholar] 42. Сеймур М.Л., Гилби Н., Бардин П.Г., Френкель Д.Д., Сандерсон Дж., Пенроуз Дж. Ф., Холгейт С.Т., Джонстон С.Л., Сэмпсон А.П. Риновирусная инфекция увеличивает содержание 5-липоксигеназы и циклооксигеназы-2 в образцах бронхиальной биопсии от субъектов без атопии. J Заразить Dis . 2002; 185: 540–544. [PubMed] [Google Scholar] 43. Proud D, Turner RB, Winther B, Wiehler S, Tiesman JP, Reichling TD, Juhlin KD, Fulmer AW, Ho BY, Walanski AA и др. Профили экспрессии генов во время инфицирования риновирусом человека in vivo: понимание ответа хозяина. Am J Respir Crit Care Med . 2008. 178: 962–968. [PubMed] [Google Scholar] 44. Льюис Т.К., Хендерсон Т.А., Карпентер А.Р., Рамирес И.А., МакГенри К.Л., Голдсмит А.М., Рен Х, Ментц Г.Б., Мукерджи Б., Робинс Т.Г. и др. Назальные цитокиновые реакции на естественные простуды у детей-астматиков. Clin Exp Allergy . 2012; 42: 1734–1744. [Бесплатная статья PMC] [PubMed] [Google Scholar] 45. Конно С., Гриндл К.А., Ли В.М., Шрот М.К., Моссер А.Г., Брокман-Шнайдер Р.А., Бусс В.В., Герн Дж. Э. Интерферон-гамма усиливает индуцированную риновирусом секрецию RANTES в эпителиальных клетках дыхательных путей человека. Am J Respir Cell Mol Biol . 2002; 26: 594–601. [PubMed] [Google Scholar] 46. Юта А., Дойл В.Дж., Гаумонд Э., Али М., Тамаркин Л., Баранюк Ю.Н., Ван Деузен М., Коэн С., Сконер Д.П. Риновирусная инфекция вызывает гиперсекрецию слизи. Am J Physiol . 1998; 274: L1017 – L1023. [PubMed] [Google Scholar] 47. Gern JE, Brockman-Schneider R, Bhattacharya S, Malter JS, Busse WW. Сыворотка и липопротеины низкой плотности усиливают секрецию интерлейкина-8 эпителиальными клетками дыхательных путей. Am J Respir Cell Mol Biol .2003. 29: 483–489. [PubMed] [Google Scholar] 48. Миллер Е.К., Лу Х, Эрдман Д.Д., Полинг К.А., Чжу Й., Гриффин М.Р., Хартерт Т.В., Андерсон Л.Дж., Вайнберг Г.А., Холл CB и др. Новая сеть эпиднадзора за вакцинами. Госпитализации детей раннего возраста, связанные с риновирусом. J Заразить Dis . 2007; 195: 773–781. [Бесплатная статья PMC] [PubMed] [Google Scholar] 49. DeMore JP, Weisshaar EH, Vrtis RF, Swenson CA, Evans MD, Morin A, Hazel E, Bork JA, Kakumanu S, Sorkness R и др. Подобные простуды у субъектов с аллергической астмой и у субъектов, не страдающих атопией, после инокуляции риновирусом-16. J Allergy Clin Immunol . 2009. 124: 245–252. [Бесплатная статья PMC] [PubMed] [Google Scholar] 50. Сообщение SD, Laza-Stanca V, Mallia P, Parker HL, Zhu J, Kebadze T., Contoli M, Sanderson G, Kon OM, Papi A, et al. Вызванное риновирусом заболевание нижних дыхательных путей увеличивается при астме и связано с вирусной нагрузкой и производством цитокинов Th2 / 2 и IL-10. Proc Natl Acad Sci USA . 2008. 105: 13562–13567. [Бесплатная статья PMC] [PubMed] [Google Scholar] 51. Simons E, Schroth MK, Gern JE. Анализ трахеального секрета на риновирус при естественных простудных заболеваниях. Pediatr Allergy Immunol . 2005. 16: 276–278. [PubMed] [Google Scholar] 52. Ю Дж.К., Ким Т.С., Хафффорд ММ, Брасиале Т.Дж. Вирусная инфекция легких: реакция хозяина и последствия. J Allergy Clin Immunol . 2013; 132: 1263–1276. [Викторина, стр. 1277.]. [Бесплатная статья PMC] [PubMed] [Google Scholar] 54. Пападопулос Н.Г., Станчу Л.А., Папи А., Холгейт СТ, Джонстон С.Л. Вызванные риновирусом изменения фенотипа мононуклеарных клеток периферической крови и экспрессии костимулирующих молекул у нормальных и атопических астматиков. Clin Exp Allergy . 2002; 32: 537–542. [PubMed] [Google Scholar] 55. Gehlhar K, Bilitewski C, Reinitz-Rademacher K, Rohde G, Bufe A. Нарушение вызванного вирусом высвобождения интерферона-альфа2 у взрослых пациентов с астмой. Clin Exp Allergy . 2006; 36: 331–337. [PubMed] [Google Scholar] 56. Сайкс А., Эдвардс М.Р., Макинтайр Дж., Дель Росарио А., Бахсолиани Е., Трухильо-Торральбо МБ, Кон О.М., Маллиа П., Макхейл М., Джонстон С.Л. Индуцированные риновирусом 16 IFN-α и IFN-β дефицитны в клетках бронхоальвеолярного лаважа у пациентов с астмой. J Allergy Clin Immunol . 2012; 129: 1506–1514. e6. [PubMed] [Google Scholar] 57. Gill MA, Bajwa G, George TA, Dong CC, Dougherty II, Jiang N, Gan VN, Gruchalla RS. Противорегуляция между путем FcepsilonRI и противовирусными ответами в плазматических дендритных клетках человека. Дж Иммунол . 2010. 184: 5999–6006. [Бесплатная статья PMC] [PubMed] [Google Scholar] 58. Wark PA, Johnston SL, Bucchieri F, Powell R, Puddicombe S, Laza-Stanca V, Holgate ST, Davies DE. Эпителиальные клетки бронхов при астме имеют недостаточный врожденный иммунный ответ на инфекцию риновирусом. J Exp Med . 2005; 201: 937–947. [Бесплатная статья PMC] [PubMed] [Google Scholar] 59. Contoli M, Message SD, Laza-Stanca V, Edwards MR, Wark PA, Bartlett NW, Kebadze T., Mallia P, Stanciu LA, Parker HL, et al. Роль дефицитной продукции интерферона-лямбда III типа в обострениях астмы. Нат Мед . 2006; 12: 1023–1026. [PubMed] [Google Scholar] 60. Эдвардс М.Р., Регейми Н., Варель М., Кенингер Э., Гупта А., Шумарк А., Саглани С., Сайкс А., Макинтайр Дж., Дэвис Дж. И др. Нарушение индукции врожденного интерферона у детей с атопической астмой, устойчивой к тяжелой терапии. Иммунол слизистой оболочки . 2013; 6: 797–806. [Бесплатная статья PMC] [PubMed] [Google Scholar] 61. Сайкс А., Макинтайр Дж., Эдвардс М.Р., Дель Росарио А., Хаас Дж., Гилен В., Кон О.М., Макхейл М., Джонстон С.Л. Вызванная риновирусом продукция интерферона не является недостаточной при хорошо контролируемой астме. Грудь . 2014; 69: 240–246. [PubMed] [Google Scholar] 62. Лопес-Соуза Н., Фаворето С., Вонг Х., Уорд Т., Яги С., Шнурр Д., Финкбайнер В.Е., Долганов Г.М., Виддикомб Дж. Х., Буши Х.А. и др. Восприимчивость к риновирусной инфекции in vitro выше для бронхов, чем для эпителиальных клеток носовых дыхательных путей у людей. J Allergy Clin Immunol . 2009; 123: 1384–1390.e2. [Бесплатная статья PMC] [PubMed] [Google Scholar] 63. Бочков Ю.А., Хансон К.М., Келес С., Брокман-Шнайдер Р.А., Ярджур Н.Н., Герн Й.Е. Риновирус-индуцированная модуляция экспрессии генов в эпителиальных клетках бронхов у пациентов с астмой. Иммунол слизистой оболочки . 2010; 3: 69–80. [Бесплатная статья PMC] [PubMed] [Google Scholar] 64. Кеннеди Дж. Л., Шейкер М., МакМин В., Герн Дж., Карпер Х., Мерфи Д., Ли В. М., Бочков Ю. А., Вртис Р. Ф., Платтс-Миллс Т. и др. Сравнение вирусной нагрузки у людей с астмой и без нее во время инфекций риновирусом. Am J Respir Crit Care Med . 2014; 189: 532–539. [Бесплатная статья PMC] [PubMed] [Google Scholar] 65. Patel DA, You Y, Huang G, Byers DE, Kim HJ, Agapov E, Moore ML, Peebles RS, Jr, Castro M, Sumino K, et al. Реакция на интерферон и контроль респираторных вирусов сохраняются в эпителиальных клетках бронхов при астме. J Allergy Clin Immunol . 2014; 134: 1402–1412.e7. [Бесплатная статья PMC] [PubMed] [Google Scholar] 67. Schwantes EA, Manthei DM, Denlinger LC, Evans MD, Gern JE, Jarjour NN, Mathur SK.Экспрессия гена интерферона в клетках мокроты коррелирует с индексом астмы во время обострений, вызванных вирусом. Clin Exp Allergy . 2014; 44: 813–821. [Бесплатная статья PMC] [PubMed] [Google Scholar] 68. Миллер EK, Эрнандес JZ, Wimmenauer V, Shepherd BE, Hijano D, Libster R, Serra ME, Bhat N, Batalle JP, Mohamed Y, et al. Механистическая роль IFN-λ1 типа III в обострениях астмы, опосредованных риновирусами человека. Am J Respir Crit Care Med . 2012; 185: 508–516. [Бесплатная статья PMC] [PubMed] [Google Scholar] 69.Тверски-младший, Ле ТВ, Биенеман А.П., Чичестер К.Л., Гамильтон Р.Г., Шредер Дж.Т. У дендритных клеток крови человека от субъектов с аллергией нарушена способность продуцировать интерферон-альфа через Toll-подобный рецептор 9. Clin Exp Allergy . 2008; 38: 781–788. [Бесплатная статья PMC] [PubMed] [Google Scholar] 70. Upham JW, Zhang G, Rate A, Еркович ST, Kusel M, Sly PD, Holt PG. Плазмацитоидные дендритные клетки в младенчестве обратно связаны с инфекциями дыхательных путей и хрипом у детей. J Allergy Clin Immunol .2009; 124: 707–713.e2. [PubMed] [Google Scholar] 71. Дуррани С.Р., Монтвилл Д.Д., Пратт А.С., Саху С., ДеВрис М.К., Раджаманикам В., Гангнон Р.Э., Гилл М.А., Герн Дж.Э., Леманске Р.Ф., младший и др. Врожденный иммунный ответ на риновирус снижается высокоаффинным рецептором IgE у детей с аллергической астмой. J Allergy Clin Immunol . 2012; 130: 489–495. [Бесплатная статья PMC] [PubMed] [Google Scholar] 72. Причард А.Л., Кэрролл М.Л., Бурел Дж. Г., Уайт О. Дж., Фиппс С., Упхэм Дж. У. Врожденные IFN и плазматические дендритные клетки ограничивают ответы цитокинов Th3 на риновирус: регуляторный механизм, имеющий отношение к астме. Дж Иммунол . 2012; 188: 5898–5905. [PubMed] [Google Scholar] 73. Гилен В., Сайкс А., Чжу Дж., Чан Б., Макинтайр Дж., Регейми Н., Кенингер Е., Гупта А., Шумарк А., Босли С. и др. Повышенный ядерный супрессор передачи сигналов цитокинов 1 в астматическом бронхиальном эпителии подавляет индукцию риновирусом врожденных интерферонов J Allergy Clin Immunol [онлайн до публикации] 25 января 2015 г .; DOI: 10.1016 / j.jaci.2014.11.039. [Бесплатная статья PMC] [PubMed] [Google Scholar] 74. Корфхаген Т.Р., Китцмиллер Дж., Чен Дж., Шридхаран А., Хайчи Х.М., Хегде Р.С., Диванович С., Карп С.Л., Уитсетт Дж.SAM-заостренный домен ETS-фактор опосредует присущую эпителиальным клеткам передачу сигналов врожденного иммунитета во время метаплазии слизистой дыхательных путей. Proc Natl Acad Sci USA . 2012; 109: 16630–16635. [Бесплатная статья PMC] [PubMed] [Google Scholar] 75. Chen G, Korfhagen TR, Karp CL, Impey S, Xu Y, Randell SH, Kitzmiller J, Maeda Y, Haitchi HM, Sridharan A, et al. Foxa3 индуцирует метаплазию бокаловидных клеток и подавляет врожденный противовирусный иммунитет. Am J Respir Crit Care Med . 2014; 189: 301–313. [Бесплатная статья PMC] [PubMed] [Google Scholar] 76.Корн Дж. М., Маршалл С., Смит С., Шрайбер Дж., Сандерсон Дж., Холгейт С.Т., Джонстон С.Л. Частота, тяжесть и продолжительность риновирусных инфекций у астматиков и неастматиков: продольное когортное исследование. Ланцет . 2002; 359: 831–834. [PubMed] [Google Scholar] 77. Holgate ST. Дисфункция эпителия при астме. J Allergy Clin Immunol . 2007; 120: 1233–1244, викторина 1245–1246. [PubMed] [Google Scholar] 78. Мейер Н., Акдис CA. Фактор роста эндотелия сосудов как ключевой индуктор ангиогенеза в дыхательных путях при астме. Curr Allergy Asthma Rep . 2013; 13: 1–9. [PubMed] [Google Scholar] 79. Лопес-Соуза Н., Долганов Г., Дубин Р., Сакс Л. А., Сассина Л., Спорер Н., Яги С., Шнурр Д., Боуши Н. А., Виддикомб Дж. Х. Устойчивость дифференцированного эпителия дыхательных путей человека к инфекции риновирусом. Am J Physiol Lung Cell Mol Physiol . 2004; 286: L373 – L381. [PubMed] [Google Scholar] 80. Jakiela B, Brockman-Schneider R, Amineva S, Lee WM, Gern JE. Базальные клетки дифференцированного эпителия бронхов более восприимчивы к риновирусной инфекции. Am J Respir Cell Mol Biol . 2008. 38: 517–523. [Бесплатная статья PMC] [PubMed] [Google Scholar] 81. Busse WW, Morgan WJ, Gergen PJ, Mitchell HE, Gern JE, Liu AH, Gruchalla RS, Kattan M, Teach SJ, Pongracic JA, et al. Рандомизированное испытание омализумаба (анти-IgE) для лечения астмы у детей из городских районов. N Engl J Med . 2011; 364: 1005–1015. [Бесплатная статья PMC] [PubMed] [Google Scholar] 82. Халдар П., Брайтлинг К.Э., Харгадон Б., Гупта С., Монтейро В., Суза А., Маршалл Р.П., Брэддинг П., Грин Р.Х., Вардлоу А.Дж. и др.Меполизумаб и обострения рефрактерной эозинофильной астмы. N Engl J Med . 2009; 360: 973–984. [Бесплатная статья PMC] [PubMed] [Google Scholar] 83. Джуканович Р., Харрисон Т., Джонстон С.Л., Габбей Ф., Уорк П., Томсон Н.К., Нивен Р., Сингх Д., Реддел Г.К., Дэвис Д.Е. и др. Исследовательская группа INTERCIA. Влияние ингаляционного IFN-β на ухудшение симптомов астмы, вызванных вирусными инфекциями. Рандомизированное испытание. Am J Respir Crit Care Med . 2014; 190: 145–154. [Бесплатная статья PMC] [PubMed] [Google Scholar]Взаимодействие вирусов и аллергенов при обострении астмы
Ann Am Thorac Soc.2015 ноя; 12 (Дополнение 2): S137 – S143.
Департамент педиатрии и Департамент медицины, Университет Висконсин-Мэдисон, Мэдисон, Висконсин
Автор для переписки. Перепечатку следует направлять Джеймсу Э. Герну, доктору медицины, K4 / 918 CSC, 600 Highland Avenue, Мэдисон, Висконсин 53792-9988. Электронная почта: ude.csiw.enicidem@nregПоступила в редакцию 16 марта 2015 г .; Принято 21 апреля 2015 г.
Авторское право © 2015 г. Американского торакального обществаAbstract
Аллергия и вирусные респираторные инфекции давно признаны двумя наиболее важными факторами риска обострений астмы. Эти наблюдения подняли вопросы относительно потенциального взаимодействия между этими двумя важными факторами риска. Например, снижает ли аллергия противовирусный ответ, способствуя тем самым обострениям астмы? С другой стороны, могут ли вирусные респираторные инфекции усиливать продолжающееся аллергическое воспаление в дыхательных путях? Ответы на эти вопросы могут иметь значение для профилактики и лечения обострений астмы.В этой статье рассматриваются клинические данные, связывающие вирусные инфекции и аллергию с обострениями астмы, рассматриваются возможные взаимодействия между этими двумя факторами риска и обсуждается возможное применение новых идей о взаимодействии вирусов и аллергенов для профилактики и лечения обострений астмы.
Ключевые слова: астма, риновирус, аллергия, интерферон
Обострения астмы составляют значительную часть заболеваемости и расходов, связанных с астмой.Обострения астмы остаются одной из наиболее частых причин госпитализации и влекут за собой дополнительные психологические и финансовые затраты, связанные с пропуском работы и учебы. В США в 2009 г. было 479 000 госпитализаций по поводу астмы, средняя продолжительность пребывания в больнице составила 4,3 дня, а уровень смертности составил 0,77 на 100 000 населения (1). Общие расходы на лечение астмы оценивались в 20 миллиардов долларов в год, и значительная часть этих затрат приходится на обострения. Затраты на медицинское обслуживание, связанные с обострениями астмы, были недавно подсчитаны для пациентов с умеренной и тяжелой астмой в большом U.База данных С. здравоохранения. Пациенты с обострениями астмы примерно вдвое превышали общие расходы на здравоохранение (9 223 доллара против 5 011 долларов) и расходы, связанные с астмой (1740 долларов против 847 долларов), по сравнению с подобранными пациентами без обострений ( P <0,0001) (2). Эти данные показывают, что личные и социальные издержки обострений астмы огромны и служат стимулом для разработки более эффективных стратегий профилактики и улучшенного лечения.
Факторы риска обострений астмы
Большинство обострений у детей и не менее половины обострений у взрослых, страдающих астмой, связаны с вирусной респираторной инфекцией (ВРИ) (3–5).Однако исследования детей школьного возраста, которые сдали обычные образцы в месяцы с высокой распространенностью, показывают, что ВРИ почти повсеместны у детей, независимо от астмы (6, 7). Многие вирусные инфекции вызывают легкие симптомы или их отсутствие даже у детей, страдающих астмой. Таким образом, вирусные инфекции, по-видимому, способствуют большинству обострений астмы, но сами по себе обычно недостаточны, чтобы вызвать обострения астмы. Действительно, существуют факторы риска или воздействие окружающей среды, которые могут либо усилить тяжесть ВРИ, либо действовать синергетически с ВРИ, вызывая обструкцию дыхательных путей и острые симптомы нижних дыхательных путей.
Факторы риска обострения астмы включают факторы, связанные с человеком, окружающей средой и инфекционным агентом. К личным факторам риска относятся тяжесть астмы и степень контроля, приверженность медикаментозному лечению и аллергия. Воздействие окружающей среды, которое может действовать вместе с вирусной инфекцией, способствуя обострению, включает загрязняющие вещества, раздражители и, для аллергиков, аллергены (8, 9). Бактериальные инфекции также могут способствовать возникновению острых хрипов и обострений астмы (6, 10).Вероятно, что множественные факторы способствуют возникновению большинства обострений, и эти факторы риска являются аддитивными и / или синергическими. К факторам риска обострений чаще всего относятся аллергия и вирусная инфекция, которые являются предметом настоящего обзора.
Клинические исследования аллергии и обострений астмы, вызванных вирусами
Сочетание аллергической сенсибилизации и вирусных заболеваний значительно увеличивает риск обострения астмы и госпитализации. В серии исследований, проведенных в Университете Вирджинии, дети с эпизодами острого свистящего дыхания оценивались в отделениях неотложной помощи, включая отделения неотложной помощи (11, 12) и стационарное отделение больницы (4).В этих исследованиях аллергическая сенсибилизация и риновирусная (RV) инфекция были значимыми факторами риска хрипов (отношение шансов [OR], 3,2 и 4,4, соответственно). Дети, у которых была выявлена инфекция правого желудочка в сочетании либо с сенсибилизацией к обычным аэроаллергенам, либо с эозинофилией, имели самые высокие шансы на свистящее дыхание (OR, 17 и 25 соответственно) (11). Эти же отношения справедливы и для детей в Коста-Рике, у которых наибольший риск хрипов наблюдался среди детей, которые были высокочувствительны к клещу домашней пыли и дали положительный результат на RV (OR на хрипы, 31.5; 95% доверительный интервал 8,3–108; P <0,001) (13). Примечательно, что аллергическая сенсибилизация увеличивает риск одышки респираторными вирусами даже в дошкольном возрасте (14, 15). Вместе взятые, эти результаты показывают, что инфекции правого желудочка вносят вклад в большинство заболеваний свистящего дыхания в детстве и что аллергическая сенсибилизация или эозинофильное воспаление дыхательных путей дополнительно увеличивает риск заболеваний свистящего дыхания.
Другие исследования выявили взаимодействия между VRI, аллергией и воздействием аллергенов, вызывающими заболевания свистящего дыхания.В исследовании «случай-контроль» острых обострений по сравнению с пациентами со стабильной астмой и детьми, госпитализированными с диагнозом, не связанным с респираторными заболеваниями, вирусная инфекция, аллергия и воздействие соответствующего аллергена были независимо связаны с обострениями (8). Сочетание этих факторов риска привело к выраженному риску госпитализации (OR, 19,4; P <0,001). Подобные результаты были получены у взрослых с астмой (9).
Вирусные факторы
РВ наиболее тесно связаны с обострениями астмы у детей и взрослых.Грипп, коронавирусы, вирусы парагриппа и другие вирусы выявляются с меньшей частотой во время обострений. Связана ли эта тесная связь с определенным свойством ПЖ или просто отражает очень общую природу инфекций ПЖ, не совсем ясно.
RV Виды и вирулентность
RV включают три вида из рода Enterovirus . Виды A и B были впервые обнаружены в 1950-х годах, а первый вирус вида C был зарегистрирован в 2006 году после обнаружения с помощью молекулярных методов (16, 17).Дополнительные исследования с использованием подобных подходов с тех пор сообщили о более чем 50 новых типах C, а также о ряде дополнительных типов A и B (18–20). Долгая задержка в обнаружении типов C была связана с невозможностью культивировать эти вирусы, которые присутствовали так же долго, как и другие виды RV (21). Вирусы RV-C можно выращивать в органной культуре слизистой оболочки носовых пазух (22) и в первичных клетках, дифференцированных на границе раздела воздух-жидкость (23, 24). Кроме того, типы RV-C могут быть получены методами обратной генетики путем трансфекции клеток вирусной РНК, транскрибируемой с плазмид (22, 25).Моделирование структуры капсида RV предполагает, что платформа связывания рецепторов для RV-C отличается от платформы для связывания RV-A и RV-B (26), и на самом деле типы RV-C используют уникальный (и пока не идентифицированный) рецептор для войти в ячейки (22). На сегодняшний день не существует клеточных линий (кроме клеток поверхности раздела воздух-жидкость), которые поддерживают инфекцию RV-C (ссылки 23 и 24 и наши неопубликованные данные).
Заметное генетическое разнообразие типов RV предполагает, что тип или виды RV могут влиять на вирулентность. В исследованиях «случай-контроль» RV-C и в некоторых исследованиях RV-A чрезмерно представлены у детей с инфекциями нижних дыхательных путей по сравнению с детьми с инфекциями верхних дыхательных путей или без симптомов (21, 27–34).Точно так же RV-B в семь-восемь раз реже вызывает респираторное заболевание средней и тяжелой степени, чем другие виды RV у младенцев (35). Наконец, у маленьких детей, которые хрипят из-за инфекции RV-C, более вероятно развитие рецидивов хрипов, чем у детей, которые хрипят из-за других вирусов (28).
Почему вирусы RV-C и RV-A с большей вероятностью вызывают обострения астмы, чем RV-B, неясно и может быть связано с рядом генетических, структурных и функциональных различий между видами RV.Например, большинство RV лучше всего растут при температуре от 33 до 35 ° C, и это свойство может ограничивать их распространение в небольшие дыхательные пути в легких. Напротив, типы RV-C одинаково хорошо растут при 33, 35 и 37 ° C (23). Рост при более высоких температурах может способствовать ассоциации между инфекцией RV-C и заболеванием нижних дыхательных путей. Кроме того, существуют различия между типами и видами RV, связанными с функцией вирусных протеаз, которые важны для управления репликацией вируса и ингибирования ключевых метаболических процессов в клетках-хозяевах (36).Кроме того, исследований in vitro продемонстрировали, что RV-B реплицируется медленнее и связан со снижением цитопатических эффектов и индукцией секреции цитокинов, чем RV-A и RV-C (37).
В совокупности эти данные предполагают, что более низкие скорости репликации RV-B и индукции цитокинов могут способствовать снижению вирулентности. Биохимия протеазы 2А, связанная с биологическими видами, соответствует снижению репликации и воспалительной реакции. Наконец, относительная нечувствительность RV-C к температуре может дать этому вирусу преимущество в возникновении инфекций нижних дыхательных путей.
Как инфекции правого желудочка вызывают обострение астмы?
VRI могут вызывать респираторные заболевания, повреждая эпителиальные клетки и другие структурные клетки и вызывая воспалительные реакции, которые вторично вызывают дисфункцию дыхательных путей и вызывают симптомы болезни. Поскольку инфекции правого желудочка обычно поражают небольшой процент эпителиальных клеток дыхательных путей (38, 39), а лизис клеток, как правило, не является обширным, вполне вероятно, что воспалительный ответ является основным фактором, вызывающим простуду и обострение астмы, вызванной ПЖ.Несмотря на то, что лизис клеток ограничен, ПЖ может нарушать барьерную функцию эпителиальных клеток, что приводит к повышенной проницаемости для макромолекул и способствует вторичной инфекции бактериями дыхательных путей (40).
В ряде исследований были выявлены воспалительные процессы, вызванные RV, которые, вероятно, способствуют дисфункции и появлению симптомов дыхательных путей. RV индуцирует цитокины острой фазы (например, IL-1β и интерфероны I типа) и медиаторы (простагландины, кинины), которые могут вызывать недомогание и миалгию (41, 42). RV активирует нервные пути, которые способствуют чиханию и кашлю, посредством механизмов, которые могут включать клеточное воспаление и высвобождение цитокинов и медиаторов.Инфекция RV заставляет эпителиальные клетки секретировать хемокины, которые способствуют привлечению воспалительных клеток (43, 44). Секреция эпителиальных хемокинов усиливается интерферонами, происходящими из мононуклеарных клеток (45). Во время ранней фазы простуды сывороточные жидкости и белки просачиваются в дыхательные пути (46), и, в свою очередь, липопротеины низкой плотности могут стимулировать секрецию хемокинов эпителиальными клетками (47). На последних стадиях инфекции секреция слизи увеличивается (46).
Долгое время считалось, что инфекции правого желудочка ограничиваются верхними дыхательными путями, но теперь есть убедительные доказательства того, что ПЖ может также инфицировать нижние дыхательные пути.Например, RV может быть единственным патогеном, обнаруживаемым в секретах нижних дыхательных путей у детей с пневмонией (48). После экспериментальной инокуляции серонегативных добровольцев ПЖ обнаруживается в секретах нижних дыхательных путей примерно у половины участников исследования, независимо от наличия астмы (39, 49). Пики выделения вируса из верхних дыхательных путей достигаются через 2–4 дня после инокуляции, а у субъектов с инфекциями нижних дыхательных путей выделение вируса из нижних дыхательных путей обычно отстает на несколько дней (49, 51). В образцах биопсии инфицированные RV клетки могут быть обнаружены в крупных нижних дыхательных путях в виде пятен, напоминающих паттерны в верхних дыхательных путях (39).Наконец, ПЖ был обнаружен в секретах нижних дыхательных путей у детей с трахеостомией (51). Как только ПЖ поражает нижние дыхательные пути, последствия инфекции, вероятно, будут аналогичны последствиям, вызванным инфекцией верхних дыхательных путей, и включают усиление секреции дыхательных путей, отек слизистой оболочки и клеточные воспалительные реакции. В совокупности эти эффекты, вероятно, способствуют обструкции дыхательных путей.
Механизмы взаимодействия вирусов и аллергии
Уменьшает ли аллергия противовирусный ответ?
Тесная связь между аллергическим заболеванием дыхательных путей и обострениями астмы, вызванными вирусами, позволяет предположить, что респираторные аллергии каким-то образом подавляют противовирусные реакции.Интерфероны являются одним из краеугольных камней врожденной противовирусной защиты от респираторных вирусов (52, 53). Из множества источников получены данные о том, что индуцированные вирусом интерфероновые ответы мононуклеарных клеток периферической крови (54, 55), мононуклеарных клеток дыхательных путей (57) и плазмоцитоидных дендритных клеток (pDC) (57) снижаются при астме. Кроме того, некоторые исследования показывают, что астма связана со снижением индуцированной вирусом продукции IFN-β и IFN-λ эпителиальными клетками (58, 59). Недостаточный ответ эпителиального интерферона может быть свойством более тяжелой астмы (60), потому что ответы на интерферон у субъектов с легкой формой астмы кажутся нормальными (49, 61).Также имеются данные о том, что недостаточный противовирусный ответ при астме может ограничиваться легкими (55), что позволяет предположить, что воспаление 2 типа может ингибировать индуцированные вирусом ответы на интерферон. Соответственно, некоторые исследования эпителиальных клеток дыхательных путей ex vivo , исключенных из потенциальных иммуномодулирующих эффектов других клеток дыхательных путей (например, клеток ILC2 и Th3), продемонстрировали нормальный вирус-индуцированный ответ интерферона (62–65). В любом случае вполне вероятно, что ранний вирус-индуцированный интерфероновый ответ является важным фактором, определяющим последующее течение инфекции и болезни.Между прочим, кинетика индуцированного вирусом ответа интерферона, вероятно, будет иметь значение. Слишком мало интерферона на ранних этапах инфекции может привести к неограниченной репликации вируса, тогда как чрезмерная секреция интерферона во время пика болезни (в ответ на репликацию вируса высокого уровня) может усугубить бремя симптомов (66–68). Недавно были описаны два возможных механизма ингибирования противовирусного ответа аллергического воспаления, которые рассматриваются в следующих разделах.
Высокоаффинные рецепторы IgE и ответы на интерферон
Аллергическое воспаление может подавлять врожденный противовирусный иммунитет при некоторых условиях (69). Например, плазматические дендритные клетки секретируют высокие уровни интерферонов типа I и III и являются важными клетками в противовирусном ответе в легких (70) (). Интересно, что эти клетки экспрессируют высокоаффинный рецептор IgE (FcεRI), который может регулировать противовирусные ответы. Экспрессия FcεRI на поверхности клетки обратно пропорциональна вирусной индукции интерферона (57).Кроме того, перекрестное связывание FcεRI заметно ухудшает ответы интерферона типа I и типа III на вирус гриппа или RV (57, 71). Эти данные свидетельствуют о том, что IgE-опосредованное аллергическое воспаление может ингибировать противовирусные реакции в КПК, патрулирующих эпителий дыхательных путей. В свою очередь, секреция интерферона pDC во время вирусных инфекций может подавлять ответы Th3 (72) и, таким образом, выполняет как противовирусную, так и иммуномодулирующую функции.
Высокоаффинные рецепторы IgE (FcεRI) на плазматических дендритных клетках и влияние на интерфероновые ответы.В отсутствие аллергии плазмацитоидные дендритные клетки (pDC) экспрессируют низкие уровни FcεRI на клеточной поверхности, и некоторые из этих рецепторов заняты IgE. Инфекция риновирусом (RV) побуждает pDC секретировать IFN-α и IFN-λ, которые ингибируют репликацию вируса аутологичным и паракринным образом. В контексте аллергии с воздействием аллергена FcεRI и IgE увеличиваются, и перекрестное связывание рецепторов аллергеном может ингибировать секрецию интерферона. Конечным результатом астмы может быть усиление репликации вирусов, более тяжелое заболевание и повышенный риск обострения хронической астмы.Рисунок любезно предоставлен Уильямом В. Буссом, доктором медицины, Университет Висконсин-Мэдисон.
Клеточная сигнализация, аллергия и противовирусные ответы
Внутриклеточные сигнальные механизмы также могут способствовать индуцированному аллергией подавлению противовирусных ответов. Супрессор передачи сигналов цитокинов (SOCS) 1 экспрессируется эпителиальными клетками дыхательных путей и может подавлять интерферон и другие цитокины. SOCS1 повышается в ядрах эпителиальных клеток дыхательных путей при астме, и этот эффект может способствовать снижению индуцированных вирусом ответов интерферона (73).Кроме того, в эпителиальных клетках аллергическое воспаление и инфекция RV могут вызывать метаплазию слизи посредством механизмов, которые включают индукцию факторов транскрипции, белка A3 (FOXA3) и заостренного домена SAM, содержащего фактор транскрипции ETS (SPDEF) (74). Экспрессия FOXA3 в эпителиальных клетках может также ингибировать интерфероны I типа и другие противовирусные реакции и усиливать экспрессию проаллергических факторов, таких как стромальный лимфопоэтин тимуса (75). Во время острых вирусных инфекций функция FOXA3 может заключаться в ограничении воспалительных реакций по мере разрешения инфекции, но хроническая экспрессия в контексте аллергического воспаления может вместо этого подавлять противовирусные реакции, потенциально приводя к более тяжелому заболеванию (75).
Усиливают ли инфекции желудочно-кишечного тракта продолжающееся аллергическое воспаление дыхательных путей?
В продольном исследовании совместно проживающих пар, которые не были согласны по поводу астмы, астма была связана с аналогичными индуцированными RV симптомами верхних дыхательных путей, но более серьезными симптомами нижних дыхательных путей (76). Это открытие предполагает, что различия в окружающей среде нижних дыхательных путей могут быть причиной повышенной тяжести заболевания при астме. Некоторые особенности нижних дыхательных путей могут способствовать увеличению тяжести заболеваний правого желудочка.Структурные и физиологические изменения, связанные с аллергическим воспалением дыхательных путей, включают гиперплазию бокаловидных клеток, гиперемию, гиперчувствительность дыхательных путей и сужение дыхательных путей (77, 78). Соответственно, стимуляция секреции слизи при ПЖ может быть хуже в дыхательных путях с большим количеством секретирующих слизь клеток, гиперемия, связанная с астмой, может усиливать вызванный вирусом отек и транссудат, а бронхоспазм может усиливаться в гиперреактивных дыхательных путях. Эти эффекты вместе могут способствовать сужению и закрытию дыхательных путей, что приводит к уменьшению воздушного потока и увеличению риска обострения.
Эпителий имеет ряд врожденных механизмов противовирусной защиты, а интактный, хорошо дифференцированный эпителий относительно устойчив к инфекции RV (79). Аллергическое воспаление дыхательных путей при астме может нарушать функцию эпителиального барьера, и исследований in vitro показывают, что репликация правого желудочка усиливается, когда апикальные клетки хорошо дифференцированных культур эпителиальных клеток либо повреждаются, либо удаляются (80). Таким образом, снижение барьерной функции при астме может привести к более тяжелым инфекциям правого желудочка.
Значение для профилактики и лечения
Стандартные схемы лечения астмы не полностью контролируют обострения, поэтому необходимы новые подходы. В большинстве случаев обострения носят многофакторный характер, и сочетание вирусной инфекции и аллергии является двумя наиболее частыми причинами. Это наблюдение предполагает, что борьба с аллергическим воспалением и усиление противовирусных реакций могут быть эффективными подходами к снижению частоты и тяжести обострений астмы.
Омализумаб связывается с Fc-частью IgE, чтобы предотвратить связывание с клеточной поверхностью и блокировать активацию клеток через высокоаффинный рецептор IgE FcεRI. В рандомизированном плацебо-контролируемом исследовании лечения астмы на основе рекомендаций по сравнению с омализумабом, добавленным к стандартной терапии, омализумаб предотвращал сезонные пики обострений осенью и весной (81). Назальные выделения, полученные во время обострений, были проанализированы на наличие вирусов, и эти данные подтвердили, что в группе лечения было меньше вирусных, а также невирусных обострений.Результаты этого интервенционного исследования показывают, что IgE-опосредованное воспаление способствует вирус-индуцированным обострениям астмы. Полученные данные также повышают вероятность того, что другие препараты, нацеленные на воспаление 2 типа (например, меполизумаб и ИЛ-5 [82]), также могут подавлять вирус-индуцированные обострения.
Другой новый подход заключался в использовании ингаляционного IFN-β для усиления противовирусного ответа в слизистой оболочке дыхательных путей. Добровольцы со стойкой астмой и в анамнезе обострения простуды были рандомизированы для лечения либо распыленным IFN-β, либо плацебо в течение 24 часов после появления симптомов простуды (83).Лечение IFN-β не уменьшало количество симптомов астмы (первичный результат) в популяции, собирающейся лечиться; однако были отмечены три положительных результата. Во-первых, IFN-β хорошо переносился и индуцировал маркеры противовирусной защиты в крови и мокроте. Во-вторых, лечение IFN-β приводило к увеличению пикового выдоха по сравнению с плацебо. Наконец, у испытуемых с более тяжелой астмой (этапы 4 и 5 Британского торакального общества) IFN-β снижал вероятность того, что простуда приведет к обострениям. Если эти данные подтвердятся, ингаляционный IFN-β может быть полезен для предотвращения обострений астмы, вызванных простудными заболеваниями, у пациентов с более тяжелой астмой.
Выводы
Клинические исследования определили аллергию и вирусные инфекции как основные факторы риска обострения астмы. Эти результаты привели к новым подходам к профилактике обострений, основанным на блокировании аллергических механизмов, и удвоили усилия по усилению противовирусной защиты в дыхательных путях. Понимание того, как аллергия и другие факторы риска способствуют обострениям астмы, вызванным вирусами, остается важной целью. Достижения в этой области могут дать дополнительную информацию о патогенезе обострений астмы и последовательно привести к более совершенным подходам к профилактике или лечению обострений астмы.
Ссылки
1. Национальные институты здоровья / Национальный институт сердца, легких и крови. Bethesda, MD: 2012. Сборник диаграмм 2012 года по сердечно-сосудистым, легочным и кровяным заболеваниям. [Google Scholar] 2. Иванова Ю.И., Бергман Р., Бирнбаум Х.Г., Колис Г.Л., Сильверман Р.А., Маклаурин К. Влияние обострений астмы на расходы на здравоохранение среди астматических пациентов с умеренной и тяжелой персистирующей астмой. J Allergy Clin Immunol . 2012; 129: 1229–1235. [PubMed] [Google Scholar] 3. Джонстон С.Л., Паттемор П.К., Сандерсон Г., Смит С., Лампе Ф., Джозефс Л., Симингтон П., О’Тул С., Мьинт С.Х., Тиррелл Д.А. и др.Общественное исследование роли вирусных инфекций в обострениях астмы у детей 9-11 лет. BMJ . 1995; 310: 1225–1229. [Бесплатная статья PMC] [PubMed] [Google Scholar] 4. Heymann PW, Carper HT, Murphy DD, Platts-Mills TA, Patrie J, McLaughlin AP, Erwin EA, Shaker MS, Hellems M, Peerzada J, et al. Вирусные инфекции в зависимости от возраста, атопии и сезона госпитализации среди детей, госпитализированных по поводу хрипов. J Allergy Clin Immunol . 2004. 114: 239–247. [Бесплатная статья PMC] [PubMed] [Google Scholar] 6.Kloepfer KM, Lee WM, Pappas TE, Kang TJ, Vrtis RF, Evans MD, Gangnon RE, Бочков Ю.А., Джексон DJ, Lemanske RF, Jr, Gern JE. Обнаружение патогенных бактерий при риновирусной инфекции связано с усилением респираторных симптомов и обострениями астмы. J Allergy Clin Immunol . 2014; 133: 1301–1307.e1–3. [Бесплатная статья PMC] [PubMed] [Google Scholar] 7. Оленек Дж. П., Ким В. К., Ли В. М., Ван Ф., Папас Т. Е., Салазар Л. Е., Эванс М. Д., Борк Дж., Роберг К., Леманске Р. Ф. младший и др. Еженедельное наблюдение за детьми, страдающими астмой, на предмет инфекций и болезней в сезон простуд. J Allergy Clin Immunol . 2010; 125: 1001–1006, e1. [Бесплатная статья PMC] [PubMed] [Google Scholar] 8. Мюррей С.С., Полетти Г., Кебадзе Т., Моррис Дж., Вудкок А., Джонстон С.Л., Кустович А. Изучение изменяемых факторов риска обострений астмы: вирусная инфекция и воздействие аллергенов увеличивают риск госпитализации астмы у детей. Грудь . 2006. 61: 376–382. [Бесплатная статья PMC] [PubMed] [Google Scholar] 9. Грин Р.М., Кустович А., Сандерсон Дж., Хантер Дж., Джонстон С.Л., Вудкок А.Синергизм между аллергенами и вирусами и риск госпитализации с астмой: исследование случай-контроль. BMJ . 2002; 324: 763–766A. [Бесплатная статья PMC] [PubMed] [Google Scholar] 10. Бисгаард Х., Хермансен М.Н., Бённеликке К., Стокгольм Дж., Баты Ф., Скайтт Н.Л., Анищенко Дж., Кебадзе Т., Джонстон С.Л. Связь бактерий и вирусов с эпизодами свистящего дыхания у детей раннего возраста: проспективное когортное исследование при рождении. BMJ . 2010; 341: c4978. [Бесплатная статья PMC] [PubMed] [Google Scholar] 11. Грабли Г. П., Арруда Э., Инграм Дж. М., Гувер Г. Е., Замбрано Дж. К., Хайден Ф. Г., Платтс-Миллс Т. А., Хейманн П. В..Риновирус и респираторно-синцитиальный вирус у детей с затрудненным дыханием, требующих неотложной помощи: анализ IgE и эозинофилов. Am J Respir Crit Care Med . 1999; 159: 785–790. [PubMed] [Google Scholar] 12. Дафф А.Л., Померанц Э.С., Гелбер Л.Е., Прайс ГВ, Фаррис Х., Хайден Ф.Г., Platts-Mills TAE, Heymann PW. Факторы риска острого свистящего дыхания у младенцев и детей: вирусы, пассивный дым и антитела IgE к ингаляционным аллергенам. Педиатрия . 1993. 92: 535–540. [PubMed] [Google Scholar] 13. Сото-Кирос М., Авила Л., Платтс-Миллс Т.А., Хант Дж.Ф., Эрдман Д.Д., Карпер Х., Мерфи Д.Д., Одио С., Джеймс Х.Р., Патри Дж. Т. и др.Высокие титры антител IgE к аллергену пылевого клеща и риск хрипов у детей-астматиков, инфицированных риновирусом. J Allergy Clin Immunol . 2012; 129: 1499–1505.e5. [Бесплатная статья PMC] [PubMed] [Google Scholar] 14. Джартти Т., Куусипало Х., Вуоринен Т., Седерлунд-Венермо М., Алландер Т., Варис М., Хартиала Дж., Руусканен О. Аллергическая сенсибилизация связана с риновирусами, но не с другими вирусами, вызванными хрипами у детей. Pediatr Allergy Immunol . 2010; 21: 1008–1014.[Бесплатная статья PMC] [PubMed] [Google Scholar] 15. Джексон Д. Д., Эванс М. Д., Гангнон Р. Э., Тислер С. Дж., Папас Т. Е., Ли В. М., Герн Дж. Э., Леманске Р. Ф., младший. Доказательства причинной связи между аллергической сенсибилизацией и риновирусным хрипом в раннем возрасте. Am J Respir Crit Care Med . 2012; 185: 281–285. [Бесплатная статья PMC] [PubMed] [Google Scholar] 16. МакЭрлин П., Шакелтон Л.А., Ламберт С.Б., Ниссен, доктор медицины, Слоутс Т.П., Маккей И.М. Характеристика недавно идентифицированного риновируса человека, HRV-QPM, обнаруженного у младенцев с бронхиолитом. Дж. Клин Вирол . 2007; 39: 67–75. [Бесплатная статья PMC] [PubMed] [Google Scholar] 17. Арден К.Э., МакЭрлин П., Ниссен, доктор медицины, Слоутс Т.П., Маккей И.М. Частое обнаружение риновирусов, парамиксовирусов, коронавирусов и бокавирусов человека при острых инфекциях дыхательных путей. J Med Virol . 2006; 78: 1232–1240. [Бесплатная статья PMC] [PubMed] [Google Scholar] 18. Ламсон Д., Ренвик Н., Капур В., Лю З., Паласиос Дж., Джу Дж., Дин А., Сент-Джордж К., Бриз Т., Липкин В. Обнаружение респираторных патогенов с помощью полимеразной цепной реакции MassTag, включая новый генотип риновируса, которые вызвали гриппоподобное заболевание в штате Нью-Йорк в 2004–2005 годах. J Заразить Dis . 2006; 194: 1398–1402. [Бесплатная статья PMC] [PubMed] [Google Scholar] 19. Кистлер А., Авила П.С., Рускин С., Ван Д., Вард Т., Яги С., Шнурр Д., Ганем Д., ДеРизи Д. Л., Боуши Н. А.. Пановирусный скрининг инфекций дыхательных путей у взрослых с астмой и без нее выявляет неожиданное разнообразие коронавирусов человека и риновирусов человека. J Заразить Dis . 2007; 196: 817–825. [Бесплатная статья PMC] [PubMed] [Google Scholar] 20. Ли В.М., Киснер К., Паппас Т., Ли И., Гриндл К., Джартти Т., Джакиела Б., Леманске Р.Ф., мл., Шулт П.А., Герн Дж. Э.Разнообразная группа ранее нераспознанных риновирусов человека является частой причиной респираторных заболеваний у младенцев. PLoS One . 2007; 2: e966. [Бесплатная статья PMC] [PubMed] [Google Scholar] 21. Линдер Дж. Э., Крафт, округ Колумбия, Мохамед Ю., Лу З., Хейл Л., Толлефсон С., Сэвилл Б. Р., Райт П. Ф., Уильямс СП, Миллер Е. К.. Человеческий риновирус C: возраст, время года и заболевания нижних дыхательных путей за последние 3 десятилетия. J Allergy Clin Immunol . 2013; 131: 69–77.e1–6. [Бесплатная статья PMC] [PubMed] [Google Scholar] 22.Бочков Ю.А., Пальменберг А.С., Ли В.М., Рат Дж.А., Аминева С.П., Сан X, Пасич Т.Р., Джарджур Н.Н., Лиггетт С.Б., Герн Дж. Э. Молекулярное моделирование, культивирование органов и обратная генетика для недавно идентифицированного риновируса человека C. Nat Med . 2011; 17: 627–632. [Бесплатная статья PMC] [PubMed] [Google Scholar] 23. Ашраф С., Брокман-Шнайдер Р., Бочков Ю.А., Пашич Т.Р., Герн Дж. Э. Биологические характеристики и распространение человеческого риновируса-C в дифференцированных эпителиальных клетках синуса. Вирусология . 2013; 436: 143–149.[Бесплатная статья PMC] [PubMed] [Google Scholar] 24. Хао В., Бернард К., Патель Н., Ульбрандт Н., Фенг Х., Свабек С., Уилсон С., Стрейснер С., Ван К., Сузич Дж. И др. Инфекция и распространение человеческого риновируса С в эпителиальных клетках дыхательных путей человека. Дж Вирол . 2012; 86: 13524–13532. [Бесплатная статья PMC] [PubMed] [Google Scholar] 25. Григгс Т.Ф., Бочков Ю.А., Накагоме К., Пальменберг А.С., Герн Дж. Э. Производство, очистка и стабильность капсида риновирусов типа С. Дж. Вирольные методы . 2015; 217: 18–23.[Бесплатная статья PMC] [PubMed] [Google Scholar] 26. Basta HA, Sgro JY, Palmenberg AC. Моделирование капсида риновируса С человека предлагает новую топографию с пониманием предпочтения рецепторов и иммуногенности. Вирусология . 2014; 448: 176–184. [Бесплатная статья PMC] [PubMed] [Google Scholar] 27. Биззинтино Дж., Ли В.М., Лайнг И.А., Ван Ф., Паппас Т., Чжан Дж., Мартин А.С., Кху СК, Кокс Д.В., Джилхоед Г.К. и др. Связь между риновирусом С человека и тяжестью острой астмы у детей. Eur Respir J .2011; 37: 1037–1042. [Бесплатная статья PMC] [PubMed] [Google Scholar] 28. Cox DW, Bizzintino J, Ferrari G, Khoo SK, Zhang G, Whelan S, Lee WM, Bochkov YA, Geelhoed GC, Goldblatt J и др. Инфекция человеческого риновируса вида C у детей раннего возраста с острым хрипом связана с увеличением количества госпитализаций по поводу острых респираторных заболеваний. Am J Respir Crit Care Med . 2013; 188: 1358–1364. [Бесплатная статья PMC] [PubMed] [Google Scholar] 29. Iwane MK, Prill MM, Lu X, Miller EK, Edwards KM, Hall CB, Griffin MR, Staat MA, Anderson LJ, Williams JV и др.Виды человеческого риновируса, связанные с госпитализацией детей раннего возраста в США по поводу острых респираторных заболеваний. J Заразить Dis . 2011; 204: 1702–1710. [PubMed] [Google Scholar] 30. Мак Р.К., Цзе Л.Й., Лам В.Й., Вонг Г.В., Чан П.К., Люн Т.Ф. Клинический спектр риновирусных инфекций человека у госпитализированных детей Гонконга. Pediatr Infect Dis J . 2011; 30: 749–753. [PubMed] [Google Scholar] 31. Драйсдейл С.Б., Альказар М., Уилсон Т., Смит М., Цукерман М., Лауэнгер И.Л., Тонг С.Й., Бротон С., Рафферти Г.Ф., Джонстон С.Л. и др.Респираторные исходы у недоношенных детей после инфицирования риновирусом человека A и C. Eur J Pediatr . 2014; 173: 913–919. [PubMed] [Google Scholar] 32. Хецуриани Н., Лу Х, Тиг В.Г., Казеруни Н., Андерсон Л.Дж., Эрдман Д.Д. Новые риновирусы человека и обострение астмы у детей. Emerg Infect Dis . 2008; 14: 1793–1796. [Бесплатная статья PMC] [PubMed] [Google Scholar] 33. Арден К.Е., Чанг А.Б., Ламберт С.Б., Ниссен, доктор медицины, Слоутс Т.П., Маккей И.М. Недавно выявленные респираторные вирусы у детей с обострением астмы, не требующие госпитализации. J Med Virol . 2010. 82: 1458–1461. [PubMed] [Google Scholar] 34. Linsuwanon P, Payungporn S, Samransamruajkit R, Posuwan N, Makkoch J, Theanboonlers A, Poovorawan Y. Высокая распространенность инфекции человеческого риновируса C у тайских детей с острым заболеванием нижних дыхательных путей. J Заразить . 2009. 59: 115–121. [Бесплатная статья PMC] [PubMed] [Google Scholar] 35. Ли В.М., Леманске Р.Ф., младший, Эванс, доктор медицины, Ван Ф., Паппас Т., Гангнон Р., Джексон Д. Д., Герн Дж. Э. Виды риновируса человека и сезон заражения определяют тяжесть заболевания. Am J Respir Crit Care Med . 2012; 186: 886–891. [Бесплатная статья PMC] [PubMed] [Google Scholar] 36. Уоттерс К., Пальменберг А.С. Дифференциальный процессинг белков комплекса ядерных пор протеазами риновируса 2А разных видов и серотипов. Дж Вирол . 2011; 85: 10874–10883. [Бесплатная статья PMC] [PubMed] [Google Scholar] 37. Накагоме К., Бочков Ю.А., Ашраф С., Брокман-Шнайдер Р.А., Эванс М.Д., Пасич Т.Р., Герн Дж.Э. Влияние видов риновирусов на репликацию вирусов и продукцию цитокинов. J Allergy Clin Immunol . 2014. 134: 332–341. [Бесплатная статья PMC] [PubMed] [Google Scholar] 38. Mosser AG, Brockman-Schneider RA, Amineva SP, Burchell L, Sedgwick JB, Busse WW, Gern JE. Сходная частота инфицирования риновирусом клеток в эпителии верхних и нижних дыхательных путей. J Заразить Dis . 2002; 185: 734–743. [PubMed] [Google Scholar] 39. Mosser AG, Vrtis R, Burchell L, Lee WM, Dick CR, Weisshaar E, Bock D, Swenson CA, Cornwell RD, Meyer KC и др. Количественный и качественный анализ риновирусной инфекции в тканях бронхов. Am J Respir Crit Care Med . 2005; 171: 645–651. [PubMed] [Google Scholar] 40. Саджан У, Ван Кью, Чжао Й, Грюнерт, округ Колумбия, Хершенсон МБ. Риновирус нарушает барьерную функцию поляризованных эпителиальных клеток дыхательных путей. Am J Respir Crit Care Med . 2008; 178: 1271–1281. [Бесплатная статья PMC] [PubMed] [Google Scholar] 41. Наклерио Р. М., Гордый Д., Лихтенштейн Л. М., Кагей-Соботка А., Хендли Дж. О., Соррентино Дж., Гвалтни Дж. М.. Кинины образуются во время экспериментальных риновирусных простуд. J Заразить Dis .1988. 157: 133–142. [PubMed] [Google Scholar] 42. Сеймур М.Л., Гилби Н., Бардин П.Г., Френкель Д.Д., Сандерсон Дж., Пенроуз Дж. Ф., Холгейт С.Т., Джонстон С.Л., Сэмпсон А.П. Риновирусная инфекция увеличивает содержание 5-липоксигеназы и циклооксигеназы-2 в образцах бронхиальной биопсии от субъектов без атопии. J Заразить Dis . 2002; 185: 540–544. [PubMed] [Google Scholar] 43. Proud D, Turner RB, Winther B, Wiehler S, Tiesman JP, Reichling TD, Juhlin KD, Fulmer AW, Ho BY, Walanski AA и др. Профили экспрессии генов во время инфицирования риновирусом человека in vivo: понимание ответа хозяина. Am J Respir Crit Care Med . 2008. 178: 962–968. [PubMed] [Google Scholar] 44. Льюис Т.К., Хендерсон Т.А., Карпентер А.Р., Рамирес И.А., МакГенри К.Л., Голдсмит А.М., Рен Х, Ментц Г.Б., Мукерджи Б., Робинс Т.Г. и др. Назальные цитокиновые реакции на естественные простуды у детей-астматиков. Clin Exp Allergy . 2012; 42: 1734–1744. [Бесплатная статья PMC] [PubMed] [Google Scholar] 45. Конно С., Гриндл К.А., Ли В.М., Шрот М.К., Моссер А.Г., Брокман-Шнайдер Р.А., Бусс В.В., Герн Дж. Э. Интерферон-гамма усиливает индуцированную риновирусом секрецию RANTES в эпителиальных клетках дыхательных путей человека. Am J Respir Cell Mol Biol . 2002; 26: 594–601. [PubMed] [Google Scholar] 46. Юта А., Дойл В.Дж., Гаумонд Э., Али М., Тамаркин Л., Баранюк Ю.Н., Ван Деузен М., Коэн С., Сконер Д.П. Риновирусная инфекция вызывает гиперсекрецию слизи. Am J Physiol . 1998; 274: L1017 – L1023. [PubMed] [Google Scholar] 47. Gern JE, Brockman-Schneider R, Bhattacharya S, Malter JS, Busse WW. Сыворотка и липопротеины низкой плотности усиливают секрецию интерлейкина-8 эпителиальными клетками дыхательных путей. Am J Respir Cell Mol Biol .2003. 29: 483–489. [PubMed] [Google Scholar] 48. Миллер Е.К., Лу Х, Эрдман Д.Д., Полинг К.А., Чжу Й., Гриффин М.Р., Хартерт Т.В., Андерсон Л.Дж., Вайнберг Г.А., Холл CB и др. Новая сеть эпиднадзора за вакцинами. Госпитализации детей раннего возраста, связанные с риновирусом. J Заразить Dis . 2007; 195: 773–781. [Бесплатная статья PMC] [PubMed] [Google Scholar] 49. DeMore JP, Weisshaar EH, Vrtis RF, Swenson CA, Evans MD, Morin A, Hazel E, Bork JA, Kakumanu S, Sorkness R и др. Подобные простуды у субъектов с аллергической астмой и у субъектов, не страдающих атопией, после инокуляции риновирусом-16. J Allergy Clin Immunol . 2009. 124: 245–252. [Бесплатная статья PMC] [PubMed] [Google Scholar] 50. Сообщение SD, Laza-Stanca V, Mallia P, Parker HL, Zhu J, Kebadze T., Contoli M, Sanderson G, Kon OM, Papi A, et al. Вызванное риновирусом заболевание нижних дыхательных путей увеличивается при астме и связано с вирусной нагрузкой и производством цитокинов Th2 / 2 и IL-10. Proc Natl Acad Sci USA . 2008. 105: 13562–13567. [Бесплатная статья PMC] [PubMed] [Google Scholar] 51. Simons E, Schroth MK, Gern JE. Анализ трахеального секрета на риновирус при естественных простудных заболеваниях. Pediatr Allergy Immunol . 2005. 16: 276–278. [PubMed] [Google Scholar] 52. Ю Дж.К., Ким Т.С., Хафффорд ММ, Брасиале Т.Дж. Вирусная инфекция легких: реакция хозяина и последствия. J Allergy Clin Immunol . 2013; 132: 1263–1276. [Викторина, стр. 1277.]. [Бесплатная статья PMC] [PubMed] [Google Scholar] 54. Пападопулос Н.Г., Станчу Л.А., Папи А., Холгейт СТ, Джонстон С.Л. Вызванные риновирусом изменения фенотипа мононуклеарных клеток периферической крови и экспрессии костимулирующих молекул у нормальных и атопических астматиков. Clin Exp Allergy . 2002; 32: 537–542. [PubMed] [Google Scholar] 55. Gehlhar K, Bilitewski C, Reinitz-Rademacher K, Rohde G, Bufe A. Нарушение вызванного вирусом высвобождения интерферона-альфа2 у взрослых пациентов с астмой. Clin Exp Allergy . 2006; 36: 331–337. [PubMed] [Google Scholar] 56. Сайкс А., Эдвардс М.Р., Макинтайр Дж., Дель Росарио А., Бахсолиани Е., Трухильо-Торральбо МБ, Кон О.М., Маллиа П., Макхейл М., Джонстон С.Л. Индуцированные риновирусом 16 IFN-α и IFN-β дефицитны в клетках бронхоальвеолярного лаважа у пациентов с астмой. J Allergy Clin Immunol . 2012; 129: 1506–1514. e6. [PubMed] [Google Scholar] 57. Gill MA, Bajwa G, George TA, Dong CC, Dougherty II, Jiang N, Gan VN, Gruchalla RS. Противорегуляция между путем FcepsilonRI и противовирусными ответами в плазматических дендритных клетках человека. Дж Иммунол . 2010. 184: 5999–6006. [Бесплатная статья PMC] [PubMed] [Google Scholar] 58. Wark PA, Johnston SL, Bucchieri F, Powell R, Puddicombe S, Laza-Stanca V, Holgate ST, Davies DE. Эпителиальные клетки бронхов при астме имеют недостаточный врожденный иммунный ответ на инфекцию риновирусом. J Exp Med . 2005; 201: 937–947. [Бесплатная статья PMC] [PubMed] [Google Scholar] 59. Contoli M, Message SD, Laza-Stanca V, Edwards MR, Wark PA, Bartlett NW, Kebadze T., Mallia P, Stanciu LA, Parker HL, et al. Роль дефицитной продукции интерферона-лямбда III типа в обострениях астмы. Нат Мед . 2006; 12: 1023–1026. [PubMed] [Google Scholar] 60. Эдвардс М.Р., Регейми Н., Варель М., Кенингер Э., Гупта А., Шумарк А., Саглани С., Сайкс А., Макинтайр Дж., Дэвис Дж. И др. Нарушение индукции врожденного интерферона у детей с атопической астмой, устойчивой к тяжелой терапии. Иммунол слизистой оболочки . 2013; 6: 797–806. [Бесплатная статья PMC] [PubMed] [Google Scholar] 61. Сайкс А., Макинтайр Дж., Эдвардс М.Р., Дель Росарио А., Хаас Дж., Гилен В., Кон О.М., Макхейл М., Джонстон С.Л. Вызванная риновирусом продукция интерферона не является недостаточной при хорошо контролируемой астме. Грудь . 2014; 69: 240–246. [PubMed] [Google Scholar] 62. Лопес-Соуза Н., Фаворето С., Вонг Х., Уорд Т., Яги С., Шнурр Д., Финкбайнер В.Е., Долганов Г.М., Виддикомб Дж. Х., Буши Х.А. и др. Восприимчивость к риновирусной инфекции in vitro выше для бронхов, чем для эпителиальных клеток носовых дыхательных путей у людей. J Allergy Clin Immunol . 2009; 123: 1384–1390.e2. [Бесплатная статья PMC] [PubMed] [Google Scholar] 63. Бочков Ю.А., Хансон К.М., Келес С., Брокман-Шнайдер Р.А., Ярджур Н.Н., Герн Й.Е. Риновирус-индуцированная модуляция экспрессии генов в эпителиальных клетках бронхов у пациентов с астмой. Иммунол слизистой оболочки . 2010; 3: 69–80. [Бесплатная статья PMC] [PubMed] [Google Scholar] 64. Кеннеди Дж. Л., Шейкер М., МакМин В., Герн Дж., Карпер Х., Мерфи Д., Ли В. М., Бочков Ю. А., Вртис Р. Ф., Платтс-Миллс Т. и др. Сравнение вирусной нагрузки у людей с астмой и без нее во время инфекций риновирусом. Am J Respir Crit Care Med . 2014; 189: 532–539. [Бесплатная статья PMC] [PubMed] [Google Scholar] 65. Patel DA, You Y, Huang G, Byers DE, Kim HJ, Agapov E, Moore ML, Peebles RS, Jr, Castro M, Sumino K, et al. Реакция на интерферон и контроль респираторных вирусов сохраняются в эпителиальных клетках бронхов при астме. J Allergy Clin Immunol . 2014; 134: 1402–1412.e7. [Бесплатная статья PMC] [PubMed] [Google Scholar] 67. Schwantes EA, Manthei DM, Denlinger LC, Evans MD, Gern JE, Jarjour NN, Mathur SK.Экспрессия гена интерферона в клетках мокроты коррелирует с индексом астмы во время обострений, вызванных вирусом. Clin Exp Allergy . 2014; 44: 813–821. [Бесплатная статья PMC] [PubMed] [Google Scholar] 68. Миллер EK, Эрнандес JZ, Wimmenauer V, Shepherd BE, Hijano D, Libster R, Serra ME, Bhat N, Batalle JP, Mohamed Y, et al. Механистическая роль IFN-λ1 типа III в обострениях астмы, опосредованных риновирусами человека. Am J Respir Crit Care Med . 2012; 185: 508–516. [Бесплатная статья PMC] [PubMed] [Google Scholar] 69.Тверски-младший, Ле ТВ, Биенеман А.П., Чичестер К.Л., Гамильтон Р.Г., Шредер Дж.Т. У дендритных клеток крови человека от субъектов с аллергией нарушена способность продуцировать интерферон-альфа через Toll-подобный рецептор 9. Clin Exp Allergy . 2008; 38: 781–788. [Бесплатная статья PMC] [PubMed] [Google Scholar] 70. Upham JW, Zhang G, Rate A, Еркович ST, Kusel M, Sly PD, Holt PG. Плазмацитоидные дендритные клетки в младенчестве обратно связаны с инфекциями дыхательных путей и хрипом у детей. J Allergy Clin Immunol .2009; 124: 707–713.e2. [PubMed] [Google Scholar] 71. Дуррани С.Р., Монтвилл Д.Д., Пратт А.С., Саху С., ДеВрис М.К., Раджаманикам В., Гангнон Р.Э., Гилл М.А., Герн Дж.Э., Леманске Р.Ф., младший и др. Врожденный иммунный ответ на риновирус снижается высокоаффинным рецептором IgE у детей с аллергической астмой. J Allergy Clin Immunol . 2012; 130: 489–495. [Бесплатная статья PMC] [PubMed] [Google Scholar] 72. Причард А.Л., Кэрролл М.Л., Бурел Дж. Г., Уайт О. Дж., Фиппс С., Упхэм Дж. У. Врожденные IFN и плазматические дендритные клетки ограничивают ответы цитокинов Th3 на риновирус: регуляторный механизм, имеющий отношение к астме. Дж Иммунол . 2012; 188: 5898–5905. [PubMed] [Google Scholar] 73. Гилен В., Сайкс А., Чжу Дж., Чан Б., Макинтайр Дж., Регейми Н., Кенингер Е., Гупта А., Шумарк А., Босли С. и др. Повышенный ядерный супрессор передачи сигналов цитокинов 1 в астматическом бронхиальном эпителии подавляет индукцию риновирусом врожденных интерферонов J Allergy Clin Immunol [онлайн до публикации] 25 января 2015 г .; DOI: 10.1016 / j.jaci.2014.11.039. [Бесплатная статья PMC] [PubMed] [Google Scholar] 74. Корфхаген Т.Р., Китцмиллер Дж., Чен Дж., Шридхаран А., Хайчи Х.М., Хегде Р.С., Диванович С., Карп С.Л., Уитсетт Дж.SAM-заостренный домен ETS-фактор опосредует присущую эпителиальным клеткам передачу сигналов врожденного иммунитета во время метаплазии слизистой дыхательных путей. Proc Natl Acad Sci USA . 2012; 109: 16630–16635. [Бесплатная статья PMC] [PubMed] [Google Scholar] 75. Chen G, Korfhagen TR, Karp CL, Impey S, Xu Y, Randell SH, Kitzmiller J, Maeda Y, Haitchi HM, Sridharan A, et al. Foxa3 индуцирует метаплазию бокаловидных клеток и подавляет врожденный противовирусный иммунитет. Am J Respir Crit Care Med . 2014; 189: 301–313. [Бесплатная статья PMC] [PubMed] [Google Scholar] 76.Корн Дж. М., Маршалл С., Смит С., Шрайбер Дж., Сандерсон Дж., Холгейт С.Т., Джонстон С.Л. Частота, тяжесть и продолжительность риновирусных инфекций у астматиков и неастматиков: продольное когортное исследование. Ланцет . 2002; 359: 831–834. [PubMed] [Google Scholar] 77. Holgate ST. Дисфункция эпителия при астме. J Allergy Clin Immunol . 2007; 120: 1233–1244, викторина 1245–1246. [PubMed] [Google Scholar] 78. Мейер Н., Акдис CA. Фактор роста эндотелия сосудов как ключевой индуктор ангиогенеза в дыхательных путях при астме. Curr Allergy Asthma Rep . 2013; 13: 1–9. [PubMed] [Google Scholar] 79. Лопес-Соуза Н., Долганов Г., Дубин Р., Сакс Л. А., Сассина Л., Спорер Н., Яги С., Шнурр Д., Боуши Н. А., Виддикомб Дж. Х. Устойчивость дифференцированного эпителия дыхательных путей человека к инфекции риновирусом. Am J Physiol Lung Cell Mol Physiol . 2004; 286: L373 – L381. [PubMed] [Google Scholar] 80. Jakiela B, Brockman-Schneider R, Amineva S, Lee WM, Gern JE. Базальные клетки дифференцированного эпителия бронхов более восприимчивы к риновирусной инфекции. Am J Respir Cell Mol Biol . 2008. 38: 517–523. [Бесплатная статья PMC] [PubMed] [Google Scholar] 81. Busse WW, Morgan WJ, Gergen PJ, Mitchell HE, Gern JE, Liu AH, Gruchalla RS, Kattan M, Teach SJ, Pongracic JA, et al. Рандомизированное испытание омализумаба (анти-IgE) для лечения астмы у детей из городских районов. N Engl J Med . 2011; 364: 1005–1015. [Бесплатная статья PMC] [PubMed] [Google Scholar] 82. Халдар П., Брайтлинг К.Э., Харгадон Б., Гупта С., Монтейро В., Суза А., Маршалл Р.П., Брэддинг П., Грин Р.Х., Вардлоу А.Дж. и др.Меполизумаб и обострения рефрактерной эозинофильной астмы. N Engl J Med . 2009; 360: 973–984. [Бесплатная статья PMC] [PubMed] [Google Scholar] 83. Джуканович Р., Харрисон Т., Джонстон С.Л., Габбей Ф., Уорк П., Томсон Н.К., Нивен Р., Сингх Д., Реддел Г.К., Дэвис Д.Е. и др. Исследовательская группа INTERCIA. Влияние ингаляционного IFN-β на ухудшение симптомов астмы, вызванных вирусными инфекциями. Рандомизированное испытание. Am J Respir Crit Care Med . 2014; 190: 145–154. [Бесплатная статья PMC] [PubMed] [Google Scholar]Взаимодействие вирусов и аллергенов при обострении астмы
Ann Am Thorac Soc.2015 ноя; 12 (Дополнение 2): S137 – S143.
Департамент педиатрии и Департамент медицины, Университет Висконсин-Мэдисон, Мэдисон, Висконсин
Автор для переписки. Перепечатку следует направлять Джеймсу Э. Герну, доктору медицины, K4 / 918 CSC, 600 Highland Avenue, Мэдисон, Висконсин 53792-9988. Электронная почта: ude.csiw.enicidem@nregПоступила в редакцию 16 марта 2015 г .; Принято 21 апреля 2015 г.
Авторское право © 2015 г. Американского торакального обществаAbstract
Аллергия и вирусные респираторные инфекции давно признаны двумя наиболее важными факторами риска обострений астмы. Эти наблюдения подняли вопросы относительно потенциального взаимодействия между этими двумя важными факторами риска. Например, снижает ли аллергия противовирусный ответ, способствуя тем самым обострениям астмы? С другой стороны, могут ли вирусные респираторные инфекции усиливать продолжающееся аллергическое воспаление в дыхательных путях? Ответы на эти вопросы могут иметь значение для профилактики и лечения обострений астмы.В этой статье рассматриваются клинические данные, связывающие вирусные инфекции и аллергию с обострениями астмы, рассматриваются возможные взаимодействия между этими двумя факторами риска и обсуждается возможное применение новых идей о взаимодействии вирусов и аллергенов для профилактики и лечения обострений астмы.
Ключевые слова: астма, риновирус, аллергия, интерферон
Обострения астмы составляют значительную часть заболеваемости и расходов, связанных с астмой.Обострения астмы остаются одной из наиболее частых причин госпитализации и влекут за собой дополнительные психологические и финансовые затраты, связанные с пропуском работы и учебы. В США в 2009 г. было 479 000 госпитализаций по поводу астмы, средняя продолжительность пребывания в больнице составила 4,3 дня, а уровень смертности составил 0,77 на 100 000 населения (1). Общие расходы на лечение астмы оценивались в 20 миллиардов долларов в год, и значительная часть этих затрат приходится на обострения. Затраты на медицинское обслуживание, связанные с обострениями астмы, были недавно подсчитаны для пациентов с умеренной и тяжелой астмой в большом U.База данных С. здравоохранения. Пациенты с обострениями астмы примерно вдвое превышали общие расходы на здравоохранение (9 223 доллара против 5 011 долларов) и расходы, связанные с астмой (1740 долларов против 847 долларов), по сравнению с подобранными пациентами без обострений ( P <0,0001) (2). Эти данные показывают, что личные и социальные издержки обострений астмы огромны и служат стимулом для разработки более эффективных стратегий профилактики и улучшенного лечения.
Факторы риска обострений астмы
Большинство обострений у детей и не менее половины обострений у взрослых, страдающих астмой, связаны с вирусной респираторной инфекцией (ВРИ) (3–5).Однако исследования детей школьного возраста, которые сдали обычные образцы в месяцы с высокой распространенностью, показывают, что ВРИ почти повсеместны у детей, независимо от астмы (6, 7). Многие вирусные инфекции вызывают легкие симптомы или их отсутствие даже у детей, страдающих астмой. Таким образом, вирусные инфекции, по-видимому, способствуют большинству обострений астмы, но сами по себе обычно недостаточны, чтобы вызвать обострения астмы. Действительно, существуют факторы риска или воздействие окружающей среды, которые могут либо усилить тяжесть ВРИ, либо действовать синергетически с ВРИ, вызывая обструкцию дыхательных путей и острые симптомы нижних дыхательных путей.
Факторы риска обострения астмы включают факторы, связанные с человеком, окружающей средой и инфекционным агентом. К личным факторам риска относятся тяжесть астмы и степень контроля, приверженность медикаментозному лечению и аллергия. Воздействие окружающей среды, которое может действовать вместе с вирусной инфекцией, способствуя обострению, включает загрязняющие вещества, раздражители и, для аллергиков, аллергены (8, 9). Бактериальные инфекции также могут способствовать возникновению острых хрипов и обострений астмы (6, 10).Вероятно, что множественные факторы способствуют возникновению большинства обострений, и эти факторы риска являются аддитивными и / или синергическими. К факторам риска обострений чаще всего относятся аллергия и вирусная инфекция, которые являются предметом настоящего обзора.
Клинические исследования аллергии и обострений астмы, вызванных вирусами
Сочетание аллергической сенсибилизации и вирусных заболеваний значительно увеличивает риск обострения астмы и госпитализации. В серии исследований, проведенных в Университете Вирджинии, дети с эпизодами острого свистящего дыхания оценивались в отделениях неотложной помощи, включая отделения неотложной помощи (11, 12) и стационарное отделение больницы (4).В этих исследованиях аллергическая сенсибилизация и риновирусная (RV) инфекция были значимыми факторами риска хрипов (отношение шансов [OR], 3,2 и 4,4, соответственно). Дети, у которых была выявлена инфекция правого желудочка в сочетании либо с сенсибилизацией к обычным аэроаллергенам, либо с эозинофилией, имели самые высокие шансы на свистящее дыхание (OR, 17 и 25 соответственно) (11). Эти же отношения справедливы и для детей в Коста-Рике, у которых наибольший риск хрипов наблюдался среди детей, которые были высокочувствительны к клещу домашней пыли и дали положительный результат на RV (OR на хрипы, 31.5; 95% доверительный интервал 8,3–108; P <0,001) (13). Примечательно, что аллергическая сенсибилизация увеличивает риск одышки респираторными вирусами даже в дошкольном возрасте (14, 15). Вместе взятые, эти результаты показывают, что инфекции правого желудочка вносят вклад в большинство заболеваний свистящего дыхания в детстве и что аллергическая сенсибилизация или эозинофильное воспаление дыхательных путей дополнительно увеличивает риск заболеваний свистящего дыхания.
Другие исследования выявили взаимодействия между VRI, аллергией и воздействием аллергенов, вызывающими заболевания свистящего дыхания.В исследовании «случай-контроль» острых обострений по сравнению с пациентами со стабильной астмой и детьми, госпитализированными с диагнозом, не связанным с респираторными заболеваниями, вирусная инфекция, аллергия и воздействие соответствующего аллергена были независимо связаны с обострениями (8). Сочетание этих факторов риска привело к выраженному риску госпитализации (OR, 19,4; P <0,001). Подобные результаты были получены у взрослых с астмой (9).
Вирусные факторы
РВ наиболее тесно связаны с обострениями астмы у детей и взрослых.Грипп, коронавирусы, вирусы парагриппа и другие вирусы выявляются с меньшей частотой во время обострений. Связана ли эта тесная связь с определенным свойством ПЖ или просто отражает очень общую природу инфекций ПЖ, не совсем ясно.
RV Виды и вирулентность
RV включают три вида из рода Enterovirus . Виды A и B были впервые обнаружены в 1950-х годах, а первый вирус вида C был зарегистрирован в 2006 году после обнаружения с помощью молекулярных методов (16, 17).Дополнительные исследования с использованием подобных подходов с тех пор сообщили о более чем 50 новых типах C, а также о ряде дополнительных типов A и B (18–20). Долгая задержка в обнаружении типов C была связана с невозможностью культивировать эти вирусы, которые присутствовали так же долго, как и другие виды RV (21). Вирусы RV-C можно выращивать в органной культуре слизистой оболочки носовых пазух (22) и в первичных клетках, дифференцированных на границе раздела воздух-жидкость (23, 24). Кроме того, типы RV-C могут быть получены методами обратной генетики путем трансфекции клеток вирусной РНК, транскрибируемой с плазмид (22, 25).Моделирование структуры капсида RV предполагает, что платформа связывания рецепторов для RV-C отличается от платформы для связывания RV-A и RV-B (26), и на самом деле типы RV-C используют уникальный (и пока не идентифицированный) рецептор для войти в ячейки (22). На сегодняшний день не существует клеточных линий (кроме клеток поверхности раздела воздух-жидкость), которые поддерживают инфекцию RV-C (ссылки 23 и 24 и наши неопубликованные данные).
Заметное генетическое разнообразие типов RV предполагает, что тип или виды RV могут влиять на вирулентность. В исследованиях «случай-контроль» RV-C и в некоторых исследованиях RV-A чрезмерно представлены у детей с инфекциями нижних дыхательных путей по сравнению с детьми с инфекциями верхних дыхательных путей или без симптомов (21, 27–34).Точно так же RV-B в семь-восемь раз реже вызывает респираторное заболевание средней и тяжелой степени, чем другие виды RV у младенцев (35). Наконец, у маленьких детей, которые хрипят из-за инфекции RV-C, более вероятно развитие рецидивов хрипов, чем у детей, которые хрипят из-за других вирусов (28).
Почему вирусы RV-C и RV-A с большей вероятностью вызывают обострения астмы, чем RV-B, неясно и может быть связано с рядом генетических, структурных и функциональных различий между видами RV.Например, большинство RV лучше всего растут при температуре от 33 до 35 ° C, и это свойство может ограничивать их распространение в небольшие дыхательные пути в легких. Напротив, типы RV-C одинаково хорошо растут при 33, 35 и 37 ° C (23). Рост при более высоких температурах может способствовать ассоциации между инфекцией RV-C и заболеванием нижних дыхательных путей. Кроме того, существуют различия между типами и видами RV, связанными с функцией вирусных протеаз, которые важны для управления репликацией вируса и ингибирования ключевых метаболических процессов в клетках-хозяевах (36).Кроме того, исследований in vitro продемонстрировали, что RV-B реплицируется медленнее и связан со снижением цитопатических эффектов и индукцией секреции цитокинов, чем RV-A и RV-C (37).
В совокупности эти данные предполагают, что более низкие скорости репликации RV-B и индукции цитокинов могут способствовать снижению вирулентности. Биохимия протеазы 2А, связанная с биологическими видами, соответствует снижению репликации и воспалительной реакции. Наконец, относительная нечувствительность RV-C к температуре может дать этому вирусу преимущество в возникновении инфекций нижних дыхательных путей.
Как инфекции правого желудочка вызывают обострение астмы?
VRI могут вызывать респираторные заболевания, повреждая эпителиальные клетки и другие структурные клетки и вызывая воспалительные реакции, которые вторично вызывают дисфункцию дыхательных путей и вызывают симптомы болезни. Поскольку инфекции правого желудочка обычно поражают небольшой процент эпителиальных клеток дыхательных путей (38, 39), а лизис клеток, как правило, не является обширным, вполне вероятно, что воспалительный ответ является основным фактором, вызывающим простуду и обострение астмы, вызванной ПЖ.Несмотря на то, что лизис клеток ограничен, ПЖ может нарушать барьерную функцию эпителиальных клеток, что приводит к повышенной проницаемости для макромолекул и способствует вторичной инфекции бактериями дыхательных путей (40).
В ряде исследований были выявлены воспалительные процессы, вызванные RV, которые, вероятно, способствуют дисфункции и появлению симптомов дыхательных путей. RV индуцирует цитокины острой фазы (например, IL-1β и интерфероны I типа) и медиаторы (простагландины, кинины), которые могут вызывать недомогание и миалгию (41, 42). RV активирует нервные пути, которые способствуют чиханию и кашлю, посредством механизмов, которые могут включать клеточное воспаление и высвобождение цитокинов и медиаторов.Инфекция RV заставляет эпителиальные клетки секретировать хемокины, которые способствуют привлечению воспалительных клеток (43, 44). Секреция эпителиальных хемокинов усиливается интерферонами, происходящими из мононуклеарных клеток (45). Во время ранней фазы простуды сывороточные жидкости и белки просачиваются в дыхательные пути (46), и, в свою очередь, липопротеины низкой плотности могут стимулировать секрецию хемокинов эпителиальными клетками (47). На последних стадиях инфекции секреция слизи увеличивается (46).
Долгое время считалось, что инфекции правого желудочка ограничиваются верхними дыхательными путями, но теперь есть убедительные доказательства того, что ПЖ может также инфицировать нижние дыхательные пути.Например, RV может быть единственным патогеном, обнаруживаемым в секретах нижних дыхательных путей у детей с пневмонией (48). После экспериментальной инокуляции серонегативных добровольцев ПЖ обнаруживается в секретах нижних дыхательных путей примерно у половины участников исследования, независимо от наличия астмы (39, 49). Пики выделения вируса из верхних дыхательных путей достигаются через 2–4 дня после инокуляции, а у субъектов с инфекциями нижних дыхательных путей выделение вируса из нижних дыхательных путей обычно отстает на несколько дней (49, 51). В образцах биопсии инфицированные RV клетки могут быть обнаружены в крупных нижних дыхательных путях в виде пятен, напоминающих паттерны в верхних дыхательных путях (39).Наконец, ПЖ был обнаружен в секретах нижних дыхательных путей у детей с трахеостомией (51). Как только ПЖ поражает нижние дыхательные пути, последствия инфекции, вероятно, будут аналогичны последствиям, вызванным инфекцией верхних дыхательных путей, и включают усиление секреции дыхательных путей, отек слизистой оболочки и клеточные воспалительные реакции. В совокупности эти эффекты, вероятно, способствуют обструкции дыхательных путей.
Механизмы взаимодействия вирусов и аллергии
Уменьшает ли аллергия противовирусный ответ?
Тесная связь между аллергическим заболеванием дыхательных путей и обострениями астмы, вызванными вирусами, позволяет предположить, что респираторные аллергии каким-то образом подавляют противовирусные реакции.Интерфероны являются одним из краеугольных камней врожденной противовирусной защиты от респираторных вирусов (52, 53). Из множества источников получены данные о том, что индуцированные вирусом интерфероновые ответы мононуклеарных клеток периферической крови (54, 55), мононуклеарных клеток дыхательных путей (57) и плазмоцитоидных дендритных клеток (pDC) (57) снижаются при астме. Кроме того, некоторые исследования показывают, что астма связана со снижением индуцированной вирусом продукции IFN-β и IFN-λ эпителиальными клетками (58, 59). Недостаточный ответ эпителиального интерферона может быть свойством более тяжелой астмы (60), потому что ответы на интерферон у субъектов с легкой формой астмы кажутся нормальными (49, 61).Также имеются данные о том, что недостаточный противовирусный ответ при астме может ограничиваться легкими (55), что позволяет предположить, что воспаление 2 типа может ингибировать индуцированные вирусом ответы на интерферон. Соответственно, некоторые исследования эпителиальных клеток дыхательных путей ex vivo , исключенных из потенциальных иммуномодулирующих эффектов других клеток дыхательных путей (например, клеток ILC2 и Th3), продемонстрировали нормальный вирус-индуцированный ответ интерферона (62–65). В любом случае вполне вероятно, что ранний вирус-индуцированный интерфероновый ответ является важным фактором, определяющим последующее течение инфекции и болезни.Между прочим, кинетика индуцированного вирусом ответа интерферона, вероятно, будет иметь значение. Слишком мало интерферона на ранних этапах инфекции может привести к неограниченной репликации вируса, тогда как чрезмерная секреция интерферона во время пика болезни (в ответ на репликацию вируса высокого уровня) может усугубить бремя симптомов (66–68). Недавно были описаны два возможных механизма ингибирования противовирусного ответа аллергического воспаления, которые рассматриваются в следующих разделах.
Высокоаффинные рецепторы IgE и ответы на интерферон
Аллергическое воспаление может подавлять врожденный противовирусный иммунитет при некоторых условиях (69). Например, плазматические дендритные клетки секретируют высокие уровни интерферонов типа I и III и являются важными клетками в противовирусном ответе в легких (70) (). Интересно, что эти клетки экспрессируют высокоаффинный рецептор IgE (FcεRI), который может регулировать противовирусные ответы. Экспрессия FcεRI на поверхности клетки обратно пропорциональна вирусной индукции интерферона (57).Кроме того, перекрестное связывание FcεRI заметно ухудшает ответы интерферона типа I и типа III на вирус гриппа или RV (57, 71). Эти данные свидетельствуют о том, что IgE-опосредованное аллергическое воспаление может ингибировать противовирусные реакции в КПК, патрулирующих эпителий дыхательных путей. В свою очередь, секреция интерферона pDC во время вирусных инфекций может подавлять ответы Th3 (72) и, таким образом, выполняет как противовирусную, так и иммуномодулирующую функции.
Высокоаффинные рецепторы IgE (FcεRI) на плазматических дендритных клетках и влияние на интерфероновые ответы.В отсутствие аллергии плазмацитоидные дендритные клетки (pDC) экспрессируют низкие уровни FcεRI на клеточной поверхности, и некоторые из этих рецепторов заняты IgE. Инфекция риновирусом (RV) побуждает pDC секретировать IFN-α и IFN-λ, которые ингибируют репликацию вируса аутологичным и паракринным образом. В контексте аллергии с воздействием аллергена FcεRI и IgE увеличиваются, и перекрестное связывание рецепторов аллергеном может ингибировать секрецию интерферона. Конечным результатом астмы может быть усиление репликации вирусов, более тяжелое заболевание и повышенный риск обострения хронической астмы.Рисунок любезно предоставлен Уильямом В. Буссом, доктором медицины, Университет Висконсин-Мэдисон.
Клеточная сигнализация, аллергия и противовирусные ответы
Внутриклеточные сигнальные механизмы также могут способствовать индуцированному аллергией подавлению противовирусных ответов. Супрессор передачи сигналов цитокинов (SOCS) 1 экспрессируется эпителиальными клетками дыхательных путей и может подавлять интерферон и другие цитокины. SOCS1 повышается в ядрах эпителиальных клеток дыхательных путей при астме, и этот эффект может способствовать снижению индуцированных вирусом ответов интерферона (73).Кроме того, в эпителиальных клетках аллергическое воспаление и инфекция RV могут вызывать метаплазию слизи посредством механизмов, которые включают индукцию факторов транскрипции, белка A3 (FOXA3) и заостренного домена SAM, содержащего фактор транскрипции ETS (SPDEF) (74). Экспрессия FOXA3 в эпителиальных клетках может также ингибировать интерфероны I типа и другие противовирусные реакции и усиливать экспрессию проаллергических факторов, таких как стромальный лимфопоэтин тимуса (75). Во время острых вирусных инфекций функция FOXA3 может заключаться в ограничении воспалительных реакций по мере разрешения инфекции, но хроническая экспрессия в контексте аллергического воспаления может вместо этого подавлять противовирусные реакции, потенциально приводя к более тяжелому заболеванию (75).
Усиливают ли инфекции желудочно-кишечного тракта продолжающееся аллергическое воспаление дыхательных путей?
В продольном исследовании совместно проживающих пар, которые не были согласны по поводу астмы, астма была связана с аналогичными индуцированными RV симптомами верхних дыхательных путей, но более серьезными симптомами нижних дыхательных путей (76). Это открытие предполагает, что различия в окружающей среде нижних дыхательных путей могут быть причиной повышенной тяжести заболевания при астме. Некоторые особенности нижних дыхательных путей могут способствовать увеличению тяжести заболеваний правого желудочка.Структурные и физиологические изменения, связанные с аллергическим воспалением дыхательных путей, включают гиперплазию бокаловидных клеток, гиперемию, гиперчувствительность дыхательных путей и сужение дыхательных путей (77, 78). Соответственно, стимуляция секреции слизи при ПЖ может быть хуже в дыхательных путях с большим количеством секретирующих слизь клеток, гиперемия, связанная с астмой, может усиливать вызванный вирусом отек и транссудат, а бронхоспазм может усиливаться в гиперреактивных дыхательных путях. Эти эффекты вместе могут способствовать сужению и закрытию дыхательных путей, что приводит к уменьшению воздушного потока и увеличению риска обострения.
Эпителий имеет ряд врожденных механизмов противовирусной защиты, а интактный, хорошо дифференцированный эпителий относительно устойчив к инфекции RV (79). Аллергическое воспаление дыхательных путей при астме может нарушать функцию эпителиального барьера, и исследований in vitro показывают, что репликация правого желудочка усиливается, когда апикальные клетки хорошо дифференцированных культур эпителиальных клеток либо повреждаются, либо удаляются (80). Таким образом, снижение барьерной функции при астме может привести к более тяжелым инфекциям правого желудочка.
Значение для профилактики и лечения
Стандартные схемы лечения астмы не полностью контролируют обострения, поэтому необходимы новые подходы. В большинстве случаев обострения носят многофакторный характер, и сочетание вирусной инфекции и аллергии является двумя наиболее частыми причинами. Это наблюдение предполагает, что борьба с аллергическим воспалением и усиление противовирусных реакций могут быть эффективными подходами к снижению частоты и тяжести обострений астмы.
Омализумаб связывается с Fc-частью IgE, чтобы предотвратить связывание с клеточной поверхностью и блокировать активацию клеток через высокоаффинный рецептор IgE FcεRI. В рандомизированном плацебо-контролируемом исследовании лечения астмы на основе рекомендаций по сравнению с омализумабом, добавленным к стандартной терапии, омализумаб предотвращал сезонные пики обострений осенью и весной (81). Назальные выделения, полученные во время обострений, были проанализированы на наличие вирусов, и эти данные подтвердили, что в группе лечения было меньше вирусных, а также невирусных обострений.Результаты этого интервенционного исследования показывают, что IgE-опосредованное воспаление способствует вирус-индуцированным обострениям астмы. Полученные данные также повышают вероятность того, что другие препараты, нацеленные на воспаление 2 типа (например, меполизумаб и ИЛ-5 [82]), также могут подавлять вирус-индуцированные обострения.
Другой новый подход заключался в использовании ингаляционного IFN-β для усиления противовирусного ответа в слизистой оболочке дыхательных путей. Добровольцы со стойкой астмой и в анамнезе обострения простуды были рандомизированы для лечения либо распыленным IFN-β, либо плацебо в течение 24 часов после появления симптомов простуды (83).Лечение IFN-β не уменьшало количество симптомов астмы (первичный результат) в популяции, собирающейся лечиться; однако были отмечены три положительных результата. Во-первых, IFN-β хорошо переносился и индуцировал маркеры противовирусной защиты в крови и мокроте. Во-вторых, лечение IFN-β приводило к увеличению пикового выдоха по сравнению с плацебо. Наконец, у испытуемых с более тяжелой астмой (этапы 4 и 5 Британского торакального общества) IFN-β снижал вероятность того, что простуда приведет к обострениям. Если эти данные подтвердятся, ингаляционный IFN-β может быть полезен для предотвращения обострений астмы, вызванных простудными заболеваниями, у пациентов с более тяжелой астмой.
Выводы
Клинические исследования определили аллергию и вирусные инфекции как основные факторы риска обострения астмы. Эти результаты привели к новым подходам к профилактике обострений, основанным на блокировании аллергических механизмов, и удвоили усилия по усилению противовирусной защиты в дыхательных путях. Понимание того, как аллергия и другие факторы риска способствуют обострениям астмы, вызванным вирусами, остается важной целью. Достижения в этой области могут дать дополнительную информацию о патогенезе обострений астмы и последовательно привести к более совершенным подходам к профилактике или лечению обострений астмы.
Ссылки
1. Национальные институты здоровья / Национальный институт сердца, легких и крови. Bethesda, MD: 2012. Сборник диаграмм 2012 года по сердечно-сосудистым, легочным и кровяным заболеваниям. [Google Scholar] 2. Иванова Ю.И., Бергман Р., Бирнбаум Х.Г., Колис Г.Л., Сильверман Р.А., Маклаурин К. Влияние обострений астмы на расходы на здравоохранение среди астматических пациентов с умеренной и тяжелой персистирующей астмой. J Allergy Clin Immunol . 2012; 129: 1229–1235. [PubMed] [Google Scholar] 3. Джонстон С.Л., Паттемор П.К., Сандерсон Г., Смит С., Лампе Ф., Джозефс Л., Симингтон П., О’Тул С., Мьинт С.Х., Тиррелл Д.А. и др.Общественное исследование роли вирусных инфекций в обострениях астмы у детей 9-11 лет. BMJ . 1995; 310: 1225–1229. [Бесплатная статья PMC] [PubMed] [Google Scholar] 4. Heymann PW, Carper HT, Murphy DD, Platts-Mills TA, Patrie J, McLaughlin AP, Erwin EA, Shaker MS, Hellems M, Peerzada J, et al. Вирусные инфекции в зависимости от возраста, атопии и сезона госпитализации среди детей, госпитализированных по поводу хрипов. J Allergy Clin Immunol . 2004. 114: 239–247. [Бесплатная статья PMC] [PubMed] [Google Scholar] 6.Kloepfer KM, Lee WM, Pappas TE, Kang TJ, Vrtis RF, Evans MD, Gangnon RE, Бочков Ю.А., Джексон DJ, Lemanske RF, Jr, Gern JE. Обнаружение патогенных бактерий при риновирусной инфекции связано с усилением респираторных симптомов и обострениями астмы. J Allergy Clin Immunol . 2014; 133: 1301–1307.e1–3. [Бесплатная статья PMC] [PubMed] [Google Scholar] 7. Оленек Дж. П., Ким В. К., Ли В. М., Ван Ф., Папас Т. Е., Салазар Л. Е., Эванс М. Д., Борк Дж., Роберг К., Леманске Р. Ф. младший и др. Еженедельное наблюдение за детьми, страдающими астмой, на предмет инфекций и болезней в сезон простуд. J Allergy Clin Immunol . 2010; 125: 1001–1006, e1. [Бесплатная статья PMC] [PubMed] [Google Scholar] 8. Мюррей С.С., Полетти Г., Кебадзе Т., Моррис Дж., Вудкок А., Джонстон С.Л., Кустович А. Изучение изменяемых факторов риска обострений астмы: вирусная инфекция и воздействие аллергенов увеличивают риск госпитализации астмы у детей. Грудь . 2006. 61: 376–382. [Бесплатная статья PMC] [PubMed] [Google Scholar] 9. Грин Р.М., Кустович А., Сандерсон Дж., Хантер Дж., Джонстон С.Л., Вудкок А.Синергизм между аллергенами и вирусами и риск госпитализации с астмой: исследование случай-контроль. BMJ . 2002; 324: 763–766A. [Бесплатная статья PMC] [PubMed] [Google Scholar] 10. Бисгаард Х., Хермансен М.Н., Бённеликке К., Стокгольм Дж., Баты Ф., Скайтт Н.Л., Анищенко Дж., Кебадзе Т., Джонстон С.Л. Связь бактерий и вирусов с эпизодами свистящего дыхания у детей раннего возраста: проспективное когортное исследование при рождении. BMJ . 2010; 341: c4978. [Бесплатная статья PMC] [PubMed] [Google Scholar] 11. Грабли Г. П., Арруда Э., Инграм Дж. М., Гувер Г. Е., Замбрано Дж. К., Хайден Ф. Г., Платтс-Миллс Т. А., Хейманн П. В..Риновирус и респираторно-синцитиальный вирус у детей с затрудненным дыханием, требующих неотложной помощи: анализ IgE и эозинофилов. Am J Respir Crit Care Med . 1999; 159: 785–790. [PubMed] [Google Scholar] 12. Дафф А.Л., Померанц Э.С., Гелбер Л.Е., Прайс ГВ, Фаррис Х., Хайден Ф.Г., Platts-Mills TAE, Heymann PW. Факторы риска острого свистящего дыхания у младенцев и детей: вирусы, пассивный дым и антитела IgE к ингаляционным аллергенам. Педиатрия . 1993. 92: 535–540. [PubMed] [Google Scholar] 13. Сото-Кирос М., Авила Л., Платтс-Миллс Т.А., Хант Дж.Ф., Эрдман Д.Д., Карпер Х., Мерфи Д.Д., Одио С., Джеймс Х.Р., Патри Дж. Т. и др.Высокие титры антител IgE к аллергену пылевого клеща и риск хрипов у детей-астматиков, инфицированных риновирусом. J Allergy Clin Immunol . 2012; 129: 1499–1505.e5. [Бесплатная статья PMC] [PubMed] [Google Scholar] 14. Джартти Т., Куусипало Х., Вуоринен Т., Седерлунд-Венермо М., Алландер Т., Варис М., Хартиала Дж., Руусканен О. Аллергическая сенсибилизация связана с риновирусами, но не с другими вирусами, вызванными хрипами у детей. Pediatr Allergy Immunol . 2010; 21: 1008–1014.[Бесплатная статья PMC] [PubMed] [Google Scholar] 15. Джексон Д. Д., Эванс М. Д., Гангнон Р. Э., Тислер С. Дж., Папас Т. Е., Ли В. М., Герн Дж. Э., Леманске Р. Ф., младший. Доказательства причинной связи между аллергической сенсибилизацией и риновирусным хрипом в раннем возрасте. Am J Respir Crit Care Med . 2012; 185: 281–285. [Бесплатная статья PMC] [PubMed] [Google Scholar] 16. МакЭрлин П., Шакелтон Л.А., Ламберт С.Б., Ниссен, доктор медицины, Слоутс Т.П., Маккей И.М. Характеристика недавно идентифицированного риновируса человека, HRV-QPM, обнаруженного у младенцев с бронхиолитом. Дж. Клин Вирол . 2007; 39: 67–75. [Бесплатная статья PMC] [PubMed] [Google Scholar] 17. Арден К.Э., МакЭрлин П., Ниссен, доктор медицины, Слоутс Т.П., Маккей И.М. Частое обнаружение риновирусов, парамиксовирусов, коронавирусов и бокавирусов человека при острых инфекциях дыхательных путей. J Med Virol . 2006; 78: 1232–1240. [Бесплатная статья PMC] [PubMed] [Google Scholar] 18. Ламсон Д., Ренвик Н., Капур В., Лю З., Паласиос Дж., Джу Дж., Дин А., Сент-Джордж К., Бриз Т., Липкин В. Обнаружение респираторных патогенов с помощью полимеразной цепной реакции MassTag, включая новый генотип риновируса, которые вызвали гриппоподобное заболевание в штате Нью-Йорк в 2004–2005 годах. J Заразить Dis . 2006; 194: 1398–1402. [Бесплатная статья PMC] [PubMed] [Google Scholar] 19. Кистлер А., Авила П.С., Рускин С., Ван Д., Вард Т., Яги С., Шнурр Д., Ганем Д., ДеРизи Д. Л., Боуши Н. А.. Пановирусный скрининг инфекций дыхательных путей у взрослых с астмой и без нее выявляет неожиданное разнообразие коронавирусов человека и риновирусов человека. J Заразить Dis . 2007; 196: 817–825. [Бесплатная статья PMC] [PubMed] [Google Scholar] 20. Ли В.М., Киснер К., Паппас Т., Ли И., Гриндл К., Джартти Т., Джакиела Б., Леманске Р.Ф., мл., Шулт П.А., Герн Дж. Э.Разнообразная группа ранее нераспознанных риновирусов человека является частой причиной респираторных заболеваний у младенцев. PLoS One . 2007; 2: e966. [Бесплатная статья PMC] [PubMed] [Google Scholar] 21. Линдер Дж. Э., Крафт, округ Колумбия, Мохамед Ю., Лу З., Хейл Л., Толлефсон С., Сэвилл Б. Р., Райт П. Ф., Уильямс СП, Миллер Е. К.. Человеческий риновирус C: возраст, время года и заболевания нижних дыхательных путей за последние 3 десятилетия. J Allergy Clin Immunol . 2013; 131: 69–77.e1–6. [Бесплатная статья PMC] [PubMed] [Google Scholar] 22.Бочков Ю.А., Пальменберг А.С., Ли В.М., Рат Дж.А., Аминева С.П., Сан X, Пасич Т.Р., Джарджур Н.Н., Лиггетт С.Б., Герн Дж. Э. Молекулярное моделирование, культивирование органов и обратная генетика для недавно идентифицированного риновируса человека C. Nat Med . 2011; 17: 627–632. [Бесплатная статья PMC] [PubMed] [Google Scholar] 23. Ашраф С., Брокман-Шнайдер Р., Бочков Ю.А., Пашич Т.Р., Герн Дж. Э. Биологические характеристики и распространение человеческого риновируса-C в дифференцированных эпителиальных клетках синуса. Вирусология . 2013; 436: 143–149.[Бесплатная статья PMC] [PubMed] [Google Scholar] 24. Хао В., Бернард К., Патель Н., Ульбрандт Н., Фенг Х., Свабек С., Уилсон С., Стрейснер С., Ван К., Сузич Дж. И др. Инфекция и распространение человеческого риновируса С в эпителиальных клетках дыхательных путей человека. Дж Вирол . 2012; 86: 13524–13532. [Бесплатная статья PMC] [PubMed] [Google Scholar] 25. Григгс Т.Ф., Бочков Ю.А., Накагоме К., Пальменберг А.С., Герн Дж. Э. Производство, очистка и стабильность капсида риновирусов типа С. Дж. Вирольные методы . 2015; 217: 18–23.[Бесплатная статья PMC] [PubMed] [Google Scholar] 26. Basta HA, Sgro JY, Palmenberg AC. Моделирование капсида риновируса С человека предлагает новую топографию с пониманием предпочтения рецепторов и иммуногенности. Вирусология . 2014; 448: 176–184. [Бесплатная статья PMC] [PubMed] [Google Scholar] 27. Биззинтино Дж., Ли В.М., Лайнг И.А., Ван Ф., Паппас Т., Чжан Дж., Мартин А.С., Кху СК, Кокс Д.В., Джилхоед Г.К. и др. Связь между риновирусом С человека и тяжестью острой астмы у детей. Eur Respir J .2011; 37: 1037–1042. [Бесплатная статья PMC] [PubMed] [Google Scholar] 28. Cox DW, Bizzintino J, Ferrari G, Khoo SK, Zhang G, Whelan S, Lee WM, Bochkov YA, Geelhoed GC, Goldblatt J и др. Инфекция человеческого риновируса вида C у детей раннего возраста с острым хрипом связана с увеличением количества госпитализаций по поводу острых респираторных заболеваний. Am J Respir Crit Care Med . 2013; 188: 1358–1364. [Бесплатная статья PMC] [PubMed] [Google Scholar] 29. Iwane MK, Prill MM, Lu X, Miller EK, Edwards KM, Hall CB, Griffin MR, Staat MA, Anderson LJ, Williams JV и др.Виды человеческого риновируса, связанные с госпитализацией детей раннего возраста в США по поводу острых респираторных заболеваний. J Заразить Dis . 2011; 204: 1702–1710. [PubMed] [Google Scholar] 30. Мак Р.К., Цзе Л.Й., Лам В.Й., Вонг Г.В., Чан П.К., Люн Т.Ф. Клинический спектр риновирусных инфекций человека у госпитализированных детей Гонконга. Pediatr Infect Dis J . 2011; 30: 749–753. [PubMed] [Google Scholar] 31. Драйсдейл С.Б., Альказар М., Уилсон Т., Смит М., Цукерман М., Лауэнгер И.Л., Тонг С.Й., Бротон С., Рафферти Г.Ф., Джонстон С.Л. и др.Респираторные исходы у недоношенных детей после инфицирования риновирусом человека A и C. Eur J Pediatr . 2014; 173: 913–919. [PubMed] [Google Scholar] 32. Хецуриани Н., Лу Х, Тиг В.Г., Казеруни Н., Андерсон Л.Дж., Эрдман Д.Д. Новые риновирусы человека и обострение астмы у детей. Emerg Infect Dis . 2008; 14: 1793–1796. [Бесплатная статья PMC] [PubMed] [Google Scholar] 33. Арден К.Е., Чанг А.Б., Ламберт С.Б., Ниссен, доктор медицины, Слоутс Т.П., Маккей И.М. Недавно выявленные респираторные вирусы у детей с обострением астмы, не требующие госпитализации. J Med Virol . 2010. 82: 1458–1461. [PubMed] [Google Scholar] 34. Linsuwanon P, Payungporn S, Samransamruajkit R, Posuwan N, Makkoch J, Theanboonlers A, Poovorawan Y. Высокая распространенность инфекции человеческого риновируса C у тайских детей с острым заболеванием нижних дыхательных путей. J Заразить . 2009. 59: 115–121. [Бесплатная статья PMC] [PubMed] [Google Scholar] 35. Ли В.М., Леманске Р.Ф., младший, Эванс, доктор медицины, Ван Ф., Паппас Т., Гангнон Р., Джексон Д. Д., Герн Дж. Э. Виды риновируса человека и сезон заражения определяют тяжесть заболевания. Am J Respir Crit Care Med . 2012; 186: 886–891. [Бесплатная статья PMC] [PubMed] [Google Scholar] 36. Уоттерс К., Пальменберг А.С. Дифференциальный процессинг белков комплекса ядерных пор протеазами риновируса 2А разных видов и серотипов. Дж Вирол . 2011; 85: 10874–10883. [Бесплатная статья PMC] [PubMed] [Google Scholar] 37. Накагоме К., Бочков Ю.А., Ашраф С., Брокман-Шнайдер Р.А., Эванс М.Д., Пасич Т.Р., Герн Дж.Э. Влияние видов риновирусов на репликацию вирусов и продукцию цитокинов. J Allergy Clin Immunol . 2014. 134: 332–341. [Бесплатная статья PMC] [PubMed] [Google Scholar] 38. Mosser AG, Brockman-Schneider RA, Amineva SP, Burchell L, Sedgwick JB, Busse WW, Gern JE. Сходная частота инфицирования риновирусом клеток в эпителии верхних и нижних дыхательных путей. J Заразить Dis . 2002; 185: 734–743. [PubMed] [Google Scholar] 39. Mosser AG, Vrtis R, Burchell L, Lee WM, Dick CR, Weisshaar E, Bock D, Swenson CA, Cornwell RD, Meyer KC и др. Количественный и качественный анализ риновирусной инфекции в тканях бронхов. Am J Respir Crit Care Med . 2005; 171: 645–651. [PubMed] [Google Scholar] 40. Саджан У, Ван Кью, Чжао Й, Грюнерт, округ Колумбия, Хершенсон МБ. Риновирус нарушает барьерную функцию поляризованных эпителиальных клеток дыхательных путей. Am J Respir Crit Care Med . 2008; 178: 1271–1281. [Бесплатная статья PMC] [PubMed] [Google Scholar] 41. Наклерио Р. М., Гордый Д., Лихтенштейн Л. М., Кагей-Соботка А., Хендли Дж. О., Соррентино Дж., Гвалтни Дж. М.. Кинины образуются во время экспериментальных риновирусных простуд. J Заразить Dis .1988. 157: 133–142. [PubMed] [Google Scholar] 42. Сеймур М.Л., Гилби Н., Бардин П.Г., Френкель Д.Д., Сандерсон Дж., Пенроуз Дж. Ф., Холгейт С.Т., Джонстон С.Л., Сэмпсон А.П. Риновирусная инфекция увеличивает содержание 5-липоксигеназы и циклооксигеназы-2 в образцах бронхиальной биопсии от субъектов без атопии. J Заразить Dis . 2002; 185: 540–544. [PubMed] [Google Scholar] 43. Proud D, Turner RB, Winther B, Wiehler S, Tiesman JP, Reichling TD, Juhlin KD, Fulmer AW, Ho BY, Walanski AA и др. Профили экспрессии генов во время инфицирования риновирусом человека in vivo: понимание ответа хозяина. Am J Respir Crit Care Med . 2008. 178: 962–968. [PubMed] [Google Scholar] 44. Льюис Т.К., Хендерсон Т.А., Карпентер А.Р., Рамирес И.А., МакГенри К.Л., Голдсмит А.М., Рен Х, Ментц Г.Б., Мукерджи Б., Робинс Т.Г. и др. Назальные цитокиновые реакции на естественные простуды у детей-астматиков. Clin Exp Allergy . 2012; 42: 1734–1744. [Бесплатная статья PMC] [PubMed] [Google Scholar] 45. Конно С., Гриндл К.А., Ли В.М., Шрот М.К., Моссер А.Г., Брокман-Шнайдер Р.А., Бусс В.В., Герн Дж. Э. Интерферон-гамма усиливает индуцированную риновирусом секрецию RANTES в эпителиальных клетках дыхательных путей человека. Am J Respir Cell Mol Biol . 2002; 26: 594–601. [PubMed] [Google Scholar] 46. Юта А., Дойл В.Дж., Гаумонд Э., Али М., Тамаркин Л., Баранюк Ю.Н., Ван Деузен М., Коэн С., Сконер Д.П. Риновирусная инфекция вызывает гиперсекрецию слизи. Am J Physiol . 1998; 274: L1017 – L1023. [PubMed] [Google Scholar] 47. Gern JE, Brockman-Schneider R, Bhattacharya S, Malter JS, Busse WW. Сыворотка и липопротеины низкой плотности усиливают секрецию интерлейкина-8 эпителиальными клетками дыхательных путей. Am J Respir Cell Mol Biol .2003. 29: 483–489. [PubMed] [Google Scholar] 48. Миллер Е.К., Лу Х, Эрдман Д.Д., Полинг К.А., Чжу Й., Гриффин М.Р., Хартерт Т.В., Андерсон Л.Дж., Вайнберг Г.А., Холл CB и др. Новая сеть эпиднадзора за вакцинами. Госпитализации детей раннего возраста, связанные с риновирусом. J Заразить Dis . 2007; 195: 773–781. [Бесплатная статья PMC] [PubMed] [Google Scholar] 49. DeMore JP, Weisshaar EH, Vrtis RF, Swenson CA, Evans MD, Morin A, Hazel E, Bork JA, Kakumanu S, Sorkness R и др. Подобные простуды у субъектов с аллергической астмой и у субъектов, не страдающих атопией, после инокуляции риновирусом-16. J Allergy Clin Immunol . 2009. 124: 245–252. [Бесплатная статья PMC] [PubMed] [Google Scholar] 50. Сообщение SD, Laza-Stanca V, Mallia P, Parker HL, Zhu J, Kebadze T., Contoli M, Sanderson G, Kon OM, Papi A, et al. Вызванное риновирусом заболевание нижних дыхательных путей увеличивается при астме и связано с вирусной нагрузкой и производством цитокинов Th2 / 2 и IL-10. Proc Natl Acad Sci USA . 2008. 105: 13562–13567. [Бесплатная статья PMC] [PubMed] [Google Scholar] 51. Simons E, Schroth MK, Gern JE. Анализ трахеального секрета на риновирус при естественных простудных заболеваниях. Pediatr Allergy Immunol . 2005. 16: 276–278. [PubMed] [Google Scholar] 52. Ю Дж.К., Ким Т.С., Хафффорд ММ, Брасиале Т.Дж. Вирусная инфекция легких: реакция хозяина и последствия. J Allergy Clin Immunol . 2013; 132: 1263–1276. [Викторина, стр. 1277.]. [Бесплатная статья PMC] [PubMed] [Google Scholar] 54. Пападопулос Н.Г., Станчу Л.А., Папи А., Холгейт СТ, Джонстон С.Л. Вызванные риновирусом изменения фенотипа мононуклеарных клеток периферической крови и экспрессии костимулирующих молекул у нормальных и атопических астматиков. Clin Exp Allergy . 2002; 32: 537–542. [PubMed] [Google Scholar] 55. Gehlhar K, Bilitewski C, Reinitz-Rademacher K, Rohde G, Bufe A. Нарушение вызванного вирусом высвобождения интерферона-альфа2 у взрослых пациентов с астмой. Clin Exp Allergy . 2006; 36: 331–337. [PubMed] [Google Scholar] 56. Сайкс А., Эдвардс М.Р., Макинтайр Дж., Дель Росарио А., Бахсолиани Е., Трухильо-Торральбо МБ, Кон О.М., Маллиа П., Макхейл М., Джонстон С.Л. Индуцированные риновирусом 16 IFN-α и IFN-β дефицитны в клетках бронхоальвеолярного лаважа у пациентов с астмой. J Allergy Clin Immunol . 2012; 129: 1506–1514. e6. [PubMed] [Google Scholar] 57. Gill MA, Bajwa G, George TA, Dong CC, Dougherty II, Jiang N, Gan VN, Gruchalla RS. Противорегуляция между путем FcepsilonRI и противовирусными ответами в плазматических дендритных клетках человека. Дж Иммунол . 2010. 184: 5999–6006. [Бесплатная статья PMC] [PubMed] [Google Scholar] 58. Wark PA, Johnston SL, Bucchieri F, Powell R, Puddicombe S, Laza-Stanca V, Holgate ST, Davies DE. Эпителиальные клетки бронхов при астме имеют недостаточный врожденный иммунный ответ на инфекцию риновирусом. J Exp Med . 2005; 201: 937–947. [Бесплатная статья PMC] [PubMed] [Google Scholar] 59. Contoli M, Message SD, Laza-Stanca V, Edwards MR, Wark PA, Bartlett NW, Kebadze T., Mallia P, Stanciu LA, Parker HL, et al. Роль дефицитной продукции интерферона-лямбда III типа в обострениях астмы. Нат Мед . 2006; 12: 1023–1026. [PubMed] [Google Scholar] 60. Эдвардс М.Р., Регейми Н., Варель М., Кенингер Э., Гупта А., Шумарк А., Саглани С., Сайкс А., Макинтайр Дж., Дэвис Дж. И др. Нарушение индукции врожденного интерферона у детей с атопической астмой, устойчивой к тяжелой терапии. Иммунол слизистой оболочки . 2013; 6: 797–806. [Бесплатная статья PMC] [PubMed] [Google Scholar] 61. Сайкс А., Макинтайр Дж., Эдвардс М.Р., Дель Росарио А., Хаас Дж., Гилен В., Кон О.М., Макхейл М., Джонстон С.Л. Вызванная риновирусом продукция интерферона не является недостаточной при хорошо контролируемой астме. Грудь . 2014; 69: 240–246. [PubMed] [Google Scholar] 62. Лопес-Соуза Н., Фаворето С., Вонг Х., Уорд Т., Яги С., Шнурр Д., Финкбайнер В.Е., Долганов Г.М., Виддикомб Дж. Х., Буши Х.А. и др. Восприимчивость к риновирусной инфекции in vitro выше для бронхов, чем для эпителиальных клеток носовых дыхательных путей у людей. J Allergy Clin Immunol . 2009; 123: 1384–1390.e2. [Бесплатная статья PMC] [PubMed] [Google Scholar] 63. Бочков Ю.А., Хансон К.М., Келес С., Брокман-Шнайдер Р.А., Ярджур Н.Н., Герн Й.Е. Риновирус-индуцированная модуляция экспрессии генов в эпителиальных клетках бронхов у пациентов с астмой. Иммунол слизистой оболочки . 2010; 3: 69–80. [Бесплатная статья PMC] [PubMed] [Google Scholar] 64. Кеннеди Дж. Л., Шейкер М., МакМин В., Герн Дж., Карпер Х., Мерфи Д., Ли В. М., Бочков Ю. А., Вртис Р. Ф., Платтс-Миллс Т. и др. Сравнение вирусной нагрузки у людей с астмой и без нее во время инфекций риновирусом. Am J Respir Crit Care Med . 2014; 189: 532–539. [Бесплатная статья PMC] [PubMed] [Google Scholar] 65. Patel DA, You Y, Huang G, Byers DE, Kim HJ, Agapov E, Moore ML, Peebles RS, Jr, Castro M, Sumino K, et al. Реакция на интерферон и контроль респираторных вирусов сохраняются в эпителиальных клетках бронхов при астме. J Allergy Clin Immunol . 2014; 134: 1402–1412.e7. [Бесплатная статья PMC] [PubMed] [Google Scholar] 67. Schwantes EA, Manthei DM, Denlinger LC, Evans MD, Gern JE, Jarjour NN, Mathur SK.Экспрессия гена интерферона в клетках мокроты коррелирует с индексом астмы во время обострений, вызванных вирусом. Clin Exp Allergy . 2014; 44: 813–821. [Бесплатная статья PMC] [PubMed] [Google Scholar] 68. Миллер EK, Эрнандес JZ, Wimmenauer V, Shepherd BE, Hijano D, Libster R, Serra ME, Bhat N, Batalle JP, Mohamed Y, et al. Механистическая роль IFN-λ1 типа III в обострениях астмы, опосредованных риновирусами человека. Am J Respir Crit Care Med . 2012; 185: 508–516. [Бесплатная статья PMC] [PubMed] [Google Scholar] 69.Тверски-младший, Ле ТВ, Биенеман А.П., Чичестер К.Л., Гамильтон Р.Г., Шредер Дж.Т. У дендритных клеток крови человека от субъектов с аллергией нарушена способность продуцировать интерферон-альфа через Toll-подобный рецептор 9. Clin Exp Allergy . 2008; 38: 781–788. [Бесплатная статья PMC] [PubMed] [Google Scholar] 70. Upham JW, Zhang G, Rate A, Еркович ST, Kusel M, Sly PD, Holt PG. Плазмацитоидные дендритные клетки в младенчестве обратно связаны с инфекциями дыхательных путей и хрипом у детей. J Allergy Clin Immunol .2009; 124: 707–713.e2. [PubMed] [Google Scholar] 71. Дуррани С.Р., Монтвилл Д.Д., Пратт А.С., Саху С., ДеВрис М.К., Раджаманикам В., Гангнон Р.Э., Гилл М.А., Герн Дж.Э., Леманске Р.Ф., младший и др. Врожденный иммунный ответ на риновирус снижается высокоаффинным рецептором IgE у детей с аллергической астмой. J Allergy Clin Immunol . 2012; 130: 489–495. [Бесплатная статья PMC] [PubMed] [Google Scholar] 72. Причард А.Л., Кэрролл М.Л., Бурел Дж. Г., Уайт О. Дж., Фиппс С., Упхэм Дж. У. Врожденные IFN и плазматические дендритные клетки ограничивают ответы цитокинов Th3 на риновирус: регуляторный механизм, имеющий отношение к астме. Дж Иммунол . 2012; 188: 5898–5905. [PubMed] [Google Scholar] 73. Гилен В., Сайкс А., Чжу Дж., Чан Б., Макинтайр Дж., Регейми Н., Кенингер Е., Гупта А., Шумарк А., Босли С. и др. Повышенный ядерный супрессор передачи сигналов цитокинов 1 в астматическом бронхиальном эпителии подавляет индукцию риновирусом врожденных интерферонов J Allergy Clin Immunol [онлайн до публикации] 25 января 2015 г .; DOI: 10.1016 / j.jaci.2014.11.039. [Бесплатная статья PMC] [PubMed] [Google Scholar] 74. Корфхаген Т.Р., Китцмиллер Дж., Чен Дж., Шридхаран А., Хайчи Х.М., Хегде Р.С., Диванович С., Карп С.Л., Уитсетт Дж.SAM-заостренный домен ETS-фактор опосредует присущую эпителиальным клеткам передачу сигналов врожденного иммунитета во время метаплазии слизистой дыхательных путей. Proc Natl Acad Sci USA . 2012; 109: 16630–16635. [Бесплатная статья PMC] [PubMed] [Google Scholar] 75. Chen G, Korfhagen TR, Karp CL, Impey S, Xu Y, Randell SH, Kitzmiller J, Maeda Y, Haitchi HM, Sridharan A, et al. Foxa3 индуцирует метаплазию бокаловидных клеток и подавляет врожденный противовирусный иммунитет. Am J Respir Crit Care Med . 2014; 189: 301–313. [Бесплатная статья PMC] [PubMed] [Google Scholar] 76.Корн Дж. М., Маршалл С., Смит С., Шрайбер Дж., Сандерсон Дж., Холгейт С.Т., Джонстон С.Л. Частота, тяжесть и продолжительность риновирусных инфекций у астматиков и неастматиков: продольное когортное исследование. Ланцет . 2002; 359: 831–834. [PubMed] [Google Scholar] 77. Holgate ST. Дисфункция эпителия при астме. J Allergy Clin Immunol . 2007; 120: 1233–1244, викторина 1245–1246. [PubMed] [Google Scholar] 78. Мейер Н., Акдис CA. Фактор роста эндотелия сосудов как ключевой индуктор ангиогенеза в дыхательных путях при астме. Curr Allergy Asthma Rep . 2013; 13: 1–9. [PubMed] [Google Scholar] 79. Лопес-Соуза Н., Долганов Г., Дубин Р., Сакс Л. А., Сассина Л., Спорер Н., Яги С., Шнурр Д., Боуши Н. А., Виддикомб Дж. Х. Устойчивость дифференцированного эпителия дыхательных путей человека к инфекции риновирусом. Am J Physiol Lung Cell Mol Physiol . 2004; 286: L373 – L381. [PubMed] [Google Scholar] 80. Jakiela B, Brockman-Schneider R, Amineva S, Lee WM, Gern JE. Базальные клетки дифференцированного эпителия бронхов более восприимчивы к риновирусной инфекции. Am J Respir Cell Mol Biol . 2008. 38: 517–523. [Бесплатная статья PMC] [PubMed] [Google Scholar] 81. Busse WW, Morgan WJ, Gergen PJ, Mitchell HE, Gern JE, Liu AH, Gruchalla RS, Kattan M, Teach SJ, Pongracic JA, et al. Рандомизированное испытание омализумаба (анти-IgE) для лечения астмы у детей из городских районов. N Engl J Med . 2011; 364: 1005–1015. [Бесплатная статья PMC] [PubMed] [Google Scholar] 82. Халдар П., Брайтлинг К.Э., Харгадон Б., Гупта С., Монтейро В., Суза А., Маршалл Р.П., Брэддинг П., Грин Р.Х., Вардлоу А.Дж. и др.Меполизумаб и обострения рефрактерной эозинофильной астмы. N Engl J Med . 2009; 360: 973–984. [Бесплатная статья PMC] [PubMed] [Google Scholar] 83. Джуканович Р., Харрисон Т., Джонстон С.Л., Габбей Ф., Уорк П., Томсон Н.К., Нивен Р., Сингх Д., Реддел Г.К., Дэвис Д.Е. и др. Исследовательская группа INTERCIA. Влияние ингаляционного IFN-β на ухудшение симптомов астмы, вызванных вирусными инфекциями. Рандомизированное испытание. Am J Respir Crit Care Med . 2014; 190: 145–154. [Бесплатная статья PMC] [PubMed] [Google Scholar]Астма, вызванная аллергией и окружающей средой — StatPearls
Непрерывное образование
Астма является основной причиной заболеваемости и смертности в США.Многочисленные исследования показали, что раннее введение ингаляционных кортикостероидов может уменьшить обострения и снизить частоту госпитализаций. В этом упражнении описаны диагностика, лечение и лечение экологической и аллергической астмы, а также описаны способы предотвращения ее обострений. Это подчеркивает важность межпрофессиональной команды в обучении пациентов соблюдению режима лечения и профилактике обострений путем выявления триггеров.
Целей:
Обобщите патофизиологию аллергической и вызванной окружающей средой астмы.
Объясните общие результаты физикального обследования, связанные с астмой.
Обозначьте цели по ведению экологической и аллергической астмы.
Подчеркните важность сотрудничества и координации между межпрофессиональной командой для улучшения ухода за пациентами и предотвращения обострений астмы.
Введение
Национальный институт сердца, легких и крови определяет астму как хроническое воспалительное заболевание.Многие клетки, включая тучные клетки, эозинофилы, макрофаги, нейтрофилы, Т-лимфоциты и эпителиальные клетки, способствуют возникновению воспаления. Воспаление может привести к появлению симптомов астмы; такие как одышка, хрипы, кашель и стеснение в груди.
Астма — это обструктивное заболевание дыхательных путей, ограничивающее поток воздуха на выдохе. Это как острое, так и обратимое заболевание, которое характеризуется обструкцией воздушного потока из-за воспаления, бронхоспазма и повышенной секреции дыхательных путей.Астма — это заболевание, поражающее людей всех рас, возрастов, полов и этнических групп. По оценкам, 7% американцев страдают астмой. В западных странах резко участились астма и атопия. Несмотря на высокую распространенность заболевания, улучшились исходы и уменьшилось количество госпитализаций по поводу приступов астмы. Астма характеризуется эпизодическим хрипом, повышенной реактивностью дыхательных путей на различные раздражители и обструкцией дыхательных путей. Эти симптомы могут возникать несколько раз в день или несколько раз в неделю, в зависимости от человека.Рекомендации Национальной группы экспертов по обучению и профилактике астмы по ведению астмы рекомендуют пациентам, которым ежедневно требуются лекарства от астмы, пройти аллергологический тест на постоянные аллергены в помещении и на улице.
Этиология
Этиология астмы может быть многофакторной. Считается, что это сочетание генетических факторов и факторов окружающей среды. Однако основным фактором, лежащим в основе всех типов астмы, является чрезмерная гиперчувствительность. Это описывается как IgE-опосредованный ответ.Этот ответ запускается агентом-нарушителем, будь то аллерген или агент окружающей среды (например, загрязнители воздуха), что приводит к увеличению присутствия эозинофилов, лимфоцитов и тучных клеток. Это вызывает воспаление дыхательных путей и повреждение эпителия бронхов. Цитокины также были определены как фактор, способствующий патогенезу астмы. Аномальные гладкие мышцы, сократимость и масса гладких мышц также являются факторами. Приступы аллергической астмы связаны с воздействием определенных возбудителей.
Самым сильным фактором риска развития астмы является наличие в анамнезе атопического заболевания. Те, у кого сенная лихорадка или экзема, имеют гораздо более высокий риск астмы.
Триггеры окружающей среды включают упражнения, гипервентиляцию, гормональные изменения и эмоциональное расстройство, переносимые по воздуху загрязнители, а также ГЭРБ.
Загрязнители окружающей среды могут влиять на тяжесть астмы, они могут действовать как спусковой механизм, приводящий к обострению астмы. Загрязнитель может усугубить ранее существовавшее воспаление дыхательных путей.
Было проведено несколько исследований, подтверждающих влияние аллергии и аллергенов на провоцирование астмы.
Необходимо учитывать как внутренние, так и наружные аллергены и загрязнители, к ним относятся:
Биологические аллергены (пылевые клещи, тараканы, перхоть животных и плесень)
Экологическое курение табака во время беременности и после родов связано к значительному риску развития астмы
Раздражающие химические вещества и пары, загрязнение дорожного движения и высокий уровень озона
Продукты сгорания
Профессиональная астма является наиболее распространенным заболеванием легких в промышленно развитых странах и составляет 15% новые случаи астмы у взрослых.Это определяется как изменяющееся ограничение воздушного потока или повышенная чувствительность в зависимости от конкретной производственной среды. Профессиональная астма может быть вызвана аллергенами или раздражителями на рабочем месте.
Гипотеза гигиены — это развивающаяся теория, которая утверждает, что ненормально чистая среда ограничивает детское воздействие триггеров и инфекций, которые вызывают «наивную» иммунную систему, увеличивают заболеваемость астмой и аллергией. [1]
Эпидемиология
Согласно отчету Центров по контролю и профилактике заболеваний (CDC), каждый 13 человек страдает астмой.От него страдают 25,7 миллиона американцев, в том числе 7,0 миллиона детей моложе 18 лет. Это серьезное бремя для здоровья и экономики пациентов, их семей и общества. К важным эпидемиологическим проблемам относятся:
В 2010 году 1,8 миллиона человек обратились в отделения неотложной помощи по поводу астмы, и 439 000 человек были госпитализированы из-за астмы.
Самые последние данные, полученные от CDC, показывают распространенность у мужчин около 6,5%, а у женщин — около 9.1%.
Что касается расового распределения, то распространенность составляет 7,8% среди белого населения, 10,3% среди чернокожих и 6,6% среди латиноамериканского населения.
По оценкам Всемирной организации здравоохранения (ВОЗ), в настоящее время астмой страдают 235 миллионов человек.
Ежегодная заболеваемость профессиональной астмой колеблется от 12 до 170 случаев на миллион работающих. Сообщается о распространенности от 5% до 15% во многих различных отраслях.
Астма — самое распространенное неинфекционное заболевание среди детей.
Большинство смертей приходится на пожилых людей.
Патофизиология
Патофизиология астмы хорошо известна и характеризуется переменным сужением воздушного потока и гиперреактивностью дыхательных путей, что вызывает сократительную реакцию дыхательных путей из-за различных раздражителей. Воспаление дыхательных путей, связанное с астмой, рассматривается как роль активации тучных клеток, опосредованная множеством клеток и цитокинов, аналогичная патогенезу аллергического ринита.
Эозинофилы являются наиболее специфическими клетками, которые накапливаются при астме и аллергическом воспалении, а также коррелируют с тяжестью заболевания. Различное сужение просвета дыхательных путей вызывает переменное уменьшение воздушного потока, что является патогномоничным для астмы.
Бронхоспазм может быть вызван прямым действием сократительных агонистов, высвобождаемых из воспалительных клеток или рефлекторных нервных механизмов. Существует также подгруппа пациентов с астмой, у которых наблюдается необратимая обструкция дыхательных путей, которая, как считается, вызвана ремоделированием дыхательных путей.Структурные клетки, эпителий, фибробласты, гладкие мышцы и эндотелий могут способствовать ремоделированию дыхательных путей посредством комбинации медиаторов и цитокинов.
Существует множество генетических, экологических и инфекционных факторов, которые, по-видимому, влияют на то, прогрессируют ли восприимчивые люди до явной астмы. [2]
Гистопатология
Гистопатология астмы характеризуется некоторыми структурными изменениями, включая отслоение эпителия, субэпителиальный фиброз, инфильтрат воспалительных клеток, гипертрофию гладких мышц бронхов, гипертрофию слизистых желез и сосудистые изменения.Эти изменения можно увидеть в проксимальных отделах дыхательных путей, а также в дистальных отделах легкого, а также при эндобронхиальной биопсии легкой, средней и тяжелой степени астмы. [1]
История и физические данные
Соответствующая история
Начало симптомов
Триггеры окружающей среды (внутри и вне дома) и факторы риска (например, употребление табака или воздействие)
Текущая терапия и предыдущая история, характерная для приступов
История болезни предварительная госпитализация или интубация по поводу астмы
Род занятий (сенсибилизаторы и 10% раздражителей вызывают 90% профессиональной астмы) *
Спросите о пищевой аллергии
Симптомы гастроэзофагеальной рефлюксной болезни (ГЭРБ)
лекарств, таких как НПВП и аспиринЕсли упражнения вызывают одышку
Симптомы астмы
Результаты физикального обследования при обострении болезни
* Сенсибилизаторы включают животных, биоаэрозоли, лекарства, ферменты, латекс, растения, морепродукты, ангидриды кислот, металлы, древесную пыль, персульфат, канифоль и изоцианаты.Раздражители включают хлор, пыль и дым с высоким уровнем активности. [3], [4]
Оценка
Начальная оценка
Пульсоксиметрия
Пиковый поток
Спирометрия — обычно, если измеренный ОФВ1 (объем форсированного выдоха за одну секунду) улучшается более чем на 12% и увеличивается на 200 миллилитров после приема бронходилататора, это подтверждает диагноз
Рентген грудной клетки, если есть показания
Мазок от гриппа / RSV может быть выполнен, если вы обеспокоены вирусом, вызывающим астму
ABG может быть гарантировано в зависимости от тяжести симптомов
Для любого пациента с Следует учитывать новое начало астмы, профессиональную астму, для проверки этого можно заказать следующие тесты:
Измерение пикового потока
Получите спирометрию, а также пиковую скорость выдоха, которую можно контролировать на работе и вне ее
Кожные пробы также могут быть выполнены для проверки на аллергию
Можно выполнить провокацию метахолином
Можно также выполнить специфическую ингаляционную провокацию
Биомаркеры воспаления оцениваются на предмет их полезности в диагностике астмы.Биомаркеры включают общий и дифференциальный подсчет клеток и анализы медиатора в мокроте, крови, моче и выдыхаемом воздухе.
Рекомендации Группы экспертов Национальной программы по обучению и профилактике астмы по астме рекомендуют пациентам, которым ежедневно требуются лекарства от астмы, пройти тестирование на аллергические реакции на постоянные аллергены в помещениях. Когда триггеры обнаружены, воздействие аллергенов следует контролировать с помощью различных мер, как описано ниже. Пациентов, симптомы которых не контролируются, следует направлять к аллергологу для иммунотерапии.
По степени тяжести астма классифицируется как прерывистая, стойкая-легкая, стойкая-умеренная и стойкая.Несколько проверенных вопросников также использовались для оценки контроля астмы у пациентов; к ним относятся анкета для оценки астмы, анкета для контроля астмы и контрольный тест на астму. Во время первого визита следует оценить астму, степень тяжести и контроль, чтобы начать лечение. Затем следует оценить контроль астмы, чтобы определить план лечения. [4]
Лечение / ведение
Целью лечения астмы является уменьшение нарушений, то есть частоты и интенсивности симптомов и функциональных ограничений, а также снижение риска будущих приступов астмы, ухудшения функции легких или побочные эффекты лекарств.Достижение и поддержание контроля над астмой включает междисциплинарный подход, который включает соответствующие лекарства, устранение факторов окружающей среды, которые могут вызвать ухудшение симптомов, и помочь пациентам освоить навыки самоконтроля и мониторинга и соответствующим образом скорректировать терапию. Целью лечения является купирование симптомов за счет уменьшения воспаления дыхательных путей и гиперреактивности.
В настоящее время лекарства от астмы классифицируются в соответствии с их ролью в общем лечении астмы: быстрое и долгосрочное.Все пациенты должны иметь в наличии бронходилататор быстрого действия для использования по мере необходимости. Если они используются более 2 дней в неделю или более 2 раз в месяц для ночных пробуждений, то следует назначить контролирующее лекарство. Ингаляторы быстрого действия являются наиболее эффективными для устранения обструкции дыхательных путей и обеспечивают немедленное облегчение симптомов. Наиболее широко применяемыми препаратами являются бета-агонисты, такие как альбутерол. Достижение долгосрочного контроля над астмой требует многофакторного подхода, включающего избегание внешних раздражителей, которые могут спровоцировать сужение бронхов и воспаление дыхательных путей, а также мониторинг изменений активности заболевания и иногда иммунотерапию аллергенами и лекарственную терапию.Ингаляционные кортикостероиды лучше всего помогают пациентам справиться с астмой. Они действуют, подавляя воспаление дыхательных путей и уменьшая гиперреактивность бронхов. Курящие астматики получают меньшую пользу от ингаляционных кортикостероидов, чем некурящие.
Повышающая терапия: цель борьбы с астмой
Шаг 1. При перемежающейся астме предпочтительной терапией является ингаляционный бета2-агонист короткого действия. При стойкой астме рекомендуется ежедневный прием лекарств.
Шаг 2: Предпочтительное лечение — низкие дозы ингаляционных кортикостероидов.
Шаг 3. Рекомендуются низкие дозы ингаляционного кортикостероида плюс ингаляционный бета2-агонист длительного действия или ингаляционный кортикостероид средней дозы.
Шаг 4. Предпочтительным лечением является ингаляционный кортикостероид средней дозы плюс агонист бета2 пролонгированного действия.
Шаг 5: Предпочтительным лечением являются высокие дозы ингаляционных кортикостероидов плюс агонист бета2 пролонгированного действия, а также применение омализумаба для людей с аллергией.
Шаг 6: Предпочтительное лечение — высокие дозы ингаляционных кортикостероидов плюс агонист бета2 пролонгированного действия плюс пероральный кортикостероид; рассмотрите омализумаб людям, страдающим аллергией.
Для шагов 2–4 также рассмотрите возможность иммунотерапии аллергии и тестирования на аллергию. Антагонисты лейкотриеновых рецепторов, кромолин натрия и теофиллин можно использовать в качестве альтернативных методов лечения, но не в качестве предпочтительных агентов. Было показано, что ингибиторы лейкотриена улучшают астму, вызванную физической нагрузкой, на 50% у детей от 12 лет и старше. Решение об усилении терапии основывается на контроле симптомов, на том, как часто используется ингалятор короткого действия, на ночных пробуждениях, вмешательстве в деятельность и на опросах.Следует также оценить комплаентность, технику ингаляции, контроль окружающей среды и сопутствующие заболевания. Рассмотрение о прекращении терапии, если астма контролируется не менее 3 месяцев.
Пациентам, использующим ингаляторы, следует рекомендовать использовать спейсеры, особенно у детей. Исследования показали, что при правильном использовании ингалятора со спейсером он так же полезен, как и небулайзер.
Аллерген и контроль окружающей среды также очень важны для астматиков. Основным фактором в программе экологического контроля является предотвращение появления пылевых клещей.Чувствительность к пылевым клещам — надежный предиктор астмы и ее тяжести. При борьбе с пылевыми клещами рекомендуется накрывать матрасы и подушки виниловыми чехлами и стирать все постельное белье каждые 1-2 недели в горячей воде. Другие меры включают снижение влажности, удаление ковров из спален и ограничение лежания на мягкой мебели. В комнатах детей мягкие игрушки следует вымыть или снять с кроватей. Если вы не можете удалить коврики, использование HEPA-фильтра снизит выбросы аллергенов.Также помогает ношение маски при использовании обычного пылесоса.
Домашние животные, особенно кошки, также могут быть потенциальным триггером астмы и аллергии, и, как правило, их следует удалить из дома. Высокое воздействие аллергена тараканов связано с риском астмы и наибольшей концентрацией на кухне. Аллергия на грибок — фактор риска астмы. Когда в вашем районе много спор, человек, страдающий астмой и аллергией, должен избегать продолжительных занятий на открытом воздухе. Следует избегать воздействия табака, поскольку было показано, что он увеличивает потребность в лекарствах, а также снижает функцию легких.Курение матери во время беременности было связано с повышением риска развития астмы у детей. Загрязнение воздуха также может способствовать обострению астмы.
Ведение острых обострений
Коррекция тяжелой гипоксемии путем применения кислорода и повторного лечения бета2 агонистами короткого действия
Быстрое устранение обструкции воздушного потока
Снижение риска рецидива
Любому, у кого пиковая скорость выдоха ниже 50%, требуется немедленная медицинская помощь.
Лекарства
Комбинация ингаляционных холинолитиков и бета2-агонистов, которые, как было показано, уменьшают госпитализацию детей школьного возраста
Также было показано, что внутривенное введение сульфата магния увеличивает функцию легких и уменьшает госпитализацию у детей
Введение системных кортикостероидов в течение одного часа после обращения в отделение неотложной помощи или оказания неотложной помощи оказывает существенное влияние на пациентов с тяжелым обострением, а также снижает количество госпитализаций.
- Пациенты должны быть отправлены домой на пероральный преднизон после острой госпитализации [4]
Дифференциальный диагноз
Создание Перед началом лечения необходимо убедиться, что у пациента астма, а не другое заболевание.
Взрослые
Хроническая обструктивная болезнь легких (ХОБЛ)
Застойная сердечная недостаточность
гастроэзофагеальная рефлюксная болезнь
механическая обструкция дыхательных путей
дисфункция голосовых связок
0 апно
0 нарушение функции голосовых связок
Депрессия и стресс
Редкие причины
Детский
У детей бывает трудно отличить одышку от астмы.Дифференциал у детей при хрипах может быть следующий:
Заболевания верхних дыхательных путей
Препятствия на пути крупных дыхательных путей
Инородное тело в трахее или бронхах
Дисфункция голосовых связок
Сосудистые кольца или ткани гортани
Ларинготрахеомальция, стеноз трахеи или бронхостеноз
или опухоль
- Препятствия на пути малых дыхательных путей
Другие причины
Прогноз
Прогноз астмы варьируется среди взрослых и детей.Дети действительно переживают полное разрешение больше, чем взрослые. Однако прогрессирование тяжелого заболевания маловероятно в обеих группах, если нет других основных заболеваний легких, таких как хроническая обструктивная болезнь легких (ХОБЛ) или злоупотребление табаком. Многие исследования показали, что у тех пациентов, которые ранее были госпитализированы, а также перенесены интубации, которые классифицируются как тяжелые астматики, имеют худший прогноз. Пациенты, которые курят и страдают ХОБЛ, имеют худший прогноз, также у этой подгруппы пациентов может произойти необратимое поражение легких.
Многие недавние исследования показали, что начало приема ингаляционных стероидов на ранних стадиях заболевания, а также постоянное положительное воздействие и улучшение функции легких. [ncbi.nlm.nih.gov/pubmed/10546480]
Осложнения
Осложнения астмы действительно существуют, хотя долгосрочные осложнения встречаются нечасто.
Общие осложнения
Нарушение нормальной деятельности
Нарушение сна
Пропущенное время на учебу и работу
Посещения отделения неотложной помощи и госпитализации
Долгосрочные осложнения астмы могут возникнуть из-за хронического воспаления что может привести к повреждению дыхательных путей.Обычно частые приступы астмы могут привести к воспалению дыхательных путей, и в конечном итоге лекарства не могут проникнуть в дыхательные пути. Смерть от астмы встречается редко, риск увеличивается у пациентов с основным заболеванием легких и у курильщиков. [5]
Консультации
Направление пациентов к специалисту по астме для консультации или совместного ведения по следующим причинам:
Когда есть трудности в достижении или поддержании контроля над астмой
Если пациенту потребовалось более двух приступов оральных системных кортикостероидов в течение 1 года или имеет обострение, требующее госпитализации
Если требуется лечение на уровне 4 или выше (лечение на уровне 3 или выше для детей в возрасте от 0 до 4 лет)
Если требуется иммунотерапия или омализумаб считается
- При необходимости дополнительного тестирования [6]
Сдерживание и обучение пациентов
Пациенты должны быть осведомлены об астме относительно использования лекарств.Они должны понимать, как принимать лекарства, а также понимать разницу между быстродействующими и поддерживающими лекарствами, такими как ингаляционные кортикостероиды.
Пациентов также следует поощрять к использованию плана действий при астме, чтобы они понимали, когда их симптомы серьезны, и им необходимо связаться с врачом или обратиться в отделение неотложной помощи.
Было показано, что инструменты APGAR для лечения астмы (активность, постоянные, триггеры, лекарства от астмы, ответ на терапию) в практике первичной медико-санитарной помощи улучшают контроль астмы и сокращают количество обращений в отделения неотложной помощи и неотложной помощи.[7]
Улучшение результатов команды здравоохранения
Астма считается наиболее распространенным хроническим заболеванием, наблюдаемым у детей. Это серьезная причина пропусков занятий в школе, а также частых посещений отделений неотложной помощи и неотложной помощи. Было показано, что использование ингаляционных кортикостероидов улучшает контроль астмы, но приверженность лечению остается низкой среди всех групп населения. В исследовании, проведенном в Массачусетсе в период с 2012 по 2015 годы, было изучено влияние программы лечения астмы под наблюдением школьных медсестер на использование медицинских услуг.Дети, участвовавшие в этом исследовании, были отнесены к группе высокого риска и имели стойкую астму. Исследование выявило плохую приверженность к лечению и у этой группы детей. Этим детям давали ингаляционные кортикостероиды под контролем школьной медсестры от ежедневного до двух раз в день. Это было ретроспективное исследование, в котором анализировались данные и анализировались электронные медицинские карты для отслеживания посещений отделений неотложной помощи и больниц, связанных с астмой, как до исследования, так и после него.Были получены запасы альбутерола и преднизона из аптечных и медицинских записей. Наконец, научные сотрудники просмотрели отчеты школьных медсестер о пропусках занятий. [Когортные исследования уровня III «случай-контроль»] Исследование показало сокращение количества посещений как в отделениях неотложной помощи, так и в больницах, а также уменьшение количества пополнений альбутерола в группе после вмешательства по сравнению с группой до вмешательства. Это небольшое исследование показало, что сотрудничество со школьной медсестрой по предоставлению контролируемых лекарств от астмы может снизить обращение за медицинской помощью у детей школьного возраста и обеспечить лучший контроль над астмой в целом.[8]
В 2013 году 1,6 миллиона обращений в отделения неотложной помощи были вызваны неконтролируемой астмой. Многие исследования показали, что просвещение по поводу астмы имеет важное значение для содействия самоконтролю пациентов и их приверженности. Ретроспективное исследование было проведено в клинике астмы Южного Бронкса, чтобы показать, что сочетание фармацевтического опыта с обучением по астме также улучшает приверженность к лечению и контроль астмы, а также снижает использование больниц. Роль преподавателя астмы состоит в том, чтобы научить пациентов лекарствам от астмы, их правильному применению и обеспечить лучшее понимание болезни.Обзор диаграмм проводился для выявления улучшения контроля астмы после обучения на основе результатов контрольных тестов астмы. Выводы этого исследования показывают, что добавление образовательной программы для фармацевтов по астме было связано с улучшением приверженности к лечению, уменьшением использования больниц и усилением контроля над астмой. [9] [Когортные исследования уровня III]
Исключительное значение в лечении и профилактике связанных с астмой заболеваемости и смертности имеет коммуникация между межпрофессиональной командой клиницистов, фармацевтов и специализированных медсестер.Обмен информацией между фармацевтами и клиницистом о несоблюдении режима приема лекарств может помочь выявить пациентов, которые подвергаются наибольшему риску обострений астмы. Медсестры-специалисты могут помочь обучить пациента правильному применению ингаляторов и их использованию. Медсестры могут помочь врачам определить наиболее подходящий рецепт для каждого пациента, чтобы обеспечить его соблюдение. Только работая вместе в качестве интегрированного межпрофессионального подразделения в лечении астмы, мы можем добиться лучших результатов для пациентов.[Уровень V]
Рисунок
На рисунке A показано расположение легких и дыхательных путей в организме. На рисунке B показано поперечное сечение нормального дыхательного пути. На рисунке C показано поперечное сечение дыхательных путей во время симптомов астмы. Предоставлено Национальным институтом здравоохранения США
Рисунок
Таблица классификации астмы. Предоставлено Риной Чабра, DO
Ссылки
- 1.
- Myers TR, Tomasio L. Asthma: 2015 и позже. Respir Care. 2011 сентябрь; 56 (9): 1389-407; обсуждение 1407-10.[PubMed: 21944687]
- 2.
- Лю М.К., Хаббард В.С., Гордый Д., Стили Б.А., Галли С.Дж., Кагей-Соботка А., Бликер Е.Р., Лихтенштейн Л.М. Непосредственные и поздние воспалительные реакции на воздействие антигена амброзии периферических дыхательных путей у аллергических астматиков. Изменения клеток, посредников и проницаемости. Am Rev Respir Dis. 1991 июл; 144 (1): 51-8. [PubMed: 2064141]
- 3.
- Тарло С.М., Альтман К.В., Оппенгеймер Дж., Лим К., Вертиган А., Презант Д., Ирвин Р.С., Группа экспертов по кашлю CHEST.Вклад профессии и окружающей среды в хронический кашель у взрослых: отчет группы экспертов по грудной клетке. Грудь. 2016 Октябрь; 150 (4): 894-907. [PubMed: 27521735]
- 4.
- Полларт С.М., Элвард К.С. Обзор изменений в рекомендациях по астме: диагностика и скрининг. Я семейный врач. 2009 01 мая; 79 (9): 761-7. [PubMed: 20141095]
- 5.
- Локсли Р.М. Астма и аллергическое воспаление. Клетка. 2010 марта 19; 140 (6): 777-83. [Бесплатная статья PMC: PMC3134388] [PubMed: 20303868]
- 6.
- Элвард К.С., Полларт С.М. Медицинская терапия астмы: обновления руководств NAEPP. Я семейный врач. 2010 15 ноября; 82 (10): 1242-51. [PubMed: 21121536]
- 7.
- Yawn BP, Wollan PC, Rank MA, Bertram SL, Juhn Y, Pace W. Использование инструментов APGAR для лечения астмы в первичной медицинской помощи: кластерное рандомизированное контролируемое исследование. Ann Fam Med. Март 2018; 16 (2): 100-110. [Бесплатная статья PMC: PMC5847347] [PubMed: 29531100]
- 8.
- Триведи М., Патель Дж., Лессард Д., Кремер Т., Байатт Н., Пипатанакул В., Пберт Л., Голдберг Р.Программа школьной медсестры по борьбе с астмой снижает обращение за медицинской помощью у детей с устойчивой астмой. J Asthma. Октябрь 2018; 55 (10): 1131-1137. [Бесплатная статья PMC: PMC5988937] [PubMed: 29206057]
- 9.
- Абрахам Т.Г., Хаггинс С., Диас-Фуэнтес Дж., Рольери Дж. Сочетание фармацевтического опыта с сертификатом преподавателя астмы: оценка воздействия на пациентов с астмой в городских районах. J Asthma. 2019 август; 56 (8): 891-896. [PubMed: 30015531]
Аллергическая астма | AAFA.org
Аллергены и аллергическая астма
Что такое аллерген?
Аллергены — это вещества, вызывающие аллергическую реакцию.Аллергены могут попасть в организм при вдыхании, глотании, прикосновении или инъекции.
Что такое аллергическая астма?
Более 25 миллионов человек в США страдают астмой, и аллергическая астма является наиболее распространенным типом, которым страдают около 60% людей, страдающих астмой. И аллергическая, и неаллергическая астма имеют одинаковые симптомы, такие как одышка и хрипы.
Наличие аллергической астмы означает, что аллергена вызывают симптомы астмы. Аллергены вызывают аллергическую реакцию, потому что ваша иммунная система считает их вредными.Ваша иммунная система отвечает, выделяя вещество, называемое иммуноглобулином E (или IgE). Слишком много IgE может вызвать воспаление (отек) дыхательных путей в легких. Это может затруднить дыхание и вызвать приступ астмы.
Как узнать, что у меня аллергическая астма?
Только врач может подтвердить диагноз аллергической астмы. Обычно это делается с помощью кожного анализа или анализа крови. Эти тесты помогут определить, вызывают ли у вас астму сезонная аллергия или круглогодичная аллергия.
Каковы общие причины аллергической астмы?
Умение избегать аллергенов — ключ к лечению аллергической астмы. Узнайте, как избежать этих распространенных аллергенов:
Тараканы
Эти насекомые обитают по всему миру, от тропиков до самых холодных мест на Земле. Исследования показывают, что в большинстве городских домов живут тараканы. Кал, слюна и части тела этих насекомых считаются аллергенами.
Пылевые клещи
Эти паукообразные существа слишком малы, чтобы их можно было увидеть невооруженным глазом.Питаются чешуйками кожи человека. И части тела, и кал пылевых клещей считаются аллергенами. Они встречаются в матрасах, подушках, коврах, мягкой мебели, покрывалах, одежде, мягких игрушках, ткани и т. Д.
Форма
В присутствии влаги плесень может расти практически на любом предмете. На открытом воздухе многие плесени живут в почве, листьях, древесине и других растительных остатках. В помещении их можно найти во влажном подвале, возле протекающего крана или трубы, а также в душевой кабине или ванне.Плесень производит крошечные споры, похожие на семена, для размножения. Эти споры легко переносятся по воздуху.
Домашние животные
Моча, фекалии, слюна, волосы или перхоть домашних животных (чешуйки кожи) являются аллергенами.
