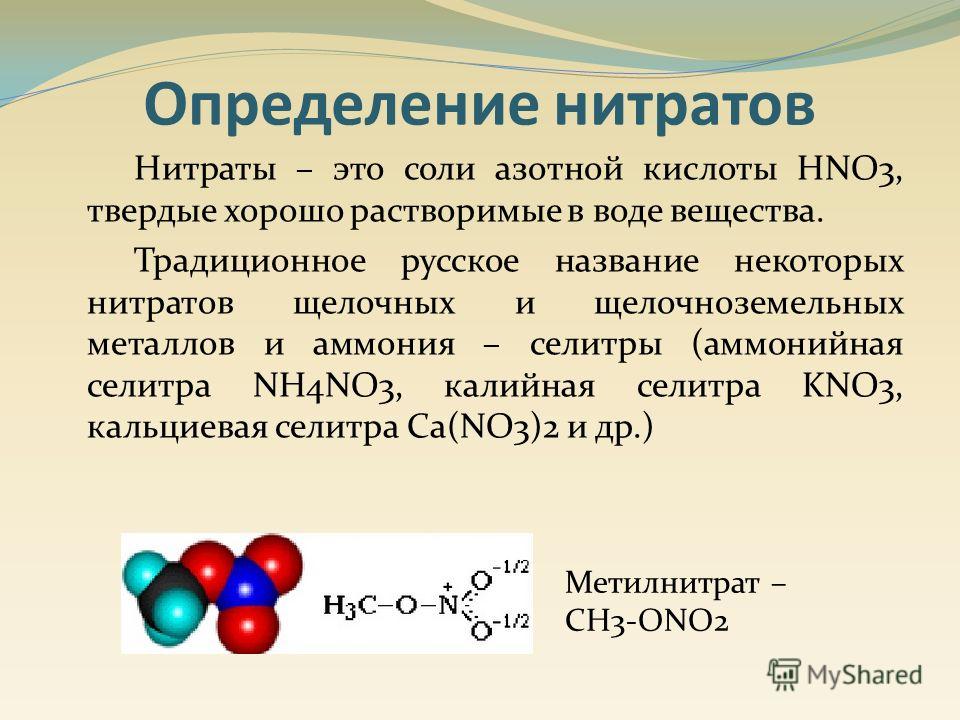
Сульфаты в воде что это такое: Содержание сульфатов в воде
Сухой остаток | О воде
Один из важнейших показателей качества питьевой воды – это количество растворенных в ней соединений, или, по-другому, сухой остаток. Сухим остатком называется общее количество растворенных в воде минеральных неорганических солей кальция, магния, калия, натрия, бикарбонатов, хлоридов и сульфатов, а также небольшое количество органических веществ. Растворенные соли попадают в воду как из природных источников – родников, известковых и солевых отложений, так и из неочищенных или в недостаточной степени очищенных бытовых и промышленных сточных вод. Кроме того, растворенные соединения привносятся в воду в результате применения химических реагентов в процессах подготовки воды на водоочистных станциях, а также вследствие попадания отложений, образовавшихся на внутренних поверхностях труб, при транспортировке воды по водораспределительным магистралям до потребителя. Величина показателя сухого остатка характеризует общую степень минерализации воды, а также определяет ее вкусовые качества и коррозионную активность.
АНАЛИЗ ВОДЫ ПО ПОКАЗАТЕЛЮ «СУХОЙ ОСТАТОК»
Специалисты отбирают пробу воды, которую необходимо проанализировать, и для начала пропускают ее через бумажный фильтр. После этого точный объем отфильтрованной пробы воды наливают в предварительно взвешенную на весах керамическую чашку для выпаривания и упаривают пробу досуха на водяной бане. Далее чашку вместе с неиспарившимся остатком сушат при температуре 105 °С в сухожаровом шкафу в течение 4 часов, после чего производят взвешивание чашки с остатком. Далее по разнице масс чашки с остатком и без него расчетным методом определяют величину сухого остатка для пробы воды.
КОЛИЧЕСТВО СУХОГО ОСТАТКА
В целом вода с общим солесодержанием (сухим остатком) менее 1000 мг/л называется пресной, более 1000 мг/л – минерализованной. Кроме того, выделяют подтипы минерализованной воды:
Кроме того, выделяют подтипы минерализованной воды:
- 1 000 – 2 000 мг/л сухого остатка – слабоминерализованная;
- 2 000 – 5 000 мг/л – маломинерализованная;
- 5 000 – 10 000 мг/л – среднеминерализованная;
- свыше 10 000 мг/л – до 15 000 мг/л – высокоминерализованная.
Итак, резюмируя вышесказанное, отметим, что повышенное содержание растворенных в воде солей – сухого остатка – не представляет большой опасности для здоровья человека, однако это указывает на непригодность воды к использованию из эстетических соображений. Такая вода характеризуется неприятным вкусом, а при использовании в быту может привести к образованию пятен на белье при стирке, накипи на нагревательных элементах бытовых приборов. Помимо этого, высокое солесодержание может указывать на возможность присутствия в воде, наряду с относительно безобидными соединениями, также и ионов токсичных металлов. Таким образом, в случае превышения допустимого значения величины сухого остатка воды требуется ее дополнительная очистка с помощью фильтров.
Фильтры БАРЬЕР для очистки воды способны удалять из нее растворенные вещества, улучшая тем самым ее вкусовые и потребительские качества.
Очистка воды от сульфатов | компания «Waterman»
Потребность очистки воды от сульфатов возникает при подготовке технологической воды для производств, а также подготовке питьевых вод в частных домах и крупных объектах промышленности.
Компания Waterman выполняет весь спектр задач по водоочистке как в частных домах, так и в масштабах промышленных предприятий.
Для решения задачи очистки воды от сульфатов используют следующие способы:
1) очистка воды от сульфатов с применением анионитов;
2) очистка воды от сульфатов мембранными методами (нанофильтрация / обратный осмос).
Поскольку сульфаты – это один из трёх основных анионов солевого состава воды, превышения по данному показателю очень часто наблюдается в паре с превышением по общему солесодержанию воды (а также другими элементами солевого состава: жёсткость общая, как сумма кальция + магний, хлориды, кремний). Исходя из этого, при подготовке питьевой воды с повышенным содержанием сульфатов возникает потребность в её частичном обессоливании (т.е. коррекции ряда элементов растворённых в воде солей). В подобных случаях применение установок обратного осмоса или нанофильтрации является более обоснованным решением.
Исходя из этого, при подготовке питьевой воды с повышенным содержанием сульфатов возникает потребность в её частичном обессоливании (т.е. коррекции ряда элементов растворённых в воде солей). В подобных случаях применение установок обратного осмоса или нанофильтрации является более обоснованным решением.
То же самое можно сказать и о подготовке технологических вод, а также вод, где сульфаты рассматриваются как источники твёрдых сульфатных накипей.
Ионный обмен может являться перспективным решением:
1) Для вод с высоким содержанием сульфатов и нитратов. Реализация очистки воды от данных соединений не требует применения агрессивных химических реагентов, однако конечный выбор зависит от стоимости энергоресурсов для конкретного объекта.
2) Подготовка воды для пивных производств. Как известно, сульфаты придают воде горьковатый привкус. Если изготавливаемый сорт пива предполагает мягкий вкус и по технологии требуется вода с низким содержанием сульфатов, а вода по прочим показателям максимально удовлетворяет заданным технологией требованиям – извлечение сульфатов на анионообменный смоле является эффективным решением.
Очистка воды от сульфатов методом обратного осмоса
Рассмотрим процедуру очистки воды от сульфатов с помощью обратного осмоса. Стоит отметить, что по сравнению с другими системами очистки обратноосмотические фильтры решают задачу очистки наиболее эффективно. Одно из очевидных преимуществ обратноосмотического оборудования — независимость результата очистки от исходного солесодержания очищаемой воды. Эта особенность обратноосмотических фильтров позволяет с их помощью успешно очищать как водопроводную воду, так и воду из поверхностных источников водозабора.
Данное оборудование компактно, поэтому для его размещения не требуется больших площадей. Обратноосмотические установки исключают применение агрессивных химических реагентов, что делает их экологически чистыми.
Процесс обратного осмоса представляет собой перетекание воды через полупроницаемые мембраны из более концентрированного в менее концентрированный раствор под воздействием высокого давления, превышающего разницу осмотических давлений этих двух растворов.
В результате очистки воды на обратноосмотических установках происходит практически полное ее избавление от примесей — как сульфатов, так и азота аммонийного, железа, нитратов, хлоридов, кальция и магния. Полезное побочное действие такой очистки — снижение жесткости воды, приводящей к образованию кальциевых и магниевых отложений в процессе нагрева воды в теплообменниках, к проблемам с бытовой техникой и сантехникой.
Пропуск воды через установку обратного осмоса является эффективным методом дезодорации воды – избавления от неприятных запахов.
Очистка воды от сульфатов методом ионного обмена
Для очистки воды от сульфатов нашли применение анионообменные смолы сильного основания. Аниониты – это смолы, извлекающие из воды анионы соединений с определённой избирательностью — характеризующиеся относительным родством в отношении удаляемых ионов по следующему ряду: ОН < F < H2PO4 < HCO3 < Cl < NO3 < H2SO4. Условие протекания реакций обмена анионов между смолой и водным раствором — расположение анионов, содержащихся в растворе, левее функциональной группы анионов, находящихся в смоле.
Аниониты – это смолы, извлекающие из воды анионы соединений с определённой избирательностью — характеризующиеся относительным родством в отношении удаляемых ионов по следующему ряду: ОН < F < H2PO4 < HCO3 < Cl < NO3 < H2SO4. Условие протекания реакций обмена анионов между смолой и водным раствором — расположение анионов, содержащихся в растворе, левее функциональной группы анионов, находящихся в смоле.

Для выбора наиболее подходящей технологии очистки воды от сульфатов и необходимого оборудования нужен индивидуальный и профессиональный подход в каждом конкретном случае, начиная со сбора информации и разработки проекта, заканчивая его реализацией и техническим и технологическим сопровождением.
Определение оптимального метода очистки является прерогативой специалистов, поэтому экономьте Ваше время и деньги — обращайтесь в нашу компанию, мы всегда на связи!
Заполните бланк опросника и отошлите его. На основании указанных данных мы подберем оптимальную схему очистки воды и вышлем вам предложение с ценой системы очистки воды от сульфатов в кратчайшие сроки. По вопросам заполнения опросных листов звоните (351) 200-44-45.
Жесткость воды и общее солесодержание — Служба поддержки АКВАФОР
Важным аспектом качества воды является общее солесодержание и жесткость. Эти показатели, хоть и не являются токсикологическими, очень сильно влияют на органолептические свойства питьевой воды и, в случае высокой жесткости, на пригодность воды для использования в хозяйственно-бытовых целях.
Эти показатели, хоть и не являются токсикологическими, очень сильно влияют на органолептические свойства питьевой воды и, в случае высокой жесткости, на пригодность воды для использования в хозяйственно-бытовых целях.
Общее солесодержание
Содержание солей в воде определяют двумя способами:
- кондуктометрией (TDS-метром) — измерением проводимости раствора;
- гравиметрией — определением массы сухого остатка после выпаривания.
Кондуктометрия позволяет определить количество растворенных в воде ионогенных веществ (тех, что дают заряженные частицы — ионы) или, по-другому, солей.
Гравиметрия показывает, сколько всего веществ растворено в воде – и заряженных, и тех, что при растворении на ионы не распадаются. Выпаренный сухой остаток включает неорганические соли (в основном кальций, магний, калий, натрий, бикарбонаты, хлориды и сульфаты) и небольшое количество органических веществ, которые растворяются в воде — то есть общее солесодержание.
Сухой остаток дает представление о степени минерализации воды. Воду с сухим остатком выше 1000 мг/л называют минерализованной (например, морская, минеральная), а до 1000 мг/л – пресной (например, речная, дождевая, вода ледников). При этом слабоминерализованной называют воду, содержащую 50 – 100 мг/л, удовлетворительно минерализованной – 100 –300 мг/л, оптимально минерализованной – 300 – 500 мг/л и повышенно минерализованной 500 –1000 мг/л.
Воду с сухим остатком выше 1000 мг/л называют минерализованной (например, морская, минеральная), а до 1000 мг/л – пресной (например, речная, дождевая, вода ледников). При этом слабоминерализованной называют воду, содержащую 50 – 100 мг/л, удовлетворительно минерализованной – 100 –300 мг/л, оптимально минерализованной – 300 – 500 мг/л и повышенно минерализованной 500 –1000 мг/л.
Названия солей состоят из названий анионов (кислотообразующих элементов) и названий катионов. Названия солей, как правило, связаны с названиями соответствующих кислот.
Наличие и концентрация солей в воде обусловлены их содержанием в природных источниках, сточных водах, городском ливневом стоке или сбросе, а также в промышленных сточных водах. Соль, используемая в некоторых странах для борьбы с обледенением дорог, также может влиять на общее солесодержание воды.
Высокие концентрации солей в воде вызывают неприятные ощущения у потребителей. Например, вода с повышенным содержанием меди характеризуется неприятным вяжущим привкусом, а высокая концентрация железа будет приводить к желтовато-бурому цвету воды. Тем не менее, слабоминерализованная вода тоже не всегда приятна на вкус.
Тем не менее, слабоминерализованная вода тоже не всегда приятна на вкус.
Жесткость воды
Жесткостью называют совокупность свойств воды, обусловленных наличием в воде солей кальция (Са2+) и, в меньшей степени, магния (Mg2+) и железа (Fe2+), способных выпадать в осадок. Одновалентные катионы (натрий Na+, калий К+) таким свойством не обладают.
Различают следующие виды жесткости:
- Карбонатная жесткость (временная) обусловлена наличием в воде гидрокарбонатов и карбонатов (при рН>8,3) кальция и магния. Такая жесткость называется временной, потому что почти полностью устраняется при кипячении воды. При нагревании воды гидрокарбонаты разлагаются с выпадением в осадок карбоната кальция (СаСО3) или карбоната магния (MgСО3), углекислого газа СО2 и воды.
- Некарбонатная жесткость (постоянная) обусловлена присутствием кальциевых и магниевых солей сильных кислот (сульфатов, нитратов, хлоридов) и при кипячении не устраняется, потому ее и называют еще постоянной жесткостью.

- Общая жесткость представляет собой сумму карбонатной и некарбонатной жесткости и определяется суммарной концентрацией ионов кальция, магния и железа. Содержанием железа при расчете жесткости, как правило, пренебрегают.
Очистка воды от минерализации, сульфатов, хлоридов в Перми
- Высочайшее качество очистки воды
- Можно использовать с септиком
| Наименование | Производительность при Т=20, м3/ч | Производительность при Т=12, м3/ч | Количество и марка рулонных элементов | Минимальное количество концетрата на 1 л пермиата, л | Максимальное количество концетрата на 1 л пермиата, л | Габариты |
| ДСЛАквагид125л/час | 0,125 | 0,1 | 4040х1 | 0,0375 | 0,125 | 600х400х1500 |
| ДСЛ Аквагид 250 л/час | 0,25 | 0,2 | 4040х1 | 0,075 | 0,25 | 600х400х1500 |
| ДСЛАквагид500л/час | 0,5 | 0,4 | 4040х2 | 0,15 | 0,5 | 600х400х1500 |
| ДСЛАквагид750л/час | 0,75 | 0,6 | 4040х3 | 0,225 | 0,75 | 700х400х1500 |
| ДСЛАквагид1000л/час | 1 | 0,8 | 4040х4 | 0,3 | 1 | 700х400х1500 |
| ДСЛАквагид1250л/час | 1,25 | 1 | 4040х5 | 0,375 | 1,25 | 700х600х1500 |
| ДСЛАквагид1500л/час | 1,5 | 1,2 | 4040х6 | 0,45 | 1,5 | 700х600х1500 |
| ДСЛАква2000л/час | 2 | 1,6 | 8080х2 | 0,6 | 2 | 1800х900х1850 |
| ДСЛАква3000л/час | 3 | 2,4 | 8080х3 | 0,9 | 3 | 1800х900х1850 |
| ДСЛАква4000л/час | 4 | 3,2 | 8080х4 | 1,2 | 4 | 1800х900х1850 |
| ДСЛАква5000л/час | 5 | 4 | 8080х5 | 1,5 | 5 | 1800х900х1850 |
- Корпус фильтра Big Blue 10″ 1шт.

- Картридж предварительныой очистки Big Blue 10″ 5 мкм 1шт.
- Впускной соленоидный клапан 1шт.
- Повысительный насос 1шт.
- Корпус мембраны стеклопластиковый 1шт.
- Обратноосмотические мембраны 4040 1шт.
- Промывочный электромагнитный клапан 1шт.
- Регулятор давления 1шт.
- Комплект расходомеров
- Комплект манометров
- Прибор контроля уровня солесодержания TDS-Meter 1шт.
- Рама из стали
Минимальное рабочее давление в системе водоснабжения Р=2,5 атм, но не более 6,0 атм;
Рабочая температура воды 4 — 30 °С;
Длительность работы в пиковом режиме не должна превышать 15 мин;
Для проведения регламентных работ расстояние от верхнего сечения установки до потолка должно быть не менее 40 см;
Расстояние до электрической розетки: не более 1,5 метров;
Расстояние до точки сброса промывной воды в канализацию: не более 6 метров
Гарантии: корпус фильтра, корпус клапана управления, электрические части — 1 год со дня установки оборудования Покупателю, загрузка — Гарантия отсутствия производственных дефектов в течение 3-х лет.
Системы промышленного осмоса на загородный дом обычно используются в сумме с накопительной емкостью, которая наполняется сверхчистой водой, и станцией насосного второго подъема, которая из накопительной емкости раздает всю накопленную воду на дом.
Промышленный обратный осмос
Промышленный фильтр с обратным осмосом позволяет получать глубоко деминерализованную воду. Поток исходной воды под высоким давлением поступает на высокоселективную пористую мембрану или несколько мембран, на которой задерживается до 97-99% всех известных загрязнителей. Основные примеси, удаляемые на промышленном осмосе, это: ионы тяжелых металлов, натрий, калий, сульфаты, хлориды, бор, фтор и множество других неорганических ионов. Мембрана имеет пористую структуру через которую преимущественно проходят только молекулы воды.
Соотношение целевого продукта — очищенной воды (пермеата) и воды, сбрасываемой в дренаж, (концентрата) составляет ориентировочно 2:1. То есть, чтобы получить 1000 л/час очищенной воды необходимо подавать на установку 1500 л/час. При это в канализацию будет удаляться 500 л/час концентрата.
То есть, чтобы получить 1000 л/час очищенной воды необходимо подавать на установку 1500 л/час. При это в канализацию будет удаляться 500 л/час концентрата.
Промышленная установка для обратного осмоса позволяет получить качественную воду с минимальными затратами. Для подбора и монтажа промышленного осмоса для очистки воды и дальнейшего его обслуживания необходимы высококвалифицированные специалисты, имеющие большой опыт в данной области.
Исходная вода, поступающая на обратный осмос для промышленности должна пройти предварительную очистку
Основные показатели качества воды — техническая информация
Мутность и прозрачность
Мутность – показатель качества воды, обусловленный присутствием в воде нерастворенных и коллоидных веществ неорганического и органического происхождения. Причиной мутности поверхностных вод являются илы, кремниевая кислота, гидроокиси железа и алюминия, органические коллоиды, микроорганизмы и планктон. В грунтовых водах мутность вызвана преимущественно присутствием нерастворенных минеральных веществ, а при проникании в грунт сточных вод – также и присутствием органических веществ. В России мутность определяют фотометрическим путем сравнения проб исследуемой воды со стандартными суспензиями. Результат измерений выражают в мг/дм3 при использовании основной стандартной суспензии каолина или в ЕМ/дм3 (единицы мутности на дм3) при использовании основной стандартной суспензии формазина. Последнюю единицу измерения называют также Единица Мутности по Формазину (ЕМФ) или в западной терминологии FTU (Formazine Turbidity Unit). 1FTU=1ЕМФ=1ЕМ/ дм3. В последнее время в качестве основной во всем мире утвердилась фотометрическая методика измерения мутности по формазину, что нашло свое отражение в стандарте ISO 7027 (Water quality — Determination of turbidity). Согласно этому стандарту, единицей измерения мутности является FNU (Formazine Nephelometric Unit). Агентство по Охране Окружающей Среды США (U.
В грунтовых водах мутность вызвана преимущественно присутствием нерастворенных минеральных веществ, а при проникании в грунт сточных вод – также и присутствием органических веществ. В России мутность определяют фотометрическим путем сравнения проб исследуемой воды со стандартными суспензиями. Результат измерений выражают в мг/дм3 при использовании основной стандартной суспензии каолина или в ЕМ/дм3 (единицы мутности на дм3) при использовании основной стандартной суспензии формазина. Последнюю единицу измерения называют также Единица Мутности по Формазину (ЕМФ) или в западной терминологии FTU (Formazine Turbidity Unit). 1FTU=1ЕМФ=1ЕМ/ дм3. В последнее время в качестве основной во всем мире утвердилась фотометрическая методика измерения мутности по формазину, что нашло свое отражение в стандарте ISO 7027 (Water quality — Determination of turbidity). Согласно этому стандарту, единицей измерения мутности является FNU (Formazine Nephelometric Unit). Агентство по Охране Окружающей Среды США (U. S. EPA) и Всемирная Организация Здравоохранения (ВОЗ) используют единицу измерения мутности NTU (Nephelometric Turbidity Unit). Соотношение между основными единицами измерения мутности следующее: 1 FTU(ЕМФ)=1 FNU=1 NTU.
S. EPA) и Всемирная Организация Здравоохранения (ВОЗ) используют единицу измерения мутности NTU (Nephelometric Turbidity Unit). Соотношение между основными единицами измерения мутности следующее: 1 FTU(ЕМФ)=1 FNU=1 NTU.
ВОЗ по показаниям влияния на здоровье мутность не нормирует, однако с точки зрения внешнего вида рекомендует, чтобы мутность была не выше 5 NTU (нефелометрическая единица мутности), а для целей обеззараживания – не более 1 NTU.
Мера прозрачности – высота столба воды, при которой можно наблюдать опускаемую в воду белую пластину определенных размеров (диск Секки) или различать на белой бумаге шрифт определенного размера и типа (шрифт Снеллена). Результаты выражаются в сантиметрах.
Характеристика вод по прозрачности (мутности)
Прозрачность | Еденица измерения, см |
Средней мутности | |
Цветность
Цветность – показатель качества воды, обусловленный главным образом присутствием в воде гуминовых и фульфовых кислот, а также соединений железа (Fe3+). Количество этих веществ зависит от геологических условий в водоносных горизонтах и от количества и размеров торфяников в бассейне исследуемой реки. Так, наибольшую цветность имеют поверхностные воды рек и озер, расположенных в зонах торфяных болот и заболоченных лесов, наименьшую – в степях и степных зонах. Зимой содержание органических веществ в природных водах минимальное, в то время как весной в период половодья и паводков, а также летом в период массового развития водорослей – цветения воды — оно повышается. Подземные воды, как правило, имеют меньшую цветность, чем поверхностные. Таким образом, высокая цветность является тревожным признаком, свидетельствующим о неблагополучии воды. При этом очень важно выяснить причину цветности, так как методы удаления, например, железа и органических соединений отличаются. Наличие же органики не только ухудшает органолептические свойства воды, приводит к возникновению посторонних запахов, но и вызывает резкое снижение концентрации растворенного в воде кислорода, что может быть критично для ряда процессов водоочистки.
Количество этих веществ зависит от геологических условий в водоносных горизонтах и от количества и размеров торфяников в бассейне исследуемой реки. Так, наибольшую цветность имеют поверхностные воды рек и озер, расположенных в зонах торфяных болот и заболоченных лесов, наименьшую – в степях и степных зонах. Зимой содержание органических веществ в природных водах минимальное, в то время как весной в период половодья и паводков, а также летом в период массового развития водорослей – цветения воды — оно повышается. Подземные воды, как правило, имеют меньшую цветность, чем поверхностные. Таким образом, высокая цветность является тревожным признаком, свидетельствующим о неблагополучии воды. При этом очень важно выяснить причину цветности, так как методы удаления, например, железа и органических соединений отличаются. Наличие же органики не только ухудшает органолептические свойства воды, приводит к возникновению посторонних запахов, но и вызывает резкое снижение концентрации растворенного в воде кислорода, что может быть критично для ряда процессов водоочистки. Некоторые в принципе безвредные органические соединения, вступая в химические реакции (например, с хлором), способны образовывать очень вредные и опасные для здоровья человека соединения.
Некоторые в принципе безвредные органические соединения, вступая в химические реакции (например, с хлором), способны образовывать очень вредные и опасные для здоровья человека соединения.
Цветность измеряется в градусах платино-кобальтовой шкалы и колеблется от единиц до тысяч градусов – Таблица 2.
Характеристика вод по цветности
Цветность | Еденица измерения, градус платино-кобальтовой шкалы |
Очень высокая |
Вкус и привкус
Вкус воды определяется растворенными в ней веществами органического и неорганического происхождения и различается по характеру и интенсивности. Различают четыре основных вида вкуса: соленый, кислый, сладкий, горький. Все другие виды вкусовых ощущений называются привкусами (щелочной, металлический, вяжущий и т.п.). Интенсивность вкуса и привкуса определяют при 20 °С и оценивают по пятибалльной системе, согласно ГОСТ 3351-74*.
Различают четыре основных вида вкуса: соленый, кислый, сладкий, горький. Все другие виды вкусовых ощущений называются привкусами (щелочной, металлический, вяжущий и т.п.). Интенсивность вкуса и привкуса определяют при 20 °С и оценивают по пятибалльной системе, согласно ГОСТ 3351-74*.Качественную характеристику оттенков вкусовых ощущений – привкуса – выражают описательно: хлорный, рыбный, горьковатый и так далее. Наиболее распространенный соленый вкус воды чаще всего обусловлен растворенным в воде хлоридом натрия, горький – сульфатом магния, кислый – избытком свободного диоксида углерода и т.д. Порог вкусового восприятия соленых растворов характеризуется такими концентрациями (в дистиллированной воде), мг/л: NaCl – 165; CaCl2 – 470; MgCl2 – 135; MnCl2 – 1,8; FeCl2 – 0,35; MgSO4 – 250; CaSO4 – 70; MnSO4 – 15,7; FeSO4 – 1,6; NaHCO3 – 450.
По силе воздействия на органы вкуса ионы некоторых металлов выстраиваются в следующие ряды:
O катионы: Nh5+ > Na+ > K+; Fe2+ > Mn2+ > Mg2+ > Ca2+;
O анионы: ОН- > NO3- > Cl- > HCO3- > SO42- .
Характеристика вод по интенсивности вкуса
Интенсивность вкуса и привкуса | Характер появления вкуса и привкуса | Оценка интенсивности, балл |
Нет | Вкус и привкус не ощущаются | 0 |
Очень слабая | Вкус и привкус не ощущаются потребителем, но обнаруживаются при лабораторном исследовании | 1 |
Слабая | Вкус и привкус замечаются потребителем, если обратить на это его внимание | 2 |
Заметная | Вкус и привкус легко замечаются и вызывают неодобрительные отзывы о воде | 3 |
Отчетливая | Вкус и привкус обращают на себя внимание и заставляют воздержаться от питья | 4 |
Очень сильная | Вкус и привкус настолько сильные, что делают воду непригодной к употреблению | 5 |
Запах
Запах – показатель качества воды, определяемый органолептическим методом с помощью обоняния на основании шкалы силы запаха. На запах воды оказывают влияние состав растворенных веществ, температура, значения рН и целый ряд прочих факторов. Интенсивность запаха воды определяют экспертным путем при 20 °С и 60 °С и измеряют в баллах, согласно требованиям.
На запах воды оказывают влияние состав растворенных веществ, температура, значения рН и целый ряд прочих факторов. Интенсивность запаха воды определяют экспертным путем при 20 °С и 60 °С и измеряют в баллах, согласно требованиям.Следует также указывать группу запаха по следующей классификации:
По характеру запахи делят на две группы:
- естественного происхождения (живущие и отмершие в воде организмы, загнивающие растительные остатки и др.)
- искусственного происхождения (примеси промышленных и сельскохозяйственных сточных вод).
Запахи второй группы (искусственного происхождения) называют по определяющим запах веществам: хлорный, бензиновый и т.д.
Запахи естественного происхождения
Обозначение запаха | Характер запаха | Примерный род запаха |
А | Ароматический | огуречный, цветочный |
Б | Болотный | илистый, тинистый |
Г | Гнилостный | фекальный, сточный |
Д | Древесный | запах мокрой щепы, древесной коры |
З | Землистый | прелый, запах свежевспаханной земли, глинистый |
П | Плесневый | затхлый, застойный |
Р | Рыбный | запах рыбьегожира, рыбный |
С | Сероводородный | запах тухлых яиц |
Т | Травянистый | запах скошенной травы, сена |
Н | Неопределенный | Запахи естественного происхождения, не попадающие под предыдущие определения |
Интенсивность запаха по ГОСТ 3351-74* оценивают в шестибальной шкале – см.
 следующую страницу.
следующую страницу.Характеристика вод по интенсивности запаха
Интенсивность запаха | Характер появления запаха | Оценка интенсивности, балл |
Нет | Запах не ощущаются | 0 |
Очень слабая | Запах не ощущаются потребителем, но обнаруживаются при лабораторном исследовании | 1 |
Слабая | Запах замечаются потребителем, если обратить на это его внимание | 2 |
Заметная | Запах легко замечаются и вызывают неодобрительные отзывы о воде | 3 |
Отчетливая | Запах обращают на себя внимание и заставляют воздержаться от питья | 4 |
Очень сильная | Запах настолько сильные, что делают воду непригодной к употреблению | 5 |
Водородный показатель (рН)
Водородный показатель (рН) — характеризует концентрацию свободных ионов водорода в воде и выражает степень кислотности или щелочности воды (соотношение в воде ионов Н+ и ОН- образующихся при диссоциации воды) и количественно определяется концентрацией ионов водорода pH = — Ig [H+]Если в воде пониженное содержание свободных ионов водорода (рН>7) по сравнению с ионами ОН-, то вода будет иметь щелочную реакцию, а при повышенном содержании ионов Н+ (рН<7)- кислую. В идеально чистой дистиллированной воде эти ионы будут уравновешивать друг друга. В таких случаях вода нейтральна и рН=7. При растворении в воде различных химических веществ этот баланс может быть нарушен, что приводит к изменению уровня рН.
В идеально чистой дистиллированной воде эти ионы будут уравновешивать друг друга. В таких случаях вода нейтральна и рН=7. При растворении в воде различных химических веществ этот баланс может быть нарушен, что приводит к изменению уровня рН.
Определение pH выполняется колориметрическим или электрометрическим методом. Вода с низкой реакцией рН отличается коррозионностью, вода же с высокой реакцией рН проявляет склонность к вспениванию.
В зависимости от уровня рН воды можно условно разделить на несколько групп:
Характеристика вод по рН
Тип воды | Величина рН |
сильнокислые воды | |
слабокислые воды | |
нейтральные воды | |
слабощелочный воды | |
щелочные воды | |
сильнощелочные воды |
Контроль над уровнем рН особенно важен на всех стадиях водоочистки, так как его «уход» в ту или иную сторону может не только существенно сказаться на запахе, привкусе и внешнем виде воды, но и повлиять на эффективность водоочистных мероприятий.
 Оптимальная требуемая величина рН варьируется для различных систем водоочистки в соответствии с составом воды, характером материалов, применяемых в системе распределения, а также в зависимости от применяемых методов водообработки.
Оптимальная требуемая величина рН варьируется для различных систем водоочистки в соответствии с составом воды, характером материалов, применяемых в системе распределения, а также в зависимости от применяемых методов водообработки.Обычно уровень рН находится в пределах, при которых он непосредственно не влияет на потребительские качества воды. Так, в речных водах pH обычно находится в пределах 6.5-8.5, в атмосферных осадках 4.6-6.1, в болотах 5.5-6.0, в морских водах 7.9-8.3. Поэтому ВОЗ не предлагает какой-либо рекомендуемой по медицинским показателям величины для рН. Вместе с тем известно, что при низком рН вода обладает высокой коррозионной активностью, а при высоких уровнях (рН>11) вода приобретает характерную мылкость, неприятный запах, способна вызывать раздражение глаз и кожи. Именно поэтому для питьевой и хозяйственно-бытовой воды оптимальным считается уровень рН в диапазоне от 6 до 9.
Кислотность
Кислотностью называют содержание в воде веществ, способных вступать в реакцию с гидроксид-ионами (ОН-). Кислотность воды определяется эквивалентным количеством гидроксида, необходимого для реакции.
Кислотность воды определяется эквивалентным количеством гидроксида, необходимого для реакции.В обычных природных водах кислотность в большинстве случаев зависит только от содержания свободного диоксида углерода. Естественную часть кислотности создают также гуминовые и другие слабые органические кислоты и катионы слабых оснований (ионы аммония, железа, алюминия, органических оснований). В этих случаях pH воды не бывает ниже 4.5.
В загрязненных водоемах может содержаться большое количество сильных кислот или их солей за счет сброса промышленных сточных вод. В этих случаях pH может быть ниже 4.5. Часть общей кислотности, снижающей pH до величин < 4.5, называется свободной.
Жесткость
Общая (полная) жесткость – свойство, вызванное присутствием растворенных в воде веществ, в основном — солей кальция (Ca2+) и магния (Mg2+), а также других катионов, которые выступают в значительно меньших количествах, таких как ионы: железа, алюминия, марганца (Mn2+) и тяжелых металлов (стронций Sr2+, барий Ba2+).
Но общее содержание в природных водах ионов кальция и магния несравнимо больше содержания всех других перечисленных ионов – и даже их суммы. Поэтому под жесткостью понимают сумму количеств ионов кальция и магния – общая жесткость, складывающаяся из значений карбонатной (временной, устраняемой кипячением) и некарбонатной (постоянной) жесткости. Первая вызвана присутствием в воде гидрокарбонатов кальция и магния, вторая наличием сульфатов, хлоридов, силикатов, нитратов и фосфатов этих металлов.
В России жесткость воды выражают в мг-экв/дм3 или в моль/л.
Карбонатная жесткость (временная) – вызвана присутствием растворенных в воде бикарбонатов, карбонатов и углеводородов кальция и магния. Во время нагревания бикарбонаты кальция и магния частично оседают в растворе в результате обратимых реакций гидролиза.
Некарбонатная жесткость (постоянная) – вызывается присутствием растворенных в воде хлоридов, сульфатов и силикатов кальция (не растворяются и не оседают в растворе во время нагревания воды).
Характеристика вод по значению общей жесткости
Группа вод | Еденица измерения, ммоль/л |
Средней жесткости | |
Очень жесткая |
Щелочность
Щелочностью воды называется суммарная концентрация содержащихся в воде анионов слабых кислот и гидроксильных ионов (выражена в ммоль/л), вступающих в реакцию при лабораторных исследованиях с соляной или серной кислотами с образованием хлористых или сернокислых солей щелочных и щелочноземельных металлов.Различают следующие формы щелочности воды: бикарбонатная (гидрокарбонатная), карбонатная, гидратная, фосфатная, силикатная, гуматная – в зависимости от анионов слабых кислот, которыми обусловливается щелочность. Щелочность природных вод, рН которых обычно < 8,35, зависит от присутствия в воде бикарбонатов, карбонатов, иногда и гуматов. Щелочность других форм появляется в процессах обработки воды. Так как в природных водах почти всегда щелочность определяется бикарбонатами, то для таких вод общую щелочность принимают равной карбонатной жесткости.
Щелочность природных вод, рН которых обычно < 8,35, зависит от присутствия в воде бикарбонатов, карбонатов, иногда и гуматов. Щелочность других форм появляется в процессах обработки воды. Так как в природных водах почти всегда щелочность определяется бикарбонатами, то для таких вод общую щелочность принимают равной карбонатной жесткости.
Железо, марганец
Железо, марганец — в натуральной воде выступают преимущественно в виде углеводородов, сульфатов, хлоридов, гумусовых соединений и иногда фосфатов. Присутствие ионов железа и марганца очень вредит большинству технологических процессов, особенно в целлюлозной и текстильной промышленности, а также ухудшает органолептические свойства воды.Кроме того, содержание железа и марганца в воде может вызывать развитие марганцевых бактерий и железобактерий, колонии которых могут быть причиной зарастания водопроводных сетей.
Хлориды
Хлориды – присутствие хлоридов в воде может быть вызвано вымыванием залежей хлоридов или же они могут появиться в воде вследствие присутствия стоков. Чаще всего хлориды в поверхностных водах выступают в виде NaCl, CaCl2 и MgCl2, причем, всегда в виде растворенных соединений.
Чаще всего хлориды в поверхностных водах выступают в виде NaCl, CaCl2 и MgCl2, причем, всегда в виде растворенных соединений.Соединения азота
Соединения азота (аммиак, нитриты, нитраты) – возникают, главным образом, из белковых соединений, которые попадают в воду вместе со сточными водами. Аммиак, присутствующий в воде, может быть органического или неорганического происхождения. В случае органического происхождения наблюдается повышенная окисляемость.Нитриты возникают, главным образом, вследствие окисления аммиака в воде, могут также проникать в нее вместе с дождевой водой вследствие редукции нитратов в почве.
Нитраты — это продукт биохимического окисления аммиака и нитритов или же они могут быть выщелочены из почвы.
Сероводород
Сероводород придает воде неприятный запах, приводит к развитию серобактерий и вызывает коррозию. Сероводород, преимущественно присутствующий в подземных водах, может быть минерального, органического или биологического происхождения, причем в виде растворенного газа или сульфидов. То, под каким видом проявляется сероводород, зависит от реакции pH:
То, под каким видом проявляется сероводород, зависит от реакции pH:O при pH < 5 имеет вид h3S;
O при pH > 7 выступает в виде иона HS-;
O при pH = 5 : 7 может быть в виде, как h3S, так и HS-.
воде. Они поступают в воду вследствие вымывания осадочных горных пород, выщелачивания почвы и иногда вследствие окисления сульфидов и серы – продуктов расклада белка из сточных вод. Большое содержание сульфатов в воде может быть причиной болезней пищеварительного тракта, а также такая вода может вызывать коррозию бетона и железобетонных конструкций.
Двуокись углерода
Двуокись углерода (CO2) – в зависимости от реакции pH воды может быть в следующих видах:Сероводород придает воде неприятный запах, приводит к развитию серобактерий и вызывает коррозию. Сероводород, преимущественно присутствующий в подземных водах, может быть минерального, органического или биологического происхождения, причем в виде растворенного газа или сульфидов. То, под каким видом проявляется сероводород, зависит от реакции pH:
- при pH < 5 имеет вид h3S;
- при pH > 7 выступает в виде иона HS-;
- при pH = 5 : 7 может быть в виде, как h3S, так и HS-.

Сульфаты
Сульфаты (SO42-) – наряду с хлоридами являются наиболее распространенными видами загрязнения в воде. Они поступают в воду вследствие вымывания осадочных горных пород, выщелачивания почвы и иногда вследствие окисления сульфидов и серы – продуктов расклада белка из сточных вод. Большое содержание сульфатов в воде может быть причиной болезней пищеварительного тракта, а также такая вода может вызывать коррозию бетона и железобетонных конструкций.Двуокись углерода
Двуокись углерода (CO2) – в зависимости от реакции pH воды может быть в следующих видах:- pH < 4,0 – в основном, как газ CO2;
- pH = 8,4 – в основном в виде иона бикарбоната НСО3- ;
- pH > 10,5 – в основном в виде иона карбоната CO32-.
Агрессивная двуокись углерода – это часть свободной двуокиси углерода (CO2), которая необходима для удержания растворенных в воде углеводородов от разложения. Она очень активна и вызывает коррозию металлов. Кроме того, приводит к растворению карбоната кальция СаСО3 в строительных растворах или бетоне и поэтому ее необходимо удалять из воды, предназначенной для строительных целей.
 При оценке агрессивности воды, наряду с агрессивной концентрацией двуокиси углерода, следует также учитывать содержание солей в воде (солесодержание). Вода с одинаковым содержанием агрессивного CO2, тем более агрессивна, чем выше ее солесодержание.
При оценке агрессивности воды, наряду с агрессивной концентрацией двуокиси углерода, следует также учитывать содержание солей в воде (солесодержание). Вода с одинаковым содержанием агрессивного CO2, тем более агрессивна, чем выше ее солесодержание.Растворенный кислород
Поступление кислорода в водоем происходит путем растворения его при контакте с воздухом (абсорбции), а также в результате фотосинтеза водными растениями. Содержание растворенного кислорода зависит от температуры, атмосферного давления, степени турбулизации воды, минерализации воды и др. В поверхностных водах содержание растворенного кислорода может колебаться от 0 до 14 мг/л. В артезианской воде кислород практически отсутствует.Относительное содержание кислорода в воде, выраженное в процентах его нормального содержания и называется степенью насыщения кислородом. Этот параметр зависит от температуры воды, атмосферного давления и уровня минерализации. Вычисляется по формуле: M = (ax0,1308×100)/NxP, где
М – степень насыщения воды кислородом, %;
а – концентрация кислорода, мг/дм3;
Р – атмосферное давление в данной местности, МПа.
N – нормальная концентрация кислорода при данной температуре и общем давлении 0,101308 МПа, приведенная в следующей таблице:
Растворимость кислорода в зависимости от температуры воды
Температура воды, °С | 0 | 10 | 20 | 30 | 40 | 50 | 60 | 80 | 100 |
мг О2/дм3 | 14,6 | 11,3 | 9,1 | 7,5 | 6,5 | 5,6 | 4,8 | 2,9 | 0,0 |
Окисляемость
Окисляемость – это показатель, характеризующий содержание в воде органических и минеральных веществ, окисляемых сильным окислителем. Окисляемость выражается в мгO2 необходимого на окисление этих веществ, содержащихся в 1 дм3 исследованной воды.
Окисляемость выражается в мгO2 необходимого на окисление этих веществ, содержащихся в 1 дм3 исследованной воды.Различают несколько видов окисляемости воды: перманганатную (1 мг KMnO4 соответствует 0,25 мг O2), бихроматную, иодатную, цериевую. Наиболее высокая степень окисления достигается бихроматным и иодатным методами. В практике водоочистки для природных малозагрязненных вод определяют перманганатную окисляемость, а в более загрязненных водах – как правило, бихроматную окисляемость (называемую также ХПК – химическое потребление кислорода). Окисляемость является очень удобным комплексным параметром, позволяющим оценить общее загрязнение воды органическими веществами. Органические вещества, находящиеся в воде весьма разнообразны по своей природе и химическим свойствам. Их состав формируется как под влиянием биохимических процессов протекающих в водоеме, так и за счет поступления поверхностных и подземных вод, атмосферных осадков, промышленных и хозяйственно-бытовых сточных вод. Величина окисляемости природных вод может варьироваться в широких пределах от долей миллиграммов до десятков миллиграммов О2 на литр воды.
Поверхностные воды имеют более высокую окисляемость, а значит в них содержится высокие концентрации органических веществ по сравнению с подземными. Так, горные реки и озера характеризуются окисляемостью 2-3 мг О2/дм3, реки равнинные – 5-12 мг О2/дм3, реки с болотным питанием – десятки миллиграммов на 1 дм3.
Подземные же воды имеют в среднем окисляемость на уровне от сотых до десятых долей миллиграмма О2/дм3 (исключения составляют воды в районах нефтегазовых месторождений, торфяников, в сильно заболоченных местностях, подземных вод северной части РФ).
Электропроводность
Электропроводность – это численное выражение способности водного раствора проводить электрический ток. Электрическая проводимость природной воды зависит в основном от степени минерализации (концентрации растворенных минеральных солей) и температуры. Благодаря этой зависимости, по величине электропроводности можно с определенной степенью погрешности судить о минерализации воды. Такой принцип измерения используется, в частности, в довольно распространенных приборах оперативного измерения общего солесодержания (так называемых TDS-метрах).
Дело в том, что природные воды представляют собой растворы смесей сильных и слабых электролитов. Минеральную часть воды составляют преимущественно ионы натрия (Na+), калия (K+), кальция (Ca2+), хлора (Cl–), сульфата (SO42–), гидрокарбоната (HCO3–).
Этими ионами и обуславливается в основном электропроводность природных вод. Присутствие же других ионов, например трехвалентного и двухвалентного железа (Fe3+ и Fe2+), марганца (Mn2+), алюминия (Al3+), нитрата (NO3–), HPO4–, h3PO4– и т.п. не столь сильно влияет на электропроводность (конечно при условии, что эти ионы не содержатся в воде в значительных количествах, как например, это может быть в производственных или хозяйственно-бытовых сточных водах). Погрешности же измерения возникают из-за неодинаковой удельной электропроводимости растворов различных солей, а также из-за повышения электропроводимости с увеличением температуры. Однако, современный уровень техники позволяет минимизировать эти погрешности, благодаря заранее рассчитанным и занесенным в память зависимостям.
Электропроводность не нормируется, но величина 2000 мкС/см примерно соответствует общей минерализации в 1000 мг/л.
Окислительно-восстановительный потенциал (редокс-потенциал, Eh)
Окислительно-восстановительный потенциал (мера химической активности) Eh вместе с рН, температурой и содержанием солей в воде характеризует состояние стабильности воды. В частности этот потенциал необходимо учитывать при определении стабильности железа в воде. Eh в природных водах колеблется в основном от -0,5 до +0,7 В, но в некоторых глубоких зонах Земной коры может достигать значений минус 0,6 В (сероводородные горячие воды) и +1,2 В (перегретые воды современного вулканизма).Подземные воды классифицируются:
- Eh > +(0,1–1,15) В – окислительная среда; в воде присутствует растворенный кислород, Fe3+, Cu2+, Pb2+, Mo2+ и др.
- Eh – 0,0 до +0,1 В – переходная окислительно-восстановительная среда, характеризуется неустойчивым геохимическим режимом и переменным содержанием кислорода и cероводорода, а также слабым окислением и слабым восстановлением разных металлов;
- Eh < 0,0 – восстановительная среда; в воде присутствуют сероводород и металлы Fe2+, Mn2+, Mo2+ и др.

Зная значения рН и Eh, можно по диаграмме Пурбэ установить условия существования соединений и элементов Fe2+, Fe3+, Fe(ОН)2, Fe(ОН)3, FeСО3, FeS, (FeOH)2+.
Для улучшения качества и надежности водоснабжения Ростовский Водоканал автоматизирует систему дозирования сульфата аммония
Для улучшения качества и надежности водоснабжения Ростовский Водоканал автоматизирует систему дозирования сульфата аммония
До конца года АО «Ростовводоканал» автоматизирует систему дозирования сульфата аммония на Александровских очистных сооружениях. Это ещё один шаг компании, направленный на улучшение качества и надежности водоснабжения.
Сульфат аммония – незаменимый реагент в процессе очистки питьевой воды. Его использование позволяет предотвратить образование побочных продуктов её дезинфекции — хлорорганических соединений. Их содержание в питьевой воде строго регламентировано и контролируется Роспотребнадзором. Кроме того, применение сульфата аммония помогает снизить потребление хлора в процессе очистки воды почти на 50%.
Кроме того, применение сульфата аммония помогает снизить потребление хлора в процессе очистки воды почти на 50%.
Ростовский Водоканал давно отказался от применения жидкого хлора и перешел на экологически безопасный реагент — гипохлорит натрия, однако активным химическим элементом для обеззараживания воды по-прежнему является хлор.
До настоящего момента дозирование сульфата аммония в процессе водоподготовки контролировали с помощью ротаметров. Прибор, представляющий собой коническую трубку с поплавком-индикатором внутри, применяется для определения объемного расхода газа или жидкости в единицу времени.
«Система приготовления и дозирования требовала капитального ремонта, рассказывает директор технологического департамента АО «Ростовводоканал» Игорь Тронь. — С целью ее модернизации для повышения надежности и улучшения технических характеристик был выполнен проект реконструкции. Сейчас ведутся строительно-монтажные работы». Новая система, помимо капитального ремонта растворных емкостей, предусматривает замену насосных агрегатов, установку современных высокоточных насосов-дозаторов вместо ротаметров. Она будет полностью автоматизирована, за исключением работ по загрузке реагента в растворный бак.
Новая система, помимо капитального ремонта растворных емкостей, предусматривает замену насосных агрегатов, установку современных высокоточных насосов-дозаторов вместо ротаметров. Она будет полностью автоматизирована, за исключением работ по загрузке реагента в растворный бак.
После пуско-наладочных работ автоматическая система дозирования сульфата аммония будет введена в эксплуатацию. Планируется, что это произойдет до конца декабря 2017 года.
METTLER TOLEDO Весы для лаборатории, производства и торговли
Измерительные приборы — это оборудование, используемое для точного определения различных параметров исследуемых объектов. Наша компания занимается …
Измерительные приборы — это оборудование, используемое для точного определения различных параметров исследуемых объектов. Наша компания занимается производством и обслуживанием контрольно-измерительных приборов и весового оборудования для различных отраслей промышленности.
Предлагаем купить измерительные приборы для оптимизации технологических процессов, повышения производительности и снижения затрат. Точные инструменты позволят установить соответствие нормативным требованиям.
Точные инструменты позволят установить соответствие нормативным требованиям.
Мы осуществляем продажу измерительных приборов, предназначенных для исследовательской деятельности и научных разработок, производства продукции и контроля качества, логистики и розничной торговли. МЕТТЛЕР ТОЛЕДО предлагает следующие измерительные приборы для различных областей применения:
Лабораторное оборудование
Для научных и лабораторных исследований требуются высокоточные измерительные и аналитические приборы и системы. Они используются для взвешивания, анализа, дозирования, автоматизации химических процессов, измерения физических и химических свойств, концентрации газов, плотности, спектрального анализа веществ и рефрактометрии, химического синтеза, подготовки проб, реакционной калориметрии, анализа размеров и формы частиц. Специализированное программное обеспечение позволяет управлять процессами и получать наглядное отображение данных.
Лабораторное оборудование включают следующие системы:
Промышленное оборудование
Если вас интересуют промышленное измерительное оборудование, предлагаем купить подходящие системы для взвешивания, контроля продукции, решения логистических задач и транспортировки грузов. Используйте точные приборы для стандартного и сложного дозирования, взвешивания в сложных условиях и взрывоопасной среде. Обеспечьте точность результатов с помощью поверочных гирь и тестовых образцов. Подключение периферийных устройств к приборам позволит регистрировать результаты и параметры взвешивания. Программное обеспечение с понятным интерфейсом оптимизирует процессы посредством управления оборудованием с ПК.
Используйте точные приборы для стандартного и сложного дозирования, взвешивания в сложных условиях и взрывоопасной среде. Обеспечьте точность результатов с помощью поверочных гирь и тестовых образцов. Подключение периферийных устройств к приборам позволит регистрировать результаты и параметры взвешивания. Программное обеспечение с понятным интерфейсом оптимизирует процессы посредством управления оборудованием с ПК.
Ассортимент промышленных контрольно-измерительных приборов и инструментов включает:
Весы для магазинов и оборудование для розничной торговли
В сфере розничной торговли продовольственными товарами необходимы измерительные приборы и оборудование для взвешивания и маркировки товаров. Используйте весы для решения типовых задач, печати чеков и быстрого взвешивания, разгружающего поток покупателей. В сложных ситуациях пригодятся специализированные весовые системы с нетребовательным обслуживанием и уходом. ПО и документация упростят настройку системы и обучение персонала.
Вниманию покупателей предлагаются следующее оборудование для торговли:
Как купить весы МЕТТЛЕР ТОЛЕДО?
Чтобы купить оборудование на нашем сайте, оформите запрос в режиме онлайн в соответствующем разделе. Уточните задачу, которая должна быть решена с помощью требуемого прибора. Укажите контактные данные: страну, город, адрес, телефон, e-mail, название предприятия. Заполненная форма направляется специалисту компании, который свяжется с вами для уточнения ключевых моментов.
Сеть представительств METTLER TOLEDO для обслуживания и сервисной поддержки распространена по всему миру. В России отдел продаж и сервиса расположен в Москве. Региональные представительства по продажам находятся также в Казани, Ростове-на-Дону, Самаре, Екатеринбурге, Красноярске, Уфе, Хабаровске, Новосибирске.
Отправьте отзыв, задайте вопрос специалисту, свяжитесь с конкретным отделом. Воспользуйтесь онлайн-формой обратной связи или позвоните по указанному телефону офиса в выбранном регионе. Консультанты ответят на каждое обращение и вышлют коммерческое предложение по индивидуальному запросу.
Консультанты ответят на каждое обращение и вышлют коммерческое предложение по индивидуальному запросу.
СУЛЬФАТ
История использования сульфатов Сульфат — это встречающееся в природе соединение, состоящее из одного иона серы и четырех ионов кислорода (SO4). Сульфат — очень распространенное соединение, которое содержится почти во всех колодцах, и попадает в воду при растворении водоносного горизонта. Обычные сульфатсодержащие соединения включают барит (BaSO4), эпсомит или соль эпсома (MgSO4 · 7h3O) и гипс (CaSO4 · 2h3O). Сульфаты находят коммерческое применение в фармацевтике, текстиле, мыле, инсектицидах и производстве древесной массы.Сульфатные соединения часто содержат ионы жесткости (кальций и магний) и способствуют повышению уровня жесткости в некоторых системах грунтовых вод. Сульфат считается вторичным загрязняющим и вредным химическим веществом в достаточно высоких концентрациях. ПДК для сульфата составляет 250 мг / л, но типичные уровни воды в колодце колеблются от 5 до 50 мг / л. Известно, что высокий уровень сульфатов 500 мг / л или более имеет горький или лекарственный вкус, оказывает слабительное действие и вызывает обезвоживание. Высокий уровень сульфатов также может способствовать образованию минеральных отложений на кранах и приборах, а также образовывать пленку в лотках для кубиков льда.В некоторых водяных скважинах сульфатредуцирующие бактерии потребляют сульфат и в качестве побочного продукта создают сероводород. Водонагреватели, в которых наблюдается высокий уровень сульфатов, также могут со временем выделять сероводород, поскольку магниевый анодный стержень реагирует с сульфатами в воде, выделяя газообразный сероводород в качестве побочного продукта.
Известно, что высокий уровень сульфатов 500 мг / л или более имеет горький или лекарственный вкус, оказывает слабительное действие и вызывает обезвоживание. Высокий уровень сульфатов также может способствовать образованию минеральных отложений на кранах и приборах, а также образовывать пленку в лотках для кубиков льда.В некоторых водяных скважинах сульфатредуцирующие бактерии потребляют сульфат и в качестве побочного продукта создают сероводород. Водонагреватели, в которых наблюдается высокий уровень сульфатов, также могут со временем выделять сероводород, поскольку магниевый анодный стержень реагирует с сульфатами в воде, выделяя газообразный сероводород в качестве побочного продукта.
Сульфированные соединения, такие как лаурилсульфат натрия или (SLS), содержатся во многих продуктах, включая мыло, шампунь и зубную пасту. SLS — это поверхностно-активное вещество, вспенивающие свойства которого способствуют очистке.(Фото Бретта Джордана на Unsplash)
Варианты лечения Как указано выше, сульфаты обычно не считаются опасными для здоровья и включены в список вторичных загрязнителей в стандартах EPA для питьевой воды. Поэтому многие сертифицированные лаборатории не включают его в анализ воды. Они могут проверить общее содержание серы, которое будет включать все присутствующие серосодержащие соединения (включая сульфат). Анализ общего содержания серы часто ошибочно принимают за определение сероводорода, что подчеркивает необходимость тщательного изучения любого отчета об анализе воды.Присутствие сульфата не означает, что присутствует сероводород, и наоборот. В мире обработки воды уровень сульфатов является важным фактором при оценке потенциальной коррозии свинцового припоя и связанного с этим повышенного уровня содержания свинца в воде. В частности, нас интересует массовое соотношение хлоридов и сульфатов (также известное как CSMR), которое учитывает отношение хлорид-ионов в мг / л к сульфат-ионам в мг / л. Сульфаты могут образовывать тонкие защитные слои на поверхностях свинца, препятствующие гальванической коррозии от хлоридов.CSMR 0,5 или выше может привести к увеличению коррозионного потенциала свинцовых несущих труб, сантехнической арматуры и припоя, который выщелачивает свинец в питьевую воду.
Поэтому многие сертифицированные лаборатории не включают его в анализ воды. Они могут проверить общее содержание серы, которое будет включать все присутствующие серосодержащие соединения (включая сульфат). Анализ общего содержания серы часто ошибочно принимают за определение сероводорода, что подчеркивает необходимость тщательного изучения любого отчета об анализе воды.Присутствие сульфата не означает, что присутствует сероводород, и наоборот. В мире обработки воды уровень сульфатов является важным фактором при оценке потенциальной коррозии свинцового припоя и связанного с этим повышенного уровня содержания свинца в воде. В частности, нас интересует массовое соотношение хлоридов и сульфатов (также известное как CSMR), которое учитывает отношение хлорид-ионов в мг / л к сульфат-ионам в мг / л. Сульфаты могут образовывать тонкие защитные слои на поверхностях свинца, препятствующие гальванической коррозии от хлоридов.CSMR 0,5 или выше может привести к увеличению коррозионного потенциала свинцовых несущих труб, сантехнической арматуры и припоя, который выщелачивает свинец в питьевую воду. На коррозию свинца на границе раздела свинца и припоя влияют другие факторы, такие как pH и щелочность, но CSMR особенно важно учитывать при удалении сульфата из воды. Например, анионная смола с сильным основанием в хлоридной форме может использоваться для удаления повышенных уровней сульфата в воде. Однако обычно это не рекомендуется для лечения высоких сульфатов.Такой подход удаляет сульфаты, но часто создает проблему коррозии, поскольку повышает уровень хлоридов в очищенной воде и, в свою очередь, увеличивает CSMR. Другими словами, можно решить проблему сульфатов, но при этом создать проблему хлоридов. В приложениях с высоким содержанием сульфатов TDS также обычно очень высок, что означает, что, вероятно, подходит более широкая, общая технология снижения TDS. Наиболее распространенной из этих технологий будет POE R.O. система с соответствующей предварительной и последующей обработкой.Master Water Conditioning предлагает несколько вариантов очистки обратным осмосом, доступных для точки использования и точки входа, которые можно найти по этой ссылке.
На коррозию свинца на границе раздела свинца и припоя влияют другие факторы, такие как pH и щелочность, но CSMR особенно важно учитывать при удалении сульфата из воды. Например, анионная смола с сильным основанием в хлоридной форме может использоваться для удаления повышенных уровней сульфата в воде. Однако обычно это не рекомендуется для лечения высоких сульфатов.Такой подход удаляет сульфаты, но часто создает проблему коррозии, поскольку повышает уровень хлоридов в очищенной воде и, в свою очередь, увеличивает CSMR. Другими словами, можно решить проблему сульфатов, но при этом создать проблему хлоридов. В приложениях с высоким содержанием сульфатов TDS также обычно очень высок, что означает, что, вероятно, подходит более широкая, общая технология снижения TDS. Наиболее распространенной из этих технологий будет POE R.O. система с соответствующей предварительной и последующей обработкой.Master Water Conditioning предлагает несколько вариантов очистки обратным осмосом, доступных для точки использования и точки входа, которые можно найти по этой ссылке.
Как сульфаты попадают в воду? Envirotech Online
Обладая ядовитым, вредным и раздражающим действием на человеческий организм, удивительно, что мы продолжаем находить сульфаты во многих наших продуктах повседневного использования. Шампунь, кондиционер, средства для мытья лица, зубная паста и даже вода, которую мы пьем, содержат это потенциально опасное соединение.Но как сульфат вредит организму? Как вообще сульфаты попадают в воду? А как определить уровень сульфата в воде? Читайте дальше, чтобы узнать больше.
Что такое сульфат?
Сульфат — или SO 4 — обычно содержится почти во всех природных источниках воды. Многоатомный анион широко используется в ряде отраслей промышленности, включая фармацевтическую промышленность, чистящие средства и косметику. Это соли серной кислоты, обычно используемые в свинцово-кислотных аккумуляторах, чистящих средствах и удобрениях.
Хотя в некоторых случаях это может происходить естественным путем — с некоторыми почвами и камнями, содержащими сульфатные минералы, — сульфат преимущественно является загрязнителем, который попадает в нашу систему водоснабжения через отходы и промышленные сточные воды. Шахты, плавильные, бумажные, текстильные и кожевенные заводы производят большое количество сульфата, который остается в промышленных отходах и попадает в ручьи и грунтовые воды. Основными сульфатами, которые содержатся в воде, являются сульфаты натрия, калия и магния, поскольку все они хорошо растворимы.
Шахты, плавильные, бумажные, текстильные и кожевенные заводы производят большое количество сульфата, который остается в промышленных отходах и попадает в ручьи и грунтовые воды. Основными сульфатами, которые содержатся в воде, являются сульфаты натрия, калия и магния, поскольку все они хорошо растворимы.
Сульфаты присутствуют не только в нашем водоснабжении, но и в атмосфере. Триоксид серы, образующийся при сгорании ископаемого топлива, соединяется с водяным паром в воздухе с образованием разбавленной серной кислоты, известной как кислотный дождь.
Воздействие на здоровье
Хотя сульфаты в небольших количествах не должны существенно влиять на пьющего или потребителя, те, кто не привык к этому соединению, могут страдать от обезвоживания и диареи. Дети или дети с уже существующими кишечными проблемами часто более чувствительны к сульфатам, что повышает важность мониторинга уровней.Например, детское питание нельзя готовить с использованием воды с содержанием сульфата 400 мг / л и более.
Животные, как и дети, также очень чувствительны к сульфатам в питьевой воде. для молодых животных, особенно у молодых животных, высокие уровни сульфатов могут вызвать тяжелую, потенциально даже смертельную, диарею и болезнь.
Удаление сульфатов из воды
Хотя маловероятно, что содержание сульфатов в воде может быть фатальным для человека, воздействие высоких уровней может быть неприятным и разрушительным для кишечника.Поэтому важно знать уровень сульфата в воде и понимать, как его удалить. Для удаления сульфатов из воды используются три основных метода:
- Обратный осмос — система очистки воды, удаляющая практически все растворенные элементы и химические вещества из воды
- Дистилляция — вода кипятится и пар охлаждается до тех пор, пока он не конденсируется в отдельную емкость, оставляя все растворенные вещества позади
- Ионный обмен — более крупномасштабная очистка воды, включающая химическое удаление растворенных веществ из воды.

Исследование: не вините воду с высоким содержанием сульфатов в низкой производительности
Спенсер Беккер и Джон Пейшенс, Департамент зоотехники Университета штата Айова
Успешное производство свинины требует нескольких ключевых факторов. Один аспект, о котором часто забывают, — это наличие достаточного количества чистой питьевой воды. Вода — необходимое требование для всех животных; однако это питательное вещество особенно трудно изучать.
На качество воды могут влиять множественные загрязнители, в том числе микроорганизмы и высокий уровень минеральных веществ, например, сульфатные соли. Сульфаты вносят вклад в концентрацию всех растворенных твердых веществ в воде, которые являются общим индикатором качества воды. Сульфаты вызывают особую озабоченность из-за их известной способности вызывать непатогенную диарею у поросят-отъемышей. Увеличение случаев диареи и снижение показателей роста часто объясняется плохим качеством воды; однако исследования неизменно показывают, что это часто не так.
В статье, впервые опубликованной в Journal of Swine Health and Production 1 , были проведены два эксперимента на коммерческой ферме на 1200 свиноматок от опороса до откорма, чтобы оценить влияние источника воды с высоким содержанием сульфатов на рост поросят-отъемышей. представление. В первом эксперименте 240 свиней весом 13,0 ± 4,2 фунта получали либо обработанную обратным осмосом (n = 14 загонов), либо необработанную (сырую; n = 14 загонов) воду в течение 35 дней. Обратный осмос — единственный эффективный способ удалить из воды сульфаты.Вода подавалась через ниппельные или тарельчатые поилки. Все свиньи получали дополнительный цинк из оксида цинка в своем рационе. В обоих экспериментах пробы воды собирались еженедельно для анализа качества.
Анализ воды (таблица 1) показал, что необработанная вода содержала концентрации TDS в 15 раз больше, чем вода, обработанная обратным осмосом. Концентрация сульфатов в неочищенной воде постоянно была на 60-70% выше рекомендованных уровней, в то время как обработка обратным осмосом удаляла примерно 99% сульфатов из воды.
Таблица 1: Рекомендации по качеству воды и среднему составу питьевой воды, оцененные у свиней-питомников, содержащихся на коммерческом предприятии.
По завершении 35-дневного эксперимента свиньи весили 46,5 ± 6,8 фунтов. В течение всего пятинедельного периода питомника среднесуточный привес и среднесуточное потребление корма (Таблица 2) были одинаковыми независимо от водоподготовки или типа поилки (P> 0,05). Эффективность корма, как правило, была выше у свиней, использующих поилки тарельчатого типа, чем у свиней в загонах с поилками с ниппельными поилками (P
Университет штата АйоваТаблица 2: Влияние качества воды и типа поилки на показатели роста и исчезновение воды у поросят-отъемышей — эксперимент 2
Второй эксперимент был проведен, чтобы подтвердить результаты первого исследования и определить, было ли отсутствие воздействия воды с высоким содержанием сульфатов связано с включением оксида цинка в рацион.Было показано, что добавление к рациону свиней-отъемышей более высоких уровней цинка улучшает ADG, возможно, потому, что он контролирует патогенную кишечную палочку. Таким образом, включение цинка в рацион может способствовать смягчению ожидаемых негативных последствий плохого качества воды.
Таким образом, включение цинка в рацион может способствовать смягчению ожидаемых негативных последствий плохого качества воды.
В эксперименте 2 230 свиней весом 12,9 ± 2,0 фунта получали либо необработанную (n = 14 загонов), либо воду, обработанную обратным осмосом (n = 14 загонов), и им назначали диеты с добавлением либо нулевых миллиграммов (кроме той, что содержится в премиксе TM). ) или 3000 миллиграммов оксида цинка на килограмм корма.Это исследование было проведено некоторое время назад; теперь известно, что нельзя кормить таким количеством цинка в течение столь длительного периода времени. Однако, как и в первом эксперименте, ADG, ADFI и эффективность корма были сопоставимы независимо от обработки воды в конце 33-дневного периода (P> 0,05; Таблица 3). Свиньи, не получавшие оксид цинка, потребляли на 0,09 фунта больше корма в день (P
Университет штата АйоваТаблица 3: Влияние качества воды и добавок оксида цинка на показатели роста поросят-отъемышей — эксперимент 2
Эти исследования демонстрируют способность свиней-отъемышей обрабатывать большие количества сульфатов в питьевой воде. Низкое качество воды не повлияло на продуктивность свиней. Проблемы, связанные с плохим ростом, потреблением корма или диареей, не следует связывать с проблемами качества воды без предварительного изучения других факторов, таких как экологические, социальные и пищевые стрессы, возникающие при отъеме. Конечно, наблюдение за свиньями на воде с высоким содержанием сульфатов при диарее не должно автоматически приводить к выводу, что они плохо себя чувствуют. Сульфат в воде вызывает осмотическую диарею, которая сильно отличается от секреторной диареи, которая может быть вызвана патогенами.Основываясь на большом количестве исследований разного масштаба и проведенных в различных условиях, выясняется, что если вода не очень низкого качества, то есть она содержит больше сульфатов, чем наблюдалось в этом исследовании, вероятность того, что это приведет к плохой продуктивности животных, составляет довольно низко.
Низкое качество воды не повлияло на продуктивность свиней. Проблемы, связанные с плохим ростом, потреблением корма или диареей, не следует связывать с проблемами качества воды без предварительного изучения других факторов, таких как экологические, социальные и пищевые стрессы, возникающие при отъеме. Конечно, наблюдение за свиньями на воде с высоким содержанием сульфатов при диарее не должно автоматически приводить к выводу, что они плохо себя чувствуют. Сульфат в воде вызывает осмотическую диарею, которая сильно отличается от секреторной диареи, которая может быть вызвана патогенами.Основываясь на большом количестве исследований разного масштаба и проведенных в различных условиях, выясняется, что если вода не очень низкого качества, то есть она содержит больше сульфатов, чем наблюдалось в этом исследовании, вероятность того, что это приведет к плохой продуктивности животных, составляет довольно низко.
Необходимо отметить несколько заключительных моментов. Во-первых, опубликованные стандарты качества воды часто взяты из руководящих принципов человека. На самом деле они не применимы к животноводству, поскольку многие стандарты питьевой воды основаны на эстетике, а не на здоровье; примеры включают железо, марганец, твердость, мутность, цвет и т. д.Даже уровни сульфатов и нитратов чрезвычайно консервативны, что, конечно, уместно при работе с питьевой водой для людей.
На самом деле они не применимы к животноводству, поскольку многие стандарты питьевой воды основаны на эстетике, а не на здоровье; примеры включают железо, марганец, твердость, мутность, цвет и т. д.Даже уровни сульфатов и нитратов чрезвычайно консервативны, что, конечно, уместно при работе с питьевой водой для людей.
Во-вторых, несмотря на то, что вышеупомянутое исследование пришло к выводу, что у сульфатов до 1770 миллиграммов на литр нет побочных эффектов, при подозрении на проблему в данном сарае воду следует сдавать на анализ, в том числе на бактериологический. Один вопрос, на который еще не был дан ответ, заключается в том, приводит ли осмотическая диарея, вызванная сульфатами, к кишечному тракту, который становится более восприимчивым к патогенам, что, в свою очередь, может привести к ухудшению здоровья животных и, возможно, к ухудшению показателей роста.
Список литературы
1. Терпение, J.F., A.D. Beaulieu, D.A. Гиллис. 2004. Влияние грунтовых вод с высоким содержанием сульфатов на показатели роста, использование питательных веществ и уровень минеральных веществ в тканях свиней, содержащихся в коммерческих условиях.
 J. Swine Health Prod. 12: 228-236.
J. Swine Health Prod. 12: 228-236. 2. Целевая группа по руководству по качеству воды. Канадские рекомендации по качеству воды, Управление внутренних вод, Оттава, Онтарио. 1987.
Как выполнить строгие требования по удалению сульфатов при очистке шахтных вод — обзор возможных методов
https: // doi.org / 10.1016 / j.envres.2018.07.018Получить права и контентОсновные моменты
- •
Осаждение гипса может достигать 1500 частей на миллион SO 4 2- , но многие шахты имеют более строгие ограничения.
- •
Доступно несколько технологий для достижения низкого уровня SO 4 2- (даже около 0 ppm).
- •
Серные химикаты могут быть извлечены из сульфата.
Abstract
Сульфат (SO 4 2- ) является повсеместным анионом в природных водах. Он не считается токсичным, но в повышенных концентрациях может быть вредным для пресноводных видов. Горнодобывающая деятельность является одним из значительных источников антропогенного поступления сульфатов в природные воды, в основном из-за воздействия на сульфидные минеральные руды выветривания. Существует несколько стратегий уменьшения выделения сульфатов, начиная с предотвращения образования сульфатов в первую очередь и заканчивая несколькими вариантами обработки в конце трубы. В настоящее время наиболее широко используемым процессом удаления сульфатов является осаждение в виде гипса (CaSO 4 · 2H 2 O).Однако наименьшая достижимая концентрация теоретически составляет 1500 мгл -1 SO 4 2- из-за растворимости гипса. В то же время несколько шахт по всему миру имеют значительно более строгие ограничения на сброс сульфатов. Цель этого обзора — изучить варианты процесса для достижения низких уровней сульфатов (<1500 мг / л -1 ) в шахтных стоках.
Он не считается токсичным, но в повышенных концентрациях может быть вредным для пресноводных видов. Горнодобывающая деятельность является одним из значительных источников антропогенного поступления сульфатов в природные воды, в основном из-за воздействия на сульфидные минеральные руды выветривания. Существует несколько стратегий уменьшения выделения сульфатов, начиная с предотвращения образования сульфатов в первую очередь и заканчивая несколькими вариантами обработки в конце трубы. В настоящее время наиболее широко используемым процессом удаления сульфатов является осаждение в виде гипса (CaSO 4 · 2H 2 O).Однако наименьшая достижимая концентрация теоретически составляет 1500 мгл -1 SO 4 2- из-за растворимости гипса. В то же время несколько шахт по всему миру имеют значительно более строгие ограничения на сброс сульфатов. Цель этого обзора — изучить варианты процесса для достижения низких уровней сульфатов (<1500 мг / л -1 ) в шахтных стоках. Примеры таких процессов включают альтернативные методы химического осаждения, мембранную технологию, биологическую очистку, ионный обмен и адсорбцию.Кроме того, обсуждаются водно-химический состав и текущие стандарты сточных вод, касающиеся сульфатов, а также обработки концентрата и извлечения серы.
Примеры таких процессов включают альтернативные методы химического осаждения, мембранную технологию, биологическую очистку, ионный обмен и адсорбцию.Кроме того, обсуждаются водно-химический состав и текущие стандарты сточных вод, касающиеся сульфатов, а также обработки концентрата и извлечения серы.
Ключевые слова
Кислотный дренаж шахты
Пределы сброса
Сульфат
Извлечение серы
Загрязнение воды
Рекомендуемые статьиЦитирующие статьи (0)
Полный текст© 2018 Elsevier Inc. Все права защищены.
Рекомендуемые статьи
Ссылки на статьи
Технологии удаления сульфатов Обзор
Марк Рейнсел, Apex Engineering
Концентрации сульфатов в воде стали объектом пристального внимания регулирующих органов за последние два десятилетия.В отличие от загрязняющих веществ, таких как нитрат, мышьяк и тяжелые металлы, сульфат не имеет основного стандарта для питьевой воды или водных организмов. Однако вторичный стандарт питьевой воды в США составляет 250 мг / л, а концентрации выше 600 мг / л могут вызывать слабительный эффект. В Миннесоте будущие выбросы сульфатов могут быть ограничены до 10 мг / л (не соблюдаемый стандарт, который в настоящее время пересматривается) для защиты среды обитания дикого риса. Нормы содержания сульфатов во всем мире приведены в таблице 1.
Однако вторичный стандарт питьевой воды в США составляет 250 мг / л, а концентрации выше 600 мг / л могут вызывать слабительный эффект. В Миннесоте будущие выбросы сульфатов могут быть ограничены до 10 мг / л (не соблюдаемый стандарт, который в настоящее время пересматривается) для защиты среды обитания дикого риса. Нормы содержания сульфатов во всем мире приведены в таблице 1.
ТАБЛИЦА 1. РЕКОМЕНДУЕМЫЕ МАКСИМАЛЬНЫЕ УРОВНИ СУЛЬФАТА
Орган | Концентрация сульфата (мг / л) |
США | 500 |
Канада | 1 000 |
Европейский Союз | 1 000 |
Южная Африка | 600 |
Австралия | 1 000 |
Всемирная организация здравоохранения (питьевая вода) | 250 |
Откуда: Рамачандран, 2012
Многие технологии очистки были разработаны и усовершенствованы для удаления сульфатов из воды, включая химические, биологические и физические процессы.
Технологии химической обработки
К химическим методам снижения концентрации сульфатов относятся:
- Известковые осадки
- Осаждение бария
- Процесс CESR
- Процесс SAVMIN ™
Самой простой технологией снижения высоких концентраций сульфатов является осаждение извести. Добавление кальция в виде гальки, гашеной извести или известняка может привести к осаждению сульфата кальция (гипсу) и снижению концентрации сульфата до предела растворимости 1500–2000 мг / л.Добавление извести не повлияет на концентрации, уже ниже этого уровня. Типичные требования к оборудованию для этого процесса: бункер для извести, гашитель извести или другая система подачи реагентов, реакционный резервуар и осветлитель. Если сульфат необходимо дополнительно восстановить («отполировать»), рекомендуется дополнительный процесс, такой как барий, CESR или SAVMIN.
В качестве стадии полировки для удаления сульфата соли бария могут быть добавлены для осаждения сульфата бария, который имеет очень низкую растворимость в воде, при этом конечная концентрация сульфата ограничивается только количеством добавленного бария и временем реакции.Типичными используемыми солями являются хлорид бария и карбонат бария. Недостатком добавления бария является относительно высокая химическая стоимость; недавняя цена на хлорид бария составляла около 2 долларов за фунт.
Процесс рентабельного удаления сульфатов (CESR) был первоначально разработан как процесс Walhalla в Европе в 1990-х годах. Специальный порошкообразный цемент (реагент) добавляется для осаждения эттрингита, который представляет собой гидратированное соединение сульфата кальция и алюминия. Процесс CESR требует добавления извести и pH около 11.3 для образования эттрингита, и может достигать концентраций сульфатов намного ниже предела растворимости гипса (Reinsel, 2001). Концентрации сульфатов обычно ограничиваются только количеством добавленного реагента и временем реакции. Недостатками являются большое количество образующегося осадка и тот факт, что высокие концентрации натрия тормозят процесс. Реагент CESR стоит около 0,40 доллара за фунт.
Процесс SAVMIN был разработан компанией MINTEK в Южной Африке в 1990-х годах для очистки кислых стоков шахт.Эттрингит осаждается, как и в процессе CESR, в данном случае путем рециркуляции гидроксида алюминия. С помощью этого процесса уровень сульфатов может быть снижен до менее 200 мг / л. MINTEK подписала соглашение с Veolia South Africa о дальнейшем развитии процесса SAVMIN (Ramachandran, 2012). Недавно была проведена первая экспериментальная оценка усовершенствованного процесса SAVMIN с использованием осветлителя MULTIFLO ™ компании Veolia.
Технологии биологической очистки
Если металлы присутствуют в воде, подлежащей обработке, биологическая обработка имеет то преимущество, что позволяет удалить их вместе с сульфатом посредством осаждения сульфида металла.Биологические процессы удаления сульфата включают:
- Процесс THIOPAQ ™
- Другие реакторы с насадочным слоем или с псевдоожиженным слоем
- Пассивное лечение
- Обработка на месте Обработка
В процессе THIOPAQ, разработанном компанией PAQUES (Нидерланды), сульфид получают путем контактирования сульфатсодержащего потока с сульфатредуцирующими бактериями (SRB) в присутствии источника углерода (донора электронов), такого как газообразный водород или уксусная кислота. кислота.Реакция на водород:
SO 4 2- + 4 H 2 + SRB à S 2- + 4 H 2 O
Избыточный сульфид затем может быть преобразован в элементарную серу (S или ) с помощью аэробных бактерий следующим образом:
HS — + ½ O 2 + бактерии à S o + OH —
Основные преимущества, заявленные этим способом: a) концентрации H 2 S низкие, b) большая часть присутствующего H 2 S будет растворена в воде, а не в газовой фазе, c) процесс может быть проводятся при температуре окружающей среды, и г) скорость потока может варьироваться.Первая коммерческая установка для этого процесса была построена в 1992 году на заводе Budel Zinc для удаления цинка и сульфата из продувки кислотного завода (Ramachandran, 2012). Многие другие заводы работают с этой технологией.
Компания «Апекс Инжиниринг» спроектировала несколько относительно небольших систем очистки для удаления сульфатов из шахтной воды (Таблица 2). Первые три представляют собой системы с уплотненным слоем с непрерывным источником углерода (метанол или этанол), а последний — пассивный биореактор.Мы проектируем еще два пассивных биореактора для строительства в 2015 году.
ТАБЛИЦА 2. СИСТЕМЫ УДАЛЕНИЯ СУЛЬФАТА | |||
Расположение | Клиент | Год постройки | Описание |
Бэббит, Миннесота | PolyMet Mining | 2012 | Система с насадкой 10 галлонов в минуту для горнодобывающей промышленности Lake |
Республика, WA | Кинросс Голд | 2006 | Система с уплотненным слоем 50 галлонов в минуту для подземных вод, подверженных воздействию горных выработок, на закрытом золотом руднике |
Республика, WA | Кинросс Голд | 2005 | Система с насадочным слоем 6 галлонов в минуту для подземных вод, подверженных воздействию горных выработок, вблизи действующих хвостохранилищ |
Elko, NV | Veris Gold | 2014 | Пассивная система со скоростью 10 галлонов в минуту для фильтрации из зоны отвала горных пород на действующем золотом руднике |
Пассивные биореакторы или биохимические реакторы — еще одна проверенная технология удаления сульфатов.Биохимические реакторы (BCR) — это инженерные системы очистки, в которых используется органический субстрат для запуска микробных и химических реакций с целью снижения концентрации металлов, кислотности и сульфатов (ITRC, 2013). BCR использовались в основном для очистки вод, подверженных влиянию горных работ, в течение последних двух десятилетий. BCR могут быть сконфигурированы для работы с внешней энергией и химическим воздействием или без них и часто могут поддерживаться месяцами без вмешательства человека (отсюда и название «пассивные биореакторы»). Список сульфатредуцирующих BCR представлен в таблице 3.
ТАБЛИЦА 3. БИОХИМИЧЕСКИЕ РЕАКТОРЫ
Название сайта | Расположение | Расчетный расход (галлонов в минуту) |
Западная вилка | Миссури | 1,200 |
Рудник Голинский | Калифорния | 10 |
Шахта Железного короля | Аризона | 7 |
Йеллоу Крик 2Б | Пенсильвания | 10 |
Шахта Рудного холма | Нью-Гэмпшир | 6 |
Шахта «Золотой крест» | Новая Зеландия | 300 |
Шахта Кендалла | Монтана | 5 |
Шахта Хайле | Южная Каролина | 6 |
Шахта Quinsam | Британская Колумбия, Канада | 250 |
Шахта Деламар | Айдахо | 20 |
Репозиторий Латтрелла | Монтана | 5 |
Согласно Mattson (2014), стандартные биореакторы имеют преимущество в производительности по сравнению с BCR, но при увеличении капитальных затрат и затрат на эксплуатацию и техническое обслуживание.По словам Маттсона, стандартные биореакторы, такие как THIOPAQ или системы с уплотненным слоем, более эффективны и могут быть лучше адаптированы для крупномасштабных применений.
Сульфатредукция in situ (ISSR) — это инновационная технология, сочетающая биологическое восстановление сульфатов с подходами гидрогеологии ремедиации (Gillow et al., 2014). Источник углерода, такой как лактат, вводят для катализа восстановления сульфата через in situ SRB, при этом сера затем выделяется в виде сульфидных минералов и / или элементарной серы.ISSR был разработан ARCADIS. Apex Engineering включила ISSR в качестве компонента систем обработки для Kinross Gold и Veris Gold (Таблица 2).
Сообщается о следующих преимуществах: а) широкий выбор недорогих источников углерода, б) низкий потенциал нарушения технологического процесса и в) меньшие усилия при эксплуатации, чем при откачке и очистке. Однако проблемы включают управление осадками, управление конечным качеством воды, распределение источника углерода в недрах и возможность «отскока» сульфатов после прекращения обработки.Доступны несколько вариантов закачки источника углерода.
Взгляд ARCADIS на будущее ISSR таков:
- Это жизнеспособная технология для конкретных приложений.
- Важно учитывать глубину, толщину насыщения и рецепторы нисходящего излучения.
- Добавление железа для контроля растворенного сульфида не требуется.
- Необходимо контролировать гидравлические характеристики и биогеохимические параметры.
- Масштаб технологии должен быть от опытного до промежуточного / полномасштабного.
Технологии физической обработки
Физические процессы удаления сульфата включают:
- Процессы ионного обмена, такие как GYP-CIX и Sulf-IX ™
- Нанофильтрация
- Обратный осмос
GYP-CIX — это процесс ионного обмена в псевдоожиженном слое, разработанный в Южной Африке для удаления сульфата из воды, близкий к гипсовому насыщению, поэтому его можно использовать в качестве этапа полировки после осаждения извести.Это исторический предшественник процесса Sulf-IX, который поддерживает смолу IX в том же сосуде, чтобы минимизировать истирание при обращении со смолой.
Компания BioteQ Environmental Technologies из Ванкувера разработала процесс Sulf-IX для удаления сульфата из воды с высокой жесткостью и почти с гипсовым насыщением. Процесс Sulf-IX предназначен для выборочного удаления кальция и сульфата из воды для обеспечения соответствия сточных вод ограничениям сброса сульфатов. Это двухступенчатый IX с использованием двух смол (катионной и анионной) для частичной деминерализации питательной воды.Катионные и анионные смолы регенерируются с использованием серной кислоты и извести, соответственно, для получения нетоксичного твердого гипса (единственного побочного продукта процесса). Одним из значительных преимуществ Sulf-IX перед мембранными системами является то, что он не производит солевой раствор, что обеспечивает значительную экономию затрат на утилизацию солевого раствора путем хранения или выпаривания. Первый коммерческий завод, использующий эту технологию, работает в Аризоне с 2011 года и имеет мощность 600 м 3 / день (110 галлонов в минуту).
Нанофильтрация (NF) — это мембранный процесс, который можно использовать для удаления сульфатов и других загрязнителей.Он работает при более высоком давлении (более высокие эксплуатационные расходы), чем микрофильтрация или ультрафильтрация, но при более низком давлении, чем обратный осмос (RO). NF будет иметь высокое удаление (высокое отклонение) сульфата, потому что это двухвалентный ион, но будет иметь более низкое отклонение одновалентных ионов, таких как нитрат и натрий. Для NF и других мембранных процессов сульфаты и другие загрязняющие вещества концентрируются в отбракованном потоке, который может составлять от 10 до 40 процентов исходного потока. Еще одно соображение — удаление или обработка отбракованного потока.
Обратный осмос для удаления сульфатов обычно рассматривается только тогда, когда необходимо удалить одновалентные загрязнения. В противном случае NF более экономичен для удаления сульфатов, чем RO.
Golder Associates представила недавний документ, в котором резюмируются процессы очистки от сульфатов (Golder, 2014). Их выводы включают:
- Активная биологическая очистка никогда не становилась популярной, несмотря на обширные исследования и разработки.
- Пассивное лечение продвинулось вперед и может быть конкурентоспособным по стоимости.
- Эксплуатационные расходы на IX зависят от цен на реагенты и эффективности использования реагентов.
- Мембранные технологии для удаления сульфатов ниже уровней растворимости гипса коммерчески продемонстрированы и получили признание.
- Стоимость и сложность усовершенствованных проектов по удалению сульфатов требует независимой экспертной оценки.
Ссылки
- Дж. Гиллоу, М. Хей и Дж. Хорст, 2014. Очистка сульфатной воды в шахтах на месте — практические разработки в полевых условиях. INAP Sulfate Workshop, Солт-Лейк-Сити, 27 февраля -е .
- Golder Associates, 2014. Установленные и инновационные процессы очистки от сульфатов. INAP Sulfate Workshop, Солт-Лейк-Сити, 27 февраля -е .
- ITRC, 2013. Биохимические реакторы для отходов горнодобывающей промышленности . БКР-1. Вашингтон, округ Колумбия: Межгосударственный совет по технологиям и регулированию, Группа по биохимическим реакторам для горнодобывающих предприятий. www.itrcweb.org.
- Mattson, B., 2014. Обзор вопросов сульфатной обработки: обзор INAP по обработке сульфата в шахтных сточных водах. INAP Sulfate Workshop, Солт-Лейк-Сити, 27 февраля -е .
- Ramachandran, V., 2012. Удаление, контроль и управление общим количеством растворенных твердых частиц из технологических стоков в цветной металлургии — обзор. Материалы 51 st Конференции металлургов, 30 сентября — 3 октября 2012 г., Ниагара, Онтарио, Канада.Стр. 101-117.
- Reinsel, M., 2001. Новый способ удаления сульфатов из промышленных вод. Water Online, июнь.
За дополнительной информацией обращайтесь к Марку Рейнзелю на http://www.apexengineering.us.
Безопасна ли вода с серой? | Очистка серной воды в вашем доме
Если вы заметили запах тухлых яиц в своей воде, вы, вероятно, задаетесь вопросом, в безопасности ли вы и ваша семья. Запах тухлых яиц — признак того, что уровень серы в вашей воде может быть слишком высоким.Иногда странный запах указывает на присутствие других загрязнений.
Это понятно, если ты не хочешь пить или купаться в дурно пахнущей воде, да и не должен. Хорошая чистая вода не имеет вкуса и запаха и не представляет опасности для вашего здоровья. Если ваша вода имеет неприятный запах или вкус тухлых яиц, мы готовы помочь. В этом посте мы рассмотрим риски, связанные с серной водой, ответим на общие вопросы и покажем вам, как обрабатывать серную воду. У вас может быть чистая вода, которая не имеет неприятного запаха и не повреждает трубы в вашем доме, независимо от того, идет ли ваша вода из колодца или из общественного источника.
Что такое сульфаты и сероводород?
Сульфаты естественным образом встречаются в горных породах и почве. Со временем сульфаты со временем растворяются и попадают в подземные воды — источник колодезной воды. Сульфат не выделяет газа и поэтому не имеет запаха.
Газообразный сероводород также встречается в природе и может поступать из множества различных источников под землей, таких как гниющий растительный материал или бактерии. Вы можете представить себе крошечные бактерии, поедающие серу, а затем производящие сероводород в виде отходов.Не очень утешительно знать, что дурно пахнущая вода — это продукт жизнедеятельности бактерий.
Сероводород также может образовываться из скважин, пробуренных в сланце, или водонагревателей, содержащих магниевые стержни. Независимо от причины, вы можете почувствовать запах сильнее, когда используете горячую воду, потому что нагретая вода выделяет захваченный газ быстрее, чем холодная вода.
Опасна ли серная вода?
Многие люди спрашивают: «Может ли серная вода вызвать болезнь?» Ответ на этот вопрос зависит от количества серы в воде.Хотя в большинстве бытовых систем водоснабжения нет опасных уровней серы, слишком высокий уровень может вызвать боль в желудке и тошноту. Точно так же высокий уровень сульфатов в питьевой воде может быть проблематичным, особенно для младенцев.
Во многих случаях самой большой проблемой серной воды является ее вкус или запах. Большинство людей может обнаружить в воде сероводород в небольшой концентрации 0,5 частей на миллион (ppm). Вода с концентрацией серы от 0,5 до 1 ppm пахнет плесенью, тогда как уровни выше 1 ppm вызывают запах тухлых яиц и разъедают металлические трубы.
Диарея и обезвоживание. Питьевая вода с высоким содержанием сульфатов может оказывать слабительное действие и вызывать диарею, которая затем может вызвать обезвоживание. Горький вкус: сульфаты могут вызывать горечь из-за отложений накипи в трубах. Слизь, забивающая трубы: сульфаты могут привести к образованию слизи, которая забивает трубы или окрашивает одежду. Неэффективный отбеливатель: сульфаты могут снизить эффективность отбеливателя и затруднить надлежащую очистку одежды ». } }] }
Можно ли пить воду с серой?
Если уровень серы в питьевой воде не слишком высок, это не должно вызывать никаких проблем со здоровьем.Однако слишком много сульфата может привести к следующим проблемам:
- Диарея и обезвоживание: Питьевая вода с высоким содержанием сульфатов может оказывать слабительное действие и вызывать диарею, которая затем может вызвать обезвоживание.
- Горький вкус: Сульфаты могут вызывать горечь из-за отложений накипи в трубах.
- Слизь, забивающая трубы: Сульфаты могут привести к образованию слизи, которая забивает трубы или окрашивает одежду.
- Неэффективный отбеливатель: Сульфаты могут снизить эффективность отбеливателя и затруднить надлежащую очистку одежды.
Сероводород также не вызывает проблем со здоровьем в питьевой воде, если его уровни не слишком высоки, но он может вызвать другие проблемы, такие как следующие:
- Неприятный запах: Сероводород вызывает запах тухлых яиц в воде и может сделать напитки и другие напитки неаппетитными.
- Плохой вкус: Сероводород может повлиять на вкус напитков и еды.
- Корродированный металл: Сероводород истирает такие металлы, как железо, сталь и медь.В результате сероводород может сократить срок службы труб и повлиять на водопроводную систему дома.
- Морилка: Сероводород может вызвать появление желтых или черных пятен на сантехнике в ванной или кухне.
- Потускневшая посуда: Сероводород может вызвать черный налет на серебряной посуде и испачкать медную или латунную посуду.
Полезна ли серная вода для волос и кожи?
Многие считают, что употребление серы или купание в серной воде полезно для кожи, волос и ногтей, но существует ограниченное количество научных данных, подтверждающих пользу этого минерала для красоты.Многие обычные продукты, такие как яйца, рыба и птица, содержат серу. Сбалансированная диета обеспечит вас всей необходимой серой, а потребление слишком большого количества серы может привести к желудочно-кишечным симптомам.
Как удалить серу из воды
Первый шаг к удалению сульфатов и сероводорода из воды — это лично проверить воду у квалифицированного специалиста. Это позволит определить точную причину появления воды с неприятным вкусом и неприятным запахом. Убедитесь, что в вашей воде нет других загрязнителей, о которых вы могли не подозревать, например, бактерий.Иногда причиной запаха является загрязнение сточных вод, которые содержат вредные примеси, такие как бактерии группы кишечной палочки и нитраты, поэтому очень важно проверить воду. Анализ воды также покажет вам, сколько серы содержится в вашей воде, чтобы вы могли предпринять правильные шаги для решения проблемы.
Даже если вас не беспокоит уровень серы, все равно стоит проверить воду. Департамент охраны окружающей среды, Агентство по охране окружающей среды и Университет штата Пенсильвания рекомендуют домовладельцам, имеющим частные колодцы, ежегодно проверять воду на наличие бактерий.
Как только вы узнаете, что в вашей воде и сколько, вы можете предпринять необходимые шаги для удаления загрязнений. Лучшее лечение зависит от уровня и формы сероводорода или сульфатов в вашей воде, а также от наличия других загрязнителей. Некоторые варианты водоподготовки включают следующее:
- Аэрация : Метод удаления аэрации добавляет в воду воздух, что может снизить уровень сероводорода в воде. Этот метод требует установки системы аэрации для добавления воздуха в воду из колодца до того, как она попадет в дом.
- Neutra Sul: Neutra Sul (перекись водорода) нейтрализует запах тухлых яиц и загрязняющие вещества серы путем окисления. Neutra Sul имеет подтвержденную консистенцию и может использоваться для предотвращения образования цвета, вкуса, коррозии и образования накипи из-за разложения загрязнений. Стабилизатор в Neutral Sul обеспечивает в 5 раз больший срок хранения, чем у стандартной 7% перекиси водорода. Pro Neutra Sul имеет сертификат NSF, соответствующий стандарту NSF / ANSI 60 для добавок к питьевой воде.
- Фильтр для удаления железа : можно использовать фильтр для удаления железа, который удаляет умеренное количество сероводорода.Фильтр химически реагирует с сероводородом, превращая его в нерастворимую серу, которую затем можно удалить в процессе фильтрации.
- Хлорный отбеливатель: Хлорный отбеливатель удаляет сероводород, вступая в реакцию с сероводородом и уничтожая запах. Этот метод требует использования автоматического хлоратора для подачи хлора в систему водоснабжения. Затем система фильтрации удаляет серу и другой образовавшийся осадок.
Другие варианты включают установку системы очистки воды на раковину или установку нового колодца.Если запах тухлого яйца исходит от стержня в водонагревателе, вы можете решить проблему, заменив магниевый стержень на стержень из алюминия или цинка.
Запланировать анализ воды на сероводород сегодня
Если вы чувствуете запах тухлых яиц в своей воде, мы рекомендуем пройти профессиональную проверку воды. Вы узнаете причину запаха и обнаружите любые другие потенциально опасные загрязнители в вашей воде. Эксперт по воде подскажет, какой метод очистки воды лучше всего подходит для вашей конкретной ситуации, чтобы вы могли спокойно пить воду дома.
Если вы живете в районе Аллентауна, штат Пенсильвания, и хотите, чтобы ваша вода проверялась профессионалами, которым вы можете доверять, обратитесь к нам в Long’s EcoWater Systems, Inc. Мы бесплатно проведем анализ воды на дому и предоставим индивидуальные услуги. решение, отвечающее вашим потребностям. Чтобы начать свой путь к чистой и безопасной воде, запланируйте тест на воду сегодня!
Поделиться:
Чувство сульфатов
В предыдущих статьях мы обсуждали влияние железа и «соленую воду» и способы их устранения.Эта статья, третья в этом выпуске, посвящена сульфату, его потенциальному воздействию и способам обращения с исходной водой с высоким содержанием сульфата.
О сульфатеСульфат присутствует почти во всех подземных и поверхностных источниках воды из-за встречающейся в природе серы в почвах, минералах и горных породах. Другие источники сульфата можно отнести к сжиганию ископаемого топлива, добыче полезных ископаемых и сельскохозяйственным ресурсам (MPCA, 1999). Сульфат хорошо растворяется в воде и не имеет запаха. Его не следует путать с сероводородом, который имеет отчетливый запах тухлого яйца при низких концентрациях.На количество сульфата, присутствующего в источнике воды, влияют такие факторы, как географическое положение и глубина скважины (Veenhuizen, 1993).
Животные, пьющие воду из источника с высоким содержанием сульфатов, часто демонстрируют более высокий уровень потребления воды, диарею, а также уменьшение количества сухого вещества фекалий (Anderson et al., 1978). Описанные симптомы обычно наиболее очевидны у молодых животных и обычно проходят в течение 7 дней после того, как они акклиматизируются к источнику воды (Veenhuizen, 1993).
Три обычные сульфатные соли, присутствующие в воде, — это сульфат натрия, сульфат магния и сульфат кальция (Patterson et al, 1979). Знание того, какая сульфатная соль преобладает в исходной воде, имеет решающее значение, поскольку степень реакции животного зависит не только от концентрации сульфата, но и от концентрации сульфата, а также связанного с ним катиона (Grout et al., 2006) . Сульфат магния может оказывать негативное воздействие на животных при гораздо более низких концентрациях, чем сульфат натрия (Adams et al., 1975).
Чтобы узнать, сколько сульфатов содержится в воде, необходимо провести лабораторный анализ воды. Если тестирование показывает, что присутствует повышенный уровень сульфатов, существует два метода удаления сульфата из воды: анионный обмен и обратный осмос. Анионный обмен работает путем обмена ионов сульфата на другой ион, который обычно является хлоридом. Возникающее в результате увеличение количества хлорид-ионов приведет к избыточному потреблению хлорида животными и приведет к обмену одного набора проблем на другой.
Обратный осмос и удаление сульфатовКогда дело доходит до здоровья животных, обратный осмос — единственное жизнеспособное применение для удаления сульфата из воды. В системах обратного осмоса используются полупроницаемые мембраны и давление для удаления твердых частиц из воды. Обратный осмос работает по принципу, описанному в его названии, — это процесс, обратный осмосу. Осмос — это процесс перемещения растворителя или воды в данном случае из области с низкой концентрацией растворенного вещества (растворенных твердых веществ) через мембрану в область с высокой концентрацией растворенного вещества.Системы обратного осмоса вызывают обратное осмосу за счет приложения давления к стороне мембраны с высокой концентрацией растворенного вещества, заставляя воду проходить через мембрану, но не позволяя твердым частицам в воде делать это.
В результате образуются два потока воды: (1) пермеат или вода, прошедшая через мембраны, из которой удалена большая часть твердых веществ, и (2) ретентат, который включает твердые частицы и другие материалы. которые не могли проходить через мембраны.Пермеат — это часть, которая в конечном итоге станет питьевой водой для животных, а ретентат — это сточный поток воды, который необходимо будет утилизировать. Отношение пермеата к ретентату будет зависеть от состава источника воды.
Рекомендации по установке обратного осмоса При использовании систем обратного осмоса необходимо учитывать несколько моментов. Во-первых, это размер системы. Каждую систему необходимо подобрать по размеру, чтобы она соответствовала индивидуальному местоположению, чтобы система могла производить достаточно воды для удовлетворения потребности в воде на ферме.
Вторая часть — это входящий источник воды. Есть определенные параметры, которым должен соответствовать источник входящей воды для установки обратного осмоса, чтобы предотвратить засорение, образование накипи или повреждение мембран. Анализ этих проблемных компонентов, таких как кальций, железо и другие твердые частицы (песок, грязь и другие твердые частицы), следует проводить до установки системы обратного осмоса. Если какой-либо из параметров превышает максимальный порог для установки обратного осмоса, необходимо будет провести предварительную обработку, чтобы удалить или смягчить эти загрязнения перед входом в установку обратного осмоса, чтобы предотвратить повреждение и снижение производительности мембран.
Если у вас есть вопросы, связанные с сульфатами в питьевой воде, и вам нужны варианты их решения, обратитесь к своему менеджеру по охране здоровья животных MWI. Мы здесь, чтобы помочь!
.