Влияние тяжелых металлов на живые организмы: «Влияние солей тяжелых металлов на системы жизнедеятельности человека»
«Влияние солей тяжелых металлов на системы жизнедеятельности человека»
Автор:
Калинченко Анна
Исследовательская работа
Скачать:
Предварительный просмотр:
li:before{margin-left:55.5pt}#doc7856947 5.lst-kix_list_30-8>li:before{margin-left:55.5pt}#doc7856947 4ol.lst-kix_list_39-3.start{margin-left:55.5pt}#doc7856947 3.lst-kix_list_34-1>li{margin-left:55.5pt}#doc7856947 2.lst-kix_list_22-8>li:before{margin-left:55.5pt}#doc7856947 1.lst-kix_list_6-7>li:before{margin-left:55.5pt}#doc7856947 0ol.lst-kix_list_37-8.start{color:#000000}#doc7856947 9.lst-kix_list_34-0>li:before{color:#000000}#doc7856947 8.lst-kix_list_21-3>li:before{color:#000000}#doc7856947 7ol.lst-kix_list_38-7.start{color:#000000}#doc7856947 6ol.lst-kix_list_39-2.start{color:#000000}#doc7856947 5ol.lst-kix_list_29-4.start{color:#000000}#doc7856947 4.lst-kix_list_8-5>li:before{color:#000000}#doc7856947 3.lst-kix_list_25-2>li:before{color:#000000}#doc7856947 2.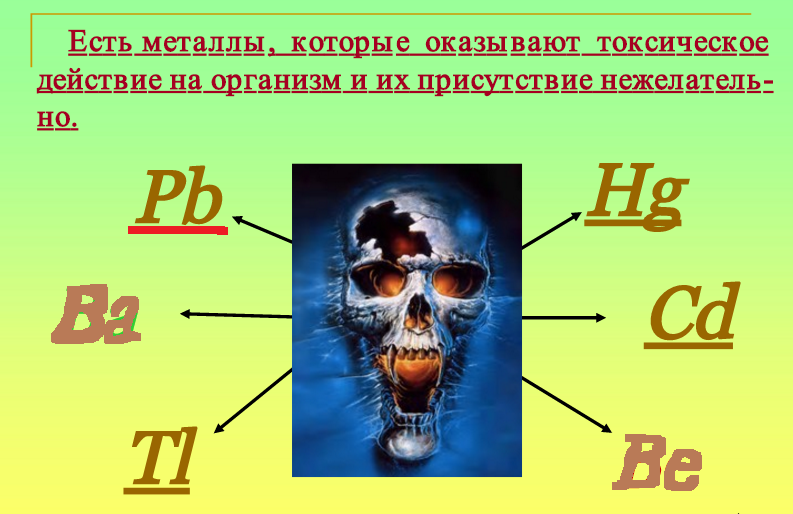 lst-kix_list_33-2>li:before{color:#000000}#doc7856947 1ol.lst-kix_list_19-1.start{color:#000000}#doc7856947 0.lst-kix_list_21-2>li{margin-right:-7.9pt}#doc7856947 9ol.lst-kix_list_16-4.start{margin-right:-7.9pt}#doc7856947 8.lst-kix_list_22-1>li:before{margin-right:-7.9pt}#doc7856947 7.lst-kix_list_16-7>li{margin-right:-7.9pt}#doc7856947 6.lst-kix_list_32-7>li:before{margin-right:-7.9pt}#doc7856947 5ol.lst-kix_list_25-2.start{margin-right:-7.9pt}#doc7856947 4.lst-kix_list_18-0>li:before{margin-right:-7.9pt}#doc7856947 3ol.lst-kix_list_30-2.start{margin-right:-7.9pt}#doc7856947 2.lst-kix_list_38-4>li:before{margin-right:-7.9pt}#doc7856947 1.lst-kix_list_13-4>li:before{margin-right:-7.9pt}#doc7856947 0.lst-kix_list_5-2>li:before{line-height:1.5}#doc7856947 9.lst-kix_list_9-1>li:before{line-height:1.5}#doc7856947 8.lst-kix_list_26-7>li{line-height:1.5}#doc7856947 7ol.lst-kix_list_33-4.start{line-height:1.5}#doc7856947 6.lst-kix_list_18-0>li{line-height:1.5}#doc7856947 5.lst-kix_list_15-8>li:before{line-height:1.
lst-kix_list_33-2>li:before{color:#000000}#doc7856947 1ol.lst-kix_list_19-1.start{color:#000000}#doc7856947 0.lst-kix_list_21-2>li{margin-right:-7.9pt}#doc7856947 9ol.lst-kix_list_16-4.start{margin-right:-7.9pt}#doc7856947 8.lst-kix_list_22-1>li:before{margin-right:-7.9pt}#doc7856947 7.lst-kix_list_16-7>li{margin-right:-7.9pt}#doc7856947 6.lst-kix_list_32-7>li:before{margin-right:-7.9pt}#doc7856947 5ol.lst-kix_list_25-2.start{margin-right:-7.9pt}#doc7856947 4.lst-kix_list_18-0>li:before{margin-right:-7.9pt}#doc7856947 3ol.lst-kix_list_30-2.start{margin-right:-7.9pt}#doc7856947 2.lst-kix_list_38-4>li:before{margin-right:-7.9pt}#doc7856947 1.lst-kix_list_13-4>li:before{margin-right:-7.9pt}#doc7856947 0.lst-kix_list_5-2>li:before{line-height:1.5}#doc7856947 9.lst-kix_list_9-1>li:before{line-height:1.5}#doc7856947 8.lst-kix_list_26-7>li{line-height:1.5}#doc7856947 7ol.lst-kix_list_33-4.start{line-height:1.5}#doc7856947 6.lst-kix_list_18-0>li{line-height:1.5}#doc7856947 5.lst-kix_list_15-8>li:before{line-height:1. 5}#doc7856947 4.lst-kix_list_38-8>li{line-height:1.5}#doc7856947 3.lst-kix_list_7-2>li:before{line-height:1.5}#doc7856947 2.lst-kix_list_21-0>li{line-height:1.5}#doc7856947 1.lst-kix_list_37-6>li:before{line-height:1.5}#doc7856947 0ol.lst-kix_list_38-1.start{margin-left:18pt}#doc7856947 9ol.lst-kix_list_40-4.start{margin-left:18pt}#doc7856947 8.lst-kix_list_37-5>li:before{margin-left:18pt}#doc7856947 7.lst-kix_list_17-8>li{margin-left:18pt}#doc7856947 6.lst-kix_list_40-2>li:before{margin-left:18pt}#doc7856947 5ol.lst-kix_list_18-3.start{margin-left:18pt}#doc7856947 4.lst-kix_list_30-5>li{margin-left:18pt}#doc7856947 3.lst-kix_list_19-8>li{margin-left:18pt}#doc7856947 2.lst-kix_list_31-7>li:before{margin-left:18pt}#doc7856947 1.lst-kix_list_36-4>li:before{margin-left:18pt}#doc7856947 0.lst-kix_list_9-3>li:before{text-indent:35.4pt}#doc7856947 9.lst-kix_list_9-6>li:before{text-indent:35.4pt}#doc7856947 8.lst-kix_list_2-0>li:before{text-indent:35.4pt}#doc7856947 7.lst-kix_list_28-7>li:before{text-indent:35.
5}#doc7856947 4.lst-kix_list_38-8>li{line-height:1.5}#doc7856947 3.lst-kix_list_7-2>li:before{line-height:1.5}#doc7856947 2.lst-kix_list_21-0>li{line-height:1.5}#doc7856947 1.lst-kix_list_37-6>li:before{line-height:1.5}#doc7856947 0ol.lst-kix_list_38-1.start{margin-left:18pt}#doc7856947 9ol.lst-kix_list_40-4.start{margin-left:18pt}#doc7856947 8.lst-kix_list_37-5>li:before{margin-left:18pt}#doc7856947 7.lst-kix_list_17-8>li{margin-left:18pt}#doc7856947 6.lst-kix_list_40-2>li:before{margin-left:18pt}#doc7856947 5ol.lst-kix_list_18-3.start{margin-left:18pt}#doc7856947 4.lst-kix_list_30-5>li{margin-left:18pt}#doc7856947 3.lst-kix_list_19-8>li{margin-left:18pt}#doc7856947 2.lst-kix_list_31-7>li:before{margin-left:18pt}#doc7856947 1.lst-kix_list_36-4>li:before{margin-left:18pt}#doc7856947 0.lst-kix_list_9-3>li:before{text-indent:35.4pt}#doc7856947 9.lst-kix_list_9-6>li:before{text-indent:35.4pt}#doc7856947 8.lst-kix_list_2-0>li:before{text-indent:35.4pt}#doc7856947 7.lst-kix_list_28-7>li:before{text-indent:35. 4pt}#doc7856947 6.lst-kix_list_2-4>li:before{text-indent:35.4pt}#doc7856947 5.lst-kix_list_10-7>li{text-indent:35.4pt}#doc7856947 4ol.lst-kix_list_15-6{text-indent:35.4pt}#doc7856947 3ol.lst-kix_list_15-7{text-indent:35.4pt}#doc7856947 2ol.lst-kix_list_15-8{text-indent:35.4pt}#doc7856947 1ol.lst-kix_list_34-7.start{text-indent:35.4pt}#doc7856947 0ol.lst-kix_list_15-0{margin-left:27pt}#doc7856947 9.lst-kix_list_37-4>li:before{margin-left:27pt}#doc7856947 8ol.lst-kix_list_15-1{margin-left:27pt}#doc7856947 7.lst-kix_list_12-7>li:before{margin-left:27pt}#doc7856947 6ol.lst-kix_list_15-2{margin-left:27pt}#doc7856947 5ol.lst-kix_list_15-3{margin-left:27pt}#doc7856947 4ol.lst-kix_list_15-4{margin-left:27pt}#doc7856947 3ol.lst-kix_list_15-5{margin-left:27pt}#doc7856947 2.lst-kix_list_34-6>li{margin-left:27pt}#doc7856947 1.lst-kix_list_21-4>li:before{margin-left:27pt}#doc7856947 0.lst-kix_list_28-6>li{text-align:right}#doc7856947 9ol.lst-kix_list_31-7.start{text-align:right}#doc7856947 8.lst-kix_list_34-6>li:before{text-align:right}#doc7856947 7.
4pt}#doc7856947 6.lst-kix_list_2-4>li:before{text-indent:35.4pt}#doc7856947 5.lst-kix_list_10-7>li{text-indent:35.4pt}#doc7856947 4ol.lst-kix_list_15-6{text-indent:35.4pt}#doc7856947 3ol.lst-kix_list_15-7{text-indent:35.4pt}#doc7856947 2ol.lst-kix_list_15-8{text-indent:35.4pt}#doc7856947 1ol.lst-kix_list_34-7.start{text-indent:35.4pt}#doc7856947 0ol.lst-kix_list_15-0{margin-left:27pt}#doc7856947 9.lst-kix_list_37-4>li:before{margin-left:27pt}#doc7856947 8ol.lst-kix_list_15-1{margin-left:27pt}#doc7856947 7.lst-kix_list_12-7>li:before{margin-left:27pt}#doc7856947 6ol.lst-kix_list_15-2{margin-left:27pt}#doc7856947 5ol.lst-kix_list_15-3{margin-left:27pt}#doc7856947 4ol.lst-kix_list_15-4{margin-left:27pt}#doc7856947 3ol.lst-kix_list_15-5{margin-left:27pt}#doc7856947 2.lst-kix_list_34-6>li{margin-left:27pt}#doc7856947 1.lst-kix_list_21-4>li:before{margin-left:27pt}#doc7856947 0.lst-kix_list_28-6>li{text-align:right}#doc7856947 9ol.lst-kix_list_31-7.start{text-align:right}#doc7856947 8.lst-kix_list_34-6>li:before{text-align:right}#doc7856947 7. lst-kix_list_35-7>li:before{text-align:right}#doc7856947 6ol.lst-kix_list_17-3.start{text-align:right}#doc7856947 5.lst-kix_list_9-4>li{text-align:right}#doc7856947 4.lst-kix_list_13-7>li{text-align:right}#doc7856947 3.lst-kix_list_12-3>li{text-align:right}#doc7856947 2ol.lst-kix_list_21-6{text-align:right}#doc7856947 1ol.lst-kix_list_21-5{text-align:right}#doc7856947 0ol.lst-kix_list_21-4{font-size:16pt}#doc7856947 9ol.lst-kix_list_21-3{font-size:16pt}#doc7856947 8ol.lst-kix_list_21-8{font-size:16pt}#doc7856947 7.lst-kix_list_8-1>li:before{font-size:16pt}#doc7856947 6.lst-kix_list_31-2>li:before{font-size:16pt}#doc7856947 5ol.lst-kix_list_21-7{font-size:16pt}#doc7856947 4.lst-kix_list_17-6>li{font-size:16pt}#doc7856947 3ol.lst-kix_list_8-1{font-size:16pt}#doc7856947 2.lst-kix_list_18-3>li:before{font-size:16pt}#doc7856947 1ol.lst-kix_list_21-1{font-size:16pt}#doc7856947 0ol.lst-kix_list_10-1.start{font-family:»Times New Roman»}#doc7856947 9ol.lst-kix_list_21-2{font-family:»Times New Roman»}#doc7856947 8ol.
lst-kix_list_35-7>li:before{text-align:right}#doc7856947 6ol.lst-kix_list_17-3.start{text-align:right}#doc7856947 5.lst-kix_list_9-4>li{text-align:right}#doc7856947 4.lst-kix_list_13-7>li{text-align:right}#doc7856947 3.lst-kix_list_12-3>li{text-align:right}#doc7856947 2ol.lst-kix_list_21-6{text-align:right}#doc7856947 1ol.lst-kix_list_21-5{text-align:right}#doc7856947 0ol.lst-kix_list_21-4{font-size:16pt}#doc7856947 9ol.lst-kix_list_21-3{font-size:16pt}#doc7856947 8ol.lst-kix_list_21-8{font-size:16pt}#doc7856947 7.lst-kix_list_8-1>li:before{font-size:16pt}#doc7856947 6.lst-kix_list_31-2>li:before{font-size:16pt}#doc7856947 5ol.lst-kix_list_21-7{font-size:16pt}#doc7856947 4.lst-kix_list_17-6>li{font-size:16pt}#doc7856947 3ol.lst-kix_list_8-1{font-size:16pt}#doc7856947 2.lst-kix_list_18-3>li:before{font-size:16pt}#doc7856947 1ol.lst-kix_list_21-1{font-size:16pt}#doc7856947 0ol.lst-kix_list_10-1.start{font-family:»Times New Roman»}#doc7856947 9ol.lst-kix_list_21-2{font-family:»Times New Roman»}#doc7856947 8ol. lst-kix_list_21-0{font-family:»Times New Roman»}#doc7856947 7.lst-kix_list_33-3>li:before{font-family:»Times New Roman»}#doc7856947 6.lst-kix_list_40-6>li{font-family:»Times New Roman»}#doc7856947 5.lst-kix_list_25-7>li:before{font-family:»Times New Roman»}#doc7856947 4.lst-kix_list_33-1>li{font-family:»Times New Roman»}#doc7856947 3ol.lst-kix_list_28-3.start{font-family:»Times New Roman»}#doc7856947 2.lst-kix_list_4-0>li:before{font-family:»Times New Roman»}#doc7856947 1.lst-kix_list_27-3>li:before{font-family:»Times New Roman»}#doc7856947 0.lst-kix_list_16-8>li:before{font-weight:bold}#doc7856947 9ol.lst-kix_list_33-1.start{font-weight:bold}#doc7856947 8.lst-kix_list_32-2>li{font-weight:bold}#doc7856947 7ol.lst-kix_list_20-5.start{font-weight:bold}#doc7856947 6.lst-kix_list_10-7>li:before{font-weight:bold}#doc7856947 5.lst-kix_list_22-3>li{font-weight:bold}#doc7856947 4ol.lst-kix_list_19-7{font-weight:bold}#doc7856947 3ol.lst-kix_list_19-6{font-weight:bold}#doc7856947 2.lst-kix_list_14-6>li:before{font-weight:bold}#doc7856947 1.
lst-kix_list_21-0{font-family:»Times New Roman»}#doc7856947 7.lst-kix_list_33-3>li:before{font-family:»Times New Roman»}#doc7856947 6.lst-kix_list_40-6>li{font-family:»Times New Roman»}#doc7856947 5.lst-kix_list_25-7>li:before{font-family:»Times New Roman»}#doc7856947 4.lst-kix_list_33-1>li{font-family:»Times New Roman»}#doc7856947 3ol.lst-kix_list_28-3.start{font-family:»Times New Roman»}#doc7856947 2.lst-kix_list_4-0>li:before{font-family:»Times New Roman»}#doc7856947 1.lst-kix_list_27-3>li:before{font-family:»Times New Roman»}#doc7856947 0.lst-kix_list_16-8>li:before{font-weight:bold}#doc7856947 9ol.lst-kix_list_33-1.start{font-weight:bold}#doc7856947 8.lst-kix_list_32-2>li{font-weight:bold}#doc7856947 7ol.lst-kix_list_20-5.start{font-weight:bold}#doc7856947 6.lst-kix_list_10-7>li:before{font-weight:bold}#doc7856947 5.lst-kix_list_22-3>li{font-weight:bold}#doc7856947 4ol.lst-kix_list_19-7{font-weight:bold}#doc7856947 3ol.lst-kix_list_19-6{font-weight:bold}#doc7856947 2.lst-kix_list_14-6>li:before{font-weight:bold}#doc7856947 1. lst-kix_list_10-6>li{font-weight:bold}#doc7856947 0ol.lst-kix_list_19-8{text-indent:28.4pt}#doc7856947 9ol.lst-kix_list_19-3{text-indent:28.4pt}#doc7856947 8ol.lst-kix_list_19-2{text-indent:28.4pt}#doc7856947 7ol.lst-kix_list_19-5{text-indent:28.4pt}#doc7856947 6.lst-kix_list_10-1>li:before{text-indent:28.4pt}#doc7856947 5ol.lst-kix_list_19-4{text-indent:28.4pt}#doc7856947 4ol.lst-kix_list_19-1{text-indent:28.4pt}#doc7856947 3ol.lst-kix_list_19-0{text-indent:28.4pt}#doc7856947 2.lst-kix_list_13-1>li:before{text-indent:28.4pt}#doc7856947 1.lst-kix_list_23-6>li:before{text-indent:28.4pt}#doc7856947 0.lst-kix_list_22-5>li{font-size:12pt}#doc7856947 9.lst-kix_list_18-8>li{font-size:12pt}#doc7856947 8ol.lst-kix_list_20-4.start{font-size:12pt}#doc7856947 7ol.lst-kix_list_33-0.start{font-size:12pt}#doc7856947 6ol.lst-kix_list_18-5.start{font-size:12pt}#doc7856947 5.lst-kix_list_8-6>li:before{font-size:12pt}#doc7856947 4.lst-kix_list_1-5>li:before{font-size:12pt}#doc7856947 3ol.lst-kix_list_29-0.
lst-kix_list_10-6>li{font-weight:bold}#doc7856947 0ol.lst-kix_list_19-8{text-indent:28.4pt}#doc7856947 9ol.lst-kix_list_19-3{text-indent:28.4pt}#doc7856947 8ol.lst-kix_list_19-2{text-indent:28.4pt}#doc7856947 7ol.lst-kix_list_19-5{text-indent:28.4pt}#doc7856947 6.lst-kix_list_10-1>li:before{text-indent:28.4pt}#doc7856947 5ol.lst-kix_list_19-4{text-indent:28.4pt}#doc7856947 4ol.lst-kix_list_19-1{text-indent:28.4pt}#doc7856947 3ol.lst-kix_list_19-0{text-indent:28.4pt}#doc7856947 2.lst-kix_list_13-1>li:before{text-indent:28.4pt}#doc7856947 1.lst-kix_list_23-6>li:before{text-indent:28.4pt}#doc7856947 0.lst-kix_list_22-5>li{font-size:12pt}#doc7856947 9.lst-kix_list_18-8>li{font-size:12pt}#doc7856947 8ol.lst-kix_list_20-4.start{font-size:12pt}#doc7856947 7ol.lst-kix_list_33-0.start{font-size:12pt}#doc7856947 6ol.lst-kix_list_18-5.start{font-size:12pt}#doc7856947 5.lst-kix_list_8-6>li:before{font-size:12pt}#doc7856947 4.lst-kix_list_1-5>li:before{font-size:12pt}#doc7856947 3ol.lst-kix_list_29-0. start{font-size:12pt}#doc7856947 2.lst-kix_list_25-3>li:before{font-size:12pt}#doc7856947 1.lst-kix_list_29-0>li:before{font-size:12pt}#doc7856947 0ol.lst-kix_list_8-1.start{margin-left:-0.6pt}#doc7856947 9.lst-kix_list_40-0>li:before{margin-left:-0.6pt}#doc7856947 8.lst-kix_list_24-1>li:before{margin-left:-0.6pt}#doc7856947 7.lst-kix_list_2-3>li:before{margin-left:-0.6pt}#doc7856947 6ol.lst-kix_list_30-3.start{margin-left:-0.6pt}#doc7856947 5.lst-kix_list_20-8>li{margin-left:-0.6pt}#doc7856947 4ol.lst-kix_list_32-1.start{margin-left:-0.6pt}#doc7856947 3.lst-kix_list_9-7>li{margin-left:-0.6pt}#doc7856947 2.lst-kix_list_13-8>li:before{margin-left:-0.6pt}#doc7856947 1ol.lst-kix_list_34-6{margin-left:-0.6pt}#doc7856947 0ol.lst-kix_list_34-5{text-indent:36pt}#doc7856947 9.lst-kix_list_16-0>li{text-indent:36pt}#doc7856947 8ol.lst-kix_list_30-8.start{text-indent:36pt}#doc7856947 7ol.lst-kix_list_34-8{text-indent:36pt}#doc7856947 6ol.lst-kix_list_34-7{text-indent:36pt}#doc7856947 5ol.lst-kix_list_29-5.
start{font-size:12pt}#doc7856947 2.lst-kix_list_25-3>li:before{font-size:12pt}#doc7856947 1.lst-kix_list_29-0>li:before{font-size:12pt}#doc7856947 0ol.lst-kix_list_8-1.start{margin-left:-0.6pt}#doc7856947 9.lst-kix_list_40-0>li:before{margin-left:-0.6pt}#doc7856947 8.lst-kix_list_24-1>li:before{margin-left:-0.6pt}#doc7856947 7.lst-kix_list_2-3>li:before{margin-left:-0.6pt}#doc7856947 6ol.lst-kix_list_30-3.start{margin-left:-0.6pt}#doc7856947 5.lst-kix_list_20-8>li{margin-left:-0.6pt}#doc7856947 4ol.lst-kix_list_32-1.start{margin-left:-0.6pt}#doc7856947 3.lst-kix_list_9-7>li{margin-left:-0.6pt}#doc7856947 2.lst-kix_list_13-8>li:before{margin-left:-0.6pt}#doc7856947 1ol.lst-kix_list_34-6{margin-left:-0.6pt}#doc7856947 0ol.lst-kix_list_34-5{text-indent:36pt}#doc7856947 9.lst-kix_list_16-0>li{text-indent:36pt}#doc7856947 8ol.lst-kix_list_30-8.start{text-indent:36pt}#doc7856947 7ol.lst-kix_list_34-8{text-indent:36pt}#doc7856947 6ol.lst-kix_list_34-7{text-indent:36pt}#doc7856947 5ol.lst-kix_list_29-5. start{text-indent:36pt}#doc7856947 4ol.lst-kix_list_34-2{text-indent:36pt}#doc7856947 3ol.lst-kix_list_34-1{text-indent:36pt}#doc7856947 2ol.lst-kix_list_34-4{text-indent:36pt}#doc7856947 1.lst-kix_list_37-2>li{text-indent:36pt}#doc7856947 0ol.lst-kix_list_34-3{height:10pt}#doc7856947 9ol.lst-kix_list_39-5.start{height:10pt}#doc7856947 8.lst-kix_list_22-8>li{height:10pt}#doc7856947 7.lst-kix_list_39-6>li:before{height:10pt}#doc7856947 6.lst-kix_list_36-8>li:before{height:10pt}#doc7856947 5ol.lst-kix_list_26-7.start{height:10pt}#doc7856947 4.lst-kix_list_20-2>li:before{height:10pt}#doc7856947 3.lst-kix_list_10-6>li:before{height:10pt}#doc7856947 2ol.lst-kix_list_34-0{height:10pt}#doc7856947 1.lst-kix_list_21-5>li:before{height:10pt}#doc7856947 0ol.lst-kix_list_15-3.start{direction:ltr}#doc7856947 9.lst-kix_list_15-5>li{direction:ltr}#doc7856947 8ol.lst-kix_list_13-3.start{direction:ltr}#doc7856947 7.lst-kix_list_10-2>li:before{direction:ltr}#doc7856947 6.lst-kix_list_20-7>li:before{direction:ltr}#doc7856947 5ol.
start{text-indent:36pt}#doc7856947 4ol.lst-kix_list_34-2{text-indent:36pt}#doc7856947 3ol.lst-kix_list_34-1{text-indent:36pt}#doc7856947 2ol.lst-kix_list_34-4{text-indent:36pt}#doc7856947 1.lst-kix_list_37-2>li{text-indent:36pt}#doc7856947 0ol.lst-kix_list_34-3{height:10pt}#doc7856947 9ol.lst-kix_list_39-5.start{height:10pt}#doc7856947 8.lst-kix_list_22-8>li{height:10pt}#doc7856947 7.lst-kix_list_39-6>li:before{height:10pt}#doc7856947 6.lst-kix_list_36-8>li:before{height:10pt}#doc7856947 5ol.lst-kix_list_26-7.start{height:10pt}#doc7856947 4.lst-kix_list_20-2>li:before{height:10pt}#doc7856947 3.lst-kix_list_10-6>li:before{height:10pt}#doc7856947 2ol.lst-kix_list_34-0{height:10pt}#doc7856947 1.lst-kix_list_21-5>li:before{height:10pt}#doc7856947 0ol.lst-kix_list_15-3.start{direction:ltr}#doc7856947 9.lst-kix_list_15-5>li{direction:ltr}#doc7856947 8ol.lst-kix_list_13-3.start{direction:ltr}#doc7856947 7.lst-kix_list_10-2>li:before{direction:ltr}#doc7856947 6.lst-kix_list_20-7>li:before{direction:ltr}#doc7856947 5ol.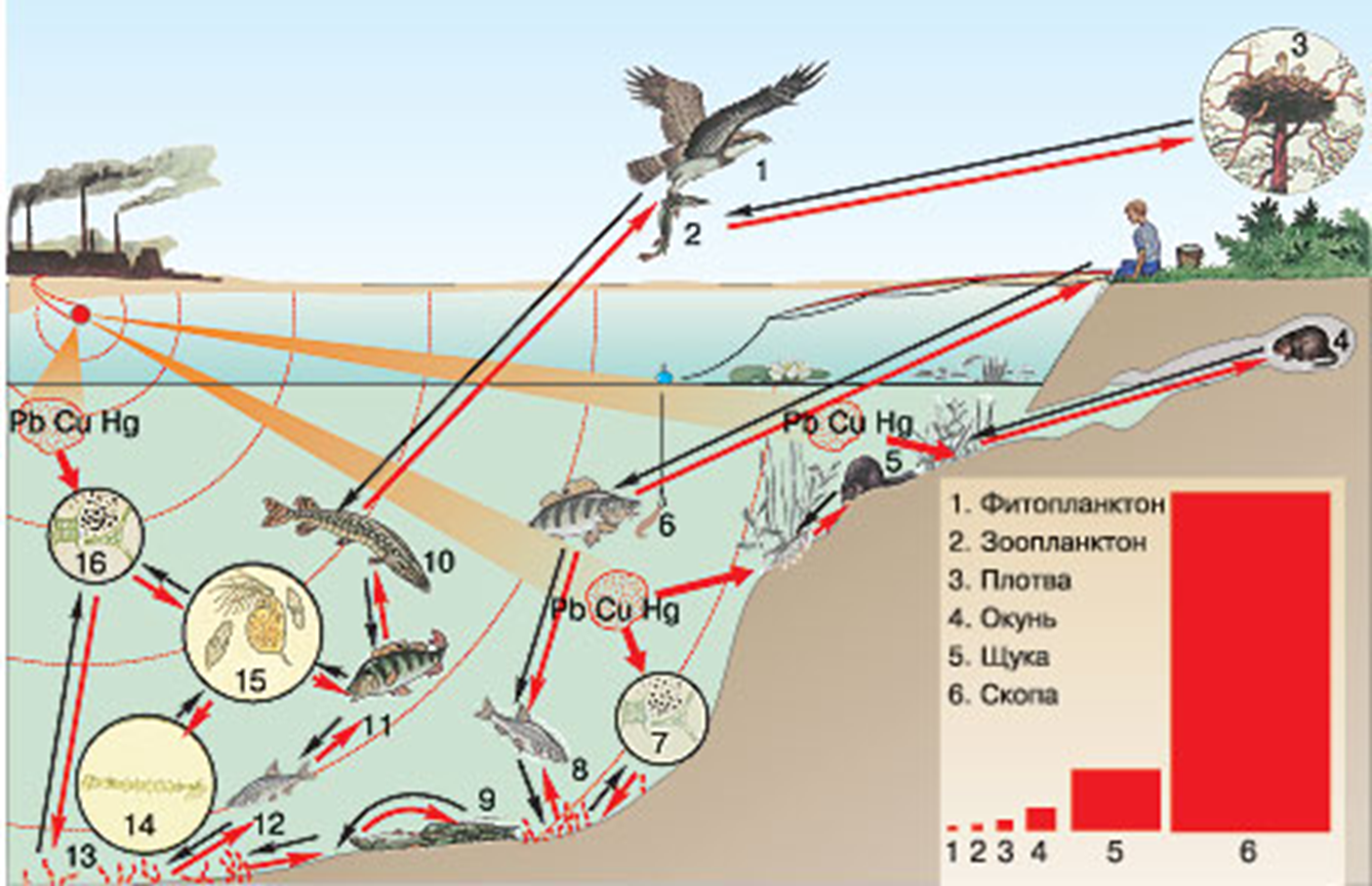 lst-kix_list_9-4.start{direction:ltr}#doc7856947 4ol.lst-kix_list_28-8.start{direction:ltr}#doc7856947 3.lst-kix_list_9-8>li{direction:ltr}#doc7856947 2ol.lst-kix_list_31-0.start{direction:ltr}#doc7856947 1.lst-kix_list_21-4>li{direction:ltr}#doc7856947 0.lst-kix_list_6-1>li:before{font-size:11pt}#doc7856947 9ol.lst-kix_list_29-7.start{font-size:11pt}#doc7856947 8ol.lst-kix_list_39-4.start{font-size:11pt}#doc7856947 7.lst-kix_list_36-1>li:before{font-size:11pt}#doc7856947 6.lst-kix_list_17-0>li:before{font-size:11pt}#doc7856947 5ol.lst-kix_list_26-5.start{font-size:11pt}#doc7856947 4ol.lst-kix_list_30-7.start{font-size:11pt}#doc7856947 3ol.lst-kix_list_34-3.start{font-size:11pt}#doc7856947 2ol.lst-kix_list_40-5.start{font-size:11pt}#doc7856947 1.lst-kix_list_22-6>li{font-size:11pt}#doc7856947 0.lst-kix_list_38-3>li:before{font-size:10pt}#doc7856947 9.lst-kix_list_13-3>li:before{font-size:10pt}#doc7856947 8.lst-kix_list_35-1>li:before{font-size:10pt}#doc7856947 7.lst-kix_list_14-7>li:before{font-size:10pt}#doc7856947 6.
lst-kix_list_9-4.start{direction:ltr}#doc7856947 4ol.lst-kix_list_28-8.start{direction:ltr}#doc7856947 3.lst-kix_list_9-8>li{direction:ltr}#doc7856947 2ol.lst-kix_list_31-0.start{direction:ltr}#doc7856947 1.lst-kix_list_21-4>li{direction:ltr}#doc7856947 0.lst-kix_list_6-1>li:before{font-size:11pt}#doc7856947 9ol.lst-kix_list_29-7.start{font-size:11pt}#doc7856947 8ol.lst-kix_list_39-4.start{font-size:11pt}#doc7856947 7.lst-kix_list_36-1>li:before{font-size:11pt}#doc7856947 6.lst-kix_list_17-0>li:before{font-size:11pt}#doc7856947 5ol.lst-kix_list_26-5.start{font-size:11pt}#doc7856947 4ol.lst-kix_list_30-7.start{font-size:11pt}#doc7856947 3ol.lst-kix_list_34-3.start{font-size:11pt}#doc7856947 2ol.lst-kix_list_40-5.start{font-size:11pt}#doc7856947 1.lst-kix_list_22-6>li{font-size:11pt}#doc7856947 0.lst-kix_list_38-3>li:before{font-size:10pt}#doc7856947 9.lst-kix_list_13-3>li:before{font-size:10pt}#doc7856947 8.lst-kix_list_35-1>li:before{font-size:10pt}#doc7856947 7.lst-kix_list_14-7>li:before{font-size:10pt}#doc7856947 6. lst-kix_list_13-2>li{font-size:10pt}#doc7856947 5.lst-kix_list_31-8>li{font-size:10pt}#doc7856947 4.lst-kix_list_40-6>li:before{font-size:10pt}#doc7856947 3.lst-kix_list_23-0>li:before{font-size:10pt}#doc7856947 2ol.lst-kix_list_38-6.start{font-size:10pt}#doc7856947 1.lst-kix_list_33-0>li:before{font-size:10pt}#doc7856947 0.lst-kix_list_12-6>li:before{height:0pt}#doc7856947 9.lst-kix_list_39-0>li:before{height:0pt}#doc7856947 8ol.lst-kix_list_22-2.start{height:0pt}#doc7856947 7.lst-kix_list_32-0>li:before{height:0pt}#doc7856947 6.lst-kix_list_3-7>li:before{height:0pt}#doc7856947 5ol.lst-kix_list_32-5.start{height:0pt}#doc7856947 4.lst-kix_list_12-8>li:before{height:0pt}#doc7856947 3.lst-kix_list_39-8>li:before{height:0pt}#doc7856947 2.lst-kix_list_36-2>li:before{height:0pt}#doc7856947 1ol.lst-kix_list_38-8.start{height:0pt}#doc7856947 0.lst-kix_list_9-8>li:before{margin-left:36pt}#doc7856947 9.lst-kix_list_16-1>li:before{margin-left:36pt}#doc7856947 8ol.lst-kix_list_13-3{margin-left:36pt}#doc7856947 7ol.
lst-kix_list_13-2>li{font-size:10pt}#doc7856947 5.lst-kix_list_31-8>li{font-size:10pt}#doc7856947 4.lst-kix_list_40-6>li:before{font-size:10pt}#doc7856947 3.lst-kix_list_23-0>li:before{font-size:10pt}#doc7856947 2ol.lst-kix_list_38-6.start{font-size:10pt}#doc7856947 1.lst-kix_list_33-0>li:before{font-size:10pt}#doc7856947 0.lst-kix_list_12-6>li:before{height:0pt}#doc7856947 9.lst-kix_list_39-0>li:before{height:0pt}#doc7856947 8ol.lst-kix_list_22-2.start{height:0pt}#doc7856947 7.lst-kix_list_32-0>li:before{height:0pt}#doc7856947 6.lst-kix_list_3-7>li:before{height:0pt}#doc7856947 5ol.lst-kix_list_32-5.start{height:0pt}#doc7856947 4.lst-kix_list_12-8>li:before{height:0pt}#doc7856947 3.lst-kix_list_39-8>li:before{height:0pt}#doc7856947 2.lst-kix_list_36-2>li:before{height:0pt}#doc7856947 1ol.lst-kix_list_38-8.start{height:0pt}#doc7856947 0.lst-kix_list_9-8>li:before{margin-left:36pt}#doc7856947 9.lst-kix_list_16-1>li:before{margin-left:36pt}#doc7856947 8ol.lst-kix_list_13-3{margin-left:36pt}#doc7856947 7ol. lst-kix_list_13-2{margin-left:36pt}#doc7856947 6ol.lst-kix_list_13-1{margin-left:36pt}#doc7856947 5ol.lst-kix_list_13-0{margin-left:36pt}#doc7856947 4ol.lst-kix_list_13-7{margin-left:36pt}#doc7856947 3ol.lst-kix_list_22-8.start{margin-left:36pt}#doc7856947 2ol.lst-kix_list_13-6{margin-left:36pt}#doc7856947 1ol.lst-kix_list_30-5.start{margin-left:36pt}#doc7856947 0ol.lst-kix_list_13-5{text-indent:18pt}#doc7856947 9.lst-kix_list_8-0>li:before{text-indent:18pt}#doc7856947 8ol.lst-kix_list_13-4{text-indent:18pt}#doc7856947 7.lst-kix_list_24-5>li:before{text-indent:18pt}#doc7856947 6.lst-kix_list_38-1>li:before{text-indent:18pt}#doc7856947 5.lst-kix_list_20-1>li:before{text-indent:18pt}#doc7856947 4ol.lst-kix_list_13-8{text-indent:18pt}#doc7856947 3ol.lst-kix_list_15-6.start{text-indent:18pt}#doc7856947 2ol.lst-kix_list_10-3.start{text-indent:18pt}#doc7856947 1.lst-kix_list_39-6>li{text-indent:18pt}#doc7856947 0.lst-kix_list_40-8>li:before{margin-right:14pt}#doc7856947 9.lst-kix_list_29-2>li:before{margin-right:14pt}#doc7856947 8.
lst-kix_list_13-2{margin-left:36pt}#doc7856947 6ol.lst-kix_list_13-1{margin-left:36pt}#doc7856947 5ol.lst-kix_list_13-0{margin-left:36pt}#doc7856947 4ol.lst-kix_list_13-7{margin-left:36pt}#doc7856947 3ol.lst-kix_list_22-8.start{margin-left:36pt}#doc7856947 2ol.lst-kix_list_13-6{margin-left:36pt}#doc7856947 1ol.lst-kix_list_30-5.start{margin-left:36pt}#doc7856947 0ol.lst-kix_list_13-5{text-indent:18pt}#doc7856947 9.lst-kix_list_8-0>li:before{text-indent:18pt}#doc7856947 8ol.lst-kix_list_13-4{text-indent:18pt}#doc7856947 7.lst-kix_list_24-5>li:before{text-indent:18pt}#doc7856947 6.lst-kix_list_38-1>li:before{text-indent:18pt}#doc7856947 5.lst-kix_list_20-1>li:before{text-indent:18pt}#doc7856947 4ol.lst-kix_list_13-8{text-indent:18pt}#doc7856947 3ol.lst-kix_list_15-6.start{text-indent:18pt}#doc7856947 2ol.lst-kix_list_10-3.start{text-indent:18pt}#doc7856947 1.lst-kix_list_39-6>li{text-indent:18pt}#doc7856947 0.lst-kix_list_40-8>li:before{margin-right:14pt}#doc7856947 9.lst-kix_list_29-2>li:before{margin-right:14pt}#doc7856947 8. lst-kix_list_29-8>li:before{margin-right:14pt}#doc7856947 7.lst-kix_list_35-6>li:before{margin-right:14pt}#doc7856947 6.lst-kix_list_10-3>li:before{margin-right:14pt}#doc7856947 5.lst-kix_list_23-5>li:before{margin-right:14pt}#doc7856947 4.lst-kix_list_16-1>li{margin-right:14pt}#doc7856947 3.lst-kix_list_7-4>li:before{margin-right:14pt}#doc7856947 2.lst-kix_list_34-3>li:before{margin-right:14pt}#doc7856947 1.lst-kix_list_18-7>li{margin-right:14pt}#doc7856947 0.lst-kix_list_30-8>li{text-align:justify}#doc7856947 9ol.lst-kix_list_16-8.start{text-align:justify}#doc7856947 8ol.lst-kix_list_20-3.start{text-align:justify}#doc7856947 7ol.lst-kix_list_39-1.start{text-align:justify}#doc7856947 6ol.lst-kix_list_25-6.start{text-align:justify}#doc7856947 5.lst-kix_list_36-3>li:before{text-align:justify}#doc7856947 4ol.lst-kix_list_19-4.start{text-align:justify}#doc7856947 3.lst-kix_list_34-3>li{text-align:justify}#doc7856947 2.lst-kix_list_24-2>li:before{text-align:justify}#doc7856947 1.lst-kix_list_31-0>li{text-align:justify}#doc7856947 0.
lst-kix_list_29-8>li:before{margin-right:14pt}#doc7856947 7.lst-kix_list_35-6>li:before{margin-right:14pt}#doc7856947 6.lst-kix_list_10-3>li:before{margin-right:14pt}#doc7856947 5.lst-kix_list_23-5>li:before{margin-right:14pt}#doc7856947 4.lst-kix_list_16-1>li{margin-right:14pt}#doc7856947 3.lst-kix_list_7-4>li:before{margin-right:14pt}#doc7856947 2.lst-kix_list_34-3>li:before{margin-right:14pt}#doc7856947 1.lst-kix_list_18-7>li{margin-right:14pt}#doc7856947 0.lst-kix_list_30-8>li{text-align:justify}#doc7856947 9ol.lst-kix_list_16-8.start{text-align:justify}#doc7856947 8ol.lst-kix_list_20-3.start{text-align:justify}#doc7856947 7ol.lst-kix_list_39-1.start{text-align:justify}#doc7856947 6ol.lst-kix_list_25-6.start{text-align:justify}#doc7856947 5.lst-kix_list_36-3>li:before{text-align:justify}#doc7856947 4ol.lst-kix_list_19-4.start{text-align:justify}#doc7856947 3.lst-kix_list_34-3>li{text-align:justify}#doc7856947 2.lst-kix_list_24-2>li:before{text-align:justify}#doc7856947 1.lst-kix_list_31-0>li{text-align:justify}#doc7856947 0. lst-kix_list_40-7>li:before{vertical-align:super}#doc7856947 9ol.lst-kix_list_39-7.start{vertical-align:super}#doc7856947 8.lst-kix_list_8-2>li:before{vertical-align:super}#doc7856947 7ol.lst-kix_list_21-6.start{vertical-align:super}#doc7856947 6.lst-kix_list_26-0>li{vertical-align:super}#doc7856947 5.lst-kix_list_14-3>li:before{vertical-align:super}#doc7856947 4.lst-kix_list_8-8>li:before{vertical-align:super}#doc7856947 3ol.lst-kix_list_10-2.start{vertical-align:super}#doc7856947 2.lst-kix_list_30-2>li:before{vertical-align:super}#doc7856947 1ol.lst-kix_list_16-1.start{vertical-align:super}#doc7856947 0ol.lst-kix_list_20-6.start{widows:2;padding-top:0pt;line-height:1.0;orphans:2;text-align:center;color:#000000;font-size:18pt;font-family:»Times New Roman»;padding-bottom:0pt;page-break-after:avoid}#doc7856947 9ul.lst-kix_list_36-7{widows:2;padding-top:0pt;line-height:1.0;orphans:2;text-align:center;color:#000000;font-size:18pt;font-family:»Times New Roman»;padding-bottom:0pt;page-break-after:avoid}#doc7856947 8ul.
lst-kix_list_40-7>li:before{vertical-align:super}#doc7856947 9ol.lst-kix_list_39-7.start{vertical-align:super}#doc7856947 8.lst-kix_list_8-2>li:before{vertical-align:super}#doc7856947 7ol.lst-kix_list_21-6.start{vertical-align:super}#doc7856947 6.lst-kix_list_26-0>li{vertical-align:super}#doc7856947 5.lst-kix_list_14-3>li:before{vertical-align:super}#doc7856947 4.lst-kix_list_8-8>li:before{vertical-align:super}#doc7856947 3ol.lst-kix_list_10-2.start{vertical-align:super}#doc7856947 2.lst-kix_list_30-2>li:before{vertical-align:super}#doc7856947 1ol.lst-kix_list_16-1.start{vertical-align:super}#doc7856947 0ol.lst-kix_list_20-6.start{widows:2;padding-top:0pt;line-height:1.0;orphans:2;text-align:center;color:#000000;font-size:18pt;font-family:»Times New Roman»;padding-bottom:0pt;page-break-after:avoid}#doc7856947 9ul.lst-kix_list_36-7{widows:2;padding-top:0pt;line-height:1.0;orphans:2;text-align:center;color:#000000;font-size:18pt;font-family:»Times New Roman»;padding-bottom:0pt;page-break-after:avoid}#doc7856947 8ul. lst-kix_list_36-8{widows:2;padding-top:0pt;line-height:1.0;orphans:2;text-align:center;color:#000000;font-size:18pt;font-family:»Times New Roman»;padding-bottom:0pt;page-break-after:avoid}#doc7856947 7ul.lst-kix_list_36-5{widows:2;padding-top:0pt;line-height:1.0;orphans:2;text-align:center;color:#000000;font-size:18pt;font-family:»Times New Roman»;padding-bottom:0pt;page-break-after:avoid}#doc7856947 6ul.lst-kix_list_36-6{widows:2;padding-top:0pt;line-height:1.0;orphans:2;text-align:center;color:#000000;font-size:18pt;font-family:»Times New Roman»;padding-bottom:0pt;page-break-after:avoid}#doc7856947 5ol.lst-kix_list_19-3.start{widows:2;padding-top:0pt;line-height:1.0;orphans:2;text-align:center;color:#000000;font-size:18pt;font-family:»Times New Roman»;padding-bottom:0pt;page-break-after:avoid}#doc7856947 4ol.lst-kix_list_17-1.start{widows:2;padding-top:0pt;line-height:1.0;orphans:2;text-align:center;color:#000000;font-size:18pt;font-family:»Times New Roman»;padding-bottom:0pt;page-break-after:avoid}#doc7856947 3.
lst-kix_list_36-8{widows:2;padding-top:0pt;line-height:1.0;orphans:2;text-align:center;color:#000000;font-size:18pt;font-family:»Times New Roman»;padding-bottom:0pt;page-break-after:avoid}#doc7856947 7ul.lst-kix_list_36-5{widows:2;padding-top:0pt;line-height:1.0;orphans:2;text-align:center;color:#000000;font-size:18pt;font-family:»Times New Roman»;padding-bottom:0pt;page-break-after:avoid}#doc7856947 6ul.lst-kix_list_36-6{widows:2;padding-top:0pt;line-height:1.0;orphans:2;text-align:center;color:#000000;font-size:18pt;font-family:»Times New Roman»;padding-bottom:0pt;page-break-after:avoid}#doc7856947 5ol.lst-kix_list_19-3.start{widows:2;padding-top:0pt;line-height:1.0;orphans:2;text-align:center;color:#000000;font-size:18pt;font-family:»Times New Roman»;padding-bottom:0pt;page-break-after:avoid}#doc7856947 4ol.lst-kix_list_17-1.start{widows:2;padding-top:0pt;line-height:1.0;orphans:2;text-align:center;color:#000000;font-size:18pt;font-family:»Times New Roman»;padding-bottom:0pt;page-break-after:avoid}#doc7856947 3.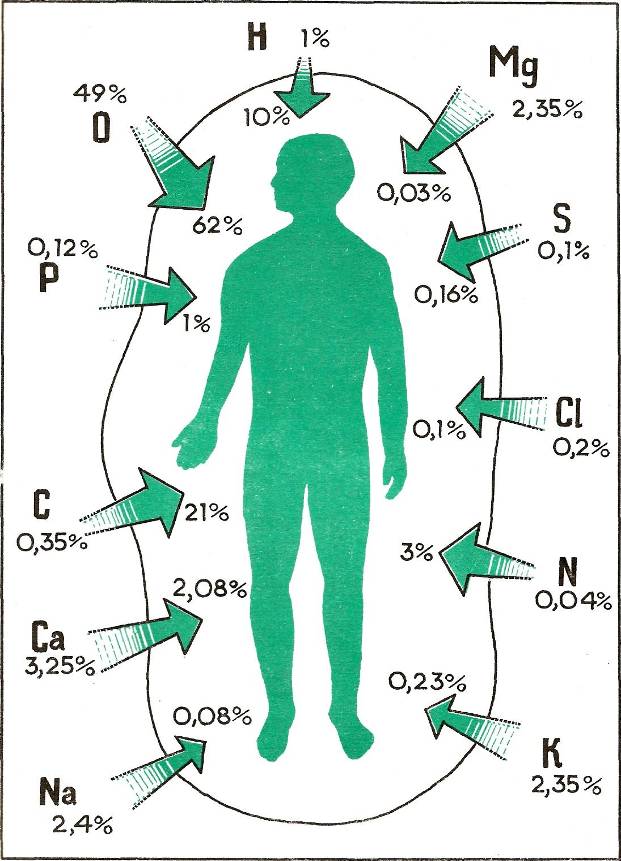 lst-kix_list_28-8>li{widows:2;padding-top:0pt;line-height:1.0;orphans:2;text-align:center;color:#000000;font-size:18pt;font-family:»Times New Roman»;padding-bottom:0pt;page-break-after:avoid}#doc7856947 2ol.lst-kix_list_9-5.start{widows:2;padding-top:0pt;line-height:1.0;orphans:2;text-align:center;color:#000000;font-size:18pt;font-family:»Times New Roman»;padding-bottom:0pt;page-break-after:avoid}#doc7856947 1.lst-kix_list_22-4>li:before{widows:2;padding-top:0pt;line-height:1.0;orphans:2;text-align:center;color:#000000;font-size:18pt;font-family:»Times New Roman»;padding-bottom:0pt;page-break-after:avoid}#doc7856947 0.lst-kix_list_38-8>li:before{padding-top:18pt;line-height:1.0;text-align:left;color:#666666;font-style:italic;font-size:24pt;font-family:»Georgia»;padding-bottom:4pt;page-break-after:avoid}#doc7856947 9ul.lst-kix_list_36-0{padding-top:18pt;line-height:1.0;text-align:left;color:#666666;font-style:italic;font-size:24pt;font-family:»Georgia»;padding-bottom:4pt;page-break-after:avoid}#doc7856947 8.
lst-kix_list_28-8>li{widows:2;padding-top:0pt;line-height:1.0;orphans:2;text-align:center;color:#000000;font-size:18pt;font-family:»Times New Roman»;padding-bottom:0pt;page-break-after:avoid}#doc7856947 2ol.lst-kix_list_9-5.start{widows:2;padding-top:0pt;line-height:1.0;orphans:2;text-align:center;color:#000000;font-size:18pt;font-family:»Times New Roman»;padding-bottom:0pt;page-break-after:avoid}#doc7856947 1.lst-kix_list_22-4>li:before{widows:2;padding-top:0pt;line-height:1.0;orphans:2;text-align:center;color:#000000;font-size:18pt;font-family:»Times New Roman»;padding-bottom:0pt;page-break-after:avoid}#doc7856947 0.lst-kix_list_38-8>li:before{padding-top:18pt;line-height:1.0;text-align:left;color:#666666;font-style:italic;font-size:24pt;font-family:»Georgia»;padding-bottom:4pt;page-break-after:avoid}#doc7856947 9ul.lst-kix_list_36-0{padding-top:18pt;line-height:1.0;text-align:left;color:#666666;font-style:italic;font-size:24pt;font-family:»Georgia»;padding-bottom:4pt;page-break-after:avoid}#doc7856947 8. lst-kix_list_19-6>li:before{padding-top:18pt;line-height:1.0;text-align:left;color:#666666;font-style:italic;font-size:24pt;font-family:»Georgia»;padding-bottom:4pt;page-break-after:avoid}#doc7856947 7.lst-kix_list_13-6>li:before{padding-top:18pt;line-height:1.0;text-align:left;color:#666666;font-style:italic;font-size:24pt;font-family:»Georgia»;padding-bottom:4pt;page-break-after:avoid}#doc7856947 6ul.lst-kix_list_36-4{padding-top:18pt;line-height:1.0;text-align:left;color:#666666;font-style:italic;font-size:24pt;font-family:»Georgia»;padding-bottom:4pt;page-break-after:avoid}#doc7856947 5ul.lst-kix_list_36-3{padding-top:18pt;line-height:1.0;text-align:left;color:#666666;font-style:italic;font-size:24pt;font-family:»Georgia»;padding-bottom:4pt;page-break-after:avoid}#doc7856947 4ul.lst-kix_list_36-2{padding-top:18pt;line-height:1.0;text-align:left;color:#666666;font-style:italic;font-size:24pt;font-family:»Georgia»;padding-bottom:4pt;page-break-after:avoid}#doc7856947 3ul.lst-kix_list_36-1{padding-top:18pt;line-height:1.
lst-kix_list_19-6>li:before{padding-top:18pt;line-height:1.0;text-align:left;color:#666666;font-style:italic;font-size:24pt;font-family:»Georgia»;padding-bottom:4pt;page-break-after:avoid}#doc7856947 7.lst-kix_list_13-6>li:before{padding-top:18pt;line-height:1.0;text-align:left;color:#666666;font-style:italic;font-size:24pt;font-family:»Georgia»;padding-bottom:4pt;page-break-after:avoid}#doc7856947 6ul.lst-kix_list_36-4{padding-top:18pt;line-height:1.0;text-align:left;color:#666666;font-style:italic;font-size:24pt;font-family:»Georgia»;padding-bottom:4pt;page-break-after:avoid}#doc7856947 5ul.lst-kix_list_36-3{padding-top:18pt;line-height:1.0;text-align:left;color:#666666;font-style:italic;font-size:24pt;font-family:»Georgia»;padding-bottom:4pt;page-break-after:avoid}#doc7856947 4ul.lst-kix_list_36-2{padding-top:18pt;line-height:1.0;text-align:left;color:#666666;font-style:italic;font-size:24pt;font-family:»Georgia»;padding-bottom:4pt;page-break-after:avoid}#doc7856947 3ul.lst-kix_list_36-1{padding-top:18pt;line-height:1. 0;text-align:left;color:#666666;font-style:italic;font-size:24pt;font-family:»Georgia»;padding-bottom:4pt;page-break-after:avoid}#doc7856947 2ul.lst-kix_list_5-1{padding-top:18pt;line-height:1.0;text-align:left;color:#666666;font-style:italic;font-size:24pt;font-family:»Georgia»;padding-bottom:4pt;page-break-after:avoid}#doc7856947 1ul.lst-kix_list_5-2{padding-top:18pt;line-height:1.0;text-align:left;color:#666666;font-style:italic;font-size:24pt;font-family:»Georgia»;padding-bottom:4pt;page-break-after:avoid}#doc7856947 0.lst-kix_list_32-5>li{color:#000000;font-size:10pt;font-family:»Times New Roman»}#doc7856947 9ul.lst-kix_list_5-3{color:#000000;font-size:10pt;font-family:»Times New Roman»}#doc7856947 8ul.lst-kix_list_5-4{color:#000000;font-size:10pt;font-family:»Times New Roman»}#doc7856947 7ol.lst-kix_list_26-3.start{color:#000000;font-size:10pt;font-family:»Times New Roman»}#doc7856947 6.lst-kix_list_10-0>li:before{color:#000000;font-size:10pt;font-family:»Times New Roman»}#doc7856947 5.
0;text-align:left;color:#666666;font-style:italic;font-size:24pt;font-family:»Georgia»;padding-bottom:4pt;page-break-after:avoid}#doc7856947 2ul.lst-kix_list_5-1{padding-top:18pt;line-height:1.0;text-align:left;color:#666666;font-style:italic;font-size:24pt;font-family:»Georgia»;padding-bottom:4pt;page-break-after:avoid}#doc7856947 1ul.lst-kix_list_5-2{padding-top:18pt;line-height:1.0;text-align:left;color:#666666;font-style:italic;font-size:24pt;font-family:»Georgia»;padding-bottom:4pt;page-break-after:avoid}#doc7856947 0.lst-kix_list_32-5>li{color:#000000;font-size:10pt;font-family:»Times New Roman»}#doc7856947 9ul.lst-kix_list_5-3{color:#000000;font-size:10pt;font-family:»Times New Roman»}#doc7856947 8ul.lst-kix_list_5-4{color:#000000;font-size:10pt;font-family:»Times New Roman»}#doc7856947 7ol.lst-kix_list_26-3.start{color:#000000;font-size:10pt;font-family:»Times New Roman»}#doc7856947 6.lst-kix_list_10-0>li:before{color:#000000;font-size:10pt;font-family:»Times New Roman»}#doc7856947 5. lst-kix_list_17-7>li:before{color:#000000;font-size:10pt;font-family:»Times New Roman»}#doc7856947 4.lst-kix_list_40-5>li:before{color:#000000;font-size:10pt;font-family:»Times New Roman»}#doc7856947 3ul.lst-kix_list_5-0{color:#000000;font-size:10pt;font-family:»Times New Roman»}#doc7856947 2.lst-kix_list_37-1>li:before{color:#000000;font-size:10pt;font-family:»Times New Roman»}#doc7856947 1.lst-kix_list_13-2>li:before{color:#000000;font-size:10pt;font-family:»Times New Roman»}#doc7856947 0.lst-kix_list_31-0>li:before{color:#000000;font-size:10pt;margin:0;font-family:»Times New Roman»}#doc7856947 9ul.lst-kix_list_5-5{color:#000000;font-size:10pt;margin:0;font-family:»Times New Roman»}#doc7856947 8ul.lst-kix_list_5-6{color:#000000;font-size:10pt;margin:0;font-family:»Times New Roman»}#doc7856947 7ol.lst-kix_list_34-6.start{color:#000000;font-size:10pt;margin:0;font-family:»Times New Roman»}#doc7856947 6ul.lst-kix_list_5-7{color:#000000;font-size:10pt;margin:0;font-family:»Times New Roman»}#doc7856947 5ul.
lst-kix_list_17-7>li:before{color:#000000;font-size:10pt;font-family:»Times New Roman»}#doc7856947 4.lst-kix_list_40-5>li:before{color:#000000;font-size:10pt;font-family:»Times New Roman»}#doc7856947 3ul.lst-kix_list_5-0{color:#000000;font-size:10pt;font-family:»Times New Roman»}#doc7856947 2.lst-kix_list_37-1>li:before{color:#000000;font-size:10pt;font-family:»Times New Roman»}#doc7856947 1.lst-kix_list_13-2>li:before{color:#000000;font-size:10pt;font-family:»Times New Roman»}#doc7856947 0.lst-kix_list_31-0>li:before{color:#000000;font-size:10pt;margin:0;font-family:»Times New Roman»}#doc7856947 9ul.lst-kix_list_5-5{color:#000000;font-size:10pt;margin:0;font-family:»Times New Roman»}#doc7856947 8ul.lst-kix_list_5-6{color:#000000;font-size:10pt;margin:0;font-family:»Times New Roman»}#doc7856947 7ol.lst-kix_list_34-6.start{color:#000000;font-size:10pt;margin:0;font-family:»Times New Roman»}#doc7856947 6ul.lst-kix_list_5-7{color:#000000;font-size:10pt;margin:0;font-family:»Times New Roman»}#doc7856947 5ul. lst-kix_list_5-8{color:#000000;font-size:10pt;margin:0;font-family:»Times New Roman»}#doc7856947 4ol.lst-kix_list_40-1.start{color:#000000;font-size:10pt;margin:0;font-family:»Times New Roman»}#doc7856947 3ul.lst-kix_list_7-8{color:#000000;font-size:10pt;margin:0;font-family:»Times New Roman»}#doc7856947 2ul.lst-kix_list_7-7{color:#000000;font-size:10pt;margin:0;font-family:»Times New Roman»}#doc7856947 1.lst-kix_list_4-3>li:before{color:#000000;font-size:10pt;margin:0;font-family:»Times New Roman»}#doc7856947 0ul.lst-kix_list_7-4{widows:2;padding-top:0pt;line-height:1.0;orphans:2;text-align:left;color:#000000;font-style:italic;font-size:14pt;font-family:»Times New Roman»;padding-bottom:0pt;page-break-after:avoid}#doc7856947 9ul.lst-kix_list_7-3{widows:2;padding-top:0pt;line-height:1.0;orphans:2;text-align:left;color:#000000;font-style:italic;font-size:14pt;font-family:»Times New Roman»;padding-bottom:0pt;page-break-after:avoid}#doc7856947 8ul.lst-kix_list_7-6{widows:2;padding-top:0pt;line-height:1.
lst-kix_list_5-8{color:#000000;font-size:10pt;margin:0;font-family:»Times New Roman»}#doc7856947 4ol.lst-kix_list_40-1.start{color:#000000;font-size:10pt;margin:0;font-family:»Times New Roman»}#doc7856947 3ul.lst-kix_list_7-8{color:#000000;font-size:10pt;margin:0;font-family:»Times New Roman»}#doc7856947 2ul.lst-kix_list_7-7{color:#000000;font-size:10pt;margin:0;font-family:»Times New Roman»}#doc7856947 1.lst-kix_list_4-3>li:before{color:#000000;font-size:10pt;margin:0;font-family:»Times New Roman»}#doc7856947 0ul.lst-kix_list_7-4{widows:2;padding-top:0pt;line-height:1.0;orphans:2;text-align:left;color:#000000;font-style:italic;font-size:14pt;font-family:»Times New Roman»;padding-bottom:0pt;page-break-after:avoid}#doc7856947 9ul.lst-kix_list_7-3{widows:2;padding-top:0pt;line-height:1.0;orphans:2;text-align:left;color:#000000;font-style:italic;font-size:14pt;font-family:»Times New Roman»;padding-bottom:0pt;page-break-after:avoid}#doc7856947 8ul.lst-kix_list_7-6{widows:2;padding-top:0pt;line-height:1. 0;orphans:2;text-align:left;color:#000000;font-style:italic;font-size:14pt;font-family:»Times New Roman»;padding-bottom:0pt;page-break-after:avoid}#doc7856947 7ul.lst-kix_list_7-5{widows:2;padding-top:0pt;line-height:1.0;orphans:2;text-align:left;color:#000000;font-style:italic;font-size:14pt;font-family:»Times New Roman»;padding-bottom:0pt;page-break-after:avoid}#doc7856947 6ul.lst-kix_list_7-0{widows:2;padding-top:0pt;line-height:1.0;orphans:2;text-align:left;color:#000000;font-style:italic;font-size:14pt;font-family:»Times New Roman»;padding-bottom:0pt;page-break-after:avoid}#doc7856947 5ul.lst-kix_list_7-2{widows:2;padding-top:0pt;line-height:1.0;orphans:2;text-align:left;color:#000000;font-style:italic;font-size:14pt;font-family:»Times New Roman»;padding-bottom:0pt;page-break-after:avoid}#doc7856947 4ul.lst-kix_list_7-1{widows:2;padding-top:0pt;line-height:1.0;orphans:2;text-align:left;color:#000000;font-style:italic;font-size:14pt;font-family:»Times New Roman»;padding-bottom:0pt;page-break-after:avoid}#doc7856947 3ol.
0;orphans:2;text-align:left;color:#000000;font-style:italic;font-size:14pt;font-family:»Times New Roman»;padding-bottom:0pt;page-break-after:avoid}#doc7856947 7ul.lst-kix_list_7-5{widows:2;padding-top:0pt;line-height:1.0;orphans:2;text-align:left;color:#000000;font-style:italic;font-size:14pt;font-family:»Times New Roman»;padding-bottom:0pt;page-break-after:avoid}#doc7856947 6ul.lst-kix_list_7-0{widows:2;padding-top:0pt;line-height:1.0;orphans:2;text-align:left;color:#000000;font-style:italic;font-size:14pt;font-family:»Times New Roman»;padding-bottom:0pt;page-break-after:avoid}#doc7856947 5ul.lst-kix_list_7-2{widows:2;padding-top:0pt;line-height:1.0;orphans:2;text-align:left;color:#000000;font-style:italic;font-size:14pt;font-family:»Times New Roman»;padding-bottom:0pt;page-break-after:avoid}#doc7856947 4ul.lst-kix_list_7-1{widows:2;padding-top:0pt;line-height:1.0;orphans:2;text-align:left;color:#000000;font-style:italic;font-size:14pt;font-family:»Times New Roman»;padding-bottom:0pt;page-break-after:avoid}#doc7856947 3ol. lst-kix_list_39-0.start{widows:2;padding-top:0pt;line-height:1.0;orphans:2;text-align:left;color:#000000;font-style:italic;font-size:14pt;font-family:»Times New Roman»;padding-bottom:0pt;page-break-after:avoid}#doc7856947 2.lst-kix_list_13-1>li{widows:2;padding-top:0pt;line-height:1.0;orphans:2;text-align:left;color:#000000;font-style:italic;font-size:14pt;font-family:»Times New Roman»;padding-bottom:0pt;page-break-after:avoid}#doc7856947 1ol.lst-kix_list_37-5{widows:2;padding-top:0pt;line-height:1.0;orphans:2;text-align:left;color:#000000;font-style:italic;font-size:14pt;font-family:»Times New Roman»;padding-bottom:0pt;page-break-after:avoid}#doc7856947 0ol.lst-kix_list_37-4{padding-top:12pt;line-height:1.0;text-align:left;color:#000000;font-style:italic;font-size:14pt;font-family:»Arial»;font-weight:bold;padding-bottom:3pt;page-break-after:avoid}#doc7856947 9ol.lst-kix_list_37-3{padding-top:12pt;line-height:1.0;text-align:left;color:#000000;font-style:italic;font-size:14pt;font-family:»Arial»;font-weight:bold;padding-bottom:3pt;page-break-after:avoid}#doc7856947 8ol.
lst-kix_list_39-0.start{widows:2;padding-top:0pt;line-height:1.0;orphans:2;text-align:left;color:#000000;font-style:italic;font-size:14pt;font-family:»Times New Roman»;padding-bottom:0pt;page-break-after:avoid}#doc7856947 2.lst-kix_list_13-1>li{widows:2;padding-top:0pt;line-height:1.0;orphans:2;text-align:left;color:#000000;font-style:italic;font-size:14pt;font-family:»Times New Roman»;padding-bottom:0pt;page-break-after:avoid}#doc7856947 1ol.lst-kix_list_37-5{widows:2;padding-top:0pt;line-height:1.0;orphans:2;text-align:left;color:#000000;font-style:italic;font-size:14pt;font-family:»Times New Roman»;padding-bottom:0pt;page-break-after:avoid}#doc7856947 0ol.lst-kix_list_37-4{padding-top:12pt;line-height:1.0;text-align:left;color:#000000;font-style:italic;font-size:14pt;font-family:»Arial»;font-weight:bold;padding-bottom:3pt;page-break-after:avoid}#doc7856947 9ol.lst-kix_list_37-3{padding-top:12pt;line-height:1.0;text-align:left;color:#000000;font-style:italic;font-size:14pt;font-family:»Arial»;font-weight:bold;padding-bottom:3pt;page-break-after:avoid}#doc7856947 8ol. lst-kix_list_37-2{padding-top:12pt;line-height:1.0;text-align:left;color:#000000;font-style:italic;font-size:14pt;font-family:»Arial»;font-weight:bold;padding-bottom:3pt;page-break-after:avoid}#doc7856947 7.lst-kix_list_19-4>li:before{padding-top:12pt;line-height:1.0;text-align:left;color:#000000;font-style:italic;font-size:14pt;font-family:»Arial»;font-weight:bold;padding-bottom:3pt;page-break-after:avoid}#doc7856947 6ol.lst-kix_list_29-2.start{padding-top:12pt;line-height:1.0;text-align:left;color:#000000;font-style:italic;font-size:14pt;font-family:»Arial»;font-weight:bold;padding-bottom:3pt;page-break-after:avoid}#doc7856947 5ol.lst-kix_list_37-1{padding-top:12pt;line-height:1.0;text-align:left;color:#000000;font-style:italic;font-size:14pt;font-family:»Arial»;font-weight:bold;padding-bottom:3pt;page-break-after:avoid}#doc7856947 4.lst-kix_list_40-2>li{padding-top:12pt;line-height:1.0;text-align:left;color:#000000;font-style:italic;font-size:14pt;font-family:»Arial»;font-weight:bold;padding-bottom:3pt;page-break-after:avoid}#doc7856947 3ol.
lst-kix_list_37-2{padding-top:12pt;line-height:1.0;text-align:left;color:#000000;font-style:italic;font-size:14pt;font-family:»Arial»;font-weight:bold;padding-bottom:3pt;page-break-after:avoid}#doc7856947 7.lst-kix_list_19-4>li:before{padding-top:12pt;line-height:1.0;text-align:left;color:#000000;font-style:italic;font-size:14pt;font-family:»Arial»;font-weight:bold;padding-bottom:3pt;page-break-after:avoid}#doc7856947 6ol.lst-kix_list_29-2.start{padding-top:12pt;line-height:1.0;text-align:left;color:#000000;font-style:italic;font-size:14pt;font-family:»Arial»;font-weight:bold;padding-bottom:3pt;page-break-after:avoid}#doc7856947 5ol.lst-kix_list_37-1{padding-top:12pt;line-height:1.0;text-align:left;color:#000000;font-style:italic;font-size:14pt;font-family:»Arial»;font-weight:bold;padding-bottom:3pt;page-break-after:avoid}#doc7856947 4.lst-kix_list_40-2>li{padding-top:12pt;line-height:1.0;text-align:left;color:#000000;font-style:italic;font-size:14pt;font-family:»Arial»;font-weight:bold;padding-bottom:3pt;page-break-after:avoid}#doc7856947 3ol. lst-kix_list_37-0{padding-top:12pt;line-height:1.0;text-align:left;color:#000000;font-style:italic;font-size:14pt;font-family:»Arial»;font-weight:bold;padding-bottom:3pt;page-break-after:avoid}#doc7856947 2.lst-kix_list_14-1>li:before{padding-top:12pt;line-height:1.0;text-align:left;color:#000000;font-style:italic;font-size:14pt;font-family:»Arial»;font-weight:bold;padding-bottom:3pt;page-break-after:avoid}#doc7856947 1ol.lst-kix_list_9-7.start{padding-top:12pt;line-height:1.0;text-align:left;color:#000000;font-style:italic;font-size:14pt;font-family:»Arial»;font-weight:bold;padding-bottom:3pt;page-break-after:avoid}#doc7856947 0.lst-kix_list_30-4>li:before{padding-top:12pt;line-height:1.0;text-align:left;color:#000000;font-size:13pt;font-family:»Arial»;font-weight:bold;padding-bottom:3pt;page-break-after:avoid}#doc7856947 9ol.lst-kix_list_37-8{padding-top:12pt;line-height:1.0;text-align:left;color:#000000;font-size:13pt;font-family:»Arial»;font-weight:bold;padding-bottom:3pt;page-break-after:avoid}#doc7856947 8ul.
lst-kix_list_37-0{padding-top:12pt;line-height:1.0;text-align:left;color:#000000;font-style:italic;font-size:14pt;font-family:»Arial»;font-weight:bold;padding-bottom:3pt;page-break-after:avoid}#doc7856947 2.lst-kix_list_14-1>li:before{padding-top:12pt;line-height:1.0;text-align:left;color:#000000;font-style:italic;font-size:14pt;font-family:»Arial»;font-weight:bold;padding-bottom:3pt;page-break-after:avoid}#doc7856947 1ol.lst-kix_list_9-7.start{padding-top:12pt;line-height:1.0;text-align:left;color:#000000;font-style:italic;font-size:14pt;font-family:»Arial»;font-weight:bold;padding-bottom:3pt;page-break-after:avoid}#doc7856947 0.lst-kix_list_30-4>li:before{padding-top:12pt;line-height:1.0;text-align:left;color:#000000;font-size:13pt;font-family:»Arial»;font-weight:bold;padding-bottom:3pt;page-break-after:avoid}#doc7856947 9ol.lst-kix_list_37-8{padding-top:12pt;line-height:1.0;text-align:left;color:#000000;font-size:13pt;font-family:»Arial»;font-weight:bold;padding-bottom:3pt;page-break-after:avoid}#doc7856947 8ul. lst-kix_list_25-0{padding-top:12pt;line-height:1.0;text-align:left;color:#000000;font-size:13pt;font-family:»Arial»;font-weight:bold;padding-bottom:3pt;page-break-after:avoid}#doc7856947 7ol.lst-kix_list_37-7{padding-top:12pt;line-height:1.0;text-align:left;color:#000000;font-size:13pt;font-family:»Arial»;font-weight:bold;padding-bottom:3pt;page-break-after:avoid}#doc7856947 6ol.lst-kix_list_30-0.start{padding-top:12pt;line-height:1.0;text-align:left;color:#000000;font-size:13pt;font-family:»Arial»;font-weight:bold;padding-bottom:3pt;page-break-after:avoid}#doc7856947 5ol.lst-kix_list_37-6{padding-top:12pt;line-height:1.0;text-align:left;color:#000000;font-size:13pt;font-family:»Arial»;font-weight:bold;padding-bottom:3pt;page-break-after:avoid}#doc7856947 4ol.lst-kix_list_15-7.start{padding-top:12pt;line-height:1.0;text-align:left;color:#000000;font-size:13pt;font-family:»Arial»;font-weight:bold;padding-bottom:3pt;page-break-after:avoid}#doc7856947 3ol.lst-kix_list_9-1.start{padding-top:12pt;line-height:1.
lst-kix_list_25-0{padding-top:12pt;line-height:1.0;text-align:left;color:#000000;font-size:13pt;font-family:»Arial»;font-weight:bold;padding-bottom:3pt;page-break-after:avoid}#doc7856947 7ol.lst-kix_list_37-7{padding-top:12pt;line-height:1.0;text-align:left;color:#000000;font-size:13pt;font-family:»Arial»;font-weight:bold;padding-bottom:3pt;page-break-after:avoid}#doc7856947 6ol.lst-kix_list_30-0.start{padding-top:12pt;line-height:1.0;text-align:left;color:#000000;font-size:13pt;font-family:»Arial»;font-weight:bold;padding-bottom:3pt;page-break-after:avoid}#doc7856947 5ol.lst-kix_list_37-6{padding-top:12pt;line-height:1.0;text-align:left;color:#000000;font-size:13pt;font-family:»Arial»;font-weight:bold;padding-bottom:3pt;page-break-after:avoid}#doc7856947 4ol.lst-kix_list_15-7.start{padding-top:12pt;line-height:1.0;text-align:left;color:#000000;font-size:13pt;font-family:»Arial»;font-weight:bold;padding-bottom:3pt;page-break-after:avoid}#doc7856947 3ol.lst-kix_list_9-1.start{padding-top:12pt;line-height:1. 0;text-align:left;color:#000000;font-size:13pt;font-family:»Arial»;font-weight:bold;padding-bottom:3pt;page-break-after:avoid}#doc7856947 2.lst-kix_list_38-0>li{padding-top:12pt;line-height:1.0;text-align:left;color:#000000;font-size:13pt;font-family:»Arial»;font-weight:bold;padding-bottom:3pt;page-break-after:avoid}#doc7856947 1.lst-kix_list_6-8>li:before{padding-top:12pt;line-height:1.0;text-align:left;color:#000000;font-size:13pt;font-family:»Arial»;font-weight:bold;padding-bottom:3pt;page-break-after:avoid}#doc7856947 0.lst-kix_list_37-2>li:before{padding-top:12pt;line-height:1.0;text-align:left;color:#000000;font-size:14pt;font-family:»Times New Roman»;font-weight:bold;padding-bottom:3pt;page-break-after:avoid}#doc7856947 9ul.lst-kix_list_3-7{padding-top:12pt;line-height:1.0;text-align:left;color:#000000;font-size:14pt;font-family:»Times New Roman»;font-weight:bold;padding-bottom:3pt;page-break-after:avoid}#doc7856947 8ul.lst-kix_list_3-8{padding-top:12pt;line-height:1.0;text-align:left;color:#000000;font-size:14pt;font-family:»Times New Roman»;font-weight:bold;padding-bottom:3pt;page-break-after:avoid}#doc7856947 7ol.
0;text-align:left;color:#000000;font-size:13pt;font-family:»Arial»;font-weight:bold;padding-bottom:3pt;page-break-after:avoid}#doc7856947 2.lst-kix_list_38-0>li{padding-top:12pt;line-height:1.0;text-align:left;color:#000000;font-size:13pt;font-family:»Arial»;font-weight:bold;padding-bottom:3pt;page-break-after:avoid}#doc7856947 1.lst-kix_list_6-8>li:before{padding-top:12pt;line-height:1.0;text-align:left;color:#000000;font-size:13pt;font-family:»Arial»;font-weight:bold;padding-bottom:3pt;page-break-after:avoid}#doc7856947 0.lst-kix_list_37-2>li:before{padding-top:12pt;line-height:1.0;text-align:left;color:#000000;font-size:14pt;font-family:»Times New Roman»;font-weight:bold;padding-bottom:3pt;page-break-after:avoid}#doc7856947 9ul.lst-kix_list_3-7{padding-top:12pt;line-height:1.0;text-align:left;color:#000000;font-size:14pt;font-family:»Times New Roman»;font-weight:bold;padding-bottom:3pt;page-break-after:avoid}#doc7856947 8ul.lst-kix_list_3-8{padding-top:12pt;line-height:1.0;text-align:left;color:#000000;font-size:14pt;font-family:»Times New Roman»;font-weight:bold;padding-bottom:3pt;page-break-after:avoid}#doc7856947 7ol. lst-kix_list_39-8{padding-top:12pt;line-height:1.0;text-align:left;color:#000000;font-size:14pt;font-family:»Times New Roman»;font-weight:bold;padding-bottom:3pt;page-break-after:avoid}#doc7856947 6ol.lst-kix_list_39-5{padding-top:12pt;line-height:1.0;text-align:left;color:#000000;font-size:14pt;font-family:»Times New Roman»;font-weight:bold;padding-bottom:3pt;page-break-after:avoid}#doc7856947 5ol.lst-kix_list_39-4{padding-top:12pt;line-height:1.0;text-align:left;color:#000000;font-size:14pt;font-family:»Times New Roman»;font-weight:bold;padding-bottom:3pt;page-break-after:avoid}#doc7856947 4ol.lst-kix_list_39-7{padding-top:12pt;line-height:1.0;text-align:left;color:#000000;font-size:14pt;font-family:»Times New Roman»;font-weight:bold;padding-bottom:3pt;page-break-after:avoid}#doc7856947 3.lst-kix_list_12-8>li{padding-top:12pt;line-height:1.0;text-align:left;color:#000000;font-size:14pt;font-family:»Times New Roman»;font-weight:bold;padding-bottom:3pt;page-break-after:avoid}#doc7856947 2.
lst-kix_list_39-8{padding-top:12pt;line-height:1.0;text-align:left;color:#000000;font-size:14pt;font-family:»Times New Roman»;font-weight:bold;padding-bottom:3pt;page-break-after:avoid}#doc7856947 6ol.lst-kix_list_39-5{padding-top:12pt;line-height:1.0;text-align:left;color:#000000;font-size:14pt;font-family:»Times New Roman»;font-weight:bold;padding-bottom:3pt;page-break-after:avoid}#doc7856947 5ol.lst-kix_list_39-4{padding-top:12pt;line-height:1.0;text-align:left;color:#000000;font-size:14pt;font-family:»Times New Roman»;font-weight:bold;padding-bottom:3pt;page-break-after:avoid}#doc7856947 4ol.lst-kix_list_39-7{padding-top:12pt;line-height:1.0;text-align:left;color:#000000;font-size:14pt;font-family:»Times New Roman»;font-weight:bold;padding-bottom:3pt;page-break-after:avoid}#doc7856947 3.lst-kix_list_12-8>li{padding-top:12pt;line-height:1.0;text-align:left;color:#000000;font-size:14pt;font-family:»Times New Roman»;font-weight:bold;padding-bottom:3pt;page-break-after:avoid}#doc7856947 2. lst-kix_list_1-6>li:before{padding-top:12pt;line-height:1.0;text-align:left;color:#000000;font-size:14pt;font-family:»Times New Roman»;font-weight:bold;padding-bottom:3pt;page-break-after:avoid}#doc7856947 1ol.lst-kix_list_39-6{padding-top:12pt;line-height:1.0;text-align:left;color:#000000;font-size:14pt;font-family:»Times New Roman»;font-weight:bold;padding-bottom:3pt;page-break-after:avoid}#doc7856947 0ol.lst-kix_list_39-1{padding-top:12pt;line-height:1.0;text-align:left;color:#000000;font-style:italic;font-size:13pt;font-family:»Times New Roman»;font-weight:bold;padding-bottom:3pt;page-break-after:avoid}#doc7856947 9ul.lst-kix_list_3-0{padding-top:12pt;line-height:1.0;text-align:left;color:#000000;font-style:italic;font-size:13pt;font-family:»Times New Roman»;font-weight:bold;padding-bottom:3pt;page-break-after:avoid}#doc7856947 8ol.lst-kix_list_39-0{padding-top:12pt;line-height:1.0;text-align:left;color:#000000;font-style:italic;font-size:13pt;font-family:»Times New Roman»;font-weight:bold;padding-bottom:3pt;page-break-after:avoid}#doc7856947 7ul.
lst-kix_list_1-6>li:before{padding-top:12pt;line-height:1.0;text-align:left;color:#000000;font-size:14pt;font-family:»Times New Roman»;font-weight:bold;padding-bottom:3pt;page-break-after:avoid}#doc7856947 1ol.lst-kix_list_39-6{padding-top:12pt;line-height:1.0;text-align:left;color:#000000;font-size:14pt;font-family:»Times New Roman»;font-weight:bold;padding-bottom:3pt;page-break-after:avoid}#doc7856947 0ol.lst-kix_list_39-1{padding-top:12pt;line-height:1.0;text-align:left;color:#000000;font-style:italic;font-size:13pt;font-family:»Times New Roman»;font-weight:bold;padding-bottom:3pt;page-break-after:avoid}#doc7856947 9ul.lst-kix_list_3-0{padding-top:12pt;line-height:1.0;text-align:left;color:#000000;font-style:italic;font-size:13pt;font-family:»Times New Roman»;font-weight:bold;padding-bottom:3pt;page-break-after:avoid}#doc7856947 8ol.lst-kix_list_39-0{padding-top:12pt;line-height:1.0;text-align:left;color:#000000;font-style:italic;font-size:13pt;font-family:»Times New Roman»;font-weight:bold;padding-bottom:3pt;page-break-after:avoid}#doc7856947 7ul. lst-kix_list_3-1{padding-top:12pt;line-height:1.0;text-align:left;color:#000000;font-style:italic;font-size:13pt;font-family:»Times New Roman»;font-weight:bold;padding-bottom:3pt;page-break-after:avoid}#doc7856947 6ol.lst-kix_list_39-3{padding-top:12pt;line-height:1.0;text-align:left;color:#000000;font-style:italic;font-size:13pt;font-family:»Times New Roman»;font-weight:bold;padding-bottom:3pt;page-break-after:avoid}#doc7856947 5ul.lst-kix_list_3-2{padding-top:12pt;line-height:1.0;text-align:left;color:#000000;font-style:italic;font-size:13pt;font-family:»Times New Roman»;font-weight:bold;padding-bottom:3pt;page-break-after:avoid}#doc7856947 4ol.lst-kix_list_39-2{padding-top:12pt;line-height:1.0;text-align:left;color:#000000;font-style:italic;font-size:13pt;font-family:»Times New Roman»;font-weight:bold;padding-bottom:3pt;page-break-after:avoid}#doc7856947 3.lst-kix_list_16-6>li{padding-top:12pt;line-height:1.0;text-align:left;color:#000000;font-style:italic;font-size:13pt;font-family:»Times New Roman»;font-weight:bold;padding-bottom:3pt;page-break-after:avoid}#doc7856947 2ul.
lst-kix_list_3-1{padding-top:12pt;line-height:1.0;text-align:left;color:#000000;font-style:italic;font-size:13pt;font-family:»Times New Roman»;font-weight:bold;padding-bottom:3pt;page-break-after:avoid}#doc7856947 6ol.lst-kix_list_39-3{padding-top:12pt;line-height:1.0;text-align:left;color:#000000;font-style:italic;font-size:13pt;font-family:»Times New Roman»;font-weight:bold;padding-bottom:3pt;page-break-after:avoid}#doc7856947 5ul.lst-kix_list_3-2{padding-top:12pt;line-height:1.0;text-align:left;color:#000000;font-style:italic;font-size:13pt;font-family:»Times New Roman»;font-weight:bold;padding-bottom:3pt;page-break-after:avoid}#doc7856947 4ol.lst-kix_list_39-2{padding-top:12pt;line-height:1.0;text-align:left;color:#000000;font-style:italic;font-size:13pt;font-family:»Times New Roman»;font-weight:bold;padding-bottom:3pt;page-break-after:avoid}#doc7856947 3.lst-kix_list_16-6>li{padding-top:12pt;line-height:1.0;text-align:left;color:#000000;font-style:italic;font-size:13pt;font-family:»Times New Roman»;font-weight:bold;padding-bottom:3pt;page-break-after:avoid}#doc7856947 2ul. lst-kix_list_3-3{padding-top:12pt;line-height:1.0;text-align:left;color:#000000;font-style:italic;font-size:13pt;font-family:»Times New Roman»;font-weight:bold;padding-bottom:3pt;page-break-after:avoid}#doc7856947 1ul.lst-kix_list_3-4{padding-top:12pt;line-height:1.0;text-align:left;color:#000000;font-style:italic;font-size:13pt;font-family:»Times New Roman»;font-weight:bold;padding-bottom:3pt;page-break-after:avoid}#doc7856947 0ul.lst-kix_list_3-5{padding-top:10pt;line-height:1.0;text-align:left;color:#000000;font-size:10pt;font-family:»Times New Roman»;font-weight:bold;padding-bottom:2pt;page-break-after:avoid}#doc7856947 9ol.lst-kix_list_26-0.start{padding-top:10pt;line-height:1.0;te]]>
lst-kix_list_3-3{padding-top:12pt;line-height:1.0;text-align:left;color:#000000;font-style:italic;font-size:13pt;font-family:»Times New Roman»;font-weight:bold;padding-bottom:3pt;page-break-after:avoid}#doc7856947 1ul.lst-kix_list_3-4{padding-top:12pt;line-height:1.0;text-align:left;color:#000000;font-style:italic;font-size:13pt;font-family:»Times New Roman»;font-weight:bold;padding-bottom:3pt;page-break-after:avoid}#doc7856947 0ul.lst-kix_list_3-5{padding-top:10pt;line-height:1.0;text-align:left;color:#000000;font-size:10pt;font-family:»Times New Roman»;font-weight:bold;padding-bottom:2pt;page-break-after:avoid}#doc7856947 9ol.lst-kix_list_26-0.start{padding-top:10pt;line-height:1.0;te]]>
Тяжелые металлы как фактор загрязнения окружающей среды. Обзор литературы. Часть 1
? LiveJournal- Main
- Ratings
- Interesting
- iOS & Android
- Disable ads
- Login
- CREATE BLOG Join
- English
(en)
- English (en)
- Русский (ru)
- Українська (uk)
- Français (fr)
- Português (pt)
- español (es)
- Deutsch (de)
- Italiano (it)
- Беларуская (be)
Тяжелые металлы как фактор загрязнения окружающей среды.
Термин тяжелые металлы (ТМ), характеризующий широкую группу загрязняющих веществ, получил в последнее время значительное распространение. На сегодняшний день к ТМ относят более 40 металлов периодической системы Менделеева с атомной массой свыше 50 атомных единиц, при этом немаловажную роль в категорировании ТМ играют следующие условия: их высокая токсичность для живых организмов в относительно низких концентрациях, а также способность к биоаккумуляции.
Тяжелые металлы при избыточном попадании в объекты окружающей среды ведут себя как токсиканты и экотоксиканты. При этом к токсикантам относятся элементы и соединения, оказывающие вредное воздействие на отдельный организм или группу организмов, а экотоксикантами являются элементы или соединения, негативным образом воздействующие не только на отдельные организмы, но и на экосистему в целом. Специалистами по охране окружающей среды среди металлов-токсикантов выделена приоритетная группа. В нее входят кадмий, медь, мышьяк, никель, ртуть, свинец, цинк и хром как наиболее опасные для здоровья человека и животных.
Для крупных городов с многопрофильной промышленностью характерно присутствие в окружающей среде не отдельного загрязнителя, а ассоциации тяжелых металлов, способных оказывать комбинированное действие на организм, при котором может наблюдаться как суммирование эффектов, так и их потенцирование. Опасные уровни загрязнения окружающей среды ТМ отмечаются во многих промышленных развитых территориях. Кроме антропогенных источников загрязнения среды обитания тяжелыми металлами существуют и другие, естественные, например вулканические извержения. Увеличение концентрации металлов-токсикантов в поверхностных водах может происходить в результате кислотных дождей, приводящих к растворению минералов и пород, омываемых этими озерами.
Попавшие в окружающую среду соединения тяжелых металлов загрязняют атмосферный воздух, воду, почву, попадают в растения и организмы животных, населяющих данную местность.

Загрязнение окружающей среды токсичными металлами в первую очередь сказывается на детях, так как интенсивное накопление различных токсичных элементов происходит еще в плаценте. Это приводит к появлению врожденных уродств, снижению иммунитета, развитию множества болезней, зачастую с хронизацией патологического процесса, задержке умственного и физического развития. Вырастает поколение ослабленных людей, восприимчивых к инфекции, с высоким риском развития ИБС и онкопатологии.
Соединения ТМ поступают в организм преимущественно через желудочно-кишечный тракт с пищевыми продуктами, водой, в меньшей степени — через органы дыхания. ТМ поступают также через кожу при контакте с загрязненными средами: воздухом, водой. Тяжелые металлы, попадая в организм человека, накапливаются по ходу биологической цепи: почва (вода) — растение — животное — продукция — человек.
Возросшая нагрузка на организм, обусловленная широким производством вредных для человека химических продуктов, попадающих в окружающую среду, изменила иммунобиологическую реактивность жителей городов, включая детское население.
В условиях экологического неблагополучия раньше других систем реагируют иммунная, эндокринная и центральная нервная системы, вызывая широкий спектр функциональных расстройств. Затем появляются нарушения обмена веществ и запускаются механизмы формирования экозависимого патологического процесса.
Большинство фундаментальных исследований о негативном влиянии ТМ на состояние здоровья населения выполнены на территориях РФ, характеризующихся развитой промышленностью, особенно горнодобывающей, предприятиями черной и цветной металлургии, развитой транспортной транзитной сетью, что определяет присутствие мощных источников загрязнения. Для ТМ почва является емким акцептором, занимающим место в руговороте химических загрязнителей в биосфере. Почва находится в постоянном взаимодействии с другими экологическими системами – атмосферной, гидросферой, растительным миром и является важным источником поступления ТМ в организм человека.
Первый период полуудаления (т.е. удаления половины от начальной концентрации) ТМ значительно варьирует у различных элементов и занимает весьма продолжительный период времени: для цинка − от 70 до 510 лет; кадмия − от 13 до 110 лет, меди − от 310 до 1 500 лет, свинца − от 770 до 5 900 лет. Изучению ТМ в почве посвящено большое количество исследований. Подробно рассмотрены источники поступления ТМ в почву и проанализировано валовое содержание целого ряда металлов.
 Часть ТМ может проникать в растительный организм не через корни, а с поверхности листьев. Доступность их через листья неодинакова и уменьшается в ряду: кадмий, свинец, цинк, медь, марганец, железо. В результате интенсивного движения транспорта вдоль автомагистралей образуются своеобразные техногенные аномалии. Почвы придорожной зоны содержат цинка и меди в несколько десятков и даже сотен раз больше, чем почвы, удаленные от автомагистралей. В придорожной полосе накопление ТМ в кормовых и овощных растениях часто достигает уровня, оказывающего вредное влияние на организм человека и животных. Ионы металлов являются непременными компонентами природных водоемов. Источниками загрязнения вод ТМ служат сточные воды гальванических цехов, недостаточно очищенные канализационные воды, стоки промышленных предприятий и поверхностный сток с территории города. ТМ входят в состав удобрений и пестицидов и могут попадать в водоемы вместе со стоком с сельскохозяйственных угодий. Повышение концентрации ТМ в природных водах часто связано с другими видами загрязнения, например, с закислением.
Часть ТМ может проникать в растительный организм не через корни, а с поверхности листьев. Доступность их через листья неодинакова и уменьшается в ряду: кадмий, свинец, цинк, медь, марганец, железо. В результате интенсивного движения транспорта вдоль автомагистралей образуются своеобразные техногенные аномалии. Почвы придорожной зоны содержат цинка и меди в несколько десятков и даже сотен раз больше, чем почвы, удаленные от автомагистралей. В придорожной полосе накопление ТМ в кормовых и овощных растениях часто достигает уровня, оказывающего вредное влияние на организм человека и животных. Ионы металлов являются непременными компонентами природных водоемов. Источниками загрязнения вод ТМ служат сточные воды гальванических цехов, недостаточно очищенные канализационные воды, стоки промышленных предприятий и поверхностный сток с территории города. ТМ входят в состав удобрений и пестицидов и могут попадать в водоемы вместе со стоком с сельскохозяйственных угодий. Повышение концентрации ТМ в природных водах часто связано с другими видами загрязнения, например, с закислением.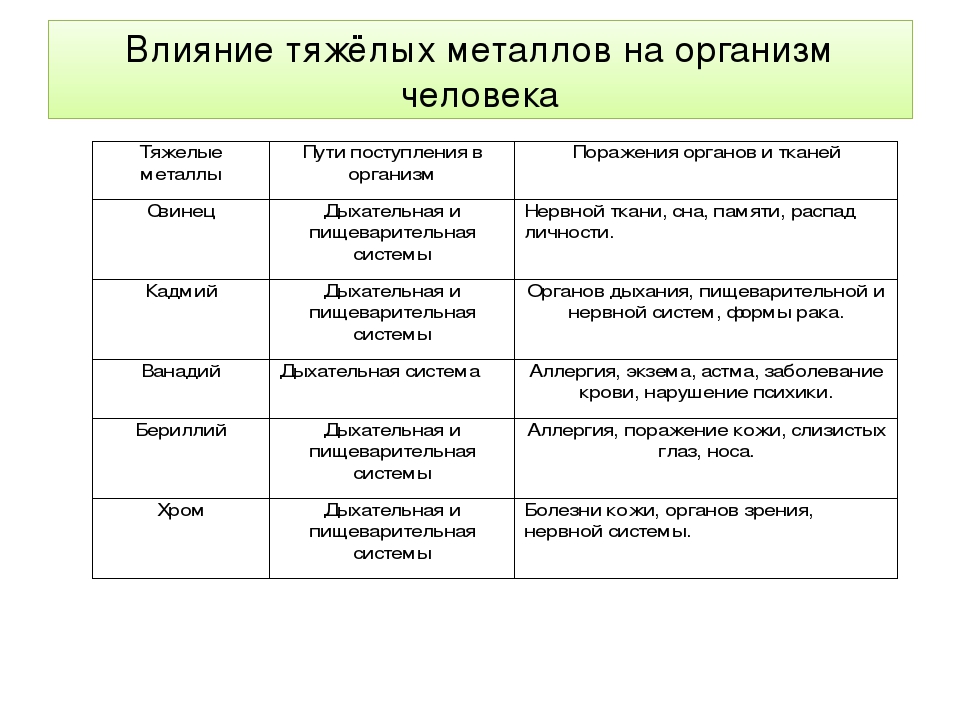 Выпадение кислотных осадков способствует снижению значения рН и переходу металлов из сорбированного на минеральных и органических веществах состояния в свободное.
Выпадение кислотных осадков способствует снижению значения рН и переходу металлов из сорбированного на минеральных и органических веществах состояния в свободное.В России, свыше 62 млн. га загрязнено выбросами промышленных предприятий, в результате добычи полезных ископаемых и работы топливно-энергетического комплекса нарушено 1,0 млн. га продуктивных земель. Загрязнение ТМ объектов биосферы (почва, вода, воздух) является причиной накопления их в пищевом сырье как растительного, так и животного происхождения в количествах, порой превышающих санитарно-гигиенические нормы. Обеспечение безопасности пищевых продуктов входит в число приоритетных направлений государственной политики в области здорового питания населения Российской Федерации. При оформлении Государственной регистрации пищевые продукты и БАДы в частности проверяют на присутствие тяжелых металлов: свинца, кадмия, мышьяка и ртути. Их значения не должны превышать определенные показатели для каждого вида продукта. Рассмотрим эти элементы более подробно.
Свинец является естественным компонентом таких природных сред, как почва, атмосферный воздух, вода. В результате природной эмиссии в атмосферу ежегодно поступает в среднем 27 тысяч тонн свинца, однако все же большая его часть поступает в окружающую среду в результате деятельности человека, т.е. из антропогенных источников. Вследствие широкой распространенности свинца в окружающей среде он в той или иной мере содержится во всех видах пищевых продуктов. Так, среди овощных культур наибольшее содержание свинца отмечено в свекле, моркови, луке, наименьшее — в капусте. Показана возможность накопления свинца в картофеле, ячмене, овсе, внутренних органах домашних животных.
Уровни свинца в растениях, произрастающих близко к автодороге, выше, чем с участков, удаленных от дороги. По этим же данным, содержание свинца в мышечной ткани и субпродуктах крупного рогатого скота составляет 0,9 и 2,4 мг/кг, соответственно, причем наибольшее количество свинца накапливается в почках. При этом более высокий уровень характерен для старых животных, что указывает на аккумуляцию данного токсичного элемента в организме животного с возрастом. Основными путями поступления свинца в организм человека являются пероральный (с водой и продуктами питания), ингаляционный, а также поступление через кожу. Всасывание свинца в желудочно-кишечном тракте у взрослых составляет от 15% поступившего с пищей, а у детей и беременных женщин его абсорбция может достигать 50%. Свинец, каким бы путем ни поступал в организм, главным образом аккумулируется в костях. Воздействие свинца и на сегодняшний день остается серьезной проблемой, особенно для детей. Отравление этим тяжелым металлом обычно происходит через старые краски, загрязненную воду и продукты, а также через косметику, кухонную утварь, консервные банки и бензин. Повышенное содержание свинца в организме вызывает анемию, почечную недостаточность и умственную отсталость. На всасывание свинца оказывают существенное влияние различные факторы. Так, кальций, железо, магний и цинк снижают всасывание свинца, что объясняется конкуренцией металлов на участках связывания, и переносчиках в эпителии кишечника. Усиление всасывания свинца наблюдается при полном и частичном голодании. Период полувыведения свинца из крови и мягких тканей составляет в среднем 25-40 дней. К стабильной фракции относится свинец скелета, период полувыведения которого составляет более 25 лет. Основными путями выведения свинца из организма являются экскреция с мочой (80%), в меньшей степени с калом (15%), потом, слюной и волосами (5%).
Свинец ингибирует действие многих энзимов, а также инкорпорацию железа в организме, в результате чего в моче резко увеличивается количество свободного протопорфирина. Основными органами-мишенями при отравлении свинцом являются кроветворная и нервная системы, почки.
Кадмий. Естественное содержание кадмия в объектах окружающей среды относительно невелико, и в основном его наличие является следствием антропогенных выбросов. Наибольшее поступление кадмия в атмосферу связано с деятельностью промышленных предприятий (34 тонны в год) и сжиганием разнообразных отходов (31 тонна в год). Основными путями поступления кадмия в организм человека являются пероральный, ингаляционный и через кожу. Всасывание кадмия в желудочно-кишечном тракте составляет 4-5% и происходит в тонком кишечнике. Всасывание кадмия усиливается в случае дефицита кальция, железа и белка. При этом, всасывание кадмия угнетается цинком, а также молоком и солями желчных кислот. Действие молока объясняется повышенным содержанием в нем кальция, а солей желчных кислот мицеллообразованием.
Абсорбция кадмия в кишечнике повышается в условиях физиологического стресса, при беременности и кормлении грудью. У новорожденных уровень всасывания кадмия в кишечнике значительно выше, чем у взрослых. Около 50% поступившего в организм кадмия обнаруживается в почках, около 15% — в печени и около 20% — в мышцах. Содержание кадмия в почках возрастает по мере поступления данного токсичного элемента в организм до достижения человеком возраста 50-60 лет, а затем снижается в результате возрастных почечных изменений. Основным путем выведения кадмия из организма является его экскреция с калом. Кроме того, данный токсичный элемент выводится из организма с мочой, слюной, через волосы и с грудным молоком. Период полувыведения кадмия составляет по разным оценкам от 10 до 38 лет. Основным критическим органом, характеризующим интенсивность кадмиевой нагрузки на организм, являются почки, поражение которых характеризуется нарушениями реабсорбции в дистальных канальцах с протеинурией, в тяжелых случаях сопровождающимися аминоацидурией, глюкозурией и фосфатурией. Кроме того, металлический кадмий является доказанным для человека канцерогеном, вызывая рак простаты, легких, кожи, почек и мочевого пузыря.
Мышьяк является естественным компонентом более 200 природных минералов. Около трети выбросов мышьяка в атмосферу осуществляется из природных источников. Источниками мышьяка могут служить выбросы предприятий стекольной, радиоэлектронной (полупроводниковой), металлургической промышленности, ТЭЦ, автомобилей. Соединения мышьяка хорошо всасываются в желудочно-кишечном тракте, и через несколько дней от 45 до 15% поступившего количества выделяется с мочой. Поступая в организм человека в повышенных количествах, мышьяк, в первую очередь, может вызвать нарушение функций печени, аллергические реакции, изменения состояния кожи (гиперкератоз, дерматит), поражение сосудов (в первую очередь, нижних конечностей), снижение слуха, повышенную возбудимость ЦНС, раздражительность, головные боли, угнетение иммунитета, кроветворения. Больше страдают периферические нервы, в которых резко выражены явления демиелинизации вплоть до деструкции осевых цилиндров. На ладонях и стопах развивается гиперкератоз. В этих участках часто возникают эпидермоидные карциномы. Главными осложнениями острой интоксикации являются внутрисосудистый гемолиз, острая почечная, печеночная недостаточность, кардиогенный шок. Отдаленными последствиями острых травлений у детей может быть значительное снижение остроты слуха. Поражение нервной системы проявляется в виде токсической энцефалопатии (нарушение речи, координации движений, эпилептиформных судорог, психозов).
Ртуть попадает в окружающую среду как в результате естественного испарения ее из земной коры, так и в результате промышленного загрязнения. Естественные выбросы ртути могут достигать 25-12000 тонн в год. До недавнего времени семена зерновых протравляли ртутью, и это отразилось на ее содержании в почве. Из овощей особенно сильно аккумулируют ртуть капуста, горький перец и фасоль. Темные сорта винограда поглощают больше ртути, чем светлые. Достаточно большое количество ртути попадает в окружающую среду самым обычным образом – при разбивании медицинских термометров. Этот тяжелый металл присутствует почти во всех морских продуктах, материале для зубных пломб, многих косметических средствах, пестицидах и фунгицидах (противогрибковых препаратах). При вдыхании паров ртути она концентрируется в мозге. Возникают нервно-психические нарушения, головокружение и постоянные головные боли, снижается память, расстраивается речь, возникает скованность, общая заторможенность. Ртуть опасна, так как действует бессимптомно. Необратимые процессы в организме начинаются незаметно: появляются головная боль, головокружение, воспаление десен, затруднения в концентрации внимания, бессонница, выпадение волос. И только через какое-то время нарушается речь, появляется состояние страха, нервозность или сонливость, количество белых кровяных телец уменьшается. Все это признаки потери иммунитета, состояние, при котором даже незначительная инфекция может оказаться смертельной.
Ртуть накапливается в организме животных и людей понемногу, но те, кто живет вблизи от предприятий, загрязняющих воздух отравляющими веществами, накапливают в себе огромное количество этих ядов, причем их накопления могут дать о себе знать и в последующих поколениях. Если этот металл проникает в организм достаточно длительное время, то это приводит человека к опасной болезни — миастении (потеря проведения нервно-мышечных импульсов), заболеваниям почек и печени. При хроническом отравлении ртутью развиваются астеновегетативный синдром, тремор, психические нарушения, лабильный пульс, тахикардия, гингивит, протеинурия, изменения со стороны крови. При пероральном поступлении ртути наблюдаются язвенно-некротический гастроэнтерит, в дальнейшем развивается некротический нефроз с гибелью эпителия проксимальных отделов почечных канальцев. Независимо от пути поступления и формы соединения, ртуть накапливается в основном в почках до 90% ее общего содержания в организме. До 10% поступившей в организм ртути, особенно в форме метилртути, может содержаться в головном мозге. Примерно 90% общего количества абсорбированной метилртути выделяется из организма с калом и желчью и меньше — с мочой, потом, грудным молоком.
Автор научной статьи Г.А. Теплая «Астраханский вестник экологического образования», №1 (23) 2013.
Воздействие тяжелых металлов на организм человека — МегаЛекции
МИНИСТЕРСТВО ОБРАЗОВАНИЯ И НАУКИ
РЕСПУБЛИКИ КАЗАХСТАН
ЕВРАЗИЙСКИЙ НАЦИОНАЛЬНЫЙ УНИВЕРСИТЕТ
Им. Л.Н. Гумилева
Факультет информационных технологий
Кафедра вычислительной техники
РЕФЕРАТ
Тяжелые металлы-загрязнители природной среды
по специальности «5B070400– Вычислительная техника и программное обеспечение»
| Работу выполнил студент группы B1-70400-02 |
| Айтакын Султан Сарсембайулы Ф.И.О. |
| _________________ подпись |
| «__» февраля 2017 г. |
АСТАНА 2017
Содержание
Введение 2стр.
Тяжелые металлы 3стр.
Биологическая роль 3стр.
Загрязнение тяжелыми металлами 3стр.
Загрязнение экосистем 7стр.
Почвенный покров 10стр.
Атмосфера 11стр
Воздействие на организм человека 11стр.
Заключение 13стр.
Список литературы 14стр.
Введение
На рубеже ХХ и ХХI веков человечество столкнулось с рядом глобальных экологических проблем, среди которых антропогенные изменения биосферы, истощение природных ресурсов, демографический взрыв, загрязнение окружающей среды. Один из распространенных видов загрязнения — поступление в различные среды тяжелых металлов (ТМ) — большой группы химических элементов с атомным весом более 50 (Hg, Pb, W, Sn, Cd, Mo, Cu, Co, Mn, Cr и др.). Тяжелые металлы, загрязняющие почву, могут поглощаться растениями и по пищевой цепи попадать в организмы животных и человека. Основные источники выбросов ТМ сконцентрированы в крупных промышленных городах. Деятельность только одной ТЭЦ, потребляющей в сутки 5000 т угля, сопряжена с ежегодным выбросом в атмосферу 21 т свинца и соизмеримого количества других вредных элементов. Современная ситуация характеризуется, с одной стороны, переходом на неэтилированные бензины, сокращением объемов выбросов имеющихся промышленных предприятий, с другой стороны, увеличением парка автомобилей, появлением новых производств (в том числе и по переработке бытовых и промышленных отходов). Все это не снимает с повестки дня проблем эмиссии тяжелых металлов. Вот почему столь необходимо дать представление о тяжелых металлах как факторе экологической опасности, научить студентов самостоятельно оценивать воздействие этого фактора на экосистемы.
Тяжелые металлы
Тяжёлые металлы — группа химических элементов со свойствами металлов (в том числе и полуметаллы) и значительным атомным весом либо плотностью. Известно около сорока различных определений термина тяжелые металлы, и невозможно указать на одно из них, как наиболее принятое. Соответственно, список тяжелых металлов согласно разным определениям будет включать разные элементы. Используемым критерием может быть атомный вес свыше 50, и тогда в список попадают все металлы, начиная с ванадия, независимо от плотности. Другим часто используемым критерием является плотность, примерно равная или большая плотности железа (8 г/см3), тогда в список попадают такие элементы как свинец, ртуть, медь, кадмий, кобальт, а, например, более легкое олово выпадает из списка. Существуют классификации, основанные и на других значениях пороговой плотности или атомного веса. Некоторые классификации делают исключения для благородных и редких металлов, не относя их к тяжелым, некоторые исключают нецветные металлы (железо, марганец).
Термин тяжелые металлы чаще всего рассматривается не с химической, а с медицинской и природоохранной точек зрения и, таким, образом, при включении в эту категорию учитываются не только химические и физические свойства элемента, но и его биологическая активность и токсичность, а также объем использования в хозяйственной деятельности.
Биологическая роль
Многие тяжелые металлы, такие как железо, медь, цинк, молибден, участвуют в биологических процессах и в определенных количествах являются необходимыми для функционирования растений, животных и человека микроэлементами. С другой стороны, тяжёлые металлы и их соединения могут оказывать вредное воздействие на организм человека, способны накапливаться в тканях, вызывая ряд заболеваний. Не имеющие полезной роли в биологических процессах металлы, такие как свинец и ртуть, определяются как токсичные металлы. Некоторые элементы, такие как ванадий или кадмий, обычно имеющие токсичное влияние на живые организмы, могут быть полезны для некоторых видов.
Загрязнение тяжелыми металлами
Ртуть
Кроме свинца наиболее полно по сравнению с другими микроэлементами изучена ртуть.
Мировое производство ртути в настоящее время составляет более 10000 т в год, большая часть этого количества используется в производстве хлора. Ртуть проникает в воздух в результате сжигания ископаемого топлива. Анализ льда Гренландского ледяного купола показал, что, начиная с 800 г. н.э. до 1950-х гг., содержание ртути оставалось постоянным, но уже с 50-х гг. нашего столетия количество ртути удвоилось. На рис.1 представлены пути цикловой миграции ртути. Ртуть и ее соединения опасны для жизни. Метилртуть особенно опасна для животных и человека, так как она быстро переходит из крови в мозговую ткань, разрушая мозжечок и кору головного мозга. Клинические симптомы такого поражения — оцепенение, потеря ориентации в пространстве, потеря зрения. Симптомы ртутного отравления проявляются не сразу. Другим неприятным последствием отравления метилртутью является проникновение ртути в плаценту и накапливание ее в плоде, причем мать не испытывает при этом болезненных ощущений. Метилртуть оказывает тератогенное воздействие на человека. Ртуть относится к I классу опасности.
Металлическая ртуть опасна, если ее проглотить и вдыхать ее пары. При этом у человека появляется металлический вкус во рту, тошнота, рвота, колики в животе, зубы чернеют и начинают крошиться. Пролитая ртуть разлетается на капельки и, если это произошло, ртуть должна быть тщательно собрана.
Неорганические соединения ртути практически нелетучи, поэтому опасность представляет попадание ртути внутрь организма через рот и кожу. Соли ртути разъедают кожу и слизистые оболочки тела. Попадание солей ртути внутрь организма вызывает воспаление зева, затрудненное глотание, оцепенение, рвоту, боли в животе.
У взрослого человека при попадании внутрь около 350 мг ртути может наступить смерть.
Загрязнение ртутью может быть уменьшено в результате запрещения производства и применения ряда продуктов. Нет сомнения, что загрязнение ртутью всегда будет острой проблемой. Но с введением строгого контроля за отходами производства, содержащими ртуть, а также за пищевыми продуктами можно уменьшить опасность отравления ртутью.
Свинец
Содержание свинца в магматических породах позволяет отнести его к категории редких металлов. Он концентрируется в сульфидных породах, которые встречаются во многих местах в мире. Свинец легко выделить путем выплавки из руды. В природном состоянии он обнаруживается в основном в виде галенита (РbS).
Ежегодно в мире в результате воздействия атмосферных процессов мигрирует около 180 тыс. т свинца. При добыче и переработке свинцовых руд теряется более 20 % свинца. Даже на этих стадиях выделение свинца в среду обитания равно его количеству, попадающему в окружающую среду в результате воздействия на магматические породы атмосферных процессов.
Наиболее серьезным источником загрязнения среды обитания организмов свинцом являются выхлопы автомобильных двигателей. Антидетонатор тетраметил — или тетраэтилсвинеп — прибавляют к большинству бензинов, начиная с 1923 г., в количестве около 80 мг/л. При движении автомобиля от 25 до 75% этого свинца в зависимости от условий движения выбрасывается в атмосферу. Основная его масса осаждается на землю, но и в воздухе остается заметная ее часть.
Свинцовая пыль не только покрывает обочины шоссейных дорог и почву внутри и вокруг промышленных городов, она найдена и во льду Северной Гренландии, причем в 1756 г. содержание свинца во льду составляло 20 мкг/т, в 1860 г. уже 50 мкг/т, а в 1965 г. — 210 мкг/т.
Активными источниками загрязнения свинцом являются электростанции и бытовые печи, работающие на угле.
Источниками загрязнения свинцом в быту могут быть глиняная посуда, покрытая глазурью; свинец, содержащийся в красящих пигментах.
Свинец не является жизненно необходимым элементом. Он токсичен и относится к I классу опасности. Неорганические его соединения нарушают обмен веществ и являются ингибиторами ферментов (подобно большинству тяжелых металлов). Одним из наиболее коварных последствий действия неорганических соединений свинца считается его способность заменять кальций в костях и быть постоянным источником отравления в течение длительного времени. Биологический период полураспада свинца в костях — около 10 лет. Количество свинца, накопленного в костях, с возрастом увеличивается, и в 30-40 лет у лиц, по роду занятий не связанных с загрязнением свинца, составляет 80-200 мг.
Органические соединение свинца считаются ещё более токсичными, чем неорганические.
Кадмий и цинк
Кадмий, цинк и медь являются наиболее важными металлами при изучении проблемы загрязнений, так они широко распространены в мире и обладают токсичными свойствами. Кадмий и цинк (так же как свинец и ртуть) обнаружены в основном в сульфидных осадках. В результате атмосферных процессов эти элементы легко попадают в океаны.
Около 1 млн. кг кадмия попадает в атмосферу ежегодно в результате деятельности заводов по его выплавке, что составляет около 45 % общего загрязнения этим элементом. 52 % загрязнений попадают в результате сжигания или переработки изделий, содержащих кадмий. Кадмий обладает относительно высокой летучестью, поэтому он легко проникает в атмосферу. Источники загрязнения атмосферы цинком те же, что и кадмием.
Попадание кадмия в природные воды происходит в результате применения его в гальванических процессах и техники. Наиболее серьёзные источники загрязнения воды цинком – заводы по выплавке цинка и гальванические производства.
Потенциальным источником загрязнением кадмием являются удобрения. При этом кадмий внедряется в растения, употребляемые человеком в пищу, и в конце цепочки переходят в организм человека. Кадмий и цинк легко проникают в морскую воду и океан через сеть поверхностных и грунтовых вод.
Кадмий и цинк накапливаются в определённых органах животных (особенно в печени и в почках).
Цинк наименее токсичен из всех вышеперечисленных тяжёлых металлов. Тем не менее все элементы становятся токсичными, если попадаются в избытке; цинк не является исключением. Физиологическое воздействие цинка заключается в действии его как активатора ферментов. В больших количествах он вызывает рвоту, эта доза составляет примерно 150 мг для взрослого человека.
Кадмий намного токсичнее цинка. Он и его соединения относятся к I классу опасности. Он проникает в человеческий организм в течение продолжительного периода. Вдыхание воздуха в течение 8 часов при концентрации кадмия 5 мг/м3 может привести к смерти.
При хроническом отравлении кадмием в моче появляется белок, повышается кровяное давление.
При исследовании присутствия кадмия в продуктах питания было выявлено, что выделения человеческого организма редко содержат столько же кадмия, сколько было поглощено. Единого мирового мнения относительно приемлемого безопасного содержания кадмия в пище сейчас нет.
Одним их эффективных путей предотвращения поступления кадмия и цинка в виде загрязнений состоит в введении контроля за содержанием этих металлов в выбросах плавильных заводов и других промышленных предприятий.
Кроме металлов, рассмотренных ранее (ртуть, свинец, кадмий, цинк), имеются и другие токсичные элементы, попадание которых в среду обитания организмов в результате деятельность людей вызывает серьёзное беспокойство.
Сурьма, мышьяк, кобальт
Сурьма присутствует вместе с мышьяком в рудах, содержащих сульфиды металлов. Мировое производство сурьмы составляет около 70 т в год. Сурьма является компонентом сплавов, используется в производстве спичек, в чистом виде применяется в полупроводниках.
Токсическое действие сурьмы подобно мышьяку. Большие количества сурьмы вызывают рвоту, при хроническом отравлении сурьмой наступает расстройство пищеварительного тракта, сопровождаемое рвотой и понижением температуры. Мышьяк в природе присутствует в виде сульфатов. Его содержание в свинцово-цинковых концентратах около 1 %. Вследствие летучести он легко попадает в атмосферу.
Самыми сильными источниками загрязнения этим металлом являются гербициды (химические вещества для борьбы с сорными растениями), фунгициды (вещества для борьбы с грибными болезнями растений) и инсектициды (вещества для борьбы с вредными насекомыми).
По токсическим свойствам мышьяк относится к накапливающимся ядам. По степени токсичности следует различать элементарный мышьяк и его соединения. Элементарный мышьяк сравнительно мало ядовит, но обладает тератогенными свойствами. Вредное воздействие на наследственный материал (мутагенность) оспаривается.
Соединения мышьяка медленно поглощаются через кожу, быстро всасываются через лёгкие и желудочно-кишечный тракт. Смертельная доза для человека – 0,15-0,3 г. Хроническое отравление вызывает нервные заболевания, слабость, онемение конечностей, зуд, потемнение кожи, атрофию костного мозга, изменения печени. Соединения мышьяка являются канцерогенными для человека. Мышьяк и его соединения относятся ко II классу опасности.
Кобальт не является широко применяемым. Так, например, его используют в сталелитейной промышленности, в производстве полимеров. При попадании внутрь больших количеств кобальт отрицательно влияет на содержание гемоглобина в крови человека и может вызвать заболевания крови. Предполагают, что кобальт вызывает базедову болезнь. Этот элемент опасен для жизни организмов ввиду его чрезвычайно высокой реакционной способности и относится к I классу опасности.
Медь и марганец
Медь обнаруживают в сульфидных осадках вместе со свинцом, камдием и цинком. Она присутствует в небольших количествах в цинковых концентратах и может переноситься на большие расстояния с воздухом и водой. Аномальное содержание меди обнаруживается в растениях с воздухом и водой. Аномальное содержание меди обнаруживается в растениях и почвах на расстоянии более 8 км от плавильного завода. Соли меди относятся ко II классу опасности. Токсические свойства меди изучены гораздо меньше, чем те же свойства других элементов. Поглощение больших количеств меди человеком приводит к болезни Вильсона, при этом избыток меди откладывается в мозговой ткани, коже, печени, поджелудочной железе.
Природное содержание марганца в растениях, животных и почвах очень высоко. Основные области производства марганца – производство легированных сталей, сплавов, электрических батарей и других химических источников тока. Присутствие марганца в воздухе сверх нормы (среднесуточная ПКД марганца в атмосфере – воздухе населённых мест – составляет 0,01 мг/м3) вредно влияет на организм человека, что выражается в прогрессирующем разрушении центральной нервной системы. Марганец относится ко II классу опасности.
Загрязнение экосистем
Водное пространство
Ионы металлов являются непременными компонентами природных водоемов. В зависимости от условий среды (pH, окислительно-восстановительный потенциал, наличие лигандов) они существуют в разных степенях окисления и входят в состав разнообразных неорганических и металлорганических соединений, которые могут быть истинно растворенными, коллоидно-дисперсными или входить в состав минеральных и органических взвесей. Истинно растворенные формы металлов, в свою очередь, весьма разнообразны, что связано с процессами гидролиза, гидролитической полимеризации (образованием полиядерных гидроксокомплексов) и комплексообразования с различными лигандами. Соответственно, как каталитические свойства металлов, так и доступность для водных микроорганизмов зависят от форм существования их в водной экосистеме. Многие металлы образуют довольно прочные комплексы с органикой; эти комплексы являются одной из важнейших форм миграции элементов в природных водах. Большинство органических комплексов образуются по хелатному циклу и являются устойчивыми. Комплексы, образуемые почвенными кислотами с солями железа, алюминия, титана, урана, ванадия, меди, молибдена и других тяжелых металлов, относительно хорошо растворимы в условиях нейтральной, слабокислой и слабощелочной сред. Поэтому металлорганические комплексы способны мигрировать в природных водах на весьма значительные расстояния. Особенно важно это для маломинерализованных и в первую очередь поверхностных вод, в которых образование других комплексов невозможно.
Тяжелые металлы и их соли — широко распространенные промышленные загрязнители. В водоемы они поступают из естественных источников (горных пород, поверхностных слоев почвы и подземных вод), со сточными водами многих промышленных предприятий и атмосферными осадками, которые загрязняются дымовыми выбросами.
Тяжелые металлы как микроэлементы постоянно встречаются в естественных водоемах и органах гидробионтов (см.таблицу). В зависимости от геохимических условий отмечаются широкие колебания их уровня.
Естественными источниками поступления свинца в поверхностные воды являются процессы растворения эндогенных (галенит) и экзогенных (англезит, церуссит и др.) минералов. Значительное повышение содержания свинца в окружающей среде (в т.ч. и в поверхностных водах) связано со сжиганием углей, применением тетраэтилсвинца в качестве антидетонатора в моторном топливе, с выносом в водные объекты со сточными водами рудообогатительных фабрик, некоторых металлургических заводов, химических производств, шахт и т.д.
Присутствие никеля в природных водах обусловлено составом пород, через которые проходит вода: он обнаруживается в местах месторождений сульфидных медно-никелевых руд и железо-никелевых руд. В воду попадает из почв и из растительных и животных организмов при их распаде. Повышенное по сравнению с другими типами водорослей содержание никеля обнаружено в сине-зеленых водорослях. Соединения никеля в водные объекты поступают также со сточными водами цехов никелирования, заводов синтетического каучука, никелевых обогатительных фабрик. Огромные выбросы никеля сопровождают сжигание ископаемого топлива. Концентрация его может понижаться в результате выпадения в осадок таких соединений, как цианиды, сульфиды, карбонаты или гидроксиды (при повышении значений рН), за счет потребления его водными организмами и процессов адсорбции. В поверхностных водах соединения никеля находятся в растворенном, взвешенном и коллоидном состоянии, количественное соотношение между которыми зависит от состава воды, температуры и значений рН. Сорбентами соединений никеля могут быть гидроксид железа, органические вещества, высокодисперсный карбонат кальция, глины.
В природные воды соединения кобальта попадают в результате процессов выщелачивания их из медноколчедановых и других руд, из почв при разложении организмов и растений, а также со сточными водами металлургических, металлообрабатывающих и химических заводов. Некоторые количества кобальта поступают из почв в результате разложения растительных и животных организмов. Соединения кобальта в природных водах находятся в растворенном и взвешенном состоянии, количественное соотношение между которыми определяется химическим составом воды, температурой и значениями рН.
В настоящее время существуют две основные группы аналитических методов для определения тяжелых металлов: электрохимические и спектрометрические методы. В последнее время с развитием микроэлектроники электрохимические методы получают новое развитие, тогда как ранее они постепенно вытеснялись спектрометрическими методами. Среди спектрометрических методов определения тяжелых металлов первое место занимает атомно-абсорбционная спектрометрия с разной атомизацией образцов: атомно-абсорбционная спектрометрия с пламенной атомизацией (FAAS) и атомно-абсорбционная спектрометрия с электротермической атомизацией в графитовой кювете (GF AAS). Основными способами определения нескольких элементов одновременно являются атомная эмиссионная спектрометрия с индукционно связанной плазмой (ICP-AES) и масс-спектрометрия с индукционно связанной плазмой (ICP-MS). За исключением ICP-MS остальные спектрометрические методы имеют слишком высокий предел обнаружения для определения тяжелых металлов в воде.
Определение содержание тяжёлых металлов в пробе производится путем перевода пробы в раствор – за счет химического растворения в подходящем растворителе (воде, водных растворах кислот, реже щелочей) или сплавления с подходящим флюсом из числа щелочей, оксидов, солей с последующим выщелачиванием водой. После этого соединение искомого металла переводится в осадок добавлением раствора соответствующего реагента – соли или щелочи, осадок отделяется, высушивается или прокаливается до постоянного веса, и содержание тяжёлых металлов определяется взвешиванием на аналитических весах и пересчетом на исходное содержание в пробе. При квалифицированном применении метод дает наиболее точные значения содержания тяжёлых металлов, но требует больших затрат времени.
Для определения содержания тяжёлых металлов электрохимическими методами пробу также необходимо перевести в водный раствор. После этого содержание тяжёлых металлов определяется различными электрохимическими методами – полярографическим (вольтамперометрическим), потенциометрическим, кулонометрическим, кондуктометрическим и другими, а также сочетанием некоторых из перечисленных методов с титрованием. В основу определения содержания тяжёлых металлов указанными методами положен анализ вольт-амперных характеристик, потенциалов ион-селективных электродов, интегрального заряда, необходимого для осаждения искомого металла на электроде электрохимической ячейки (катоде), электропроводности раствора и др., а также электрохимический контроль реакций нейтрализации и др. в растворах. С помощью этих методов можно определять тяжёлые металлы до 10-9 моль/л.
Почвенный покров
Почва является основной средой, в которую попадают тяжёлые металлы, в том числе из атмосферы и водной среды. Она же служит источником вторичного загрязнения приземного воздуха и вод, попадающих из неё в Мировой океан. Из почвы тяжёлые металлы усваиваются растениями, которые затем попадают в пищу более высокоорганизованным животным.
Продолжительность пребывания загрязняющих компонентов в почве гораздо выше, чем в других частях биосферы, что приводит к изменению состава и свойств почвы как динамической системы и в конечном итоге вызывает нарушение равновесия экологических процессов.
В естественных нормальных условиях все процессы, происходящие в почвах, находятся в равновесии. Изменение состава и свойств почвы может быть вызвано природными явлениями, но наиболее часто в нарушении равновесно состоянию почвы повинен человек:
1. атмосферный перенос загрязняющих веществ в виде аэрозолей и пыли (тяжелые металлы, фтор, мышьяк, оксиды серы, азота и др.)
2. сельскохозяйственные загрязнения (удобрения, пестициды)
3. неземное загрязнение – отвалы крупнотоннажных производств и выбросы топливно-энергетических комплексов
4. загрязнение нефтью и нефтепродуктами
5. растительный опад. Токсичные элементы в любом состоянии поглощаются листьями или оседают на листовой поверхности. Затем, при опадании листьев, эти соединения попадают в почву.
Определение тяжелых металлов в первую очередь проводят в почвах, расположенных в зонах экологического бедствия, на сельскохозяйственных угодьях, прилегающих к загрязнителям почв тяжелыми металлами, и на полях, предназначенных для выращивания экологически чистой продукции.
В почвенных пробах определяют «подвижные» формы тяжелых металлов или их валовое содержание. Как правило, при необходимости контроля над техногенным загрязнением почв тяжелыми металлами, принято определять их валовое содержание. Однако валовое содержание не всегда может характеризовать степень опасности загрязнения почвы, поскольку почва способна связывать соединения металлов, переводя их в недоступные растениям соединения. Правильнее говорить о роли «подвижных» и «доступных» для растений форм. Определение содержания подвижных форм металлов желательно проводить в случае высоких их валовых количеств в почве, а также, когда необходимо характеризовать миграцию металлов-загрязнителей из почвы в растения.
Если почвы загрязнены тяжелыми металлами и радионуклидами, то очистить их практически невозможно. Пока известен единственный путь: засеять такие почвы быстрорастущими культурами, дающими большую фитомассу. Такие культуры, извлекающие тяжелые металлы, после созревания подлежат уничтожению. На восстановление загрязненных почв требуются десятки лет.
Атмосфера
Часть техногенных выбросов тяжелых металлов, поступающих в атмосферу в виде аэрозолей, переносится на значительное расстояние и вызывает глобальное загрязнение. Другая часть с гидрохимическим стоком попадает в бессточные водоемы, где накапливается в водах и донных отложениях и может стать источником вторичного загрязнения. Соединения тяжелых металлов сравнительно быстро распространяются по объемам водного объекта. Частично они выпадают в осадок в виде карбонатов, сульфатов, частично адсорируются на минеральных и органических осадках. В результате содержание тяжелых металлов в отложениях постоянно растет, и когда абсорбционная способность осадков исчерпывается и тяжелые металлы поступают в воду, возникает особо напряженная ситуация. Этому способствует повышение кислотности воды, сильное зарастание водоемов, интенсификация выделения СО2 в результате деятельности микроорганизмов. Значительное загрязнение тяжелыми металлами, особенно свинцом, а также цинком и кадмием обнаружено вблизи автострад. Ширина придорожных аномалий свинца в почве достигает 100 м и более.
Воздействие тяжелых металлов на организм человека
К тяжелым металлам, которые обладают высокой токсичностью можно отнести свинец, ртуть, никель, медь, кадмий, цинк, олово, марганец, хром, мышьяк, алюминий, железо. Эти вещества широко используются в производстве, вследствие чего в огромных количествах накапливаются в окружающей среде и легко попадают в организм человека как с продуктами питания и водой, так и при вдыхании воздуха.
Когда содержание тяжелых металлов в организме превышает предельно-допустимые концентрации, начинается их отрицательное воздействие на человека. Помимо прямых последствий в виде отравления, возникают и косвенные – ионы тяжелых металлов засоряют каналы почек и печени, чем снижают способность этих органов к фильтрации. Вследствие этого в организме накапливаются токсины и продукты жизнедеятельности клеток, что приводит к общему ухудшению здоровья человека.
Вся опасность воздействия тяжелых металлов заключается в том, что они остаются в организме человека навсегда. Вывести их можно лишь употребляя белки, содержащиеся в молоке и белых грибах, а также пектин, который можно найти в мармеладе и фруктово-ягодном желе.
Заключение
Атмосфера промышленных городов загрязнена выбросами в атмосферу тяжелых металлов. Их поставляют цветная металлургия, стекольное и гальваническое производство, выхлопы автотранспорта… В организме человека накапливаются вредные для него вещества. Они нарушают его работу. Часто на организм оказывают влияние не один, а несколько компонентов— свинец, марганец, хром, мышьяк, кадмий.
Считается, что расстояние в 1 километр — это зона сильного влияния, а 5 км и более — минимального влияния. В организме ребенка, живущего недалеко от промышленного предприятия с рождения, уже к 5 годам накапливается достаточная доза вредных веществ. Раньше всего начинают наблюдаться нарушения со стороны центральной нервной системы. Как правило, такие дети очень неусидчивы и рассеянны. Если человек переселяется из опасной зоны, концентрация тяжелых металлов в крови постепенно снижается. От «осевшего» в волосах можно избавиться состриганием. А вот от попавшего в кости и ЦНС — нельзя. У беременных тяжелые металлы могут влиять на плод.
Если ваше жилье расположено поблизости от предприятия, то окна вашей квартиры надо чаще мыть и тщательней изолировать. В этом случае помогут герметичные стеклопакеты. Кроме того, нужно всеми возможными средствами бороться с пылью: на пылевые частицы оседают все вредные вещества, которые находятся в воздухе. Необходимо чаще проводить влажную уборку с моющими средствами. Использовать пылесос с мелкими фильтрами. Отчасти могут помочь увлажнители и озонаторы.
Список литературы
1. Ахметов Н.С. Общая и неорганическая химия. — М.: Высшая школа, 1988.
2. Некрасов Б.В. Основы общей химии: Т. I. -М.: Химия, 1969.
3. Крискунов Е. А., Пасечник В. В., Сидорин А. П. Экология учебник для 9-го класса издательский лом «Дрофа» 1995
4. Экологические преступления.
5. Экология. Учебник. Е.А.Криксунов., Москва, 1995г..- 240с.
6. wikipedia.org
Рекомендуемые страницы:
Воспользуйтесь поиском по сайту:
Как вывести тяжелые металлы из организма (взрослого, ребенка): препараты, продукты, народные способы
Задумываться, как вывести тяжелые металлы из организма, нужно не только тем, кто ими отравился, но и людям, которые считают себя здоровыми. Контакт с этими веществами неизбежен, поэтому их доза в организме часто может превышать норму.
Тяжелые металлы — отдельная группа химических элементов со свойствами металлов (и некоторых полуметаллов) со значительным атомным весом и плотностью. Именно эти элементы — основные загрязнители окружающей среды.
Они применяются в быту, на производстве, в сельском хозяйстве. Эти химикаты часто попадают со стоками в водоемы, отравляют воздух парами и дымом. Большинство металлов очень ядовиты (свинец, ртуть, медь, кадмий и т. п.) и способны накапливаться в живых организмах.
Отравиться ими легко, а вывести из организма — сложная задача, требующая комплексного и длительного лечения.
Отравление тяжелыми металлами
Некоторые из них в малом количестве необходимы организму, но при повышенном содержании оказывают токсичное воздействие.
Пути поражения тяжелыми металлами.
- Через дыхательные пути (при проживании в экологически неблагополучных районах или при работе на вредном производстве или в быту при вдыхании сигаретного дыма, лакокрасочных испарений, выхлопов автомобилей и т. д.).
- После употребления внутрь (плохая вода, продукты, в которых накопились примеси и пр.).
- При неосторожном употреблении медицинских препаратов, включающих в себя тяжелые металлы.
Общие симптомы отравления солями металлов сначала похожи на признаки пищевой интоксикации (тошнота, колики, запор или понос, рвота и пр., вплоть до бреда, галлюцинаций и комы). Но по мере усиления воздействия на организм появятся симптомы, характерные для интоксикации тем или иным металлом. Специфические признаки часто помогают определить, что за элемент стал причиной плохого самочувствия.
Соли металлов очень быстро всасываются в кровь, разносятся по организму человека и оседают в органах, преимущественно в печени и почках. В результате их функции нарушаются, и вывести металлы из организма они уже не смогут. Поэтому при первых признаках отравления этими ядами нужно сделать все, чтобы не пострадали печень и почки.
Выводятся ли соли металлов из организма
Ждать, что металлы, попавшие в организм, чудесным образом выйдут самостоятельно — по меньшей мере неразумно. Даже при воздействии на токсины сильных препаратов этот процесс происходит медленно.
Это объясняется значительной атомной массой элементов, с которой выделительная система человека не может справиться (ей сложно вымывать и выводить эти вещества).
Наиболее опасными признаны свинец, ртуть, кадмий, медь и полуметалл мышьяк. Но по сравнению с ртутью и другими металлами, самым тяжелым считается свинец. Система фильтрации воды неспособна «отсеять» его, и элемент, запросто попадая в организм, прочно оседает в органах, преимущественно в костях. Таким образом, свинец постоянно присутствует в водопроводной воде, которая в итоге всегда оказывается источником токсинов. Не использовать ее совсем — невозможно, т. к. даже если не пить такую воду, все равно придется, так или иначе, контактировать с ней (принимать душ, мыть посуду и т. д.).
Иными словами, свинец попадает в организм постоянно, поэтому и вывести его чрезвычайно сложно. Помочь с выведением свинца и других тяжелых металлов могут только специальные препараты, процедуры и диеты, причем на все это потребуется большое количество сил и времени.
Как вывести тяжелые металлы из организма
Вывести соли тяжелых металлов из организма невозможно без врачебных назначений, но и народная медицина здесь часто бывает хорошей подмогой, ускоряющей данный процесс.
Медикаментозно
Все назначения будут напрямую зависеть от того, что за металл попал в организм. Выявить «отравителя» можно благодаря специальным скринингам, проводимым в медицинском учреждении и характерным симптомам.
Обычно пациенту предписывается комплекс мер по детоксикации организма:
- антидоты (универсальное средство — Унитиол, но могут быть и другие лекарства),
- гомеопатические препараты,
- фиторастворы (Лимфомиозот и др.),
- сорбенты (Энтеросгель, Полифепан),
- форсированный диурез (Маннит, раствор глюкозы, Торасемид),
- инъекции с растворами Желатиноль, Реамберин, Гемодез Н,
- гемодиализ в особо тяжелых случаях.
Это лишь основные способы выведения тяжелых металлов. На самом деле, врачи всегда смотрят по ситуации: каково состояние пациента, насколько велико было количество токсинов в организме, какой металл требуется вывести и т. д. Поэтому в каждом отдельном случае методы лечения могут несколько различаться.
Народными методами
В народной медицине можно найти действительно хорошие способы, помогающие в выведении солей тяжелых металлов из организма:
- Вода. При отравлениях организм обезвожен. С жидкостью выводится масса вредных веществ, поэтому надо больше пить (не меньше 2 л в день чистой отфильтрованной воды).
- Расторопша (молочный чертополох). Отвар из ее семян — отличное средство, предупреждающее всасывание солей металлов и укрепляющее печень. В сутки нужно выпивать 6 чашек отвара (1 ч. л. семян залить стаканом кипятка, настоять около получаса и пить курсом длительностью в 1 месяц).
- Травяные чаи (ромашковый, шиповниковый, облепиховый и из календулы). Эти напитки помогают вывести из организма тяжелые металлы, предотвращают их проникновение.
- Овсяный отвар. Стакан хлопьев заливают 2 л воды. Кипятят 40 минут на слабом огне и пьют по полстакана 4 раза в день.
- Чеснок. Это природный антибиотик, отлично выводящий шлаки, токсины и опасные тяжелые металлы. Нужно ежедневно съедать по половине зубчика, запивая водой.
- Кинза (кориандр). Давно проверенное средство, оказывающее детоксикационное действие. Можно просто почаще добавлять эту траву в пищу или приготовить полезный чай: 4 ложки измельченной травы залить 1 л кипятка в неметаллической посудине. Пить можно уже через 20 минут.
- Сауна, баня. Огромное количество солей металлов выходит через поры, и парилка — то самое место, где можно добиться отличного эффекта. Еще полезнее будет воспользоваться в бане сухой мочалкой или щеткой для глубокой очистки кожных пор. Чем большее количество их широко раскроется в парной — тем больше токсинов выведется. Но применять этот метод можно только с разрешения врача. Тем, кто находится в пожилом возрасте или страдает сердечными заболеваниями, этот метод противопоказан.
- Физические нагрузки. Принцип действия здесь тот же — токсины выходят через поры. Активные движения вызовут обильное потоотделение, с которым начнут выходить соли металлов.
Выбирая народное средство, нужно понимать, что ни одно из них не является единственно возможным лечением. Основной упор при выведении тяжелых металлов всегда делается на традиционной терапии в стационаре.
Продукты для выведения металлов
Чтобы ускорить очищение организма, необходимо правильно питаться и употреблять продукты, способствующие очищению организма от тяжелых металлов.
Какие продукты выводят соли металлов:
- Цитрусы. Они содержат пектины, оказывающие мощное очищающее действие.
- Свекла. Флавоноиды в ее составе нейтрализуют металлы и превращают их в безопасные соединения.
- Чеснок. Сильный детоксикант, увеличивает количество лимфоцитов и укрепляюет иммунитет.
- Водоросли морские. Могут очистить кровь и вывести токсины из ЖКТ благодаря альгину в составе.
- Рис. Отлично впитывает токсины и соли металлов и выводит их из организма.
- Ягоды (калина, малина, рябина и клюква). Активно связывают соли металлов.
- Хлорелла. Купить этот порошок с мощным детоксикационным действием можно в аптеке и принимать как пищевую добавку.
- Продукты с живыми бактериями (кисломолочная продукция, квашеная капуста и квас). Отлично корректируют флору кишечника, связывают соли металлов и выводят их. Справляются даже с кадмием и свинцом.
- Продукты с серой. Сера необходима для формирования глутатиона — основного борца с токсинами. Содержится она в крестоцветных — капусте брокколи, брюссельской, цветной, а также в луке порее и шалоте.
- Продукты с полифенолами. Они помогают организму производить металлотионеин — белок, очищающий кровь от солей тяжелых металлов и других вредных веществ. Полезно будет пить зеленый чай и какао, кушать темный шоколад, клубнику, ежевику, смородину, сливы, добавлять в пищу мяту, гвоздику, семя льна.
Очень хорошо, если эти продукты всегда есть в рационе.
Как вывести тяжелые металлы из организма ребенка
Некоторые металлы (например, ртуть) вызывают у ребенка состояние, по признакам сходное с аутизмом. Это не обязательно говорит о том, что отравление ртутью стало причиной заболевания, но при симптомах аутизма детям все равно проводят биокоррекцию — хелирование.
Начинают этот процесс с обязательной подготовки.
- Нормализация работы кишечника в случае дисбаланса или дисбиоза (если этого не сделать — препараты и добавки для хелирования могут активизировать дрожжевую инфекцию и ощущение, что состояние малыша ухудшается).
- Анализы волоса, крови и мочи с пробным введением хелатора, без которого уровень ртути может показаться ниже, чем на самом деле.
И только после этого начинают сам процесс хелирования детей. Он может проходить по-разному.
Преимущественно для детоксикации используют раствор димеркаптосукциновой кислоты — DMSA. Он считается лучшим хелатором, в плане безопасности и эффективности. У детей после препарата быстро наблюдается улучшение в общении, зрительный контакт, восстановление речи и координация движений.
Дозировка индивидуальна, но не менее 10 и не более 30 мг/кг в сутки. Раствор принимают орально, смешивая со сладким напитком, но некоторым детям с аутичным расстройством препарат вводят внутривенно. Оптимальный курс хелирования — 3 дня, затем — пауза в 11 суток, после чего цикл повторяют 8 –12 раз, чтобы ртуть вышла из тканей полностью.
Чем старше ребенок, тем большее время может потребоваться для очищения от ртути.
После окончания курса приема хелатора к процессу очищения организма подключают и другие необходимые препараты:
- липоевая кислота — сильный антиоксидант, натуральный хелатор, изготавливающийся на основе человеческих тканей и применяющийся для выведения ртути из мозга, очистить который DMSA не может,
- мелатонин — биокорректор аутизма, регулирующий циклы бодрствования и сна,
- глутатион — трипептид, который принимается перорально и восполняет слизистые кишечника (этого вещества у аутичных детей недостаточно),
- таурин — тоже в дефиците у аутистов, но необходим для естественного выведения токсинов через почки, кишечник или с потом, помогает усваиваться жирорастворимым веществам и жирам,
- стимуляторы металлотионеина — для восполнения его количества и усиления функций, чтобы организм потихоньку сам подключался к выводу токсинов (металлотионеина у аутичных детей тоже не хватает),
- аллитиамин — новый препарат для биокоррекции аутизма с содержанием витамина B1 и серы, эффективно связывающее тяжелые металлы и выводящее их с мочой.
После наступления улучшения курс лечения продолжают еще 2 месяца. Затем у детей берут контрольные анализы крови и мочи на тяжелые металлы. По результатам будет ясно, освободился организм от ртути или терапию следует закрепить.
Как тяжелые металлы попадают в организм с прививками
В раннем детстве ребенку делается множество прививок. И часто в одной инъекции содержится сразу несколько разных вакцин, в том числе содержащих ртуть, формальдегиды и гидроксид алюминия. Это может стать толчком к адаптивным нарушениям у ребенка и началу развития аутизма. Особенно часто такое происходит, если у ребенка дефицит металлотионенина, и организм не может самостоятельно очищаться от токсинов. В результате вакцины приводят к побочным явлениям, одним из которых может стать аутизм.
Алюминий и ртуть входят в вакцины как консерванты (ртуть — в составе консерванта Тимеросала). Они опасны для организма малышей даже в микроскопических дозах.
Медики отмечают, что с увеличением количества прививок в раннем детстве выросла и численность заболеваний аутизмом. Также было доказано, что основным провокатором болезни были вакцины на основе Тимеросала, от которого сейчас в ряде стран полностью отказались, после чего случаи развития аутизма резко пошли на спад.
Основными причинами аутизма считаются вакцины:
- от паротита (свинки),
- кори,
- краснухи,
- гепатита B,
- АКДС.
Что касается двух последних прививок, их вред объясняется тем, что введенный состав приводит к путанице в проводящих путях головного мозга из-за перегрузки токсинами, мешающей кислороду попадать в мозг. Это и приводит к нарушению развития ребенка.
Но аутизм развивается не всегда. У одних детей организм справляется с выводом ртути и других тяжелых металлов, у других — нет. Именно последняя группа и становится аутистами. Печально, что предугадать это заранее чаще всего невозможно.
Вокруг вопроса о прививании сейчас ведется много споров. Но давать согласие на вакцинацию или отказаться решать только родителям.
Если приложить усилия, то можно вывести из организма даже соли тяжелых металлов, но это длительный и трудоемкий процесс, поэтому лучше заниматься профилактикой.
Загрузка…
Последствия загрязнения почвы тяжелыми металлами
Стремительная индустриализация и интенсивная сельскохозяйственная деятельность за последние несколько десятилетий привели к накоплению различных загрязняющих веществ в окружающей среде, в особенности — тяжёлых металлов. Негативные последствия загрязнения окружающей среды тяжёлыми металлами представляют реальную угрозу для биосферы.
Ключевые слова: тяжёлые металлы, металлоиды, почва, загрязнение, микроорганизмы, окружающая среда.
В последние десятилетия ведущим процессом, определяющим формирование эколого-геохимического состояния территории, стал техногенез. Интенсивное промышленное использование природных ресурсов вызвало существенные изменения распределения некоторых химических элементов в поверхностном слое зоны аэрации. Прежде всего это касается тяжёлых металлов, накопление высоких концентраций которых в естественной среде связано с антропогенной деятельностью. Тяжёлые металлы, как особая группа элементов, выделяются в связи с токсическим действием на живые организмы при их высоких концентрациях, значительно превышающих фоновые величины. Выбросы и сбросы техногенных объектов, с высоким содержанием тяжёлых металлов, аккумулируются в почвах, которые в значительной степени подвержены влиянию, обусловленному промышленной деятельностью человека.
Почва — это сложная и динамичная система. Она состоит из нескольких слоёв, которые различаются по своему физическому, химическому, минералогическому и биологическому характеру, на которые влияет климат и активность живых организмов. Кроме того, способствуя сохранению всех форм жизни, образующихся на земной поверхности, почва играет важную роль в защите грунтовых вод, действующих как коллекторный фильтр органических и неорганических остатков, способствуя связыванию возможных токсичных соединений [10, с. 661–670].
В последние годы, с развитием мировой экономики, как тип, так и содержание тяжёлых металлов в почве, вызванные деятельностью человека, постепенно увеличивались, что приводило к ухудшению состояния окружающей среды [6, c. 62–67; 6].
В конце XX-го века люди стали осознавать значение почвы как экологического компонента и признали необходимость поддерживать или улучшать способность почвы к выполнению присущих ей различных функций. В то же время учёные доказали, что почва не является неисчерпаемым ресурсом и если её использовать ненадлежащим образом, она может утратить свои характеристики за очень короткий промежуток времени, иногда даже без возможности регенерации [9, с. 161].
В прошлом загрязнению почвы уделялось гораздо меньше значения, чем загрязнению, например, воды и воздуха. Однако в последние годы люди стали осознавать всю серьёзность ситуации, поэтому проблеме загрязнения почвы уделяется всё больше внимания и горячо обсуждается на саммитах по охране окружающей среды во всём мире.
Загрязнение тяжёлыми металлами является чрезмерным осаждением токсичных тяжелых металлов в почве в результате деятельности человека. Загрязнение почвенного покрова тяжелыми металлами связано с наличием различных источников техногенных эмиссий поллютантов: промышленные объекты горно-металлургического, химического, топливно-энергетического комплекса, машиностроительные предприятия, разветвленная транспортная система и т. д. Среди тяжёлых металлов в почве часто встречаются металлы высокой биологической токсичности, такие как ртуть (Hg), кадмий (Cd), свинец (Pb), хром (Cr), мышьяк (As) и т. д. Также почву загрязняют такие металлы как цинк (Zn), медь (Cu), никель (Ni), олово (Sn), адид (V) и прочие.
В 2006–2015 гг. Росгидрометом проводились наблюдения за уровнем загрязнения почв токсикантами промышленного происхождения — тяжёлыми металлами, фтором, нефтью и нефтепродуктами, сульфатами, нитратами, бенз(а)пиреном. Основным источником загрязнения пахотных почв тяжёлыми металлами до (50 %) являются фосфорные удобрения. Наиболее опасны по степени загрязнения почв тяжёлыми металлами почвы многогумусовые, глинисто-суглинистые с щелочной реакцией среды: темно-серые лесные, черноземы и темно-каштановые — почвы, обладающие высокой аккумулятивной способностью [13, с. 118]. Геохимическая обстановка, присущая дерново-подзолистым почвам, не способствует аккумуляции тяжёлых металлов, однако в этих областях техногенная нагрузка настолько велика, что почвы не успевают «самоочищаться». Локальное загрязнение почв тяжелыми металлами связано, прежде всего, с крупными городами и промышленными центрами.
Опасность поступления в окружающую среду тяжёлых металлов определяется тем, что в отличие от органических загрязнителей, они не разрушаются, а переходят из одной формы в другую, в частности, включаются в состав солей, оксидов, металлоорганических соединений.
Интересно, что тяжёлым металлам присуще антагонистическое и синергетическое поведение. Иными словами, наличие одного тяжёлого металла в почве может повлиять на наличие другого. Например, ингибирующее действие Mn на общее количество минерализованного C антагонизировалось Cd. Медь и цинк, а также никель и кадмий конкурируют за те же мембранные носители в растениях. Напротив, сообщалось, что медь увеличивает токсичность цинка в яровом ячмене. Это означает, что взаимосвязь между тяжёлыми металлами довольно сложна. Различные виды одного и того же металла могут также взаимодействовать друг с другом. Наличие арсенита сильно подавляет поглощение арсената рисовыми растениями, растущими на загрязнённой почве [8, с. 123].
Тяжёлые металлы оказывают неблагоприятное воздействие на здоровье человека по трём путям воздействия: ингаляционное, оральное и через кожу. Многие тяжёлые металлы и металлоиды настолько токсичны, что могут вызывать нежелательные последствия и серьёзные проблемы даже при очень низких концентрациях [2, c. 32]. Тяжелые металлы вызывают процесс повреждения клетки в результате окисления, так называемый окислительный стресс [8]. Что касается их токсичности, наиболее опасными тяжёлыми металлами являются As, Cd, Cr, Cu, Hg, Pb, Sn и Zn [7]. Токсичные тяжёлые металлы могут вызывать различные проблемы со здоровьем в зависимости от вида металла и его концентрации. Например, потребление неорганического мышьяка в течение длительного периода может привести к хроническому отравлению мышьяком — арсеникозу, — в результате чего повреждаются желудочно-кишечный тракт, кожа, сердце, печень. Отравление мышьяком может вызвать развитие диабета, болезни костного мозга и крови, сердечно-сосудистые, онкологические заболевания. А вот органические соединения мышьяка менее вредны для здоровья и достаточно быстро выводятся из организма.
Функционирование урбоэкосистем производит дополнительное поступление в биогеохимических циклах целого ряда опасных токсикантов, среди которых особое место занимает кадмий — элемент первого класса токсичности, который способен оказывать тератогенные, мутагенные и канцерогенные действия на организм человека. Следует отметить, что благодаря своим буферным свойствам, даже антропогенно преобразованные почвы, среди которых ведущее место занимают урбаноземы, способны депонировать кадмий в течение длительного времени, частично исключая его избыток из кругооборота.
Интоксикация солями кадмия вызывает повреждение печени и почек, приводит к снижению плотности костной ткани, к нестерпимым болям в суставах и позвоночнике. Эти симптомы известны как болезнь итай-итай («ой как больно»). При ингаляционном воздействии кадмий чрезвычайно канцерогенен.
Отравление свинцом наносит неврологический ущерб, приводит к снижению уровня IQ, внимания, к нарушению координации рук, вызывает энцефалопатию, ухудшает состояние костей, гипертонию, болезнь почек.
Воздействие метилртути, наиболее вредной формы ртути, влияет на развитие мозга, что приводит к снижению уровня IQ. Ртуть приводит к повреждению центральной нервной и желудочной систем, влияет на координацию, зрение и чувство осязания, повреждает почки, сердце, печень. Интоксикация вызывает тревогу, беспокойство, депрессивное состояние, раздражительность, тремор [4].
Отравление медью вызывает повреждение головного мозга и почек; цирроз печени, хроническую анемию, желудочное и кишечное раздражение. Никель вызывает аллергический дерматит, при ингаляционном воздействии возникает угроза рака лёгких, носа, горла, желудка. Оказывает токсическое воздействие на иммунную, репродуктивную системы, кровь, имеет нейротоксическое и генотоксическое действие, повреждает печень, вызывает потерю волос. Избыток цинка приводит к головокружению и усталости.
Некоторые тяжёлые металлы, такие как As, Cd, Hg, Pb не оказывают существенное влияние на рост растений, поскольку им не присуща какая-либо известная физиологическая функция в жизненном цикле растений, но такие металлы как Cu, Fe, Mn, Mo, Ni и Zn являются важными элементами, необходимыми для нормального роста и метаболизма растений. Но избыток этих веществ может привести к существенному отравлению растения.
Поглощение тяжёлых металлов растениями и последующее накопление вдоль пищевой цепи представляет собой потенциальную угрозу для здоровья животных и человека. Поглощение корнями растений является одним из основных путей поступления тяжёлых металлов в пищевую цепь. Поглощение и накопление тяжёлых металлов в растительной ткани зависит от многих факторов: температуры, влажности, органического вещества, PH, питательных веществ и т. д. [5].
Загрязнение грунта сопряжено также с ухудшением качества воды, потому что тяжёлые металлы могут попадать в питьевую воду и становиться источником заболеваний для человека и животных.
Накопление тяжёлых металлов в растениях происходит также в зависимости от вида растений. Повышенный уровень свинца в почве может снизить её продуктивность, а очень низкая концентрация может ингибировать некоторые жизненно важные процессы, такие как фотосинтез, митоз и водопоглощение [3]. Тяжёлые металлы потенциально токсичны для растений, их концентрация приводит к хлорозу, слабому росту растений, снижению урожайности и может даже сопровождаться снижением поглощения питательных веществ, нарушением в метаболизме растений и снижением способности фиксировать молекулярный азот в бобовых растениях.
Повышение общего содержания тяжёлых металлов в почве сопряжено с увеличением относительного содержания более подвижных соединений металлов, что свидетельствует о снижении способности почвы защищать сопредельные среды от загрязнения.
Загрязнение металлами влияет на фауну и микрофауну почвы. При повреждении лесного покрова в лесной подстилке падает численность насекомых (клещей, бескрылых насекомых), при этом количество пауков и многоножек может оставаться стабильным. Страдают и почвенные беспозвоночные, часто наблюдается гибель дождевых червей. Дикие виды древесных растений на загрязнённых территориях формируют листовую пластинку меньшей площади, большей толщины, с меньшим содержанием хлорофиллов, кратно снижается в них активность клеточных ферментов.
Как уже было отмечено, в загрязнённых металлами почвах существенно меняются важнейшие микробиологические и химические свойства. Ухудшается состояние микробоценоза. Концентрации тяжёлых металлов оказывают влияние на биологическую активность почвенных микроорганизмов. Загрязнение почвы тяжёлыми металлами оказывает давление на чувствительные микроорганизмы, изменяя разнообразие почвенной микрофлоры, которая представляет собой трофические группы микроорганизмов. Самую высокую чувствительность к загрязнению тяжёлыми металлами проявляют олиготрофные бактерии, что указывает на то, что ограничение бактериального сообщества более выражено в почвах, состояние которых неудовлетворительное по органическому веществу и содержанию питательных веществ.
Почвенные микроорганизмы, как свободноживущие, так и симбиотические почвенные микробы в ризосфере растений, растущих на загрязнённых тяжёлыми металлами почвах, могут увеличить производство биомассы растений и усилить процесс фиторемедиации. Однако тяжёлые металлы влияют на рост, морфологию и метаболизм почвенных микроорганизмов через функциональные нарушения, денатурацию белка или разрушение целостности клеточных мембран. Почвенные микроорганизмы необходимы для разложения органического вещества почвы; любое уменьшение микробного разнообразия или обилия может отрицательно повлиять на способность растений поглощать питательные вещества из почвы. Повышенные уровни тяжёлых металлов в почвах оказывают значительное влияние на численность популяции и общую активность почвенных микробных сообществ. Несколько исследований, в зависимости от используемых методов изоляции, показали, что загрязнение тяжелыми металлами привело к сдвигам в микробных популяциях.
Также была замечена корреляция между повышенными уровнями никеля и хрома в почве и амплитудой землетрясений. Землетрясения связаны с конкретными геологическими особенностями и границами плиток.
Высокий уровень техногенной нагрузки на геологическую среду обусловил комплексные изменения геохимических условий. Эти изменения привели к устойчивому ухудшению природной обстановки и получили трансграничный характер. Техногенез вызвал значительные изменения элементного состава компонентов биосферы. Наиболее ярко это проявляется в загрязнении почвы тяжёлыми металлами, которые являются наиболее опасными токсикантами с экоцидными свойствами.
Загрязнение тяжёлыми металлами может повлиять на всю окружающую среду, но серьёзная экологическая проблема и самые длительные последствия человеческой деятельности — загрязнение почв. Накопление тяжёлых металлов в почве происходит в результате добычи, плавки металлических руд, промышленных выбросов и применения пестицидов, гербицидов и удобрений. Металлы, такие как Cd, Cu, Pb, Zn и металлоиды (например, As), считаются загрязнителями окружающей среды ввиду их стойкости, биоаккумулятивности и способности оказывать серьёзное негативное воздействие на здоровье человека и окружающую среду.
Литература:
- A New Strategy for Heavy Metal Polluted Environments: A Review of Microbial Biosorbents / Ayansina Segun Ayangbenro, Olubukola Oluranti Babalola // Int J Environ Res Public Health. 2017 Jan; 14(1): 94.
- Asfa Rizvi and Mohammad Saghir Khan. “Cellular Damage, Plant Growth Promoting Activity and Chromium Reducing Ability of Metal Tolerant Pseudomonas aeruginosa CPSB1 Recovered from Metal Polluted Chilli (Capsicum annuum) Rhizosphere”. cta Scientific Agriculture 1.2 (2017): 36–46.
- Dixit R., Malaviya D., Pandiyan K., Singh U. B., Sahu A., Shukla R., Singh B. P., Rai J. P., Sharma P. K., Lade H. Bioremediation of heavy metals from soil and aquatic environment: An overview of principles and criteria of fundamental processes. Sustainability. 2015;7:2189–2212. doi: 10.3390/su7022189.
- Finally, a global agreement on mercury Elaine Baker, Kristina Thygesen & Charles Roche. — September 26, 2017. Available at: https://news.grida.no/finally-a-global-agreement-on-mercury
- Gaur N., Flora G., Yadav M., Tiwari A. A review with recent advancements on bioremediation-based abolition of heavy metals. Environ. Sci. Process. Impacts. 2014;16:180–193. doi: 10.1039/C3EM00491K.
- Grain size fraction of heavy metals in soil and their relationship with land use / M. H. Sayadi1, A. Rezaei, M. R. G. Sayyed // Proceedings of the International Academy of Ecology and Environmental Sciences, 2017, 7(1): 1–11. Available at: http://www.iaees.org/publications/journals/piaees/articles/2017–7(1)/grain-size-fraction-of-heavy-metals-in-soil.pdf
- Heavy Metal Toxicity & Contamination: What You Need To Know. — Jun 28, 2017. Available at: https://www.hydroviv.com/blogs/water-smarts/heavy-metal-toxicity
- M. J. Abedin, J. Feldmann, and A. A. Meharg, “Uptake kinetics of arsenic species in rice plants,” Plant Physiology, vol. 128, no. 3, pp. 1120–1128, 2002.
- Nortcliff S. Standardisation of soil quality attributes. Agriculture, Ecosystems and Environment 2002.
- Sousa A, Pereira R, Antunes SC, Cachada A, Pereira E, Duarte AC, Gonçalves F. Validation of avoidance assays for the screening assessment of soils under different anthropogenic disturbances. Ecotoxicology and Environmental Safety 2008. 661–670.
- US EPA 2017. How does mercury threaten our health? Available at: https://www.epa.gov/international-cooperation/mercury-emissions-global-context#health
- Zojaji F, Hassani AH, Sayadi MH. 2014. Bioaccumulation of chromium by Zea mays in wastewater-irrigated soil: An experimental study. Proceedings of the International Academy of Ecology and Environmental Sciences, 4.
- Государственный доклад «О состоянии и об охране окружающей среды Российской Федерации в 2015 году». — М.: Минприроды России; НИА-Природа. — 2016. — 639 с.
Основные термины (генерируются автоматически): металл, окружающая среда, почва, загрязнение, загрязнение почвы, загрязнение почв, ингаляционное воздействие, органическое вещество, пищевая цепь, техногенная нагрузка.
Рисков загрязнения тяжелыми металлами системы «почва-труба» при наземном внесении осадка сточных вод: обзор данных из Бразилии
1. Введение
Сброс городских сточных вод непосредственно в реки и озера является одной из основных причин загрязнения поверхностных вод . Загрязненные водные ресурсы угрожают водоснабжению городов и экологическому равновесию водных экосистем. Чтобы свести к минимуму или избежать этих негативных воздействий, сточные воды необходимо очищать.
Очистка сточных вод увеличивается до степени, необходимой для поддержания качества воды.Однако, несмотря на очистку городских сточных вод, что делает их пригодными для сброса в водоприемники, такие как реки и озера, в процессе очистки сточных вод образуется большой объем ила, который необходимо надлежащим образом и быстро обрабатывать, чтобы избежать его накопления и, следовательно, его превращения в окружающую среду. обязательства по очистным сооружениям (ВОС).
Варианты утилизации осадка сточных вод разнообразны. В целом, они включают: (i) внесение в землю, (ii) промышленное повторное использование, (iii) захоронение на свалках, (iv) сжигание и (v) сброс в океаны [1].Внесение отходов в землю и захоронение на свалках — наиболее широко используемые методы утилизации в различных частях мира [2, 3]. Внесение в землю считается наиболее привлекательным вариантом, поскольку ил сточных вод может улучшить почвенные условия для сельскохозяйственного производства, так как он богат органическими веществами и питательными веществами для растений [4, 5]. Однако в его составе есть нежелательные составляющие.
Тяжелые металлы, такие как кадмий (Cd), свинец (Pb), среди прочих, являются наиболее нежелательными составляющими [5-7], поскольку они могут быть токсичными для микроорганизмов, растений, животных и людей в не очень высоких концентрациях. [8-10].Следовательно, почвы, модифицированные осадком сточных вод, следует оценивать на предмет загрязнения тяжелыми металлами, чтобы предотвратить их чрезмерное попадание в пищевую цепочку, тем самым снижая риск токсичности для живых организмов, создаваемый методом удаления осадка на суше.
Оценка содержания тяжелых металлов в почве может производиться несколькими способами. Основным и наиболее распространенным является определение общей концентрации [11]. Большим преимуществом этой меры является ее надежность, то есть ее нелегко изменить в зависимости от условий окружающей среды, но ее можно изменить путем добавления металлов из внешних источников, таких как ил, что позволяет использовать ее в качестве индикатора загрязнения почвы. тяжелыми металлами.Однако общая концентрация неудовлетворительно представляет количество металла, доступного для поглощения растениями, то есть долю загрязняющего вещества, которое может вызвать фитотоксичность и попасть в пищевую цепь, поражая животных и людей. Из-за его прямой связи с потенциальными токсическими эффектами, доступную концентрацию следует определять в дополнение к общей концентрации.
Доступность тяжелых металлов для растений была определена с помощью химических экстрагентов, некоторые из которых уже используются в обычном анализе почвы, например Mehlich 1, Mehlich 3 и DTPA.Обычно экстрагентами являются (i) кислоты, (ii) хелатирующие агенты, (iii) хелатирующие кислоты или (iv) солевые растворы [11]. Химическая природа экстрагирующего раствора влияет на способность экстрагирования металлов и, в конечном итоге, на эффективность экстрагента по представлению доступной фракции. Следовательно, экстрагенты следует систематически тестировать перед использованием для мониторинга тяжелых металлов в почвах, загрязненных осадком сточных вод.
Фракционирование также представляет собой интересный метод оценки содержания тяжелых металлов в почвах.Его принцип заключается в разделении металлов на фракции почвы, в которых они обладают переменной растворимостью [12]. С помощью этой процедуры можно определить вклад каждой фракции в доступность металлов для растений [13, 14]. Это также позволяет выбрать лучший химический экстрагент на основе его соотношения с фракциями, которые больше всего способствуют поглощению металлов растениями. Кроме того, можно изучить перераспределение металлов между фракциями в ответ на изменение почвенных условий [15].Таким образом, фракционирование может указать, должны ли металлы, добавленные в почву шламом, перераспределяться по фракциям, в которых они более или менее доступны, то есть имеют ли они больший или меньший потенциал для возникновения проблем токсичности соответственно [7 , 16].
Изучение видообразования — еще одна интересная стратегия для оценки содержания тяжелых металлов в почвах, так как она позволяет различать различные химические вещества в почвенном растворе. У каждого вида есть определенное химическое поведение с точки зрения доступности и подвижности в почве.Свободные ионы более важны для доступности металлов, потому что они являются предпочтительными формами поглощения растений [11]. Напротив, металлоорганические комплексы больше связаны с подвижностью металлов и, следовательно, с их выщелачиванием [17]. Таким образом, видообразование может указывать на то, выше или ниже риск фитотоксичности и загрязнения пищевой цепи, чем риск загрязнения грунтовых вод, в зависимости от доли химических веществ, образующихся в результате применения осадка сточных вод.
Помимо загрязнения почвы, необходимо также оценить, может ли отстой сточных вод, наносимый на землю, загрязнять посевы тяжелыми металлами. Оценка загрязнения сельскохозяйственных культур должна включать исследования дифференциальной способности поглощения, транслокации, накопления и выделения металлов в различных видах растений. В случае выделения важно оценить интересующие металлы в собранных частях, особенно съедобных [18]. В результате этих исследований растения можно разделить по их восприимчивости к загрязнению тяжелыми металлами, и, таким образом, можно будет указать на использование менее восприимчивых растений в районах, принимающих отстой сточных вод.
В Бразилии очистка сточных вод значительно выросла за последние годы. В 2001 г. было обработано 25,6% сточных вод [19]. Спустя десять лет, в 2011 году, этот показатель вырос до 37,5% [20]. Рост должен оставаться сильным, поскольку в санитарию в стране необходимо инвестировать значительный объем ресурсов [21]. Расширение очистки сточных вод неизбежно приводит к увеличению образования осадка сточных вод.
Бразильское производство осадка сточных вод оценивается в 150-220 тысяч тонн в год (сухой остаток) [22] с перспективой увеличения.Как и в других частях света, внесение удобрений в землю было одной из предпочтительных форм удаления ила [1]. Как видно выше, этот вариант требует тщательной оценки содержания тяжелых металлов в почвах с поправками. В последние десятилетия в Бразилии было проведено множество экспериментов для оценки воздействия осадка сточных вод на тяжелые металлы в почвах и сельскохозяйственных культурах. Результаты этих работ могут помочь техническим специалистам более безопасно управлять внесением осадка на землю.
Таким образом, наша цель состояла в том, чтобы проанализировать научную литературу о воздействии осадка сточных вод на тяжелые металлы в почвах и растениях в условиях Бразилии, пытаясь оценить риски загрязнения системы почва-растения.Мы сосредоточились на исследованиях, включающих полевые эксперименты, потому что они лучше отражают реальные ситуации обращения с илом.
2. Тяжелые металлы: обзор
Тяжелые металлы представляют собой класс не очень хорошо определенных химических элементов. Их обычно характеризовали как металлы и металлоиды (полуметаллы) с плотностью выше 5 г / см –3 , что связано с проблемами загрязнения окружающей среды и токсичности, хотя некоторые из них требуются в низких концентрациях для некоторых организмов, таких как высшие растения, животные. и человек [23, 24].Однако это определение (попытка) подверглось критике за его химическую и токсикологическую неадекватность, и оно не получило институциональной поддержки со стороны IUPAC (Международного союза чистой и прикладной химии) [25]. Несмотря на критику, нет более подходящего термина для коллективного обозначения элементов, известных как тяжелые металлы. Поэтому мы используем эту терминологию в этом тексте и поддерживаем ее использование в определении, введенном Хоуксом [26], согласно которому тяжелые металлы составляют блок в Периодической таблице со всеми металлами и металлоидами в группах с 3 по 16, которые находятся в периодах 4. и больше.Поскольку некоторые авторы считают селен (Se) металлоидом и, следовательно, тяжелым металлом [10, 27], мы также рассматриваем его как металлоид в этой главе, хотя он и не является металлом. Таким образом, мы расширяем определение Хокса [26], чтобы включить Se как тяжелый металл, имея в виду, что это переопределение просто действует, просто чтобы присоединить к тому же классу специфические химические элементы, обычно связанные с проблемами загрязнения окружающей среды и токсичности.
Тяжелые металлы можно разделить в зависимости от их потребности в различных организмах.Есть те, которые, несомненно, существенны, и те, которые не признаются как существенные (Таблица 1). Медь (Cu), железо (Fe), марганец (Mn), молибден (Mo) и цинк (Zn) необходимы растениям, животным и людям. Кобальт (Co) и Se необходимы только для животных и людей, а хром (Cr) и никель (Ni) необходимы для человека и растений соответственно. Напротив, мышьяк (As), Cd, Pb и ртуть (Hg) не являются необходимыми ни для одного из этих организмов. Однако основные или несущественные металлы могут быть токсичными.Например, марганец (Mn) является важным элементом (то есть микронутриентом) для растений, но его чрезмерное поглощение может вызвать токсичность для сельскохозяйственных культур [28, 29]. С другой стороны, As, Cd, Pb и ртуть (Hg) не являются необходимыми для человека, но их избыток также может вызывать токсичность. У людей, подвергающихся воздействию Pb или Hg, развиваются неврологические расстройства, в то время как воздействие Cd связано с повреждением почек и хрупкостью костей, а также могут возникать различные формы рака из-за приема пищи или воды, загрязненных As [30]. Сводная информация о токсичности тяжелых металлов, обычно связанная с загрязнением окружающей среды, приведена в таблице 1.
| Тяжелый металл (символ) | Организм † | Сущность ‡ | Токсичность§ | Ссылка |
| Мышьяк (As) | Растения | Нет | Повышенный окислительный стресс и замедление роста растений. | [31-33] |
| Животные | № | Слепота и снижение набора веса. | [9] | |
| Люди | № | Повышенный риск рака. | [30] | |
| Кадмий (Cd) | Растения | № | Повышенный окислительный стресс и замедление роста растений. | [34, 35] |
| Животные | № | Сниженная прибавка в весе. | [36] | |
| Люди | № | Повреждение почек и хрупкость костей. | [30] | |
| Хром (Cr) | Растения | № | Повышенный окислительный стресс и снижение роста растений.Cr (VI) более токсичен, чем Cr (III). | [9, 37] |
| Животные | № | ? | [38] | |
| Люди | Да | Аллергия и повышенный риск рака. Cr (VI) более токсичен, чем Cr (III) или Cr (V). | [39-41] | |
| Кобальт (Co) | Растения | № | Хлороз молодых листьев (ограниченная транслокация Fe) и снижение роста растений. | [42, 43] |
| Животные | Да | Потеря массы тела и нарушение координации движений мышц. | [9, 44] | |
| Люди | Да | Кардиомиопатия и повышенный риск рака. | [45] | |
| Медь (Cu) | Растения | Да | Промежуточный хлороз молодых листьев, уменьшение ветвления, утолщение, потемнение корешков и замедление роста растений. | [9, 43, 46] |
| Животные | Да | Гастроэнтериты, поражение печени и смерть. | [9, 47] | |
| Люди | Да | Болезнь Вильсона, гемолиз, некроз печени и повреждение почек. | [9, 48] | |
| Железо (Fe) | Растения | Да | Бронзовый цвет листьев, корни с черным налетом и снижение роста растений. Часто встречается в заливном рисе. | [9, 49] |
| Животные | Да | Анорексия, диарея, метаболический ацидоз, снижение скорости роста тела и смерть. | [9, 44] | |
| Люди | Да | Рвота, диарея, метаболический ацидоз и повышенный риск атеросклероза и болезни Альцгеймера. | [9, 50] | |
| Свинец (Pb) | Растения | № | Хлороз, потемнение корневой системы, задержка роста растений и повышенный окислительный стресс. | [51] |
| Животные | № | Потеря аппетита, диарея, анемия и потеря веса тела. | [9] | |
| Люди | № | Неврологические проблемы (от головной боли до психоза) и поражение почек. | [9, 30] | |
| Марганец (Mn) | Заводы | Да |
Frontiers | Фитоэкстракция тяжелых металлов: перспективный инструмент очистки загрязненной окружающей среды?
- Кафедра биохимии и микробиологии, Факультет пищевой и биохимической технологии, Химико-технологический университет, Прага, Чехия
Загрязнение тяжелыми металлами (ТМ) представляет серьезную угрозу как для окружающей среды, так и для здоровья человека.Из-за их элементарного характера ТМ не может подвергаться химическому разложению, и их детоксикация в окружающей среде в основном заключается либо в стабилизации in situ , либо в их удалении из матрицы, например почвы. С этой целью в качестве многообещающей зеленой альтернативы традиционным физическим и химическим методам была предложена фиторемедиация, то есть применение растений для восстановления загрязненной окружающей среды. Среди методов фиторемедиации фитоэкстракция относится к удалению ТМ из матрикса путем их поглощения растением.Он обладает значительными преимуществами по сравнению с традиционными методами, особенно из-за его рентабельности, возможности одновременной обработки нескольких ТМ, отсутствия необходимости выемки загрязненной почвы, хорошего признания общественностью, возможности последующей обработки производимой биомассы и т. Д. В этом обзоре мы сосредоточились на трех основных стратегиях фитоэкстракции ТМ, которые различаются типом используемых видов растений: естественные гипераккумуляторы, быстрорастущие виды растений с высокой продукцией биомассы и, возможно, растения, генетически модифицированные в соответствии с фенотипом, благоприятствующим эффективности. Поглощение ТМ и повышение толерантности к ТМ.На сегодняшний день накоплен значительный объем знаний о применимости растений для фитоэкстракции ТМ как в лабораторных исследованиях, проведенных в контролируемых модельных условиях, так и в полевых испытаниях с использованием реальных условий окружающей среды. На основе этих знаний было предложено множество конкретных применений растений для восстановления почв, загрязненных ТМ. Такие исследования часто также включают предложения по дальнейшей переработке биомассы, загрязненной ТМ, что обеспечивает дополнительную экономическую ценность. На основе представленных здесь примеров мы рекомендуем провести интенсивные исследования по выбору подходящих таксонов растений для различных наборов условий, оценке экологических рисков, судьбе биомассы, обогащенной ТМ, экономическим аспектам процесса и т. Д.
Введение
С индустриализацией и урбанизацией развивающихся стран и растущим спросом человечества, потребление элементов тяжелых металлов (ТМ, см. Глоссарий) чрезвычайно выросло. В результате загрязнение ТМ и металлоидами (см. Глоссарий) становится все более серьезной проблемой, которая повышает осведомленность общественности. В отличие от органических загрязнителей, которые могут полностью или частично разлагаться под действием различных (микро) организмов или детоксифицироваться под действием растений, ТМ не разлагаются и могут быть преобразованы только в формы с измененной токсичностью и / или подвижностью / биодоступностью. (е.g. бактериальное восстановление Hg 2+ до элементарной Hg 0 , которая менее токсична и может испаряться, или восстановление арсената до менее токсичных оксианионов арсенита; Сильвер и Фунг, 2005; Сильвер и Фунг ле, 2005). Устойчивость ТМ в экологических матрицах, особенно в почвах, отложениях и водоемах, является результатом элементного характера ТМ (Chapman et al., 1996). Таким образом, загрязнение ТМ представляет собой долгосрочную угрозу для окружающей среды и здоровья человека не только в промышленных и постиндустриальных областях.
Глоссарий .
Heavy Metal Пока нет единого определения термина «тяжелый металл» (HM). Тем не менее, самый последний предложенный критерий определяет ТМ как встречающиеся в природе металлы с атомным номером> 20 и элементной плотностью> 5 г · см −3 (Ali and Khan, 2018). В биологических науках этот термин вместо этого описывает серию металлических элементов и металлоидов с потенциальным токсическим действием на живые организмы даже при очень низких концентрациях.С этой токсикологической / экотоксикологической точки зрения химические свойства и поведение в живых системах являются более важным критерием. Следовательно, в дополнение к элементам переходных металлов, таким как Cd, Pb, Hg, Zn, Cu, Co, Ni, Al, Cr, Fe, металлоиды As, Se или Sb также могут рассматриваться как «тяжелые металлы».
Фиторемедиация Использование растений для восстановления загрязненной окружающей среды. Как правило, существует две основные стратегии снижения токсичности ТМ в почвах: стабилизация участка (включая методы фитостабилизации) и методы «очистки » (включая методы фитоэкстракции и фитовулатилизации).
Фитостабилизация Использование растений для снижения токсичности ТМ в почве за счет снижения их подвижности / биодоступности.
Фитоэкстракция Использование растений для удаления ТМ из загрязненной матрицы (почвы и воды) путем их поглощения собираемыми частями растений.
Гипераккумуляция Способность растения накапливать ТМ в надземных частях без фитотоксических симптомов в концентрациях до 100–1000 раз выше, чем у негипераккумулирующих видов (Baker, 1981).Такая способность заключается в (i) увеличении поглощения ТМ из ризосферы через плазматическую мембрану корневой клетки, (ii) уменьшении секвестрации ТМ в вакуолях корневых клеток, (iii) увеличении загрузки ТМ в ксилема для транспорта к побегам и (iv) стимуляция притока ТМ через плазматическую мембрану листовых клеток и секвестрацию в вакуолях листа (клетки мезофилла) (Milner and Kochian, 2008).
Фитодобыча Использование установок для удаления in situ ТМ из субхозяйственных рудных тел, металлоносных почв или загрязненных участков рудников с дополнительной целью извлечения экономичного количества металлов из растений [по Шеорану и al.(2009)].
Стратегия «генного стекирования» (также «генная пирамида») Экспрессия или манипулирование множественными (транс) генами в одной линии растений [обзор см. В Halpin (2005)]. Этот процесс дает возможность накапливать несколько признаков, обычно множественную устойчивость к различным типам стресса или патогенов. Как обсуждается в тексте, это также может предоставить инструмент для получения сорта растений, подходящего для эффективной фитоэкстракции ТМ.
Система лесного хозяйства / плантаций с коротким севооборотом Концепция выращивания древесных растений (особенно быстрорастущих деревьев, таких как ива, тополь, сосна, осина, береза, бук, эвкалипт и т. Д.)) или ежегодно собираемые энергетические культуры для производства энергии.
Трангеноз Метод генной селекции с введением трансгена , который, согласно Jacobsen и Schouten (2009), является (синтетическим) геном с некоторыми или всеми регуляторными последовательностями и кодирующими последовательностями от доноров, отличных от пригодных для скрещивания растений, включая микроорганизмы и животные. Трансгены составляют новый генофонд для селекции растений.
Цисгенез Метод генной технологии селекции для введения цисгена , который, согласно Jacobsen и Schouten (2009), является уже существующим естественным геном из самого таксона растений или из скрещиваемых видов, включая его природный промотор и терминатор.Ген принадлежит к традиционному генофонду заводчиков и является уже существующим результатом естественной эволюции.
Intragenesis Селекционный метод генной технологии для введения внутригена , который, согласно Jacobsen и Schouten (2009), представляет собой ген, состоящий из природных функциональных элементов, таких как кодирующая часть, промотор и терминатор, происходящие от разных генов растения таксон или от скрещиваемых видов. Все природные генные элементы принадлежат к традиционному генофонду заводчиков.
Обычные физические и химические методы удаления ТМ из загрязненной окружающей среды, как правило, неприменимы в больших масштабах, часто дороги и не принимаются общественностью [недавний обзор см. В Khalid et al. (2017)]. Напротив, биоремедиация, то есть использование живых организмов или их частей для восстановления, представляет собой группу методов, которые очень применимы на больших загрязненных территориях, особенно в тех случаях, когда удаление загрязнения ТМ не является срочным. Использование растений для обеззараживания загрязненной окружающей среды получило название фиторемедиации и было описано в середине 90-х годов (Sandermann, 1994; Cunningham et al., 1995; Schnoor et al., 1995; Каннингем и Оу, 1996). С тех пор огромное количество исследований было сосредоточено на использовании различных видов растений для удаления или стабилизации как органических, так и неорганических загрязнителей (обзоры см. В Salt et al., 1998; Macek et al., 2000; Mackova et al. , 2006a, b; Marmiroli et al., 2006; Cristaldi et al., 2017; Wang et al., 2017).
Как правило, наиболее часто используемые стратегии по восстановлению окружающей среды, загрязненной ТМ, основаны либо на их стабилизации in situ , т.е.д., снижение острой токсичности ТМ за счет уменьшения их подвижности и биодоступности (так называемые методы «стабилизации сайта») или основаны на удалении ТМ (группа методов «очистки»). При использовании растений первая группа обозначается термином фитостабилизация (см. Глоссарий). Среди методов очистки фитоэкстракция использует установки для извлечения ТМ из почв и их накопления в собираемых частях, которые впоследствии удаляются и обрабатываются (Baker et al., 1994; Salt et al., 1995, 1998; Chaney et al., 1997). Фитолатилизация , an
Марганец — это химически активный элемент серо-розового цвета. Это твердый металл и очень хрупкий. Трудно плавится, но легко окисляется. В чистом виде марганец реакционноспособен, и в виде порошка он горит в кислороде, он реагирует с водой (ржавеет, как железо) и растворяется в разбавленных кислотах. Области применения Марганец необходим для производства чугуна и стали.В настоящее время на производство стали приходится от 85% до 90% от общего спроса, большая часть от общего спроса. Марганец является ключевым компонентом недорогих составов нержавеющей стали и некоторых широко используемых алюминиевых сплавов. Диоксид марганца также используется в качестве катализатора. Марганец используется для обесцвечивания стекла и изготовления стекла фиолетового цвета. Перманганат калия является сильным окислителем и используется в качестве дезинфицирующего средства. Другие соединения, которые находят применение, — это оксид марганца (MnO) и карбонат марганца (MnCO 3 ): первое используется в удобрениях и керамике, второе является исходным материалом для получения других соединений марганца. Марганец в окружающей среде Марганец — один из наиболее распространенных металлов в почвах, где он встречается в виде оксидов и гидроксидов и циклически проходит через различные степени окисления. Марганец встречается в основном в виде пиролюзита (MnO 2 ) и в меньшей степени в виде родохрозита (MnCO 3 ). Ежегодно добывается более 25 миллионов тонн, что составляет 5 миллионов тонн металла, а запасы оцениваются в более чем 3 миллиарда тонн металла.Основными районами добычи марганцевых руд являются Южная Африка, Россия, Украина, Грузия, Габон и Австралия.
Рекомендуемое суточное потребление марганца |
Биовыщелачивание тяжелых металлов из осадка сточных вод с использованием местных железоокисляющих микроорганизмов: влияние местных железоокисляющих микроорганизмов Всего твердых веществ
1 Международный журнал экологической, химической, экологической, геологической и геофизической инженерии Том: 3, №: 1, 29 Биовыщелачивание тяжелых металлов из осадка сточных вод с использованием местных железоокисляющих микроорганизмов: влияние концентрации субстрата и общего содержания твердых веществ Ashish Pathak a, M .Г. Дастидар a *, TR Sreekrishnan b Международный научный индекс, Экологическая и экологическая инженерия Том: 3, №: 1, 29 waset.org/publication/116 Резюме В настоящем исследовании влияние концентрации сульфата железа и общего содержания твердых веществ на биовыщелачивание тяжелых металлов из осадка сточных вод исследовали с помощью аборигенных железоокисляющих микроорганизмов. Эксперименты по влиянию концентраций сульфата двухвалентного железа на биовыщелачивание проводились с использованием сульфата двухвалентного железа различных концентраций (5-2 г / л) для оптимизации концентрации сульфата железа для максимального биовыщелачивания.Быстрое изменение pH и ОВП происходило в первые 2 дня с последующим медленным изменением до 16-го дня во всех образцах ила. Концентрация сульфата железа в 1 г / л оказалась достаточной для биовыщелачивания металлов в следующем порядке: Zn: 69%> Cu: 52%> Cr: 46%> Ni: 45. Кроме того, было обнаружено, что биовыщелачивание с использованием сульфата железа приводит к быть эффективным до концентрации 2 г / л. Результаты настоящего исследования убедительно указывают на то, что использование 1 г / л сульфата двухвалентного железа местных микроорганизмов, окисляющих железо, может снизить pH до значения, необходимого для значительной солюбилизации металла.Ключевые слова Биовыщелачивание, тяжелые металлы, ил сточных вод, микроорганизмы, окисляющие железо. I. ВВЕДЕНИЕ Утилизация ила сточных вод на суше в качестве удобрения является старой практикой из-за присутствия в иле азота, фосфора и других питательных веществ [1]. Однако присутствие тяжелых металлов в иле ограничивает его использование на суше. Применение осадков сточных вод, загрязненных тяжелыми металлами, представляет серьезную угрозу для окружающей среды из-за потенциального риска вымывания металлов в грунтовые и поверхностные воды, а также из-за их попадания в пищевую цепочку [2].Поэтому удаление тяжелых металлов из загрязненного осадка сточных вод имеет большое значение для обеспечения безопасного удаления осадка на суше. На протяжении многих лет технология биовыщелачивания с участием железо и окисляющих серу микроорганизмов приобретает все большее значение как эффективный и экономичный метод обеззараживания осадка сточных вод [3]. Процесс биовыщелачивания с использованием окисляющего железо F.A. Автор из Центра энергетических исследований Индийского технологического института, Хауз Хас, Нью-Дели-1116, Индия. Автор — Центр энергетических исследований Индийского технологического института, Хауз Хас, Нью-Дели-1116, Индия (* Автор для переписки: Ph; Fax; T.C. Автор работает в Департаменте биохимической инженерии и биотехнологии (микроорганизмы и сульфат железа в качестве источника энергии считаются лучшими, так как существует меньший риск повторного подкисления почвы. Когда сульфат железа используется в качестве субстрата, окисление двухвалентного железа приводит к для производства трехвалентного железа, действующего как окислитель, вызывающий солюбилизацию металлов. Количество сульфата двухвалентного железа, используемого при биовыщелачивании металлов, влияет на соотношение двухвалентного железа и, следовательно, на pH в системе. При более низких концентрациях сульфата двухвалентного железа изменение pH может не измениться. достаточно для растворения металлов.С другой стороны, слишком много сульфата железа не улучшит растворение металлов и, следовательно, увеличит экономичность процесса. Кроме того, избыток железа вызовет образование огромного количества шлама, удаление которого будет дополнительной проблемой. Следовательно, концентрация сульфата железа является важным параметром, который необходимо оптимизировать для эффективного биовыщелачивания. Помимо концентрации субстрата, содержание твердых веществ в иле также играет важную роль в определении эффективности процесса биовыщелачивания.Биовыщелачивание с более высокими показателями дает привлекательную возможность, так как за заданное время можно обработать большее количество ила. Однако при более высоком содержании снижение pH снижается из-за более высокой буферной способности ила, что в конечном итоге требует больше времени для достижения значений pH, необходимых для солюбилизации металлов. Поэтому стоит изучить оптимальную концентрацию, при которой может происходить эффективное биовыщелачивание. В настоящем исследовании была сделана попытка оптимизации концентрации сульфата железа, а также концентрации для эффективного биовыщелачивания.Эксперименты проводились с анаэробно сброженным осадком сточных вод с использованием местных окисляющих железо микроорганизмов осадка с использованием различного количества сульфата железа (5-2 г л -1) и (5-4 г л -1). II. МАТЕРИАЛЫ И МЕТОДЫ 2.1 Сбор осадка: анаэробно сброженный осадок сточных вод был получен на одной из крупнейших станций очистки сточных вод в Дели, столице Индии, с мощностью очистки более 1 MGD. 2.2 Микроорганизмы и приготовление инокулята: окисляющие железо микроорганизмы, изначально присутствовавшие в иле, были использованы для приготовления инокулята, для чего использовался активный ил от Международного ученого и научного исследования и инноваций 3 (1).waset.org/1999.6/116
2 Международный журнал экологической, химической, экологической, геологической и геофизической инженерии Том: 3, №: 1, 29 Международный научный индекс, Экологическая и экологическая инженерия Том: 3, №: 1, 29 waset.org/publication/116 вторичная обработка ступень очистных сооружений была обогащена 3 г л -1 сульфата железа. Колбу инкубировали в орбитальном шейкере при 28 ° C и 18 об / мин и отслеживали pH культуры.Когда pH с исходного значения 7 снизился до 3, культуру перенесли в свежий ил. Эту процедуру повторяли трижды, чтобы получить активный посевной материал (акклиматизированный ил) для использования в последующих экспериментах по биовыщелачиванию. 2.3 Характеристика ила: pH ила определяли с помощью 51 ph-метра Cyberscan, а ОВП ила измеряли с помощью стандартного зонда-измерителя ОВП. Общее содержание твердых веществ, зольность, общее содержание азота и общее содержание фосфора определяли по стандартным методикам [5].Для определения общего содержания тяжелых металлов образцы ила подвергали двухкислотному сбраживанию (HNO 3 + HClO 4), а тяжелые металлы в сброженной жидкости определяли с помощью атомно-абсорбционного спектрофотометра (Perkin Elmer AAnalyst 2). Физико-химические свойства ила представлены в таблице Биовыщелачивание металлов: Эксперименты по биовыщелачиванию по влиянию концентрации субстрата проводили в колбах Эрленмейера на 5 мл с 25 мл ила (концентрация твердого вещества 2 г / л), содержащего 1% активный посевной материал.Эксперименты проводили в течение 16 дней при 28 ° C и 18 об / мин с использованием различных концентраций (5, 1, 15 и 2 г / л) сульфата железа. Для сравнения результатов также был проведен контрольный цикл без добавления сульфата железа и инокулята. Образцы отбирали каждые два дня из каждой колбы и анализировали на pH, ОВП и содержание металлов. Эксперименты проводили в двух экземплярах. Металлы в смеси (ил + посевной материал) регистрировали как показания нулевого дня. Аналогичная процедура была проведена для проведения экспериментов по влиянию использования различных концентраций (5-4 г / л).ТАБЛИЦА 1 ФИЗИКО-ХИМИЧЕСКИЕ СВОЙСТВА анаэробно переваренного осадка Параметры Значение ph 7,22 Общее количество твердых веществ (г / л) 2 Cu (мг / кг сухого осадка) 472 Ni (мг / кг сухого осадка) 294 Zn (мг / кг сухого осадка) 131 Cr (мг кг-1 сухого осадка) 332 III. РЕЗУЛЬТАТЫ И ОБСУЖДЕНИЕ 3.1 Влияние концентрации субстрата Изменение pH и ОВП: Изменение pH во времени во время биовыщелачивания при различных концентрациях сульфата железа вместе с контролем показано на рисунке 1. В контроле без добавления сульфата железа и инокулята. , наблюдалось лишь небольшое снижение ph от начального значения 7.до 6,9 на 16-е сутки. Этого следовало ожидать, поскольку посевной материал активных микробов, а также источник энергии не подавались извне для поддержания in-situ окисляющих железо микроорганизмов в иле. ph g / l 1 Рис. 1 Изменение pH во времени во время биовыщелачивания при различных концентрациях сульфата железа С другой стороны, в присутствии посевного материала и сульфата железа (5, 1, 15 и 2 г / л) резкое падение in ph до <4 наблюдалась в первые 2 дня во всех образцах ила, содержащих сульфат железа в качестве источника энергии.Уменьшение pH происходило быстрее с увеличением концентрации сульфата железа. Однако через 16 дней не было большой разницы в конечных показателях pH, достигнутых для всех шламов (кроме 5 г / л), содержащих сульфат железа. Резкое снижение pH в первые 2 дня указывает на лучшую акклиматизацию и быстрый рост железоокисляющих микроорганизмов, использующих сульфат железа в качестве источника энергии. В илах, содержащих сульфат железа выше 5 г / л, pH снижался быстрее до <3 в первые 2 дня, а затем оставался почти постоянным в конце 16-го дня.В конце 16-го дня периода биовыщелачивания конечный pH составлял 3,4, 2,5, 2,3 и 2,2 для шламов, содержащих 5, 1, 15 и 2 г / л сульфата железа, соответственно. Следовательно, очевидно, что 1 г / л сульфата двухвалентного железа достаточно для понижения pH до значения менее 3, необходимого для эффективной солюбилизации металлов. Биоокисление сульфата железа местными микроорганизмами, окисляющими железо, также вызывало увеличение ОВП системы. На рисунке 2 показано изменение ОВП осадка во времени при контроле.Снижение pH, связанное с увеличением ОВП, является показателем значительного роста микроорганизмов [6]. В контроле ОВП достигло только 12 мВ от начального значения -98 мВ через 16 дней. С другой стороны, в илах, содержащих сульфат железа и инокулят, ОВП быстро увеличивался в первые 2 дня, а затем оставался постоянным до 16 дней. Через 16 дней значения ОВП составили 446, 472 и 492 мВ соответственно для ила, получавшего 1, 15 и 2 г л -1 сульфата железа.Международные научные исследования и инновации 3 (1) scholar.waset.org/1999.6/116
3 Международный журнал экологической, химической, экологической, геологической и геофизической инженерии Том: 3, №: 1, 29 Международный научный индекс, Экологическая и экологическая инженерия Том: 3, №: 1, 29 waset.org/publication/116 ORP ( mv) Рис. 2 Изменение ОВП во времени во время биовыщелачивания при различных концентрациях сульфата двухвалентного железа Солюбилизация тяжелых металлов: изменение в% солюбилизации Cu представлено на рисунке 3.В контроле на 16-й день биовыщелачивания солюбилизировалось только 1% Cu. В присутствии сульфата двухвалентного железа значительное количество меди солюбилизировалось. При концентрации сульфата двухвалентного железа 1 г / л на 16-й день солюбилизировалось максимум 52% Cu по сравнению с 28% при использовании 5 г / л сульфата двухвалентного железа. Кроме того, увеличение концентрации сульфата двухвалентного железа не привело к значительной солюбилизации Cu, которая составила 55% и 58% для шламов, получающих 15 и 2 г л -1 сульфата железа, соответственно. Сообщалось, что солюбилизация Cu сильно зависит от ОВП, и для солюбилизации Cu ОВП среды должно быть более 25 мВ [7].В настоящем исследовании высокий ОВП более 4 мВ был достигнут на 16-й день при использовании 1-2 г / л сульфата двухвалентного железа, который способствует солюбилизации Cu. На фиг. 4 показано% солюбилизации Ni со временем. Подобная тенденция наблюдалась при солюбилизации Ni, как и в случае Cu. Однако во всех металлах была достигнута самая низкая солюбилизация Ni. Около 45% Ni солюбилизировалось на 16-й день с использованием 1 г л -1 сульфата железа по сравнению с 12% солюбилизацией в контроле. Дальнейшее увеличение концентрации сульфата железа выше 1 г / л не привело к значительному увеличению солюбилизации Ni, и после 16 дней биовыщелачивания только 48% и 52% Ni были солюбилизированы с использованием 15 и 2 г / л сульфата железа, соответственно. Рис.4% солюбилизация Ni со временем во время биовыщелачивания на Фигуре 5 показывает% солюбилизации Zn со временем. Во всех металлах максимальная солюбилизация была достигнута для Zn. В контроле максимум 16% Zn солюбилизировалось за 16 дней по сравнению с 69% солюбилизацией для ила, получающего 1 г / л сульфата железа. Дальнейшее увеличение содержания сульфата двухвалентного железа дает лишь незначительное повышение солюбилизации Zn, которое составило 74 и 75% для шламов, содержащих 15 и 2 г л -1 сульфата железа (рис. 3).% Солюбилизации Cu со временем во время биовыщелачивания (рис. 5).% солюбилизации Zn со временем во время биовыщелачивания в Международных научных исследованиях и инновациях 3 (1) scholar.waset.org/1999.6/116
4 Международный журнал экологической, химической, экологической, геологической и геофизической инженерии Том: 3, №: 1, 29 Международный научный индекс, Экологическая и экологическая инженерия Том: 3, №: 1, 29 waset.org / publishing / 116% солюбилизации Cr с течением времени показан на фиг. 6. В контроле солюбилизировалось только 12% Cr по сравнению с 46% в осадке, содержащем 1 г / л сульфата железа. Дальнейшее увеличение концентрации Cr сверх 1 г л -1 вызвало лишь небольшое увеличение солюбилизации Cr, и конечная солюбилизация Cr, достигнутая для Cr, составила 51 и 55% для ила, имеющего 15 и 2 г л -1 соответственно. Низкую растворимость Cr при биовыщелачивании можно объяснить его преобладающим присутствием в виде трехвалентного гидроксида в анаэробном иле.Из-за восстановительных условий, преобладающих в анаэробном иле, Cr существует в виде Cr (III). Следовательно, Cr требует длительного времени и низкого значения pH для растворения во время биовыщелачивания. Из приведенных выше результатов можно видеть, что концентрации сульфата двухвалентного железа в 1 г / л достаточно, чтобы довести pH до уровня, необходимого для значительной солюбилизации металла. не привело к значительной солюбилизации металлов, и, следовательно, концентрация сульфата железа в 1 г / л, по-видимому, является жизнеспособным вариантом для эффективного биовыщелачивания.3.2 Влияние изменения pH и ОВП от общего содержания твердых веществ: Изменение pH во времени при различных концентрациях показано на рисунке 7. Можно видеть, что при более высоких концентрациях снижение ph было незначительным. Это связано с более высокой буферной способностью ила при более высокой концентрации твердых веществ, что потребовало больше времени и кислоты для такого же снижения ph. Изменение pH было быстрым при более низкой концентрации до 2 г / л. Потребовалось всего 2 дня для достижения pH менее 3 для ила, имеющего концентрацию твердых веществ 5-2 г / л, тогда как для ила, имеющего твердые частицы ила 3 г / л, потребовалось 4 дня.При более высоком уровне 4 г / л снижение pH было незначительным, и даже после 16 дней биовыщелачивания pH достигал только 3,7. После 16 дней биовыщелачивания значения pH составляли 1,9, 2,1, 2,5 и 2,9 для ила, содержащего 5, 1, 2 и 3 г / л твердого вещества, соответственно. Следовательно, похоже, что использованного количества сульфата железа (1 г / л) было недостаточно для получения достаточного количества кислоты для шламов, имеющих содержание твердых веществ выше .. ph г / л 4 г / л Рис. 7 Изменение pH со временем при различных концентрациях. Изменение ОВП во времени в течение 16 дней периода биовыщелачивания показано на Фигуре 8.ОВП для всех илов постепенно увеличивалось, и через 2 дня ОВП для всех илов составляло более 3 мВ. Однако при более высокой концентрации твердых веществ увеличение ОВП было меньше. Более высокое значение вызвало падение скорости увеличения ОВП. Шлам с самым низким содержанием твердых веществ показал максимальное значение ОВП с максимальным значением 465 мВ после 16 дней биовыщелачивания. 5 ОВП (мВ) г / л 4 г / л Рис. 8 Изменения ОВП во времени при различных концентрациях твердого осадка Солюбилизация тяжелых металлов: изменение солюбилизации Cu при различных концентрациях во время биовыщелачивания показано на рис. 9.Международные научные исследования и инновации 3 (1) scholar.waset.org/1999.6/116
5 Международный журнал экологической, химической, экологической, геологической и геофизической инженерии Том: 3, №: 1, г / л 4 г / lg / л 4 г / л Международный научный индекс, Экологическая и экологическая инженерия Том: 3, номер: 1, 29 waset.org/publication/ Рис. 9 Изменение солюбилизации Cu при различных концентрациях Cu. Как можно видеть, при более высокой концентрации достигается более низкая солюбилизация Cu.При более низкой концентрации твердых частиц ила 5 г / л было достигнуто максимальное удаление меди 69%. При концентрации около 54% Cu было солюбилизировано, тогда как при концентрации твердых частиц осадка 3 и 4 г л -1 солюбилизировались только 46 и 26% Cu. Аналогичная тенденция солюбилизации была достигнута с Ni (рис. 1), Zn (рис. 11) и Cr (рис. 12) г / л 4 г / л рис. 1 Изменение солюбилизации Ni при различных концентрациях на рис. Солюбилизация Zn при различных концентрациях At 2 г л -1, солюбилизировалось около 45% Ni, 67% Zn и 48% Cr.При повышенной концентрации 4 г / л была достигнута пониженная солюбилизация металлов, которая составляла 25%, 36% и 23% только для Ni, Zn и Cr, соответственно. Приведенные выше результаты ясно показывают, что биовыщелачивание с использованием 1 г / л сульфата железа является эффективным до концентрации твердых частиц осадка 2 г / л. Дальнейшее увеличение привело к меньшей солюбилизации металлов г / л 4 г / л Рис. 12 Изменение солюбилизации Cr при различных концентрациях IV. ЗАКЛЮЧЕНИЕ Результаты настоящего исследования показывают, что это оптимальная концентрация сульфата железа, которая может довести pH до уровня, необходимого для солюбилизации металла.. Международные научные исследования и инновации 3 (1) scholar.waset.org/1999.6/116
6 Международный журнал экологической, химической, экологической, геологической и геофизической инженерии Том: 3, №: 1, 29 Используя 1 г / л сульфата железа, на 16-й день pH ила упал до 2,5, необходимого для эффективной солюбилизации металлов. . После 16 дней биовыщелачивания примерно 52% Cu, 45% Ni, 69% Zn и 46% Cr были растворены с использованием 1 г / л сульфата железа в качестве источника энергии.Однако биовыщелачивание 1 г / л сульфата железа эффективно только до концентрации 2 г / л. При более высокой концентрации твердых веществ процентная солюбилизация ингибируется из-за буферной способности ила. Результаты настоящего исследования формируют основу для разработки подходящей стратегии операции биовыщелачивания металлов для обеспечения безопасной утилизации осадка. Международный научный индекс, Экологическая и экологическая инженерия Том: 3, №: 1, 29 waset.org/publication/116 ССЫЛКИ [1] Lombardi, A.Т .; Гарсия, младший О. Оценка потенциала биологической обработки для удаления металлов из осадка сточных вод. Критические обзоры в микробиологии. 1999, 25 (4), [2] Fytianos, K .; Charantoni, E. Выщелачивание тяжелых металлов из осадка городских сточных вод. Экологический. International.1998, 24 (4), [3] Chan, L.C .; Gu, X.Y .; Вонг, J.W.C. Сравнение биовыщелачивания тяжелых металлов из осадка сточных вод с использованием железо- и сероокисляющих бактерий. Достижения в экологических исследованиях. 23, 7, [4] Биовыщелачивание тяжелых металлов из анаэробно сброженных осадков сточных вод с использованием FeS2 в качестве источника энергии.Chemosphere, 24, 55, [5] APHA. Нормы методов исследования воды и сточных вод. 1989 г., 17-е дополнение, Американская ассоциация общественного здравоохранения, Вашингтон, округ Колумбия. [6] Couillard, D .; Chartier, M .; Мерсье, Г. Бактериальное выщелачивание тяжелых металлов из аэробного ила. Технология биоресурсов, 1991, 36 (3), [7] Theis, T.L .; Хейс, Т. Д. Химия тяжелых металлов в анаэробном пищеварении. В кн .: Химия водоотведения / под ред. А. Дж. Рубина. Ann Arbor Science Publishers Inc., Анн-Арбор, Мичиган, 1978 г., стипендиат международных научных и научных исследований и инноваций 3 (1).waset.org/1999.6/116
.
