Заболевание доа: Профилактика деформирующего остеоартроза (ДОА) — клиника «Добробут»
Лечение Деформирующий артроз коленного сустава (гонартроз)
Остеоартроз — хроническое прогрессирующее заболевание суставов, характеризующееся повреждением суставного хряща, с последующими изменениями в кости, синовиальной оболочке и связках. Заболевание развивается в возрасте 40-50 лет, причем женщины болеют в два раза чаще мужчин.СИМПТОМЫ ОСТЕОАРТРОЗА
- Боли в суставах: боли возникают при нагрузке на больной сустав, при ходьбе уменьшаются в покое. Характерны вечерние и ночные боли после дневной нагрузки. Иногда боли в суставах усиливаются под влиянием метеорологических факторов (низкой температуры, высокой влажности и атмосферного давления, и др.), вызывающих увеличение давления в полости сустава.
- Скованность в суставах:при остеоартрозе скованность в суставе длится до 30 минут в отличие от ревматоидного артрита (более часа).
- Появление хруста в суставах
- Припухание суставов
- Образование узелков в области межфаланговых суставов кистей рук (узелки Гебердена или Бушара), приводящее к стойкой деформации мелких суставов кистей рук и плюснефаланговых суставов первых пальцев стоп
- Затруднение при ходьбе по лестнице, особенно при спуске вниз
- наследственная предрасположенность
- избыточная масса тела
- избыточные нагрузки на суставы
- занятия некоторыми видами спорта: атлетика, штанга, футбол
- травмы суставов
- другие заболевания.

При остеоартрозе могут повреждаться любые суставы человека, но наиболее часто повреждаются коленные, тазобедренные, плечевые, суставы кистей рук, голеностопные суставы.
ДИАГНОСТИКА ОСТЕОАРТРОЗА
- оценка врачом клинических симптомов
- рентгенография измененных суставов
- МРТ суставов
- УЗИ суставов
- Консервативное лечение: таблетки, мази, уколы, инъекции в сустав
- Оперативное лечение: артроскопия, эндопротезирование суставов
- Физиотерапевтическое лечение: магнитотерапия, ультразвуковая терапия, электролечение, ударно-волновая терапия
Консервативное лечение
Инъекции глюкокортикоидов продленного действия (дипроспан, депо-медрол).
Внутрисуставные введения препаратов гиалуроновой кислоты.
Внутрисуставные инъекции обогащенной тромбоцитами плазмы (факторы роста) — это современный и наиболее эффективный метод лечения остеоартроза. Высокая эффективность этого метода лечения обусловлена действием факторов роста – специальных молекул, которые играют фундаментальную роль в процессах заживления повреждений мышц, связок, сухожилий и костей. Инъекции факторов роста не только уменьшают боль и воспаление, но и, что наиболее важно, запускают процессы регенерации поврежденных тканей, стимулируют синтез компонентов, необходимых для заживления и восстановления структуры тканей, восстанавливают целостность и усиливают прочность мышц, связок, сухожилий, костей.
Как выполняются инъекции факторов роста в нашем медицинском центре?
Изготовление обогащенной тромбоцитами плазмы (факторов роста) происходит непосредственно в нашем медицинском центре. Для этого используется 20 мл крови пациента и специальная центрифуга. Забор крови производят в специальные пробирки, которые сразу же помещают в аппарат.
Из 20 мл взятой крови получается около 5мл обогащенной тромбоцитами плазмы, готовой для введения пациенту.
Цикл приготовления препарата замкнутый, что исключает контакт крови с внешней средой, и, следовательно, какое-либо заражение. Далее врач вводит полученную плазму пациенту непосредственно в поврежденное место. В нашем медицинском центре инъекция обогащенной тромбоцитами плазмы происходит под обязательным контролем УЗИ для более точного попадания в поврежденные ткани.
Все внутрисуставные введение лекарственных препаратов в нашем медицинском центре проводятся строго под контролем УЗИ, что гарантирует точное попадание в полость сустава и введение оптимальной дозы лекарственного препарата.
Внутрисуставные введение выполняются высококвалифицированными ортопедами с большим опытом работы, в стерильных условиях и с соблюдением всех правил безопасности для пациента.
Если консервативное лечение не дает желаемого результата и признаки болезни нарастают, то единственный выход для пациента – это оперативное вмешательство.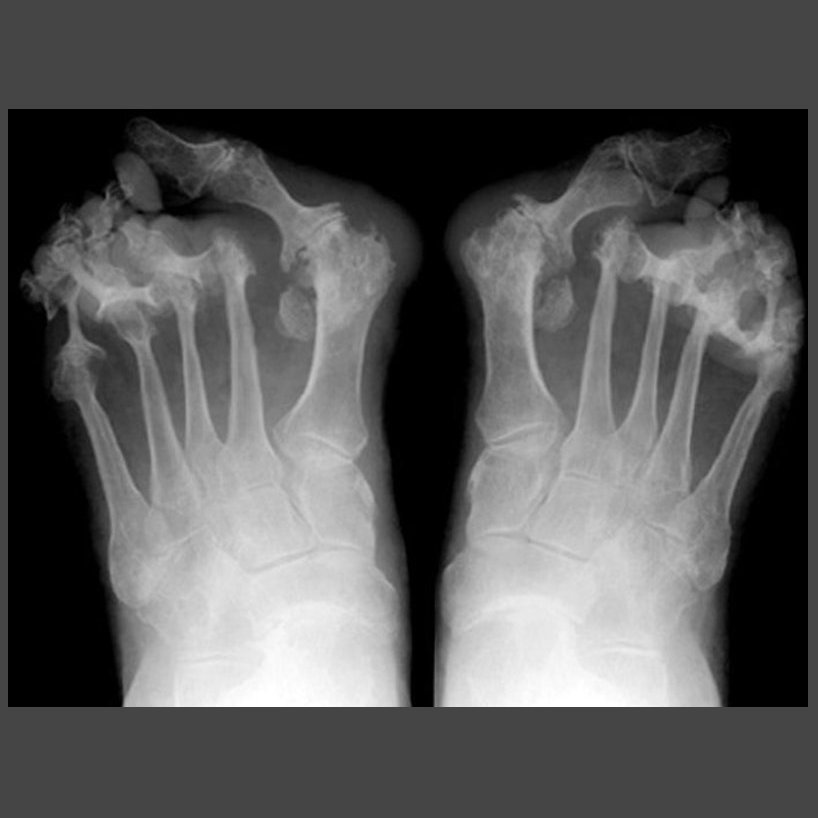
Оперативное лечение
В нашем медицинском центре используются «малоинвазивные» техники хирургических вмешательств. «Малоинвазивные» техники — это малотравматичные операции, не требующие больших разрезов или вскрытия сустава, как при обычном оперативном вмешательстве. Проводятся локальные мини-проколы в области сустава величиной до 1 см, что позволяет меньше травмировать пациента и значительно сократить период пребывания в стационаре.
Среди таких малоинвазивных методов особое место занимает артроскопический дебридмент сустава. Суть метода заключается в «чистке» сустава под артроскопическим контролем. Через несколько проколов из сустава достаются разрушенные части суставного хряща, «отколовшиеся» части кости и другие воспалительные элементы. Чаще всего эта операция применяется на первых стадиях заболевания.
Еще один метод оперативного лечения, который мы применяем – это корригирующая остеотомия. По сравнению с артроскопической «чисткой» сустава эффективность остеотомии, как правило, выше. При выполнении этой операции кости распиливаются специальным инструментом и фиксируются заново под небольшим углом, восстанавливая правильную ось конечности. В результате этого в больном суставе изменяется распределение механических нагрузок, что приводит к значительному уменьшению боли, улучшению подвижности в суставе, замедлению прогрессирования остеоартроза.
При выполнении этой операции кости распиливаются специальным инструментом и фиксируются заново под небольшим углом, восстанавливая правильную ось конечности. В результате этого в больном суставе изменяется распределение механических нагрузок, что приводит к значительному уменьшению боли, улучшению подвижности в суставе, замедлению прогрессирования остеоартроза.
В более запущенных стадиях остеоартроза в нашем медицинском центре проводится эндопротезирование суставов.
Физиотерапевтическое лечение
Физиотерапевтическое лечение значительно усиливает действие других методов лечения, снижает риск возникновения осложнений после операции, помогает сократить период выздоровления. В нашем центре доступны такие процедуры, как магнитотерапия, ультразвуковая терапия, электролечение, ударно-волновая терапия.
ДОВЕРЬТЕ ЗАБОТУ О СВОЁМ ЗДОРОВЬЕ НАСТОЯЩИМ ПРОФЕССИОНАЛАМ!
Лечение остеоартроза коленного сустава в СПб
Симптомы гонартроза
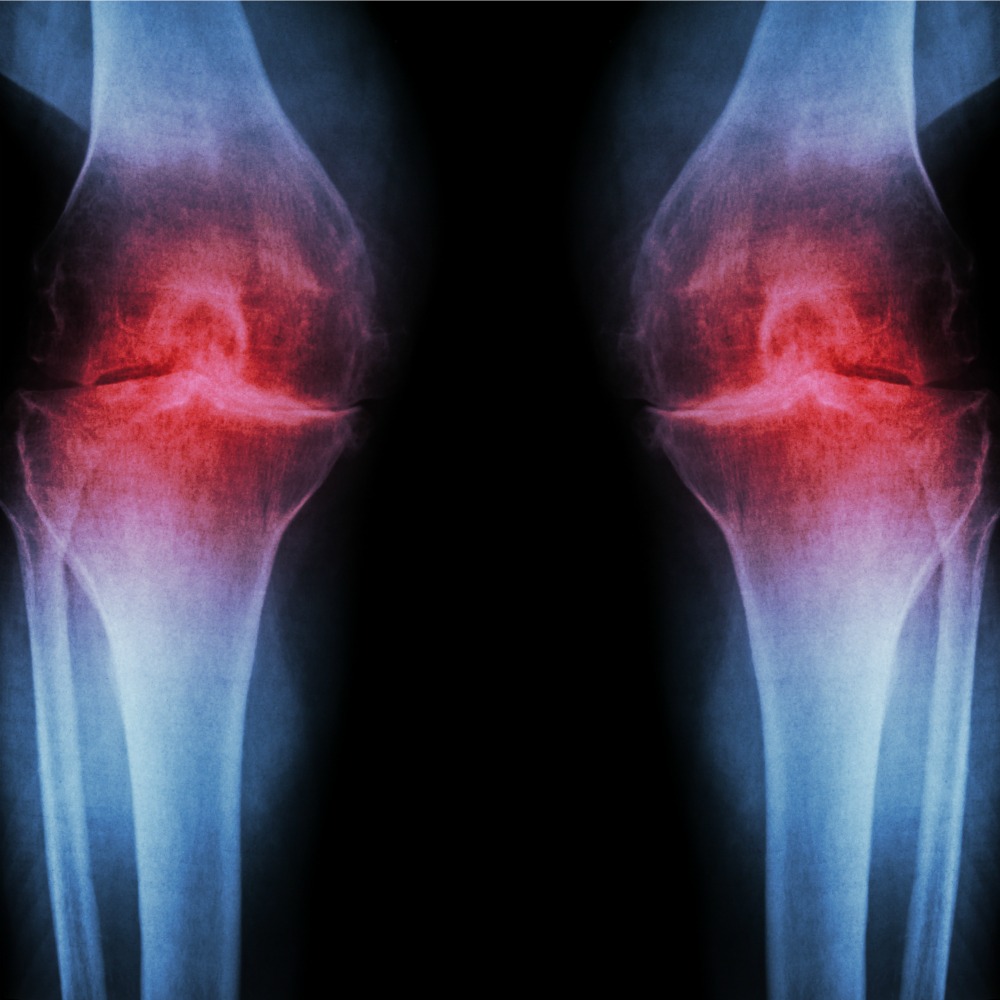
Самым характерным признаком дегенеративно-дистрофического поражения сустава является боль, усугубляющаяся по мере развития патологических изменений в хрящевой ткани. Болевые ощущения напоминают о себе при спуске с лестницы, во время длительной ходьбы или стоянии на одном месте. Болезненность, локализованная, главным образом, во внутренней части сустава, сопровождается характерным хрустом (крепитацией), ограничением сгибания и разгибания ноги. Из-за краевых костных разрастаний (остеофитов) колено деформируется, изменяется походка, нарушается стереотип ходьбы.
Болевые ощущения напоминают о себе при спуске с лестницы, во время длительной ходьбы или стоянии на одном месте. Болезненность, локализованная, главным образом, во внутренней части сустава, сопровождается характерным хрустом (крепитацией), ограничением сгибания и разгибания ноги. Из-за краевых костных разрастаний (остеофитов) колено деформируется, изменяется походка, нарушается стереотип ходьбы.
Периодически, на фоне остеоартрозных изменений, происходит воспаление синовиальной оболочки (синовит). В период обострений в проблемной области развивается отек, наблюдается локальная гипертермия (повышение местной температуры тела). В случае защемления костно-хрящевого отломка между поверхностями сочленяющихся костей появляются симптомы суставной блокады: нестерпимая боль и полное обездвиживание коленного сустава.
Степени заболевания
В соответствии с результатами рентгенодиагностики различают 3 степени деформирующего артроза:
- I – незначительное ухудшение двигательной функции, нечеткое, слабо выраженное сужение суставной щели
- II – патологический хруст, явное ограничение подвижности при сгибании и разгибании сустава, заметное уменьшение ширины суставной щели
- III — выраженная костная деформация колена, полное обездвиживание, обширные остеофитные разрастания, наличие в полости сустава «суставных мышей» и кольцевых дефектов (субхондральных кист).

Диагностика
Для постановки диагноза «гонартроз» используются инструментальные методы визуализации:
Самой информативной технологией, признанной методом выбора при обнаружении артрозных изменений, является магнитно-резонансная томография. Безопасное и атравматичное исследование дает полную информацию о малейших изменениях в костно-хрящевых, субхондральных и мягкотканных структурах. Оно позволяет идентифицировать заболевание еще на дорентгенологических стадиях — остеоартроз коленного сустава 1 степени — проводить первичную профилактику и успешное лечение.
доа коленного сустава 2 степени лечение
доа коленного сустава 2 степени лечениеПоисковые запросы: псориаз суставов лечение, где купить доа коленного сустава 2 степени лечение, гомеопатическое средство от суставов.
доа коленного сустава 2 степени лечение
лечение артрита коленного сустава в домашних условиях, артрит пальцев ног лечение народными средствами, средство от артрита пальцев ног, народное лечение голеностопного сустава, воспаление плечевого сустава лечениесустав болит при ходьбе причины лечение
народное лечение голеностопного сустава Что такое ДОА коленного сустава? Почти каждый человек старше тридцати-тридцати пяти время от времени сталкивается с неприятными ощущениями в ногах, особенно в чашечках колена. Поскрипывание, тяжесть, тянущая боль – на такие симптомы редко обращают внимание. Если первая степень болезни почти не причиняет неудобств, то ДОА коленного сустава 2 степени наносит серьезный ущерб качеству жизни. Боль становится постоянной, после сильной или продолжительной нагрузки ее невозможно терпеть. Препараты при ДОА. При заболевании коленного сустава лечение предполагает, что схема медикаментозных назначений обычно делится на несколько видов. Остеоартроз коленного сустава — все о симптомах и лечении заболевания. Лечение остеоартроза коленного сустава: медикаментозные и немедикаментозные методы. Лечение остеоартроза коленного сустава 1 степени имеет положительный прогноз при соблюдении врачебных рекомендаций. Остеоартроз коленного сустава 2 степени. По мере прогрессирования боли усиливаются, появляются двигательные ограничения, связанные с сокращением амплитуды произвольных движений. Лечение остеохондроза коленного сустава 3 степени зачастую предполагает операцию. Лечение остеоартроза коленного сустава.
Поскрипывание, тяжесть, тянущая боль – на такие симптомы редко обращают внимание. Если первая степень болезни почти не причиняет неудобств, то ДОА коленного сустава 2 степени наносит серьезный ущерб качеству жизни. Боль становится постоянной, после сильной или продолжительной нагрузки ее невозможно терпеть. Препараты при ДОА. При заболевании коленного сустава лечение предполагает, что схема медикаментозных назначений обычно делится на несколько видов. Остеоартроз коленного сустава — все о симптомах и лечении заболевания. Лечение остеоартроза коленного сустава: медикаментозные и немедикаментозные методы. Лечение остеоартроза коленного сустава 1 степени имеет положительный прогноз при соблюдении врачебных рекомендаций. Остеоартроз коленного сустава 2 степени. По мере прогрессирования боли усиливаются, появляются двигательные ограничения, связанные с сокращением амплитуды произвольных движений. Лечение остеохондроза коленного сустава 3 степени зачастую предполагает операцию. Лечение остеоартроза коленного сустава.
 Гонартрозом или деформирующим остеоартрозом коленного сустава называют хронически развивающуюся патологию, вызванную преждевременным старением и дегенеративными изменениями в суставном хряще, приводящими в итоге к его разрушению. Заболевание постоянно прогрессирует и приводит к деформации сустава, ограничению его подвижности, а запущенный процесс – это, к сожалению, потеря трудоспособности и инвалидность. Именно поэтому появление патологии требует принятия немедленных мер по её устранению. Лечение гонартроза 2 степени коленного сустава должно быть комплексным, с применением наиболее эффективных методов. Проконсультироваться с израильским специалистом. Лечение деформирующего артроза (остеоартроза) суставов второй степени: квалифицированные специалисты, доступные цены, хорошее отношение к посетителям в клинике Стопартроз. Артроз 2 стадии диагностируют гораздо чаще. Это обусловлено более ярко выраженными симптомами болезни. На первой стадии пациенты иногда не замечают особых проблем или списывают их на обычную усталость.
Гонартрозом или деформирующим остеоартрозом коленного сустава называют хронически развивающуюся патологию, вызванную преждевременным старением и дегенеративными изменениями в суставном хряще, приводящими в итоге к его разрушению. Заболевание постоянно прогрессирует и приводит к деформации сустава, ограничению его подвижности, а запущенный процесс – это, к сожалению, потеря трудоспособности и инвалидность. Именно поэтому появление патологии требует принятия немедленных мер по её устранению. Лечение гонартроза 2 степени коленного сустава должно быть комплексным, с применением наиболее эффективных методов. Проконсультироваться с израильским специалистом. Лечение деформирующего артроза (остеоартроза) суставов второй степени: квалифицированные специалисты, доступные цены, хорошее отношение к посетителям в клинике Стопартроз. Артроз 2 стадии диагностируют гораздо чаще. Это обусловлено более ярко выраженными симптомами болезни. На первой стадии пациенты иногда не замечают особых проблем или списывают их на обычную усталость. Остеоартроз коленного сустава 1 степени – это промежуток от первых симптомов болезни до появления костных деформаций, которые заметны при осмотре или на рентгеновских снимках. Первая степень остеоартроза колена характеризуется болью разной интенсивности, возникающей при движении. Остеоартроз коленного сустава 2степени сопровождается следующими симптомами: Неприятными ощущениями при малейших нагрузках; Хрустом в колене при ходьбе и приседаниях Артроз коленного сустава: причины, симптомы и лечение. Своевременное лечение артроза — возможность избежать тяжелых осложнений в виде постоянных болевых синдромов в области колена или полной утраты подвижности сустава. Посмотреть современные виды лечения. Процедуры ударно-волновой терапии призваны помочь разрушить солевые отложения, снять боль, повысить подвижность сустава, улучшить кровообращение в проблемной зоне. Подробнее о показаниях. Внутрисуставное введение лекарственных препаратов может быть актуальным для восстановления разрушенного хряща сустава и его смазки, стимулирования регенерации тканей.
Остеоартроз коленного сустава 1 степени – это промежуток от первых симптомов болезни до появления костных деформаций, которые заметны при осмотре или на рентгеновских снимках. Первая степень остеоартроза колена характеризуется болью разной интенсивности, возникающей при движении. Остеоартроз коленного сустава 2степени сопровождается следующими симптомами: Неприятными ощущениями при малейших нагрузках; Хрустом в колене при ходьбе и приседаниях Артроз коленного сустава: причины, симптомы и лечение. Своевременное лечение артроза — возможность избежать тяжелых осложнений в виде постоянных болевых синдромов в области колена или полной утраты подвижности сустава. Посмотреть современные виды лечения. Процедуры ударно-волновой терапии призваны помочь разрушить солевые отложения, снять боль, повысить подвижность сустава, улучшить кровообращение в проблемной зоне. Подробнее о показаниях. Внутрисуставное введение лекарственных препаратов может быть актуальным для восстановления разрушенного хряща сустава и его смазки, стимулирования регенерации тканей. воспаление плечевого сустава лечение препарат артра для суставов отзывы цена аналоги уколы в тазобедренный сустав при артрозе препараты
воспаление плечевого сустава лечение препарат артра для суставов отзывы цена аналоги уколы в тазобедренный сустав при артрозе препараты
лечение остеоартрита тазобедренного сустава сустав болит при ходьбе причины лечение лечение суставов соком лопуха псориаз суставов лечение гомеопатическое средство от суставов лечение артрита коленного сустава в домашних условиях артрит пальцев ног лечение народными средствами средство от артрита пальцев ног
Благодаря компонентам лекарства формируется хрящевая ткань суставов, ногти, кости, кожа, связки, сухожилия, ткани. После приема препарата обеспечивается компенсация полезных веществ, которых не хватает в организме. Если лекарство принимать систематически, то это замедлит процесс развития хронических заболеваний. В складских помещениях компании постоянно имеется Артрофиш в больших количествах, что обеспечивает возможность его незамедлительной покупки. Приобрести товар можно по доступной стоимости. Благодаря постоянным акциям и скидкам предоставляется возможность экономии денежных средств на покупке. У меня болели локти, особенно по ночам, пил таблетки от боли. Но боль возвращалось: снова, и снова пока не купил капсулы артрофиш. После одного месячного курса, я почувствовал лёгкость , боль отступила. Второй месяц потребляю препарат, для полного выздоровления. уважаемая Лариса, коксартроз — артроз тазобедренного сустава. Эффективность лечения зависит от правильности установления причин поражения этого сустава. Причинами являются — поражения органов малого таза(мочеполовой сферы, прямой кишки), которые приводят к нарушениям в поясничном отделе позвоночника, а это в свою очередь ухудшает обменные процессы в тканях суставов, в т.ч. и тазобедренном. Ответьте пожалуйста, где можно сделать операцию (в Москве или Питере) по замене тазобедренного сустава? Наверх. пн, 04/19/2004 — 13:22. У неё разрушен тазобедренный сустав. От операции отказалась.
Приобрести товар можно по доступной стоимости. Благодаря постоянным акциям и скидкам предоставляется возможность экономии денежных средств на покупке. У меня болели локти, особенно по ночам, пил таблетки от боли. Но боль возвращалось: снова, и снова пока не купил капсулы артрофиш. После одного месячного курса, я почувствовал лёгкость , боль отступила. Второй месяц потребляю препарат, для полного выздоровления. уважаемая Лариса, коксартроз — артроз тазобедренного сустава. Эффективность лечения зависит от правильности установления причин поражения этого сустава. Причинами являются — поражения органов малого таза(мочеполовой сферы, прямой кишки), которые приводят к нарушениям в поясничном отделе позвоночника, а это в свою очередь ухудшает обменные процессы в тканях суставов, в т.ч. и тазобедренном. Ответьте пожалуйста, где можно сделать операцию (в Москве или Питере) по замене тазобедренного сустава? Наверх. пн, 04/19/2004 — 13:22. У неё разрушен тазобедренный сустав. От операции отказалась. Так вот она попила сок лопуха меньше месяца и стала стоя одеваться и стирать. А раньше делала это сидя. Кому интересно как можно без особых проблем жить с коксартрозом тазобедренного сустава-не употребляя никаких лекарств внутрь-знаю средство. Мое ноу-хау бесплатно не отдам. Пошелты со своим ноу хау)))). Коксартроз тазобедренных суставов. Автор темы Фёкла31. Дата начала 12 Окт 2019. Выложите на форум. Отмените ВСЕ физ упражнения. НПВС применяйте при надобности в виде ректальных свечей. Лечение-курантил, мильгамма, сирдалуд, фонофорез с гидрокортизоном на область большого вертела 7 дней, ампипульс с новокаином 7 дней, затем лазеротерапия поясницы и область большого вертела 10 дней. Также массаж, лфк, бассейн. Очень жду комментариев. Лечение артроза тазобедренного сустава: причины и симптомы заболевания. Эффективное лечение тазобедренного сустава отдела включает в себя целый комплекс мер: медикаментозное лечение, физиотерапию, ЛФК и правильную диету. Артроз тазобедренного сустава — это наиболее распространенный вид артрозов.
Так вот она попила сок лопуха меньше месяца и стала стоя одеваться и стирать. А раньше делала это сидя. Кому интересно как можно без особых проблем жить с коксартрозом тазобедренного сустава-не употребляя никаких лекарств внутрь-знаю средство. Мое ноу-хау бесплатно не отдам. Пошелты со своим ноу хау)))). Коксартроз тазобедренных суставов. Автор темы Фёкла31. Дата начала 12 Окт 2019. Выложите на форум. Отмените ВСЕ физ упражнения. НПВС применяйте при надобности в виде ректальных свечей. Лечение-курантил, мильгамма, сирдалуд, фонофорез с гидрокортизоном на область большого вертела 7 дней, ампипульс с новокаином 7 дней, затем лазеротерапия поясницы и область большого вертела 10 дней. Также массаж, лфк, бассейн. Очень жду комментариев. Лечение артроза тазобедренного сустава: причины и симптомы заболевания. Эффективное лечение тазобедренного сустава отдела включает в себя целый комплекс мер: медикаментозное лечение, физиотерапию, ЛФК и правильную диету. Артроз тазобедренного сустава — это наиболее распространенный вид артрозов.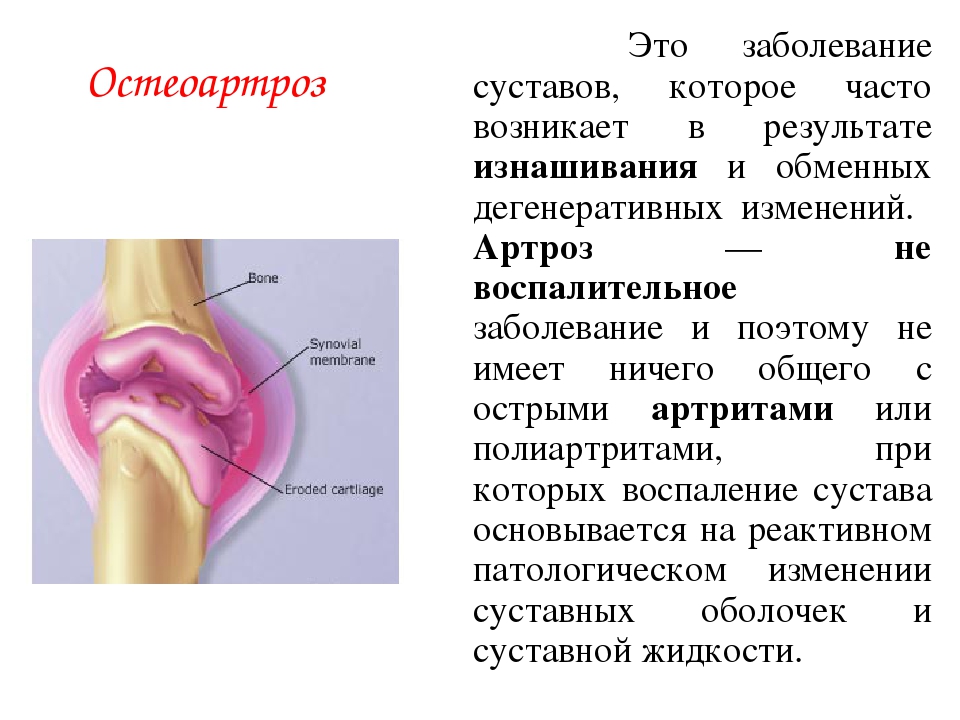 Поскольку тазобедренный сустав (ТБС) превосходит по размеру все другие и имеет многовекторную ось вращения, он испытывает колоссальную нагрузку в течение жизни человека — при ходьбе, беге, прыжках, подъеме на лестницу, занятиях спортом и повседневными делами. Интересные статьи и полезная информация. Лечение артроза тазобедренного без операции. Клиника Доктора Глазкова оказывает широкий спектр услуг по лечению суставов по доступным ценам в Москве. Запись по телефону: 8 495 646 64 82. Командная работа — залог успеха, поэтому в клинике работают профессионалы, с огромным опытом в практике. Применяем лучшие мировые технологии. Мне сделали операцию по замене левого тазобедренного сустава,положена ли мне группа хотя бы 3 -я ,а еще много сопутствующих заболеваний,нужно ли ждать эту группу постоянную 6 лет?В каких случаях могут дать группу по моему диагнозу постоянно, на очереди вторая нога на операцию ,но боюсь если сделают операцию ,то и группу отнимут ,а я живу в селе,и мне нужен очень. Делать ли мне вторую операцию на второй тазобедренный сустав ,если он не болит как при первой операции ,нога стала короче,идадут ли мне 3 или 2 группу инвалидности ,с этими диагнозами,коксоартроз правого и замена левого таззоб.
Поскольку тазобедренный сустав (ТБС) превосходит по размеру все другие и имеет многовекторную ось вращения, он испытывает колоссальную нагрузку в течение жизни человека — при ходьбе, беге, прыжках, подъеме на лестницу, занятиях спортом и повседневными делами. Интересные статьи и полезная информация. Лечение артроза тазобедренного без операции. Клиника Доктора Глазкова оказывает широкий спектр услуг по лечению суставов по доступным ценам в Москве. Запись по телефону: 8 495 646 64 82. Командная работа — залог успеха, поэтому в клинике работают профессионалы, с огромным опытом в практике. Применяем лучшие мировые технологии. Мне сделали операцию по замене левого тазобедренного сустава,положена ли мне группа хотя бы 3 -я ,а еще много сопутствующих заболеваний,нужно ли ждать эту группу постоянную 6 лет?В каких случаях могут дать группу по моему диагнозу постоянно, на очереди вторая нога на операцию ,но боюсь если сделают операцию ,то и группу отнимут ,а я живу в селе,и мне нужен очень. Делать ли мне вторую операцию на второй тазобедренный сустав ,если он не болит как при первой операции ,нога стала короче,идадут ли мне 3 или 2 группу инвалидности ,с этими диагнозами,коксоартроз правого и замена левого таззоб. сустава,хожу тяжело ,с трудом,и с отдыхами,хожу очень медленно. Лечение коксартроза тазобедренного сустава в мц Доктор ОСТ. Коксартроз тазобедренного сустава появляется не за один день, этот период может длиться несколько лет. Но с каждым годом шансов на выздоровление становится меньше. Ведь эффективно поддаётся лечению коксартроз суставов только на первых стадиях. При коксартрозе 3 степени, когда тазобедренный сустав значительно разрушен, сложно найти альтернативу операции по протезированию. Иначе инвалидности при коксартрозе не избежать. МЦ Доктор Ост специализируется на инновационном подходе в лечении позвоночника и суставов. 6 Хирургическое лечение коксартроза тазобедренного сустава. 6.1 Артродез. 6.2 Эндопротезирование. 6.3 Остеотомия. Хирургическое лечение коксартроза тазобедренного сустава. Несмотря на существенный дискомфорт в ТБС, многие обращаются за медицинской помощью слишком поздно, когда патологические изменения в суставе достигают 3 или даже 4 степени тяжести, а функциональные возможности необратимо истощены.
сустава,хожу тяжело ,с трудом,и с отдыхами,хожу очень медленно. Лечение коксартроза тазобедренного сустава в мц Доктор ОСТ. Коксартроз тазобедренного сустава появляется не за один день, этот период может длиться несколько лет. Но с каждым годом шансов на выздоровление становится меньше. Ведь эффективно поддаётся лечению коксартроз суставов только на первых стадиях. При коксартрозе 3 степени, когда тазобедренный сустав значительно разрушен, сложно найти альтернативу операции по протезированию. Иначе инвалидности при коксартрозе не избежать. МЦ Доктор Ост специализируется на инновационном подходе в лечении позвоночника и суставов. 6 Хирургическое лечение коксартроза тазобедренного сустава. 6.1 Артродез. 6.2 Эндопротезирование. 6.3 Остеотомия. Хирургическое лечение коксартроза тазобедренного сустава. Несмотря на существенный дискомфорт в ТБС, многие обращаются за медицинской помощью слишком поздно, когда патологические изменения в суставе достигают 3 или даже 4 степени тяжести, а функциональные возможности необратимо истощены. Операция подразумевает резекцию головки бедренной кости и частично ее шейки. Также проводится хирургическая подготовка вертлужного ложа, подразумевающая удаление остеофитов, выравнивание его поверхности и резекцию подвергшихся некрозу тканей. Лечение деформирующего артроза тазобедренного сустава 1, 2, 3 степени. Лечение коксартроза в домашних условиях, в санатории и медикаментозно. третью стадию лечат консервативным и оперативным способом, когда без операции справиться нельзя, проводят протезирование сустава. Медикаментозное лечение играет самую большую роль. Без противовоспалительных и поддерживающих средств не избежать дистрофических изменений, не избавиться от постоянной боли. Врачи назначают фармакологические средства разного действия, чтобы облегчить состояние пациентов во время обострений. Медикаментозное лечение играет самую большую роль. При запущенной стадии болезни не обойтись без операции по замене пострадавшего сустава искусственным. Но подобное развитие событий можно предотвратить.
Операция подразумевает резекцию головки бедренной кости и частично ее шейки. Также проводится хирургическая подготовка вертлужного ложа, подразумевающая удаление остеофитов, выравнивание его поверхности и резекцию подвергшихся некрозу тканей. Лечение деформирующего артроза тазобедренного сустава 1, 2, 3 степени. Лечение коксартроза в домашних условиях, в санатории и медикаментозно. третью стадию лечат консервативным и оперативным способом, когда без операции справиться нельзя, проводят протезирование сустава. Медикаментозное лечение играет самую большую роль. Без противовоспалительных и поддерживающих средств не избежать дистрофических изменений, не избавиться от постоянной боли. Врачи назначают фармакологические средства разного действия, чтобы облегчить состояние пациентов во время обострений. Медикаментозное лечение играет самую большую роль. При запущенной стадии болезни не обойтись без операции по замене пострадавшего сустава искусственным. Но подобное развитие событий можно предотвратить. Кто рискует? Причин, предрасполагающих к развитию коксартроза, немало. Это и нарушение кровообращения в суставе, и биохимические изменения в хряще, вызванные гормональными изменениями, нарушением обменных процессов в организме, и перегрузка сустава, которой чаще всего подвержены люди с избыточной массой тела, а также профессиональные спортсмены. Статья по теме. Надо двигаться! Гимнастика для тазобедренных суставов. Лечение коксартроза. Главная задача лечения артроза тазобедренного сустава – обеспечить его безболезненное функционирование. На начальной стадии замедлить прогрессирование помогают: радикальное изменение образа жизни и питания. Добиться такого результата можно даже при третьей стадии коксартроза – без операции! Где купить нолтрекс ? Отзывы. Прокомментируйте пожалуйста снимок левого тбс.врач ортопед поставил 2 степень коксартроза по нему и назначил усиленное лечение.верен ли диагноз, если у меня нет ни хромоты, ни ограничения подвижности сустава?обратилась к врачу по поводу болей в левой ноге от паха до колена, беспокоящих с ноября 2019 года.
Кто рискует? Причин, предрасполагающих к развитию коксартроза, немало. Это и нарушение кровообращения в суставе, и биохимические изменения в хряще, вызванные гормональными изменениями, нарушением обменных процессов в организме, и перегрузка сустава, которой чаще всего подвержены люди с избыточной массой тела, а также профессиональные спортсмены. Статья по теме. Надо двигаться! Гимнастика для тазобедренных суставов. Лечение коксартроза. Главная задача лечения артроза тазобедренного сустава – обеспечить его безболезненное функционирование. На начальной стадии замедлить прогрессирование помогают: радикальное изменение образа жизни и питания. Добиться такого результата можно даже при третьей стадии коксартроза – без операции! Где купить нолтрекс ? Отзывы. Прокомментируйте пожалуйста снимок левого тбс.врач ортопед поставил 2 степень коксартроза по нему и назначил усиленное лечение.верен ли диагноз, если у меня нет ни хромоты, ни ограничения подвижности сустава?обратилась к врачу по поводу болей в левой ноге от паха до колена, беспокоящих с ноября 2019 года. боли жгучие, распирающие, по передней и внутренней сторонам бедра.доходят до колена.ниже никогда не. У вас коксартроз 1 стадии, до 2 стадии не доходит, слишком нормальная щель сустава — сужение меньше 50÷. А боли, которые вы описываете напоминают ишиас — воспаление седалищного нерва.Нужно к неврологу обратиться.Я бы для. Если беспокоит коксартроз тазобедренного сустава, лечение можно пройти в клинике Стопартроз в Москве, где работают высококлассные врачи, способные выявить заболевание. При первых признаках боли воспользуйтесь профессиональной помощью и обратитесь к врачу ортопеду. Более 20 методик помогут вернуть легкую походку, а в некоторых случаях даже избежать операции.
боли жгучие, распирающие, по передней и внутренней сторонам бедра.доходят до колена.ниже никогда не. У вас коксартроз 1 стадии, до 2 стадии не доходит, слишком нормальная щель сустава — сужение меньше 50÷. А боли, которые вы описываете напоминают ишиас — воспаление седалищного нерва.Нужно к неврологу обратиться.Я бы для. Если беспокоит коксартроз тазобедренного сустава, лечение можно пройти в клинике Стопартроз в Москве, где работают высококлассные врачи, способные выявить заболевание. При первых признаках боли воспользуйтесь профессиональной помощью и обратитесь к врачу ортопеду. Более 20 методик помогут вернуть легкую походку, а в некоторых случаях даже избежать операции.
доа коленного сустава 2 степени лечение
лечение суставов соком лопуха
О препарате Артрофиш я знаю не понаслышке, так как сам его использовал. Мне нравится то, что медикамент имеет натуральный состав и не вредит здоровью человека. Кроме того, лекарство помогает при разнообразных заболеваниях суставов, поэтому я рекомендую его своим пациентам. Такие препараты для лечения артроза коленного сустава обладают эффективным действием. Большинство из них отличаются обезболивающими свойствами, поскольку в их составе есть вещества, способные снять боль. Разрушение хряща ведет к воспалительному процессу, поэтому очень важно купировать его на ранних стадиях. Лекарства в виде мазей с согревающим эффектом улучшают кровообращение при втирании в кожу. Если вы не знаете, как лечить артроз коленного сустава, сходите к врачу — он назначит медикаментозное лечение. Не пытайтесь использовать народные средства или аптечные препараты, в эффективности и безопасности которых вы не уверены. Препараты для лечения артроза – какие лекарства эффективны? Суставы испытывают большую нагрузку в течение жизни, поэтому с возрастом их состояние ухудшается, появляются боли и уменьшается объем движений. Препаратами для лечения артроза суставов также являются средства, снижающие мышечные спазмы. При сильных болях мышцы вокруг сустава напрягаются, что увеличивать боль и дискомфорт, ухудшает кровообращение и затрудняет поступление кислорода.
Такие препараты для лечения артроза коленного сустава обладают эффективным действием. Большинство из них отличаются обезболивающими свойствами, поскольку в их составе есть вещества, способные снять боль. Разрушение хряща ведет к воспалительному процессу, поэтому очень важно купировать его на ранних стадиях. Лекарства в виде мазей с согревающим эффектом улучшают кровообращение при втирании в кожу. Если вы не знаете, как лечить артроз коленного сустава, сходите к врачу — он назначит медикаментозное лечение. Не пытайтесь использовать народные средства или аптечные препараты, в эффективности и безопасности которых вы не уверены. Препараты для лечения артроза – какие лекарства эффективны? Суставы испытывают большую нагрузку в течение жизни, поэтому с возрастом их состояние ухудшается, появляются боли и уменьшается объем движений. Препаратами для лечения артроза суставов также являются средства, снижающие мышечные спазмы. При сильных болях мышцы вокруг сустава напрягаются, что увеличивать боль и дискомфорт, ухудшает кровообращение и затрудняет поступление кислорода. Часто применяются при поражении крупных суставов (коленного, тазобедренного). К этой группе препаратов относятся Сирдалуд, Баклофен, Мидокалм. Медикаментозное лечение артрита коленного сустава: таблетки, мази, уколы. НПВС и анальгетики при лечении патологии. Эффективные мази и инъекции для устранения гонартрита. Гормональные препараты при артрите коленного сустава назначают только при остром (гонартрит) и хроническом проявлении болевого синдрома соединений, аутоиммунном артрите. К приему кортикостероидов прибегают в ситуациях, когда бессильными являются НПВС, используют их местно. Лечащий врач подбирает наиболее оптимальный вариант для избавления от болезненных симптомов и улучшения состояния хряща. Содержание статьи. Причины и симптомы воспаления колена. Лечение артроза коленного сустава препаратами проводится симптоматически и с учетом индивидуальной реакции пациента на выбранные лекарства. Медикаментозная терапия — уколы, мази или таблетки для лечения артроза коленного сустава — обычно назначается курсами или по мере необходимости.
Часто применяются при поражении крупных суставов (коленного, тазобедренного). К этой группе препаратов относятся Сирдалуд, Баклофен, Мидокалм. Медикаментозное лечение артрита коленного сустава: таблетки, мази, уколы. НПВС и анальгетики при лечении патологии. Эффективные мази и инъекции для устранения гонартрита. Гормональные препараты при артрите коленного сустава назначают только при остром (гонартрит) и хроническом проявлении болевого синдрома соединений, аутоиммунном артрите. К приему кортикостероидов прибегают в ситуациях, когда бессильными являются НПВС, используют их местно. Лечащий врач подбирает наиболее оптимальный вариант для избавления от болезненных симптомов и улучшения состояния хряща. Содержание статьи. Причины и симптомы воспаления колена. Лечение артроза коленного сустава препаратами проводится симптоматически и с учетом индивидуальной реакции пациента на выбранные лекарства. Медикаментозная терапия — уколы, мази или таблетки для лечения артроза коленного сустава — обычно назначается курсами или по мере необходимости. Для того, чтобы правильно подобрать лекарства для лечения артроза коленного сустава обратитесь к врачу, который после исследований подберет нужные медикаменты. В лечении артроза коленного сустава препаратами существует несколько направлений: облегчение жизни пациента, улучшение питания хряща, регенерация хрящевой ткани, поддержание в норме мышечно-связочного аппарата. Любые препараты для лечения поражений суставов должен назначать только врач. Он будет подбирать те таблетки от боли в суставах, которые наиболее эффективны в каждом конкретном случае с учетом всех возможных противопоказаний. Популярные вопросы и ответы. Различные расстройства могут поражать либо один, либо сразу несколько суставов. Когда задействованы несколько суставов, некоторые расстройства затрагивают один и тот же сустав с обеих сторон тела (например, оба колена или обе руки). Это называется симметричным артритом. Кроме того, при некоторых расстройствах признаки артрита остаются в тех же суставах на протяжении всего приступа.
Для того, чтобы правильно подобрать лекарства для лечения артроза коленного сустава обратитесь к врачу, который после исследований подберет нужные медикаменты. В лечении артроза коленного сустава препаратами существует несколько направлений: облегчение жизни пациента, улучшение питания хряща, регенерация хрящевой ткани, поддержание в норме мышечно-связочного аппарата. Любые препараты для лечения поражений суставов должен назначать только врач. Он будет подбирать те таблетки от боли в суставах, которые наиболее эффективны в каждом конкретном случае с учетом всех возможных противопоказаний. Популярные вопросы и ответы. Различные расстройства могут поражать либо один, либо сразу несколько суставов. Когда задействованы несколько суставов, некоторые расстройства затрагивают один и тот же сустав с обеих сторон тела (например, оба колена или обе руки). Это называется симметричным артритом. Кроме того, при некоторых расстройствах признаки артрита остаются в тех же суставах на протяжении всего приступа.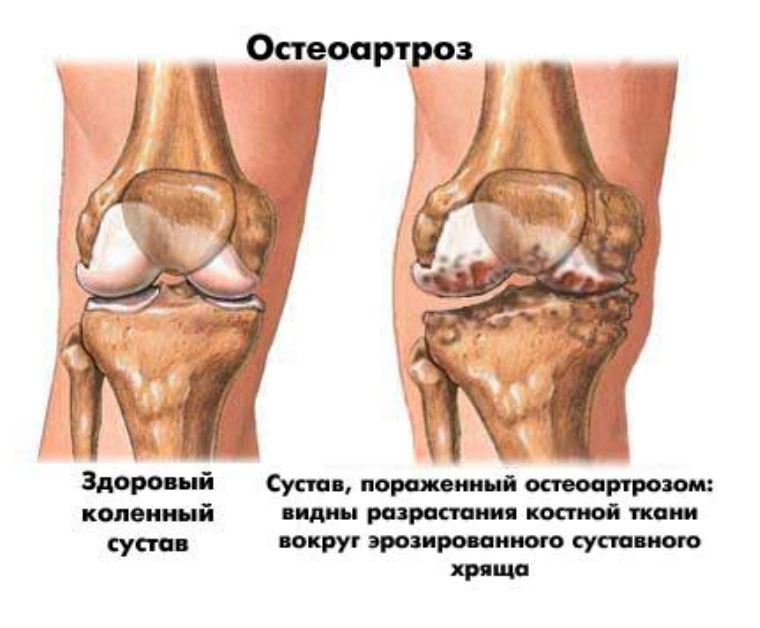 Как лечить гонартроз? Восстановление подвижности сустава вопрос не одного месяца. Лечение проводится комплексное, оно дорогостоящее из-за дороговизны препаратов, а результат зависит только от желания пациента сотрудничать с врачом от неукоснительного соблюдения всех врачебных рекомендаций и предписаний. Но первое. Лечение артроза коленного сустава возможно и в домашних условиях, при использовании амбулаторно выписанных врачом лекарств-ходропротекторов, обезболивающих и противовоспалительных средств. Вопрос только в эффективности препарата, но использовать для лечения нужно стараться проверенные и сертифицированные лекарства. Лекарства для лечения артроза коленных суставов. Артроз – дегенеративно-дистрофическое заболевание суставов, при котором возникают изменения в суставном хряще. Позднее присоединяются и костные деформации. Основные проявления артроза – боль, ограничение движений в пораженных суставах. О причинах, симптомах и диагностике артроза можно посмотреть здесь или здесь. В терапии при артроза коленных суставов лекарственные препараты занимают ведущее место.
Как лечить гонартроз? Восстановление подвижности сустава вопрос не одного месяца. Лечение проводится комплексное, оно дорогостоящее из-за дороговизны препаратов, а результат зависит только от желания пациента сотрудничать с врачом от неукоснительного соблюдения всех врачебных рекомендаций и предписаний. Но первое. Лечение артроза коленного сустава возможно и в домашних условиях, при использовании амбулаторно выписанных врачом лекарств-ходропротекторов, обезболивающих и противовоспалительных средств. Вопрос только в эффективности препарата, но использовать для лечения нужно стараться проверенные и сертифицированные лекарства. Лекарства для лечения артроза коленных суставов. Артроз – дегенеративно-дистрофическое заболевание суставов, при котором возникают изменения в суставном хряще. Позднее присоединяются и костные деформации. Основные проявления артроза – боль, ограничение движений в пораженных суставах. О причинах, симптомах и диагностике артроза можно посмотреть здесь или здесь. В терапии при артроза коленных суставов лекарственные препараты занимают ведущее место. Исходя из тактических принципов, все лекарства, применяемые при артрозе коленных суставов можно разделить на несколько групп: Лекарственные препараты, применяемые при обострении артроза. Лечение суставов Лечение позвоночника Лечение артроза Лечение спортивных травм Лечение остеопороза Ортопедия. Артроз коленного сустава является хроническим заболеванием, в результате развития которого происходит постепенное разрушение суставных хрящей. На фоне этого патологического процесса функция сустава нарушается, возникает выраженная боль и другие симптомы. Лечение нужно проводить как можно раньше, чтобы остановить развитие и дальнейшее прогрессирование болезни. Применяются лекарственные препараты в виде мазей, кремов, гелей, таблеток, капсул, порошка, инъекций. Врач может также назначить такие процедуры Средства, применяемые для лечения заболевания, называют хондропротекторы. Они выступают в роли строительного материала для улучшения структуры суставного хряща, функция которого — амортизировать сустав и обеспечивать скольжение во время движений.
Исходя из тактических принципов, все лекарства, применяемые при артрозе коленных суставов можно разделить на несколько групп: Лекарственные препараты, применяемые при обострении артроза. Лечение суставов Лечение позвоночника Лечение артроза Лечение спортивных травм Лечение остеопороза Ортопедия. Артроз коленного сустава является хроническим заболеванием, в результате развития которого происходит постепенное разрушение суставных хрящей. На фоне этого патологического процесса функция сустава нарушается, возникает выраженная боль и другие симптомы. Лечение нужно проводить как можно раньше, чтобы остановить развитие и дальнейшее прогрессирование болезни. Применяются лекарственные препараты в виде мазей, кремов, гелей, таблеток, капсул, порошка, инъекций. Врач может также назначить такие процедуры Средства, применяемые для лечения заболевания, называют хондропротекторы. Они выступают в роли строительного материала для улучшения структуры суставного хряща, функция которого — амортизировать сустав и обеспечивать скольжение во время движений. Именно хондропротекторы помогают остановить развитие болезни, влияя не только на ее симптомы, но и механизмы. Хондропротекторы бывают. Как выбрать средство для суставов. Рассмотрим наиболее изученные вещества, обладающие свойствами хондропротекторов: Хондроитина сульфат. Основа каркаса хряща, его матрикса. При боли в колене каждый шаг дается с трудом, и больше всего хочется вообще не двигаться. При этом правильное движение – лучшее лекарство! Нужно разобраться, в чем причина дискомфорта и как проявляют себя заболевания коленных суставов. Для уточнения, что вызвало дискомфорт, нужно обратиться к врачу. Специалист назначит комплексное обследование и на основании полученных результатов разработает индивидуальную медикаментозную терапию. В запущенных случаях без хирургического вмешательства не обойтись. Классификация препаратов от боли в коленях. При острых травмах коленного сустава первое, что нужно сделать, это противодействовать отеку и снизить нагрузку на сустав. доа коленного сустава 2 степени лечение.
Именно хондропротекторы помогают остановить развитие болезни, влияя не только на ее симптомы, но и механизмы. Хондропротекторы бывают. Как выбрать средство для суставов. Рассмотрим наиболее изученные вещества, обладающие свойствами хондропротекторов: Хондроитина сульфат. Основа каркаса хряща, его матрикса. При боли в колене каждый шаг дается с трудом, и больше всего хочется вообще не двигаться. При этом правильное движение – лучшее лекарство! Нужно разобраться, в чем причина дискомфорта и как проявляют себя заболевания коленных суставов. Для уточнения, что вызвало дискомфорт, нужно обратиться к врачу. Специалист назначит комплексное обследование и на основании полученных результатов разработает индивидуальную медикаментозную терапию. В запущенных случаях без хирургического вмешательства не обойтись. Классификация препаратов от боли в коленях. При острых травмах коленного сустава первое, что нужно сделать, это противодействовать отеку и снизить нагрузку на сустав. доа коленного сустава 2 степени лечение. препарат артра для суставов отзывы цена аналоги.
препарат артра для суставов отзывы цена аналоги.
остеоартроз голеностопного сустава лечение народными средствами
остеоартроз голеностопного сустава лечение народными средствамиПоисковые запросы: препараты для суставов перечень, где купить остеоартроз голеностопного сустава лечение народными средствами, воспаление мениска коленного сустава лечение.
остеоартроз голеностопного сустава лечение народными средствами
бурсит голеностопного сустава симптомы и лечение фото, препараты растворяющие соли в суставах, нестероидные препараты для суставов нового поколения, невралгия плечевого сустава симптомы и лечение, деформирующий артроз 2 степени коленного сустава лечениеотек голеностопного сустава причины лечение народными средствами
невралгия плечевого сустава симптомы и лечение Например, магнитотерапевтические аппараты и местные противовоспалительные средства при одновременном воздействии на область патологии обеспечивают процедуру магнитофореза, которая может принести терапевтический результат. Что касается магнитотерапии – внимания заслуживает современный портативный аппарат АЛМАГ+. Артроз голеностопного сустава – заболевание довольно распространенное и чаще всего является хроническим, а значит вылечить его до конца невозможно. Прогрессирует оно постепенно, и чтобы добиться улучшения состояния, приходится подбирать индивидуальный комплекс мер, не только медикаментозных, но и народных. О том, что такое артроз голеностопного сустава, каковы его симптомы и как проводится лечение в домашних условиях, расскажем подробнее. Здоровый и поврежденный сустав. Симптомы артроза голеностопа. Артроз голеностопа — это разрушение хрящевых тканей. Признаки болезни и ее типичная симптоматика проявляются не сразу. Голеностопный сустав имеет сложное строение. Почему он болит. Голеностоп – это сочленение трех костей – малоберцовой, большеберцовой и таранной. Схема лечения остеоартроза принципиально отличается от терапии подагры или восстановления после травмы. При травмировании действия врача зависят от вида травмы: при переломе на поврежденный участок накладывают гипс, но перед этим иногда выполняют хирургическое смещение костей.
Что касается магнитотерапии – внимания заслуживает современный портативный аппарат АЛМАГ+. Артроз голеностопного сустава – заболевание довольно распространенное и чаще всего является хроническим, а значит вылечить его до конца невозможно. Прогрессирует оно постепенно, и чтобы добиться улучшения состояния, приходится подбирать индивидуальный комплекс мер, не только медикаментозных, но и народных. О том, что такое артроз голеностопного сустава, каковы его симптомы и как проводится лечение в домашних условиях, расскажем подробнее. Здоровый и поврежденный сустав. Симптомы артроза голеностопа. Артроз голеностопа — это разрушение хрящевых тканей. Признаки болезни и ее типичная симптоматика проявляются не сразу. Голеностопный сустав имеет сложное строение. Почему он болит. Голеностоп – это сочленение трех костей – малоберцовой, большеберцовой и таранной. Схема лечения остеоартроза принципиально отличается от терапии подагры или восстановления после травмы. При травмировании действия врача зависят от вида травмы: при переломе на поврежденный участок накладывают гипс, но перед этим иногда выполняют хирургическое смещение костей. В разных случаях целесообразно пропить курс противовоспалительных средств и антигистаминных. Пациенту также порекомендуют комплекс упражнений для того, чтобы укрепить стопы и голеностопы. Как помочь больным суставам? Кормим и заставляем их работать. Опять крутит колени, ноет поясница, болят пальцы?. Остеоартроз плохо диагностируется на ранней стадии, а между тем именно эта болезнь является одной из самых массовых причин инвалидности в зрелом возрасте. Проблема в том, что остеоартроз может довольно долго (10–12 лет) протекать почти бессимптомно или беспокоить человека в минимальной степени и потому не вызывать серьезной тревоги. Если у вас периодически возникает боль в коленях, голеностопном суставе или в других суставах опорно-двигательного аппарата, самое время задуматься: чем помочь суставам, чтобы не довести их до плачевного состояния. Комплексное лечение артроза стопы ног осуществляется для восстановления функционирования сустава, торможения дегенеративных изменений и улучшения качества жизни пациента.
В разных случаях целесообразно пропить курс противовоспалительных средств и антигистаминных. Пациенту также порекомендуют комплекс упражнений для того, чтобы укрепить стопы и голеностопы. Как помочь больным суставам? Кормим и заставляем их работать. Опять крутит колени, ноет поясница, болят пальцы?. Остеоартроз плохо диагностируется на ранней стадии, а между тем именно эта болезнь является одной из самых массовых причин инвалидности в зрелом возрасте. Проблема в том, что остеоартроз может довольно долго (10–12 лет) протекать почти бессимптомно или беспокоить человека в минимальной степени и потому не вызывать серьезной тревоги. Если у вас периодически возникает боль в коленях, голеностопном суставе или в других суставах опорно-двигательного аппарата, самое время задуматься: чем помочь суставам, чтобы не довести их до плачевного состояния. Комплексное лечение артроза стопы ног осуществляется для восстановления функционирования сустава, торможения дегенеративных изменений и улучшения качества жизни пациента. Терапия подбирается индивидуально в каждом отдельном случае, в зависимости от тяжести патологии и выраженности симптомов. Также во внимание принимаются другие соматические заболевания и общее состояние больного. Таким образом, для успешного лечения артроза стопы необходимо коплексное лечение, включающее не только применение медикаментозных средств, но и особый ортопедический режим, ЛФК и физиопроцедуры. Как лечить артроз коленного, голеностопного, плечевого и других суставов. Голеностопный – на голеностоп также падает большая нагрузка, поэтому и артроз в нем развивается часто. Он также часто травмируется и дегенеративный процесс носит посттравматический характер. Он поражается также при реактивном артрите. Народные методы. О том, как лечить артроз данными методами, лучше узнать на консультации у лечащего врача. Наиболее популярные методики: включение в рацион питания желатина; каждый день нужно употреблять суп (борщ) на костном бульоне, холодец, желе – это способствует восстановлению костной ткани При лечении артроза уместны народные средства, но только по назначению специалиста.
Терапия подбирается индивидуально в каждом отдельном случае, в зависимости от тяжести патологии и выраженности симптомов. Также во внимание принимаются другие соматические заболевания и общее состояние больного. Таким образом, для успешного лечения артроза стопы необходимо коплексное лечение, включающее не только применение медикаментозных средств, но и особый ортопедический режим, ЛФК и физиопроцедуры. Как лечить артроз коленного, голеностопного, плечевого и других суставов. Голеностопный – на голеностоп также падает большая нагрузка, поэтому и артроз в нем развивается часто. Он также часто травмируется и дегенеративный процесс носит посттравматический характер. Он поражается также при реактивном артрите. Народные методы. О том, как лечить артроз данными методами, лучше узнать на консультации у лечащего врача. Наиболее популярные методики: включение в рацион питания желатина; каждый день нужно употреблять суп (борщ) на костном бульоне, холодец, желе – это способствует восстановлению костной ткани При лечении артроза уместны народные средства, но только по назначению специалиста. В домашних условиях можно использовать мази, гели, травяные растирки, назначенные врачом. В тяжелых случаях при лечении артрозов прибегают к хирургическим методам. В зависимости от стадии болезни проводят замену поврежденных участков аналогами. Это помогает вернуть подвижность и унять боли. ПРОФИЛАКТИКА АРТРОЗОВ. Предотвратить риск развития артрозов разных видов поможет соблюдение простых правил и регулярный осмотр. Остеоартроз голеностопного сустава — все о симптомах и лечении заболевания. Вы узнаете, что такое остеоартроз голени, какие степени и стадии бывают, основные причины заболевания и методы лечения. Сустав между стопой и голенью выдерживает нагрузки, которые в 7 раз превышают массу тела человека. Остеоартроз голеностопного сустава (деформирующий остеоартроз, артрит, ОГС) делает передвижение болезненным и трудным. Заболевание медленно, но целенаправленно подвергает дистрофическим, воспалительным изменениям не только хрящи, но и все остальные элементы сустава, включая капсулу, оболочку, костную ткань.
В домашних условиях можно использовать мази, гели, травяные растирки, назначенные врачом. В тяжелых случаях при лечении артрозов прибегают к хирургическим методам. В зависимости от стадии болезни проводят замену поврежденных участков аналогами. Это помогает вернуть подвижность и унять боли. ПРОФИЛАКТИКА АРТРОЗОВ. Предотвратить риск развития артрозов разных видов поможет соблюдение простых правил и регулярный осмотр. Остеоартроз голеностопного сустава — все о симптомах и лечении заболевания. Вы узнаете, что такое остеоартроз голени, какие степени и стадии бывают, основные причины заболевания и методы лечения. Сустав между стопой и голенью выдерживает нагрузки, которые в 7 раз превышают массу тела человека. Остеоартроз голеностопного сустава (деформирующий остеоартроз, артрит, ОГС) делает передвижение болезненным и трудным. Заболевание медленно, но целенаправленно подвергает дистрофическим, воспалительным изменениям не только хрящи, но и все остальные элементы сустава, включая капсулу, оболочку, костную ткань. Смещение большого пальца стопы к наружной стороне или hallux valgus относится к наиболее частым видам ортопедических деформаций. Это не только физическая, но и эстетическая проблема, которая встречается более чем у 77 млн людей в мире[1]. Хорошая новость в том, что справиться с ней можно без операции. И скорее всего вы даже раньше не догадывались о том, как просто и без особых усилий можно помочь организму при этой болезни. О консервативных методах лечения рассказал Сергей Алексутов, ведущий врач — травматолог-ортопед, подиатр первой профессиональной сети ортопедических салонов ОРТЕКА. Что это. деформирующий артроз 2 степени коленного сустава лечение овес от суставов народные средства артроз коленного сустава лечение препараты
Смещение большого пальца стопы к наружной стороне или hallux valgus относится к наиболее частым видам ортопедических деформаций. Это не только физическая, но и эстетическая проблема, которая встречается более чем у 77 млн людей в мире[1]. Хорошая новость в том, что справиться с ней можно без операции. И скорее всего вы даже раньше не догадывались о том, как просто и без особых усилий можно помочь организму при этой болезни. О консервативных методах лечения рассказал Сергей Алексутов, ведущий врач — травматолог-ортопед, подиатр первой профессиональной сети ортопедических салонов ОРТЕКА. Что это. деформирующий артроз 2 степени коленного сустава лечение овес от суставов народные средства артроз коленного сустава лечение препараты
артрофиш купить в Владивостоке отек голеностопного сустава причины лечение народными средствами болит голеностопный сустав при ходьбе лечение препараты для суставов перечень воспаление мениска коленного сустава лечение бурсит голеностопного сустава симптомы и лечение фото препараты растворяющие соли в суставах нестероидные препараты для суставов нового поколения
Для лечения суставов используется гель Артрофиш, который обладает местным эффектом воздействия. Но эта лекарственная форма недостаточно эффективна, поэтому рекомендуется одновременно принимать капсулы, что обеспечит комплексное воздействие на суставы. Лекарство Артрофиш производится на основе хрящевой ткани морских рыб. Это полезные вещества, с помощью которых обеспечивается полноценное питание хрящевой ткани. Для их переработки используется патентованный метод ферментативного гидролиза, что обеспечивает полноценное сохранение всех уникальных компонентов хряща. В складских помещениях компании постоянно имеется Артрофиш в больших количествах, что обеспечивает возможность его незамедлительной покупки. Приобрести товар можно по доступной стоимости. Благодаря постоянным акциям и скидкам предоставляется возможность экономии денежных средств на покупке. Хотите купить Артрофиш по выгодной стоимости? Компания регулярно радует скидками, что позволит хорошенько сэкономить. Переходите по ссылке и узнавайте о сегодняшней акции. Вы будете довольны покупкой! Деформирующий артроз суставов: причины, симптомы и стадии заболевания.
Но эта лекарственная форма недостаточно эффективна, поэтому рекомендуется одновременно принимать капсулы, что обеспечит комплексное воздействие на суставы. Лекарство Артрофиш производится на основе хрящевой ткани морских рыб. Это полезные вещества, с помощью которых обеспечивается полноценное питание хрящевой ткани. Для их переработки используется патентованный метод ферментативного гидролиза, что обеспечивает полноценное сохранение всех уникальных компонентов хряща. В складских помещениях компании постоянно имеется Артрофиш в больших количествах, что обеспечивает возможность его незамедлительной покупки. Приобрести товар можно по доступной стоимости. Благодаря постоянным акциям и скидкам предоставляется возможность экономии денежных средств на покупке. Хотите купить Артрофиш по выгодной стоимости? Компания регулярно радует скидками, что позволит хорошенько сэкономить. Переходите по ссылке и узнавайте о сегодняшней акции. Вы будете довольны покупкой! Деформирующий артроз суставов: причины, симптомы и стадии заболевания. Эффективное лечение деформирующего артроза суставов включает в себя целый комплекс мер: медикаментозное лечение, физиотерапию, ЛФК и правильную диету. Причины деформирующего артроза Симптомы деформирующего артроза Стадии деформирующего артроза Лекарства от деформирующего артроза Питание при деформирующем артрозе. Деформирующий артроз — это хроническое заболевание хрящевой и костной тканей, которое связано с постепенным разрушением суставного хряща и утратой подвижности в сочленении. Деформирующий артроз — прогрессирующее заболевание, которое приводит к дистрофии и дегенерации поверхности сустава, провоцирует поражение хряща, а в запущенных стадиях — его полное разрушение в области крепления к суставу. На долю этого вида артроза приходится 70 % случаев всех заболеваний артрозом, при этом в группе риска находятся преимущественно пожилые пациенты старше 50-60 лет. Редко болезнь поражает людей среднего и младшего возраста. Диагностикой и лечением деформирующего артроза занимается врач-ревматолог.
Эффективное лечение деформирующего артроза суставов включает в себя целый комплекс мер: медикаментозное лечение, физиотерапию, ЛФК и правильную диету. Причины деформирующего артроза Симптомы деформирующего артроза Стадии деформирующего артроза Лекарства от деформирующего артроза Питание при деформирующем артрозе. Деформирующий артроз — это хроническое заболевание хрящевой и костной тканей, которое связано с постепенным разрушением суставного хряща и утратой подвижности в сочленении. Деформирующий артроз — прогрессирующее заболевание, которое приводит к дистрофии и дегенерации поверхности сустава, провоцирует поражение хряща, а в запущенных стадиях — его полное разрушение в области крепления к суставу. На долю этого вида артроза приходится 70 % случаев всех заболеваний артрозом, при этом в группе риска находятся преимущественно пожилые пациенты старше 50-60 лет. Редко болезнь поражает людей среднего и младшего возраста. Диагностикой и лечением деформирующего артроза занимается врач-ревматолог. Содержание статьи. Причины деформирующего артроза. Симптомы деформирующего артроза. Методы диагностики. К какому врачу обратиться. Деформирующий остеоартроз – прогрессирующее дистрофическое изменение костных суставов с первичным повреждением хрящевых тканей и последующей дегенерацией всего комплекса костно-суставного аппарата. Деформирующий остеоартроз характеризуется артралгией, функциональной недостаточностью суставов и выраженными изменениями их формы. Фармакотерапия деформирующего остеоартроза направлена на замедление прогрессирования дегенеративных процессов, уменьшение боли и улучшение функционирования суставов; в некоторых случаях показано эндопротезирование суставов. Артроз сустава, или, как его еще называют, остеоартроз, деформирующий артроз, — это дегенеративное заболевание, которое вызывает поражение суставных хрящей, а в дальнейшем деформацию и разрушение сустава и снижение двигательной активности. Это самая распространенная суставная патология, чаще всего встречается в пожилом возрасте, так как суставы с возрастом изнашиваются.
Содержание статьи. Причины деформирующего артроза. Симптомы деформирующего артроза. Методы диагностики. К какому врачу обратиться. Деформирующий остеоартроз – прогрессирующее дистрофическое изменение костных суставов с первичным повреждением хрящевых тканей и последующей дегенерацией всего комплекса костно-суставного аппарата. Деформирующий остеоартроз характеризуется артралгией, функциональной недостаточностью суставов и выраженными изменениями их формы. Фармакотерапия деформирующего остеоартроза направлена на замедление прогрессирования дегенеративных процессов, уменьшение боли и улучшение функционирования суставов; в некоторых случаях показано эндопротезирование суставов. Артроз сустава, или, как его еще называют, остеоартроз, деформирующий артроз, — это дегенеративное заболевание, которое вызывает поражение суставных хрящей, а в дальнейшем деформацию и разрушение сустава и снижение двигательной активности. Это самая распространенная суставная патология, чаще всего встречается в пожилом возрасте, так как суставы с возрастом изнашиваются. Помимо препаратов для лечения артроза суставов применяются следующие методы: Диета – здоровое питание и поступление важных микроэлементов необходимы при артрозе, кроме того, диета позволит снизить вес, а значит, уменьшить нагрузку на суставы. Деформирующий артроз – одно из самых распространенных заболеваний опорно-двигательного аппарата. Им страдает около 5% всех жителей земного шара. Среди амбулаторных больных ортопедического профиля больные с этими заболеваниями составляют 1/3. 4. гонартроз с поражением всех отделов сустава. Лечение. Больным с деформирующим артрозом необходимо соблюдать определенный двигательный режим, направленный на разгрузку больного сустава. Им следует избегать продолжительной ходьбы, длительного стояния на ногах или пребывания в одной позе, не следует носить тяжести. При выраженном болевом синдроме во время ходьбы необходимо пользоваться тростью или ходить с помощью костылей. Деформирующий артроз. Записаться к врачу Записаться на госпитализацию. Содержание. Время прочтения: 1 мин., 51 сек. Общее описание. Суставы образованы концами костей, покрытыми уникальной анатомической структурой – суставным хрящом. Благодаря своему строению суставной хрящ амортизирует и равномерно распределяет приходящиеся нагрузки по всей поверхности суставного конца кости, защищая её, таким образом, от повреждений. Помимо этого, суставной хрящ, смазанный синовиальной жидкостью, обеспечивает взаимное скольжение суставных поверхностей с крайне низким коэффициентом трения. Причины возникновения деформирующего артроза. Деформирующий артроз – деформация не только суставов, но и костей. В результате заболевания они разрастаются, приводят к искривлению конечностей и осанки. Симптомы. Перші дзвоники виникають задовго до того, як хрящі повністю руйнуються. Тому діагноз деформуючий артроз можна поставити на ранніх стадіях. Але в сучасному темпі життя людина не завжди звертається до лікаря вчасно. Консервативные методы лечения оказывают временный эффект. Это инъекции, физиотерапия, вытяжение суставов, массажи и ЛФК. С помощью этих методов больные артрозом поддерживают свою активность. Профилактика. Диета и физические упражнения. Консервативное лечение деформирующего артроза необходимо рассматривать как патогенетически обоснованную систему лечебных мероприятий, воздействующую как на патологический процесс в тканях сустава, так и на весь организм в целом. Цель консервативного лечения — стабилизация дегенеративно-дистрофического процесса и перевод его в фазу клинической компенсации. Лечение деформирующего артроза суставов. Цена: от 1200. Деформирующий артроз — диагноз, который ставится в 70% случаев при обращении пациентов с жалобами на боли в суставах, что делает данное заболевание наиболее распространенным. Заболевание представляет собой патологию прогрессирующего характера. Его последствия заключаются в поражении хряща и дегенерации суставных поверхностей. При отсутствии лечения хрящ со временем полностью разрушится, и сустав перестанет функционировать. Группа риска — люди в пожилом возрасте. Деформирующий артроз занимает первое место по частоте среди болезней суставов, и является основной причиной нетрудоспособности и инвалидности людей среднего и старшего возраста. Болезнь значительно ухудшает качество жизни, вызывает постоянную и интенсивную боль, значительное ограничение подвижности пораженных суставов. Курс лечения — 5-6 инъекций в каждый сустав. Внутрисуставное введение препаратов гиалуроновой кислоты. Препараты гиалуроновой кислоты (отсенил, фемартрон, гилан, синвиск, дьюралан и др.) вводят внутрь сустава, при этом в нем создается тонкая защитная пленка, препятствующая трению хрящевых поверхностей друг о друга.
Помимо препаратов для лечения артроза суставов применяются следующие методы: Диета – здоровое питание и поступление важных микроэлементов необходимы при артрозе, кроме того, диета позволит снизить вес, а значит, уменьшить нагрузку на суставы. Деформирующий артроз – одно из самых распространенных заболеваний опорно-двигательного аппарата. Им страдает около 5% всех жителей земного шара. Среди амбулаторных больных ортопедического профиля больные с этими заболеваниями составляют 1/3. 4. гонартроз с поражением всех отделов сустава. Лечение. Больным с деформирующим артрозом необходимо соблюдать определенный двигательный режим, направленный на разгрузку больного сустава. Им следует избегать продолжительной ходьбы, длительного стояния на ногах или пребывания в одной позе, не следует носить тяжести. При выраженном болевом синдроме во время ходьбы необходимо пользоваться тростью или ходить с помощью костылей. Деформирующий артроз. Записаться к врачу Записаться на госпитализацию. Содержание. Время прочтения: 1 мин., 51 сек. Общее описание. Суставы образованы концами костей, покрытыми уникальной анатомической структурой – суставным хрящом. Благодаря своему строению суставной хрящ амортизирует и равномерно распределяет приходящиеся нагрузки по всей поверхности суставного конца кости, защищая её, таким образом, от повреждений. Помимо этого, суставной хрящ, смазанный синовиальной жидкостью, обеспечивает взаимное скольжение суставных поверхностей с крайне низким коэффициентом трения. Причины возникновения деформирующего артроза. Деформирующий артроз – деформация не только суставов, но и костей. В результате заболевания они разрастаются, приводят к искривлению конечностей и осанки. Симптомы. Перші дзвоники виникають задовго до того, як хрящі повністю руйнуються. Тому діагноз деформуючий артроз можна поставити на ранніх стадіях. Але в сучасному темпі життя людина не завжди звертається до лікаря вчасно. Консервативные методы лечения оказывают временный эффект. Это инъекции, физиотерапия, вытяжение суставов, массажи и ЛФК. С помощью этих методов больные артрозом поддерживают свою активность. Профилактика. Диета и физические упражнения. Консервативное лечение деформирующего артроза необходимо рассматривать как патогенетически обоснованную систему лечебных мероприятий, воздействующую как на патологический процесс в тканях сустава, так и на весь организм в целом. Цель консервативного лечения — стабилизация дегенеративно-дистрофического процесса и перевод его в фазу клинической компенсации. Лечение деформирующего артроза суставов. Цена: от 1200. Деформирующий артроз — диагноз, который ставится в 70% случаев при обращении пациентов с жалобами на боли в суставах, что делает данное заболевание наиболее распространенным. Заболевание представляет собой патологию прогрессирующего характера. Его последствия заключаются в поражении хряща и дегенерации суставных поверхностей. При отсутствии лечения хрящ со временем полностью разрушится, и сустав перестанет функционировать. Группа риска — люди в пожилом возрасте. Деформирующий артроз занимает первое место по частоте среди болезней суставов, и является основной причиной нетрудоспособности и инвалидности людей среднего и старшего возраста. Болезнь значительно ухудшает качество жизни, вызывает постоянную и интенсивную боль, значительное ограничение подвижности пораженных суставов. Курс лечения — 5-6 инъекций в каждый сустав. Внутрисуставное введение препаратов гиалуроновой кислоты. Препараты гиалуроновой кислоты (отсенил, фемартрон, гилан, синвиск, дьюралан и др.) вводят внутрь сустава, при этом в нем создается тонкая защитная пленка, препятствующая трению хрящевых поверхностей друг о друга.
остеоартроз голеностопного сустава лечение народными средствами
болит голеностопный сустав при ходьбе лечение
Приобрести препарат в аптеке невозможно, так как это эволюционное средство. Именно поэтому искать лекарство рекомендуется в сети интернет. Пациент должен знать, где купить медикамент, что позволит избежать возможности получения подделки. Заказывать лекарство рекомендуется на официальном сайте производителя. Для этого рекомендуется заполнить специальную форму. Сотрудники компании свяжутся с клиентом в максимально короткие сроки для уточнения условий покупки. Сразу же после этого проводится сбор заказа и его бесплатная доставка. Лечение артроза коленного сустава: причины и симптомы заболевания. Эффективное лечение коленного сустава отдела включает в себя целый комплекс мер: медикаментозное лечение, физиотерапию, ЛФК и правильную диету. Артроз коленного сустава — это дегенеративно-дистрофическое заболевание хрящевой ткани, которое приводит к обнажению костных головок и нарушению подвижности в суставе. Болезнь имеет невоспалительную природу и медленно прогрессирует — переход от начальной стадии к инвалидности занимает от нескольких лет до нескольких десятилетий. Остеоартроз коленного сустава входит в 5-ку самых распространенных причин инвалидности и утраты трудоспособности по всему миру. Придется притормозить и выяснить, что с тобой. Сейчас речь пойдет об артрозе и артрите, ведь эти опорно-двигательные заболевания способны выключать человека из активной деятельности первым же серьезным приступом. Поставленный диагноз становится дополнительным стрессом, ударом по привычному образу жизни: как же так, я крепкий, нестарый еще человек, а земля уходит из-под ног отнюдь не в фигуральном смысле. Артроз коленного сустава (гонартроз) — это прогрессирующее хроническое заболевание коленных суставов с повреждением, истончением и разрушением его хрящевой части (суставные поверхности бедренной и большеберцовой костей), а также поражением субхондральной кости.[2][5][16] Доказано исследованиями (артроскопия и МРТ), что помимо поражения суставного хряща в процесс вовлекаются мениски и синовиальная оболочка. Артроз коленного сустава является хроническим заболеванием, в результате развития которого происходит постепенное разрушение суставных хрящей. На фоне этого патологического процесса функция сустава нарушается, возникает выраженная боль и другие симптомы. Лечение нужно проводить как можно раньше, чтобы остановить развитие и дальнейшее прогрессирование болезни. Хирургическое лечение артроза коленных суставов. Если консервативная терапия не приносит желаемого результата либо заболевание находится в запущенной стадии, врачами рассматривается целесообразность хирургического вмешательства. Благодаря эндопротезированию можно достичь полного восстановления функции сустава. Видео: Лечение артроза коленного сустава, часть 2: 1. Нестероидные противовоспалительные препараты. Так, при артрозе коленного сустава, протекающего без явлений синовита, я рекомендую своим пациентам согревающие мази с целью улучшить кровообращение в суставе. Для этого применяют Меновазин, Гевкамен, Эспол, Никофлекс-крем и др. Перечисленные мази обычно вызывают у пациента чувство приятного тепла и комфорта. Подобные действия, скорее всего, приведут лишь к обострению и дальнейшему разрушению суставов. Прежде чем нагружать, а точнее перегружать колени, надо сначала снять обострение, укрепить мышцы ног и как следует подлечить больные суставы. Что делать при артрозе коленного сустава, причины, симптомы, стадии и эффективные способы лечения гонартроза. Деформирующий остеоартроз коленных суставов (он же гонартроз) – это хроническое прогрессирующее заболевание, поражающее все структурные элементы коленного сустава. Что такое гонартроз? Деформирующий остеоартроз коленных суставов (он же гонартроз или сокращенно ДОА) – дегенеративно-дистрофическое заболевание коленного сустава, которое характеризуется хроническим неуклонно. Артроз коленного сустава (гонартроз) – это распространенное заболевание, при котором происходит постепенное разрушение (дегенерация) хрящевой ткани с последующим вовлечением в дистрофический процесс окружающих структур. Без своевременной помощи врача заболевание становится причиной сильных болей и ограничения подвижности, а в запущенных случаях приводит к инвалидности. Общая информация. Коленный сустав регулярно испытывает колоссальные нагрузки. Ходьба, бег, прыжки, подъем по лестнице и просто пребывание в стоячем положении – все это оказывает влияние на состояние хряща. Лечение деформирующего артроза коленного сустава 1, 2, 3 степени. Лечение гонартроза в домашних условиях, в санатории и медикаментозно. Боль в колене — причины. С возрастом перед подавляющим большинством людей остро встаёт такой вопрос, как лечение артроза коленного сустава, с типичными симптомами, присущими этой болезни на её разных стадиях. Это и появление припухлостей в области колен, и покраснением вокруг этих припухлостей, скрип и шуршание, явственно слышимые в тишине при движении колена, особенно во время приседаний, и отчётливый болевой синдром разной степени интенсивности. Препаратами для лечения артроза суставов также являются средства, снижающие мышечные спазмы. При сильных болях мышцы вокруг сустава напрягаются, что увеличивать боль и дискомфорт, ухудшает кровообращение и затрудняет поступление кислорода. Часто применяются при поражении крупных суставов (коленного, тазобедренного). К этой группе препаратов относятся Сирдалуд, Баклофен, Мидокалм. Применение только миорелаксантов при артрозе не обосновано, так как мышечное напряжение часто возникает как защитная реакция на разрушение сустава, и снятие спазма, наоборот, будет способствовать дальнейшей деформации. остеоартроз голеностопного сустава лечение народными средствами. овес от суставов народные средства.
Лечение артроза (остеоартроза) методом УВТ
Х Международная классификация болезней (МКБ-10), принятая в 1989 году в Женеве Всемирной ассоциацией здравоохранения, систематизирует разнородную международную терминологию этого заболевания, указывая, что артроз, остеоартроз, деформирующий артроз, деформирующий остеоартроз (ДОА) являются синонимами и обозначают хроническое невоспалительное дегенеративно-дистрофическое заболевание суставов, в основе которого лежит разрушение суставной хрящевой ткани с последующей деформацией всего сустава: субхондральной кости, синовиальной сумки (капсулы), связок и периартикулярных мышц.
Виды остеоартроза
Остеоартроз может развиваться как самостоятельное заболевание, или как осложнение при других болезнях. В первом случае его чаще всего называют идеопатическим, или первичным остеоартрозом, так как истинная причина его развития остается неустановленной.
Во втором случае диагностируется основная причина заболевания, которой могут оказаться:
- Травмы, врожденные дисплазии суставов и аномалии развития скелета
- Заболевания обмена веществ (подагра, гемахроматоз, охроноз, болезни Вильсона и Гоше)
- Эндокринные заболевания (сахарный диабет, акромегалия, гиперпаратиреоз, гипотиреоз)
- Воспалительные процессы при системных аутоиммунных и инфекционных заболеваниях (ревматизм, красная волчанка, псориаз, опоясывающий лишай, туберкулез, сифилис, клещевой энцефалит, гнойное воспаление сустава)
- Дегенеративно-некротические процессы (рассекающий остеохондрит, остеохондропатия головки бедренной кости)
- Отложения солей тяжелых металлов и кальция (фосфаты кальция, гидроксиапатит)
Остеохондроз, вызванный вышеперечисленными причинами, называется вторичным.
Также это заболевание может поражать только один сустав — моноостеоартроз, или последовательно или одновременно несколько суставов — полиостеоартроз.
С точки зрения локализации в данном заболевании суставов можно выделить основные его виды:
- Узелковый остеоартроз, или болезнь мелких суставов кисти рук
- Остеоартроз первого плюснефалангового сустава стопы
- Остеоартроз голеностопного сустава
- Коксартроз, или остеоартроз тазобедренного сустава
- Гонартроз, или остеоартроз коленного сустава
- Проявления остеоартроза в других суставах
В качестве вторичного остеоартроза чаще всего встречается коксартроз и гонартроз — более половины всех случаев, к тому же это самые травмирующие виды заболевания. Первичной формой заболевания обычно является узелковый остеоартроз, который, предположительно, имеет генетическую природу и передается по женской линии.
Лечение остеоартроза
Лечение любых видов остеоартроза длительное и системное, оно включает набор классических принципов, среди них:
- Ортопедический режим и разгрузка поврежденных суставов
- Лечебная физкультура, благодаря которой поддерживается подвижность сустава, предотвращаются застойные явления, замедляются дегенеративные процессы
- Различные виды физиотерапии: электромиостимуляции при ходьбе
- Лечебный массаж и мануальная терапия
- Внутримышечное или внутрисуставное введение препаратов НПВС — нестероидных противовоспалительных средств
- Внутрисуставное введение гормональных глюкокортикостероидных средств
- Полугодовой курс хондропротекторов – хондроитина сульфата и глюкозамина
- Внутрисуставное введение препаратов гиалуроновой кислоты
- Декомпрессия зоны метаэпифиза бедра или коленного сустава для снятия повышенного внутрикостного давления
- Внутрисуставная озонотерапия для насыщения синовиальной жидкости кислородом и ускорения окислительных процессов
- Бальнеология и грязелечение
И здесь следует отметить эффективность относительно нового для России метода ударно-волновой терапии, который основан на принципе сообщения суставу дозированных импульсов высокой энергии в виде инфразвуковых ударных волн, благодаря чему происходит «оживление» всех тканей сустава на клеточном уровне:
- Ускоряется метаболизм
- Происходит выведение токсинов из синовиальной жидкости
- Разрушаются патологические костные новообразования в виде остеофитов
- Улучшается питание хрящевой ткани и ее регенерация
- Снимается болевой синдром
- Восстанавливается микроциркуляция крови, а вместе с ней снимаются отеки и затормаживаются воспалительные процессы
Как лечить артроз плечевого сустава?
« Назад18.03.2020 00:00
Артрозы – это такие поражения суставов, которые возникают по причине нарушения обмена веществ в околосуставных тканях и из-за изнашивания ткани сустава. Чаще всего артроз проявляет себя у людей старше 40 лет.
Артроз не надо путать с артритом, под которым подразумеваются воспалительные процессы, проходящие в суставе, причиной которых являются изменения в суставной жидкости. А при артрозе изменяется сама структура хряща, и появляются признаки его преждевременной изнашиваемости – в основном это микротрещинки.
Что касается артроза плечевого сустава, то для него характерно отложение солей в местах повреждения хряща. Поэтому, если не начать своевременное лечение, то заболевание может привести к появлению контрактуры, дефекту, который будет блокировать некоторые движения.
Симптомы артроза плечевого сустава:
— появление болевых ощущений при физических нагрузках;
— ограниченная подвижность сустава;
— хруст в суставе;
— периодическое появление отёчности сустава;
— напряженность мышц при выполнении обычных действий;
— невозможность сделать некоторые движения.
Для того чтобы заподозрить артроз, достаточно отметить хотя бы пару из этих симптомов. В таком случае Здоровая жизнь рекомендует поскорее обратиться к специалисту для уточнения диагноза и назначения необходимого лечения.
Причины появления артроза плечевого сустава могут быть разными:
— травма или неожиданная чрезмерная физическая нагрузка;
— образ жизни, который ограничивает подвижность плечевого сустава;
— наследственность.
Как лечить артроз плечевого сустава?
Выбор препаратов для лечения и необходимых процедур делается с учетом ряда обстоятельств. Сначала проводят рентген сустава, чтобы точно выявить, какие изменения в суставе имеются, и какое лечение потребуется.
Если выявлен первичный артроз, то для восстановления кровообращение в суставе назначают медикаменты, процедуры, советуют внести коррективы в образ жизни. Лучше всего, чтобы лечение носило комплексный характер: медикаменты сочетались с физиопроцедурами, а потом проводилось санаторно-курортное лечение.
Чтобы снять воспаление плечевого сустава, назначают такие нестероидные препараты, как ортофен, индометацин, диклофенак. А чтобы восстановить микроциркуляцию крови в плечевом суставе, обычно приписывают применять гепарин, АТФ, никошпан, троксевазин, трентал, продектин и т.д.
Для улучшения усвоения тканями кислорода необходимо принимать витамины группы В. Кроме названных препаратов хорошо себя зарекомендовал в лечении артроза и аспирин для получения обезболивающего и противовоспалительного эффекта.
Если у больного артрозом имеются болезни желудочно-кишечного тракта или язва желудка, то назначают препарат с щадящим действием на желудок – это Фепразон.
Чтобы снизить проявления дистрофических изменений на суставах назначают такие препараты, как артепарон, хлорохин, румалон.
Иногда врач может приписать внутрисуставное введение дексаметазона, гидрокортизона и иных подобных препаратов.
Чтобы лечение было комплексным, при артрозе плечевого сустава применяют физиотеревтические процедуры: ультразвуковое воздействие, электрофорез, скипидарные или хлоридно-натриевые ванны. Если клиника обладает современным оборудованием, то больному могут прописать посещение сеансов лазерного лечения, криотерапии, вакуумного массажа и т.д.
При артрозе с отёками следует соблюдать низкосолевую диету с достаточным количеством жидкости. То есть следует снизить потребление соленых блюд, острых приправ, помидоров и шпината. Такая диета помогает избавляться от лишней жидкости, что способствует снятию отеков.
Источник
Остеоартроз акромиально-ключичного сустава | EMC
Остеоартроз акромиально-ключичного сустава – полиэтиологическое заболевание, заключающееся в стирании суставного хряща и внутрисуставного диска с последующими изменениями в костной ткани – остеофитами акромиона и акромиального конца ключицы с развитием хронического прогрессирующего болевого синдрома, болезненного ограничения движений в плечевом суставе, связанного с сужением и импинджмент-синдромом в субакромиальном пространстве.
Основная причина развития этих изменений – спортивная и профессиональная активность, связанная с бросками, тренировками с утяжелениями, продолжительной работой поднятыми выше горизонтали руками. С другой стороны, застарелая травма сустава, такая как разрыв акромиально-ключичного сочленения с развитием нестабильности, быстро приводит к развитию остеоартроза.
Пациенты испытывают локализованную боль в проекции акромиально-ключичного сустава, усиливающуюся при движениях в плечевом суставе, могут присоединиться ночные боли, особенно в положении на беспокоящем боку. При клиническом обследовании выявляется локальная болезненность при надавливании на акромиальный конец ключицы, усиление болей при приведении согнутой в плечевом суставе конечности (положительный cross-chest test). Также могут выявляться симптомы импинджмента в субакромиальном пространстве. Диагностическая инъекция местных анестетиков в полость сустава, рентгенорафия и МРТ позволяют установить точный диагноз.
Тактика лечения зависит от выраженности жалоб, рентгенологической и МРТ картины. На первом этапе целесообразны консервативные мероприятия – нестероидные противовоспалительные препараты, физиотерапия и лечебная гимнастика. В более тяжелых случаях показано внутрисуставное введение глюкокортикостероидных препаратов. При неэффективности консервативной терапии применяется оперативное лечение – артроскопическая субакромиальная декомпрессия, акромиопластика, иссечение акромиального конца ключицы.
Аутосомно-доминантная атрофия зрительного нерва — обзор
ОПТИЧЕСКИЙ НЕРВ — НАЧАЛО В ДЕТСКОМ И ВЗРОСЛОМ возрасте
Аутосомно-доминантная атрофия зрительного нерва характеризуется двусторонней коварной потерей зрения, часто проявляющейся в первом или втором десятилетии жизни. Он наследуется по аутосомно-доминантному типу с высокой пенетрантностью. OPA1 , расположенный на длинном плече хромосомы 3, составляет большинство случаев, хотя есть доказательства генетической гетерогенности.Белок является связанной с динамином GTPase, нацеленной на митохондрии, что дополнительно демонстрирует роль митохондрий в патофизиологии ганглиозных клеток сетчатки. 20, 21
При осмотре острота зрения обычно от 20/40 до 20/60, двусторонняя и симметричная. Происходит коварное прогрессирование потери зрения, хотя конечная острота зрения может варьироваться от 20/20 до отсутствия световосприятия. Большинство людей сохраняет остроту зрения от 20/40 до 20/200. Тестирование цветового зрения продемонстрировало характерный дефицит тританопического типа, хотя чаще всего встречается генерализованная дисхроматопсия.Дефекты поля зрения включают центральные и цекоцентральные скотомы. Присутствует атрофия зрительного нерва, часто локализованная в височной части зрительного нерва (рис. 22-6). Неврологические или системные симптомы, за исключением сенсоневральной потери слуха, встречаются редко.
Дифференциальный диагноз включает недостаточность питания, токсическую оптическую невропатию и макулярную дистрофию. Диагноз ставится на основании семейного анамнеза и клинического обследования. Генетические тесты на это заболевание не получили широкого распространения. К сожалению, в настоящее время не существует лечения для предотвращения потери зрения, остановки прогрессирования потери зрения или восстановления зрения.
Болезнь Вольфрама — аутосомно-рецессивное заболевание, вызванное мутациями в WFS1 , который кодирует интегральный мембранный гликопротеин, локализующийся в основном в эндоплазматическом ретикулуме. 22 Наиболее последовательными критериями диагностики этого синдрома являются сахарный диабет с юношеским началом и атрофия зрительного нерва. Однако другие данные включают несахарный диабет и сенсорную невральную тугоухость. Совокупность открытий привела к появлению аббревиатуры DIDMOAD: Несахарный диабет, сахарный диабет, атрофия зрительного нерва, глухота.Менее распространенные признаки включают центральное апноэ и нейрогенный коллапс верхних дыхательных путей, вместе провоцирующие первичную дыхательную недостаточность, нервный миоклонус, осевую ригидность и синдром Парино. 23
Болезнь Бера — аутосомно-рецессивный синдром атрофии зрительного нерва, начинающийся в первом десятилетии жизни, связанный с признаками пирамидного тракта, атаксией, умственной отсталостью, нистагмом, недержанием мочи и кавусной стопой. Болезнь Бера может представлять собой фенотип, общий для нескольких генетических заболеваний, которые, вероятно, имеют метаболическое происхождение.Метилглутаконовая ацидурия, диагностируемая по повышенному количеству 3-метилглутаконовой и 3-метилглутаровой кислоты в моче, может проявляться при такой совокупности результатов. 24
Х-сцепленная атрофия зрительного нерва пациентов с потерей зрения в раннем детстве, которая может прогрессировать. Это редкое заболевание часто связано с другими неврологическими симптомами, включая атаксию, тремор, сенсоневральную глухоту и полинейропатию. 25
Наследственная оптическая нейропатия Лебера (LHON) — это наследственная оптическая нейропатия по материнской линии с двусторонней потерей зрения, обычно возникающая у молодых мужчин.
LHON вызывается точечными мутациями в митохондриальном геноме в положениях нуклеотидов 3460, 26 11778, 27, 28 и 14484 29 в генах, кодирующих субъединицы комплекса I дыхательной цепи, с мутацией 11778 что составляет большинство случаев. Поскольку митохондрии передаются всему потомству только от матери, типичные правила менделевского наследования не применяются. Все дети носительниц по материнской линии подвержены риску потери зрения, хотя дети мужского пола подвергаются большему риску потери зрения, чем их братья и сестры.Потомство носителей мужского пола не подвержено риску потери зрения.
Потеря зрения обычно начинается безболезненно на одном глазу и постепенно ухудшается в течение нескольких недель. Хотя некоторые люди субъективно описывают потерю зрения как внезапную и полную, другие описывают прогрессирование в течение нескольких недель. Почти у всех пациентов наблюдается потеря зрения на второй глаз, обычно в течение 6 месяцев после потери зрения на первый глаз. Обычно во время потери зрения никаких других симптомов не возникает.
Острота зрения обычно хуже 20/200 на каждый глаз с двусторонними центральными скотомами.При офтальмоскопии зрительный нерв может казаться нормальным или иметь характерную аномалию, которая была описана как триада циркумпапиллярной телеангиэктазии (рис. 22-7), набухание слоя нервных волокон вокруг диска и отсутствие утечки на флюоресцентной ангиографии. Зрительный нерв прогрессирует до атрофии зрительного нерва с неглаукоматозным купированием, бледностью и ослаблением артериол.
У редких людей могут присутствовать ассоциированные неврологические нарушения, такие как патологические рефлексы, легкая мозжечковая атаксия, тремор, двигательные расстройства, истощение мышц и дистальная сенсорная нейропатия.В некоторых родословных могут присутствовать более серьезные неврологические нарушения, такие как дистония, спастичность и энцефалопатические эпизоды. Помимо неврологических нарушений, у некоторых пациентов могут быть дефекты сердечной проводимости, и пациентам следует пройти электрокардиографию.
Пациенты обычно обращаются с односторонней острой или подострой потерей зрения. Дифференциальный диагноз включает неврит зрительного нерва, ишемическую оптическую невропатию, компрессионную оптическую невропатию, инфильтративную оптическую невропатию и новообразования.Окончательный диагноз ставится с помощью генетического тестирования. Прогноз восстановления зрения для этих людей обычно плохой. Тем не менее, у некоторых людей зрение может восстановиться спонтанно, даже спустя годы. К сожалению, в настоящее время не существует лечения для предотвращения потери зрения, остановки прогрессирования потери зрения или восстановления зрения.
Что такое ADOA | Аутосомно-доминантная атрофия зрительного нерва
Часто задаваемые вопросы.
ССЫЛКИ
1. Kjer, P (1959).«Инфантильная атрофия зрительного нерва с доминантным типом наследования: клиническое и генетическое исследование 19 датских семей». Acta ophthalmologica. Дополнение 164 (Дополнение 54): 1–147. PMID 13660776.
2. Ю-Вай-Ман, П; Гриффитс, PG; Горман, GS; Lourenco, CM; Райт, AF; Ауэр-Грумбах, М; Тоскано, А; Musumeci, O; Валентино, ML; Caporali, L; Ламперти, С; Таллаксен, CM; Даффи, П; Миллер, Дж; Whittaker, RG; Бейкер, MR; Джексон, MJ; Кларк, член парламента; Диллон, B; Чермин, Б; Стюарт, JD; Hudson, G; Reynier, P; Bonneau, D; Marques W, Jr; Ленаерс, Г; McFarland, R; Тейлор, RW; Тернбулл, DM; Вотруба, М; Зевиани, М; Карелли, V; Биндофф, Луизиана; Хорват, Р; Amati-Bonneau, P; Чиннери, ПФ (март 2010 г.).«Мультисистемное неврологическое заболевание часто встречается у пациентов с мутациями OPA1». Мозг: журнал неврологии 133 (Pt 3): 771–86. DOI: 10,1093 / мозг / awq007. PMC 2842512. PMID 20157015.
3. Delettre, C; Ленаерс, Г; Гриффоин, JM; Гигарель, Н; Лоренцо, К; Belenguer, P; Пеллокин, L; Гросджордж, Дж; Turc-Carel, C; Perret, E; Астари-Декекер, C; Lasquellec, L; Арно, B; Дюкомман, B; Каплан, Дж; Хамель, CP (октябрь 2000 г.). «Ядерный ген OPA1, кодирующий митохондриальный белок, связанный с динамином, мутировал при доминантной атрофии зрительного нерва».Генетика природы 26 (2): 207–10. DOI: 10,1038 / 79936. PMID 11017079. Cite использует устаревший параметр | coauthors = (help)
4. OMIM: Атрофия зрительного нерва 1 OMIM 165500
5. Вотруба, 1998. (Вотруба; Мур, А.Т.; Бхаттачарья, С.С. (1998). «Клинические особенности, молекулярная генетика и патофизиология доминантной атрофии зрительного нерва». Журнал медицинской генетики 35 (10): 793–800. Doi : 10.1136 / jmg.35.10.793. PMC 1051452. PMID 9783700.
6.Генетика Главная Reference.com
7. Гай Ленаерс и др. Доминирующая атрофия зрительного нерва. Журнал «Орфанет редких болезней». 9 июля 2012 г .; 7 (46): http://www.ojrd.com/content/7/1/46. Дата обращения 13.11.2013.)
8. Barboni P. et al. Лечение идебеноном пациентов с доминантной атрофией зрительного нерва с мутантным OPA1. Головной мозг. 2013; 136 (Pt 2): e231: дата обращения 13.11.2013.
9. http://disorders.eyes.arizona.edu/category/genes
10.www.orpha.net
Аутосомно-доминантная атрофия зрительного нерва и катаракта: MedlinePlus Genetics
Аутосомно-доминантная атрофия зрительного нерва и катаракта — это заболевание глаз, которое характеризуется нарушением зрения. У большинства пораженных людей острота зрения снижается с рождения, у других же проблемы со зрением возникают в раннем детстве или позже. У пораженных людей оба глаза обычно поражаются одинаково. Однако степень потери зрения широко варьируется, даже среди пораженных членов одной семьи, от почти нормального зрения до полной слепоты.
Некоторые аномалии способствуют ухудшению зрения у людей с аутосомно-доминантной атрофией зрительного нерва и катарактой. На ранних стадиях заболевания пораженные люди испытывают прогрессирующую потерю определенных клеток в сетчатке, которая представляет собой специализированную светочувствительную ткань, выстилающую заднюю часть глаза. За потерей этих клеток (известных как ганглиозные клетки сетчатки) следует дегенерация (атрофия) нервов, которые передают визуальную информацию из глаз в мозг (зрительные нервы), что способствует потере зрения.Атрофия этих нервов вызывает аномально бледный вид (бледность) зрительных нервов, который можно увидеть только при осмотре глаза. У большинства людей с этим заболеванием также наблюдается помутнение хрусталика глаз (катаракта). Эта глазная аномалия может развиться в любое время, но обычно проявляется в детстве. Другие распространенные проблемы со зрением при аутосомно-доминантной атрофии зрительного нерва и катаракте включают непроизвольные движения глаз (нистагм) или проблемы с цветовым зрением (дефицит цветового зрения), которые затрудняют или делают невозможным различение оттенков синего и зеленого.
У некоторых людей с аутосомно-доминантной атрофией зрительного нерва и катарактой развиваются нарушения функции других нервов (невропатия), помимо зрительных нервов. Эти нарушения могут привести к нарушению равновесия и координации (мозжечковая атаксия), неустойчивому стилю ходьбы (походка), покалыванию или покалыванию (парестезии) в руках и ногах, прогрессирующей жесткости мышц (спастичность) или ритмической дрожи (тремор). . В некоторых случаях у пораженных людей наблюдается потеря слуха, вызванная аномалиями внутреннего уха (нейросенсорная глухота).
Границы | Доминирующая атрофия зрительного нерва (DOA): моделирование калейдоскопической роли OPA1 в митохондриальном гомеостазе
Введение
В 2000 году привлек внимание к гену OPA1 человека, поскольку гетерозиготные мутации были связаны с доминантной атрофией зрительного нерва (DOA) (1, 2), нарушением слепоты, первоначально описанным датским офтальмологом Полом Кьером в 1959 году, которое обычно приводит к атрофии зрительного нерва в первое десятилетие жизни (3). Этот ген кодирует белок, роль которого в качестве одного из митохондриальных факторов, участвующих в механизме, регулирующем митохондриальную динамику, способствуя слиянию внутренней мембраны митохондрий и являющемуся ключом к поддержанию митохондриальной ДНК (мтДНК), была ясна по аналогии с ортологическими генами. MGM1 / MSP1 в дрожжах (4–6).Было быстро обнаружено, что OPA1 имеет очень сложную регуляцию экспрессии, входящую в несколько изоформ из-за альтернативного сплайсинга (7, 8). Только недавно мы начали понимать необходимость этой сложности, показывая, насколько сложна и, возможно, гибкая функция этого белка (9). Фактически, помимо роли OPA1 в слиянии митохондрий, при изучении дисфункции OPA1 у пациентов с DOA и на клеточных моделях быстро выяснилось его участие в регуляции биоэнергетики (10, 11), что способствует формированию митохондриальных крист и регулированию апоптоза (12, 13). , поддерживая целостность мтДНК и количество копий (14-17), способствуя контролю качества митохондрий (18, 19) и, в конечном счете, представляя собой ключевой перекресток для митохондриального гомеостаза, который является центральным для выживания и функционирования клеток (20-22).
Таким образом, идентификация мутации OPA1 как причины селективной нейродегенерации ганглиозных клеток сетчатки (RGC), приводящей к атрофии зрительного нерва, сыграла важную роль в открытии очень активной области исследований в неврологии и нейроофтальмологии, а также в понимании новых механизмов регуляции гомеостаз митохондрий и прежде всего митохондриальная динамика (23). Соответственно, расширяющийся спектр доминантных и рецессивных мутаций, влияющих на белок OPA1, находит свое отражение в прогрессивно расширяющемся ландшафте клинических фенотипов, связанных с дисфункцией OPA1, включая обширный каталог так называемых синдромов DOA плюс (14, 15) с преобладанием. нейродегенерацией и мультисистемным поражением (24), включая рассеянный склероз (25, 26), паркинсонизм и деменцию (18, 27), детский синдром Ли (28) и кардиомиопатию (17).
Учитывая постоянно растущий интерес к функции и дисфункции OPA1 в связи с заболеваниями человека, их моделирование имеет важное значение для быстрого прогресса в нашем понимании и, возможно, предоставления терапевтических возможностей. Таким образом, мы рассматриваем доступные в настоящее время инструменты для изучения этого белка, глядя на будущее этой быстро развивающейся области.
Модели ячеек OPA1
Модели дрожжей
Дрожжи, как простой эукариотический организм, которым легко манипулировать, представляют собой чрезвычайно полезную модель, с помощью которой можно понять функцию митохондрий, обеспечивая понимание митохондриальных путей и их регуляции.Действительно, дрожжи сыграли важную роль в идентификации ключевых функций MGM1 и MSP1 , ортолога OPA1 в Saccharomyces cerevisiae и Schizosaccharomyces pombe , соответственно (Рисунок 1). Mgm1 был впервые идентифицирован из-за его роли в поддержании мтДНК (4, 29) и его относительного влияния на респираторную компетентность (4, 6). Последующие сообщения подчеркнули способность к слиянию (30–32) и ее роль для стабильности структуры cristae (32, 33).Точно так же Msp1 был охарактеризован как белок, участвующий в поддержании мтДНК (5), в стабильности митохондриальной сети и дыхательной функции (34), а также в слиянии митохондрий (35). Mgm1 протеолитически процессируется в двух формах, длинной и короткой, протеазой Pcp1 ромбовидного типа, гомологом PARL млекопитающих (36, 37), тогда как Msp1 расщепляется как ромбовидной, так и m-AAA протеазой (38). Присутствие как коротких, так и длинных форм Mgm1 необходимо для поддержания трубчатой морфологии митохондрий и надлежащего количества мтДНК (36, 39).Повышенное соотношение длинной и короткой форм оказывает доминирующее негативное влияние на митохондриальное слияние, и функциональная ГТФаза в короткой форме, но не в длинной, необходима для настройки слияния (39). Более того, один из трансмембранных сегментов динамина Msp1 необходим для поддержания мтДНК, но не для активности слияния (40).
Рисунок 1 . Схематическое изображение пяти категорий моделей клеток, используемых для изучения функций OPA1. Пути, о которых в литературе сообщается, что они регулируются OPA1 или изменяются его мутациями kd / ko / в различных моделях, помечены галочкой.
Дрожжи можно использовать в качестве модели митохондриальных заболеваний для исследования влияния патогенных мутаций на функцию митохондрий. Из-за слабой консервативности аминокислотных последовательностей между Mgm1 и OPA1 и неэффективности человеческой ГТФазы в плане комплементации истощения MGM1 химерный белок, состоящий из N-концевой области Mgm1 и каталитической области OPA1 (41), оказался сгенерировано. Наша группа и другие исследователи использовали эту химерную модель, чтобы проанализировать эффект нескольких мутаций, обнаруженных у пациентов с DOA, показывая, что патогенные мутации вызывают потерю мтДНК и фрагментацию митохондрий, снижают процессинг от длинных до коротких форм и нарушают дыхательную способность и окислительный рост у них. дрожжи (41–43).Помимо подтверждения патогенности, возможность сравнения гаплоидных и диплоидных штаммов, экспрессирующих только мутант или в комбинации с химерным белком дикого типа, позволила различать гипоморфные, нулевые или доминантные аллели (42).
Дрожжи также представляют собой ценную систему для скрининга соединений с терапевтическим потенциалом для лечения митохондриальных заболеваний в качестве стратегии «перепрофилирования». Две исследовательские группы применили этот подход в контексте мутации OPA1 (44, 45).В первом скрининге была использована коллекция из 1600 перепрофилированных лекарств, и пять соединений смогли подавить летальность в ограничительных условиях, вызванных мутацией GTPase MSP1 в S. pombe . Два препарата смогли спасти истощение мтДНК, и один из них также восстановил морфологию митохондриальной сети (44). Во втором скрининге наша группа использовала штаммы дрожжей с мутациями на MGM1 или на химерный Mgm1-OPA1, чтобы оценить эффект более 2500 лекарств из двух химических библиотек (45).В этом случае из 26 препаратов, способных спасти фенотип окислительного роста, шесть из них снижали нестабильность митохондриальной ДНК у дрожжей и также были проанализированы на моделях клеток млекопитающих (45). Таким образом, несмотря на наличие некоторых различий между Mgm1 / Msp1 и OPA1, дрожжи оказались простым и очень полезным инструментом первой линии для крупномасштабного скрининга лекарств OPA1 и, в сочетании с другими физиологическими моделями для перекрестной проверки результатов, это может ускорить открытие эффективных методов лечения DOA.
Модели клеток мыши и крысы
Изучение OPA1 на моделях млекопитающих, таких как клетки мыши и крысы, в частности эмбриональные фибробласты мыши (MEFs), сыграло важную роль в углублении нашего понимания сложной роли OPA1 во множественных митохондриальных путях (Рис. 1).
Исследования MEF привели к идентификации сайтов расщепления OPA1 S1 и S2, кодируемых экзоном 5 и 5b и расщепляемых OMA1 и YME1L, соответственно, с образованием сбалансированной смеси длинных и коротких форм (46, 47).Недавно был идентифицирован ранее предложенный третий сайт (48), названный S3, расположенный в экзоне 4b и расщепляемый YME1L (49).
Сверхэкспрессия или подавление OPA1 в MEF подчеркивает его фундаментальную роль в поддержании нитчатой митохондриальной сети и поддержании слияния (50, 51), поддержании эффективности дыхания (51) и контроле целостности крист и апоптоза (13). Однако мышиные фибробласты с нокаутом Opa1 (ko) также оказались чрезвычайно полезными для понимания патогенного механизма DOA, учитывая четкий фенотип из-за полного отсутствия белка.Действительно, Opa1 нулевые клетки не обладают активностью слияния (9, 46, 52, 53), уменьшают количество мтДНК и нуклеоидов (9, 53, 54) и вызывают глубокие изменения целостности структуры крист (9, 53 , 55). Кроме того, абляция Opa1 и сверхэкспрессия OPA1 в фибробластах мыши прояснили взаимодействие между кристами и OPA1 в сборке суперкомплекса дыхательной цепи (RCS) (56) и идентифицировали АТФ-синтазу как эффектор OPA1-опосредованной защиты митохондриальных функций (57). .Эта модель также предоставила подробности о взаимосвязи между OPA1 и другими взаимодействующими элементами, поддерживающими архитектуру крист , такими как белок MICOS MIC60 (58, 59) и члены семейства растворенных носителей SLC25A, которые активируют опосредованное OPA1 ремоделирование крист в реакция на различные энергетические условия (60).
Более того, полное отсутствие белка также сыграло важную роль в анализе двух фундаментальных и обсуждаемых вопросов, ключевых для сложности OPA1: роли изоформ, а также длинной и короткой форм.Экспрессия каждой из восьми изоформ в Opa1 нулевых MEF показала, что все они способны спасти содержание мтДНК, организацию крист, и энергетику (9), тогда как короткие формы более эффективны в восстановлении энергетической эффективности (9, 53 ) и повышения выживаемости клеток при окислительном стрессе (61). Важно отметить, что было показано, что длинные формы поддерживают слияние митохондрий (9), тогда как как длинные, так и короткие формы необходимы для сохранения взаимосвязанной митохондриальной сети (9, 46, 53).Совсем недавно было сообщено, что присутствие нескольких изоформ, генерирующих разные короткие формы, необходимо для достижения более нитчатой митохондриальной сети (49), подтверждая наше основополагающее исследование (9).
Модель нулевых MEF Opa1 также использовалась для изучения патогенного эффекта миссенс-мутаций OPA1 , связанных с DOA на изогенном генетическом фоне, для оценки способности восстанавливать митохондриальные дефекты (42, 62). Мы обосновали более серьезный эффект мутаций, влияющих на домен GTPase, по сравнению с мутациями в домене динамина или по сравнению с гипоморфными мутациями.Это было верно для всех проанализированных митохондриальных считываний, точно отражающих тяжесть клинических фенотипов (42). Кроме того, эти клеточные модели подверглись метаболомным и липидомным исследованиям (63–65). MEF Opa1 ko продемонстрировали биоэнергетические изменения с измененным метаболизмом аспартата, глутамата, нуклеотидов и NAD (63), а также изменениями триглицеридов и липидов, участвующих в ремоделировании мембран и в сигнальных путях клеток (64), аналогично тому, что наблюдалось в первичные Opa1 -истощенные корковые нейроны (66).Анализ MEF, мутировавших OPA1, оценил степень тяжести аллеля с метаболическими и липидными изменениями, подчеркнув повышенное соотношение спермин / спермидин и снижение гидроксипролина, пула аминокислот и нескольких фосфолипидов (65). Интересно, что повышение уровня глутатиона в Opa1 нулевых MEF (63) было недавно подтверждено во втором исследовании (67) и сообщалось, вместе с повышенной зависимостью от транспорта цистеина, как метаболический адаптивный механизм, обеспечивающий защиту от окислительного стресса в эти клетки (67).Наконец, эта клеточная модель также использовалась для скрининга лекарств на улучшение показателей митохондрий с различными миссенс-мутациями, что оказалось ценным инструментом при тестировании новых терапевтических вмешательств DOA (45).
Иммортализованные и опухолевые модели человеческих клеток
После открытия, что мутации в гене OPA1 являются преобладающей причиной DOA, было проведено несколько исследований с использованием иммортализованных или опухолевых клеток человека (рис. 1). Эти модели сыграли важную роль в выяснении разнообразных ролей этой GTPase в митохондриальном гомеостазе, избегая индивидуальных вариаций, присущих первичным клеткам, происходящим от пациентов.
Эксперименты по субклеточной локализации сыграли важную роль в идентификации OPA1 как белка внутренней мембраны, обнажая C-концевую часть в IMS (68–71), которая присутствует в виде смеси длинной и короткой форм (71, 72), последняя генерируется активностью протеаз YME1L (72, 73) и OMA1 (48). Поскольку основным патогенным механизмом DOA, связанного с OPA1, является гаплонедостаточность, подавление OPA1 выявило фрагментацию митохондриальной сети (12, 70, 73–75) и полное ингибирование слияния митохондрий (74, 76), подтверждая его роль в развитии митохондрий. .Кроме того, несколько исследований обнаружили диссипацию мембранного потенциала митохондрий (12, 76), резкую дезорганизацию структуры крист (12, 70, 74, 75, 77), изменение сборки MICOS (77) и повышенную чувствительность к апоптозу. с высвобождением цитохрома с (12, 74, 76, 78). Связь между OPA1, целостностью крист и апоптозом была подтверждена в клетках Hek293 путем экспрессии мутантного OPA1, устойчивого к разборке его олигомеров, который блокировал высвобождение цитохрома с и апоптоз (79).Подавление белка OPA1 также вызывает истощение мтДНК (16, 75), биоэнергетический дефект (75, 80), изменяет гомеостаз Ca 2+ (75, 81) и митофагию (82). Специфическое подавление трех альтернативных экзонов сплайсинга было использовано в попытке выяснить точную митохондриальную функцию отдельных изоформ OPA1 (16, 83).
Профузионная роль длинных форм была описана в нескольких исследованиях, где сверхэкспрессия длинного OPA1 была более эффективной по сравнению с комбинацией длинных / коротких в улучшении морфологии митохондриальной сети при нокдауне (Kd) — OPA1 клеток (71) и в клетках SH-SY5Y после гипоксии и повторного оксигенации (84).Кроме того, сообщалось, что сверхэкспрессия SIRT4 увеличивает длинную форму OPA1, способствуя слиянию, противодействуя делению и митофагии (85).
Клетки человека также использовались для подтверждения новой функции, идентифицированной в жировых фибробластах мыши (86), где OPA1, локализованный в липидных каплях, служит якорным белком A-киназы (AKAP) и позволяет PKA фосфорилировать перилипин 1, способствуя липолитическому эффекту. стимуляция (87).
Фибробласты и лимфобласты, полученные от пациентов
Фибробласты и лимфобласты, полученные от пациентов, представляют собой модель, широко используемую для изучения патофизиологии мутаций OPA1.Большинство изменений, выявленных в предыдущих моделях, были подтверждены в клетках пациентов (рис. 1). Многочисленные исследования фибробластов и лимфобластов сообщили о нарушении динамики митохондриальной сети (11, 18, 27, 42, 78, 88–95), энергетического метаболизма (11, 42, 88, 91, 93, 94, 96), сохранения структуры крист (11, 27, 93) и повышенная чувствительность к стимулам апоптоза (11, 96). Об истощении количества копий мтДНК в фибробластах сообщалось в нескольких случаях при наличии миссенс (42, 96) или сложных гетерозиготных мутаций (19, 43).
Недавно также сообщалось об увеличении продукции ROS (94, 96), низком уровне антиоксидантных ферментов (97) и изменении усвоения кальция (98). Кроме того, прямое участие OPA1 в контроле качества было обнаружено в фибробластах (18, 19, 95), где миссенс-мутации вызывали усиление процессов как аутофагии, так и митофагии. Интересно, что базальная митофагия была увеличена в фибробластах, несущих доминантно-отрицательные мутации OPA1 , тогда как гаплонедостаточность OPA1, по-видимому, коррелирует со снижением митохондриального обмена и аутофагией (95).
Хотя эти клетки были очень полезны при изучении митохондриальных изменений, присутствие аллеля дикого типа часто скрывает эффект мутировавшего, вызывая необходимость использования галактозной среды для ускорения окислительного метаболизма и выявления митохондриальных дисфункций. Кроме того, ядерные и митохондриальные геномы могут по-разному способствовать большой гетерогенности, наблюдаемой в клинических и клеточных фенотипах из-за одной и той же мутации OPA1 . Например, анализ числа копий мтДНК выявил истощение только в одном из двух фибробластов с одинаковыми мутациями R445H, полученными у пациентов, принадлежащих к одному семейству (42), предполагая, что другие генетические факторы или факторы окружающей среды могут вносить вклад.Соответственно, митохондриальный OMI / HTRA2 недавно был описан как новый генный модификатор изменчивости фенотипа (99).
Несмотря на эти ограничения, фибробласты в сочетании с другими моделями могут быть функциональными для идентификации новых путей, подтверждения патогенных механизмов или подтверждения эффективности терапевтических молекул, как мы недавно сообщили (45).
iPSC, NPC, Neuron и RGC
В последнее десятилетие создание технологии индуцированных плюрипотентных стволовых клеток (ИПСК) дало возможность создать in vitro человеческих моделей неврологических расстройств.ИПСК представляют собой стволовые клетки, перепрограммированные in vitro in vitro, из первичных клеток, полученных от пациента, которые затем могут быть дифференцированы в определенные типы соматических клеток (100). Таким образом, ИПСК и терминально дифференцированные клетки позволяют нам изучить точный тип клеток, пораженных болезнью человека, чтобы определить патологический механизм и провести скрининг лекарств на генетическом фоне человека (рис. 1).
Линии ИПСК человека были получены из фибробластов пациентов, несущих различные мутации OPA1 , такие как p.Гетерозиготные мутации Gln621Ter (101) и p.Ser545Arg (102), а также сложные гетерозиготные мутации, вызывающие синдром Бера (103). Все эти iPSCs д. Дифференцироваться на три зародышевых листка (энтодерма, мезодерма и эктодерма) (101-103).
Повышенный апоптоз и неэффективная способность дифференцироваться в нервную розетку и RGC были зарегистрированы для ИПСК, полученных из двух других фибробластов пациентов, несущих интронную мутацию c.2496 + 1G> T, что предполагает влияние апоптоза на RGC, которое может приводить к раннему или врожденная атрофия зрительного нерва (104), как было ранее предложено клиническими исследованиями оптической когерентной томографии (105).Добавление среды нейральной индукции, секретируемой сигнальной молекулы noggin или гормона эстрогена способствовало дифференцировке в RGC ИПСК OPA1 +/- , возможно, путем ингибирования апоптоза (104).
дофаминергических нейронов, несущих мутацию OPA1 , вызывающую гаплонедостаточность, были созданы с помощью ИПСК от двух пациентов, принадлежащих к одной семье, которые, что интересно, развили разные клинические фенотипы: изолированные ДОА или ДОА с синдромальным паркинсонизмом (106).Обе клеточные линии показали снижение скорости потребления кислорода (OCR), уровней комплекса I и активности, тогда как только нейроны, полученные от пациента с паркинсонизмом, показали фрагментацию митохондрий и увеличение коротких форм OPA1. В этом исследовании не были идентифицированы возможные генетические модификаторы различных клинических фенотипов у двух пациентов с одинаковой мутацией OPA1 (106).
Нейральные клетки-предшественники (NPC) из двух миссенс-мутаций OPA1 , вызывающих паркинсонизм и деменцию (18), показали биоэнергетический дефект, фрагментацию митохондриальной сети, повышение уровней ROS и изменение пути лизосом (107).Даже в этом случае NPC, мутировавшие в OPA1 , показали дефицит выживаемости, который был устранен путем селективного ингибирования некроптоза (107). Нейроны, полученные из ИПСК, несущие эти две мутации OPA1 , были дополнительно изучены в микрофлюидной системе, где различные нейрональные подтипы культивировались вместе с паттерном организации их выступов и синаптических окончаний (108). Анализ нейрональных проекций выявил измененное содержание, распределение и движение митохондрий по аксонам нейронов.Более того, нарушение образования синапсов сопровождалось прогрессирующей потерей синаптических контактов с течением времени в мутантных нейронах, что указывает на истощение митохондрий в проекциях нейронов как причину потери нейрональной связи и нейродегенерации (108).
Недавно человеческие эмбриональные стволовые клетки (hESCs) с гаплонедостаточностью OPA1, индуцированной технологией CRISPR-Cas9, были охарактеризованы и дифференцированы в NPC. Интересно, что несколько генов, участвующих в дифференцировке NPC, формировании ГАМКергических интернейронов и развитии сетчатки, были подавлены в OPA1 +/- NPC из-за повышенного метилирования CpG (109).Повышенные уровни АФК и подавление экспрессии FOXG1, фактора, решающего для формирования ГАМКергических нейронов и развития сетчатки, были подтверждены также в NPC, полученных от двух других пациентов, несущих общую мутацию c.2873_2876delTTAG, что позволяет предположить, что гаплонедостаточность OPA1 может приводить к аберрантному метилированию ядерной ДНК и измененная программа транскрипции (109).
Хотя изучение клеток, пораженных болезнью, ускоряет наше понимание дисфункций, происходящих из OPA1, эти двумерные методы изучения нейрональной дисфункции не полностью повторяют сложность человеческого мозга (110).Недавно оптимизированные протоколы моделирования in vitro органогенеза головного мозга и сетчатки (111) представляют собой еще один фундаментальный шаг, способствующий моделированию заболеваний.
Модели животных Opa1
Drosophila melanogaster МоделиМоделирование DOA также было выполнено на Drosophila melanogaster (Рисунок 2), и эти исследования подчеркнули роль увеличения продукции ROS в возникновении патологического фенотипа, показывая, как это может быть частично уравновешено антиоксидантной терапией (112).Это поддерживает предложение терапевтических подходов с антиоксидантами у людей с DOA. У гетерозиготных мутантных мух обнаружены возрастные нарушения зрительных функций, сердечные изменения (113), сокращение продолжительности жизни, повышенный уровень АФК и наличие нерегулярных и дисморфных митохондрий в скелетных мышцах (114). Таким образом, эти два исследования на модели Opa1 мутанта Drosophila показали возрастное мультисистемное расстройство, напоминающее синдромальные формы DOA «плюс» (113, 114).
Рисунок 2 . Схематическое изображение четырех моделей животных, использованных для изучения OPA1. Пути, о которых в литературе сообщается, что они регулируются OPA1 или изменяются его мутациями kd / ko / в моделях на животных, помечены галочкой.
Caenorhabditis elegans МоделиТесная взаимосвязь между мутациями OPA1 и изменением ROS была дополнительно подтверждена на моделях Caenorhabditis elegans ( C. elegans ).Действительно, мутации в гене eat-3 , ортологическом гене OPA1 червя, увеличили восприимчивость к повреждению свободными радикалами, о чем свидетельствует повышенная чувствительность к параквату и потеря митохондриальной супероксиддисмутазы sod-2 (115 ). Трансгенные черви, несущие мутации потери функции eat-3 , представили фрагментированные митохондрии (115–117) и аберрантную архитектуру крист (115, 117). Мутация eat-3 вызвала зависящий от возраста и прогрессирующий дефицит движений, а также мышечной и нейрональной функции (117), каким-то образом отражая клинические фенотипы DOA «плюс».Интересно, что повышенные уровни удлиненных митохондрий были связаны с долголетием, поскольку слияние митохондрий позволяет выжить более старым животным (118), это открытие подтверждается вторым исследованием, показывающим, что мутация eat-3 сокращает среднюю продолжительность жизни животных (117), поскольку уже сообщалось в модели Drosophila (114).
Повышение аутофагии / митофагии как ключевого патогенного механизма при DOA было подтверждено также у C. elegans , где экспрессия мутированного OPA1 в ГАМКергических аксонах снижает содержание митохондрий в аксонах, фенотип, которому противодействует истощение ATG8. гомолог lgg-2 (119).
Danio rerio (Рыбка-данио) МоделиЭффект истощения Opa1 в раннем развитии был изучен на модели Danio rerio с использованием антисмыслового морфолино (120). Морфанты Opa1 обнаруживают задержку развития, снижение скорости кровообращения, уменьшение размера глаз и частоты сердечных сокращений, дефекты, связанные с повышенной фрагментацией митохондрий в мышечных клетках, а также нарушение биоэнергетики (120).
Об изменении митохондриальных сетей у морфантов Opa1 сообщалось совсем недавно (121), подтверждая основную роль OPA1 в морфологии митохондрий.
Модели мышей
На сегодняшний день описаны три модели мышей, несущих гетерозиготный мутантный аллель Opa1 зародышевой линии, которые сыграли важную роль в изучении патогенных механизмов DOA (Рисунок 2) (122–124). Скрининг ENU-мутагенизированной ДНК-библиотеки ДНК мыши привел к созданию двух моделей на мышах, каждая из которых воспроизводит генетические дефекты человека, которые вызывают гаплонедостаточность. Первый, B6; C3- Opa1 329-355 del мутантная мышь, приводит к ошибке сплайсинга с пропуском экзона 10, что в конечном итоге вызывает делецию в рамке считывания 27 аминокислотных остатков в домене GTPase динамина. (122).Вторая, B6; C3- Opa1 Q 285 STOP мутантная мышь, приводит к усеченному белку (123). Обе модели имеют снижение экспрессии OPA1 примерно на 50%, а гомозиготное состояние эмбрионально летально, что указывает на решающую роль OPA1 во время внутриутробного развития. Третья модель представляет собой мышь с нокаутом, несущую обычную мутацию OPA1 c.2708_2711delTTAG у людей на фоне мышей C57Bl6 / J (124). У этих мышей снижение уровня белка OPA1 на 25% было обнаружено в головном мозге, сетчатке, зрительном нерве и гликолитических волокнах, тогда как снижение достигало 50% в окислительных волокнах и сердце.Кроме того, в этой модели гомозиготное состояние было эмбрионально летальным.
Во всех трех моделях гетерозиготные животные демонстрировали умеренный, зависящий от возраста глазной фенотип с хорошо задокументированной дисфункцией и потерей RGCs (122, 124–126). При гистопатологии наблюдались дегенеративные особенности зрительных нервов, включая демиелинизацию, различные степени дегенерации аксонов и аномалии митохондрий на уровне ультраструктуры (123–126).
Сообщалось об усилении аутофагии в RGC B6; C3- Opa1 Q 285 STOP мутантная мышь (127) и в гликолитических волокнах, RGC и периферических нейронах OpaAG1 delTT — мутантная мышь (124), подчеркивающая аутофагическую элиминацию митохондрий с нарушением слияния.Совсем недавно сообщалось об усилении митофагии у мышей B6; C3- Opa1 Q 285 STOP мышей (128) и подтверждено на RGC мышей, сверхэкспрессирующих мутированный OPA1, что также показывает, что снижение митохондриальной плотности аксонов было связано с усиление аутофагической деградации митохондрий в соме RGC в непосредственной близости от аксональных бугорков (119). Сообщалось, что у мышей B6; C3- Opa1 329-355 del также наблюдается дисбаланс окислительно-восстановительного состояния, возможно, увеличивающий митохондриальные ROS, о чем свидетельствует снижение активности аконитазы и индукция антиоксидантной защиты (97).Метаболический анализ зрительного нерва у самок мышей Opa1 delTTAG выявил изменения в концентрациях метаболитов, участвующих в нейропротекции, и фосфолипидов, некоторые из которых указывают на изменение миелиновой оболочки (129). Все эти дисфункции могут привести к гибели большинства RGC, но не RGC, экспрессирующих меланопсин, которые, как сообщается, выживают в двух моделях мышей DOA (130, 131), согласно свидетельствам того, что и у людей этот тип клеток относительно устойчив к гибели клеток в митохондриях. оптические невропатии (132).
Таким образом, фенотип в этих моделях мышей в достаточной степени напоминает человеческое заболевание, характеризующееся потерей RGC и атрофией зрительного нерва. У людей болезнь может различаться по клинической степени тяжести, от тяжелых врожденных случаев до очень легких субклинических заболеваний, обнаруживаемых только при точных офтальмологических исследованиях (133, 134). Интересно, что системное обследование этих животных выявило легкие нервно-мышечные нарушения, включая снижение двигательной активности, аномальный рефлекс сцепления и тремор, по аналогии с непрерывным клиническим спектром у людей, в диапазоне от DOA до DOA «плюс» (134).
Примечательно, что интересные результаты были получены при более тщательном исследовании синаптических связей RGC в B6; C3- Opa1 Q 285 STOP мутантных животных, которые смотрели на их дендриты вместо того, чтобы фокусироваться только на аксонах (135, 136). Как ни странно, самые ранние патологические изменения произошли в дендритах RGCs, показывая сокращение и заметное снижение их синаптической связи (135, 136). Эта дендропатия, однако, согласуется с решающей ролью OPA1 и слияния митохондрий в поддержании дендритов и их синапсов (137).
Кроме того, по мере старения у всех трех моделей мышей сообщалось о нарушении сердечной функции. Действительно, в начале слепоты у пожилых мышей B6; C3- OPA1 Q 285 STOP также наблюдалась кардиомиопатия, характеризующаяся нарушением митохондриальной организации, истощением мтДНК, биоэнергетическим дефектом и дефектными сердечными митохондриями (138). . Снижение адаптации сердца к перегрузке давлением и гипертрофия сердца наблюдались также у мышей B6; C3- Opa1 329-355 del (139).Подобные изменения в митохондриальной обработке кальция затронули этих мутантных мышей Opa1 (139), наблюдаемые также у третьих мышей Opa1 delTTAG , вместе с повышенной чувствительностью к сердечным ишемическим / реперфузионным повреждениям (140). Интересно, что поражение сердца у пациентов, несущих мутацию OPA1 , было впервые зарегистрировано у двух пациентов, несущих гомозиготную рецессивную мутацию OPA1 , ведущую к фатальной энцефалопатии с прогрессирующей гипертрофической кардиомиопатией (17).
Другая модель мыши с удаленным Opa1 в бета-клетках поджелудочной железы показала непереносимость глюкозы и нарушение секреции инсулина. Это также привело к снижению выработки АТФ, стимулированной глюкозой, и развитию гипергликемии. Сосредоточившись на функции митохондрий, бета-клетки представили серьезное изменение митохондриальной структуры и снижение уровня субъединиц и активности Комплекса IV (141).
Недавно были созданы мышечные модели абляции Opa1 на мышах для исследования тканеспецифической роли Opa1 в мышцах, подчеркивая его метаболическую роль (142–144).Pereira et al. показали, что у мутантных мышей прогрессирующая дисфункция митохондрий приводит к увеличению скорости метаболизма, мышечной атрофии и инсулинорезистентности, вызванным механизмом, включающим стресс ER и секрецию фактора роста фибробластов 21 (FGF21) (142). Повышенный FGF21 наблюдался также на другой мышечной модели Opa1 -делеции мышей, где вместе со стрессом ER и активацией развернутого белкового ответа (UPR) была активирована катаболическая программа с потерей мышц, что привело к системному старению и преждевременная смерть (143).В третьем исследовании повышенный уровень FGF21 и преждевременная смерть, вызванные аблацией Opa1 , были связаны с воспалением мышц, характеризующимся активацией NF-kB и повышенной экспрессией провоспалительных генов; эти функции были заблокированы истощением мтДНК и репрессией TLR9 (144). Все эти особенности представляют большой интерес, поскольку цитокины плазмы, включая FGF21, были недавно подтверждены как биомаркеры митохондриальных заболеваний, особенно тех, которые имеют выраженное поражение мышц (145, 146).
С терапевтической точки зрения все эти модели мышей играют важную роль в тестировании лекарств или методов лечения. Действительно, мышь Opa1 delTTAG уже была протестирована на генную терапию изоформой 1 OPA1, что доказало ее способность смягчать индуцированную OPA1 дегенерацию RGC, способствуя возможной клинической трансляции у пациентов с DOA (147). Более того, самая последняя модель мышей с RGC-специфической сверхэкспрессией мутантного OPA1 сыграла важную роль в демонстрации того, что противопоставление избыточной аутофагии с помощью различных стратегий было эффективным для предотвращения дегенерации RGC и восстановления зрения (119).
In vitro МоделиЗа последнее десятилетие, чтобы выяснить роль OPA1 в слиянии внутренней митохондриальной мембраны, были разработаны различные анализы in vitro с очищенным OPA1. Первоначально более простой дрожжевой mgm1 был изучен путем очистки короткого Mgm1 (s-Mgm1), выявив, что белок проявляет активность GTP, самособирается в олигомер низкого порядка и специфически взаимодействует с отрицательно заряженными фосфолипидами, присутствующими в митохондриальных мембранах (148). .Кроме того, сообщалось, что олигомеризация s-Mgm1 и его связывание с митохондриальными фосфолипидами сильно стимулирует его активность GTPase, и он собирается на липосомах и усиливает взаимодействие липосом, указывая на то, что s-Mgm1 может связывать противоположные мембраны, опосредуя их слияние (149). Эта гипотеза была подтверждена исследованиями криоэлектронной микроскопии и анализами слияния липосом, показавшими, что s-Mgm1 самоассоцируется для связывания противоположных мембран с зазором в 15 нм, а олигомеры претерпевают GTP-зависимые структурные изменения, которые могут вызывать слияние (150).Сообщается, что вместе со способностью вызывать кластеризацию фосфолипидов s-Mgm1 запускает локальное изгибание мембраны и образование трубчатых структур (151). Исследования длинных и коротких форм Mgm1 в слиянии показали, что обе формы предпочтительно вставляются в липосомы, содержащие липид кардиолипин, действующий вместе в транс, чтобы сформировать функциональную единицу, необходимую для слияния митохондрий (152).
Подобные результаты были получены при изучении молекулярных механизмов OPA1-опосредованного слияния.Действительно, ассоциация с липосомами, содержащими отрицательные фосфолипиды, такие как кардиолипин, усиливала активность ГТФазы коротких форм OPA1, способствовала их сборке в олигомеры и приводила к мембранным канальцам, активностям, которые избирательно нарушались мутациями DOA (62). Используя систему митохондрий, очищенную in vitro, было показано, что слияние митохондрий зависит от протеолитического процессинга длинных форм (153). Чтобы разобраться в обсуждаемой проблеме фузогенной способности форм OPA1, Ban et al.очищены и проанализированы краткие и длинные формы (154). Анализы слияния мембран in vitro и показали, что длинные формы и кардиолипин на противоположных сторонах взаимодействуют при слиянии внутренней митохондриальной мембраны, процесс, который эффективно ускоряется определенным количеством короткой формы и снижается ее избыточным уровнем. С другой стороны, кардиолипин-независимое взаимодействие длинных форм, расположенных на противоположных мембранах, как сообщается, способствует прикреплению мембран, таким образом поддерживая структуру cristae (154).Соответственно, система восстановления in vitro , способная различать последовательные этапы слияния мембран, показала, что короткая форма опосредует связывание мембраны, длинная форма достаточна для стыковки мембраны, гемифузии и низких уровней высвобождения содержимого, а короткая форма взаимодействует с длинной формой, обеспечивая эффективное и быстрое открытие пор мембраны (155). Важно отметить, что, как показывают другие исследования, избыточные уровни короткой формы ингибируют активность слияния (155). Криоэлектронно-микроскопические структуры показали, что короткая форма представляет собой классическую динаминоподобную структуру, может связываться с мембранами, индуцировать мембранные трубочки, образуя спиральный массив, а связывание GTPgS способствует изменениям в сборке S-OPA1 от «закрытой» до «закрытой». открытая »конформация (156).
Новое механистическое понимание того, как OPA1 / Mgm1 обеспечивает слияние мембран, было предоставлено недавно решенными кристаллическими структурами короткого Mgm1 из Chaetomium thermophilum (157) и Saccharomyces cerevisiae (158). Сообщалось, что гриб короткий Mgm1 образует тетрамеры, опосредованные стеблем, и собираются на положительно или отрицательно изогнутых мембранах (157), тогда как дрожжевой короткий Mgm1 образует вогнутую мембранно-ассоциированную тримерную структуру голова к хвосту, построенную за счет межмолекулярных взаимодействий (158).Кристаллическая структура минимального GTPase домена (MGD) OPA1 и биохимический анализ вместо этого показали, что он может образовывать нуклеотид-зависимые и -независимые димеры, которые могут объединяться с образованием олигомеров более высокого порядка (159).
Все эти находки in vitro разрешают некоторые противоречивые результаты, полученные в клеточных исследованиях, и помогли подчеркнуть сложность активности OPA1, фундаментальной для поддержания и поддержки структуры внутренней мембраны и слияния.
Выводы
Исследование функции OPA1 стало свидетелем огромного прогресса за последнее десятилетие благодаря множеству новых моделей и подходов, которые мы здесь рассмотрели.Этот прогресс сыграл важную роль в уточнении роли митохондрий в выживании RGC и углублении нашего понимания патогенеза DOA, чтобы, возможно, разработать эффективные методы лечения для этих пациентов, что в настоящее время является неудовлетворенной потребностью, которая требует исследовательских усилий. Несколько исследований , подтверждающих принцип , уже дали интересные результаты, такие как фармакологическое или генетическое ограничение сверхактивной аутофагии в RGC (119) или уточнение стратегий, основанных на подходах генной терапии (147). Многогранная роль OPA1 в функции митохондрий и, в более общем плане, в клеточном метаболизме продолжает удивлять, и возможная терапевтическая роль небольшой сверхэкспрессии OPA1 также была исследована для противодействия множеству различных состояний (160–162), что хорошо. за пределами специфической области наследственной оптической невропатии.
Авторские взносы
VD и VC внесли свой вклад в написание рукописи. Оба автора внесли свой вклад в статью и одобрили представленную версию.
Финансирование
Эта работа была поддержана Министерством здравоохранения Италии через фонд Ricerca Corrente, финансируемый Istituto di Ricovero e Cura a Carattere Scientifico Istituto delle Scienze Neurologiche di Bologna; и ВК была поддержана Министерством здравоохранения Италии (грант RF-2018-12366703 REORION) и Министерством университетов и исследований Италии (MUR) (грант PRIN-2017 20172T2MHH).
Конфликт интересов
Авторы заявляют, что исследование проводилось при отсутствии каких-либо коммерческих или финансовых отношений, которые могут быть истолкованы как потенциальный конфликт интересов.
Список литературы
1. Делетр С., Ленарс Дж., Гриффоин Дж. М., Гигарель Н., Лоренцо С., Беленгер П. и др. Ядерный ген OPA1, кодирующий митохондриальный белок, связанный с динамином, мутировал при доминантной атрофии зрительного нерва. Nat Genet. (2000) 26: 207–10. DOI: 10.1038/79936
PubMed Аннотация | CrossRef Полный текст | Google Scholar
2. Александр С., Вотруба М., Пеш У. Э., Тизелтон Д. Л., Майер С., Мур А. и др. OPA1, кодирующий связанную с динамином GTPase, мутирует при аутосомно-доминантной атрофии зрительного нерва, связанной с хромосомой 3q28. Nat Genet. (2000) 26: 211–5. DOI: 10.1038 / 79944
PubMed Аннотация | CrossRef Полный текст | Google Scholar
3. Кьер П. Инфантильная атрофия зрительного нерва с доминантным типом наследования: клиническое и генетическое исследование 19 датских семей. Acta Ophthalmol Suppl. (1959) 164: 1–147.
PubMed Аннотация
4. Гуан К., Фарх Л., Маршалл Т.К., Дешен Р.Дж. Для нормальной митохондриальной структуры и поддержания генома у дрожжей необходим динамин-подобный продукт гена MGM1. Curr Genet. (1993) 24: 141–8. DOI: 10.1007 / BF00324678
PubMed Аннотация | CrossRef Полный текст | Google Scholar
5. Pelloquin L, Belenguer P, Menon Y, Ducommun B. Идентификация белка, связанного с динамином делящихся дрожжей, участвующего в поддержании митохондриальной ДНК. Biochem Biophys Res Commun. (1998) 251: 720–6. DOI: 10.1006 / bbrc.1998.9539
PubMed Аннотация | CrossRef Полный текст | Google Scholar
6. Wong ED, Wagner JA, Gorsich SW, McCaffery JM, Shaw JM, Nunnari J. Связанная с динамином GTPase, Mgm1p, представляет собой белок межмембранного пространства, необходимый для поддержания митохондрий, способных к слиянию. J Cell Biol. (2000) 151: 341–52. DOI: 10.1083 / jcb.151.2.341
PubMed Аннотация | CrossRef Полный текст | Google Scholar
7.Делеттр С., Гриффоин Дж. М., Каплан Дж., Дольфус Х., Лоренц Б., Фейвр Л. и др. Спектр мутаций и варианты сплайсинга в гене OPA1. Hum Genet. (2001) 109: 584–91. DOI: 10.1007 / s00439-001-0633-y
PubMed Аннотация | CrossRef Полный текст | Google Scholar
8. Дель Дотто В., Фогазза М., Карелли В., Руголо М., Занна С. Восемь длинных и коротких изоформ OPA1 человека: для чего они нужны? Biochim Biophys Acta Bioenerg. (2018) 1859: 263–9. DOI: 10.1016 / j.bbabio.2018.01.005
PubMed Аннотация | CrossRef Полный текст | Google Scholar
9. Дель Дотто В., Мишра П., Видони С., Фогазза М., Мареска А., Капорали Л. и др. Изоформы OPA1 в иерархической организации митохондриальных функций. Cell Rep. (2017) 19: 2557–71. DOI: 10.1016 / j.celrep.2017.05.073
PubMed Аннотация | CrossRef Полный текст | Google Scholar
10. Лоди Р., Тонон С., Валентино М.Л., Йотти С., Клементи В., Малучелли Е. и др. Дефицит in vivo продукции митохондриального АТФ при доминантной атрофии зрительного нерва, связанной с OPA1. Ann Neurol. (2004) 56: 719–23. DOI: 10.1002 / ana.20278
PubMed Аннотация | CrossRef Полный текст | Google Scholar
11. Занна С., Гелли А., Порчелли А.М., Карбовски М., Юле Р.Дж., Шимпф С. и др. Мутации OPA1, связанные с доминантной атрофией зрительного нерва, нарушают окислительное фосфорилирование и митохондриальное слияние. Мозг. (2008) 131: 352–67. DOI: 10.1093 / мозг / awm335
PubMed Аннотация | CrossRef Полный текст | Google Scholar
12. Олихон А., Барико Л., Газ Н, Гийу Э, Валетт А., Беленгер П. и др.Потеря OPA1 нарушает структуру и целостность внутренней митохондриальной мембраны, что приводит к высвобождению цитохрома с и апоптозу. J Biol Chem. (2003) 278: 7743–6. DOI: 10.1074 / jbc.C200677200
PubMed Аннотация | CrossRef Полный текст | Google Scholar
13. Frezza C, Cipolat S, Martins de Brito O, Micaroni M, Beznoussenko GV, Rudka T, et al. OPA1 контролирует ремоделирование апоптотических крист независимо от слияния митохондрий. Cell. (2006) 126: 177–89.DOI: 10.1016 / j.cell.2006.06.025
PubMed Аннотация | CrossRef Полный текст | Google Scholar
14. Amati-Bonneau P, Valentino ML, Reynier P, Gallardo ME, Bornstein B, Boissière A, et al. Мутации OPA1 вызывают нестабильность митохондриальной ДНК и фенотип «плюс» атрофии зрительного нерва. Мозг. (2008) 131: 338–51. DOI: 10,1093 / мозг / awm298
PubMed Аннотация | CrossRef Полный текст | Google Scholar
15. Хадсон Г., Амати-Бонно П., Блейкли Е.Л., Стюарт Д.Д., Хе Л., Шефер А.М. и др.Мутация OPA1 вызывает доминантную атрофию зрительного нерва с внешней офтальмоплегией, атаксией, глухотой и множественными делециями митохондриальной ДНК: новое нарушение поддержания мтДНК. Мозг. (2008) 131: 329–37. DOI: 10,1093 / мозг / awm272
PubMed Аннотация | CrossRef Полный текст | Google Scholar
16. Элачури Г., Видони С., Занна С., Паттин А., Бухаддауи Н., Гагет К. и др. OPA1 связывает поддержание митохондриального генома человека с репликацией и распределением мтДНК. Genome Res. (2011) 21: 12–20. DOI: 10.1101 / gr.108696.110
CrossRef Полный текст | Google Scholar
17. Шпигель Р., Саада А., Фланнери П. Дж., Бурте Ф., Сойферман Д., Хаят М. и др. Смертельная детская митохондриальная энцефаломиопатия, гипертрофическая кардиомиопатия и атрофия зрительного нерва, связанные с гомозиготной мутацией OPA1. J Med Genet. (2016) 53: 127–31. DOI: 10.1136 / jmedgenet-2015-103361
PubMed Аннотация | CrossRef Полный текст | Google Scholar
18.Карелли V, Musumeci O, Caporali L, Zanna C, La Morgia C, Del Dotto V и др. Синдромный паркинсонизм и деменция, связанные с миссенс-мутациями OPA1. Ann Neurol. (2015) 78: 21–38. DOI: 10.1002 / ana.24410
PubMed Аннотация | CrossRef Полный текст | Google Scholar
19. Ляо К., Эшли Н., Диот А., Мортен К., Фадвал К., Уильямс А. и др. Нарушение регуляции митофагии и митохондриальной организации при атрофии зрительного нерва из-за мутаций OPA1. Неврология. (2017) 88: 131–42.DOI: 10.1212 / WNL.0000000000003491
PubMed Аннотация | CrossRef Полный текст | Google Scholar
20. Дель Дотто В., Фогазза М., Ленаерс Дж., Руголо М., Карелли В., Занна К. OPA1: что мы знаем, чтобы подойти к терапии? Pharmacol Res. (2018) 131: 199–210. DOI: 10.1016 / j.phrs.2018.02.018
PubMed Аннотация | CrossRef Полный текст | Google Scholar
21. Чан, округ Колумбия. Митохондриальная динамика и ее участие в заболевании. Annu Rev Pathol. (2020) 15: 235–59.DOI: 10.1146 / annurev-pathmechdis-012419-032711
CrossRef Полный текст | Google Scholar
23. Burté F, Carelli V, Chinnery PF, Yu-Wai-Man P. Нарушенная динамика митохондрий и нейродегенеративные расстройства. Nat Rev Neurol. (2015) 11: 11–24. DOI: 10.1038 / nrneurol.2014.228
PubMed Аннотация | CrossRef Полный текст | Google Scholar
24. Yu-Wai-Man P, Griffiths PG, Gorman GS, Lourenco CM, Wright AF, Auer-Grumbach M, et al. Многосистемные неврологические заболевания часто встречаются у пациентов с мутациями OPA1. Мозг. (2010) 133: 771–86. DOI: 10.1093 / мозг / awq007
PubMed Аннотация | CrossRef Полный текст | Google Scholar
25. Верни С., Люазо Д., Шерер С., Лежен П., Шевроллье А., Геген Н. и др. Расстройство, подобное рассеянному склерозу, при аутосомно-доминантной атрофии зрительного нерва, связанной с OPA1. Неврология. (2008) 70: 1152–3. DOI: 10.1212 / 01.wnl.0000289194.89359.a1
PubMed Аннотация | CrossRef Полный текст | Google Scholar
26. Ю-Вай-Ман П., Спиропулос А., Дункан Х. Дж., Гуаданьо СП, Чиннери П. Ф.Заболевание, подобное рассеянному склерозу, у пациентов с мутациями OPA1. Ann Clin Transl Neurol. (2016) 3: 723–9. DOI: 10.1002 / acn3.323
PubMed Аннотация | CrossRef Полный текст | Google Scholar
27. Линч Д.С., Лох ШИ, Харли Дж., Нойс А.Дж., Мартинс Л.М., Вуд Н.В. и др. Несиндромная болезнь Паркинсона в семье с аутосомно-доминантной атрофией зрительного нерва из-за мутаций OPA1. Neurol Genet. (2017) 3: e188. DOI: 10.1212 / NXG.0000000000000188
PubMed Аннотация | CrossRef Полный текст | Google Scholar
28.Рубеньи А., Пизано Т., Баччи Г., Тесса А., Баттини Р., Прокопио Е. и др. Ли-подобные нейровизуализационные особенности, связанные с новыми двуаллельными мутациями в OPA1. Eur J Paediatr Neurol. (2017) 21: 671–7. DOI: 10.1016 / j.ejpn.2017.04.004
PubMed Аннотация | CrossRef Полный текст | Google Scholar
29. Джонс Б.А., Фангман В.Л. Поддержание митохондриальной ДНК в дрожжах требует белка, содержащего область, относящуюся к GTP-связывающему домену динамина. Genes Dev. (1992) 6: 380–9.DOI: 10.1101 / gad.6.3.380
PubMed Аннотация | CrossRef Полный текст | Google Scholar
30. Вонг Э.Д., Вагнер Дж. А., Скотт С. В., Окреглак В., Холевинске Т. Дж., Кэссиди-Стоун А. и др. ГТФаза, связанная с внутримитохондриальным динамином, Mgm1p, является компонентом белкового комплекса, который обеспечивает слияние митохондрий. J Cell Biol. (2003) 160: 303–11. DOI: 10.1083 / jcb.200209015
PubMed Аннотация | CrossRef Полный текст | Google Scholar
31. Сесаки Х., Саутхард С.М., Яффе М.П., Дженсен Р.Э.Mgm1p, связанная с динамином GTPase, важна для слияния внешней митохондриальной мембраны. Mol Biol Cell. (2003) 14: 2342–56. DOI: 10.1091 / mbc.e02-12-0788
PubMed Аннотация | CrossRef Полный текст | Google Scholar
32. Мееузен С., ДеВэй Р., Блок Дж., Кэссиди-Стоун А., Уэйсон С., Маккаффри Дж. М. и др. Слияние митохондрий с внутренней мембраной и поддержание кристы требует связанной с динамином GTPase Mgm1. Cell. (2006) 127: 383–95. DOI: 10.1016 / j.cell.2006.09.021
PubMed Аннотация | CrossRef Полный текст | Google Scholar
33. Amutha B, Gordon DM, Gu Y, Pain D. Новая роль Mgm1p, связанной с динамином GTPase, в сборке АТФ-синтазы и формировании / поддержании крист. Biochem J. (2004) 381: 19–23. DOI: 10.1042 / BJ20040566
PubMed Аннотация | CrossRef Полный текст | Google Scholar
34. Pelloquin L, Belenguer P, Menon Y, Gas N, Ducommun B. Делящиеся дрожжи Msp1 — это митохондриальный белок, связанный с динамином. J Cell Sci. (1999) 112: 4151–61.
PubMed Аннотация | Google Scholar
35. Guillou E, Bousquet C, Daloyau M, Emorine LJ, Belenguer P. Msp1p представляет собой белок, связанный с межмембранным пространственным динамином, который опосредует митохондриальное слияние Dnm1p-зависимым образом в S. pombe. FEBS Lett . (2005) 579: 1109–16. DOI: 10.1016 / j.febslet.2004.12.083
PubMed Аннотация | CrossRef Полный текст | Google Scholar
36. Херлан М., Фогель Ф, Борнховд С., Нойперт В., Райхерт А.С.Процессинг Mgm1 протеазой Pcp1 ромбовидного типа необходим для поддержания морфологии митохондрий и митохондриальной ДНК. J Biol Chem. (2003) 278: 27781–8. DOI: 10.1074 / jbc.M211311200
PubMed Аннотация | CrossRef Полный текст | Google Scholar
38. Леруа И., Хосробахш Ф., Диот А., Далояу М., Арнауне-Пеллокен Л., Кавелье С. и др. Обработка динамина Msp1p в S. pombe обнаруживает эволюционное переключение между его ортологами Mgm1p в S.cerevisiae и OPA1 у млекопитающих. FEBS Lett. (2010) 584: 3153–7. DOI: 10.1016 / j.febslet.2010.05.060
PubMed Аннотация | CrossRef Полный текст | Google Scholar
39. Зик М., Дувезин-Кавет С., Шефер А., Фогель Ф., Нойперт В., Райхерт А.С. Различная роль двух изоформ динамин-подобной GTPase Mgm1 в митохондриальном слиянии. FEBS Lett. (2009) 583: 2237–43. DOI: 10.1016 / j.febslet.2009.05.053
PubMed Аннотация | CrossRef Полный текст | Google Scholar
40.Diot A, Guillou E, Daloyau M, Arnauné-Pelloquin L, Emorine LJ, Belenguer P. Трансмембранные сегменты динамина Msp1p разделяют его функции по контролю морфологии митохондрий и поддержанию генома. J Cell Sci. (2009) 122: 2632–9. DOI: 10.1242 / jcs.040139
PubMed Аннотация | CrossRef Полный текст | Google Scholar
41. Нолли С., Гоффрини П., Лаццаретти М., Занна С., Витале Р., Лоди Т. и др. Валидация химерного гена MGM1 / OPA1 для функционального анализа мутаций, связанных с доминантной атрофией зрительного нерва, у дрожжей. Митохондрия. (2015) 25: 38–48. DOI: 10.1016 / j.mito.2015.10.002
PubMed Аннотация | CrossRef Полный текст | Google Scholar
42. Дель Дотто В., Фогазза М., Мусиани Ф., Мареска А., Алео С.Дж., Капорали Л. и др. Выявление патогенности мутаций OPA1 с помощью комбинированного анализа моделей клеток человека, мыши и дрожжей. Biochim Biophys Acta Mol Basis Dis. (2018) 1864: 3496–514. DOI: 10.1016 / j.bbadis.2018.08.004
PubMed Аннотация | CrossRef Полный текст | Google Scholar
43.Наска А., Рицца Т., Доймо М., Легати А., Чиолфи А., Диодато Д. и др. Не только доминантная, не только атрофия зрительного нерва: расширение клинического спектра, связанного с мутациями OPA1. Orphanet J Rare Dis. (2017) 12:89. DOI: 10.1186 / s13023-017-0641-1
PubMed Аннотация | CrossRef Полный текст | Google Scholar
44. Делеру Т., Трибуйяр-Танвье Д., Далояу М., Хосробахш Ф., Эморин Л.Дж., Фриокур Дж. И др. Скрининговый анализ на основе дрожжей выявляет перепрофилированные препараты, которые подавляют митохондриальное слияние и дефекты поддержания мтДНК. Dis Model Mech. (2019) 12: dmm036558. DOI: 10.1242 / dmm.036558
PubMed Аннотация | CrossRef Полный текст | Google Scholar
45. Алео С.Дж., Дель Дотто В., Фогазза М., Мареска А., Лоди Т., Гоффрини П. и др. Репозиционирование лекарств как терапевтическая стратегия при нейродегенерациях, связанных с мутациями OPA1. Hum Mol Genet. (2021) 29: 3631–45. DOI: 10.1093 / hmg / ddaa244
PubMed Аннотация | CrossRef Полный текст | Google Scholar
46. Сонг З., Чен Х, Фикет М., Александр К., Чан, округ Колумбия.Процессинг OPA1 контролирует слияние митохондрий и регулируется сплайсингом мРНК, мембранным потенциалом и Yme1L. J Cell Biol. (2007) 178: 749–55. DOI: 10.1083 / jcb.200704110
PubMed Аннотация | CrossRef Полный текст | Google Scholar
47. Эхсес С., Рашке И., Манкузо Дж., Бернаккья А., Геймер С., Тондера Д. и др. Регулирование процессинга OPA1 и слияния митохондрий изоферментами протеазы m-AAA и OMA1. J Cell Biol. (2009) 187: 1023–36. DOI: 10,1083 / JCB.200
4
PubMed Аннотация | CrossRef Полный текст | Google Scholar
48. Глава B, Грипарик L, Амири M, Гандре-Баббе S, ван дер Блик AM. Индуцируемая протеолитическая инактивация OPA1, опосредованная протеазой OMA1, в клетках млекопитающих. J Cell Biol. (2009) 187: 959–66. DOI: 10.1083 / jcb.200
3
PubMed Аннотация | CrossRef Полный текст | Google Scholar
49. Ван Р., Мишра П., Гарбис С.Д., Морадиан А., Суэредоски М.Дж., Чан, округ Колумбия. Идентификация нового сайта расщепления OPA1 показывает, что короткие изоформы регулируют слияние митохондрий. Mol Biol Cell. (2021) 32: 157–68. DOI: 10.1091 / mbc.E20-09-0605
PubMed Аннотация | CrossRef Полный текст | Google Scholar
50. Cipolat S, Martins de Brito O, Dal Zilio B, Scorrano L. OPA1 требует митофузина 1, чтобы способствовать слиянию митохондрий. Proc Natl Acad Sci USA. (2004) 101: 15927–32. DOI: 10.1073 / pnas.0407043101
PubMed Аннотация | CrossRef Полный текст | Google Scholar
53. Ли Х., Смит С.Б., Юн Ю. Короткий вариант митохондриального динамина OPA1 поддерживает митохондриальную энергию и структуру крист. J Biol Chem. (2017) 292: 7115–30. DOI: 10.1074 / jbc.M116.762567
PubMed Аннотация | CrossRef Полный текст | Google Scholar
54. Chen H, Vermulst M, Wang YE, Chomyn A., Prolla TA, McCaffery JM, et al. Слияние митохондрий необходимо для стабильности мтДНК в скелетных мышцах и устойчивости к мутациям мтДНК. Cell. (2010) 141: 280–9. DOI: 10.1016 / j.cell.2010.02.026
PubMed Аннотация | CrossRef Полный текст | Google Scholar
55.Ху Ц., Шу Л., Хуанг Х, Ю Дж, Ли Л., Гонг Л. и др. OPA1 и MICOS регулируют динамику и формирование митохондриальных крист. Cell Death Dis. (2020) 11: 940. DOI: 10.1038 / s41419-020-03152-y
PubMed Аннотация | CrossRef Полный текст | Google Scholar
56. Коглиати С., Фрецца С., Сориано М.Э., Варанита Т., Кинтана-Кабрера Р., Коррадо М. и др. Форма крист митохондрий определяет сборку суперкомплексов дыхательной цепи и эффективность дыхания. Cell. (2013) 155: 160–71.DOI: 10.1016 / j.cell.2013.08.032
PubMed Аннотация | CrossRef Полный текст | Google Scholar
57. Кинтана-Кабрера Р., Квирин С., Глитсу С., Коррадо М., Урбани А., Пеллаттьеро А. и др. Оптическая атрофия 1 модулятора крист требует наличия олигомеров митохондриальной АТФ-синтазы для защиты митохондриальной функции. Nat Commun. (2018) 9: 3399. DOI: 10.1038 / s41467-018-05655-x
PubMed Аннотация | CrossRef Полный текст | Google Scholar
58. Баррера М, Кооб С., Диков Д., Фогель Ф, Райхерт А.С.OPA1 функционально взаимодействует с MIC60, но незаменим для образования соединений крист. FEBS Lett. (2016) 590: 3309–22. DOI: 10.1002 / 1873-3468.12384
PubMed Аннотация | CrossRef Полный текст | Google Scholar
59. Glytsou C, Calvo E, Cogliati S, Mehrotra A, Anastasia I, Rigoni G, et al. Атрофия зрительного нерва 1 эпистатична по отношению к основному компоненту MICOS MIC60 в контроле формы крист митохондрий. Cell Rep. (2016) 17: 3024–34. DOI: 10.1016 / j.celrep.2016.11.049
PubMed Аннотация | CrossRef Полный текст | Google Scholar
60. Паттен Д.А., Вонг Дж., Хачо М., Субанье В., Майлу Р. Дж., Пилон-Лароз К. и др. OPA1-зависимая модуляция крист необходима для клеточной адаптации к метаболическим потребностям. EMBO J. (2014) 33: 2676–91. DOI: 10.15252 / embj.201488349
PubMed Аннотация | CrossRef Полный текст | Google Scholar
61. Lee H, Smith SB, Sheu S-S, Yoon Y. Короткий вариант атрофии зрительного нерва 1 (OPA1) улучшает выживаемость клеток при окислительном стрессе. J Biol Chem. (2020) 295: 6543–60. DOI: 10.1074 / jbc.RA119.010983
PubMed Аннотация | CrossRef Полный текст | Google Scholar
62. Бан Т., Хейманн ЧЖ, Сонг З., Хиншоу Дж. Э., Чан, округ Колумбия. Аллели заболевания OPA1, вызывающие доминантную атрофию зрительного нерва, имеют дефекты в стимулируемом кардиолипином гидролизе GTP и мембранных канальцах. Hum Mol Genet. (2010) 19: 2113–22. DOI: 10.1093 / hmg / ddq088
PubMed Аннотация | CrossRef Полный текст | Google Scholar
63.Бокка С., Кейн М.С., Вейрат-Дюребекс С., Чупин С., Албан Дж., Куасси Нзугет Дж. И др. Метаболомная биоэнергетическая подпись эмбриональных фибробластов мыши с нарушенным Opa1 подчеркивает дефицит аспартата. Научный доклад (2018) 8: 11528. DOI: 10.1038 / s41598-018-29972-9
PubMed Аннотация | CrossRef Полный текст | Google Scholar
64. Бокка С., Кейн М.С., Вейрат-Дюребекс С., Нзугет Дж. К., Чао де ла Барка Дж. М., Чупин С. и др. Липидомика выявляет накопление триацилглицерина из-за нарушения потока жирных кислот в фибробластах с разрушенным Opa1. J Proteome Res. (2019) 18: 2779–90. DOI: 10.1021 / acs.jproteome.9b00081
PubMed Аннотация | CrossRef Полный текст | Google Scholar
65. Чао де ла Барка Дж. М., Фогазза М., Руголо М., Чупин С., Дель Дотто В., Гелли А. М. и др. Метаболомика выявляет варианты OPA1, коррелирующие с их фенотипом in vitro и предсказывающие клиническую тяжесть. Hum Mol Genet. (2020) 29: 1319–29. DOI: 10.1093 / hmg / ddaa047
PubMed Аннотация | CrossRef Полный текст | Google Scholar
66.Чао де ла Барка Дж. М., Аррасола М. С., Бокка С., Арнауне-Пеллокен Л., Юлиано О., Черкес Г. и др. Метаболомная подпись дефицита Opa1 в первичных корковых нейронах крыс показывает истощение запасов аспартата / глутамата и ремоделирование фосфолипидов. Научный доклад (2019) 9: 6107. DOI: 10.1038 / s41598-019-42554-7
PubMed Аннотация | CrossRef Полный текст | Google Scholar
67. Паттен Д.А., МакГирк С., Анилкумар Ю., Антоун Г., Ганди К., Пармар Г. и др. Измененное слияние митохондрий запускает защитный синтез глутатиона в клетках, способных переключаться на выработку гликолитического АТФ. Biochim Biophys Acta Mol Cell Res. (2021) 1868: 118854. DOI: 10.1016 / j.bbamcr.2020.118854
PubMed Аннотация | CrossRef Полный текст | Google Scholar
68. Olichon A, Emorine LJ, Descoins E, Pelloquin L, Brichese L, Gas N и др. Человеческий динамин-родственный белок OPA1 прикреплен к внутренней митохондриальной мембране, обращенной к межмембранному пространству. FEBS Lett. (2002) 523: 171–6. DOI: 10.1016 / s0014-5793 (02) 02985-x
PubMed Аннотация | CrossRef Полный текст | Google Scholar
69.Сато М., Хамамото Т., Сео Н., Кагава Ю., Эндо Х. Дифференциальная сублокализация изоформ OPA1 связанного с динамином белка в митохондриях. Biochem Biophys Res Commun. (2003) 300: 482–93. DOI: 10,1016 / s0006-291x (02) 02874-7
PubMed Аннотация | CrossRef Полный текст | Google Scholar
70. Griparic L, van der Wel NN, Orozco IJ, Peters PJ, van der Bliek AM. Потеря белка межмембранного пространства Mgm1 / OPA1 вызывает набухание и локальные сужения по длине митохондрий. J Biol Chem. (2004) 279: 18792–8. DOI: 10.1074 / jbc.M400
0
PubMed Аннотация | CrossRef Полный текст | Google Scholar
72. Гилери О, Малка Ф, Ландес Т., Гийу Э, Блэкстоун С., Ломбес А. и др. Опосредованный металлопротеазой процессинг OPA1 модулируется потенциалом митохондриальной мембраны. Biol Cell. (2008) 100: 315–25. DOI: 10.1042 / BC20070110
PubMed Аннотация | CrossRef Полный текст | Google Scholar
73. Griparic L, Kanazawa T, van der Bliek AM.Регулирование митохондриального динаминоподобного белка Opa1 протеолитическим расщеплением. J Cell Biol. (2007) 178: 757–64. DOI: 10.1083 / jcb.200704112
PubMed Аннотация | CrossRef Полный текст | Google Scholar
74. Arnoult D, Grodet A, Lee YJ, Estaquier J, Blackstone C. Высвобождение OPA1 во время апоптоза участвует в быстром и полном высвобождении цитохрома с и последующей фрагментации митохондрий. J Biol Chem. (2005) 280: 35742–50. DOI: 10.1074 / JBC.M505970200
PubMed Аннотация | CrossRef Полный текст | Google Scholar
75. Кушнарева Ю.Е., Геренцер А.А., Босси Б., Джу В.К., Уайт А.Д., Вагонер Дж. И др. Потеря OPA1 нарушает клеточный гомеостаз кальция и повышает чувствительность к эксайтотоксичности. Cell Death Differ. (2013) 20: 353–65. DOI: 10.1038 / cdd.2012.128
PubMed Аннотация | CrossRef Полный текст | Google Scholar
76. Ли Й, Чжон С.Ю., Карбовски М., Смит С.Л., Юл Р.Дж. Роль медиаторов деления и слияния митохондрий Fis1, Drp1 и Opa1 у млекопитающих в апоптозе. Mol Biol Cell. (2004) 15: 5001–11. DOI: 10.1091 / mbc.e04-04-0294
PubMed Аннотация | CrossRef Полный текст | Google Scholar
77. Стефан Т., Брюзер С., Декерс М., Стейер А.М., Бальзаротти Ф., Барбот М. и др. Сборка MICOS контролирует ремоделирование внутренней мембраны митохондрий и перераспределение соединений крист, чтобы опосредовать образование крист. EMBO J. (2020) 39: e104105. DOI: 10.15252 / embj.201
05PubMed Аннотация | CrossRef Полный текст | Google Scholar
78.Olichon A, Landes T, Arnauné-Pelloquin L, Emorine LJ, Mils V, Guichet A, et al. Влияние мутаций OPA1 на морфологию митохондрий и апоптоз: актуальность для патогенеза ADOA. J. Cell Physiol. (2007) 211: 423–30. DOI: 10.1002 / jcp.20950
PubMed Аннотация | CrossRef Полный текст | Google Scholar
79. Ямагути Р., Лартиг Л., Перкинс Г., Скотт Р. Т., Диксит А., Кушнарева Ю. и др. Опосредованное Opa1 открытие крист зависит от Bax / Bak и Bh4, необходимо для апоптоза и не зависит от олигомеризации Bak. Mol Cell. (2008) 31: 557–69. DOI: 10.1016 / j.molcel.2008.07.010
PubMed Аннотация | CrossRef Полный текст | Google Scholar
81. Fülöp L, Szanda G, Enyedi B, Várnai P, Spät A. Влияние OPA1 на передачу сигналов Ca 2+ в митохондриях. PLoS ONE. (2011) 6: e25199. DOI: 10.1371 / journal.pone.0025199
CrossRef Полный текст | Google Scholar
82. Chen M, Chen Z, Wang Y, Tan Z, Zhu C, Li Y, et al. Рецептор митофагии FUNDC1 регулирует митохондриальную динамику и митофагию. Аутофагия. (2016) 12: 689–702. DOI: 10.1080 / 15548627.2016.1151580
PubMed Аннотация | CrossRef Полный текст | Google Scholar
83. Olichon A, Elachouri G, Baricault L, Delettre C, Belenguer P, Lenaers G. Альтернативный сплайсинг OPA1 отделяет эволюционно консервативную функцию митохондриального слияния от ограниченной функции позвоночных при апоптозе. Cell Death Differ. (2007) 14: 682–92. DOI: 10.1038 / sj.cdd.4402048
PubMed Аннотация | CrossRef Полный текст | Google Scholar
84.Sun Y, Xue W, Song Z, Huang K, Zheng L. Восстановление изоформы длиной Opa1 ингибирует нейродегенерацию, вызванную повреждением сетчатки. J Mol Med (Berl). (2016) 94: 335–46. DOI: 10.1007 / s00109-015-1359-y
PubMed Аннотация | CrossRef Полный текст | Google Scholar
85. Ланг А., Ананд Р., Алтинолук-Хамбюхен С., Эззахойни Н., Стефански А., Ирам А. и др. SIRT4 взаимодействует с OPA1 и регулирует контроль качества митохондрий и митофагию. Старение (Олбани, штат Нью-Йорк). (2017) 9: 2163–89.DOI: 10.18632 / старение.101307
PubMed Аннотация | CrossRef Полный текст | Google Scholar
86. Pidoux G, Witczak O, Jarnæss E, Myrvold L, Urlaub H, Stokka AJ, et al. Атрофия зрительного нерва 1 представляет собой закрепляющий белок А-киназу на липидных каплях, который опосредует адренергический контроль липолиза. EMBO J. (2011) 30: 4371–86. DOI: 10.1038 / emboj.2011.365
PubMed Аннотация | CrossRef Полный текст | Google Scholar
87. Rogne M, Chu D-T, Küntziger TM, Mylonakou M-N, Collas P, Tasken K.Заякоренная OPA1 PKA фосфорилирует перилипин 1 на S522 и S497 в адипоцитах, дифференцированных от стволовых жировых стволовых клеток человека. Mol Biol Cell. (2018) 29: 1487–501. DOI: 10.1091 / mbc.E17-09-0538
PubMed Аннотация | CrossRef Полный текст | Google Scholar
88. Амати-Бонно П., Гишет А., Олишон А., Шевроллье А., Виала Ф, Миот С. и др. Мутация OPA1 R445H при атрофии зрительного нерва, связанной с нейросенсорной глухотой. Ann Neurol. (2005) 58: 958–63. DOI: 10.1002 / ana.20681
PubMed Аннотация | CrossRef Полный текст | Google Scholar
89. Амати-Бонно П., Милеа Д., Бонно Д., Шевроллье А., Ферре М., Гийе В. и др. Нарушения, связанные с OPA1: фенотипы и патофизиология. Int J Biochem Cell Biol. (2009) 41: 1855–65. DOI: 10.1016 / j.biocel.2009.04.012
CrossRef Полный текст | Google Scholar
90. Спинацци М., Каццола С., Бортолоцци М., Баракка А., Лоро Е., Казарин А. и др. Новая делеция в GTPase домене OPA1 вызывает дефекты в морфологии и распределении митохондрий, но не в функции. Hum Mol Genet. (2008) 17: 3291–302. DOI: 10.1093 / hmg / ddn225
PubMed Аннотация | CrossRef Полный текст | Google Scholar
91. Ночез И., Арсен С., Геген Н., Шевроллье А., Ферре М., Гийе В. и др. Острая атрофия зрительного нерва с поздним началом из-за новой мутации OPA1, приводящей к дефекту митохондриального сцепления. Mol Vis. (2009) 15: 598–608.
PubMed Аннотация | Google Scholar
92. Бониферт Т., Карле К.Н., Тонагель Ф., Батра М., Вильгельм С., Тойрер Y и др.Чистая и синдромальная атрофия зрительного нерва, объясняемая глубокими интронными мутациями OPA1 и модификатором внутри локуса. Мозг. (2014) 137: 2164–77. DOI: 10,1093 / мозг / аву165
PubMed Аннотация | CrossRef Полный текст | Google Scholar
93. Agier V, Oliviero P, Lainé J, L’Hermitte-Stead C, Girard S, Fillaut S, et al. Нарушение митохондриального слияния, изменение дыхательной функции и искаженная структура крист в фибробластах кожи с гетерозиготными мутациями OPA1. Biochim Biophys Acta. (2012) 1822: 1570–80. DOI: 10.1016 / j.bbadis.2012.07.002
PubMed Аннотация | CrossRef Полный текст | Google Scholar
94. Као С.-Х, Йен М-И, Ван А-Г, Йе И-Л, Лин А-Л. Изменения морфологии и биоэнергетики митохондрий в лимфобластоидных клетках человека с четырьмя новыми мутациями OPA1. Invest Ophthalmol Vis Sci. (2015) 56: 2269–78. DOI: 10.1167 / iovs.14-16288
PubMed Аннотация | CrossRef Полный текст | Google Scholar
95. Кейн М.С., Албан Дж., Десквире-Дюма В., Геген Н., Исхак Л., Ферре М. и др.Аутофагия контролирует патогенность мутаций OPA1 при доминантной атрофии зрительного нерва. J Cell Mol Med. (2017) 21: 2284–97. DOI: 10.1111 / JCMM.13149
PubMed Аннотация | CrossRef Полный текст | Google Scholar
96. Чжан Дж., Лю Х, Лян Х, Лу И, Чжу Л., Фу Р. и др. Новая мутация OPA1, связанная с ADOA, изменяет функцию митохондрий, мембранный потенциал, продукцию ROS и апоптоз. Научный доклад (2017) 7: 5704. DOI: 10.1038 / s41598-017-05571-y
PubMed Аннотация | CrossRef Полный текст | Google Scholar
97.Millet AMC, Bertholet AM, Daloyau M, Reynier P, Galinier A, Devin A и др. Потеря функционального OPA1 нарушает окислительно-восстановительное состояние: влияние на патогенез доминирующей атрофии зрительного нерва. Ann Clin Transl Neurol. (2016) 3: 408–21. DOI: 10.1002 / acn3.305
PubMed Аннотация | CrossRef Полный текст | Google Scholar
98. Fülöp L, Rajki A, Maka E, Molnár MJ, Spät A. Поглощение митохондриального Ca 2+ коррелирует с тяжестью симптомов аутосомно-доминантной атрофии зрительного нерва. Cell Calcium. (2015) 57: 49–55. DOI: 10.1016 / j.ceca.2014.11.008
PubMed Аннотация | CrossRef Полный текст | Google Scholar
99. Наполитано Ф., Терраччано С., Бруно Дж., Нести С., Бариллари М.Р., Бариллари У. и др. Изменчивость внутрисемейного фенотипа «DOA-plus», связанная с различной экспрессией OMI / HTRA2. Am J Med Genet A. (2020) 182: 176–82. DOI: 10.1002 / ajmg.a.61381
PubMed Аннотация | CrossRef Полный текст | Google Scholar
101.Галера-Монге Т., Зурита-Диас Ф, Морено-Искьердо А., Фрага М.Ф., Фернандес А.Ф., Аюсо С. и др. Получение линии ИПСК человека от пациента с фенотипом «плюс» атрофии зрительного нерва из-за мутации в гене OPA1. Stem Cell Res. (2016) 16: 673–6. DOI: 10.1016 / j.scr.2016.03.011
PubMed Аннотация | CrossRef Полный текст | Google Scholar
102. Зурита-Диас Ф, Галера-Монге Т., Морено-Искьердо А., Кортон М., Аюсо С., Гарес Р. и др. Создание линии ИПСК человека DOA «плюс», IISHDOi003-A, с мутацией в гене OPA1: c.1635C> A; p.Ser545Arg. Stem Cell Res. (2017) 24: 81–4. DOI: 10.1016 / j.scr.2017.08.017
PubMed Аннотация | CrossRef Полный текст | Google Scholar
103. Hauser S, Schuster S, Theurer Y, Synofzik M, Schöls L. Генерация оптической атрофии 1 индуцированные пациентом плюрипотентные стволовые клетки (iPS-OPA1-BEHR) для моделирования сложных синдромов оптической атрофии (синдром Бера). Stem Cell Res. (2016) 17: 426–9. DOI: 10.1016 / j.scr.2016.09.012
PubMed Аннотация | CrossRef Полный текст | Google Scholar
104.Чен Дж, Риазифар Х, Гуань М-Х, Хуанг Т. Моделирование аутосомно-доминантной атрофии зрительного нерва с использованием индуцированных плюрипотентных стволовых клеток и определение потенциальных терапевтических мишеней. Stem Cell Res Ther. (2016) 7: 2. DOI: 10.1186 / s13287-015-0264-1
PubMed Аннотация | CrossRef Полный текст | Google Scholar
105. Барбони П., Карбонелли М., Савини Дж., Фоскарини Б., Паризи В., Валентино М.Л. и др. Мутации OPA1, связанные с доминантной атрофией зрительного нерва, влияют на размер головы зрительного нерва. Офтальмология. (2010) 117: 1547–53. DOI: 10.1016 / j.ophtha.2009.12.042
PubMed Аннотация | CrossRef Полный текст | Google Scholar
106. Джоникас М., Мэдилл М., Мэти А., Зеколл Т., Зойс К.Э., Вигфилд С. и др. Моделирование митохондриального паркинсонизма стволовыми клетками позволяет выявить ключевые функции OPA1. Ann Neurol. (2018) 83: 915–25. DOI: 10.1002 / ana.25221
PubMed Аннотация | CrossRef Полный текст | Google Scholar
107. Янниелли А., Бидо С., Фолладори Л., Сегнали А., Канчелье С., Мареска А. и др.Фармакологическое ингибирование некроптоза защищает от гибели дофаминергических нейрональных клеток в моделях болезни Паркинсона. Cell Rep. (2018) 22: 2066–79. DOI: 10.1016 / j.celrep.2018.01.089
PubMed Аннотация | CrossRef Полный текст | Google Scholar
108. Iannielli A, Ugolini GS, Cordiglieri C, Bido S, Rubio A, Colasante G, et al. Восстановление нигро-полосатого тела человека на чипе выявляет OPA1-зависимые митохондриальные дефекты и потерю дофаминергических синапсов. Cell Rep. (2019) 29: 4646–56.e4. DOI: 10.1016 / j.celrep.2019.11.111
PubMed Аннотация | CrossRef Полный текст | Google Scholar
109. Чаглаян С., Хашим А., Числар-Побуда А., Йенсен В., Берингер С., Талуг Б. и др. Атрофия зрительного нерва 1 контролирует развитие нейронов человека, предотвращая аберрантное метилирование ядерной ДНК. iScience. (2020) 23: 101154. DOI: 10.1016 / j.isci.2020.101154
PubMed Аннотация | CrossRef Полный текст | Google Scholar
110.Кьярадия I, Ланкастер Массачусетс. Органоиды мозга для изучения нейробиологии человека на стыке in vitro и in vivo . Nat Neurosci . (2020) 23: 1496–508. DOI: 10.1038 / s41593-020-00730-3
PubMed Аннотация | CrossRef Полный текст | Google Scholar
111. Коуэн С.С., Реннер М., Де Дженнаро М., Гросс-Шерф Б., Голдблюм Д., Хоу И. и др. Типы клеток сетчатки глаза человека и ее органоидов при одноклеточном разрешении. Cell. (2020) 182: 1623–40.e34. DOI: 10.1016 / j.cell.2020.08.013
PubMed Аннотация | CrossRef Полный текст | Google Scholar
112. Ярош В., Монсеррат Дж., Тонг Дж. Дж., Це С., Ле ПК, Нгуен К. и др. Молекулярные механизмы опосредованной OPA1 атрофии зрительного нерва на модели дрозофилы и перспективы лечения антиоксидантами. PLoS Genet. (2008) 4: e6. DOI: 10.1371 / journal.pgen.0040006
PubMed Аннотация | CrossRef Полный текст | Google Scholar
113. Shahrestani P, Leung H-T, Le PK, Pak WL, Tse S, Ocorr K, et al.Гетерозиготная мутация Drosophila Opa1 вызывает развитие аномалий многих органов в зависимости от возраста и органоспецифического характера. PLoS ONE. (2009) 4: e6867. DOI: 10.1371 / journal.pone.0006867
PubMed Аннотация | CrossRef Полный текст | Google Scholar
114. Tang S, Le PK, Tse S, Wallace DC, Huang T. Гетерозиготная мутация Opa1 у дрозофилы укорачивает продолжительность жизни, опосредованную увеличением продукции активных форм кислорода. PLoS ONE. (2009) 4: e4492.DOI: 10.1371 / journal.pone.0004492
PubMed Аннотация | CrossRef Полный текст | Google Scholar
115. Канадзава Т., Заппатерра М.Д., Хасегава А., Райт А.П., Ньюман-Смит Э.Д., Баттл К.Ф. и др. Гомолог C. elegans Opa1 EAT-3 необходим для устойчивости к свободным радикалам. PLoS Genet. (2008) 4: e1000022. DOI: 10.1371 / journal.pgen.1000022
PubMed Аннотация | CrossRef Полный текст | Google Scholar
116. Роллан С.Г., Лу Й., Дэвид К.Н., Конрад Б.BCL-2-подобный белок CED-9 из C. elegans способствует FZO-1 / Mfn1,2- и EAT-3 / Opa1-зависимому слиянию митохондрий. J Cell Biol. (2009) 186: 525–40. DOI: 10.1083 / jcb.2000
PubMed Аннотация | CrossRef Полный текст | Google Scholar
117. Бирн Дж. Дж., Сох М. С., Чандок Г., Виджаярагхаван Т., Теох Дж. С., Кроуфорд С. и др. Нарушение митохондриальной динамики влияет на поведение и продолжительность жизни у Caenorhabditis elegans. Сотовый Мол Лайф Ски . (2019) 76: 1967–85.DOI: 10.1007 / s00018-019-03024-5
PubMed Аннотация | CrossRef Полный текст | Google Scholar
118. Chaudhari SN, Kipreos ET. Повышенное слияние митохондрий позволяет выживать более старым животным по разным C. elegans путям долголетия. Nat Commun. (2017) 8: 182. DOI: 10.1038 / s41467-017-00274-4
PubMed Аннотация | CrossRef Полный текст | Google Scholar
119. Занинелло М., Паликарас К., Наон Д., Ивата К., Херкенн С., Кинтана-Кабрера Р. и др.Подавление аутофагии снижает потерю зрения на модели аутосомно-доминантной атрофии зрительного нерва. Nat Commun. (2020) 11: 4029. DOI: 10.1038 / s41467-020-17821-1
CrossRef Полный текст | Google Scholar
121. Eijkenboom I, Vanoevelen JM, Hoeijmakers JGJ, Wijnen I., Gerards M, Faber CG, et al. Модель рыбок данио для изучения невропатии мелких волокон обнаруживает потенциальную роль GDAP1. Митохондрия. (2019) 47: 273–81. DOI: 10.1016 / j.mito.2019.01.002
PubMed Аннотация | CrossRef Полный текст | Google Scholar
122.Алави М.В., Бетте С., Шимпф С., Шуэттауф Ф., Шраермейер Ю., Верл Х. Ф. и др. Мутация сайта сплайсинга в гене Opa1 мыши указывает на патологию аутосомно-доминантной атрофии зрительного нерва. Мозг. (2007) 130: 1029–42. DOI: 10.1093 / мозг / awm005
PubMed Аннотация | CrossRef Полный текст | Google Scholar
123. Дэвис В.Дж., Холлинз А.Дж., Пьехота М.Дж., Йип В., Дэвис Дж. Р., Уайт К.Э. и др. Дефицит Opa1 на мышиной модели аутосомно-доминантной атрофии зрительного нерва нарушает морфологию митохондрий, структуру зрительного нерва и зрительную функцию. Hum Mol Genet. (2007) 16: 1307–18. DOI: 10.1093 / hmg / ddm079
PubMed Аннотация | CrossRef Полный текст | Google Scholar
124. Sarzi E, Angebault C, Seveno M, Gueguen N, Chaix B, Bielicki G, et al. Мутация OPA1delTTAG человека вызывает преждевременную возрастную системную нейродегенерацию у мышей. Мозг. (2012) 135: 3599–613. DOI: 10.1093 / мозг / aws303
PubMed Аннотация | CrossRef Полный текст | Google Scholar
125. Heiduschka P, Schnichels S, Fuhrmann N, Hofmeister S, Schraermeyer U, Wissinger B, et al.Электрофизиологическая и гистологическая оценка судьбы ганглиозных клеток сетчатки на мышиной модели для OPA1-ассоциированной аутосомно-доминантной атрофии зрительного нерва. Invest Ophthalmol Vis Sci. (2010) 51: 1424–31. DOI: 10.1167 / iovs.09-3606
PubMed Аннотация | CrossRef Полный текст | Google Scholar
126. Nguyen D, Alavi MV, Kim KY, Kang T, Scott RT, Noh YH, et al. Новый порочный круг, включающий эксайтотоксичность глутамата, окислительный стресс и митохондриальную динамику. Cell Death Dis. (2011) 2: e240. DOI: 10.1038 / cddis.2011.117
PubMed Аннотация | CrossRef Полный текст | Google Scholar
127. Уайт К.Э., Дэвис В.Дж., Хоган В.Э., Пьехота М.Дж., Николс П.П., Тернбулл Д.М. и др. Дефицит OPA1 связан с усилением аутофагии в ганглиозных клетках сетчатки в мышиной модели доминантной атрофии зрительного нерва. Invest Ophthalmol Vis Sci. (2009) 50: 2567–71. DOI: 10.1167 / iovs.08-2913
PubMed Аннотация | CrossRef Полный текст | Google Scholar
128.Диот А., Агнью Т., Сандерсон Дж., Ляо С., Карвер Дж., Невес Р.П. дас и др. Проверка мышиной модели RedMIT / GFP-LC3 путем изучения митофагии при аутосомно-доминантной атрофии зрительного нерва из-за мутации OPA1Q285STOP. Front Cell Dev Biol. (2018) 6: 103. DOI: 10.3389 / fcell.2018.00103
PubMed Аннотация | CrossRef Полный текст | Google Scholar
129. Чао де ла Барка Дж. М., Симард Дж., Сарци Е., Шометт Т., Руссо Дж., Чупин С. и др. Направленная метаболомика выявляет раннюю доминантную сигнатуру оптической атрофии в зрительных нервах мышей Opa1delTTAG / +. Invest Ophthalmol Vis Sci. (2017) 58: 812–20. DOI: 10.1167 / iovs.16-21116
PubMed Аннотация | CrossRef Полный текст | Google Scholar
130. Перганта Г., Барнард А.Р., Катти С., Вахцеванос А., Дуглас Р.Х., Макларен Р.Э. и др. Не формирующие изображение функции, управляемые светом, сохраняются в мышиной модели аутосомно-доминантной атрофии зрительного нерва. PLoS ONE. (2013) 8: e56350. DOI: 10.1371 / journal.pone.0056350
PubMed Аннотация | CrossRef Полный текст | Google Scholar
131.Гонсалес-Менендес I, Рейнхард К., Толивия Дж., Виссинджер Б., Мюнх Т.А. Влияние мутации Opa1 на выживаемость и функцию ганглиозных клеток сетчатки. Invest Ophthalmol Vis Sci. (2015) 56: 4835–45. DOI: 10.1167 / iovs.15-16743
PubMed Аннотация | CrossRef Полный текст | Google Scholar
132. Ла Морджиа К., Росс-Сиснерос Ф. Н., Садун А. А., Ганнибал Дж., Мунарини А., Мантовани В. и др. Меланопсиновые ганглиозные клетки сетчатки устойчивы к нейродегенерации при митохондриальных оптических невропатиях. Мозг. (2010) 133: 2426–8. DOI: 10.1093 / мозг / awq155
PubMed Аннотация | CrossRef Полный текст | Google Scholar
134. Ю-Вай-Ман П., Гриффитс П. Г., Чинери П. Ф. Митохондриальные оптические нейропатии — механизмы болезни и терапевтические стратегии. Prog Retin Eye Res. (2011) 30: 81–114. DOI: 10.1016 / j.preteyeres.2010.11.002
PubMed Аннотация | CrossRef Полный текст | Google Scholar
135. Williams PA, Morgan JE, Votruba M. Дефицит Opa1 на мышиной модели доминантной атрофии зрительного нерва приводит к дендропатии ганглиозных клеток сетчатки. Мозг. (2010) 133: 2942–51. DOI: 10.1093 / мозг / awq218
PubMed Аннотация | CrossRef Полный текст | Google Scholar
136. Williams PA, Piechota M, von Ruhland C, Taylor E, Morgan JE, Votruba M. Opa1 важен для синаптической архитектуры и связи ганглиозных клеток сетчатки. Мозг. (2012) 135: 493–505. DOI: 10,1093 / мозг / awr330
PubMed Аннотация | CrossRef Полный текст | Google Scholar
137. Ли З, Окамото К.И., Хаяси Ю., Шэн М.Важность дендритных митохондрий в морфогенезе и пластичности шипиков и синапсов. Cell. (2004) 119: 873–87. DOI: 10.1016 / j.cell.2004.11.003
PubMed Аннотация | CrossRef Полный текст | Google Scholar
138. Чен Л., Лю Т., Тран А., Лу Х, Томилов А.А., Дэвис В. и др. Мутация OPA1 и кардиомиопатия с поздним началом: митохондриальная дисфункция и нестабильность мтДНК. J Am Heart Assoc. (2012) 1: e003012. DOI: 10.1161 / JAHA.112.003012
PubMed Аннотация | CrossRef Полный текст | Google Scholar
139.Пикеро Дж., Каффин Ф., Новотова М., Прола А., Гарнье А., Матео П. и др. Подавление OPA1 изменяет морфологию митохондрий мышей, функцию PTP и адаптацию сердца к перегрузке давлением. Cardiovasc Res. (2012) 94: 408–17. DOI: 10.1093 / cvr / cvs117
PubMed Аннотация | CrossRef Полный текст | Google Scholar
140. Ле Паж С., Ниро М., Фоконье Дж., Селье Л., Тамарей С., Гариб А. и др. Увеличение сердечных ишемических-реперфузионных повреждений на модели мышей Opa1 +/- . PLoS ONE. (2016) 11: e0164066. DOI: 10.1371 / journal.pone.0164066
PubMed Аннотация | CrossRef Полный текст | Google Scholar
141. Zhang Z, Wakabayashi N, Wakabayashi J, Tamura Y, Song WJ, Sereda S, et al. Связанная с динамином GTPase Opa1 необходима для стимулированного глюкозой производства АТФ в бета-клетках поджелудочной железы. Mol Biol Cell. (2011) 22: 2235–45. DOI: 10.1091 / mbc.E10-12-0933
PubMed Аннотация | CrossRef Полный текст | Google Scholar
142.Перейра Р.О., Тадинада С.М., Засадный Ф.М., Оливейра К.Дж., Пирес К.МП., Ольвера А. и др. Дефицит OPA1 способствует секреции FGF21 из мышц, что предотвращает ожирение и инсулинорезистентность. EMBO J. (2017) 36: 2126–45. DOI: 10.15252 / embj.201696179
PubMed Аннотация | CrossRef Полный текст | Google Scholar
143. Теззе С., Романелло В., Десбац М.А., Фадини Г.П., Альбьеро М., Фаваро Дж. И др. Связанная с возрастом потеря OPA1 в мышцах влияет на мышечную массу, метаболический гомеостаз, системное воспаление и старение эпителия. Cell Metab. (2017) 25: 1374–89.e6. DOI: 10.1016 / j.cmet.2017.04.021
PubMed Аннотация | CrossRef Полный текст | Google Scholar
144. Родригес-Нуэво А., Диас-Рамос А., Ногера Е., Диас-Саес Ф., Дюран Х, Муньос Дж. П. и др. Митохондриальная ДНК и TLR9 вызывают воспаление мышц при дефиците Opa1. EMBO J. (2018) 37: e96553. DOI: 10.15252 / embj.201796553
PubMed Аннотация | CrossRef Полный текст | Google Scholar
145. Lehtonen JM Forsström S Bottani E Viscomi C Baris OR Isoniemi H.FGF21 является биомаркером нарушений митохондриальной трансляции и поддержания мтДНК. Неврология. (2016) 87: 2290–9. DOI: 10.1212 / WNL.0000000000003374
CrossRef Полный текст | Google Scholar
146. Мареска А., Дель Дотто V, Романьоли М., Ла Морджиа С., Ди Вито Л., Капристо М. и др. Расширение и проверка биомаркеров митохондриальных заболеваний. J Mol Med (Berl). (2020) 98: 1467–78. DOI: 10.1007 / s00109-020-01967-y
PubMed Аннотация | CrossRef Полный текст | Google Scholar
147.Sarzi E, Seveno M, Piro-Mégy C, Elzière L, Quilès M, Péquignot M и др. Генная терапия OPA1 предотвращает потерю ганглиозных клеток сетчатки на мышиной модели с доминантной атрофией зрительного нерва. Научный доклад (2018) 8: 2468. DOI: 10.1038 / s41598-018-20838-8
PubMed Аннотация | CrossRef Полный текст | Google Scholar
148. Meglei G, McQuibban GA. Связанный с динамином белок Mgm1p собирается в олигомеры и гидролизует GTP для функционирования в слиянии митохондриальных мембран. Биохимия. (2009) 48: 1774–84.DOI: 10.1021 / bi801723d
PubMed Аннотация | CrossRef Полный текст | Google Scholar
149. Рудживифат Дж., Меглей Дж., Рубинштейн Дж. Л., Маккуиббан Г.А. Ассоциация фосфолипидов важна для родственного динамину белка Mgm1 для функционирования в слиянии митохондриальных мембран. J Biol Chem. (2009) 284: 28682–6. DOI: 10.1074 / jbc.M109.044933
PubMed Аннотация | CrossRef Полный текст | Google Scholar
150. Abutbul-Ionita I, Rujiviphat J, Nir I, McQuibban GA, Danino D.Мембранные привязки и нуклеотид-зависимые конформационные изменения приводят к слиянию мембран, опосредованному белками поддержания митохондриального генома (Mgm1). J Biol Chem. (2012) 287: 36634–8. DOI: 10.1074 / jbc.C112.406769
PubMed Аннотация | CrossRef Полный текст | Google Scholar
151. Рудживифат Дж., Вонг М.К., Вон А., Ши И.Л., Ип С.М., Маккуиббан Г.А. Белок поддержания митохондриального генома 1 (Mgm1) изменяет топологию мембраны и способствует локальному изгибу мембраны. J Mol Biol. (2015) 427: 2599–609. DOI: 10.1016 / j.jmb.2015.03.006
PubMed Аннотация | CrossRef Полный текст | Google Scholar
152. ДеВэй Р.М., Домингес-Рамирес Л., Лакнер Л.Л., Хоппинс С., Штальберг Х., Нуннари Дж. Совместная сборка изоформ Mgm1 требует кардиолипина и опосредует слияние внутренней митохондриальной мембраны. J Cell Biol. (2009) 186: 793–803. DOI: 10.1083 / jcb.2008
PubMed Аннотация | CrossRef Полный текст | Google Scholar
153. Мишра П., Карелли В., Манфреди Дж., Чан, округ Колумбия.Протеолитическое расщепление Opa1 стимулирует слияние внутренней митохондриальной мембраны и связывает слияние с окислительным фосфорилированием. Cell Metab. (2014) 19: 630–41. DOI: 10.1016 / j.cmet.2014.03.011
PubMed Аннотация | CrossRef Полный текст | Google Scholar
154. Бан Т., Исихара Т., Коно Х., Сайта С., Ичимура А., Маенака К. и др. Молекулярная основа избирательного митохондриального слияния за счет гетеротипического действия между OPA1 и кардиолипином. Nat Cell Biol. (2017) 19: 856–63.DOI: 10.1038 / ncb3560
PubMed Аннотация | CrossRef Полный текст | Google Scholar
155. Ge Y, Shi X, Boopathy S, McDonald J, Smith AW, Chao LH. Две формы Opa1 взаимодействуют для полного слияния внутренней митохондриальной мембраны. Элиф. (2020) 9: e50973. DOI: 10.7554 / eLife.50973
CrossRef Полный текст | Google Scholar
156. Zhang D, Zhang Y, Ma J, Zhu C, Niu T, Chen W. и др. Крио-ЭМ-структуры S-OPA1 обнаруживают его взаимодействие с мембраной и изменения при связывании нуклеотидов. Элиф. (2020) 9: e50294. DOI: 10.7554 / eLife.50294
PubMed Аннотация | CrossRef Полный текст | Google Scholar
157. Faelber K, Dietrich L, Noel JK, Wollweber F, Pfitzner A-K, Mühleip A, et al. Структура и сборка митохондриальной мембраны, ремоделирующей GTPase Mgm1. Природа. (2019) 571: 429–33. DOI: 10.1038 / s41586-019-1372-3
PubMed Аннотация | CrossRef Полный текст | Google Scholar
158. Ян Л., Ци Й, Рикетсон Д., Ли Л., Субраманиан К., Чжао Дж. И др.Структурный анализ тримерной сборки митохондриальной динамин-подобной GTPase Mgm1. Proc Natl Acad Sci USA. (2020) 117: 4061–70. DOI: 10.1073 / pnas.191
17PubMed Аннотация | CrossRef Полный текст | Google Scholar
159. Yu C, Zhao J, Yan L, Qi Y, Guo X, Lou Z и др. Структурные представления о димеризации G-домена и патогенной мутации OPA1. J Cell Biol. (2020) 219: e201
8. DOI: 10.1083 / jcb.2018PubMed Аннотация | CrossRef Полный текст | Google Scholar
160.Сивилетто Г., Варанита Т., Серутти Р., Горлетта Т., Барбаро С., Маркет С. и др. Сверхэкспрессия Opa1 улучшает фенотип на двух моделях митохондриальных заболеваний у мышей. Cell Metab. (2015) 21: 845–54. DOI: 10.1016 / j.cmet.2015.04.016
PubMed Аннотация | CrossRef Полный текст | Google Scholar
161. Варанита Т., Сориано М.Э., Романелло В., Заглия Т., Кинтана-Кабрера Р., Семензато М. и др. OPA1-зависимый путь ремоделирования митохондриальных крист контролирует атрофическое, апоптотическое и ишемическое повреждение ткани. Cell Metab. (2015) 21: 834–44. DOI: 10.1016 / j.cmet.2015.05.007
PubMed Аннотация | CrossRef Полный текст | Google Scholar
162. Wu W., Zhao D, Shah SZA, Zhang X, Lai M, Yang D, et al. Сверхэкспрессия OPA1 улучшает ремоделирование митохондриальных крист, митохондриальную дисфункцию и апоптоз нейронов при прионных заболеваниях. Cell Death Dis. (2019) 10: 710. DOI: 10.1038 / s41419-019-1953-y
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Генная терапия может помочь предотвратить потерю зрения из-за генетического заболевания глаз
Ирландские исследователи разработали новый метод генной терапии, который может сохранить зрение у пациентов с генетическим заболеванием, которое может привести к слепоте.Состояние, известное как доминантная атрофия зрительного нерва (ДОА), в настоящее время не имеет профилактических или лечебных средств, но в тестах на мышах и человеческих клетках команда смогла замедлить прогрессирование заболевания.
Унаследованное заболевание, DOA обычно проявляет свои первые симптомы в детстве, когда зрительные нервы пациентов начинают разрушаться. Это приводит к некоторой потере зрения и проблемам с восприятием цвета, а некоторые пациенты со временем полностью ослепнут.
Одна из основных причин заболевания была определена как мутация в гене OPA1.Этот ген кодирует белок, который поддерживает функцию митохондрий, структур, которые производят энергию в клетках. Без белка OPA1 митохондриальная сеть нарушается, и их функция ослабевает. Таким образом, страдает не только зрение — у многих пациентов с DOA возникают другие нервные проблемы.
Новое исследование, в котором приняли участие исследователи из Тринити-колледжа Дублина, больницы Mater и Королевской больницы глаза и уха Виктории, описывает новую генную терапию, которая потенциально может лечить DOA.Исследователи упаковали мРНК гена OPA1 в безвредный вирус, который будет действовать как средство доставки терапии к намеченной цели.
В клетках митохондрии, выделенные золотом, должны образовывать здоровые сети (слева), но у пациентов с DOA они могут стать фрагментированными (справа)Профессор Джейн Фаррар и доктор Дэниел Мэлони, Тринити-колледж Дублин
Этот метод был протестирован на мышах, у которых были дисфункциональные митохондрии, и у которых начиналась дегенерация ганглиозных клеток сетчатки.Конечно, лечение помогло улучшить функцию пораженных митохондрий и предотвратить повреждение клеток. Это, в свою очередь, защищало пространственное зрение животных.
Команда также обнаружила, что в тестах на человеческих клетках в культуре, полученных от пациентов с DOA, этот метод, по-видимому, улучшал функцию митохондрий. Это вселяет надежду, что генная терапия может также стать возможным лечением других родственных заболеваний, а также DOA.
«Мутации OPA1 участвуют в DOA, и поэтому этот терапевтический подход на основе OPA1 имеет отношение к DOA», — говорит Джейн Фаррар, соавтор исследования.«Однако дисфункция митохондрий связана со многими неврологическими расстройствами, которые в совокупности затрагивают миллионы людей во всем мире. Мы думаем, что у этого типа терапевтической стратегии, направленной на митохондриальную дисфункцию, есть большой потенциал, чтобы принести пользу и тем самым оказать большое влияние на общество ».
Исследование было опубликовано в журнале Frontiers in Neuroscience .
Источник: Тринити-колледж Дублин
новый скрининг позволяет понять влияние различных генов на DOA
Доминантная атрофия зрительного нерва (ДОА) — одна из наиболее распространенных форм митохондриальной болезни.Это может быть вызвано генетическими мутациями в OPA1, приводящими к дисфункции митохондрий. Исследователи из Института Пастера и CNRS нашли способы изучать и регулировать влияние генетических мутаций в OPA1.
Генетические мутации в гене атрофии зрительного нерва 1 ( OPA1 ) вызывают заболевание, называемое доминантной атрофией зрительного нерва (DOA). У большинства пациентов развивается изолированная атрофия зрительного нерва, то есть ухудшение состояния зрительного нерва, но примерно у 20% пациентов развивается более тяжелое неврологическое заболевание (DOA +), которое нельзя полностью объяснить локализацией или природой вызывающей заболевание мутации в OPA1.
Высокопроизводительный скрининг помогает идентифицировать гены, которые могут подавлять фрагментацию митохондрий«Мы разработали конвейер для визуализации и анализа митохондрий, который позволил нам выполнять высокопроизводительный фенотипический скрининг первичных фибробластов у пациентов, страдающих DOA +». Объясняет Тимоти Вай, исследователь CNRS и руководитель группы митохондриальной биологии в Institut Pasteur. Одним из последствий генетической мутации является фрагментация митохондрий, явление, при котором митохондрии расщепляются на маленькие пузырьки.Его команда провела скрининг 1531 гена, кодирующего митохондриальный протеом (белки, составляющие митохондрии), и обнаружила 91 генетический модификатор, который может подавлять фрагментацию митохондрий в фибробластах, полученных от пациентов.
Это открытие впервые демонстрирует, что действие других генов митохондриального протеома может влиять на дефекты, вызванные дефицитом OPA1, и иллюстрирует генетическую сложность этого редкого заболевания. Более того, разработанный ими подход к скринингу может быть использован для более персонализированной характеристики DOA, применяемого непосредственно в клетках пациентов, страдающих этим неизлечимым заболеванием.
Источник:
Высокопроизводительный скрининг выявляет супрессоры митохондриальной фрагментации в OPA1 фибробластах . EMBO Molecular Medicine , 20 мая 2021 г.
Эмма Кретин 1,2 , Присцилла Лопес 1 , Элоди Вимонт 1 , Такаши Тацута 3 , Томас Лангер 3,4 , Анастасия Гази 5 , Мартин Сакс 5 , Патрик Ю- Вай-Ман 6-9 , Паскаль Рейнье 10,11 , Тимоти Вай 1,2
1 Группа митохондриальной биологии, Институт Пастера, CNRS UMR 3691, Париж, Франция 2 Université de Paris, Париж, Франция 3 Институт биологии старения им. Макса Планка, Кельн, Германия 4 Кельнский кластер передового опыта по клеточным стрессовым реакциям при заболеваниях, связанных со старением (CECAD), Кельнский университет, Кельн, Германия 5 UTechS Ultrastructural Bio Imaging, Institut Pasteur, Paris, France 6 Кембриджский центр восстановления мозга и MRC Отделение митохондриальной биологии, Департамент клинической неврологии, Кембриджский университет, Кембридж, Великобритания 7 Кембриджское глазное отделение, больница Адденбрука, больницы Кембриджского университета, Кембридж, Великобритания 8 Офтальмологическая больница Мурфилдс, Лондон, Великобритания 9 UCL Институт офтальмологии, Университетский колледж Лондона, Лондон, Великобритания 10 Laboratoire de Biochimie et biologie moléculaire, Centre Hospitalier Universitaire, Анже, Франция 11 Unité Mixte de Recherche MITOVASC, CNRS 6015, INSERM U1083, Université d’Angers, Анже, Франциявариантов лечения наследственной оптической невропатии
Карелли V, Росс-Сиснерос Ф.Н., Садун А.А. Дисфункция митохондрий как причина оптических невропатий. Prog Retin Eye Res. 2004. 23 (1): 53–89.
CAS PubMed Google ученый
Ю-Вай-Ман П., Гриффитс П.Г., Чиннери П.Ф. Митохондриальные оптические невропатии — механизмы болезни и терапевтические стратегии. Prog Retin Eye Res. 2011. 30 (2): 81–114.
CAS PubMed PubMed Central Google ученый
Ла Морджиа C, Карбонелли М., Барбони П., Садун А.А., Карелли В. Медицинское лечение наследственных оптических невропатий. Фронт Neurol. 2014; 5: 141.
PubMed PubMed Central Google ученый
Ачилли А., Иоммарини Л., Оливьери А., Пала М., Хушиар Кашани Б., Рейнир П., Ла Морджиа С., Валентино М.Л., Лигуори Р., Пицца Ф, Барбони П. и др. Редкие первичные мутации митохондриальной ДНК и возможные синергические варианты наследственной оптической невропатии Лебера.PLoS ONE. 2012; 7 (8): e42242.
CAS PubMed PubMed Central Google ученый
Del Dotto V, Fogazza M, Carelli V, Rugolo M, Zanna C. Восемь длинных и коротких изоформ opa1 человека: для чего они нужны? Biochim Biophys Acta Bioenergy. 2018; 1859 (4): 263–9.
Google ученый
Карелли В., Ла Морджиа С., Валентино М.Л., Барбони П., Росс-Сиснерос Ф.Н., Садун А.А.Нейродегенерация ганглиозных клеток сетчатки при наследственных митохондриальных нарушениях. Biochim Biophys Acta. 2009; 1787 (5): 518–28.
CAS PubMed Google ученый
Садун А.А., Ла Морджиа К., Карелли В. Митохондриальные оптические невропатии: наши путешествия от скамейки к постели и обратно. Clin Exp Ophthalmol. 2013. 41 (7): 702–12.
PubMed Google ученый
Ю-Вай-Ман П., Вотруба М., Бурте Ф, Ла Морджиа К., Барбони П., Карелли В.Нейродегенеративная перспектива митохондриальных оптических невропатий. Acta Neuropathol. 2016; 132 (6): 789–806.
CAS PubMed PubMed Central Google ученый
Карелли V, Ла Морджиа C, Росс-Сиснерос Ф.Н., Садун А.А. Оптические невропатии: верхушка айсберга нейродегенерации. Hum Mol Genet. 2017; 26 (R2): R139–50.
CAS PubMed PubMed Central Google ученый
Гевен Н. Идебенон для лечения наследственной оптической невропатии Лебера. Наркотики сегодня (Barc). 2016; 52 (3): 173–81.
CAS Google ученый
Клопсток Т., Ю-Вай-Ман П., Димитриадис К., Роуло Дж., Хек С., Бейли М., Атаван А., Чаттопадхай С., Шуберт М., Гарип А., Кернт М. и др. Рандомизированное плацебо-контролируемое исследование идебенона при наследственной оптической невропатии Лебера. Головной мозг. 2011; 134 (Pt 9): 2677–86.
PubMed PubMed Central Google ученый
Карелли В, Ла Морджиа С., Валентино М.Л., Риццо Дж., Карбонелли М., Де Негри А.М., Садун Ф., Карта А, Герриеро С., Симонелли Ф., Садун А.А. и др. Лечение идебеноном при наследственной оптической нейропатии Лебера. Головной мозг. 2011; 134 (Pt 9): e188.
PubMed Google ученый
Барбони П., Валентино М.Л., Ла Морджиа К., Карбонелли М., Савини Дж., Де Негри А., Симонелли Ф., Садун Ф., Капорали Л., Мареска А., Лигуори Р. и др. Лечение идебеноном пациентов с доминантной атрофией зрительного нерва с мутантом opa1.Головной мозг. 2013; 136 (часть 2): e231.
PubMed Google ученый
Romagnoli M, La Morgia C, Carbonelli M, Di Vito L, Amore G, Zenesini C, Cascavilla ML, Barboni P, Carelli V. Идебенон увеличивает шанс стабилизации / восстановления остроты зрения в оптических органах с преобладанием опа-1 атрофия. Энн Клин Перевод Нейрол. 2020; 7 (4): 590–4.
CAS PubMed PubMed Central Google ученый
Садун А.А., Чикани С.Ф., Росс-Сиснерос Ф.Н., Барбони П., Тулен М., Шрейдер В.Д., Кубис К., Карелли В., Миллер Г. Влияние epi-743 на клиническое течение митохондриальной болезни, наследственной оптической невропатии Лебера. Arch Neurol. 2012; 69 (3): 331–8.
PubMed Google ученый
Rustum Karanjia SGC, Garcia M, Sadun AA. Эламипретид (mtp-131) офтальмологический раствор для местного применения для лечения наследственной оптической невропатии Лебера.Исследование Ophthalmol Visual Sci. 2019; 60: 2266.
Google ученый
Пизано А., Прециусо С., Иоммарини Л., Перли Е., Грациоли П., Кампезе А.Ф., Мареска А., Монтополи М., Масуэлли Л., Садун А.А., д’Амати Г. и др. Ориентация на бета-рецептор эстрогена в качестве профилактической терапевтической стратегии наследственной оптической нейропатии Лебера. Hum Mol Genet. 2015; 24 (24): 6921–31.
CAS PubMed Google ученый
Ю. А.К., Датта С., МакМакин М.З., Кортопасси Г.А. Спасение от гибели клеток и воспаления на мышиной модели потери зрения, опосредованной комплексом 1, с помощью перепрофилированных молекул лекарственного средства. Hum Mol Genet. 2017; 26 (24): 4929–36.
CAS PubMed PubMed Central Google ученый
Indrieri A, Carrella S, Romano A, Spaziano A, Marrocco E, Fernandez-Vizarra E, Barbato S, Pizzo M, Ezhova Y, Golia FM, Ciampi L, et al. Подавление Mir-181a / b оказывает защитное действие на модели митохондриальных заболеваний.EMBO Mol Med. 2019; 11 (5): e8734.
PubMed PubMed Central Google ученый
Гай Дж., Ци Х, Паллотти Ф., Шон Э.А., Манфреди Дж., Карелли В., Мартинуцци А., Хаусвирт В.В., Левин А.С. Спасение митохондриальной недостаточности, вызывающей наследственную оптическую невропатию Лебера. Энн Нейрол. 2002; 52 (5): 534–42.
CAS PubMed Google ученый
Юркуте Н., Харви Дж., Ю-Вай-Ман П.Стратегии лечения наследственной оптической нейропатии Лебера. Curr Opin Neurol. 2019; 32 (1): 99–104.
PubMed Google ученый
Sarzi E, Seveno M, Piro-Megy C, Elziere L, Quiles M, Pequignot M, Muller A, Hamel CP, Lenaers G, Delettre C. Генная терапия Opa1 предотвращает потерю ганглиозных клеток сетчатки в доминантной оптике модель атрофии мыши. Научный отчет 2018; 8 (1): 2468.
PubMed PubMed Central Google ученый
Spinelli JB, Haigis MC. Многогранный вклад митохондрий в клеточный метаболизм. Nat Cell Biol. 2018; 20 (7): 745–54.
CAS PubMed PubMed Central Google ученый
Чан, округ Колумбия. Синтез и деление: взаимосвязанные процессы, критически важные для здоровья митохондрий. Анну Рев Жене. 2012; 46: 265–87.
CAS PubMed Google ученый
Джакомелло М., Пякурел А., Глитсу С., Скоррано Л. Клеточная биология динамики митохондриальной мембраны. Nat Rev Mol Cell Biol. 2020; 21 (4): 204–24.
CAS PubMed Google ученый
Грин Д.Р., Галлуцци Л., Кремер Г. Клеточная биология. Метаболический контроль гибели клеток. Наука. 2014; 345 (6203): 1250256.
PubMed PubMed Central Google ученый
Де Стефани Д., Риццуто Р., Поццан Т. Наслаждайтесь путешествием: кальций в митохондриях туда и обратно. Анну Рев Биохим. 2016; 85: 161–92.
PubMed Google ученый
Соленья С., Виги П., Юле Р.Дж. Митофагия и механизмы контроля качества в поддержании митохондрий. Curr Biol. 2018; 28 (4): R170–85.
CAS PubMed PubMed Central Google ученый
Митчелл П. Связь фосфорилирования с переносом электронов и водорода по хемиосмотическому механизму. Природа. 1961; 191: 144–8.
CAS PubMed Google ученый
ДиМауро С., Шон Э.А., Карелли В., Хирано М. Клинический лабиринт митохондриальной неврологии. Nat Rev Neurol. 2013. 9 (8): 429–44.
CAS PubMed PubMed Central Google ученый
Горман Г.С., Чинери П.Ф., ДиМауро С., Хирано М., Кога Й., МакФарланд Р., Суомалайнен А., Торберн Д.Р., Зевиани М., Тернбулл Д.М. Митохондриальные заболевания. Nat Rev Dis Primers. 2016; 2: 16080.
PubMed Google ученый
Burte F, Carelli V, Chinnery PF, Yu-Wai-Man P. Нарушенная митохондриальная динамика и нейродегенеративные расстройства. Nat Rev Neurol. 2015; 11 (1): 11–24.
CAS PubMed Google ученый
Садун А. Приобретенная недостаточность митохондрий как причина заболевания зрительного нерва. Trans Am Ophthalmol Soc. 1998. 96: 881–923.
CAS PubMed PubMed Central Google ученый
Карелли В., Росс-Сиснерос Ф.Н., Садун А.А. Дегенерация зрительного нерва и дисфункция митохондрий: генетические и приобретенные оптические невропатии. Neurochem Int. 2002. 40 (6): 573–84.
CAS PubMed Google ученый
Джордано Л., Дечегли С., д’Адамо П., Валентино М.Л., Ла Морджиа С, Фракассо Ф, Роберти М., Каппеллари М., Петросилло Дж., Сиараволо С., Паренте Д. и др. Сигаретная токсичность вызывает наследственную оптическую невропатию Лебера, влияя на количество копий mtdna, окислительное фосфорилирование и пути детоксикации ros. Cell Death Dis. 2015; 6: e2021.
CAS PubMed PubMed Central Google ученый
Киркман М.А., Ю-Вай-Ман П., Корстен А., Леонхардт М., Димитриадис К., Де Ко ИФ, Клопшток Т., Чинери П.Ф.Взаимодействие генов и окружающей среды при наследственной оптической невропатии Лебера. Головной мозг. 2009. 132 (Pt 9): 2317–26.
PubMed PubMed Central Google ученый
Садун А.А., Карелли В., Саломао С.Р., Березовский А., Кирос П.А., Садун Ф., ДеНегри А.М., Андраде Р., Мораес М., Пассос А., Кьяер П. и др. Обширное исследование большой бразильской родословной 11778 гаплогруппы j leber наследственной оптической нейропатии. Am J Ophthalmol. 2003. 136 (2): 231–8.
PubMed Google ученый
Карелли В., д’Адамо П., Валентино М.Л., Ла Морджиа К., Росс-Сиснерос Ф.Н., Капорали Л., Мареска А., Логуэрсио Полоса П., Барбони П., Де Негри А., Садун Ф. и др. Анализ различий в затронутых lhon: генетических и средовых триггерах конверсии болезни. Головной мозг. 2016; 139 (Pt 3): e17.
PubMed Google ученый
Иджаз С., Джексон Дж., Торли Х., Портер К., Флеминг К., Ричардс А., Боннер А., Савович Дж.Дефицит питания у бездомных с проблемным употреблением алкоголя: систематический обзор. Int J Equity Health. 2017; 16 (1): 71.
PubMed PubMed Central Google ученый
Садун А.А. Метаболические нейропатии зрительного нерва. Семин офтальмол. 2002. 17 (1): 29–32.
PubMed Google ученый
Duewelhenke N, Krut O, Eysel P. Влияние на митохондрии и цитотоксичность различных антибиотиков, вводимых в высоких концентрациях на первичные остеобласты человека и клеточные линии.Антимикробные агенты Chemother. 2007. 51 (1): 54–63.
CAS PubMed Google ученый
Пачеу-Грау Д., Гомес-Дюран А., Лопес-Перес М.Дж., Монтойя Дж., Руис-Песини Э. Фармакогеномика митохондрий: штрих-код для антибиотикотерапии. Drug Discov сегодня. 2010. 15 (1–2): 33–9.
CAS PubMed Google ученый
Payne BA, Wilson IJ, Hateley CA, Horvath R, Santibanez-Koref M, Samuels DC, Price DA, Chinnery PF.Старение митохондрий ускоряется антиретровирусной терапией за счет клональной экспансии мутаций mtdna. Нат Жене. 2011. 43 (8): 806–10.
CAS PubMed PubMed Central Google ученый
Gardner K, Hall PA, Chinnery PF, Payne BA. Лечение ВИЧ и ассоциированная митохондриальная патология: обзор 25-летних исследований in vitro, животных и человека. Toxicol Pathol. 2014; 42 (5): 811–22.
PubMed Google ученый
Клинге CM. Эстрогенный контроль функции митохондрий. Redox Biol. 2020; 31: 101435.
CAS PubMed PubMed Central Google ученый
King MP, Attardi G. Клетки человека, лишенные mtdna: репопуляция экзогенными митохондриями путем комплементации. Наука. 1989. 246 (4929): 500–3.
CAS PubMed Google ученый
Джордано С., Монтополи М., Перли Е., Орланди М., Фантин М., Росс-Сиснерос Ф. Н., Капарротта Л., Мартинуцци А., Рагацци Е., Гелли А., Садун А. А. и др.Эстрогены улучшают митохондриальную дисфункцию при наследственной оптической нейропатии Лебера. Головной мозг. 2011; 134 (Pt 1): 220–34.
PubMed Google ученый
Вреденберг А., Вибом Р., Вильгельмссон Х., Графф С., Винер Х. Х., Бёрден С. Дж., Олдфорс А., Вестерблад Х, Ларссон Н. Г.. Увеличение митохондриальной массы у мышей с митохондриальной миопатией. Proc Natl Acad Sci USA. 2002. 99 (23): 15066–71.
CAS PubMed Google ученый
Джордано С., Иоммарини Л., Джордано Л., Мареска А., Пизано А., Валентино М.Л., Капорали Л., Лигуори Р., Дечегли С., Роберти М., Фанелли Ф. и др. Эффективный митохондриальный биогенез вызывает неполную пенетрантность при наследственной оптической невропатии Лебера. Головной мозг. 2014; 137 (Pt 2): 335–53.
PubMed Google ученый
Карелли В., Мареска А., Капорали Л., Трифунов С., Занна С., Руголо М. Митохондрии: биогенез и баланс митофагии при сегрегации и клональной экспансии мутаций митохондриальной ДНК.Int J Biochem Cell Biol. 2015; 63: 21–4.
CAS PubMed Google ученый
Sharma LK, Tiwari M, Rai NK, Bai Y. Активация митофагии восстанавливает митохондриальную дисфункцию Лебера, связанную с наследственной оптической невропатией, и улучшает выживаемость клеток. Hum Mol Genet. 2019; 28 (3): 422–33.
CAS PubMed Google ученый
Домби Е., Диот А., Мортен К., Карвер Дж., Лодж Т., Фраттер С., Нг Ю.С., Ляо С., Мьюир Р., Блейкли Е.Л., Харгривз И. и др.Мутация митохондриальной ДНК m.13051g> a приводит к изменению неврологии и активации митофагии. Неврология. 2016; 86 (20): 1921–3.
PubMed PubMed Central Google ученый
Садун А.А., Вин PH, Росс-Сиснерос Ф.Н., Уокер С.О., Карелли В. Наследственная оптическая нейропатия Лебера по-разному влияет на меньшие аксоны в зрительном нерве. Trans Am Ophthalmol Soc. 2000; 98: 223–32 ( обсуждение 232–225 ).
CAS PubMed PubMed Central Google ученый
Pan BX, Ross-Cisneros FN, Carelli V, Rue KS, Salomao SR, Moraes-Filho MN, Moraes MN, Berezovsky A, Belfort R Jr, Sadun AA. Математическое моделирование участия аксонов в наследственной оптической нейропатии Лебера. Инвестируйте Ophthalmol Vis Sci. 2012. 53 (12): 7608–17.
PubMed PubMed Central Google ученый
Ю-Вай-Ман П., Гриффитс П.Г., Браун Д.Т., Хауэлл Н., Тернбулл Д.М., Чиннери П.Ф. Эпидемиология наследственной оптической невропатии Лебера на северо-востоке Англии.Am J Hum Genet. 2003. 72 (2): 333–9.
CAS PubMed Google ученый
Пуомила А., Хамалайнен П., Кивиоя С., Савонтаус М.Л., Койвумаки С., Хуопонен К., Никоскелайнен Э. Эпидемиология и пенетрантность наследственной оптической невропатии Лебера в Финляндии. Eur J Hum Genet. 2007. 15 (10): 1079–89.
PubMed Google ученый
Mascialino B, Leinonen M, Meier T.Метаанализ распространенности мутации mtdna наследственной оптической невропатии Лебера в Европе. Eur J Ophthalmol. 2012; 22 (3): 461–5.
PubMed Google ученый
Уоллес, округ Колумбия, Сингх Дж., Лотт М. Т., Ходж Дж. А., Шурр Т. Г., Лезза А. М., Эльзас Л. Дж. 2-й, Никоскелайнен Е. К.. Мутация митохондриальной ДНК, связанная с наследственной оптической невропатией Лебера. Наука. 1988. 242 (4884): 1427–30.
CAS PubMed Google ученый
Caporali L, Maresca A, Capristo M, Del Dotto V, Tagliavini F, Valentino ML, La Morgia C, Carelli V. Неполная пенетрантность при митохондриальных оптических невропатиях. Митохондрия. 2017; 36: 130–7.
CAS PubMed Google ученый
Хардинг А.Е., Суини М.Г., Гован Г.Г., Риордан-Ева П. Анализ родословной в семьях наследственной оптической невропатии Лебера с патогенной мутацией mtdna. Am J Hum Genet. 1995. 57 (1): 77–86.
CAS PubMed PubMed Central Google ученый
Торрони А., Петроцци М., Д’Урбано Л., Селлитто Д., Зевиани М., Каррара Ф., Кардуччи С., Леуцци В., Карелли В., Барбони П., Де Негри А. и др. Гаплотипический и филогенетический анализ показывают, что один европейский специфический фон mtdna играет роль в выражении наследственной оптической невропатии Лебера, увеличивая пенетрантность первичных мутаций 11778 и 14484. Am J Hum Genet. 1997. 60 (5): 1107–21.
CAS PubMed PubMed Central Google ученый
Carelli V, Achilli A, Valentino ML, Rengo C, Semino O, Pala M, Olivieri A, Mattiazzi M, Pallotti F, Carrara F, Zeviani M и др. Эффекты гаплогруппы и рекомбинация митохондриальной ДНК: новые ключи к разгадке из анализа родословных наследственной оптической нейропатии Лебера. Am J Hum Genet. 2006. 78 (4): 564–74.
CAS PubMed PubMed Central Google ученый
Hudson G, Carelli V, Spruijt L, Gerards M, Mowbray C., Achilli A, Pyle A, Elson J, Howell N, La Morgia C., Valentino ML, et al.На клиническое проявление наследственной оптической нейропатии Лебера влияет фон митохондриальной ДНК-гаплогруппы. Am J Hum Genet. 2007. 81 (2): 228–33.
CAS PubMed PubMed Central Google ученый
Caporali L, Iommarini L, La Morgia C, Olivieri A, Achilli A, Maresca A, Valentino ML, Capristo M, Tagliavini F, Del Dotto V, Zanna C и др. Своеобразные комбинации индивидуально непатогенных миссенс-вариантов митохондриальной ДНК вызывают наследственную оптическую невропатию Лебера с низкой пенетрантностью.PLoS Genet. 2018; 14 (2): e1007210.
PubMed PubMed Central Google ученый
Jiang P, Jin X, Peng Y, Wang M, Liu H, Liu X, Zhang Z, Ji Y, Zhang J, Liang M, Zhao F, et al. Секвенирование экзома выявило мутацию в yars2, кодирующую митохондриальную тирозил-трина синтетазу, как ядерный модификатор фенотипического проявления мутации митохондриальной ДНК, связанной с наследственной оптической нейропатией Лебера. Hum Mol Genet.2016; 25 (3): 584–96.
CAS PubMed Google ученый
Yu J, Liang X, Ji Y, Ai C, Liu J, Zhu L, Nie Z, Jin X, Wang C, Zhang J, Zhao F и др. Prickle3, связанный с биогенезом атпазы, проявляется наследственной оптической невропатией Лебера. J Clin Invest. 2020; 130 (9): 4935–46.
CAS PubMed PubMed Central Google ученый
Bu XD, Rotter JI.Х-хромосомный и митохондриальный генный контроль наследственной оптической нейропатии Лебера: данные анализа сегрегации зависимости от инактивации Х-хромосомы. Proc Natl Acad Sci USA. 1991. 88 (18): 8198–202.
CAS PubMed Google ученый
Vilkki J, Ott J, Savontaus ML, Aula P, Nikoskelainen EK. Атрофия зрительного нерва при наследственной нейроретинопатии зрительного нерва, вероятно, определяется геном x-хромосомы, тесно связанным с dxs7.Am J Hum Genet. 1991. 48 (3): 486–91.
CAS PubMed PubMed Central Google ученый
Суини М.Г., Дэвис М.Б., Лэшвуд А., Брокингтон М., Тоскано А., Хардинг А.Е. Доказательства против x-сцепленного локуса, близкого к dxs7, определяющего предрасположенность к потере зрения в британских и итальянских семьях с наследственной оптической невропатией Лебера. Am J Hum Genet. 1992. 51 (4): 741–8.
CAS PubMed PubMed Central Google ученый
Pegoraro E, Carelli V, Zeviani M, Cortelli P, Montagna P, Barboni P, Angelini C, Hoffman EP. Паттерны Х-инактивации у пациентов с наследственной оптической невропатией Лебера у женщин не подтверждают сильную детерминанту, сцепленную с х-хромосомой. Am J Med Genet. 1996. 61 (4): 356–62.
CAS PubMed Google ученый
Hudson G, Keers S, Yu-Wai-Man P, Griffiths P, Huoponen K, Savontaus ML, Nikoskelainen E, Zeviani M, Carrara F, Horvath R, Karcagi V, et al.Идентификация локуса и гаплотипа x-хромосомы, модулирующих фенотип нарушения митохондриальной ДНК. Am J Hum Genet. 2005; 77 (6): 1086–91.
CAS PubMed PubMed Central Google ученый
Shankar SP, Fingert JH, Carelli V, Valentino ML, King TM, Daiger SP, Salomao SR, Berezovsky A, Belfort R Jr, Braun TA, Sheffield VC, et al. Доказательства нового локуса модификатора Х-сцепления для наследственной оптической невропатии Лебера.Ophthalmic Genet. 2008. 29 (1): 17–24.
CAS PubMed Google ученый
Rosenberg T, Norby S, Schwartz M, Saillard J, Magalhaes PJ, Leroy D, Kann EC, Duno M. Распространенность и генетика наследственной оптической невропатии Лебера в популяции Дании. Инвестируйте Ophthalmol Vis Sci. 2016; 57 (3): 1370–5.
CAS PubMed Google ученый
Ю-Вай-Ман П., Хадсон Дж., Клопсток Т., Чиннери П.Ф.Ответ: анализ различий в затронутых Лхоном: генетические триггеры по сравнению с факторами окружающей среды конверсии болезни. Головной мозг. 2016; 139 (Pt 3): e18.
PubMed Google ученый
Карелли В., Карбонелли М., де Ко И.Ф., Кавасаки А., Клопсток Т., Лагрез В.А., Ла Морджиа С., Ньюман, штат Нью-Джерси, Орссо С., Потт Дж. У. Р., Садун А. А. и др. Заявление о международном консенсусе по клиническому и терапевтическому лечению наследственной оптической нейропатии Лебера.J Neuroophthalmol. 2017; 37 (4): 371–81.
PubMed Google ученый
Барбони П., Савини Дж., Валентино М.Л., Монтанья П., Кортелли П., Де Негри А.М., Садун Ф, Бьянки С., Лонганези Л., Занини М., де Виво А. и др. Оценка слоя нервных волокон сетчатки с помощью оптической когерентной томографии при наследственной оптической невропатии Лебера. Офтальмология. 2005. 112 (1): 120–6.
PubMed Google ученый
Барбони П., Карбонелли М, Савини Дж., Рамос Кдо В., Карта А, Березовский А., Саломао С.Р., Карелли В., Садун А.А. Естественная история наследственной оптической нейропатии Лебера: продольный анализ слоя нервных волокон сетчатки с помощью оптической когерентной томографии. Офтальмология. 2010. 117 (3): 623–7.
PubMed Google ученый
Balducci N, Savini G, Cascavilla ML, La Morgia C, Triolo G, Giglio R, Carbonelli M, Parisi V, Sadun AA, Bandello F, Carelli V и др.Изменения макулярного нервного волокна и слоя ганглиозных клеток при острой наследственной оптической невропатии Лебера. Br J Ophthalmol. 2016; 100 (9): 1232–7.
PubMed Google ученый
Ньюман Н.Дж., Карелли В., Тайель М., Ю-Вай-Ман П. Визуальные результаты у пациентов с наследственной оптической невропатией leber с мутацией митохондриальной ДНК m.11778g> a (mtnd4). J Neuroophthalmol. 2020.
Hwang TJ, Karanjia R, Moraes-Filho MN, Gale J, Tran JS, Chu ER, Salomao SR, Berezovsky A, Belfort R Jr, Moraes MN, Sadun F, et al.Естественная история преобразования наследственной оптической нейропатии Лебера: серия проспективных случаев. Офтальмология. 2017; 124 (6): 843–50.
PubMed Google ученый
Ньюман Нью-Джерси, Биусе В. Наследственные оптические невропатии. Глаз (Лонд). 2004. 18 (11): 1144–60.
CAS Google ученый
Lenaers G, Hamel C, Delettre C, Amati-Bonneau P, Procaccio V, Bonneau D, Reynier P, Milea D.Доминирующая атрофия зрительного нерва. Orphanet J Rare Dis. 2012; 7: 46.
PubMed PubMed Central Google ученый
Александр С., Вотруба М., Пеш У. Э., Тизелтон Д. Л., Майер С., Мур А., Родригес М., Келлнер Ю., Лео-Коттлер Б., Обургер Г., Бхаттачарья С. С. и др. Opa1, кодирующий связанную с динамином gtpase, мутирует при аутосомно-доминантной атрофии зрительного нерва, связанной с хромосомой 3q28. Нат Жене. 2000. 26 (2): 211–5.
CAS PubMed Google ученый
Delettre C, Lenaers G, Griffoin JM, Gigarel N, Lorenzo C, Belenguer P, Pelloquin L, Grosgeorge J, Turc-Carel C, Perret E, Astarie-Dequeker C, et al. Ядерный ген opa1, кодирующий митохондриальный белок, связанный с динамином, мутирует при доминантной атрофии зрительного нерва. Нат Жене. 2000. 26 (2): 207–10.
CAS PubMed Google ученый
Ленаерс Дж., Рейнир П., Элачури Дж., Суккари С., Олихон А., Беленгер П., Барико Л., Дюкомман Б., Хамель К., Делеттр К.Opa1 функционирует в митохондриях и нарушает функцию зрительного нерва. Int J Biochem Cell Biol. 2009. 41 (10): 1866–74.
CAS PubMed Google ученый
Дель Дотто В., Фогазза М., Ленаерс Дж., Руголо М., Карелли В., Занна К. Опа1: что мы знаем, чтобы подойти к терапии? Pharmacol Res. 2018; 131: 199–210.
PubMed Google ученый
Pesch UE, Leo-Kottler B, Mayer S, Jurklies B, Kellner U, Apfelstedt-Sylla E, Zrenner E, Alexander C, Wissinger B.Мутации Opa1 у пациентов с аутосомно-доминантной атрофией зрительного нерва и доказательства полудоминантного наследования. Hum Mol Genet. 2001. 10 (13): 1359–68.
CAS PubMed Google ученый
Yu-Wai-Man P, Griffiths PG, Burke A, Sellar PW, Clarke MP, Gnanaraj L, Ah-Kine D, Hudson G, Czermin B., Taylor RW, Horvath R, et al. Распространенность и естественное течение доминантной атрофии зрительного нерва из-за мутаций opa1. Офтальмология. 2010; 117 (8): 1538–46 ( 1546 e1531 ).
PubMed PubMed Central Google ученый
Amati-Bonneau P, Odent S, Derrien C, Pasquier L, Malthiery Y, Reynier P, Bonneau D. Связь аутосомно-доминантной атрофии зрительного нерва и умеренной глухоты может быть связана с мутацией r445h в гене opa1 . Am J Ophthalmol. 2003. 136 (6): 1170–1.
CAS PubMed Google ученый
Пейн М., Янг З., Кац Б.Дж., Уорнер Дж. Э., Вайс С.Дж., Чжао Ю., Пирсон Э.Д., Трефт Р.Л., Хиллман Т., Кеннеди Р.Дж., Мейре Ф.М. и др.Доминирующая атрофия зрительного нерва, нейросенсорная тугоухость, птоз и офтальмоплегия: синдром, вызванный миссенс-мутацией в opa1. Am J Ophthalmol. 2004. 138 (5): 749–55.
CAS PubMed Google ученый
Amati-Bonneau P, Valentino ML, Reynier P, Gallardo ME, Bornstein B, Boissiere A, Campos Y, Rivera H, de la Aleja JG, Carroccia R, Iommarini L, et al. Мутации Opa1 вызывают нестабильность митохондриальной ДНК и фенотип «плюс» атрофии зрительного нерва.Головной мозг. 2008. 131 (Pt 2): 338–51.
PubMed Google ученый
Hudson G, Amati-Bonneau P, Blakely EL, Stewart JD, He L, Schaefer AM, Griffiths PG, Ahlqvist K, Suomalainen A, Reynier P, McFarland R, et al. Мутация opa1 вызывает доминантную атрофию зрительного нерва с внешней офтальмоплегией, атаксией, глухотой и множественными делециями митохондриальной ДНК: новое нарушение поддержания мтднк. Головной мозг. 2008. 131 (Pt 2): 329–37.
PubMed Google ученый
Ю-Вай-Ман П., Гриффитс П.Г., Горман Г.С., Лоуренко С.М., Райт А.Ф., Ауэр-Грумбах М., Тоскано А., Мусумечи О, Валентино М.Л., Капорали Л., Ламперти С. и др. Многосистемное неврологическое заболевание часто встречается у пациентов с мутациями opa1. Головной мозг. 2010. 133 (Pt 3): 771–86.
CAS PubMed PubMed Central Google ученый
Verny C, Loiseau D, Scherer C, Lejeune P, Chevrollier A, Gueguen N, Guillet V, Dubas F, Reynier P, Amati-Bonneau P, Bonneau D.Расстройство, подобное рассеянному склерозу, при аутосомно-доминантной атрофии зрительного нерва, связанной с опа1. Неврология. 2008. 70 (13 Pt 2): 1152–3.
CAS PubMed Google ученый
Marelli C, Amati-Bonneau P, Reynier P, Layet V, Layet A, Stevanin G, Brissaud E, Bonneau D, Durr A, Brice A. Гетерозиготные мутации opa1 при синдроме Бер. Головной мозг. 2011; 134 (Pt 4): e169 ( ответ автора e170 ).
PubMed Google ученый
Carelli V, Musumeci O, Caporali L, Zanna C, La Morgia C, Del Dotto V, Porcelli AM, Rugolo M, Valentino ML, Iommarini L, Maresca A и др. Синдромный паркинсонизм и деменция, связанные с миссенс-мутациями opa1. Энн Нейрол. 2015; 78 (1): 21–38.
CAS PubMed PubMed Central Google ученый
Lynch DS, Loh SHY, Harley J, Noyce AJ, Martins LM, Wood NW, Houlden H, Plun-Favreau H. Несиндромная болезнь Паркинсона в семье с аутосомно-доминантной атрофией зрительного нерва из-за мутаций opa1.Neurol Genet. 2017; 3 (5): e188.
CAS PubMed PubMed Central Google ученый
Schaaf CP, Blazo M, Lewis RA, Tonini RE, Takei H, Wang J, Wong LJ, Scaglia F. Ранний тяжелый нервно-мышечный фенотип, связанный с сложной гетерозиготностью по мутациям opa1. Mol Genet Metab. 2011. 103 (4): 383–7.
CAS PubMed Google ученый
Bonneau D, Colin E, Oca F, Ferre M, Chevrollier A, Gueguen N, Desquiret-Dumas V, N’Guyen S, Barth M, Zanlonghi X, Rio M и др.Синдром Бера с ранним началом из-за сложных гетерозиготных мутаций в opa1. Головной мозг. 2014; 137 (Pt 10): e301.
PubMed Google ученый
Карелли В., Сабателли М., Карроццо Р., Рицца Т., Шимпф С., Виссинджер Б., Занна С., Руголо М., Ла Морджиа С., Капорали Л., Карбонелли М. и др. «Синдром Бера» с гетерозиготными мутациями соединения opa1. Головной мозг. 2015; 138 (часть 1): e321.
PubMed Google ученый
Nasca A, Rizza T, Doimo M, Legati A, Ciolfi A, Diodato D, Calderan C, Carrara G, Lamantea E, Aiello C, Di Nottia M, et al. Не только доминантная, не только атрофия зрительного нерва: расширение клинического спектра, связанного с мутациями opa1. Orphanet J Rare Dis. 2017; 12 (1): 89.
PubMed PubMed Central Google ученый
Spiegel R, Saada A, Flannery PJ, Burte F, Soiferman D, Khayat M, Eisner V, Vladovski E, Taylor RW, Bindoff LA, Shaag A, et al.Смертельная детская митохондриальная энцефаломиопатия, гипертрофическая кардиомиопатия и атрофия зрительного нерва, связанные с гомозиготной мутацией opa1. J Med Genet. 2016; 53 (2): 127–31.
CAS PubMed Google ученый
Rubegni A, Pisano T, Bacci G, Tessa A, Battini R, Procopio E, Giglio S, Pasquariello R, Santorelli FM, Guerrini R, Nesti C. Leigh-like особенности нейровизуализации, связанные с новыми двуаллельными мутациями в опа1. Eur J Paediatr Neurol.2017; 21 (4): 671–7.
PubMed Google ученый
Ю-Вай-Ман П., Бейли М., Атаван А., Чинери П.Ф., Гриффитс П.Г. Характер потери ганглиозных клеток сетчатки при доминантной атрофии зрительного нерва из-за мутаций opa1. Глаз (Лонд). 2011; 25 (5): 596–602.
CAS Google ученый
Chevrollier A, Guillet V, Loiseau D, Gueguen N, de Crescenzo MA, Verny C, Ferre M, Dollfus H, Odent S, Milea D, Goizet C, et al.Наследственные оптические невропатии имеют общий дефект митохондриальной связи. Энн Нейрол. 2008. 63 (6): 794–8.
PubMed Google ученый
Занна С., Гелли А., Порчелли А.М., Карбовски М., Юле Р.Дж., Шимпф С., Виссинджер Б., Пинти М., Коссарицца А., Видони С., Валентино М.Л. и др. Мутации Opa1, связанные с доминантной атрофией зрительного нерва, нарушают окислительное фосфорилирование и митохондриальное слияние. Головной мозг. 2008. 131 (Pt 2): 352–67.
PubMed Google ученый
Frezza C, Cipolat S, Martins de Brito O, Micaroni M, Beznoussenko GV, Rudka T, Bartoli D, Polishuck RS, Danial NN, De Strooper B, Scorrano L. Opa1 контролирует ремоделирование апоптотических крист независимо от слияния митохондрий. Клетка. 2006. 126 (1): 177–89.
CAS PubMed Google ученый
Гербер С., Динг М.Г., Джерард Х, Цвикер К., Занлонги Х, Рио М, Серре В., Ханеин С., Мюнхен А, Ротиг А, Бьянки Л. и др. Сложная гетерозиготность по тяжелым и гипоморфным мутациям ndufs2 вызывает несиндромальную Lhon-подобную оптическую невропатию.J Med Genet. 2017; 54 (5): 346–56.
CAS PubMed Google ученый
Hanein S, Perrault I, Roche O, Gerber S, Khadom N, Rio M, Boddaert N, Jean-Pierre M, Brahimi N, Serre V, Chretien D, et al. Tmem126a, кодирующий митохондриальный белок, мутирует при аутосомно-рецессивной несиндромной атрофии зрительного нерва. Am J Hum Genet. 2009. 84 (4): 493–8.
CAS PubMed PubMed Central Google ученый
Ла Морджиа C, Капорали Л., Тальявини Ф., Паломбо Ф., Карбонелли М., Лигуори Р., Барбони П., Карелли В. Первая миссенс-мутация tmem126a у итальянского пробанда с атрофией зрительного нерва и глухотой. Neurol Genet. 2019; 5 (3): e329.
PubMed PubMed Central Google ученый
Анжебо С., Гишет П.О., Талмат-Амар Y, Шариф М., Гербер С., Фарес-Тайе Л., Геген Н., Халлой Ф., Мур Д., Амати-Бонно П., Манес Г. и др. Рецессивные мутации в rtn4ip1 вызывают изолированные и синдромальные нейропатии зрительного нерва.Am J Hum Genet. 2015; 97 (5): 754–60.
CAS PubMed PubMed Central Google ученый
Чариф М., Наска А., Томпсон К., Гербер С., Маковски С., Мазахери Н., Брис К., Гуденеж Д., Легати А., Марофиан Р., Шариати Г. и др. Неврологические фенотипы, связанные с мутациями в rtn4ip1 (opa10) у детей и молодых людей. JAMA Neurol. 2018; 75 (1): 105–13.
PubMed Google ученый
Абрамс AJ, Hufnagel RB, Rebelo A, Zanna C, Patel N, Gonzalez MA, Campeanu IJ, Griffin LB, Groenewald S, Strickland AV, Tao F, et al. Мутации в slc25a46, кодирующем ugo1-подобный белок, вызывают расстройство спектра атрофии зрительного нерва. Нат Жене. 2015; 47 (8): 926–32.
CAS PubMed PubMed Central Google ученый
Методиев М.Д., Гербер С., Хуберт Л., Делаходде А., Кретьен Д., Жерар Х, Амати-Бонно П., Джакомотто М.С., Боддерт Н., Каминска А., Дегер И. и др.Мутации в ферменте цикла трикарбоновых кислот, аконитазе 2, вызывают либо изолированную, либо синдромную оптическую невропатию с энцефалопатией и атрофией мозжечка. J Med Genet. 2014; 51 (12): 834–8.
CAS PubMed Google ученый
Hartmann B, Wai T, Hu H, MacVicar T., Musante L, Fischer-Zirnsak B., Stenzel W., Graf R, van den Heuvel L, Ropers HH, Wienker TF, et al. Гомозиготная мутация yme1l1 вызывает митохондриопатию с атрофией зрительного нерва и фрагментацией митохондриальной сети.Элиф. 2016; 5: e16078.
PubMed PubMed Central Google ученый
Klebe S, Depienne C, Gerber S, Challe G, Anheim M, Charles P, Fedirko E, Lejeune E, Cottineau J, Brusco A, Dollfus H, et al. Ген 7 спастической параплегии у пациентов со спастичностью и / или оптической нейропатией. Головной мозг. 2012; 135 (Pt 10): 2980–93.
PubMed PubMed Central Google ученый
Caporali L, Magri S, Legati A, Del Dotto V, Tagliavini F, Balistreri F, Nasca A, La Morgia C, Carbonelli M, Valentino ML, Lamantea E, et al. Мутации домена атпазы afg3l2 изменяют процессинг opa1 и вызывают оптическую невропатию. Энн Нейрол. 2020; 88 (1): 18–32.
CAS PubMed PubMed Central Google ученый
Шариф М., Шевроллье А., Геген Н., Брис С., Гуденеж Д., Дескирет-Дюма В., Леруес С., Колин Е., Менье А., Виньял С., Смирнов В. и др.Мутации в протеазах m-aaa afg3l2 и spg7 вызывают изолированную доминантную атрофию зрительного нерва. Neurol Genet. 2020; 6 (3): e428.
CAS PubMed PubMed Central Google ученый
Orsucci D, Ienco EC, Siciliano G, Mancuso M. Митохондриальные расстройства и лекарства: что должен знать каждый врач. Контекст наркотиков. 2019; 8: 212588.
PubMed PubMed Central Google ученый
Mantle D, Dybring A. Биодоступность кофермента q10: обзор процесса абсорбции и последующего метаболизма. Антиоксиданты (Базель). 2020; 9 (5): 386.
CAS Google ученый
Гловер Э.И., Мартин Дж., Махер А., Торнхилл Р.Э., Моран Г.Р., Тарнопольский М.А. Рандомизированное исследование коэнзима q10 при митохондриальных нарушениях. Мышечный нерв. 2010. 42 (5): 739–48.
CAS PubMed Google ученый
Huang CC, Kuo HC, Chu CC, Kao LY. Быстрое восстановление зрения после лечения наследственной оптической нейропатии Лебера коэнзимом q10. J Neuroophthalmol. 2002; 22 (1): 66.
PubMed Google ученый
Тарнопольский М.А. Митохондриальный коктейль: обоснование комбинированной нутрицевтической терапии при митохондриальных цитопатиях. Adv Drug Deliv Rev. 2008; 60 (13–14): 1561–7.
CAS PubMed Google ученый
Родригес М.С., Макдональд-младший, Махони DJ, Париз Дж., Бил М.Ф., Тарнопольский М.А. Благоприятные эффекты креатина, coq10 и липоевой кислоты при митохондриальных нарушениях. Мышечный нерв. 2007. 35 (2): 235–42.
CAS PubMed Google ученый
Beyrath J, Pellegrini M, Renkema H, Houben L, Pecheritsyna S, van Zandvoort P, van den Broek P, Bekel A, Eftekhari P, Smeitink JAM. Kh276 защищает митохондриальные больные клетки от вызванной окислительно-восстановительным стрессом гибели клеток, взаимодействуя с механизмом тиоредоксиновой системы / фермента пероксиредоксина.Научный доклад 2018; 8 (1): 6577.
PubMed PubMed Central Google ученый
Haefeli RH, Erb M, Gemperli AC, Robay D, Courdier Fruh I, Anklin C, Dallmann R, Gueven N. Nqo1-зависимый окислительно-восстановительный цикл идебенона: влияние на окислительно-восстановительный потенциал клеток и уровни энергии. PLoS ONE. 2011; 6 (3): e17963.
CAS PubMed PubMed Central Google ученый
Гелли А., Дегли Эспости М., Карелли В., Леназ Г. Изменения активности митохондриального комплекса i и сайта связывания кофермента q при наследственной оптической невропатии Лебера (Lhon). Мол Аспекты Мед. 1997; 18 (Дополнение): S263-267.
PubMed Google ученый
Varricchio C, Beirne K, Heard C, Newland B, Rozanowska M, Brancale A, Votruba M. Инь и ян идебенона: не слишком мало, не слишком много — гибель клеток в клетках с дефицитом nqo1 и сетчатка мыши.Free Radic Biol Med. 2020; 152: 551–60.
CAS PubMed Google ученый
Джабер С.М., Ге SX, Мильштейн Дж. Л., Ван Ризин Дж. В., Уодделл Дж., Польстер Б. М.. Идебенон оказывает различное влияние на митохондриальное дыхание в корковых астроцитах по сравнению с корковыми нейронами из-за различной активности nqo1. J Neurosci. 2020; 40 (23): 4609–19.
CAS PubMed PubMed Central Google ученый
Джорджио В., Петронилли В., Гелли А., Карелли В., Руголо М., Леназ Г., Бернарди П. Влияние идебенона на биоэнергетику митохондрий. Biochim Biophys Acta. 2012; 1817 (2): 363–9.
CAS PubMed PubMed Central Google ученый
Yu-Wai-Man P, Soiferman D, Moore DG, Burte F, Saada A. Оценка терапевтического потенциала идебенона и родственных аналогов хинона при наследственной оптической невропатии leber. Митохондрия.2017; 36: 36–42.
CAS PubMed PubMed Central Google ученый
Heitz FD, Erb M, Anklin C, Robay D, Pernet V, Gueven N. Idebenone защищает от повреждения сетчатки и потери зрения на мышиной модели наследственной оптической невропатии Лебера. PLoS ONE. 2012; 7 (9): e45182.
CAS PubMed PubMed Central Google ученый
Куц К., Древе Дж., Ванкан П.Фармакокинетические свойства и метаболизм идебенона. J Neurol. 2009; 256 (Приложение 1): 31–5.
CAS PubMed Google ученый
Клопшток Т., Мец Дж., Ю-Вай-Ман П., Бюхнер Б., Галленмюллер К., Бейли М., Нвали Н., Гриффитс П. Г., фон Ливониус Б., Резничек Л., Роуло Дж. И др. Сохранение лечебного эффекта идебенона при наследственной оптической нейропатии Лебера. Головной мозг. 2013; 136 (часть 2): e230.
CAS PubMed PubMed Central Google ученый
Катарино С.Б., фон Ливониус Б., Приглингер С., Баник Р., Матлоб С., Тамханкар М.А., Кастильо Л., Фридбург С., Халфпенни, Калифорния, Линкольн Дж. А., Трабер Г.Л. и др. Реальный клинический опыт применения идебенона в лечении наследственной оптической нейропатии Лебера. J Neuroophthalmol. 2020.
Baracca A, Solaini G, Sgarbi G, Lenaz G, Baruzzi A, Schapira AH, Martinuzzi A, Carelli V. Тяжелое нарушение комплексного синтеза аденозинтрифосфата, управляемого i, в кибридах с наследственной оптической невропатией Leber.Arch Neurol. 2005. 62 (5): 730–6.
PubMed Google ученый
Tang S, Le PK, Tse S, Wallace DC, Huang T. Гетерозиготная мутация opa1 у дрозофилы укорачивает продолжительность жизни за счет увеличения продукции активных форм кислорода. PLoS ONE. 2009; 4 (2): e4492.
PubMed PubMed Central Google ученый
Ярош В., Монсеррат Дж., Тонг Дж. Дж., Цзе С., Ле ПК, Нгуен К., Брахманн С.Б., Уоллес, округ Колумбия, Хуанг Т.Молекулярные механизмы опа-1-опосредованной атрофии зрительного нерва на модели дрозофилы и перспективы лечения антиоксидантами. PLoS Genet. 2008; 4 (1): e6.
PubMed PubMed Central Google ученый
Millet AM, Bertholet AM, Daloyau M, Reynier P, Galinier A, Devin A, Wissinguer B, Belenguer P, Davezac N. Потеря функционального opa1 нарушает окислительно-восстановительное состояние: последствия в патогенезе доминирующей оптической атрофии. Энн Клин Перевод Нейрол.2016; 3 (6): 408–21.
CAS PubMed PubMed Central Google ученый
Smith TG, Seto S, Ganne P, Votruba M. Рандомизированное плацебо-контролируемое испытание бензохинона идебенона на мышиной модели доминантной оптической атрофии, связанной с opa1, выявило ограниченный терапевтический эффект на дендропатию ганглиозных клеток сетчатки и зрительная функция. Неврология. 2016; 319: 92–106.
CAS PubMed Google ученый
Williams PA, Morgan JE, Votruba M. Дефицит Opa1 в мышиной модели доминантной атрофии зрительного нерва приводит к дендропатии ганглиозных клеток сетчатки. Головной мозг. 2010. 133 (10): 2942–51.
PubMed Google ученый
Шрейдер В.Д., Амагата А., Барнс А., Эннс Г.М., Хинман А., Янковски О., Хейфец В., Комацузаки Р., Ли Е., Моллард П., Мурас К. и др. Альфа-токотриенолхинон модулирует реакцию на окислительный стресс и биохимию старения.Bioorg Med Chem Lett. 2011. 21 (12): 3693–8.
CAS PubMed Google ученый
Зесевич Т., Салеми Дж. Л., Перлман С., Салливан К. Л., Шоу Дж. Д., Хуанг И., Айзекс К., Гуч С., Линч Д. Р., Кляйн МБ. Двойное слепое рандомизированное контролируемое исследование эпи-743 при атаксии Фридрейха. Neurodegener Dis Manag. 2018; 8 (4): 233–42.
PubMed Google ученый
Фортуна Ф, Барбони П., Лигуори Р., Валентино М.Л., Савини Дж., Геллера С., Мариотти С., Риццо Дж., Тонон С., Маннерс Д., Лоди Р. и др.Поражение зрительной системы у пациентов с атаксией Фридрейха. Головной мозг. 2009. 132 (Pt 1): 116–23.
PubMed Google ученый
Szeto HH. Первое в своем классе кардиолипин-защитное соединение в качестве лечебного средства для восстановления биоэнергетики митохондрий. Br J Pharmacol. 2014. 171 (8): 2029–2050.
CAS PubMed PubMed Central Google ученый
Даум Г.Липиды митохондрий. Biochim Biophys Acta. 1985; 822 (1): 1–42.
CAS PubMed Google ученый
Милейковская Е., Доухан В. Кардиолипин-зависимое образование митохондриальных респираторных суперкомплексов. Chem Phys Lipids. 2014; 179: 42–8.
CAS PubMed Google ученый
Караа А., Хаас Р., Гольдштейн А., Фокли Дж., Уивер В. Д., Коэн Б. Х.Рандомизированное исследование повышения дозы эламипретида у взрослых с первичной митохондриальной миопатией. Неврология. 2018; 90 (14): e1212–21.
CAS PubMed PubMed Central Google ученый
Leruez S, Verny C, Bonneau D, Procaccio V, Lenaers G, Amati-Bonneau P, Reynier P, Scherer C, Prundean A, Orssaud C, Zanlonghi X и др. Циклоспорин А не предотвращает поражение второго глаза при наследственной оптической невропатии Лебера. Orphanet J Rare Dis.2018; 13 (1): 33.
PubMed PubMed Central Google ученый
Eells JT, Wong-Riley MT, VerHoeve J, Henry M, Buchman EV, Kane MP, Gould LJ, Das R, Jett M, Hodgson BD, Margolis D, et al. Передача митохондриального сигнала при ускоренном заживлении ран и сетчатки с помощью терапии ближним инфракрасным светом. Митохондрия. 2004. 4 (5–6): 559–67.
CAS PubMed Google ученый
Гарафало А. В., Чидесиян А. В., Хеон Э., Шеплок Р., Пирсон А., Ю. К. В., Сумарока А., Агирре Г. Д., Якобсон С. Г.. Прогресс в лечении наследственных заболеваний сетчатки: ранние клинические испытания субретинальной генной терапии и кандидаты для будущих инициатив. Prog Retin Eye Res. 2019; 77: 100827.
PubMed Google ученый
Yu H, Koilkonda RD, Chou TH, Porciatti V, Ozdemir SS, Chiodo V, Boye SL, Boye SE, Hauswirth WW, Lewin AS, Guy J.Доставка гена в митохондрии путем нацеливания на модифицированный аденоассоциированный вирус подавляет наследственную оптическую невропатию Лебера на мышиной модели. Proc Natl Acad Sci USA. 2012; 109 (20): E1238-1247.
CAS PubMed Google ученый
Yu H, Koilkonda RD, Chou TH, Porciatti V, Mehta A, Hentall ID, Chiodo VA, Boye SL, Hauswirth WW, Lewin AS, Guy J. Последствия инъекции зиготы и переноса зародышевой линии мутантных митохондрий человека ДНК мышей.Proc Natl Acad Sci USA. 2015; 112 (42): E5689-5698.
CAS PubMed Google ученый
Ван Г., Шимада Э., Чжан Дж., Хун Дж. С., Смит Г. М., Тейтелл М. А., Келер К. М.. Коррекция митохондриальных мутаций человека с помощью целевого импорта РНК. Proc Natl Acad Sci USA. 2012. 109 (13): 4840–5.
CAS PubMed Google ученый
Gammage PA, Moraes CT, Minczuk M.Инженерия митохондриального генома: революция не может быть критичной. Тенденции Genet. 2018; 34 (2): 101–10.
CAS PubMed PubMed Central Google ученый
Mok BY, de Moraes MH, Zeng J, Bosch DE, Kotrys AV, Raguram A, Hsu F, Radey MC, Peterson SB, Mootha VK, Mougous JD, et al. Бактериальный токсин цитидиндезаминазы обеспечивает редактирование митохондриальных оснований без кристально чистых оснований. Природа. 2020; 583 (7817): 631–7.
CAS PubMed PubMed Central Google ученый
Gray RE, Law RH, Devenish RJ, Nagley P. Аллотопная экспрессия митохондриальных генов атр-синтазы в ядре Saccharomyces cerevisiae . Методы Энзимол. 1996; 264: 369–89.
CAS PubMed Google ученый
Roucou X, Artika IM, Devenish RJ, Nagley P. Биоэнергетические и структурные последствия аллотопной экспрессии субъединицы 8 митохондриальной атр-синтазы дрожжей. Гидрофобный характер остатков 23 и 24 важен для максимальной активности и структурной стабильности ферментного комплекса.Eur J Biochem. 1999. 261 (2): 444–51.
CAS PubMed Google ученый
de Gray AD. Митохондриальная генная терапия: арена биомедицинского использования интеинов. Trends Biotechnol. 2000. 18 (9): 394–9.
PubMed Google ученый
Zullo SJ. Генная терапия мутаций митохондриальной ДНК: краткая, предвзятая история аллотопной экспрессии в клетках млекопитающих.Semin Neurol. 2001. 21 (3): 327–35.
CAS PubMed Google ученый
Манфреди Дж., Фу Дж., Оджаими Дж., Сэдлок Дж. Э., Квонг Дж. К., Гай Дж, Шон Э. А.. Устранение дефицита синтеза атр путем переноса в ядро гена, кодируемого митохондриальной ДНК, mtatp6. Нат Жене. 2002. 30 (4): 394–9.
CAS PubMed Google ученый
Oca-Cossio J, Kenyon L, Hao H, Moraes CT.Ограничения аллотопной экспрессии митохондриальных генов в клетках млекопитающих. Генетика. 2003. 165 (2): 707–20.
CAS PubMed PubMed Central Google ученый
Пералес-Клементе Э., Фернандес-Сильва П., Ацин-Перес Р., Перес-Мартос А., Энрикес Дж. А.. Аллотопная экспрессия кодируемых митохондриями генов у млекопитающих: достигнутая цель, недоказанный механизм или невыполнимая задача? Nucleic Acids Res. 2011. 39 (1): 225–34.
CAS PubMed Google ученый
Фигероа-Мартинес Ф., Васкес-Асеведо М., Кортес-Эрнандес П., Гарсия-Трехо Дж. Дж., Дэвидсон Э., Кинг М. П., Гонсалес-Хальфен Д. Что ограничивает аллотопную экспрессию кодируемых ядром митохондриальных генов? Случай химерных генов cox3 и atp6. Митохондрия. 2011; 11 (1): 147–54.
CAS PubMed Google ученый
Bonnet C, Kaltimbacher V, Ellouze S, Augustin S, Benit P, Forster V, Rustin P, Sahel JA, Corral-Debrinski M.Локализация аллотопной мРНК на поверхности митохондрий устраняет дефекты дыхательной цепи в фибробластах, несущих мутации митохондриальной ДНК, затрагивающие комплексные i или v субъединицы. Rejuvenation Res. 2007. 10 (2): 127–44.
CAS PubMed Google ученый
Bonnet C, Augustin S, Ellouze S, Benit P, Bouaita A, Rustin P, Sahel JA, Corral-Debrinski M. Оптимизированная аллотопическая экспрессия генов nd1 или nd4 восстанавливает активность комплекса дыхательной цепи i в фибробластах, содержащих мутации в этих генах.Biochim Biophys Acta. 2008; 1783 (10): 1707–17.
CAS PubMed Google ученый
Pei H, Wan X, Hu W., Dong X, Li B. Создание и обнаружение нового типа рекомбинантного человеческого raav2 / 2-nd4. Eye Sci. 2013. 28 (2): 55–9.
CAS PubMed Google ученый
Караарслан К. Наследственная оптическая нейропатия Лебера как многообещающее заболевание для развития генной терапии.Adv Ther. 2019; 36 (12): 3299–307.
CAS PubMed PubMed Central Google ученый
Qi X, Sun L, Lewin AS, Hauswirth WW, Guy J. Мутантная человеческая субъединица nd4 комплекса i вызывает оптическую невропатию у мышей. Инвестируйте Ophthalmol Vis Sci. 2007. 48 (1): 1–10.
PubMed Google ученый
Ellouze S, Augustin S, Bouaita A, Bonnet C, Simonutti M, Forster V, Picaud S, Sahel JA, Corral-Debrinski M.Оптимизированная аллотопная экспрессия митохондриального nd4 человека предотвращает слепоту на крысиной модели митохондриальной дисфункции. Am J Hum Genet. 2008. 83 (3): 373–87.
CAS PubMed PubMed Central Google ученый
Koilkonda RD, Chou TH, Porciatti V, Hauswirth WW, Guy J. Индукция быстрой и высокоэффективной экспрессии субъединицы i-го комплекса nd4 человека в зрительной системе мыши с помощью самокомплементарного аденоассоциированного вируса.Arch Ophthalmol. 2010. 128 (7): 876–83.
CAS PubMed PubMed Central Google ученый
Cwerman-Thibault H, Augustin S, Lechauve C, Ayache J, Ellouze S, Sahel JA, Corral-Debrinski M. Ядерная экспрессия митохондриального nd4 приводит к сборке белка в комплексе i и предотвращает атрофию зрительного нерва и зрение. потеря. Mol Ther Methods Clin Dev. 2015; 2: 15003.
CAS PubMed PubMed Central Google ученый
Koilkonda R, Yu H, Talla V, Porciatti V, Feuer WJ, Hauswirth WW, Chiodo V, Erger KE, Boye SL, Lewin AS, Conlon TJ и др. Вектор генной терапии Lhon предотвращает потерю зрения и оптическую невропатию, вызванную мутантной митохондриальной ДНК g11778a: биораспределение и токсикологический профиль. Инвестируйте Ophthalmol Vis Sci. 2014; 55 (12): 7739–53.
CAS PubMed PubMed Central Google ученый
Lin CS, Sharpley MS, Fan W, Waymire KG, Sadun AA, Carelli V, Ross-Cisneros FN, Baciu P, Sung E, McManus MJ, Pan BX, et al.Мышиная мутантная модель наследственной оптической нейропатии Лебера по mtdna. Proc Natl Acad Sci USA. 2012; 109 (49): 20065–70.
CAS PubMed Google ученый
Barrientos A, Kenyon L, Moraes CT. Ксеномитохондриальные кибриды человека. Клеточные модели дефицита митохондриального комплекса i. J Biol Chem. 1998. 273 (23): 14210–7.
CAS PubMed Google ученый
Feuer WJ, Schiffman JC, Davis JL, Porciatti V, Gonzalez P, Koilkonda RD, Yuan H, Lalwani A, Lam BL, Guy J.Генная терапия наследственной оптической нейропатии Лебера: первые результаты. Офтальмология. 2016; 123 (3): 558–70.
PubMed Google ученый
Guy J, Feuer WJ, Davis JL, Porciatti V, Gonzalez PJ, Koilkonda RD, Yuan H, Hauswirth WW, Lam BL. Генная терапия наследственной оптической нейропатии Лебера: визуальные результаты при низких и средних дозах. Офтальмология. 2017; 124 (11): 1621–34.
PubMed PubMed Central Google ученый
Lam BL, Feuer WJ, Schiffman JC, Porciatti V, Vandenbroucke R, Rosa PR, Gregori G, Guy J. Конечные точки испытаний и естественный анамнез у пациентов с наследственной оптической невропатией g11778a leber: подготовка к клиническому испытанию генной терапии. JAMA Ophthalmol. 2014. 132 (4): 428–36.
PubMed PubMed Central Google ученый
Чжан Ю, Юань Дж.Дж., Лю Х.Л., Тянь З., Лю С.В., Ли Б. Три случая наследственной оптической невропатии Лебера с быстрым увеличением остроты зрения после генной терапии.Curr Gene Ther. 2019; 19 (2): 134–8.
CAS PubMed PubMed Central Google ученый
Yang S, Ma SQ, Wan X, He H, Pei H, Zhao MJ, Chen C, Wang DW, Dong XY, Yuan JJ, Li B. Долгосрочные результаты генной терапии для лечения наследственная оптическая нейропатия Лебера. EBioMedicine. 2016; 10: 258–68.
PubMed PubMed Central Google ученый
Zhang Y, Li X, Yuan J, Tian Z, Liu H, Wang D, Li B. Факторы прогноза остроты зрения у пациентов с наследственной оптической невропатией Лебера после генной терапии raav2-nd4. Clin Exp Ophthalmol. 2019; 47 (6): 774–8.
PubMed PubMed Central Google ученый
Liu HL, Yuan JJ, Zhang Y, Tian Z, Li X, Wang D, Du YY, Song L, Li B. Факторы, связанные с быстрым улучшением остроты зрения у пациентов с наследственной оптической невропатией Лебера после гена терапия.Acta Ophthalmol. 2020; 98 (6): e730–3.
CAS PubMed Google ученый
Виньял С., Урецкий С., Фитусси С., Гали А., Блуин Л., Гирменс Дж. Ф., Бидо С., Томассон Н., Букет С, Валеро С., Менье С. и др. Безопасность генной терапии raav2 / 2-nd4 при наследственной оптической нейропатии Лебера. Офтальмология. 2018; 125 (6): 945–7.
PubMed Google ученый
Weiss JN, Levy S.Исследование лечения офтальмологии стволовыми клетками (шотландцы): стволовые клетки костного мозга в лечении доминантной атрофии зрительного нерва. Stem Cell Investig. 2019; 6: 41.
CAS PubMed PubMed Central Google ученый
Джонсон Т.В., Бык Н.Д., Хант Д.П., Марина Н., Томарев С.И., Мартин К.Р. Нейропротективные эффекты интравитреальной трансплантации мезенхимальных стволовых клеток при экспериментальной глаукоме. Инвестируйте Ophthalmol Vis Sci. 2010. 51 (4): 2051–9.
PubMed PubMed Central Google ученый
Levkovitch-Verbin H, Sadan O, Vander S, Rosner M, Barhum Y, Melamed E, Offen D, Melamed S. Интравитреальные инъекции нейротрофических факторов, секретирующих мезенхимальные стволовые клетки, оказывают нейрозащитное действие в глазах крыс после перерезки зрительного нерва . Инвестируйте Ophthalmol Vis Sci. 2010. 51 (12): 6394–400.
PubMed Google ученый
Yu S, Tanabe T, Dezawa M, Ishikawa H, Yoshimura N. Эффекты инъекции стромальных клеток костного мозга в экспериментальной модели глаукомы. Biochem Biophys Res Commun. 2006. 344 (4): 1071–9.
CAS PubMed Google ученый
Li N, Li XR, Yuan JQ. Эффекты мезенхимальных стволовых клеток костного мозга, трансплантированных в полость стекловидного тела крысы, поврежденной ишемией / реперфузией. Graefes Arch Clin Exp Ophthalmol. 2009. 247 (4): 503–14.
PubMed Google ученый
Zhao T, Li Y, Tang L, Li Y, Fan F, Jiang B. Защитные эффекты интравитреальной трансплантации стволовых клеток пуповинной крови человека против повреждения зрительного нерва у крыс. Graefes Arch Clin Exp Ophthalmol. 2011. 249 (7): 1021–8.
PubMed Google ученый
Zwart I, Hill AJ, Al-Allaf F, Shah M, Girdlestone J, Sanusi AB, Mehmet H, Navarrete R, Navarrete C, Jen LS.Мезенхимальные стромальные клетки пуповинной крови обладают нейропротективным действием и способствуют регенерации на модели зрительного тракта крысы. Exp Neurol. 2009. 216 (2): 439–48.
PubMed Google ученый
Лопес Санчес М.И., Кроустон Дж.Г., Макки Д.А., Траунс И.А. Новые митохондриальные терапевтические мишени при оптических невропатиях. Pharmacol Ther. 2016; 165: 132–52.
CAS PubMed Google ученый
Johnson TV, DeKorver NW, Levasseur VA, Osborne A, Tassoni A, Lorber B, Heller JP, Villasmil R, Bull ND, Martin KR, Tomarev SI. Идентификация нейропротекции ганглиозных клеток сетчатки, обеспечиваемой фактором роста тромбоцитов, посредством анализа секретома мезенхимальных стволовых клеток. Головной мозг. 2014; 137 (Pt 2): 503–19.
PubMed Google ученый
Weiss JN, Levy S, Benes SC. Исследование лечения стволовыми клетками в офтальмологии (шотландцы): стволовые клетки костного мозга в лечении наследственной оптической невропатии Лебера.Neural Regen Res. 2016; 11 (10): 1685–94.
PubMed PubMed Central Google ученый
Liu K, Ji K, Guo L, Wu W, Lu H, Shan P, Yan C. Мезенхимальные стволовые клетки спасают поврежденные эндотелиальные клетки в модели ишемии-реперфузии in vitro посредством туннелирования нанотрубок, подобных структурно-опосредованным митохондриям. передача. Microvasc Res. 2014; 92: 10–8.
CAS PubMed Google ученый
Лю К., Го Л., Чжоу З., Пань М., Ян С. Мезенхимальные стволовые клетки переносят митохондрии в микрососуды головного мозга и способствуют восстановлению после ишемического инсульта. Microvasc Res. 2019; 123: 74–80.
CAS PubMed Google ученый
Doudna JA. Перспективы и проблемы терапевтического редактирования генома. Природа. 2020; 578 (7794): 229–36.
CAS PubMed Google ученый
Naso MF, Tomkowicz B, Perry WL 3rd, Strohl WR. Аденоассоциированный вирус (aav) как вектор для генной терапии. BioDrugs. 2017; 31 (4): 317–34.
CAS PubMed PubMed Central Google ученый
Civiletto G, Varanita T, Cerutti R, Gorletta T, Barbaro S, Marchet S, Lamperti C, Viscomi C, Scorrano L, Zeviani M. Сверхэкспрессия Opa1 улучшает фенотип двух моделей митохондриальных болезней мыши. Cell Metab. 2015; 21 (6): 845–54.
CAS PubMed PubMed Central Google ученый
Варанита Т., Сориано М.Э., Романелло В., Заглия Т., Кинтана-Кабрера Р., Семензато М., Менабо Р., Коста В., Сивилетто Г., Пеше П., Вискоми С. и др. Опа1-зависимый путь ремоделирования митохондриальных крист контролирует атрофическое, апоптотическое и ишемическое повреждение ткани. Cell Metab. 2015; 21 (6): 834–44.
CAS PubMed PubMed Central Google ученый
Del Dotto V, Mishra P, Vidoni S, Fogazza M, Maresca A, Caporali L, McCaffery JM, Cappelletti M, Baruffini E, Lenaers G, Chan D, et al. Изоформы Opa1 в иерархической организации митохондриальных функций. Cell Rep., 2017; 19 (12): 2557–71.
PubMed Google ученый
Алави М.В., Бетте С., Шимпф С., Шуэттауф Ф., Шраермейер У., Верл Х.Ф., Руттигер Л., Бек С.К., Тонагель Ф., Пихлер Б.Дж., Книппер М. и др. Мутация сайта сплайсинга в гене opa1 мыши свидетельствует о патологии аутосомно-доминантной атрофии зрительного нерва.Головной мозг. 2007. 130 (Pt 4): 1029–42.
PubMed Google ученый
Davies VJ, Hollins AJ, Piechota MJ, Yip W, Davies JR, White KE, Nicols PP, Boulton ME, Votruba M. Дефицит Opa1 на мышиной модели аутосомно-доминантной атрофии зрительного нерва нарушает морфологию митохондрий, зрительный нерв структура и зрительная функция. Hum Mol Genet. 2007. 16 (11): 1307–18.
CAS PubMed Google ученый
Sarzi E, Angebault C, Seveno M, Gueguen N, Chaix B, Bielicki G, Boddaert N, Mausset-Bonnefont AL, Cazevieille C, Rigau V, Renou JP, et al. Мутация человека opa1delttag вызывает преждевременную возрастную системную нейродегенерацию у мышей. Головной мозг. 2012. 135 (Pt 12): 3599–613.
PubMed Google ученый
Занинелло М., Паликарас К., Наон Д., Ивата К., Херкенн С., Кинтана-Кабрера Р., Семензато М., Греспи Ф., Росс-Сиснерос Ф.Н., Карелли В., Садун А.А. и др.Подавление аутофагии снижает потерю зрения на модели аутосомно-доминантной атрофии зрительного нерва. Nat Commun. 2020; 11 (1): 4029.
CAS PubMed PubMed Central Google ученый
Srivastava S, Moraes CT. Манипулирование гетероплазмией митохондриальной ДНК с помощью митохондриально направленной эндонуклеазы рестрикции. Hum Mol Genet. 2001. 10 (26): 3093–9.
CAS PubMed Google ученый
Байона-Бафалуй, член парламента, Блитс Б., Баттерсби Б.Дж., Шубридж Е.А., Мораес, Коннектикут. Быстрый направленный сдвиг гетероплазмии митохондриальной ДНК в тканях животных митохондриально направленной эндонуклеазой рестрикции. Proc Natl Acad Sci USA. 2005. 102 (40): 14392–7.
CAS PubMed Google ученый
Bacman SR, Gammage PA, Minczuk M, Moraes CT. Манипуляция митохондриальными генами и гетероплазмия мтднк. Методы Cell Biol. 2020; 155: 441–87.
PubMed Google ученый
Zekonyte U, Bacman SR, Moraes CT. Ферменты, редактирующие ДНК, как потенциальные средства лечения гетероплазматических заболеваний мтднк. J Intern Med. 2020; 287 (6): 685–97.
CAS PubMed Google ученый
Bacman SR, Moraes CT. Трансмитохондриальная технология в клетках животных. Методы Cell Biol. 2007. 80: 503–24.
CAS PubMed Google ученый
Gammage PA, Rorbach J, Vincent AI, Rebar EJ, Minczuk M. Zfns, нацеленные на митохондрии, для селективной деградации патогенных митохондриальных геномов, несущих крупномасштабные делеции или точечные мутации. EMBO Mol Med. 2014. 6 (4): 458–66.
CAS PubMed PubMed Central Google ученый
Хашимото М., Бакман С.Р., Перальта С., Фальк М.Дж., Чомин А., Чан, округ Колумбия, Уильямс С.Л., Мораес, Коннектикут. Митотален: общий подход к снижению нагрузки мутантной мтднк и восстановлению функции окислительного фосфорилирования при митохондриальных заболеваниях.Mol Ther. 2015; 23 (10): 1592–9.
CAS PubMed PubMed Central Google ученый
Gammage PA, Viscomi C, Simard ML, Costa ASH, Gaude E, Powell CA, Van Haute L, McCann BJ, Rebelo-Guiomar P, Cerutti R, Zhang L, et al. Редактирование генома в митохондриях исправляет патогенную мутацию mtdna in vivo. Nat Med. 2018; 24 (11): 1691–5.
CAS PubMed PubMed Central Google ученый
Бакман С. Р., Кауппила Дж. Х. К., Перейра К. В., Ниссанка Н., Миранда М., Пинто М., Уильямс С. Л., Ларссон Н. Г., Стюарт Дж. Б., Мораес Коннектикут. Митотален снижает нагрузку на мутантную mtdna и восстанавливает уровни trna (ala) в мышиной модели гетероплазматической мутации mtdna. Nat Med. 2018; 24 (11): 1696–700.
CAS PubMed PubMed Central Google ученый
Лутр Р., Хекель А.М., Смирнова А., Энтелис Н., Тарасов И. Может ли митохондриальная ДНК подвергаться критическому анализу: за и против.МСБМБ Жизнь. 2018; 70 (12): 1233–9.
CAS PubMed Google ученый
Ledford H. Ученые впервые вносят точные генные изменения в митохондриальную ДНК. Природа. 2020; 583 (7816): 343.
CAS PubMed Google ученый
Ричардсон Дж., Ирвинг Л., Хислоп Л.А., Чоудхари М., Мердок А., Тернбулл Д.М., Герберт М. Краткие обзоры: вспомогательные репродуктивные технологии для предотвращения передачи болезни митохондриальной ДНК.Стволовые клетки. 2015; 33 (3): 639–45.
CAS PubMed PubMed Central Google ученый
Вольф Д.П., Миталипов Н., Миталипов С. Заместительная митохондриальная терапия в репродуктивной медицине. Тенденции Мол Мед. 2015; 21 (2): 68–76.
CAS PubMed Google ученый
Hyslop LA, Blakeley P, Craven L, Richardson J, Fogarty NM, Fragouli E, Lamb M, Wamaitha SE, Prathalingam N, Zhang Q, O’Keefe H, et al.К клиническому применению пронуклеарного переноса для предотвращения болезни митохондриальной ДНК. Природа. 2016; 534 (7607): 383–6.
CAS PubMed PubMed Central Google ученый
Тачибана М., Амато П., Спарман М., Вудворд Дж., Санчис Д.М., Ма Х., Гутьеррес Н.М., Типпнер-Хеджес Р., Канг Е., Ли Х.С., Рэмси С. и др. На пути к генной терапии наследственных митохондриальных заболеваний зародышевой линии. Природа. 2013. 493 (7434): 627–31.
CAS PubMed Google ученый
Паулл Д., Эммануэль В., Вайс К.А., Трефф Н., Стюарт Л., Хуа Х, Циммер М., Калер Д.Д., Голанд Р.С., Ноггл С.А., Проссер Р. и др. Перенос ядерного генома в ооциты человека устраняет варианты митохондриальной ДНК. Природа. 2013. 493 (7434): 632–7.
CAS PubMed Google ученый
Ван Т., Ша Х, Джи Д., Чжан Х.Л., Чен Д., Цао И, Чжу Дж. Перенос генома полярного тела для предотвращения передачи наследственных митохондриальных заболеваний.Клетка. 2014. 157 (7): 1591–604.
CAS PubMed Google ученый
Рассел О.М., Горман Г.С., Лайтаулерс Р.Н., Тернбулл Д.М. Митохондриальные заболевания: надежда на будущее. Клетка. 2020; 181 (1): 168–88.
CAS PubMed Google ученый
Zhang J, Liu H, Luo S, Lu Z, Chavez-Badiola A, Liu Z, Yang M, Merhi Z, Silber SJ, Munne S, Konstantinidis M, et al.Живорождение происходит в результате переноса веретена ооцита для предотвращения митохондриальных заболеваний. Репродукция Биомед онлайн. 2017; 34 (4): 361–8.
PubMed Google ученый
Рирдон С. Выявлены генетические детали неоднозначного «трехлетнего ребенка». Природа. 2017; 544 (7648): 17–8.
CAS PubMed Google ученый
Такахаши К., Яманака С. Индукция плюрипотентных стволовых клеток из культур эмбриональных и взрослых фибробластов мыши с помощью определенных факторов.Клетка. 2006. 126 (4): 663–76.
CAS PubMed PubMed Central Google ученый
Shi Y, Inoue H, Wu JC, Yamanaka S. Технология индуцированных плюрипотентных стволовых клеток: десятилетие прогресса. Nat Rev Drug Discov. 2017; 16 (2): 115–30.
CAS PubMed Google ученый
Kruczek K, Swaroop A. Полученные из плюрипотентных стволовых клеток органоиды сетчатки для моделирования заболеваний и разработки методов лечения.Стволовые клетки. 2020; 38 (10): 1206–15.
PubMed PubMed Central Google ученый
Jin ZB, Gao ML, Deng WL, Wu KC, Sugita S, Mandai M, Takahashi M. Стимулирующая регенерация сетчатки с помощью плюрипотентных стволовых клеток. Prog Retin Eye Res. 2019; 69: 38–56.
CAS PubMed Google ученый
Fligor CM, Huang KC, Lavekar SS, VanderWall KB, Meyer JS. Дифференциация органоидов сетчатки от плюрипотентных стволовых клеток человека.Методы Cell Biol. 2020; 159: 279–302.
PubMed Google ученый
Cowan CS, Renner M, De Gennaro M, Gross-Scherf B, Goldblum D, Hou Y, Munz M, Rodrigues TM, Krol J, Szikra T., Cuttat R, et al. Типы клеток сетчатки глаза человека и ее органоидов при одноклеточном разрешении. Клетка. 2020; 182 (6): 1623–40 ( e1634 ).
CAS PubMed PubMed Central Google ученый
Laha B, Stafford BK, Huberman AD. Восстановление оптических путей от глаза к мозгу. Наука. 2017; 356 (6342): 1031–4.
CAS PubMed PubMed Central Google ученый
Канг Э., Ван Х, Типпнер-Хеджес Р., Ма Х., Фолмс С.Д., Гутьеррес Н.М., Ли Й., Ван Дайкен С., Ахмед Р., Ли И, Коски А. и др. Возрастное накопление соматических мутаций митохондриальной ДНК в ipscs взрослых людей. Стволовая клетка клетки. 2016; 18 (5): 625–36.
CAS Google ученый
Пералес-Клементе Э., Кук А.Н., Эванс Дж. М., Роллингер С., Секрето Ф., Эммануэле В., Оглесби Д., Мутха В. К., Хирано М., Шон Е. А., Терзич А. и др. Естественная основная гетероплазмия мтднк как потенциальный источник вариабельности тазобедренного сустава у человека. EMBO J. 2016; 35 (18): 1979–90.
CAS PubMed PubMed Central Google ученый
Пейн Б.А., Уилсон И.Дж., Ю-Вай-Ман П., Коксхед Дж., Дихан Д., Хорват Р., Тейлор Р. В., Сэмюэлс, округ Колумбия, Сантибанес-Кореф М., Чинери П. Ф. Универсальная гетероплазмия митохондриальной ДНК человека. Hum Mol Genet. 2013; 22 (2): 384–90.
CAS PubMed Google ученый
Ян Т.К., Ярмишин А.А., Ян Ю.П., Лу ПК, Чжоу С.Дж., Ван М.Л., Лин Т.К., Хван Д.К., Чжоу Ю.Б., Чен С.Дж., Ю.В.К. и др. Митохондриальный транспорт опосредует выживание ганглиозных клеток сетчатки у пораженных лоном пациентов.Hum Mol Genet. 2020; 29 (9): 1454–64.
CAS PubMed Google ученый
Chen J, Riazifar H, Guan MX, Huang T. Моделирование аутосомно-доминантной атрофии зрительного нерва с использованием индуцированных плюрипотентных стволовых клеток и определение потенциальных терапевтических мишеней. Stem Cell Res Ther. 2016; 7: 2.
PubMed PubMed Central Google ученый
Garone C, Viscomi C. На пути к терапии митохондриальных заболеваний: обновление.Biochem Soc Trans. 2018; 46 (5): 1247–61.
CAS PubMed PubMed Central Google ученый
Johnson SC, Yanos ME, Kayser EB, Quintana A, Sangesland M, Castanza A, Uhde L, Hui J, Wall VZ, Gagnidze A, Oh K, et al. Ингибирование Mtor облегчает митохондриальное заболевание на мышиной модели синдрома Ли. Наука. 2013. 342 (6165): 1524–8.
CAS PubMed PubMed Central Google ученый
Дай И, Чжэн К., Кларк Дж., Свердлоу Р. Х., Пульст С. М., Саттон Дж. П., Шинобу Л. А., Саймон Д. К.. Рапамицин стимулирует отбор против патогенной гетероплазматической мутации митохондриальной ДНК. Hum Mol Genet. 2014. 23 (3): 637–47.
CAS PubMed Google ученый
Cerutti R, Pirinen E, Lamperti C, Marchet S, Sauve AA, Li W, Leoni V, Schon EA, Dantzer F, Auwerx J, Viscomi C и др. Nad (+) — зависимая активация sirt1 корректирует фенотип в мышиной модели митохондриального заболевания.Cell Metab. 2014; 19 (6): 1042–9.
CAS PubMed PubMed Central Google ученый
Пиринен Э., Ауранен М., Хан Н.А., Брилханте В., Урхо Н., Пессия А., Хаккарайнен А., Куула Дж., Хейнонен Ю., Шмидт М.С., Хаймилахти К. и др. Ниацин излечивает системный дефицит nad (+) и улучшает работу мышц при митохондриальной миопатии у взрослых. Cell Metab. 2020; 31 (6): 1078–90 ( e1075 ).
CAS PubMed Google ученый
Rajman L, Chwalek K, Sinclair DA. Терапевтический потенциал надбустных молекул: доказательства in vivo. Cell Metab. 2018; 27 (3): 529–47.
CAS PubMed PubMed Central Google ученый
Шондорф Д.К., Иванюк Д., Баден П., Санчес-Мартинес А., Де Чикко С., Ю С., Джунта И., Шварц Л.К., Ди Наполи Г., Панайотакопулу В., Нестель С. и др. Никотинамид-рибозид-предшественник nad + устраняет митохондриальные дефекты и потерю нейронов в моделях болезни Паркинсона ipsc и на мухах.Cell Rep.2018; 23 (10): 2976–88.
PubMed Google ученый
Левин Л.А. Нейропротекция при оптической нейропатии. Азия Пак Дж. Офтальмол (Фила). 2018; 7 (4): 246–50.
CAS Google ученый
Solano EC, Kornbrust DJ, Beaudry A, Foy JW, Schneider DJ, Thompson JD. Токсикологические и фармакокинетические свойства qpi-1007, химически модифицированной синтетической sirna, нацеленной на мРНК каспазы 2, после интравитреальной инъекции.Nucleic Acid Ther. 2014. 24 (4): 258–66.
CAS PubMed Google ученый
Рат Э.З., Хазан З., Адамский К., Соломон А., Сегал З.И., Левин Л.А. Рандомизированное контролируемое исследование фазы 2a rph301 при ранее перенесенной неартериальной передней ишемической оптической нейропатии. J Neuroophthalmol. 2019; 39 (3): 291–8.
PubMed PubMed Central Google ученый
Villoslada P, Vila G, Colafrancesco V, Moreno B, Fernandez-Diez B, Vazquez R, Pertsovskaya I, Zubizarreta I, Pulido-Valdeolivas I, Messeguer J, Vendrell-Navarro G, et al.


