Отрицательный и положительный ион: Ион — Частица, в которой общее число электронов не равно общему числу протонов….
Разница между положительным и отрицательным ионом — Разница Между
Разница Между 2021
Ключевое отличие: Положительный ион и отрицательный ион являются частью атома или молекулы. Основное различие между двумя ионами заключается в их суммарном электрическом заряде, в котором положительны
Содержание:
Ключевое отличие: Положительный ион и отрицательный ион являются частью атома или молекулы. Основное различие между двумя ионами заключается в их суммарном электрическом заряде, в котором положительный ион имеет суммарный отрицательный заряд, а отрицательный ион — суммарный положительный заряд.В химии атом считается самой маленькой частицей материи. И дело в том, что сделала вся вселенная. Итак, вся материя, живые или неживые организмы состоят из атомов. Атом состоит из небольшого ядра, которое состоит из протонов, нейтронов и электронов. Только протоны и нейтроны присутствуют внутри атома, тогда как электроны вращаются вокруг ядра по выделенному круговому пути.
Ионы определяются как молекула или атом, где общее количество электронов не равно общему количеству протонов, таким образом, давая атому чистый положительный или отрицательный электрический заряд. Теперь, если ион образован потерей электронов, образуется положительный заряд, а если он образован усилением электронов, то частице придается отрицательный заряд. Весь этот процесс называется ионизацией.
При ионизации ион с чистым положительным зарядом на нем называется «положительным ионом» или «катионом». Катион — это ион, который имеет большее количество протонов, чем электронов. Это сформировано, когда нейтральный ион теряет свой один электрон от оболочки валанса, и число протонов в ядрах становится больше, чем число электронов во внешней оболочке.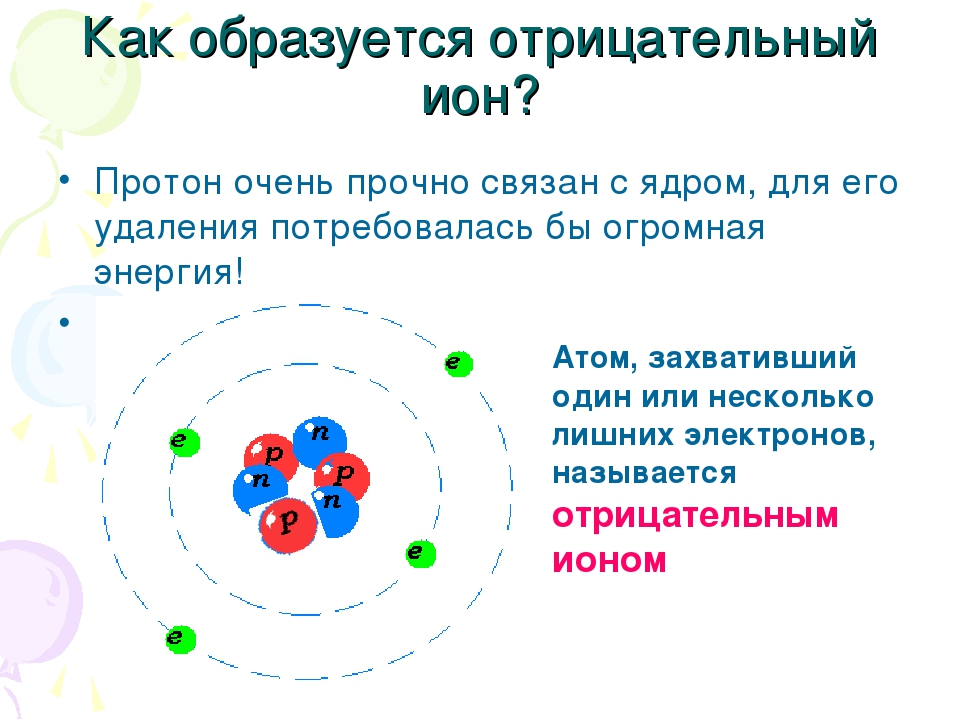
И анионы, и катионы могут быть дополнительно разделены в зависимости от множества зарядов. И все вышеперечисленные термины используются для разовых платежей. Положительные ионы и отрицательные ионы дифференцированы в таблице ниже.
Сравнение между положительным и отрицательным ионом:
Положительный ион | Отрицательный ион | |
Определение | Атом или молекула, которая заряжена отрицательно, то есть имеет больше электронов, чем протонов. | Атом или молекула, которая заряжена положительно, то есть имеет больше протонов, чем электронов. |
Результирующий заряд | Это отрицательный чистый ионный заряд. | Это положительный заряд чистого иона. |
Ионизация | Этот процесс носит экзотермический характер. | Этот процесс носит эндотермический характер. |
электрод | Во время электролиза он притягивается к аноду. | Во время электролиза он притягивается к катоду. |
Образована | Они образуются путем привлечения электронов. | Они образуются в результате потери электронов. |
Также упоминается как | Анион | Катион |
Тип элемента | Неметалл | металл |
Примеры | Сульфид, фторид, хлорид, бромид, йодид, нитрид и гидрид. | Натрий, железо и свинец. |
РАЗНИЦА МЕЖДУ ПОЛОЖИТЕЛЬНЫМ И ОТРИЦАТЕЛЬНЫМ ИОНАМИ | СРАВНИТЕ РАЗНИЦУ МЕЖДУ ПОХОЖИМИ ТЕРМИНАМИ — НАУКА
В ключевое отличие между положительным и отрицательным ионом заключается в том, что положительный ион несет положительный электрический заряд, тогда как отрицательный ион несет отрицательный электриче
В ключевое отличие между положительным и отрицательным ионом заключается в том, что
Ионы — это химические вещества, которые возникают в результате потери или усиления электронов. Следовательно, эти виды несут электрический заряд. Этот заряд может быть как положительным, так и отрицательным. Следовательно, есть две формы ионов: положительные ионы и отрицательные.
1. Обзор и основные отличия
2. Что такое положительный ион
3. Что такое отрицательный ион
Что такое отрицательный ион
4. Параллельное сравнение — положительный и отрицательный ион в табличной форме
5. Резюме
Что такое положительный ион?
Положительные ионы — это химические вещества, несущие положительный электрический заряд. Мы называем это катионом. Эти катионы образуются, когда нейтральные химические соединения теряют электрон из своей химической структуры. Положительные ионы могут быть атомами или фрагментами молекул.
У этих разновидностей есть протоны и электроны в равных количествах, чтобы нейтрализовать заряды. Следовательно, когда этот атом или молекула теряет электрон, появляется дополнительный протон с положительным зарядом. Это дает чистый положительный заряд атому или молекуле. Более того, эти ионы находятся в нескольких формах как одноатомные ионы, двухатомные ионы или многоатомные ионы в зависимости от количества атомов, присутствующих в ионных частицах.
Пример: K+, Na+, NH4+, и т. д.
д.
Что такое отрицательный ион?
Отрицательные ионы — это химические вещества, несущие отрицательный электрический заряд. Мы называем это анионом. Эти анионы образуются, когда нейтральные химические соединения получают электрон из своей химической структуры. Отрицательные ионы могут быть атомами или фрагментами молекул.
У этих разновидностей есть протоны и электроны в равных количествах, чтобы нейтрализовать заряды. Следовательно, когда этот атом или молекула получает электрон, появляется дополнительный электрон с отрицательным зарядом. Это дает атому или молекуле чистый отрицательный заряд. Более того, эти ионы находятся в нескольких формах как одноатомные ионы, двухатомные ионы или многоатомные ионы в зависимости от количества атомов, присутствующих в ионных частицах.
Пример: Cl–, Br–, ТАК4–, и т.д.
В чем разница между положительным и отрицательным ионами?
Положительные ионы — это химические вещества, несущие положительный электрический заряд. Эти ионы образуются, когда атом или молекула теряют электрон. Следовательно, у положительных ионов больше протонов, чем электронов. Но отрицательные ионы — это химические вещества, которые несут отрицательный электрический заряд. Эти ионы образуются, когда атом или молекула получает электрон. Следовательно, отрицательные ионы имеют больше электронов, чем протонов. Это основные различия между положительными и отрицательными ионами.
Эти ионы образуются, когда атом или молекула теряют электрон. Следовательно, у положительных ионов больше протонов, чем электронов. Но отрицательные ионы — это химические вещества, которые несут отрицательный электрический заряд. Эти ионы образуются, когда атом или молекула получает электрон. Следовательно, отрицательные ионы имеют больше электронов, чем протонов. Это основные различия между положительными и отрицательными ионами.
Резюме — положительный и отрицательный ион
Ионы — это химические вещества, несущие электрический заряд. Есть две формы: положительные ионы и отрицательные ионы. Разница между положительными и отрицательными ионами заключается в том, что положительные ионы несут положительный электрический заряд, тогда как отрицательные ионы несут отрицательный электрический заряд.
положительный ион — это… Что такое положительный ион?
- положительный ион
- positive ion
Большой англо-русский и русско-английский словарь.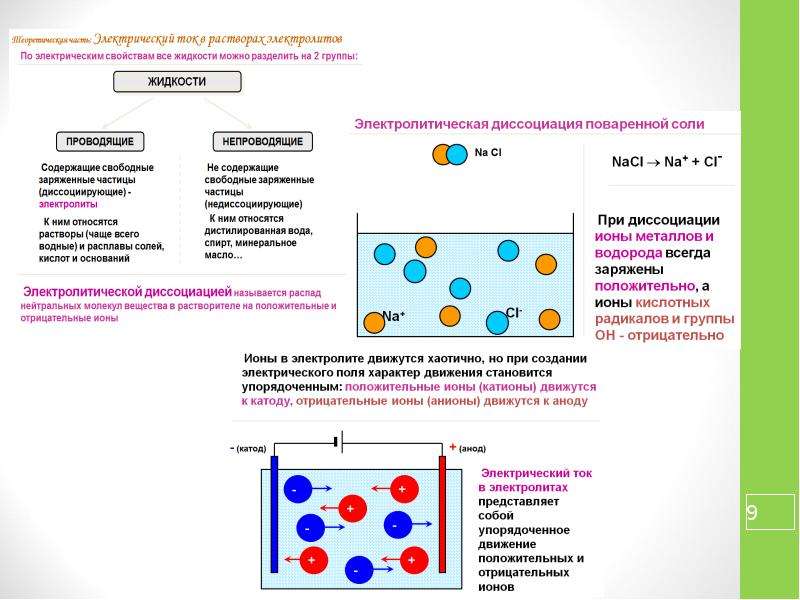 2001.
2001.
- положительный интегрант
- положительный итог
Смотреть что такое «положительный ион» в других словарях:
положительный ион — положительно заряженный ион катион — [Я.Н.Лугинский, М.С.Фези Жилинская, Ю.С.Кабиров. Англо русский словарь по электротехнике и электроэнергетике, Москва, 1999 г.] Тематики электротехника, основные понятия Синонимы положительно заряженный… … Справочник технического переводчика
положительный ион — teigiamasis jonas statusas T sritis fizika atitikmenys: angl. positive ion vok. positives Ion, n rus. положительный ион, m pranc. ion positif, m … Fizikos terminų žodynas
положительный ион — Атом, молекула или комплекс последних, обладающие положительным зарядом … Политехнический терминологический толковый словарь
ион — Атом или группа атомов, который за счет потери или приобретения одного или более электронов приобрел электрический заряд.
 Если ион получен из атома водорода или атома металла, он обычно положительно заряжен; если ион получен из атома неметалла… … Справочник технического переводчика
Если ион получен из атома водорода или атома металла, он обычно положительно заряжен; если ион получен из атома неметалла… … Справочник технического переводчикаИОН — [icov идущий] атом (или гр. атомов комплексный ион), несущий положительный (катион) или отрицательный (анион) электрический заряд и являющийся самостоятельной или относительно самостоятельной составной частью (строительной единицей) к лов или… … Геологическая энциклопедия
Ион — Ion Ион. Атом или группа атомов, который за счет потери или приобретения одного или более электронов приобрел электрический заряд. Если ион получен из атома водорода или атома металла, он обычно положительно заряжен; если ион получен из атома… … Словарь металлургических терминов
Ион — (греч. ion идущий) молекула, имеющая электрический заряд (анион положительный, катион отрицательный) … Энциклопедический словарь по психологии и педагогике
ИОН — Молекула, имеющая заряд; анионы имеют отрицательный заряд, катионы – положительный … Толковый словарь по психологии
Цвиттер-Ион (Zwitterion) — ион, несущий одновременно положительный и отрицательный заряды.
 Производить цвиттерионы могут, например, аминокислоты. Источник: Медицинский словарь … Медицинские термины
Производить цвиттерионы могут, например, аминокислоты. Источник: Медицинский словарь … Медицинские терминыЦвиттер-ион
Биполярный ион — Аминокислота в нормальной форме (1) и в виде цвиттер иона (2) Цвиттер ион (биполярный ион) (от нем. Zwitter гибрид, гермафродит) молекула, которая, являясь в целом электронейтральной, в своей структуре имеет части, несущие как отрицательный, так… … Википедия
Положительные и отрицательные электронные состояния
В основном состоянии отсутствует спин-орбитальное взаимодействие, и состояние подмешивается к А2д только в небольшой степени. Уравнение (13.46) отличается от приведенных ранее в двух отношениях. Спин-орбитальное взаимодействие описывается X (который может быть и положительным, и отрицательным) и характеризует состояние. При наличии более чем одного неспаренного электрона разности энергий также могут быть выражены через разности энергий соответствующих электронных состояний.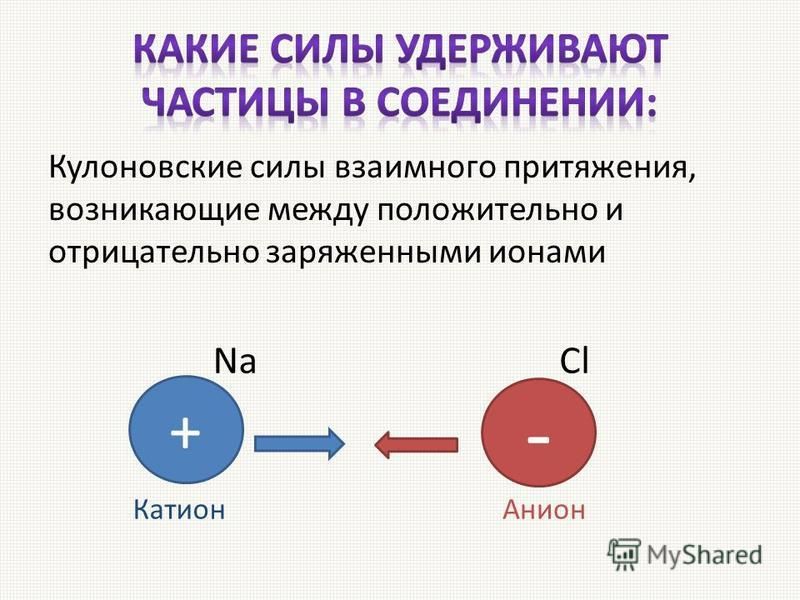 Расчет в случае комплекса У(Н20)й с использованием Д = 11 800 см и = 56 см дает значение -факто-ра, равное 1,964. которое близко к наблюдаемому значению 1,972 [34]. Для комплекса Сг(Н20) Д = 17400 см Я, = 91 см и предсказываемое значение д ниже экспериментального, равного 1,977 [35]. В случае комплекса расхождение даже больше рассчитанное значение равно [c.236]
Расчет в случае комплекса У(Н20)й с использованием Д = 11 800 см и = 56 см дает значение -факто-ра, равное 1,964. которое близко к наблюдаемому значению 1,972 [34]. Для комплекса Сг(Н20) Д = 17400 см Я, = 91 см и предсказываемое значение д ниже экспериментального, равного 1,977 [35]. В случае комплекса расхождение даже больше рассчитанное значение равно [c.236]
Ионы обозначают теми же символами, что и атомы, указывая справа вверху их заряд, например, положительный трехзарядный ион алюминия обозначают А1 +, отрицательный однозарядный ион хлора — С1 . Для ионов, как и для атомов, существует несколько систем радиусов. На их размеры влияют такие факторы, как количество ближайших ионов в узлах кристаллической решетки (называемое координационным числом) и их электронное состояние (заряд, размер и др.). Поэтому наиболее индивидуальным радиусом иона так же, как и для атома, можно считать его орбитальный радиус.
 Потеря атомом электронов приводит к уменьшению его эффективных размеров, а присоединение избыточных электронов — к увеличению. Поэтому радиус положительно заряженного иона (катиона) всегда меньше, а радиус отрицательно заряженного иона (аниона) всегда больше радиуса соответствующего электронейтрального атома [c.82]
Потеря атомом электронов приводит к уменьшению его эффективных размеров, а присоединение избыточных электронов — к увеличению. Поэтому радиус положительно заряженного иона (катиона) всегда меньше, а радиус отрицательно заряженного иона (аниона) всегда больше радиуса соответствующего электронейтрального атома [c.82]Подгруппа щелочных металлов Ь1, N3, К, НЬ, Сз, Рг. Наружный слой атомов состоит из одного х-электрона. Они образуют однозарядные положительные ионы. Отрицательное валентное состояние для них неизвестно. Максимальная положительная валентность 1. [c.83]
Радиусы нейтральных атомов Na и С1 равны соответственно 1,86 и 0,99 А. Из сопоставления величин ионных и атомных радиусов видно, как сильно влияет на размеры отдача или присоединение атомов электронов. Для одного и того же элемента это влияние наглядно показано на рис. 111-61, где даны увеличенные в 50 миллионов раз размеры атома серы в нейтральном (S°), отрицательно двухвалентном (S» ) и положительно шестивалентном (S+ ) состояниях. В дальнейшем придется часто иметь дело с размерами атомов и ионов, так как от них сильно зависят многие свойства веществ. [c.110]
В дальнейшем придется часто иметь дело с размерами атомов и ионов, так как от них сильно зависят многие свойства веществ. [c.110]
Для того чтобы понять существование различных электронных состояний с различными вращательными и колебательными постоянными, необходимо рассмотреть движение электронов вокруг двух ядер и исследовать их энергий. Сначала рассмотрим один электрон в поле двух неподвижных ядер. Примером может служить ион Исследование уравнения Шредингера для такой системы показывает, что, так же как и для атома водорода, возможны все положительные значения энергии тг только некоторые отрицательные значения. Качественно можно получить дискретные (отрицательные) уровни энергии из уровней так называемого объединенного [c.30]
В обычном состоянии всякое тело пмеет такое количество отрицательных электронов и положительных зарядов атомных ядер, при котором общий отрицательный заряд всех электронов равен общему положительному заряду всех ядер. Поэтому тело не обнаруживает ни положительного ни отрицательного заряда. [c.127]
Поэтому тело не обнаруживает ни положительного ни отрицательного заряда. [c.127]
Постоянная взаимодействия А может быть положительной или отрицательной величиной соответственно различают нормальные и обращенные электронные состояния например, у гидроксила основное состояние обращенное (состояние а у метина — нормальное (состояние А П ). [c.48]
Наиболее вероятно, что выделяющаяся энергия (равная разности работ ионизации молекулы, соответствующей положительному иону, и отрыва электрона от отрицательного иона) переведет молекулу, образованную из положительного иона, в сильно возбужденное состояние, тогда как молекула, полученная из отрицательного иона, будет находиться в нормальном электронном состоянии [c.349]
Если электронное состояние 2 » ф = (—1) так что вращательному состоянию отвечает положительная функция при четном J и отрицательная — при нечетном J.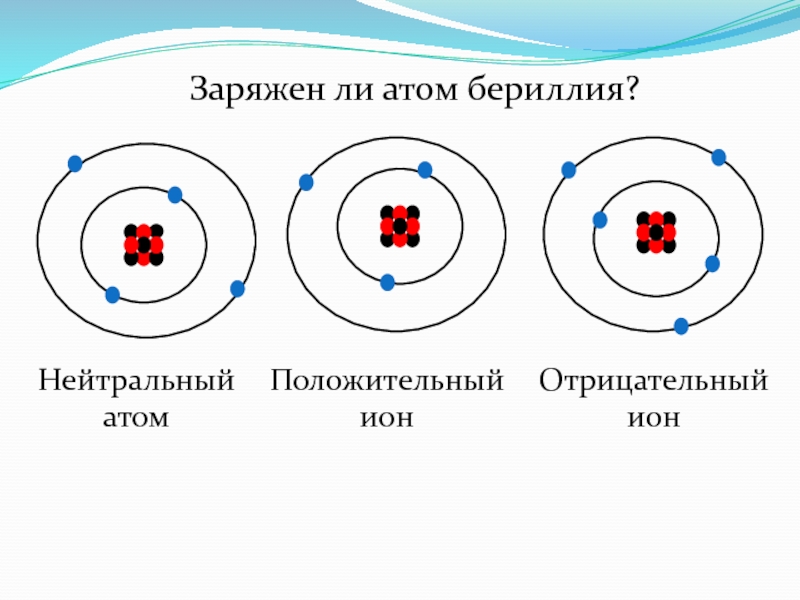 [c.349]
[c.349]
Если электронное состояние 2 «»i = (—1) ф, так что вращательному состоянию отвечает отрицательная функция при четном У и положительная функция при нечетном J. [c.349]
Частоты ЯКР для атомов различных элементов в зависимости от значений eQ лежат в интервале 10 —10 гц (рис. 2-1). Таунс [1] дает интересную корреляцию QIR (где Я — среднее значение радиуса ядра) от числа четных нуклонов. Собственные квадрупольные моменты ядер меняются довольно систематично, увеличиваясь сверху вниз и справа налево по периодической системе элементов. Исключение составляют С5 и обладающие магическими числами нейтронов, т. е. имеющие замкнутые нуклонные оболочки в ядре. Ядерные квадрупольные моменты для элементов левых подгрупп всегда больше, чем для правых. Однако значения е С1ц для атомов левых подгрупп всегда меньше, чем для правых, из-за различия в электронных состояниях валентных электронов соответствующих элементов. Кроме того, большинство квадрупольных моментов положительно, что вызывается тенденцией ядра к вытянутой относительно оси квантования форме, имеющей более низкую электростатическую энергию, чем в случае сжатой формы ядра с отрицательным значением е 3 .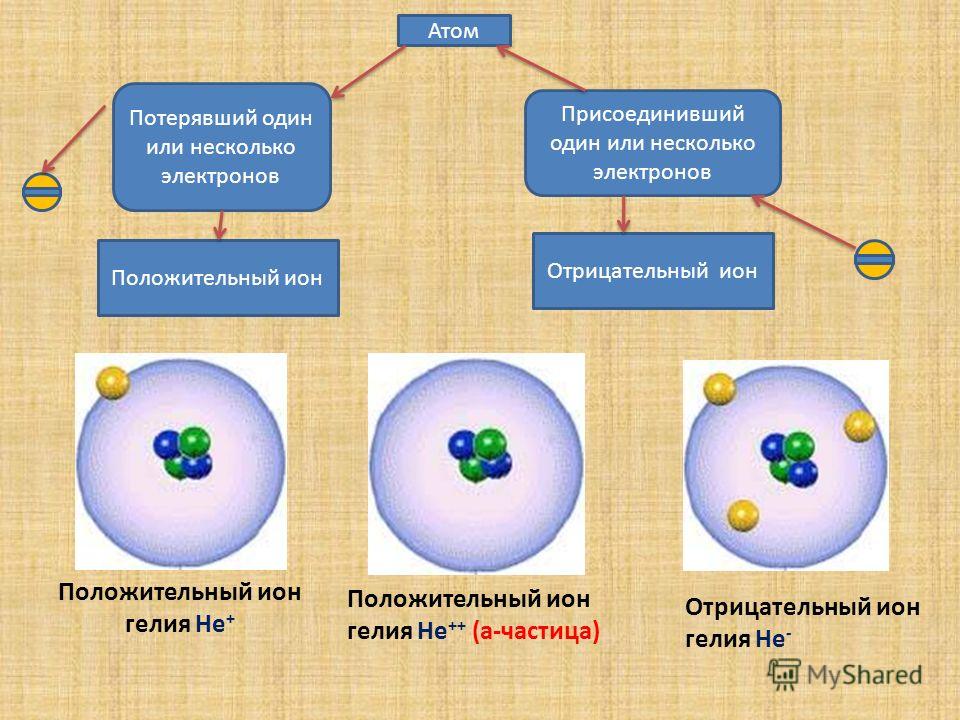 [c.26]
[c.26]
По этой причине картина изменения электронных состояний свободного иона в поле лигандов имеет вид, представленный на рис. IV. 2. Энергия дестабилизации о при комплексообразовании компенсируется за счет основной энергии связей, в данном случае—притяжения положительного остова центрального иона и отрицательных лигандов. Эту часть энергии в теории кристаллического поля не рассчитывают и поэтому положение центра тяжести [c.71]
Кристаллическая структура шпинели во многом определяет магнитную структуру. Если в А- и В-положениях находятся магнитные ионы, то, как видно из рассмотрения кристаллической структуры, основным видом взаимодействия между ними будут косвенные отрицательные обменные взаимодействия типа А—X—В. Угол связи равен 125°. Именно этот вид взаимодействий приводит к образованию двух магнитных А- и В-подре-шеток. При этом магнитные моменты ионов, находящихся в А- и В-положениях, направлены противоположно друг другу. Однако, в отличие от ферримагнетиков со структурой граната и перовскита, в шпинелях существенную роль могут играть и прямые В — В-взаимодействия (см. рис. 16), которые могут быть как положительными, так и отрицательными в зависимости от электронного состояния катионов [3]. Кроме того, обменные взаимодействия в В-подрешетке могут осуществляться и косвенным путем по цепи В — X — В под углом 90° [3]. [c.6]
рис. 16), которые могут быть как положительными, так и отрицательными в зависимости от электронного состояния катионов [3]. Кроме того, обменные взаимодействия в В-подрешетке могут осуществляться и косвенным путем по цепи В — X — В под углом 90° [3]. [c.6]
Первые два перехода дают состояния 2 и Ей, вторые — состояния А . Все состояния нечетные, так как совокупность трех нечетных и одной четной орбитали дает нечетное состояние. На антисимметричной относительно плоскости XZ орбитали может находиться либо один, либо два электрона, соответственно состояние может быть антисимметричным и симметричным относительно этой плоскости, т. е. отрицательным или положительным. Таким образом, состояния соответствующие возбуждению одного электрона могут быть Е+, 27, А , А . [c.57]
Настоящая глава посвящена электронам проводимости. Каждый электрон в любом теле имеет заряд, равный заряду свободного электрона. Даже дырке, оказывается, можно не приписывать положительный заряд, если учесть, что она представляет собой незанятое электроном состояние с отрицательной эффективной массой (см.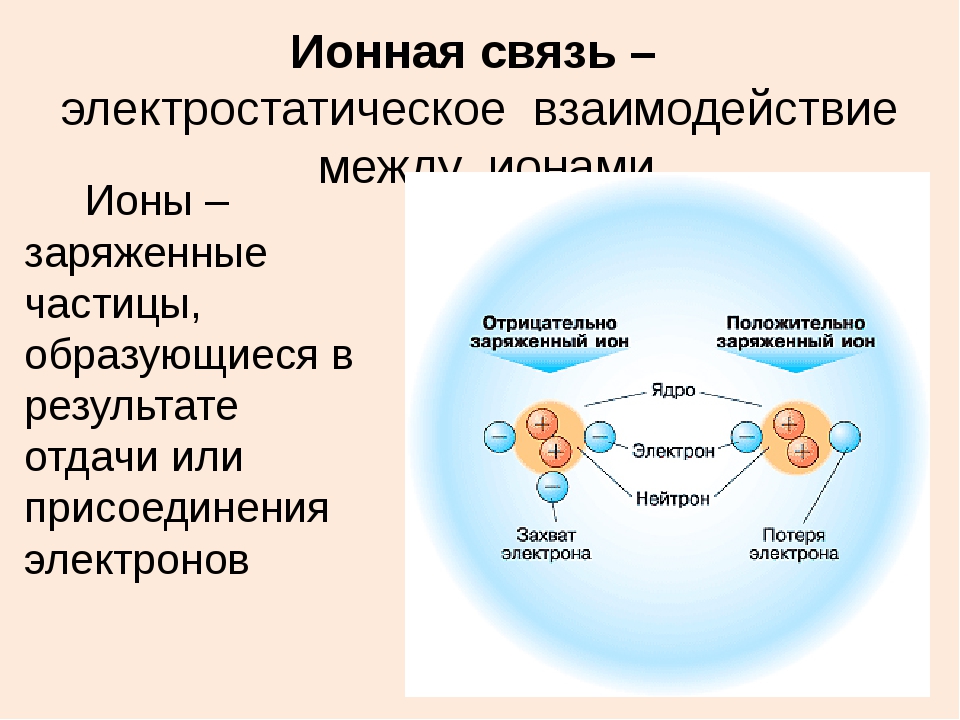 (16.3)). [c.310]
(16.3)). [c.310]
Электронные состояния двухатомных молекул могут различаться также по свойствам симметрии. В основе этого, как уже отмечалось (см. гл. 3), лежит поведение волновых функций молекулы при операциях симметрии. Для операции отражения в плоскости симметрии, проходящей через ось молекулы, состояния могут быть либо положительными ( + ), либо отрицательными (—) в зависимости от того, сохраняет или меняет при этом знак волновая функция Ч . Этот индекс пишется около символа состояния вверху справа. Если двухатомная молекула состоит из двух одинаковых атомов, то она обладает центром симметрии. По отношению к операции отражения в центре симметрии электронные состояния таких молекул подразделяются на четные ( ) и нечетные (ы). Этот индекс пишется внизу справа относительно символа состояния. Так, основное электронное состояние молекулы водорода (НИН) является состоянием т. е. син- [c.66]
Для циклич.
 переходного состояния (активир. комплекса) существенно, каким образом замыкаются новые связи в фазе или в противофазе, т. е. имеют ли атомные орбитали реагентов в области макс. перекрывания одинаковые или противоположные знаки (рис. 1 и 3). В первом случае взаимод. наз. связывающим, во втором-разрых-ляющим. В зависимости от числа атомных орбиталей в сопряженной системе активир. комплекса, электронного состояния реагирующей системы и характера вновь возникающих взаимодействий, энергия замыкания цикла м. б. как положительной, так и отрицательной, причем ее знак определяется без вычислений. В частности, при циклизации производных бутадиена (р-ция 2) в основном электронном состоянии переходное состояние стабилизируется замыканием связей посредством разрыхляющих взаимод. (перекрывание в противофазе, рис. 3), делая энергетически выгодным коиротаторный путь термич. р-ции. В первом электронном возбужденном состоянии циклич. переходное состояние стабилизируется связывающим взаимод. (перекрывание в фазе), что соответствует дисротаторному пути.
переходного состояния (активир. комплекса) существенно, каким образом замыкаются новые связи в фазе или в противофазе, т. е. имеют ли атомные орбитали реагентов в области макс. перекрывания одинаковые или противоположные знаки (рис. 1 и 3). В первом случае взаимод. наз. связывающим, во втором-разрых-ляющим. В зависимости от числа атомных орбиталей в сопряженной системе активир. комплекса, электронного состояния реагирующей системы и характера вновь возникающих взаимодействий, энергия замыкания цикла м. б. как положительной, так и отрицательной, причем ее знак определяется без вычислений. В частности, при циклизации производных бутадиена (р-ция 2) в основном электронном состоянии переходное состояние стабилизируется замыканием связей посредством разрыхляющих взаимод. (перекрывание в противофазе, рис. 3), делая энергетически выгодным коиротаторный путь термич. р-ции. В первом электронном возбужденном состоянии циклич. переходное состояние стабилизируется связывающим взаимод. (перекрывание в фазе), что соответствует дисротаторному пути. Эти общие положения позволяют предсказывать закономерности Р. с. согласованных электроциклич. р-ций (Р. Вудворд, Р. Хофман, 1965). [c.214]
Эти общие положения позволяют предсказывать закономерности Р. с. согласованных электроциклич. р-ций (Р. Вудворд, Р. Хофман, 1965). [c.214]Многочисленные опыты показали, что в кристаллах типа Na l структурные частицы, слагающие кристалл, являются ионами. Атом натрия, после отщепления от него валентного электрона, становится положительно заряженным ионом с устойчивой внешней электронной оболочкой, аналогичной электронной оболочке благородного газа (неона). Атом хлора, присоединяя один электрон, заряжается отрицательно и получает аналогичную устойчивую конфигурацию внешних электронов. Состояние равновесия между ионами [c.136]
Это позволяет одновременно отразить тот факт, что в сопряженных системах порядки я-связей меньше, чем в изолированной я-связи. В молекулах число я-электронов равно числу 5р2-гибридных атомов углерода, тогда как в однозарядных катионах содержится на один я-электрон меньше, а в однозарядных анионах — на один я-электрон больше. Отображение истинного состояния связей в сопряженных системах с помощью классических структурных формул возможно и с использованием представлений о мезомерии (Лепуорт, Робинсон, Ингольд, Арндт, Вейц, 1922 г.). В основном они близки к представлениям о резонансе или делокализации я-электронов. Согласно мезомерным представлениям основное состояние сопряженной системы описывается наложением двух или трех различных состояний, каждое из которых может быть изображено с помощью классических структурных формул. В таких формулах свободные пары электронов обозначают двумя точками, неспаренные электроны — одной точкой, положительный заряд — знаком + , а отрицательный — — . Основное состояние называется мезомерным, а используемые для его описания мысленно налагаемые структуры — мезомерными граничными структурами резонансными структурами). Последние представляют собой граничные (крайние) формы распределения я-электронов. Наложение граничных структур указывается обоюдоострой стрелкой — , например [c.
Отображение истинного состояния связей в сопряженных системах с помощью классических структурных формул возможно и с использованием представлений о мезомерии (Лепуорт, Робинсон, Ингольд, Арндт, Вейц, 1922 г.). В основном они близки к представлениям о резонансе или делокализации я-электронов. Согласно мезомерным представлениям основное состояние сопряженной системы описывается наложением двух или трех различных состояний, каждое из которых может быть изображено с помощью классических структурных формул. В таких формулах свободные пары электронов обозначают двумя точками, неспаренные электроны — одной точкой, положительный заряд — знаком + , а отрицательный — — . Основное состояние называется мезомерным, а используемые для его описания мысленно налагаемые структуры — мезомерными граничными структурами резонансными структурами). Последние представляют собой граничные (крайние) формы распределения я-электронов. Наложение граничных структур указывается обоюдоострой стрелкой — , например [c.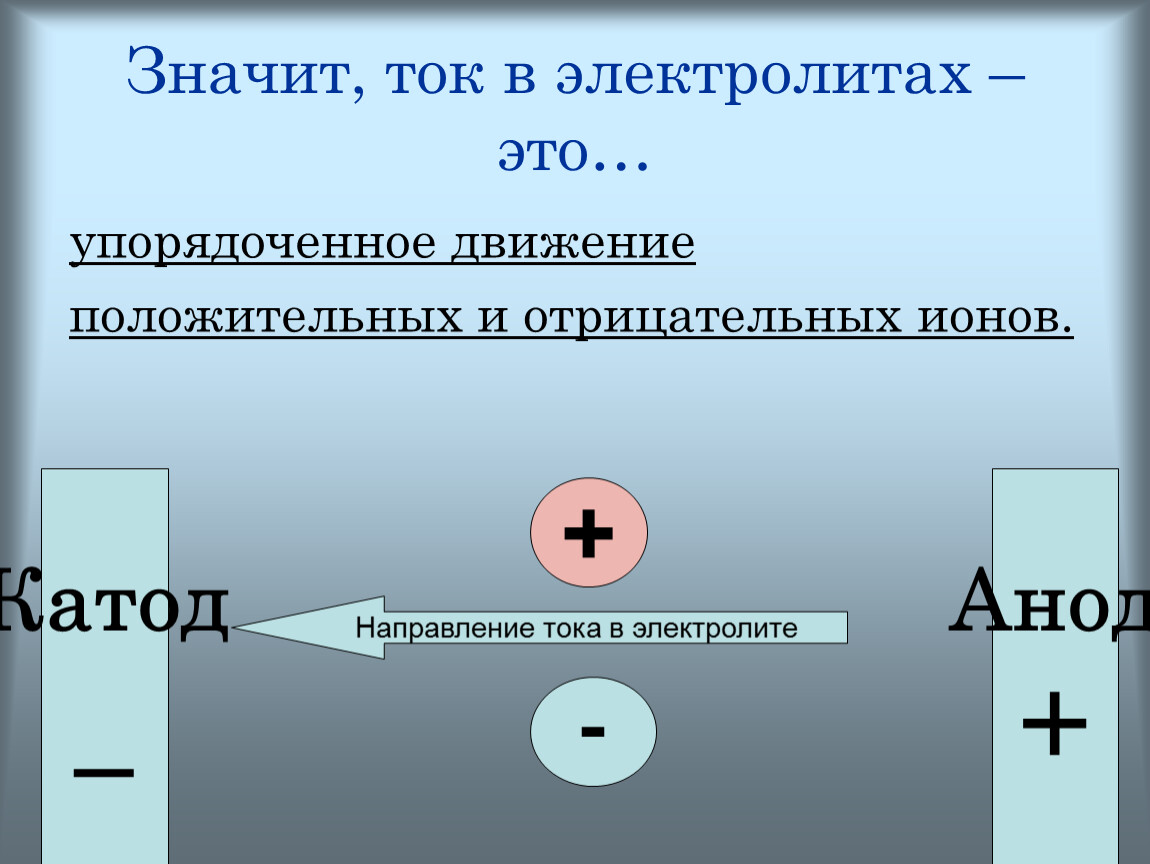 72]
72]
Этот третий род взаимодействий является более интересным и неожиданным, и даже приближенное объяснение его не может быть дано без привлечения квантово-механических представлений. Согласно Дираку, электроны могут существовать в состояниях как положительной, так и отрицательной кинетической энергии. Обычно мы не замечаем отрицательных электронов с отрицательной энергией просто потому, что они имеются повсюду. При столкновении достаточно энергичного -фотона с одним из этих электронов фотон может вырвать его из состояния отрицательной энергии и таким образом освободить его. Электрон вылетит как обычный отрицательный электрон с положительной кинетической энергией, оставив положительную дырку в сплошном фоне отрицательного заряда. Эта дырка ведет себя как положительный заряд, т. е. как позитрон. Позитрон и электрон имеют одинаковую массу покоя то, энергетический эквивалент которой равен тос1 Фотон с энергией 2 тоС (1,02 Мэе) или большей может таким образом вызвать рождение электрон-нозитронной пары. Из всей энергии фотона первые 1,02 Мэе используются для создания массы покоя, а остаток переходит в кинетическую энергию электрона и позитрона. Фотон не рассеивается в этом процессе, а полностью поглощается. Вследствие требований сохранения энергии и импульса рождение пар не может происходить в пустом пространстве, ему в большой степени способствует наличие атомных ядер рождение пар может происходить и в присутствии электрона. В первом приближении вероятность рождения пар в поглощающей среде пропорциональна Z , так что для его изучения наиболее удобны элементы с большим атомным номером, например свинец. [c.35]
Из всей энергии фотона первые 1,02 Мэе используются для создания массы покоя, а остаток переходит в кинетическую энергию электрона и позитрона. Фотон не рассеивается в этом процессе, а полностью поглощается. Вследствие требований сохранения энергии и импульса рождение пар не может происходить в пустом пространстве, ему в большой степени способствует наличие атомных ядер рождение пар может происходить и в присутствии электрона. В первом приближении вероятность рождения пар в поглощающей среде пропорциональна Z , так что для его изучения наиболее удобны элементы с большим атомным номером, например свинец. [c.35]
Молекула, как и атом, характеризуется мультиплет-ностью электронных состояний. Мультиплетность уровня определяется и обозначается по указанным выше правилам. По отношению к отражению в плоскости симметрии, проходящей через ось молекулы, электронные состояния разделяются на положительные (-1-) и отрицательные (—), что указывается вверху справа у квантового числа Л. Для линейных молекул, обладающих центром симметрии, электронные состояния делятся на четные (g и нечетные (и), что указывается справа внизу у Л. В ряде случаев перед символом терма Л дается дополнительный символ (А, В, С, X,. .., а, Ь, с,. ..), приписываемый каждому конкретному терму и не связанный однозначно со спектроскопическими характеристиками молекулы. [c.649]
Для линейных молекул, обладающих центром симметрии, электронные состояния делятся на четные (g и нечетные (и), что указывается справа внизу у Л. В ряде случаев перед символом терма Л дается дополнительный символ (А, В, С, X,. .., а, Ь, с,. ..), приписываемый каждому конкретному терму и не связанный однозначно со спектроскопическими характеристиками молекулы. [c.649]
Отрицательно активная молекула. Под влиянием внешних воздействий молекулы способны терять часть своих электронов, превращаясь в положительно заряженные ионы. Если подведенной энергии недостаточно для полной ионизации молекулы, т. е. для выброса электрона за пределы действия внутримолекулярных сил, то молекула окажется в возбужденном состоянии. Возбуждение состоит в том, что при сообщении энергии молек5 ла как целое (ради простоты возьмем двухатомную) начинает быстрее вращаться вокруг оси, соединяющей ядра атомы в молекуле начинают сильнее колебаться один относительно другого при дальнейшем подводе энергии происходит переход электронов с низшего уровня на высший.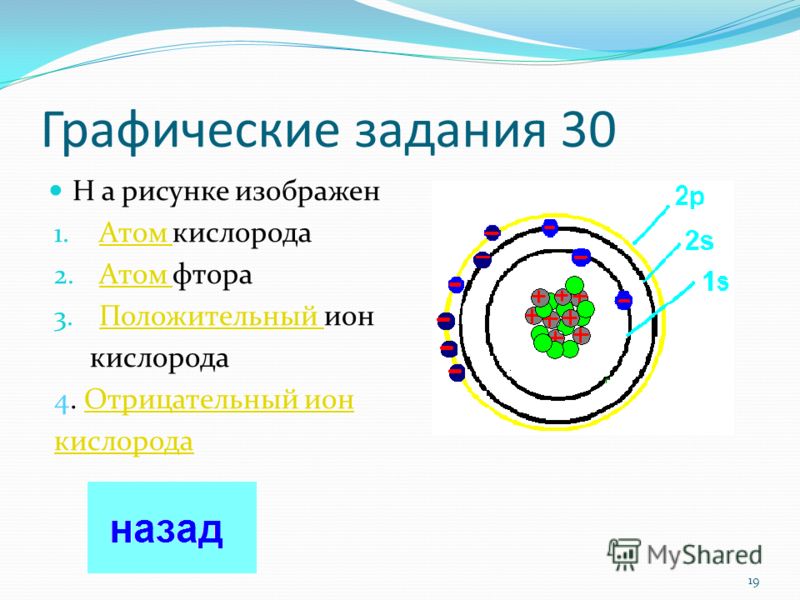 В каждом устойчивом электронном состоянии молекула может совершать колебания относительно положения равновесия, т. е. может иметь некоторую колебательную энергию Е,. и может также вращаться, т. е. иметь некоторую вращательную энергию Едр. Полная энергия Е молекулы равна с очень хорошим приближением сумме [28] [c.144]
В каждом устойчивом электронном состоянии молекула может совершать колебания относительно положения равновесия, т. е. может иметь некоторую колебательную энергию Е,. и может также вращаться, т. е. иметь некоторую вращательную энергию Едр. Полная энергия Е молекулы равна с очень хорошим приближением сумме [28] [c.144]
Особенностью химичесютх реакций является передача электрона от одного атома или молекулы к другим. Процесс передачи электрона вовсе необязательно реализуется переходом свободного электрона. Электрон может быть отщеплен от реагента, если в его непосредственном соседстве находится электронный акцептор. Прирост свободной энергии при акцептировании электрона должен превосходить энергию, необходимую для его отщепления от электронного донора. Освобождение электрона можно также осуществить, сообщая донорной системе избыточную энергию с помощью теплового, фотохимического или электростатического воздействии. Такой процесс происходит независимо от наличия каютх-либо акцепторов электронов.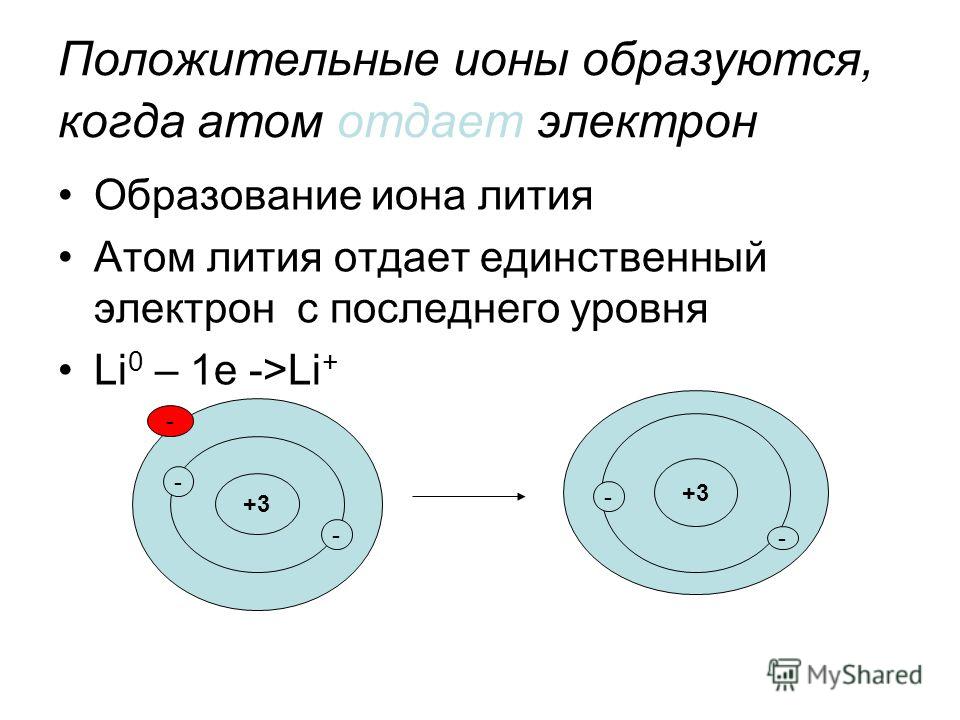 Отщепленный электрон диффундирует в среде до его захвата в результате одного из двух возможных актов. Он может присоединиться к атому или молекуле, которые обладают положительным сродством к электрону. В то же время, если электрон перемещается в конденсированной среде, состоящей из молекул с нулевым или отрицательным электронным сродством, он оканчивает свой путь в ловушке , образованной его собственным поляризационным полем. Такой захваченный электрон уже не в состоянии свободно перемещаться в веществе. Из своей потенциальной ямы электрон может освободиться только при условии, если он приобретет энергию извне или перейдет в соседнюю ловушку. Электрон, захваченный в растворителе, отличается от свободного электрона меньшей подвижностью и большей локализацией. Кроме того, захваченный электрон характеризуется отрицательной свободной энергией образования, т. е. является термодинамически более стабильным. Эти свойства, напоминающие свойства отрицательного сольватированного иона, позволяют рассматривать электрон как особую гидратированную частицу.
Отщепленный электрон диффундирует в среде до его захвата в результате одного из двух возможных актов. Он может присоединиться к атому или молекуле, которые обладают положительным сродством к электрону. В то же время, если электрон перемещается в конденсированной среде, состоящей из молекул с нулевым или отрицательным электронным сродством, он оканчивает свой путь в ловушке , образованной его собственным поляризационным полем. Такой захваченный электрон уже не в состоянии свободно перемещаться в веществе. Из своей потенциальной ямы электрон может освободиться только при условии, если он приобретет энергию извне или перейдет в соседнюю ловушку. Электрон, захваченный в растворителе, отличается от свободного электрона меньшей подвижностью и большей локализацией. Кроме того, захваченный электрон характеризуется отрицательной свободной энергией образования, т. е. является термодинамически более стабильным. Эти свойства, напоминающие свойства отрицательного сольватированного иона, позволяют рассматривать электрон как особую гидратированную частицу. В общем смысле электронный акцептор также можно рассматривать как ловушку, в которой электрон локализован гораздо сильнее, чем в ловушке, образованной молекулами растворителя. Электрон, окруженный ориентированными молекулами растворителя, является (и это его наиболее существенная в химическом отношении характеристика) необычайно активным электронным донором. Такое образование, существующее в жидкостях, называется солъватированным электроном е , если же растворителем является вода, то это гидратированный электрон вад. [c.169]
В общем смысле электронный акцептор также можно рассматривать как ловушку, в которой электрон локализован гораздо сильнее, чем в ловушке, образованной молекулами растворителя. Электрон, окруженный ориентированными молекулами растворителя, является (и это его наиболее существенная в химическом отношении характеристика) необычайно активным электронным донором. Такое образование, существующее в жидкостях, называется солъватированным электроном е , если же растворителем является вода, то это гидратированный электрон вад. [c.169]
Этот предельный случай впервые был введен Розенблютол и Ростокером (1960) при исследовании соответствующих уравнений для высокотемпературной плазмы. Плазмой называется состояние вещества за пределами атомарной газообразной фазы. Когда атомарный газ нагревается выше некоторого предела, появляется механизм, который непрерывно поглощает кинетическую энергию хаотического движения. Это подобно энергии диссоциации в жидкости с полукристаллической структурой, которая является как бы каналом для непрерывного поглощения энергии при переходе из жидкого состояния в газообразное.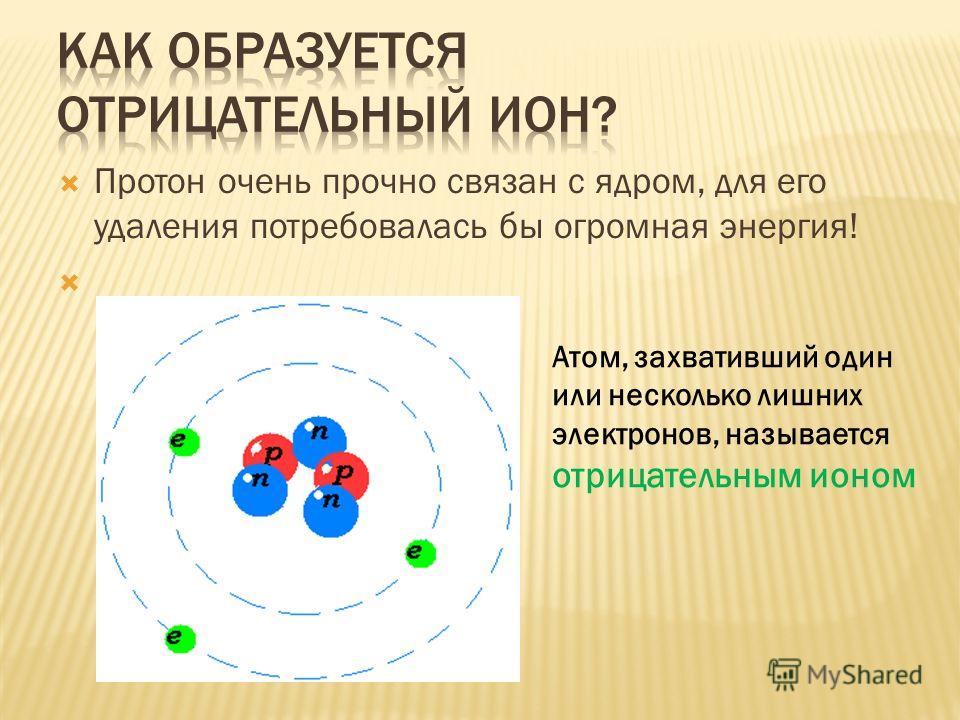 При переходе в плазменную фазу поглощающим каналом является механизм ионизации, и в новой фазе частицами будут положительные ионы и отрицательные электроны. Законы, управляющие поведением плазмы, так же сильно отличаются от законов газообразной фазы, как законы газообразной фазы отличаются от законов жидкой фазы. Силы взаимодействия в плазме — кулоновские. Они отличаются от всех других сил взаимодействия между частицами очень большим радиусом действия. Эти две характеристики — дальнодействие и высокая температура — дают возможность предположить, что Фо/й Т о е и г1п 8″ , так что ( оГ п 1кТ 1. Для кулоновского закона взаимодействия [c.143]
При переходе в плазменную фазу поглощающим каналом является механизм ионизации, и в новой фазе частицами будут положительные ионы и отрицательные электроны. Законы, управляющие поведением плазмы, так же сильно отличаются от законов газообразной фазы, как законы газообразной фазы отличаются от законов жидкой фазы. Силы взаимодействия в плазме — кулоновские. Они отличаются от всех других сил взаимодействия между частицами очень большим радиусом действия. Эти две характеристики — дальнодействие и высокая температура — дают возможность предположить, что Фо/й Т о е и г1п 8″ , так что ( оГ п 1кТ 1. Для кулоновского закона взаимодействия [c.143]
Вращательные собственные волновые функции имеют важные свойства симметрии вращательные функции положительны ( г) лц отрицательны (—) в зависимости от того, меняется или не меняется знак функций при отражении всех атомов в начале координат, а для молекул с центром симметрии собственные функции симметричны (s) или антисимметричны (а) в зависимости от того, являются ли они таковыми по отношению к перестановке одинаковых ядер. Соответствующие вращательные уровни обозначают соответственно + или — их или а. Статистические веса симметричных и антисимметричных уровней различны и зависят от спина и статистики эквивалентных ядер. Для линейных молекул точечной группы симметрии Dork, если спины всех ядер равны нулю, за исключением молекул с центром симметрии, антисимметричные уровни отсутствуют, т. е. для электронного состояния отсутствуют все нечетные уровни, а для состояния 2 j — четные. [c.137]
Соответствующие вращательные уровни обозначают соответственно + или — их или а. Статистические веса симметричных и антисимметричных уровней различны и зависят от спина и статистики эквивалентных ядер. Для линейных молекул точечной группы симметрии Dork, если спины всех ядер равны нулю, за исключением молекул с центром симметрии, антисимметричные уровни отсутствуют, т. е. для электронного состояния отсутствуют все нечетные уровни, а для состояния 2 j — четные. [c.137]
Многочисленные опыты показали, что в кристаллах типа Na l структурные частицы, слагающие кристалл, являются ионами. Атом натрия, после отщепления от его валентного электрона, становится положительно заряженным ионом с устойчивой внешней электронной оболочкой, аналогичной электронной оболочке благородного газа (неона). Атом хлора, присоединяя один электрон, заряжается отрицательно и получает аналогичную устойчивую конфигурацию внешних электронов. Состояние равновесия между Ионами натрия и хлора наступает в результате ураБновешивания сил притяжения между разноименными ионами и сил отталкивания, возникающих между отрицательно заряженными электронными оболочками обоих ионов.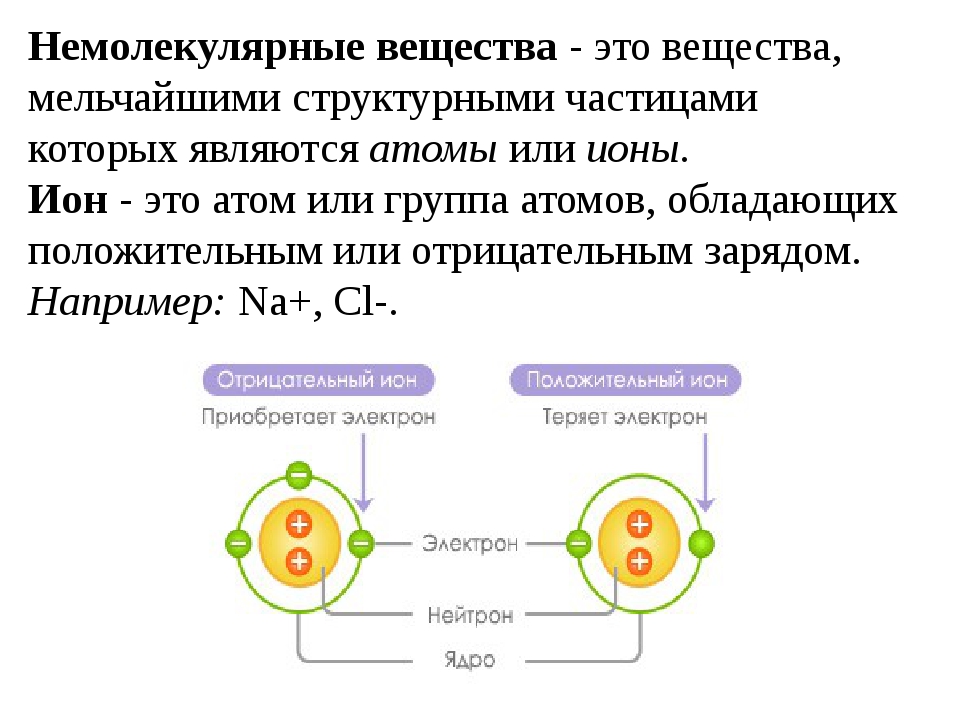 При симметричном окружении каждого иона в кристалле ионами противоположного знака можно с большой степенью точности считать эти ионы несжимаемыми шарами [c.160]
При симметричном окружении каждого иона в кристалле ионами противоположного знака можно с большой степенью точности считать эти ионы несжимаемыми шарами [c.160]
По этой причине картина изменения электронных состояний свободного иона в поле лигандов имеет вид, представленный на рис. 11.2. Энергия дестабилизации Ео при комплексообразовании компенсируется за счет основной энергии связей, в данном случае— притяжения положительного остова центрального иона и отрицательных лигандов. Эту часть энергии в теории кристаллического поля не рассчитывают и поэтому положение центра тяжести расщепленных уровней (относительно которого отсчитывается расщепление) остается неопределенным. Легко показать, что он совпадает с положением терма центрального иона в поле заряда лигандов, распределенного сферически симметрично. Вполне определены здесь лишь относительные положения уровней T2g и Eg, энергетическое расстояние между которыми А называется параметром расщепления кристаллическим полем. [c.38]
[c.38]
Передача влияния заместителя по линии а- и л-связей приводит к изменению электронного состояния этих связей происходит их поляризация, которая оказывается различной в зависимости от типа связи. Если влияние заместителя передается при участии 0-связей, то наблюдается постепенное уменьшение изменения электронного состояния связей. Такая поляризация называется индукционной, а заместитель проявляет индуктивный эффект (/-эффект). Если в цеип имеется л -связь или изолированные л-связи, то происходит поляризация их я-облаков (/д-эффект). Если заместитель имеет положительно пли отрицательно заряженные атомы, то вокруг них создается электрическое поле, которое действует на другие атомы не только по линии связей, но и непосредственно через пространство в этом случае сила воздействия заместителя на другие атомы зависит от конфигурации и от конформации молекулы. Такое влияние заместителя называется эффектом поля (/ -эффект). Если в цепи имеется система сопряженных кратных связей или заместитель с неподеленной электронной парой находится при кратной связи или при ароматическом ядре, то передача влияния происходит по системе я-связей, и эффект заместителя называется эффектом сопряжения (С-эффект), [c.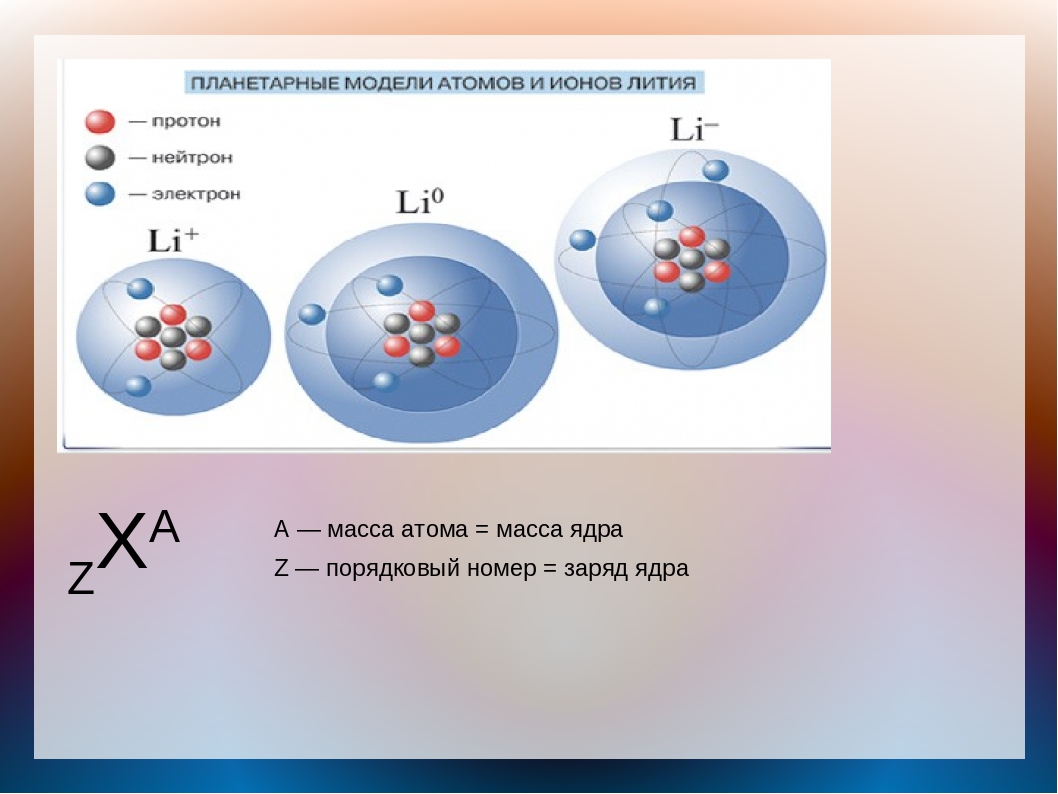 51]
51]
Отрицательные ионы — Справочник химика 21
Одним из важных понятий в электрохимии является число переноса ионов. В электролитах электричество переносится одновременно положительными и отрицательными ионами, потому, естественно, возникает вопрос, каково участие в этом процессе ионов каждого знака (например, доля Ва + и С1 в растворе ВаСЬ доля и 804″ в растворе алюминиевых квасцов). [c.444]К укрупнению частиц осадка приводит также процесс агломерации частиц. Он объясняется тем, что многие осадки состоят из кристаллов с ионной решеткой. Поэтому положительные ионы на поверхности одной частицы могут притягивать к себе отрицательные ионы поверхности другой, в результате чего частицы прилипают друг к другу и образуют агломераты, имеющие более или [c.104]
Применительно к диффузии положительных и отрицательных ионов уравнение (6.23) имеет вид [c. 142]
142]
Аналогичным путем можно найти и поверхностный избыток отрицательных ионов Г [c.244]
Интересно заметить, что было накоплено много фактов в пользу того, что первой стадией окисления Ре такими веществами, как Вгз [135], С1г [136], Гг [117] и О2 [137], является перенос заряда с образованием отрицательных ионов Вг и т. д. -ЬРе подобно тому, как это происходит в системах, содержащих перекись. Оказывается, что прямое окисление Вг», СГ, Р и ОН до соответствующих радикалов может быть индуцировано светом в присутствии Ре или Се , действующих как катализатор . [c.513]
Положительные ионы образуются в результате потери электронов, а отрицательные ионы — в результате присоединения электронов. Следовательно, у иона натрия меньше электронов, чем у атома натрия, а у иона хлора их больше, чем у атома хлора. [c.157]
На примере кристаллического осадка это легко проиллюстрировать следующей схемой (рис. 15). Если рассмотреть схематический разрез кристалла, в котором положительные ионы правильно чередуются с отрицательными, то очевидно, что положительный ион А, находящийся внутри кристалла, окружен в пространстве шестью отрицательными ионами (а, 6, с, и двумя ионами, находящимися в соседних плоскостях) и является электростатически уравновешенным. Напротив, положительный ион В на поверхности кристалла испытывает притяжение лишь пяти отрицательных ионов (/, а, / и двух ионов, находящихся в соседних плоскостях), т. е. он обладает избыточным положительным зарядом, за счет которого может притягивать отрицательные ионы из раствора. Сказанное относится и к отрицательно заряженным ионам. Поверхность осадка притягивает из раствора и катионы, и анионы (а также [c.110]
15). Если рассмотреть схематический разрез кристалла, в котором положительные ионы правильно чередуются с отрицательными, то очевидно, что положительный ион А, находящийся внутри кристалла, окружен в пространстве шестью отрицательными ионами (а, 6, с, и двумя ионами, находящимися в соседних плоскостях) и является электростатически уравновешенным. Напротив, положительный ион В на поверхности кристалла испытывает притяжение лишь пяти отрицательных ионов (/, а, / и двух ионов, находящихся в соседних плоскостях), т. е. он обладает избыточным положительным зарядом, за счет которого может притягивать отрицательные ионы из раствора. Сказанное относится и к отрицательно заряженным ионам. Поверхность осадка притягивает из раствора и катионы, и анионы (а также [c.110]
Правило 10. При применении правила 8 простейший путь — разрушение ближайшего вышестоящего целого или избыточного (отрицательные ионы) уровня, а при применении правила 9 простейший путь — достройка ближайшего нижестоящего нецелого уровня.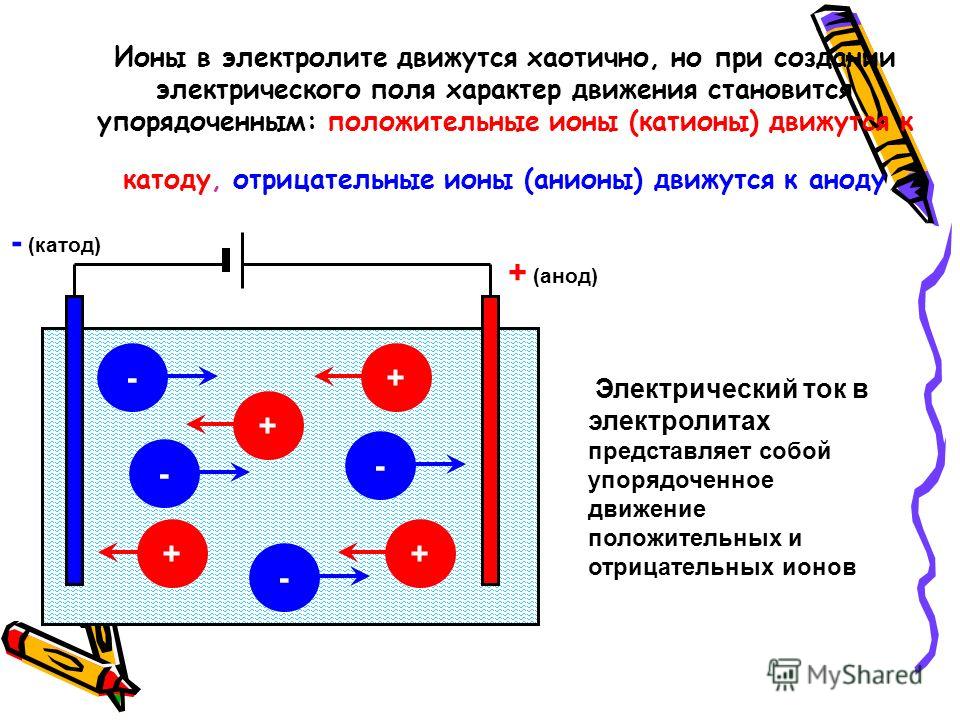 [c.201]
[c.201]
Процесс образования отрицательного иона Н из атома экзотермический (сродство к электрону 0,75 эВ), поэтому для водорода в степени окисления —1 возможны ионные соединения. [c.272]
Для однозарядных отрицательных ионов Ма6=—84 кДж-моль , а для положите [ьны с Л л6= —33 кДж-моль , т. е. для анионов А [c.62]
V тический эффект Р процесса присоединения электрона к нейтральному атому Э с превращением его в отрицательный ион Э» [c.35]
Сродство К электрону выражено через энергию ионизации отрицательных ионов Э . [c.36]
Нейтральные комплексы образуются при координации вокруг атома молекул, а также при одновременной координации вокруг положительного иона-комплексообразователя отрицательных ионов и молекул. Например [c.95]
У Кислоты и основания. Как мы видели, ионизация соединений со / степенью окисления водорода +1 в жидком состоянии происходит с образованием сольватированных положительного и отрицательного ионов [c. 132]
132]
Увотрицательных ионов растворителя) в водных растворах происходит, например, при растворении аммиака [c.133]
Кратные связи, такие, как С = С, С=0, С = С, С = N1 и сопряженные ароматические системы благодаря избытку электронов могут действовать как основания, предоставляя электроны кислотам Льюиса. С другой стороны, в виде отрицательных ионов они могут действовать как кислоты Льюиса по отношению к достаточно сильным основаниям. Такое поведение более характерно для полярных связей, таких, как С = О, а не С = и или С = С. [c.499]
На базе вышесказанного можно дать следующее определение основаниям основание — это соединение, при растворении которого увеличивается концентрация отрицательных ионов растворителя. [c.133]
При бомбардировке молекул электронами наблюдается появление не только положительных, но и отрицательных ионов. Так, при бомбардировке метана электронами наблюдается появление ионов СНГ, СН , С и Н . Присоединение электронов к молекулам, радикалам или атомам обусловлено наличием у них сродства к электрону. При образовании отрицательных ионов очень часто энергия, выделяющаяся в результате присоединения электрона, превосходит энергию диссоциации молекулы. Например, для галогенов наблюдается процесс [c.78]
Присоединение электронов к молекулам, радикалам или атомам обусловлено наличием у них сродства к электрону. При образовании отрицательных ионов очень часто энергия, выделяющаяся в результате присоединения электрона, превосходит энергию диссоциации молекулы. Например, для галогенов наблюдается процесс [c.78]
В нем хорошо растворяются вода, фториды, сульфаты и нитраты s-элементов I группы, несколько хуже аналогичные соединения s-элементов II группы. При этом растворенные веш.ества, отнимая от молекул НР протоны, увеличивают концентрацию отрицательных ионов (HFj), т. е. ведут себя как основания. Например [c.284]
Количества положительных и отрицательных ионов, находящихся в элементе объема йУ, расположенном на расстоянии г от иона, создающего поле, будут (в соответствии с законом распределения Больцмана) равны [c.405]
Озониды — это соединения, состоящие из положительных ионов металла и отрицательных ионов О3 оо = 0,134 нм). Наличие в ионе Оз непарного электрона обусловливает парамагнетизм и наличие окраски у озонидов. Обычно они окрашены в красный цвет. [c.322]
Наличие в ионе Оз непарного электрона обусловливает парамагнетизм и наличие окраски у озонидов. Обычно они окрашены в красный цвет. [c.322]
Если два инертных плоских металлических электрода поместить параллельно друг другу в раствор, который содержит электролит, и приложить к ним небольшой электрический потенциал Е, то между ними возникнет ток /, уменьшающийся во времени. Этот ток будет создаваться движением положительных ионов к катоду и отрицательных ионов к аноду. Вначале он будет подчиняться закону Ома 1=Е1Е, где сопротивление раствора i обратно пропорционально подвижности ионов. Однако по прошествии некоторого времени накопление ионов противоположного заряда вокруг каждого из электродов повлечет за собой образование в растворе некоторого потенциала противоположного знака — потенциала поляризации. Потенциал поляри- [c.552]
Кислотный характер ненасыщенных систем проявляется в их реакциях с щелочными металлами, приводящих к образованию окрашенных отрицательных ионов . Например, реакция [c.500]
Например, реакция [c.500]
Добавки отрицательных ионов оказывают сильное каталитическое действие, вызывая изменение закона скорости. Скорость в этом случае оказывается зависящей либо от первой степени концентрации добавленного иона, либо от квадрата его концентрации. Константы равновесия для ассоциации большинства этих ионов с Ре » известны, и можно считать, что реакция идет через активированный комплекс, образующийся при взаимодействии Ре » и комплекса Ре . Следует учитывать, что закон скорости дает сведения только о числе комплексообразующих ионов, входящих в состав активированного комплекса, но не о том, каким образом они соединены между собой. Некоторые значения констант скоростей, полученных таким образом, приведены в табл. XVI.2. [c.505]
При рассмотрении реакций образования ионов карбония часто удобно рассматривать изменения только иона карбония, не принимая во внимание отрицательный ион. Однако при этом следует помнить, что анион также играет хотя и меньшую, ио существенную роль. Необходимо также отметить, что вошло в привычку рассматривать реакции ионов карбония как процессы, связанные с перемещением (или отщеплением) атома или группы атомов (например, водорода или метила) с присоединенной парой электронов (или, в случае отщепления, без нее) между том полезнее и, вероятно, точнее рассматривать эти реакции, как такие, которые протекают с перемещением или отщеплением пары электронов вместе с присоединенным атомом, группой атомов или без них [67]. [c.216]
Необходимо также отметить, что вошло в привычку рассматривать реакции ионов карбония как процессы, связанные с перемещением (или отщеплением) атома или группы атомов (например, водорода или метила) с присоединенной парой электронов (или, в случае отщепления, без нее) между том полезнее и, вероятно, точнее рассматривать эти реакции, как такие, которые протекают с перемещением или отщеплением пары электронов вместе с присоединенным атомом, группой атомов или без них [67]. [c.216]
Образование отрицательных ионов наблюдается во многих газах (например, в Nh4, N2O, SO2, h3S, Н2О), при этом образуются ионы NH-, 0 , S0, HS- и HQ-. [c.78]
Если имеются только одновалентные положительные и отрицательные ионы, то [c.405]
Прибор позволяет получать различные ионы и ио шзированные осколки и измерять их отиоситольное содержание и массы. Ионы и ионизированные осколки образуются при бомбардировке вещества — в нашем случае углеводородов — электронами в ионизационной камере масс-спектрометра. Эти ионы и ионизированные осколки образуются при прохождении электрона соответствующей энергии вблизи нейтральной молекулы. В зависимости от энергии электрона, которую получает молекула, могут наблюдаться различные эффекты молекула может потерять один или несколько своих электронов и таким образом образовать положительный ион молекула можот распасться на осколки, прячем некоторые из этих осколков теряют электроны я становятся положительными ионами. Реже может происходить захват электрона, приводящий к образованию отрицательного иона. В масс-спектрометрах стандартного типа отрицательные ионы обычно не измеряются относительно образования таких ионов из углеводородов и их поведения мы располагаем весьма ограниченными сведениями. [c.336]
Эти ионы и ионизированные осколки образуются при прохождении электрона соответствующей энергии вблизи нейтральной молекулы. В зависимости от энергии электрона, которую получает молекула, могут наблюдаться различные эффекты молекула может потерять один или несколько своих электронов и таким образом образовать положительный ион молекула можот распасться на осколки, прячем некоторые из этих осколков теряют электроны я становятся положительными ионами. Реже может происходить захват электрона, приводящий к образованию отрицательного иона. В масс-спектрометрах стандартного типа отрицательные ионы обычно не измеряются относительно образования таких ионов из углеводородов и их поведения мы располагаем весьма ограниченными сведениями. [c.336]
Очень часто в твердых солях появляется так называемая униполярная (односторонняя) проводимость —электрический ток в них представляет собой движение или только положительных, или только отрицательных ионов. Наличие односторонней проводимости можно доказать экспериментально. Можно, например, зажать несколько столбиков иодистого серебра между серебряными электродами и пропускать через этот проводник ток при [c.453]
Можно, например, зажать несколько столбиков иодистого серебра между серебряными электродами и пропускать через этот проводник ток при [c.453]
Для многозарядных ионов дополнительные трудности возникают из-за того, что специфическое взаимодействие ионов, предложенное Бренстедом, оказывает гораздо более сильное влияние на скорость реакции, чем изменение коэффициентов активности. Поэтому корреляция между ]g k/k° и концентрацией многозарядного иона, противоположного по знаку иону, участвующему в реакции, соблюдается лучше, чем между ]g(A /A o) иионной силой раствора. Это было проиллюстрировано на примере зависимости константы скорости реакции Hg -l-GO(NHз)5Br (см. рис. XV.5) от концентрации (С1О4) одновременно замечено, что константа не зависит от концентрации катиона [45]. Те же авторы показали, что в реакции ВгСНаСО + ЗгОз — — (ЗгОзСНгСОг) Н- Вг» константа скорости зависит от (К ), а не от концентрации отрицательного иона (в качестве отрицательных ионов использовались N03, 30 и o( N)5″. В большинстве опытов ионная сила раствора менялась в интервале от 0,001 до 0,04 М). В обоих случаях при постоянной концентрации иона противоположного заряда, но более чем двукратном изменении ионной силы раствора константа скорости реакции изменялась менее чем на 2%. Это совершенно очевидно противоречит уравнению Бренстеда. [c.450]
В большинстве опытов ионная сила раствора менялась в интервале от 0,001 до 0,04 М). В обоих случаях при постоянной концентрации иона противоположного заряда, но более чем двукратном изменении ионной силы раствора константа скорости реакции изменялась менее чем на 2%. Это совершенно очевидно противоречит уравнению Бренстеда. [c.450]
Заряженными частицами, принимающими участие в обмене между фазами, могут быть положительные и отрицательные ионы, а также электроны. Какие именно частицы переходят из одной фазы в другую и тем самым обусл(Звливают возникновение скачка потенциала, определяется природой граничащих фаз. На границах металл — вакуум или металл 1 — металл 2 такими частицами являются обычно электроны. При создании границы металл — раствор солн металла в обмене участвуют катионы металла (см., однако, ниже). Скачок потенциала на границе стекло — раствор, а также ионообменная смола — раствор по5 вляется в результате обмена, в котором участвуют два вида одноименно заряженных ионов. На границах стекло — раствор и катионнг—раствор такими нонами являются ноны щелочного металла и водорода иа границе анионит— раствор это ион гидроксила н какой-либо другой анион. Прн контакте двух несмешивающихся жидкостей, каждая из которых содержит в растворенном виде один и тот же электролит, потенциал возникает за счет неэквивалентного перехода обоих ионов электролита из одной фазы в другую. [c.28]
На границах стекло — раствор и катионнг—раствор такими нонами являются ноны щелочного металла и водорода иа границе анионит— раствор это ион гидроксила н какой-либо другой анион. Прн контакте двух несмешивающихся жидкостей, каждая из которых содержит в растворенном виде один и тот же электролит, потенциал возникает за счет неэквивалентного перехода обоих ионов электролита из одной фазы в другую. [c.28]
Таким образом, согласно теории Бренстеда, кислотами и основаниями могут быть иедиссоциироваииые молекулы (иапример, H l и Nh4), пoлo>китeJПJИыe и отрицательные ионы (например, NH I-). [c.71]
Из (3.10) п (3.11) следует, что реально определимы химические потенциалы, а следовательно, и а коэффициенты активностей лишь молекулярных веществ, в том числе и электролита в целом. Активность отдельных заряженных частиц, в том числе ионов, на которые распадается электролит, в общем случае экспериментально определить нельзя ее можно оценить приближенно лишь в области весьма разбавленных растворов. Действительно, в силу условия электронептральностн раствора изменение содержания ионов данного вида (да1шого заряда) в сколько-нибудь заметных пределах без одновременного и эквивалентного пзмене-иия содержания ионов противоположного знака невозможно. Определяются обычно активность эл( ктролита йэ и так называемые средние активности ионов а . Соотношения между ними можно найти следующим образом. Предполагая, что электролит распадается при диссоциации на v+ положительных и V отрицательных ионов, [c.76]
Действительно, в силу условия электронептральностн раствора изменение содержания ионов данного вида (да1шого заряда) в сколько-нибудь заметных пределах без одновременного и эквивалентного пзмене-иия содержания ионов противоположного знака невозможно. Определяются обычно активность эл( ктролита йэ и так называемые средние активности ионов а . Соотношения между ними можно найти следующим образом. Предполагая, что электролит распадается при диссоциации на v+ положительных и V отрицательных ионов, [c.76]
ИОН, расположенный в начале координат, заряжен положительно, то элемент объема с1У будет обладать избыточным отрицательным зарядом. Предполагая, что к распределению ионов в растворе применим иринцин Больцмана и что силы, действующие между ионами, по своей природе электростатические, число отрицательных ионов в элементарном объеме с1У можно выразить как [c.85]
Градиент потенциала в растворе электролита может возникать либо в результате наложения внешнего электрического поля на электрохимическую систему (см. гл. 4 и 5), либо в результате различия в скоростях движения положительных и отрицательных ионов, приводящего к появлению так называемого диффузионного потенциала (см. ниже). Следовательнс, в отличие от злектропроводно-сти, где можно было пренебречь и конвекцией, и молекулярной диффузней и рассматривать миграцию в чистом виде, при изучении диффузии электролитов необходимо учитывать градиенты как химического, так и электрического потенциалов. [c.140]
гл. 4 и 5), либо в результате различия в скоростях движения положительных и отрицательных ионов, приводящего к появлению так называемого диффузионного потенциала (см. ниже). Следовательнс, в отличие от злектропроводно-сти, где можно было пренебречь и конвекцией, и молекулярной диффузней и рассматривать миграцию в чистом виде, при изучении диффузии электролитов необходимо учитывать градиенты как химического, так и электрического потенциалов. [c.140]
Как уже отмечалось, подвижности катионов и анионов обычно неодинаковы и+Фи- II Х+ФЛ-), а следовательно, не равны и их коэффициенты диффузии (В фВ ). Поэтому ири одном и том же. градиенте коцентрации скорость диффузии положительных и отрицательных ионов различна. Если предположить, например, что создана граница между двумя растворами соляной кислоты, концентрации которых равны соответственно с и с—de, то в сторону разбавленного раствора иродиффундирует за некоторый отрезок времени больше ионов водорода, чем хлора, поскольку Я ] — > -В результате этого возникнет разность потенциалов между концентрированным и разбавленным растворами, причем последний ока- [c. 142]
142]
Электрокапиллярные свойства граиицы ртуть — раствор электролита можно объяснить, если допустить, что в отсутствие внешней э.д.с. ртуть при потенциале оказывается заряженной положительно по отношению к раствору (рис. 11.3, а). Избыточный положительный заряд ртути связан, вероятнее всего, с ионами ртути, находящимся у ее поверхности (со стороны металла). Система в целом, так же как и входящая в нее поверхностная фаза, должны подчиняться закону электронейтральности. Поэтому со стороны раствора у границы раздела будет избыток отрицательных ионов, компенсирующий положительные ионы ртути, находящиеся на металле. Присутствие одноименно (положительно) заряженных ионов ртути на поверхности металла неизбежно приводит к появлению отталкивающих сил, и поверхностное натяжение на границе ртуть — раствор не может быть высоким на рис. П.З оно отвечает некоторой величине оь [c.238]
Концентрация отрицательных ионов растворителя может увеличиваться также за счет растворения некоторых соединений, содер-жащи -соответствующие радикалы.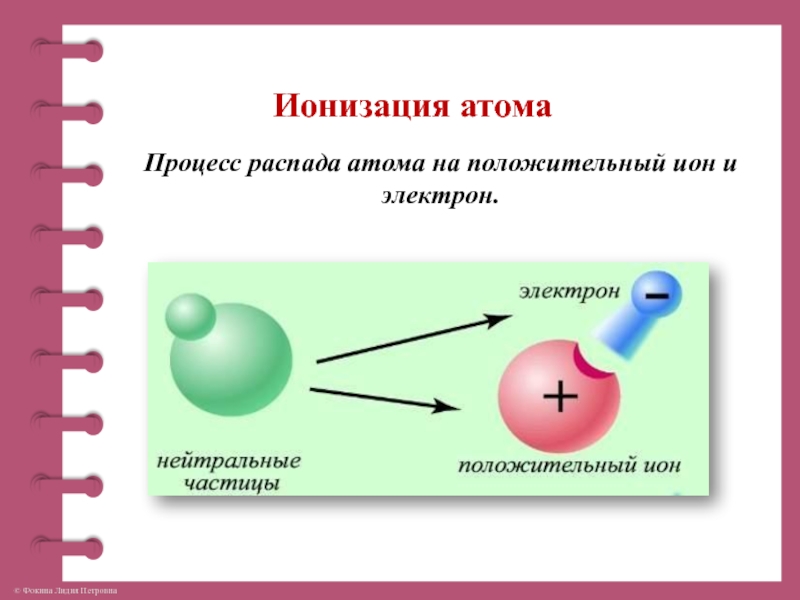 Из этих соединений лучше всего диссоциируют щелочи. В водных растворах щелочами являются гидроксиды— КОН, Ва(ОН)г в жидком аммиаке к щелочам относятся дигидронитриды — KNH г, Ba(NH 2) 2- [c.133]
Из этих соединений лучше всего диссоциируют щелочи. В водных растворах щелочами являются гидроксиды— КОН, Ва(ОН)г в жидком аммиаке к щелочам относятся дигидронитриды — KNH г, Ba(NH 2) 2- [c.133]
Так, представления ТКП можно распространить на описание кристаллических соединений. Если допустить, что кристалл состоит из ионов, то каждый из ионов ( -эле-мента 1 аходится в поле отрицательных ионов. Это приводит к расщеплению -уровня иона -элемента, что определяет магнитные свойства его соешнений, их окраску и другие свойства. [c.509]
Хотя эти данные показывают, что отрицательные ионы, которые, вероятно, действуют как частицы, уменьшающие плотность заряда, могут ускорять обмен, они не дают нам сведений о механизме реакции, не дают ответа на вопрос, идут ли эти реакции за счет переноса электрона или путем переноса атома. Некоторые весьма интересные с этой точки зрения факты вытекают из работы Таубе с сотр. [98] по изучению реакции между Со (NHз)5 P и Сг » в растворах НСЮ4, приводящей к образованию частиц Со » и Сг » . Они нашли, что все образующиеся ионы Сг= » находятся в виде комплекса СгСР» и что если кобальтовый комплекс содержит радиоактивный С1 , то в конце реакции последний оказывается в СгСР» . Это весьма недвусмысленное указание на то, что перенос атома С1 осуществляется через двух-ядерный активированный комплекс [c.505]
Они нашли, что все образующиеся ионы Сг= » находятся в виде комплекса СгСР» и что если кобальтовый комплекс содержит радиоактивный С1 , то в конце реакции последний оказывается в СгСР» . Это весьма недвусмысленное указание на то, что перенос атома С1 осуществляется через двух-ядерный активированный комплекс [c.505]
Иаппые твердые вещества. Ветцсства тина Na l с решеткой, построенной из регулярно чередуюш,ихся положительных и отрицательных ионов. Иа поверхностях и в углах таких твердых тел электрические ноля весьма велики. Можно ожидать, что такие вещества будут облегчать протекание ионных реакций II реакций между полярными молекулами. [c.532]
Время, необходимое для установления такого стационарного состояния, будет зависеть от коэффициентов диффузии иопов в растворе и размеров электродов. Для малого сферического электрода радиусом Гр время установления квазистационарного состояния будет порядка При tq = 0,1 см ti D 10 5 см /сек t приблизительно равно 100 сек, так что для больших электродов времена могут оказаться весьма большими. В случае ионов диффузия О и R зависит также от скорости движения отрицательных ионов в растворе. [c.556]
В случае ионов диффузия О и R зависит также от скорости движения отрицательных ионов в растворе. [c.556]
По Уитмору при реакции присоединения галоидоводородов к олефинам сначала протон присоединяется к олефину с образованием карбоний-иона, затем отрицательный ион галоида присоединяется к атому углерода с недостаточным количеством электронов. Так, для пропилена реакцию можно написать так [c.367]
Урок 6. Простые ионы – HIMI4KA
У нас вышел новый курс, где всё объясняется ещё проще. Подробннее по ссылке
В уроке 6 «Простые ионы» из курса «Химия для чайников» познакомимся с простыми ионами и выясним, чему равен его заряд; также рассмотрим как образуется ионная химическая связь; научимся определять степень окисления и валентность элементов. Данный урок очень важный, и чтобы его лучше понять, обязательно просмотрите прошлые уроки, особое внимание уделяя уроку 1 «Схема строения атомов», а также уроку 3 «Схема образования молекул».
Ионная химическая связь
Мы уже кратко рассматривали ковалентную полярную химическую связь, в которой из-за незначительного различия в электроотрицательности атомов (0.4-2.0) электронная пара распределяется между ними не равномерно. Для тех, кто забыл, напоминаю, что электроотрицательность — это способность атомов притягивать к себе электроны.
Однако, если электроотрицательность атомов различается больше чем на 2 по таблице электроотрицательности, то электронная пара полностью переходит к более электроотрицательному атому, и в результате образуется ионная химическая связь. Ионная химическая связь образуется только между атомами типичных металлов (т.к. они легко теряют внешние электроны) и неметаллов (т.к. они обладают большой электроотрицательностью).
Положительные и отрицательные ионы
Наглядным примером ионной химической связи может служить обычная поваренная соль NaCl, которая присутствует на каждой кухне.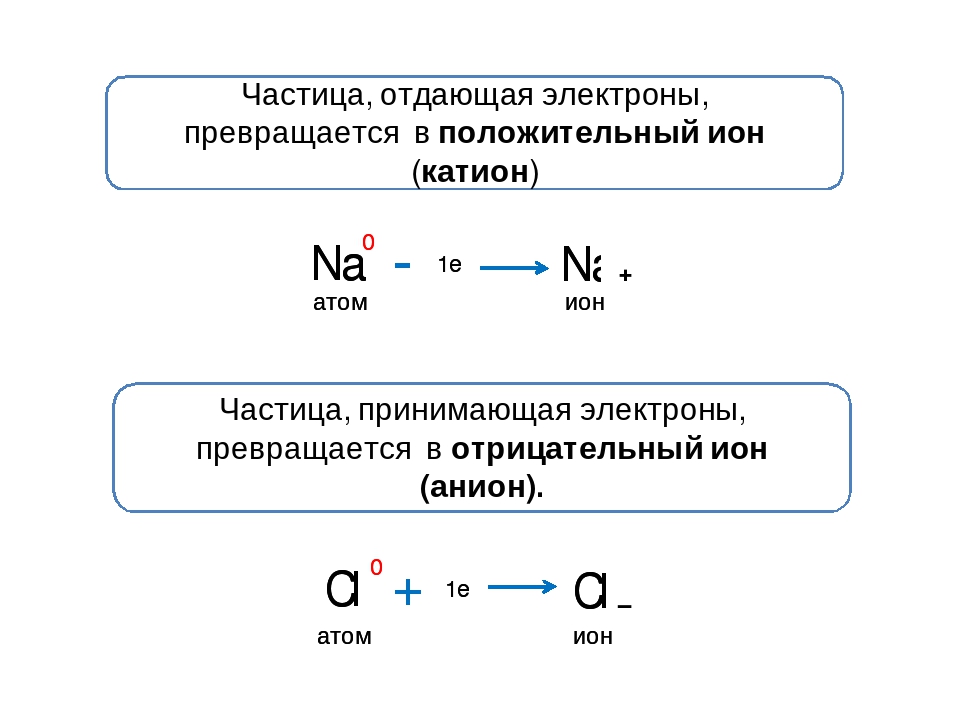 Атомы натрия (и вообще всех металлов) слабо удерживают внешние электроны, тогда как атомы хлора напротив, обладают очень большой способностью притягивать к себе электроны, т.е обладают большой электроотрицательностью.
Атомы натрия (и вообще всех металлов) слабо удерживают внешние электроны, тогда как атомы хлора напротив, обладают очень большой способностью притягивать к себе электроны, т.е обладают большой электроотрицательностью.
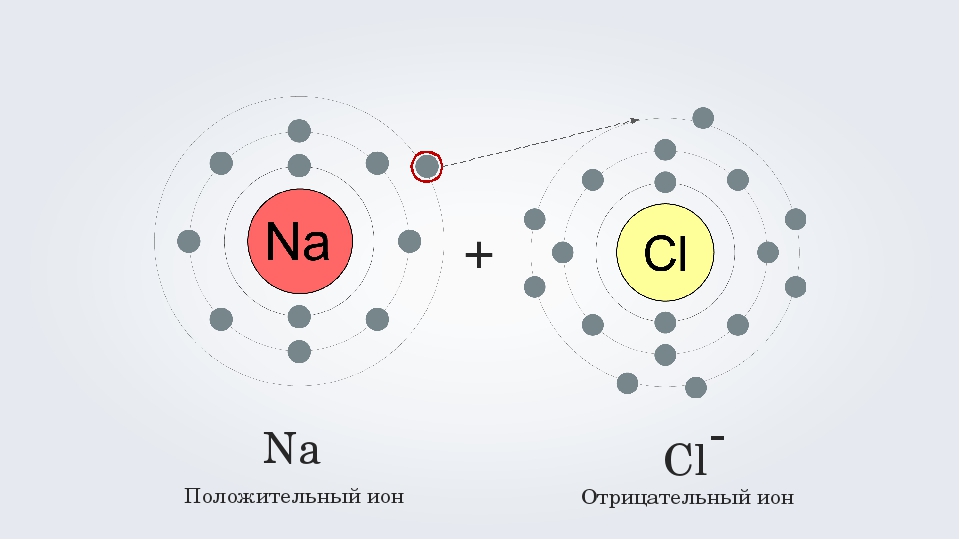
Поэтому при образовании молекулы NaCl каждый атом Na теряет один электрон (e—), образуя положительный ион натрия Na+, а каждый атом Cl, наоборот, приобретает этот потерянный электрон натрия, образуя отрицательный ион хлора Cl—. Это записывается в виде двух реакций:
- Na → Na+ + e— и ½Cl2 + e— → Cl—
Записать ½Cl2 пришлось потому, что газообразный хлор в природе состоит из двухатомных молекул, а не из свободных одиночных атомов хлора.
На рисунке выше, изображена кристаллическая решетка NaCl, где каждый хлорид-ион Cl— окружен со всех сторон соседними положительными ионами натрия Na+; ионы натрия Na+ точно также окружены ближайшими хлорид-ионами Cl—.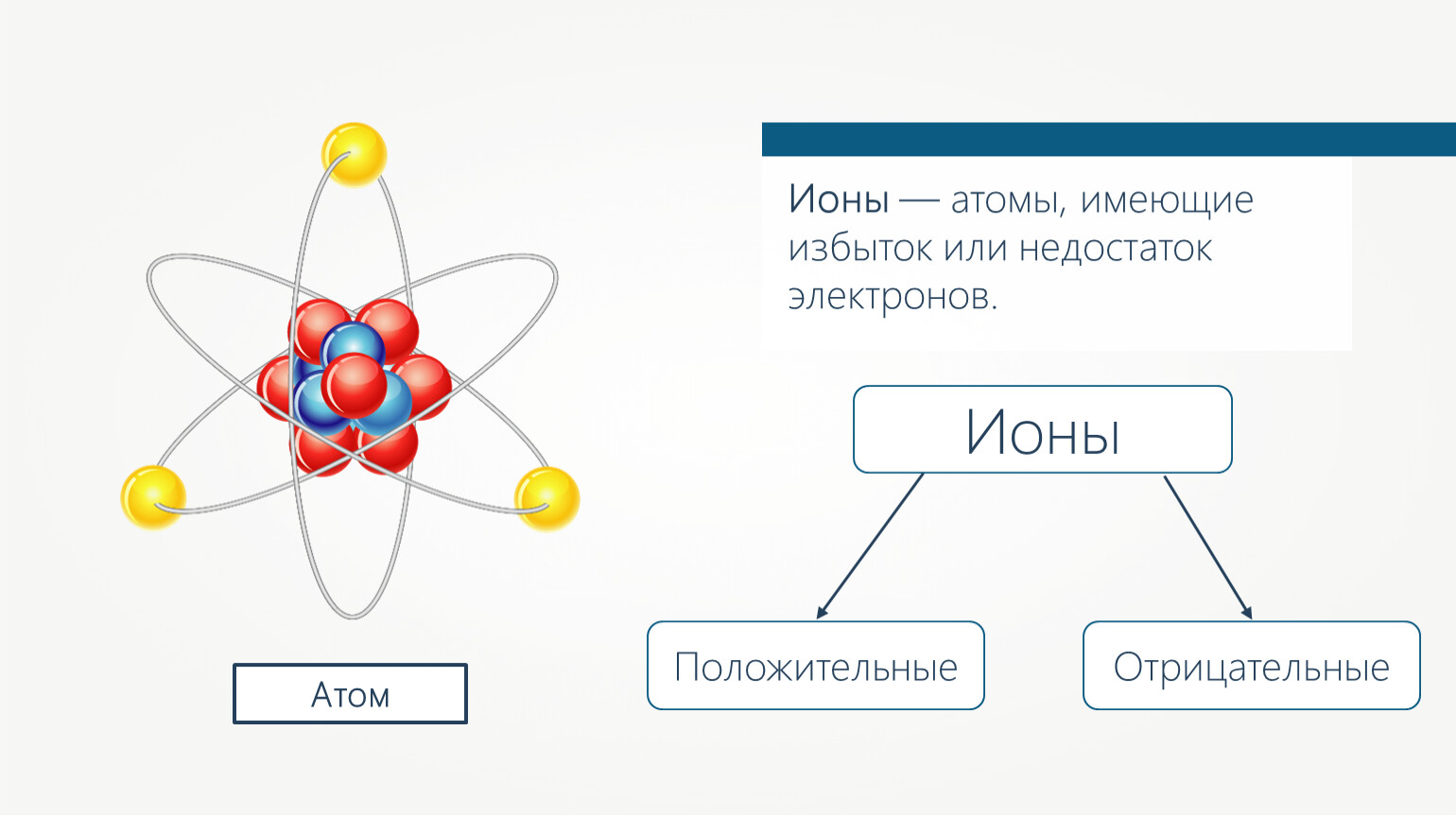 Подобное расположение ионов обладает высокой устойчивостью.
Подобное расположение ионов обладает высокой устойчивостью.
Положительно заряженные ионы называются катионами. К ним в основном относятся металлы, так как они легко отдают от одного до трех электронов. Ниже приведены примеры катионов:
Анионами являются неметаллы, поскольку с радостью присоединяют к себе электроны, превращаясь в отрицательно заряженные ионы. Примеры анионов:
Степень окисления веществ
Заряд простого, одноатомного иона, например Mg2+ или F2-, называется его степенью окисления. Степень окисления — это такое число электронов, которое необходимо прибавить (восстановить) к иону или отнять (окислить) у него, чтобы он превратился обратно в нейтральный атом.
- Реакция восстановления: Mg2+ + 2e— → Mg
- Реакция окисления: F2- → F + 2e—
Процесс присоединения электронов к атому или просто их смещение в сторону данного атома называется реакцией восстановления, а оттягивание электронов от атома или их полное удаление называется реакцией окисления. Вот вам отличная шпаргалка со степенями окисления простых ионов:
Вот вам отличная шпаргалка со степенями окисления простых ионов:
Пример 12. Окисляется или восстанавливается хлор при образовании хлорид-иона? Какова степень окисления этого иона?
Решение: Хлор восстанавливается, поскольку к каждому атому хлора необходимо присоединить один электрон, чтобы образовался хлорид-ион. Хлорид-ион, Сl—, имеет степень окисления -1.
Пример 13. Окисляются или восстанавливаются металлы при образовании ими ионов? Какова степень окисления иона алюминия?
Решение: При образовании ионов металлов последние окисляются, поскольку при этом происходит удаление электронов от атомов металла. Ион алюминия, Аl3+, имеет степень окисления +3.
Валентность химических элементов
Валентностью называют число химических связей, которые данный атом образует с другими атомами в молекуле. Однако, если говорить простыми словами, то под валентностью понимается все та же степень окисления, но в отличии от нее валентность не имеет знака и не равна нулю.
| Молекулярная формула | Валентность | Степень окисления |
| H2O | H(I), O(II) | H+1, O-2 |
| CS2 | C(IV), S(II) | C+4, S-2 |
| CH4 | C(IV), H(I) | C-4, H+1 |
Название ионов
Ионы металлов, которые имеют различные (переменные) степени окисления, записываются следующим образом:
- Fe2+ железо(II) или ион двухвалентного железа
- Fe3+ железо(III) или ион трехвалентного железа
- Сu+ медь(I) или ион одновалентной меди
- Cu2+ медь (II) или ион двухвалентной меди
- Sn2+ олово(II) или двухвалентного олова
- Sn4+ олово(IV) или ион четырехвалентного олова
Пример 2: Окисление или восстановление происходит при превращении иона трехвалентного железа в ион двухвалентного? Запишите уравнение этого процесса.
Решение: Уравнение реакции имеет следующий вид: Fe3+ + e— → Fe2+. Она представляет собой процесс восстановления, поскольку к исходному иону присоединяется электрон.
Надеюсь урок 6 «Простые ионы» оказался для вас понятным и полезным. Если у вас возникли вопросы, пишите их в комментарии.
Хотите ещё проще? Мы создали новый курс, где максимум за 7 дней вы овладете химией с нуля. Подробннее по ссылке
Электрический заряд: положительный, отрицательный. Элементарный, дискретность, электрон, протон, точечный. Модель атома. Закон сохранения
Тестирование онлайн
Электрический заряд. Основные понятия
Электрический заряд
Нам приходится буквально отлеплять одну от другой свежевыстиранные и доставаемые из сушилки вещи, или когда мы никак не можем привести в порядок наэлектризованные и буквально встающие дыбом волосы. А кто не пробовал подвесить воздушный шарик к потолку, после трения его о голову? Подобное притяжение и отталкивание является проявлением статического электричества. Подобные действия называются электризацией.
Подобные действия называются электризацией.
Статическое электричество объясняется существованием в природе электрического заряда. Заряд является неотъемлемым свойством элементарных частиц. Заряд, который возникает на стекле при трении его о шелк, условно называют положительным, а заряд, возникающий на эбоните при трении о шерсть, — отрицательным.
Рассмотрим атом. Атом состоит из ядра и, летающих вокруг него, электронов (на рисунке синие частицы). Ядро состоит из протонов (красные) и нейтронов (черные).
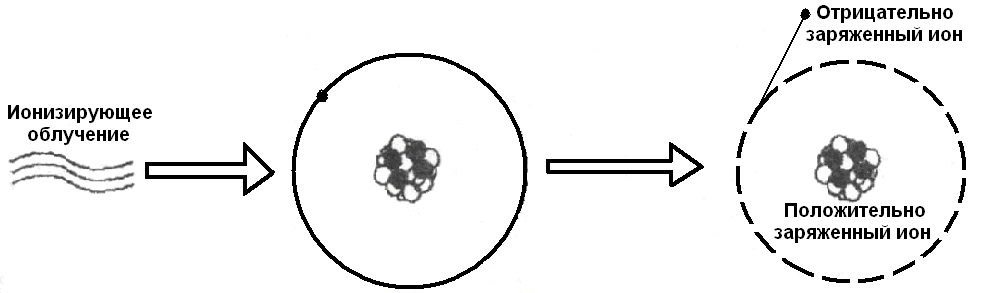
.Носителем отрицательного заряда является электрон, положительного — протон. Нейтрон — нейтральная частица, не имеет заряда.
Величина элементарного заряда — электрона или протона, имеет постоянное значение и равна
Весь атом нейтрально заряжен, если количество протонов соответствует электронам. Что произойдет, если один электрон оторвется и улетит? У атома станет на один протон больше, то есть положительных частиц больше, чем отрицательных. Такой атом называют положительным ионом. А если присоединится один электрон лишний — получим отрицательный ион. Электроны, оторвавшись, могут не присоединятся, а некоторое время свободно перемещаться, создавая отрицательный заряд. Таким образом, в веществе свободными носителями заряда являются электроны, положительные ионы и отрицательные ионы.
Такой атом называют положительным ионом. А если присоединится один электрон лишний — получим отрицательный ион. Электроны, оторвавшись, могут не присоединятся, а некоторое время свободно перемещаться, создавая отрицательный заряд. Таким образом, в веществе свободными носителями заряда являются электроны, положительные ионы и отрицательные ионы.
Для того, чтобы имелся свободный протон, необходимо, чтобы разрушилось ядро, а это означает разрушение атома целиком. Такие способы получения электрического заряды мы рассматривать не будем.
Тело становится заряженным, когда оно содержит избыток одних или иных заряженных частиц (электронов, положительных или отрицательных ионов).
Величина заряда тела кратна элементарному заряду. Например, если в теле 25 свободных электронов, а остальные атомы являются нейтральными, то тело заряжено отрицательно и его заряд составляет . Элементарный заряд не делим — это свойство называется дискретностью
Одноименные заряды (два положительных или два отрицательных) отталкиваются, разноименные (положительный и отрицательный) — притягиваются
Точечный заряд — это материальная точка, которая имеет электрический заряд.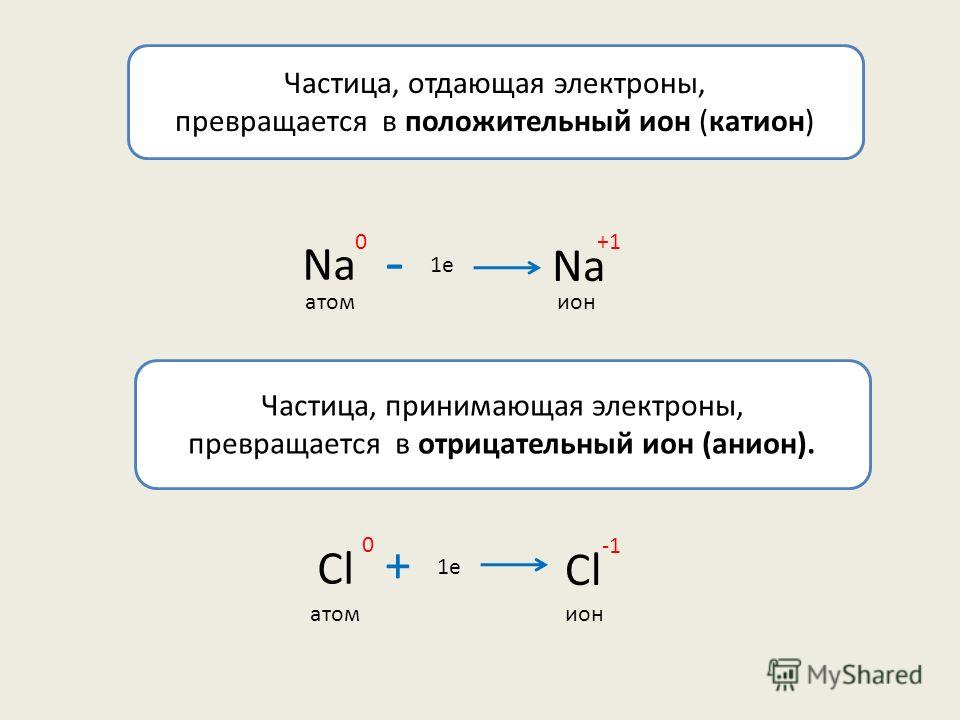
Закон сохранения электрического заряда
Замкнутая система тел в электричестве — это такая система тел, когда между внешними телами нет обмена электрическими зарядами.
Алгебраическая сумма электрических зарядов тел или частиц остается постоянной при любых процессах, происходящих в электрически замкнутой системе.
На рисунке пример закона сохранения электрического заряда. На первой картинке два тела разноименного заряда. На втором рисунке те же тела после соприкосновения. На третьем рисунке в электрически замкнутую систему внесли третье нейтральное тело и тела привели во взаимодействие друг с другом.
В каждой ситуации алгебраическая сумма заряда (с учетом знака заряда) остается постоянной.
Главное запомнить
1) Элементарный электрический заряд — электрон и протон
2) Величина элементарного заряда постоянна
3) Положительный и отрицательный заряды и их взаимодействие
4) Носителями свободных зарядов являются электроны, положительные ионы и отрицательные ионы
5) Электрический заряд дискретен
6) Закон сохранения электрического заряда
Что такое отрицательные и положительные ионы?
1 Ионы сейчас окружают вас повсюду, и, хотя вы их не замечаете, они могут влиять на ваше самочувствие.
Так что же такое ион? Это молекула, которая потеряла или приобрела электрон в результате различных атмосферных воздействий или воздействий окружающей среды.
Существуют как положительные, так и отрицательные ионы, но определения вводят в заблуждение с точки зрения того, как они влияют на вас.
Что такое положительно заряженные ионы?
Простое определение положительного иона — это электрически заряженный атом или группа атомов, образованная потерей одного или нескольких электронов.Число протонов не меняется, но уменьшение количества электронов дает атому положительный заряд.
Положительные ионы в воздухе — это обычно молекулы углекислого газа, лишенные электрона. Было доказано, что они, также известные как положительно заряженные ионы или катионы, оказывают негативное влияние на ваше тело, когда вы подвергаетесь их чрезмерному воздействию.
Это особенно касается ваших легких и дыхательных путей, хотя ваша иммунная система также может быть затронута. Это связано с тем, что ионы настолько малы, что они попадают прямо в кровоток из воздуха, которым вы дышите.
Это связано с тем, что ионы настолько малы, что они попадают прямо в кровоток из воздуха, которым вы дышите.
Избыток положительно заряженных ионов в окружающей среде может способствовать усталости и нехватке энергии, напряженности, беспокойству и раздражительности. Они даже были исследованы как фактор, способствующий аллергии, мигрени и расстройствам настроения.
Как образуется положительный ион?
В природе положительные ионы обычно образуются из-за сильного ветра, пыли, влажности и загрязнения.Они достигли своего пика прямо перед грозой.
Это было выдвинуто предположением о том, почему так много людей чувствуют себя неуютно перед бурей и почему в это время часто также сообщают о респираторных проблемах.
Если вы когда-либо проводили много времени, гуляя по оживленной дороге или в прачечной, вы испытали на себе утомляющие эффекты высоко заряженной среды.
К сожалению, наши современные дома и рабочие места также стали хроническими генераторами потенциально вредных положительных ионов.
Офисные системы кондиционирования воздуха, флуоресцентные лампы, сотовые телефоны, электрическое и компьютерное оборудование — все это мощные генераторы положительных ионов, особенно плохие принтеры и копировальные аппараты.
Хороший настольный очиститель воздуха и ионизатор могут помочь бороться с загрязнением положительными ионами во время работы, а также с вредными летучими органическими соединениями, которые так часто встречаются в офисном воздухе открытой планировки.
В вашем доме люминесцентные лампы, телевизоры, кондиционеры и микроволновые печи являются излучателями положительных ионов.
Тепловентиляторы, фены и сушилки для одежды также являются особенно сильными источниками положительно заряженных ионов.
Что еще хуже, поскольку большинство домов изолированы снаружи, у свежего воздуха мало шансов, и его отрицательные ионы поступают с достаточно высокими уровнями, чтобы противодействовать этому загрязнению положительными ионами.
Если вы не живете в деревне, открывать окно в любом случае может быть не так полезно. В больших городах и городских условиях в воздухе гораздо больше катионов и гораздо меньше анионов, чем в сельской местности.
В больших городах и городских условиях в воздухе гораздо больше катионов и гораздо меньше анионов, чем в сельской местности.
Что такое отрицательно заряженные ионы?
Определение отрицательного иона — это электрически заряженный атом или кластер атомов, образованный путем получения одного или нескольких электронов. Число протонов в атоме не меняется, но лишние электроны придают ему отрицательный заряд.
Отрицательные ионы, также известные в науке как анионы, являются противоположностью положительных ионов, и они оказывают противоположное влияние на ваше настроение, уровень энергии и самочувствие, когда вы подвергаетесь их воздействию.
Анионы имеют сильный отрицательный заряд и статически притягиваются к частицам в воздухе, таким как пыль, споры плесени, шерсть домашних животных и другие аллергены.
Присоединяясь к плавающим загрязнителям, они придают им отрицательный заряд, и вместо того, чтобы летать по воздуху, они заземляются и падают на пол или ближайшую поверхность.
Научные исследования показывают, что даже бактерии и вирусы, циркулирующие в воздухе вашего дома, могут быть удалены путем прикрепления к ним отрицательно заряженных ионов и удаления их из воздуха, которым вы дышите.
Как образуется отрицательный ион?
В природе отрицательные ионы в изобилии встречаются, особенно в лесах, на пляже и особенно у водопадов, где разбивающаяся вода является естественным генератором анионов.
Это хорошая часть причины, по которой вы обычно так хорошо себя чувствуете в этих местах и вам трудно быть усталым или несчастным в такой обстановке.
Самую яркую демонстрацию бодрящего и освежающего действия отрицательно заряженных ионов можно ощутить в воздухе после сильной грозы, который насыщен полезными анионами.
Что, если бы вы могли приносить такой очищенный воздух в свой дом каждый день?
Можно с отрицательным ионизатором высокой мощности.Это специальные устройства, генерирующие отрицательные ионы, которые используют способ генерации молнии в гораздо меньшем масштабе.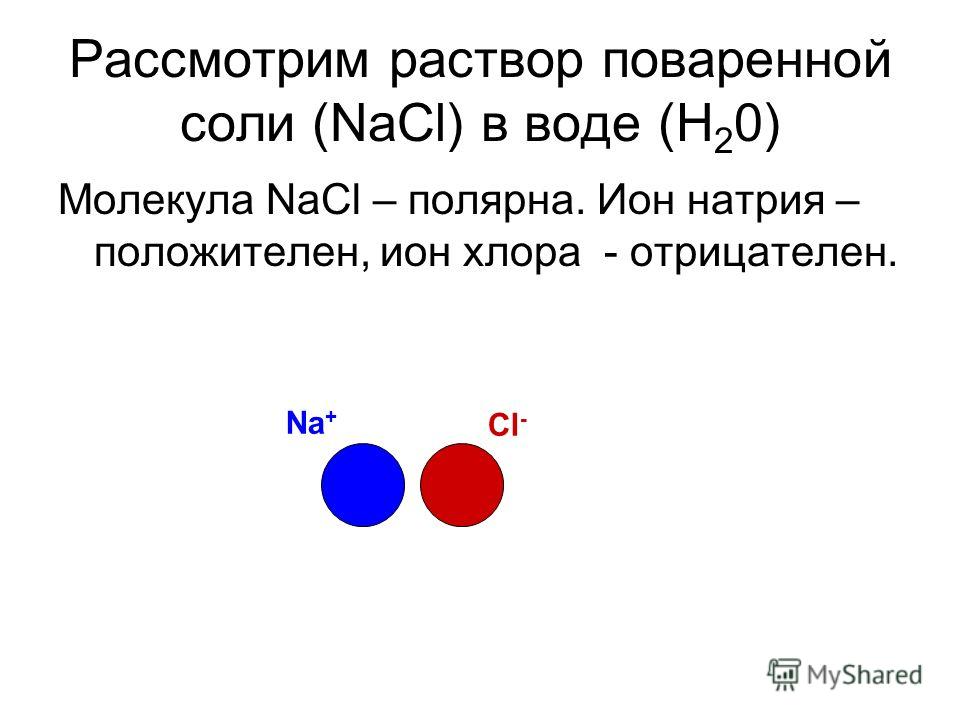
Их использование может помочь вернуть баланс положительных и отрицательных ионов в вашем доме или офисе в сторону, более благоприятную для здоровья.
Многие люди удивляются тому, насколько хорошо они себя чувствуют с большим количеством отрицательно заряженных ионов по сравнению с положительно заряженными ионами, циркулирующими в их жилом пространстве.
Еще один хороший вариант — это ионизирующий очиститель воздуха, подобный этому, специально разработанный для наполнения воздуха в вашем доме полезными отрицательно заряженными ионами, одновременно фильтруя воздух от загрязняющих веществ.
Здесь рассказывается о многих преимуществах отрицательных ионов для вашего здоровья, а также о том, как работают генераторы ионов, чтобы изменить воздух, которым вы дышите.
Я надеюсь, что эта страница помогла прояснить разницу между положительно заряженными ионами и отрицательно заряженными ионами. А также почему полезно иметь меньше катионов и гораздо больше анионов там, где вы работаете и живете.
Простой и недорогой способ противодействовать разрушающим положительным ионам и очищать воздух, которым вы дышите, где бы вы ни находились, с помощью одного из этих персональных очистителей воздуха, которые вы можете носить.Они приносят здоровые отрицательные ионы даже в самые загрязненные места.
Когда отрицательный является положительным — как воздействие большего количества отрицательных ионов может положительно повлиять на ваше здоровье
Что такое положительные ионы?Положительные ионы — это небольшие молекулы, которые приобрели положительный заряд. Большинство загрязнений, токсичных химикатов, перхоти домашних животных, пыльцы, плесени и других вредных химикатов в воздухе несут положительный электрический заряд, что делает их положительными ионами.
Высокий уровень положительных ионов в окружающей среде может привести к множеству заболеваний. Это потому, что мы окружены положительными ионами из электромагнитных полей, генерируемых компьютерами, сотовыми телефонами и другими электронными устройствами, которые могут нарушать работу мозга и подавлять иммунную систему, вызывая такие симптомы, как беспокойство, затрудненное дыхание, усталость, головные боли, раздражительность, недостаток энергии. энергии, плохой концентрации, тошноты и головокружения.
К сожалению, в современном обществе в воздухе содержится значительное количество положительных ионов, намного больше, чем то, с чем приходилось иметь дело нашим предкам.Особенно проблематичны они в городах, офисных зданиях и промышленных зонах.
Что генерирует положительные ионы?В природе положительные ионы обычно образуются из-за сильного ветра, пыли, влажности и загрязнения. Они достигли своего пика прямо перед грозой. Как правило, все токсичное или электромагнитное вещество генерирует вредные положительные ионы.
Офисные системы кондиционирования воздуха, флуоресцентные лампы, сотовые телефоны, телевизоры, компьютеры, токсичные ковровые покрытия, обивка, краска и загрязнение воздуха — все это мощные генераторы положительных ионов, особенно плохие принтеры и копировальные аппараты.
Окружающая среда, в которой мы живем сегодня, имеет гораздо больше источников положительных ионов, создающих электрический дисбаланс в воздухе и в наших телах.
Что такое отрицательные ионы?Отрицательные ионы противоположны положительным ионам, и они оказывают противоположное влияние на ваше здоровье, настроение и уровень энергии.
Мы вдыхаем отрицательные ионы в таких средах, как океан, горы, леса и водопады. Считается, что как только они попадают в наш кровоток, отрицательные ионы вызывают биохимические реакции, которые повышают уровень химического вещества серотонина, помогая облегчить депрессию, снять стресс и повысить энергию.
Что генерирует отрицательные ионы?Отрицательные ионы в воздухе имеют сильный отрицательный заряд. Их статически притягивают частицы, переносимые по воздуху, такие как пыль, споры плесени, перхоть домашних животных и другие плавающие загрязнители и потенциальные аллергены.
Присоединяясь к этим загрязняющим веществам и аллергенам, они дают им отрицательный заряд и, вместо того, чтобы летать по воздуху, они заземляются и падают на пол или ближайшую поверхность.
Отрицательные ионы заставляют ваше тело чувствовать себя заряженным и помолодевшим.Причина, по которой вы чувствуете себя таким освеженным при воздействии отрицательных ионов, заключается в значительно более высокой концентрации отрицательных ионов в пригодной для дыхания атмосфере.
Список положительных и отрицательных ионов
Каждый из элементов периодической таблицы способен образовывать ион. Ионы — это атомы, которые имеют положительный или отрицательный заряд и участвуют в процессе ионной связи с образованием соединения. Не все соединения являются ионными, но все атомы способны образовывать ион.
TL; DR (слишком долго; не читал)
Ионы — электрически заряженные атомы — могут нести положительный или отрицательный заряд. Положительные ионы — это катионы, обычно такие металлы, как медь или натрий. Отрицательно заряженные ионы — это анионы, образованные из неметаллических элементов, таких как кислород и сера.
Образование ионов
Все атомы содержат компоненты, называемые субатомными частицами. Нейтроны — это нейтральные частицы, которые находятся в ядре атома вместе с положительно заряженными протонами.Число протонов определяет идентичность элемента атома, а нейтроны помогают определить конкретный изотоп атома. Электроны заряжены отрицательно и свободно вращаются вокруг ядра по трехмерным орбиталям. Способность электронов перемещаться по орбиталям и прыгать от атома к атому способствует процессу образования ионов. Атомы отдают электроны другим атомам, чтобы сформировать положительно заряженные ионы, называемые катионами, а атомы, которые собирают дополнительные электроны от других атомов, образуют отрицательно заряженные ионы, называемые анионами.
Катионы
Катионы образуются из атомов металлов, таких как медь, золото, серебро и натрий. Это составляет около двух третей всей таблицы Менделеева. Потеря электронов превратит нейтральный атом в положительный, когда в атоме будет больше протонов, чем электронов, оставшихся в атоме. Металлы являются отличными проводниками электричества из-за того, что электроны легко перемещаются от одного атома к другому, неся вместе с собой электрическую энергию. Металлы можно найти в группах с 1 по 16 в периодической таблице.Все металлы первой группы образуют катионы с зарядом +1, металлы со второй по 12-ю и 16-ю группы образуют катионы с зарядом +2, металлы тринадцатой и пятнадцатой групп образуют катион +3, а металлы, находящиеся в группе 14, образуют катионы. +4 катион.
Анионы
Анионы образуются из неметаллических элементов периодической таблицы, таких как кислород, сера и углерод. Эти элементы находятся в группах с 13 по 17, и каждый из них получает электроны от других атомов во время процесса ионной связи.Этот выигрыш приводит к большему количеству отрицательно заряженных электронов, чем положительно заряженных протонов в ранее нейтральном атоме. Они не проводят электричество. Неметаллы в группах 13 и 15 каждая образуют катион -3, в то время как неметаллы в группе 14 образуют анионы с зарядом -4. Неметаллы группы 16 образуют анионы с зарядом -2, а каждый галоген группы 17 образует -1 заряженный анион.
9.4: Ионное связывание — Chemistry LibreTexts
Ионы — это атомы или молекулы, которые электрически заряжены. Катионы заряжены положительно, а анионы несут отрицательный заряд. Ионы образуются, когда атомы приобретают или теряют электроны. Поскольку электроны заряжены отрицательно, атом, потерявший один или несколько электронов, станет заряженным положительно; атом, который получает один или несколько электронов, становится отрицательно заряженным. Ионная связь — это притяжение между положительно и отрицательно заряженными ионами. Эти противоположно заряженные ионы притягиваются друг к другу, образуя ионные сети (или решеток, ).Электростатика объясняет, почему это происходит: противоположные заряды притягиваются, а одинаковые — отталкиваются. Когда многие ионы притягиваются друг к другу, они образуют большие упорядоченные кристаллические решетки, в которых каждый ион окружен ионами противоположного заряда. Обычно, когда металлы реагируют с неметаллами, электроны передаются от металлов к неметаллам. Металлы образуют положительно заряженные ионы, а неметаллы образуют отрицательно заряженные ионы.
Создание ионных связей
Ионные связи образуются при химической реакции металлов и неметаллов.По определению, металл относительно стабилен, если он теряет электроны, образуя полную валентную оболочку, и становится положительно заряженным. Точно так же неметалл становится стабильным, приобретая электроны, чтобы заполнить свою валентную оболочку и стать отрицательно заряженным. Когда металлы и неметаллы вступают в реакцию, металлы теряют электроны, передавая их неметаллам, которые их приобретают. Следовательно, образуются ионы, которые мгновенно притягиваются друг к другу — ионная связь.
В общем ионном соединении положительные и отрицательные заряды должны быть сбалансированы, потому что электроны не могут быть созданы или уничтожены, а только перенесены.Таким образом, общее количество электронов, потерянных катионными частицами, должно равняться общему количеству электронов, приобретенных анионными частицами.
Пример \ (\ PageIndex {1} \): хлорид натрия
Например, в реакции Na (натрия) и Cl (хлора) каждый атом Cl отнимает один электрон от атома Na. Следовательно, каждый Na становится катионом Na + , а каждый атом Cl становится анионом Cl —. Из-за их противоположных зарядов они притягиваются друг к другу, образуя ионную решетку.Формула (отношение положительных и отрицательных ионов) в решетке \ (\ ce {NaCl} \).
\ [\ ce {2Na (s) + Cl 2 (g) \ rightarrow 2NaCl (s)} \ nonumber \]
Эти ионы расположены в твердом NaCl в регулярном трехмерном расположении (или решетке):
Решетка NaCl. (слева) трехмерная структура и (справа) простой двухмерный разрез латте. Изображения использованы с разрешения Википедии и Майка Блабера.
Хлор имеет высокое сродство к электронам, а натрий — низкую энергию ионизации.Таким образом, хлор получает электрон от атома натрия. Это может быть представлено с помощью точечных символов ewis (здесь мы будем рассматривать один атом хлора, а не Cl 2 ):
Стрелка указывает перенос электрона от натрия к хлору с образованием иона металла Na + и иона хлорида Cl —. Каждый ион теперь имеет октетов и электронов в валентной оболочке:
.Энергетика образования ионных связей
Ионные связи образуются, когда положительно и отрицательно заряженные ионы удерживаются вместе электростатическими силами.Рассмотрим одну пару ионов, один катион и один анион. Насколько сильной будет сила их притяжения? Согласно закону Кулона , энергия электростатического притяжения (\ (E \)) между двумя заряженными частицами пропорциональна величине зарядов и обратно пропорциональна межъядерному расстоянию между частицами (\ (r \)):
\ [E \ propto \ dfrac {Q_ {1} Q_ {2}} {r} \ label {Eq1a} \]
\ [E = k \ dfrac {Q_ {1} Q_ {2}} {r} \ label {Eq1b} \]
, где заряд каждого иона представлен символом Q .Константа пропорциональности k равна 2,31 × 10 −28 Дж · м. Если Q 1 и Q 2 имеют противоположные знаки (например, в NaCl, где Q 1 равно +1 для Na + и Q 2 равно -1 для Cl — ), тогда E отрицательно, что означает, что энергия выделяется , когда противоположно заряженные ионы сближаются с бесконечного расстояния, чтобы сформировать изолированную ионную пару.
Энергия всегда высвобождается при образовании связи и, соответственно, всегда требуется энергия для разрыва связи.
Как показано зеленой кривой в нижней половине рисунка \ (\ PageIndex {1} \), максимальная энергия будет выделяться, когда ионы бесконечно близки друг к другу, при r = 0. Поскольку ионы занимают пространство и имеют структуру с положительным ядром, окруженным электронами, однако они не могут быть бесконечно близко друг к другу. На очень коротких расстояниях отталкивающие электрон-электронные взаимодействия между электронами на соседних ионах становятся сильнее, чем притягивающие взаимодействия между ионами с противоположными зарядами, как показано красной кривой в верхней половине рисунка \ (\ PageIndex {1} \).Полная энергия системы — это баланс между притягивающим и отталкивающим взаимодействиями. Фиолетовая кривая на рисунке \ (\ PageIndex {1} \) показывает, что полная энергия системы достигает минимума в точке r 0 , точке, где электростатическое отталкивание и притяжение точно уравновешены. Это расстояние такое же, как экспериментально измеренное расстояние соединения .
Рисунок \ (\ PageIndex {1} \): график зависимости потенциальной энергии от межъядерного расстояния для взаимодействия газообразного иона Na + и газообразного иона Cl — .{23} \; \ cancel {ion \; пара} / моль \ вправо) = — 589 \; кДж / моль \ label {Eq3} \]Это энергия, выделяющаяся при образовании 1 моль газообразных ионных пар, не , когда 1 моль положительных и отрицательных ионов конденсируется с образованием кристаллической решетки. Из-за дальнодействующих взаимодействий в структуре решетки эта энергия не соответствует непосредственно энергии решетки кристаллического твердого тела. Однако большое отрицательное значение указывает на то, что объединение положительных и отрицательных ионов энергетически очень выгодно, независимо от того, образуется ли ионная пара или кристаллическая решетка.
Подытожим важные моменты, касающиеся ионной связи:
- При r 0 ионы более стабильны (имеют более низкую потенциальную энергию), чем они находятся на бесконечном межъядерном расстоянии. Когда противоположно заряженные ионы собираются вместе от r = ∞ до r = r 0 , энергия системы понижается (энергия высвобождается).
- Из-за низкой потенциальной энергии при r 0 в систему необходимо добавить энергию для разделения ионов.Необходимое количество энергии — это энергия связи.
- Энергия системы достигает минимума на определенном межъядерном расстоянии (расстояние связи).
Пример \ (\ PageIndex {2} \): LiF
Рассчитайте количество энергии, выделяющейся при образовании 1 моль газообразных ионных пар Li + F — из разделенных ионов. Наблюдаемое межъядерное расстояние в газовой фазе составляет 156 пм.
Дано: катион и анион, количество и межъядерное расстояние
Запрошено: энергия, выделяемая при образовании пар газообразных ионов
Стратегия:
Подставьте соответствующие значения в уравнение \ (\ ref {Eq1b} \), чтобы получить энергию, выделяемую при образовании единственной ионной пары, а затем умножьте это значение на число Авогадро, чтобы получить энергию, выделяемую на моль.{23} \ cancel {\ text {ion pair}} / моль \ right) \\ [4pt] & −891 \; кДж / моль \ end {align *} \]
Поскольку Li + и F — меньше, чем Na + и Cl — (см. Раздел 7.3), межъядерное расстояние в LiF короче, чем в NaCl. Следовательно, в соответствии с уравнением \ (\ ref {Eq1b} \), когда образуется 1 моль газообразных ионных пар Li + F — (-891 кДж / моль), выделяется гораздо больше энергии, чем когда 1 моль образуются газообразные ионные пары Na + Cl — (-589 кДж / моль).
Упражнение \ (\ PageIndex {2} \): оксид магния
Рассчитайте количество энергии, выделяющейся при образовании 1 моль газообразных ионных пар \ (\ ce {MgO} \) из разделенных ионов. Межъядерное расстояние в газовой фазе составляет 175 пм.
- Ответ
−3180 кДж / моль = −3,18 × 10 3 кДж / моль
Электронная конфигурация ионов
Как энергия, выделяемая при образовании решетки, сравнивается с энергией, необходимой для отрыва второго электрона от иона Na + ? Поскольку ион Na + имеет электронную конфигурацию благородного газа, удаление следующего электрона из этого стабильного расположения потребует больше энергии, чем выделяется во время образования решетки (натрий I 2 = 4560 кДж / моль).Таким образом, натрий присутствует в ионных соединениях в виде Na + , а не Na 2+ . Точно так же добавление электрона для заполнения валентной оболочки (и достижения электронной конфигурации благородного газа) экзотермично или лишь слегка эндотермично. Чтобы добавить дополнительный электрон в новую подоболочку , требуется огромная энергия — больше, чем энергия решетки. Таким образом, мы находим Cl — в ионных соединениях, но не Cl 2-.
| Соединение | Энергия решетки (кДж / моль) |
|---|---|
| LiF | 1024 |
| LiI | 744 |
| NaF | 911 |
| NaCl | 788 |
| NaI | 693 |
| KF | 815 |
| KBr | 682 |
| КИ | 641 |
| MgF 2 | 2910 |
| SrCl 2 | 2130 |
| MgO | 3938 |
Это количество энергии может компенсировать такие большие значения, как I 3 для валентных электронов (т.е.е. может удалить до 3 валентных электронов). Поскольку для большинства переходных металлов требуется удаление более 3 электронов для достижения сердцевины из благородного газа, они не встречаются в ионных соединениях с сердцевиной из благородного газа. Переходный металл всегда сначала теряет электроны из подоболочки более высокой «s», а затем теряет электроны из нижней подоболочки «d». (Оставшиеся электроны в незаполненной d подоболочке являются причиной ярких цветов, наблюдаемых во многих соединениях переходных металлов!) Например, ионы железа , а не образуют ядро благородного газа:
- Fe: [Ar] 4s 2 3d 6
- Fe 2+ : [Ar] 3d 6
- Fe 3+ : [Ar] 3d 5
Некоторые ионы металлов могут образовывать ядро псевдо благородного газа (и быть бесцветными), например:
- Ag: [Kr] 5s 1 4d 10 Ag + [Kr] 4d 10 Соединение: AgCl
- Cd: [Kr] 5s 2 4d 10 Cd 2+ [Kr] 4d 10 Соединение: CdS
Валентные электроны не подчиняются «правилу октетов» в этом случае (ограничение полезности этого правила).Примечание: атомы серебра и кадмия потеряли 5s-электроны при достижении ионного состояния.
Когда из атома образуется положительный ион, электронов всегда теряются первыми из подоболочки с наибольшим главным квантовым числом
Многоатомные ионы
Не все ионные соединения образуются только из двух элементов. Существует много многоатомных ионов , в которых два или более атома связаны ковалентными связями. Они образуют стабильную группу, несущую заряд (положительный или отрицательный).Группа атомов в целом действует как заряженная разновидность, образуя ионное соединение с противоположно заряженным ионом. Многоатомные ионы могут быть как положительными, так и отрицательными, например:
- NH 4 + (аммоний) = катион
- SO 4 2- (сульфат) = анион
Принципы ионной связи с многоатомными ионами такие же, как и с одноатомными ионами. Противоположно заряженные ионы объединяются, образуя кристаллическую решетку, высвобождая энергию решетки.В зависимости от формы и заряда многоатомных ионов эти соединения могут образовывать кристаллические решетки с интересными и сложными структурами.
Положительный ион — обзор
9.12.5.1 Правила фрагментации пептидов
В режиме положительных ионов удобным средством ионизации с помощью MALDI или ESI является протонирование молекул пептида; MALDI дает монопротонированные ионы, тогда как ESI дает многократно протонированные ионы, в зависимости от количества основных остатков в пептиде.Положительный заряд изначально локализован в аминогруппе N-конца или в боковой цепи одного из основных остатков. Протон основного остатка сильно стабилизирован, но N-концевой протон легко мигрирует к любому из амидных атомов азота пептидного каркаса посредством процесса, известного как « внутренняя сольватация », в результате чего образуется гетерогенная популяция пептидных ионов, каждый компонент имеет одинаковую последовательность. но различаются местом протонирования.
Энергия, выделяемая во время ионизации или активации ионов, вызывает разрыв связей по всей длине пептидной цепи. 57–64 Стоит прочитать недавнее руководство по газофазной фрагментации пептидов. 64 Основной движущей силой, определяющей, какая связь в основной цепи должна диссоциировать, является место присоединения протона. 65 Пептидный каркас состоит из трех различных типов связей: алкилкарбонильной связи (–CHR – CO), пептидной амидной связи (–CO – NH) и аминоалкильной связи (–NH – CHR). Теоретически расщепление этих связей приводит к шести типам фрагментных ионов, по три от каждого конца пептида (, фиг. 8, ).Согласно общепринятой номенклатуре N-концевые заряженные фрагменты, образованные расщеплением связей CHR – CO, CO – NH и NH – CHR, обозначаются символами a n , b n и c n , соответственно, и соответствующие С-концевые ионы на x n , y n и z n , где n относится к количеству аминокислот остатки от соответствующего пептидного конца. 66,67 Ионы типа b, и y являются ключевыми элементами в интерпретации пептидного спектра, поскольку они неизменно образуются во время CID пептидов. Часто ионы a, также образуются из-за потери CO (28 Да) из ионов b (см. Рисунок 9 ). Упрощенный вид образования b, — и y -ионов из однократно протонированного пептида изображен на Фиг.9 и из дважды протонированного триптического пептида на Фиг.10 .Хотя стабильной формой b -ионов является протонированный оксазолон, 61,68 они обычно представлены как ионы ацилия, для простоты, то есть как усеченный пептид без группы ОН; обе формы показаны на рис. 9 . -Ион y также представлен как усеченный пептид плюс протон. Дважды протонированные триптические пептиды более полезны для анализа последовательности пептидов, потому что они фрагментируются более предсказуемым образом по всей пептидной цепи; разрыв пептидной связи приводит к образованию однозарядных ионов b — и y (путь a , Рисунок 10 ; ион b на этом рисунке показан как ион ацилия, а не в виде протонированного оксазолона).Кроме того, из-за локализации одного заряда на C-концевом основном остатке эти ионы также фрагментируются с образованием двухзарядных y -ионов и нейтральных фрагментов (путь b , Рисунок 10, ), но в меньшей степени .
Рис. 8. Номенклатура и структура последовательностей пептидных ионов. Воспроизведено из C. Dass, Principles and Practice of Biological Mass Spectrometry ; Wiley-Interscience: Нью-Йорк, 2000, с разрешения Wiley-Interscience, Copyright 2001.
Фигура 9. Образование b, — и y -ионов из однократно протонированных пептидов.
Фигура 10. Образование b, — и y -ионов из дважды протонированных пептидов; путь a дает однозарядные b — и y -ионы, а путь b — двухзарядные b -ионы.
В дополнение к ионам b, и y , высокоэнергетические CID пептидов могут также производить ионы типа z и c , а также продукты второго поколения w n , v n и d n ; Ионы w образованы из ионов z посредством расщепления β, γ-связи, v -ионов от y -ионов посредством расщепления α, β-связи (т.е.е., отщепление всей боковой цепи) и d -ионов от ( a + 1) -ионов через разрыв β, γ-связи. 63,69 Хотя это не типично, они также наблюдались в масс-спектре с полным сканированием. 60,70 Ионы w и d использовались в качестве зонда для различения Leu и Ile. 63
Одновременный разрыв двух связей в основной цепи пептида также является обычным явлением, которое приводит к образованию двух дополнительных типов ионов, ионов иммония и внутренних фрагментов, которые могут иметь структуру типа ацилия или иммония ( см. Рисунок 11 ().Ионы иммония обычно наблюдаются при значениях m / z менее 200 . Эти ионы также могут подвергаться фрагментации с образованием ионов второго поколения. 71 Хотя ионы иммония не могут предсказать последовательность пептида, они дают полезный ключ к разгадке присутствия определенных аминокислот в последовательности (см. Таблица 2 ).
Рис. 11. Образование иона иммония и внутренних фрагментов. Ионы иммония дают ключ к разгадке состава пептида. Воспроизведено по материалам C.Dass, Основы современной масс-спектрометрии ; Wiley-Interscience: Hoboken, NJ, 2007, с разрешения Wiley-Interscience, Copyright 2007.
Таблица 2. Массы аминокислотных остатков, их ионов иммония и их боковых цепей, а также потери нейтральности
| Аминокислоты | Символ | Остаточная масса (Да) | Масса иона иммония (Да) | Масса боковой цепи (Да) | Нейтральные потери (Да) | ||||||
|---|---|---|---|---|---|---|---|---|---|---|---|
| Аланин | 7 | 7 Ala | 037144 | 15 | — | ||||||
| Argnine | Arg | R | 156.1011 | 129 | 100 | 17 | 100 | 17 | Asparagine 907 907 904 Asparagine 907 90458 | 17 | |
| Аспарагиновая кислота | Asp | D | 115.0269 | 88 | 59 | 18 | |||||
| Cysteine7 Cysteine | 9276 | 47 | 34 a | ||||||||
| Глутаминовая кислота | Glu | E | 129.0426 | 102 | 73 | 9036 907 Glut128.0586 | 101 | 72 | 17 | ||
| Глицин | Gly | G | 57.0215 | 30 | — | — | |||||
| 110 | 81 | — | |||||||||
| Изолейцин | Иль | I | 113.0841 | 86 | 57 | — | |||||
| — | |||||||||||
| Leaf | 57 | — | |||||||||
| Лизин | Lys | K | 128.0950 | 101 | 72 | 17 | |||||
| Метионин | Метионин | Метионин | 0405 | 104 | 75 | 48 b | |||||
| Phenylalanine | Phe | F | 147.0684 | 120 | 91 9036 | 120 | 91 | 97,0528 | 70 | — | — |
| Серин | Ser | S | 87.0320 | 60 | 31 | 18 | 74 | 45 | 18 | ||
| Триптофан | Trp | W | 186.0793 | 159 | 30 | — | 107 | — | |||
| Valine | Val | V | 99.0684 | 72 | 43 | — |
Воспроизведено с C.Dass, Основы современной масс-спектрометрии ; Wiley-Interscience: Hoboken, NJ, 2007, с разрешения Wiley-Interscience, Copyright 2007.
Диагностические потери некоторых нейтральных видов обычно наблюдаются из b — и y -ионов. Например, боковые цепи Ser, Thr, Asp и Glu демонстрируют значительную потерю воды (-18 Да), а ионы, содержащие Asn-, Gln-, Lys- и Arg, аналогичным образом демонстрируют значительную потерю аммиака (-17 Да ). Потеря 48 Да (HSCH 3 ) наблюдается от Met-содержащих ионов последовательности, но если Met находится в окисленной форме, масса вытесненного нейтрального иона становится 64 Да.Cys-содержащие ионы демонстрируют потерю 34 Да (H 2 S), которая смещается до 92 Да (HSCH 2 COOH), если белок-предшественник алкилируется йодуксусной кислотой перед перевариванием. Пептиды, которые содержат основной остаток на С-конце, вероятно, вытеснят С-концевой остаток с образованием иона ( b n -1 + OH).
Определенные свойства пептида имеют подавляющее влияние на выход конкретного типа иона последовательности. Одно из основных правил состоит в том, что более легко расщепляемые участки — это те, которые можно легко протонировать.Например, поскольку боковые цепи кислых аминокислот — глутамат и аспартат — могут легко стабилизировать положительный заряд, соседняя связь имеет высокую склонность к расщеплению. Присутствие остатка с относительно высокой основностью возле любого конца пептида помогает удерживать заряд этим концевым фрагментом. Триптические пептиды за счет аргинина или лизина на С-конце производят более интенсивные серии —-ионов, чем b--серии. Если аргинин присутствует на N-конце, то ряд b, -ион будет более заметным, а если он находится в середине последовательности, может быть отсутствие фрагментации связей вокруг аргинина.Отщепление С-конца связи с пролином происходит с меньшей вероятностью, что приводит к уменьшению количества или отсутствию соответствующих b — и y -ионов, но расщепление N-концевой связи с пролином более легкое. 68,72–74 Пролин — необычная встречающаяся в природе аминокислота; его боковая цепь существует как циклическая структура, образуя связь со своим атомом азота. Эта циклическая структура предотвращает разрыв С-конца связи с пролином. При образовании оксазолоновой структуры атом кислорода предыдущей карбонильной группы соединяется с карбонильным углеродом амидной связи, подвергающейся разрыву (см. , рис. 9, ).Как показано на фиг. 12 , этот процесс в пролине должен приводить к образованию напряженной [3,3,0] бициклической системы, которая снижает возможность расщепления до его С-конца, но способствует расщеплению до его N-конца. Глицин также ведет себя аналогичным образом.
Фигура 12. Влияние пролина на разрыв пептидной связи; атака карбонильного кислорода на карбонильный углерод будет формировать напряженную [3,3,0] бициклическую систему, таким образом предотвращая разрыв С-конца связи с пролином.
Разница между положительным ионом и отрицательным ионом
Ключевое отличие : положительный ион и отрицательный ион являются частью атома или молекулы. Ключевым различием между двумя ионами является их чистый электрический заряд иона, при этом положительный ион имеет чистый отрицательный заряд, а отрицательный ион имеет чистый положительный заряд.В химии атом считается самой маленькой частицей вещества. И дело в том, что сделала вся вселенная. Итак, вся материя, живые или неживые организмы состоят из атомов.Атом состоит из небольшого ядра, состоящего из протонов, нейтронов и электронов. Только протоны и нейтроны присутствуют внутри атома, тогда как электроны вращаются вокруг ядра по определенному круговому пути.
Теперь в зависимости от количества протонов и электронов в ядре определяется заряд атома. Часто заряд атома носит нейтральный характер, потому что он состоит из равного количества протонов и электронов. Эти нейтроны, электроны и протоны далее подразделяются на ионы.
Ионы определяются как молекула или атом, в которых общее количество электронов не равно общему количеству протонов, что придает атому чистый положительный или отрицательный электрический заряд. Теперь, если ион образуется в результате потери электронов, возникает положительный заряд, а если он образуется в результате усиления электронов, то частице передается отрицательный заряд. Весь этот процесс называется ионизацией.
При ионизации ион с чистым положительным зарядом называется «положительный ион» или «катион».Катион — это ион, который имеет большее количество протонов, чем электронов. Он образуется, когда нейтральный ион теряет один электрон на валансной оболочке, и количество протонов в ядрах становится больше, чем количество электронов на внешней оболочке. А из-за меньшего количества электронов ион получает положительный заряд.
С другой стороны, ион с суммарным отрицательным зарядом называется «отрицательный ион» или «анион». Анион — это полная противоположность катиона. Это просто отрицательно заряженные ионы, образованные нейтральными атомами.Нейтральный атом получает электрон на своей валентной оболочке, и количество электронов в атоме увеличивается. Ион использует электрон для стабилизации и мгновенно притягивает больше электронов из оболочки. Таким образом, количество электронов в атоме увеличивается, а количество протонов уменьшается.
И анионы, и катионы можно разделить дальше в зависимости от множества зарядов. И все вышеперечисленные термины используются для разовой оплаты. Положительные ионы и отрицательные ионы дифференцированы в таблице ниже.
Сравнение положительного и отрицательного иона:
Положительный ион | Отрицательный ион | |
Определение | Атом или молекула, которые имеют отрицательный заряд, т. Е. Имеют большее количество электронов, чем протонов. | Атом или молекула, которые заряжены положительно, т. Е. Имеют большее количество протонов, чем электронов. |
Чистая плата | Это ион с отрицательным зарядом. | Это ион с положительным чистым зарядом. |
Ионизация | Этот процесс экзотермический по своей природе. | Этот процесс носит эндотермический характер. |
Электрод | Во время электролиза он притягивается к аноду. | Во время электролиза он притягивается к катоду. |
Образовано | Они образуются за счет притяжения электронов. | Они образуются при потере электронов. |
Также упоминается как | Анион | Катион |
Тип элемента | Неметаллический | Металл |
Примеры | Сульфид, фторид, хлорид, бромид, йодид, нитрид и гидрид. | Натрий, железо и свинец. |
Играйте под дождем для улучшения здоровья
Когда люди говорят о здоровье, вы можете услышать, что они относятся к отрицательным и положительным ионам, плавающим вокруг нас, и считают это кучей странностей, не имеющих научного или разумного обоснования.
Панорама тропического водопада Пном Кулен, КамбоджаНичего страшного, отрицательные ионы — естественное явление. Фактически, водопады являются естественными генераторами отрицательных ионов.
Давайте вернемся в базовый пятый класс естественных наук. Атомы состоят из протонов, нейтронов и электронов. Электроны — это те маленькие частицы, которые энергично вращаются вокруг ядра протонов и нейтронов.
Схема атома от Buzzle.comКогда количество электронов снаружи больше, чем количество протонов в середине, атом становится отрицательно заряженным ионом (анионом). Если протонов больше, чем электронов, атом становится положительно заряженным ионом (катионом).
Отрицательные ионы образуются в больших количествах при разрыве молекул воздуха от движущейся воды, такой как ливневые дожди, реки, грохочущие волны и даже фонтаны. Растения, движение воздуха, солнечный свет и радиоактивный распад благородных газов также естественным образом создают их.
Поскольку ионы заряжены, они подвижны. Отрицательные ионы меньше и легче и с большей вероятностью попадут в воздух, а положительные ионы тяжелее и имеют тенденцию падать на землю. Таким образом, концентрация отрицательных ионов выше в атмосфере около движущейся воды.Ливни, водопады и пляжи являются естественными генераторами отрицательных ионов.
Ура наука!
Хорошо, может быть, наука заставляет ваши глаза тускнеть, и я потерял вас в «пятом классе естествознания», но для урока есть причина: исследования показывают, что воздействие отрицательных ионов оказывает прямое влияние на наше настроение и благополучие.
В этом исследовании было показано, что как яркий свет, так и воздействие отрицательных аэроионов облегчают хроническую несезонную депрессию, а также сезонное аффективное расстройство (САР).
Теории предполагают, что отрицательные ионы повышают уровень серотонина, чтобы улучшить наше настроение и энергию, облегчить депрессию и снять стресс. В этом исследовании упражнения (в форме
Тренировки на свежем воздухе могут принести пользу.Тайцзи в данном случае) в сочетании с воздействием отрицательных ионов оказало лучшее влияние на здоровье, чем одни упражнения. Да, похоже, среда, в которой вы тренируетесь, может сыграть роль в ее эффективности.
Говоря об окружающей среде, компании сейчас продают генераторы отрицательных ионов для людей, которые могут использовать их дома и на работе.Эти генераторы работают? Конечно, компании, продающие их, ответят искренним «да!». но жюри все еще нет. Исследования еще не доказали преимущества искусственно созданных источников отрицательных ионов.
Это нормально. Если вы хотите увеличить количество отрицательных ионов в своем доме или на рабочем месте, подумайте о живых растениях или (если это позволяет сезонная аллергия) просто откройте окна и впустите свежий воздух. Кто знает, какой ветерок унесет с деревьев.Дома душ тоже считается движущейся водой. Вы когда-нибудь задумывались, насколько хорошо вы себя чувствуете после душа? Вы создавали свои собственные отрицательные ионы.
Выйдите на улицу, чтобы воспользоваться преимуществами воздействия отрицательных ионов.Поскольку концентрация отрицательных ионов наиболее высока на улице, лучший вариант для увеличения воздействия — это проводить время на природе.


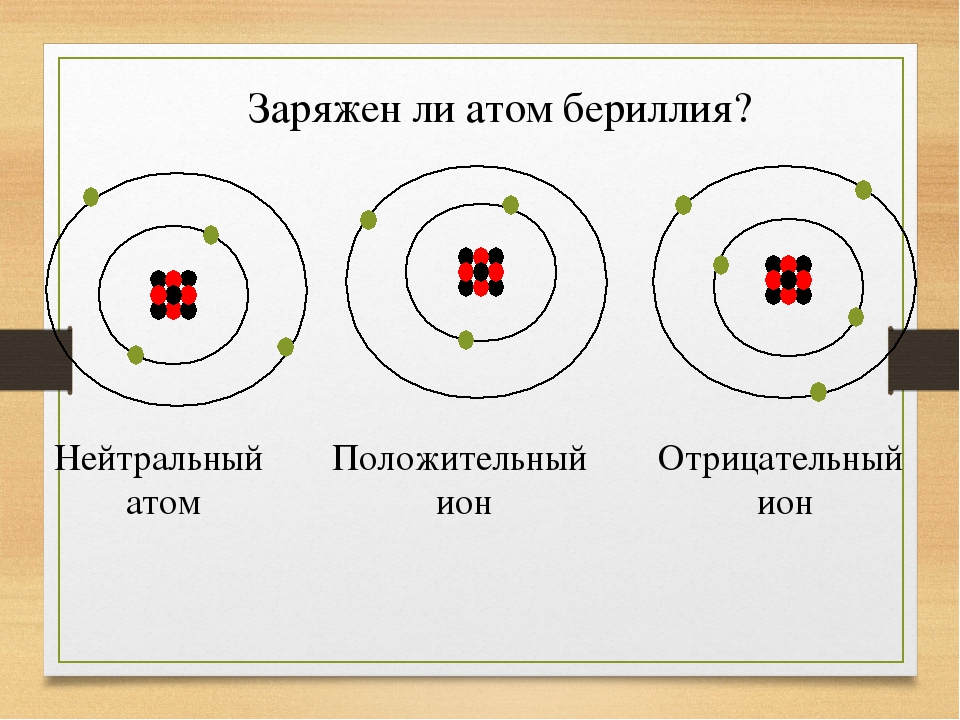
 Если ион получен из атома водорода или атома металла, он обычно положительно заряжен; если ион получен из атома неметалла… … Справочник технического переводчика
Если ион получен из атома водорода или атома металла, он обычно положительно заряжен; если ион получен из атома неметалла… … Справочник технического переводчика Производить цвиттерионы могут, например, аминокислоты. Источник: Медицинский словарь … Медицинские термины
Производить цвиттерионы могут, например, аминокислоты. Источник: Медицинский словарь … Медицинские термины