Похудение последствия дистрофия: Потеря массы тела
Проблемы с печенью и лишний вес
Проблемы с печенью могут быть связаны с лишним весом. Неалкогольная жировая болезнь (НАЖБП) или жировой гепатоз (стеатоз) — одно из самых распространенных заболеваний печени1, которое развивается из-за избыточного накопления жира в печеночных клетках. НАЖБП относится к болезням, ассоциированным с ожирением и наблюдается у 4 из 5 пациентов с ожирением1.
В случае дальнейшего прогрессирования заболевания соединительная ткань прорастает практически весь орган, что делает его недостаточно работоспособным. Это состояние и называется циррозом.
Симптомы стеатоза неспецифичны (чаще всего возникает слабость, утомляемость, может быть дискомфрот или тяжесть в правом подреберье, изменение аппетита2). У части больных заболевание может протекать практически бессимптомно.
Диагностика стеатоза основывается на данных клинической картины, результатах лабораторных и инструментальных исследований.
Также при неалкогольной жировой болезни печени может отмечаться повышение активности щелочной фосфатазы (ЩФ) и гаммаглутамилтранспептидазы (ГГТП).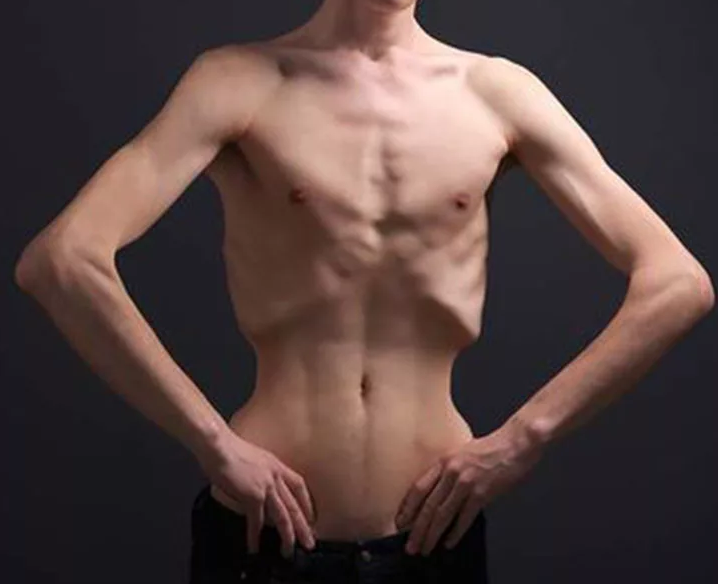
Лечение жирового гепатоза, ассоциированного с ожирением, обязательно включает рекомендации по изменению образа жизни3. Особое внимание уделяется диете с постепенным переходом на правильное питание и формированием сбалансированного рациона. В дополнение назначаются дозированные физические нагрузки, начиная с ходьбы, плавания и лечебной физкультуры.
Одна из предполагаемых причин в том, что при резких ограничениях в диете происходит мобилизация собственного жира из других тканей, большой поток высвободившихся жирных кислот попадает в печень для переработки, и печень не успевает переработать их, поэтому в клетках появляются жировые капли. Состояние может усугубиться в случае присоединения воспаления и развития стеатогепатита.
Поэтому рекомендуется снижать массу тела постепенно (не более 0,5-1 кг в неделю), не торопясь, чтобы не навредить печени и всему организму 5.
Польза от похудения
В то же время постепенное и плавное похудение – это достаточно эффективный метод профилактики и лечения НАЖБП.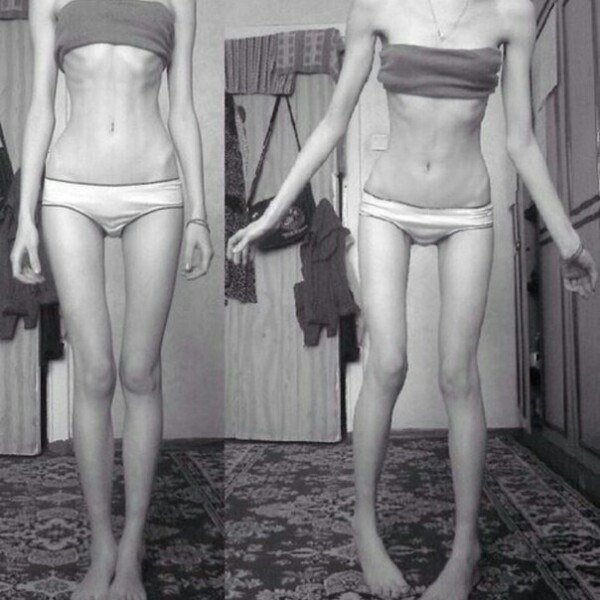 Такой подход способствует положительной динамике лабораторных показателей, и даже улучшает гистологическую картину печени4.
Такой подход способствует положительной динамике лабораторных показателей, и даже улучшает гистологическую картину печени4.
Изменение образа жизни и лечение жирового гепатоза
Общие диетические рекомендации:
Также рекомендуется оптимальный для данного пациента уровень динамических физических нагрузок: ходьба в среднем темпе, плавание, езда на велосипеде5.
Возможно подключение медикаментозного лечения НАЖБП . С этой целью могут применяться, например, лекарственные препараты на основе эссеницальных фосфолипидов, которые встраиваясь в мембрану клеток печени, помогают их восстанавливать, укреплять за счет энергетически «заряженных» полиненасыщенных связей, защищать их от свободных радикалов. Кроме того, такие средства препятствуют воспалению и способствуют снижению уровня жировой нагрузки в печени
Так или иначе, вопреки существующей волне «бодипозитивности», которая изначально была призвана оградить то обидного и негативного отношения к людям с избыточным весом, мы должны признать, что ожирение – не просто вопрос эстетики и красоты, а медицинское состояние, свидетельствующее о метаболическом неблагополучии.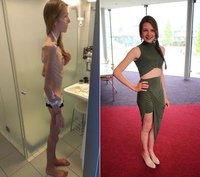 В конечном счете, такие изменения несут негативные последствия для всего организма. Мы призываем не игнорировать эту проблему и заниматься здоровьем, не откладывая «на потом». Разобраться во всех медицинских вопросах вам всегда поможет врач.
В конечном счете, такие изменения несут негативные последствия для всего организма. Мы призываем не игнорировать эту проблему и заниматься здоровьем, не откладывая «на потом». Разобраться во всех медицинских вопросах вам всегда поможет врач.
Дата публикации материала: 20 октября 2021 года
MAT-RU-2003445-1.00-11/2020
Жирная печень: причины и последствия
Пирогова Ирина ЮрьевнаЗаместитель главного врача по организационно-методической работе, заведующая центром гастроэнтерологии и гепатологии, врач-гастроэнтеролог
Что вредно для печени?
Регулярно пить вредно – это знает любой, даже далекий от медицины человек. И когда речь заходит о болезнях, вызываемых неумеренным употреблением горячительных напитков, как правило, первым делом вспоминают о циррозе печени. Действительно, перед врачом встает трудная задача, когда больной приходит к нему уже с «готовым» циррозом, проявляющимся нарушением структуры и функции органа. Помочь можно и на этой стадии, однако все же до цирроза болезнь доводить не стоит. Гораздо лучше и для врача, и для пациента, когда изменения печени еще минимальны и обратимы. Речь идет о так называемом жировом гепатозе или, проще говоря, жирной печени.
Помочь можно и на этой стадии, однако все же до цирроза болезнь доводить не стоит. Гораздо лучше и для врача, и для пациента, когда изменения печени еще минимальны и обратимы. Речь идет о так называемом жировом гепатозе или, проще говоря, жирной печени.
Что такое жирная печень?
Жировая дистрофия печени, жировой гепатоз, стеатоз печени – все эти понятия отражают одно и то же патологическое состояние, которое может развиваться вследствие воздействия самых разнообразных факторов. Вместе с тем буквальный перевод англоязычного термина «fatty liver» – «жирная печень» – привлекает внимание тем, что он понятен как врачу, так и больному. Как и тучного человека, «жирную печень» подстерегает целый набор болезней. Однако в большинстве случаев ожирение печени полностью обратимо при условии ликвидации причин, ведущих к его формированию. Именно на этот неоспоримый факт должно в первую очередь быть обращено внимание как врачей, так и пациентов, так как своевременное распознавание жирового гепатоза позволяет предотвратить развитие воспаления, лечить которое намного труднее.
Что приводит к жирной печени?
Для отложения жира в печени существует множество причин, но у 2/3 больных это все-таки алкоголь. На втором, третьем и последующих местах находятся сахарный диабет, ожирение и гиперлипидемия (повышенное содержание некоторых фракций жира в крови вследствие генетических причин и соответствующих пищевых предпочтений). К числу более редких причин развития жирной печени относятся прием некоторых лекарственных препаратов, операции на желудочно-кишечном тракте, наследственные заболевания. Кроме того, перечисленные факторы могут сочетаться.Алкоголь и печень – враги?
Итак, вернемся к алкоголю. Жирная печень стала частым диагнозом представителей высоких слоев: политиков, бизнесменов, дипломатов, деятелей искусства. Они не алкоголики, они даже не злоупотребляют алкоголем в общепринятом понимании. Просто у этих категорий граждан рюмка коньяка или водки – либо непременный атрибут фуршетов и презентаций, либо средство для снятия стресса после рабочего дня, а иногда и во время.
 Если пить и не закусывать, ожирение печени появится быстрее. Однако даже самые изысканные деликатесы с полным комплексом витаминов от жирной печени не спасут — это доказано как на животных моделях, так и в многочисленных клинических исследованиях.
Если пить и не закусывать, ожирение печени появится быстрее. Однако даже самые изысканные деликатесы с полным комплексом витаминов от жирной печени не спасут — это доказано как на животных моделях, так и в многочисленных клинических исследованиях. Почему жир откладывается в печени?
Дело в том, что печень несет основную нагрузку по окислению жирных кислот, в результате которого организм пополняется запасами энергии. Алкоголь повреждает оболочку печеночных клеток и нарушает функцию ферментов, участвующих в транспорте и окислении жирных кислот. Это ведет к нарушению их нормального обмена и накоплению в клетке. При сахарном диабете 2-го типа (характерен для лиц среднего и пожилого возраста), ожирении и гиперлипидемии также нарушается соотношение между количеством жира, проникающего в печеночную клетку, и способностью клетки к его утилизации.
Почему опасна жирная печень?
Главная опасность этого состояния заключается в том, что избыточный жир под влиянием разнообразных факторов начинает окисляться с образованием высокоактивных соединений, дополнительно повреждающих клетку. А это уже следующая стадия заболевания – гепатит, то есть воспаление печени. В этом аспекте ожирение печени уместно сравнить со складом горючесмазочных материалов, который должен охраняться вооруженным караулом, так как одной искры достаточно для возникновения пожара. Прогрессирование воспаления ведет к гибели клеток печени (гепатоцитов), замещению их каркасной соединительной тканью, а в итоге – нарушению кровообращения в печени и развитию печеночной недостаточности. Это, собственно, и есть основные проявления цирроза.
А это уже следующая стадия заболевания – гепатит, то есть воспаление печени. В этом аспекте ожирение печени уместно сравнить со складом горючесмазочных материалов, который должен охраняться вооруженным караулом, так как одной искры достаточно для возникновения пожара. Прогрессирование воспаления ведет к гибели клеток печени (гепатоцитов), замещению их каркасной соединительной тканью, а в итоге – нарушению кровообращения в печени и развитию печеночной недостаточности. Это, собственно, и есть основные проявления цирроза.
Жирная печень коварна тем, что она часто себя никак не проявляет. Некоторых приводят к врачу чувство тяжести или тупая боль в правом подреберье, тошнота, неприятный вкус во рту. Приблизительно представляя себе расположение органов, пациенты считают, что у них болит печень. Но в печени болеть нечему, потому что там нет нервных окончаний, они имеются только в капсуле и желчевыводящих протоках. Обычно болезненные ощущения связаны с нарушением двигательной активности (дискинезией) желчевыводящих путей.
 У большинства же признаки жирной печени выявляются случайно при обследовании по какому-то другому поводу. Например, больному проводится ультразвуковое исследование (УЗИ) органов брюшной полости или он обращается к доктору по поводу какого-либо другого заболевания (ишемической болезни сердца, сахарного диабета и др.), а уже врач при обследовании выявляет нарушения структуры и функции печени.
У большинства же признаки жирной печени выявляются случайно при обследовании по какому-то другому поводу. Например, больному проводится ультразвуковое исследование (УЗИ) органов брюшной полости или он обращается к доктору по поводу какого-либо другого заболевания (ишемической болезни сердца, сахарного диабета и др.), а уже врач при обследовании выявляет нарушения структуры и функции печени. Возможно ли самоизлечение?
В этой ситуации очень важно, чтобы пациент обратился к специалисту по заболеваниям печени. Дело даже не в том, что в специализированной клинике практикуются методы лабораторной и инструментальной диагностики, недоступные, например, районной поликлинике. Существуют прекрасно оснащенные поликлиники, в которых проводят любые исследования, но не могут правильно интерпретировать их результаты из-за нехватки соответствующего опыта.
Как выявить жирную печень?
Диагностика жирной печени и ее осложнений комплексная. Опытный врач всегда начинает с тщательного сбора анамнеза (воспоминания о жизни пациента), обращая особое внимание на дозы и регулярность приема алкоголя, а также сопутствующие заболевания. Затем больной осматривается с целью выявления внешних признаков поражения печени и других органов, определения размеров печени и селезенки. И только после этого наступает этап лабораторных и инструментальных методов. Новейший метод диагностики жировой болезни печени доступен в нашей клинике. Это фибросканирование печени, когда врач прямо на приеме может «заглянуть внутрь печени» и поставить правильный диагноз разработать программу лечения Биохимический анализ крови дает ценную диагностическую информацию о наличии и характере воспаления, нарушении обмена желчи и функциональных резервах печени. Обязательно исследование на наличие вирусов гепатита: это обусловлено как тем, что вирусные гепатиты – самая частая причина поражения печени в мире, так и тем, что, в частности, вирус гепатита С может нарушать обмен жира в печени. Дополнительное обследование, включающее определение иммунологических параметров, компьютерную томографию назначается при наличии особых показаний.
Затем больной осматривается с целью выявления внешних признаков поражения печени и других органов, определения размеров печени и селезенки. И только после этого наступает этап лабораторных и инструментальных методов. Новейший метод диагностики жировой болезни печени доступен в нашей клинике. Это фибросканирование печени, когда врач прямо на приеме может «заглянуть внутрь печени» и поставить правильный диагноз разработать программу лечения Биохимический анализ крови дает ценную диагностическую информацию о наличии и характере воспаления, нарушении обмена желчи и функциональных резервах печени. Обязательно исследование на наличие вирусов гепатита: это обусловлено как тем, что вирусные гепатиты – самая частая причина поражения печени в мире, так и тем, что, в частности, вирус гепатита С может нарушать обмен жира в печени. Дополнительное обследование, включающее определение иммунологических параметров, компьютерную томографию назначается при наличии особых показаний.
Как лечить жирную печень?
В первую очередь надлежит либо исключить, либо максимально уменьшить действие фактора, который привел к отложению жира в печени. Это почти всегда возможно в отношении алкоголя, если речь не идет о формировании зависимости, когда требуется помощь нарколога. Больные сахарным диабетом, ожирением и гиперлипидемией должны наблюдаться совместно эндокринологом и кардиологом соответственно. Всем пациентам требуется соблюдение диеты с низким содержанием углеводов, а также достаточная ежедневная физическая активность.
Это почти всегда возможно в отношении алкоголя, если речь не идет о формировании зависимости, когда требуется помощь нарколога. Больные сахарным диабетом, ожирением и гиперлипидемией должны наблюдаться совместно эндокринологом и кардиологом соответственно. Всем пациентам требуется соблюдение диеты с низким содержанием углеводов, а также достаточная ежедневная физическая активность.
Когда указанных мер недостаточно, врач назначает специальные лекарственные препараты, влияющие на обмен жира в печени. Только опытный врач может установить, чем вызваны изменения печени у конкретного больного и насколько они выражены. Если у вас возникли какие-то подозрения – обратитесь за консультацией к гастроэнтерологу или гепатологу.
Лечение нервной анорексии в Екатеринбурге
Анонимно. Нервная анорексия определена МКБ-10 как синдром расстройства пищевого поведения. Заболевание в 98% ситуаций имеет психологическую природу, выражается в преднамеренном снижении веса до критических показателей, следствием которых нередко является дистрофия, пожизненная инвалидность и летальный исход.
Наиболее часто встречается анорексия у девушек и женщин, причем возраст может очень сильно отличаться: от подросткового периода до климактерического этапа. Люди, склонные к проявлению нарушений, боятся поправиться, потерять привлекательность, упругость тела и стройность. В последние годы распространение получила мужская анорексия, о которой ранее общество даже не подозревало.
Признаки и симптомы анорексии
Заподозрить болезнь сразу сложно, ведь диагноз способен поставить только врач на основе осмотра, выявления данных анамнеза обратившегося пациента. Тем не менее, существуют признаки и симптомы анорексии, к которым относятся:
- пристрастие к строгим диетическим ограничениям;
- истязание себя в спортивном зале для обретения стройных форм;
- постоянное недовольство своим телом, поиск лишних сантиметров объема и килограммов веса;
- прием лекарственных средств, блокирующих чувство голода;
- истощение организма с превышением допустимой нормы от 15%;
- панический страх перед лишним весом;
- прекращение менструаций, потеря либидо, импотенция.

Причины возникновения анорексии
Наиболее распространенные причины возникновения анорексии можно выделить в следующие группы:
- органические поражения ответственных центров головного мозга;
- депрессивные расстройства, повышенная тревожность, стрессы, апатия
Заметив патологическое изменение привычек в еде и резкое сокращение объемов тела, близким важно уговорить больного человека пройти обследование. В обратном случае последствия могут стать необратимыми: развивается атрофия мышц, разрушается костный скелет, отказывает кишечник и другие жизненно важные органы.
Стадии анорексии
- Первичные изменения – этот этап длится от 2 до 4 лет. Предпосылки заболевания таятся в недовольстве телом, резком ограничении питания.
- Аноректический этап – больные начинают скрывать отказ от пищи от родственников. Едят мало, вызывают рвоту, принимают таблетки для искоренения чувства голода.
 Глубоко корят себя за мнимый лишний вес.
Глубоко корят себя за мнимый лишний вес. - Кахектическая стадия – сгорание подкожной жировой клетчатки, дистрофия внутренних органов, признаки сильнейшего истощения.
Психологическая анорексия поддается коррекции. Чем раньше начато лечение, тем менее губительными оказываются последствия болезни. Опытный психолог способен оказать помощь, вернуть пациенту желание жить. Вылечить изменения органов, нарушение функций жизнедеятельности помогают профильные врачи.
Нервная анорексия у девочек-подростков
Существует недопонимание родителями и другими значимыми людьми тех факторов, которые могут способствовать возникновению, прогрессированию и рецидивированию анорексии в детско-подростковом возрасте и у женщин молодого возраста. В последние годы отмечена тенденция появления расстройств пищевого поведение и у юношей-подростков, особенно тех кто рассматривал диеты и тренировки для коррекции своей фигуры, а зацикленность и навязчивые мысли оказались сильнее. Считается, что появление расстройств в подростковом возрасте лучше лечиться, чем появление анорексии позже. Здесь речь идёт о психологических кризисах и гормональной перестройке у подростков, соответственно минование подросткового возраста помогает, при условии своевременного лечения, справиться с подростковой анорексией. Быстро лечить нервную анорексию, как правило, не получается Выздоровление происходит в течение нескольких лет. Назрелая личность подростка может пострадать как в процессе формирования заболевания так и от его последствий. Коморбидными являются тревожно-фобические, депрессивные, обсессивно-компульсивные расстройства, патологическое развитие личности в виде патохарактериологических реакций и психопатизации. В некоторых случаях на смену анорексии, восстановлению веса и месячных приходят симптомы булимии. Чаще всего за помощью обращаются девочки-подростки в возрасте 14-16 лет. При выраженной кахексии пациентки направляются в реанимацию и лишь потом попадают к психотерапевту.
Считается, что появление расстройств в подростковом возрасте лучше лечиться, чем появление анорексии позже. Здесь речь идёт о психологических кризисах и гормональной перестройке у подростков, соответственно минование подросткового возраста помогает, при условии своевременного лечения, справиться с подростковой анорексией. Быстро лечить нервную анорексию, как правило, не получается Выздоровление происходит в течение нескольких лет. Назрелая личность подростка может пострадать как в процессе формирования заболевания так и от его последствий. Коморбидными являются тревожно-фобические, депрессивные, обсессивно-компульсивные расстройства, патологическое развитие личности в виде патохарактериологических реакций и психопатизации. В некоторых случаях на смену анорексии, восстановлению веса и месячных приходят симптомы булимии. Чаще всего за помощью обращаются девочки-подростки в возрасте 14-16 лет. При выраженной кахексии пациентки направляются в реанимацию и лишь потом попадают к психотерапевту. Девушки с анорексией при шизофрении направляются в острый круглосуточный психиатрический стационар на длительное время. С пациентками без шизофрении и психоза с первых дней начинается психотерапевтическая работа индивидуально и с семьей. У многих девушек еще в младшем школьном возрасте выявляются особенности приема пищи. К ним относятся избирательность к продуктам, например отказывались от мяса и рыбы, психогенная тошнота и рвота, заболевания желудочно-кишечного тракта, снижающие аппетит и вызывающие дискомфорт в животе.
Девушки с анорексией при шизофрении направляются в острый круглосуточный психиатрический стационар на длительное время. С пациентками без шизофрении и психоза с первых дней начинается психотерапевтическая работа индивидуально и с семьей. У многих девушек еще в младшем школьном возрасте выявляются особенности приема пищи. К ним относятся избирательность к продуктам, например отказывались от мяса и рыбы, психогенная тошнота и рвота, заболевания желудочно-кишечного тракта, снижающие аппетит и вызывающие дискомфорт в животе.Одними из серьезных причинных факторов возникновения нервной анорексии являлись конфликты и разводы в семье, личность подростка таким образом протестует против разрушения эмоциональной стабильности. Часто среди близких родственников выявляются люди, страдающие зависимостями от алкоголя, наркотиков, кибер-игры, перееданием или анорексией в прошлом. Нередко взросление, появление вторичных половых признаков и месячных, изменения тела пугало девочек, внутри они предпочитали быть маленькими и не хотели взрослеть. Среди родственников встречаются люди, которые сами выбирали «моду и красоту», а не здоровье.
Среди родственников встречаются люди, которые сами выбирали «моду и красоту», а не здоровье.
Высокий уровень тревожности выявляется у большинства девушек с анорексией (Пичиков АА., Попов Ю.В., 2017). По видам и уровням тревоги разработана следующая классификация. 1. Тревога в отношениях со сверстниками. 2. Тревога, связанная с оценкой окружающих. 3. Тревога в отношениях с учителями. 4. Тревога в отношениях с родителями. 5. Тревога, связанная с успешным обучением. 6. Тревога в ситуации самовыражения. 7. Тревога при проверке знаний. 8. Ухудшение психических сил и активности из за тревоги. 9. Повышения вегетативная реактивность из за тревоги.
Переедание жирной и сладкой пищей до анорексии встречается у части будущих пациенток. Чрезмерная чувствительность к оценкам и насмешкам со стороны окружающих, предвзятое отношение к собственной фигуре приводили к началу избирательность в пище. Более раннее начало заболевания наносит более серьезные последствия развитию мозга и тела. В среднем до обращения за помощью пациентки теряют около 12-15 кг, а индекс массы тела достигает 13.5-14. К счастью встречаются случаи, когда до обращении за помощью пациентки теряли не более 10 кг и тогда процесс излечения проходит успешнее. При ограничительном типе нервной анорексии девушки используют только диеты и физические нагрузки, при очистительном типе в ход идут клизмы, слабительные, мочегонные препараты и другая фармакология. Очистительный тип анорексии выглядит хуже в плане прогноза развития и рецидивирования болезни.
В среднем до обращения за помощью пациентки теряют около 12-15 кг, а индекс массы тела достигает 13.5-14. К счастью встречаются случаи, когда до обращении за помощью пациентки теряли не более 10 кг и тогда процесс излечения проходит успешнее. При ограничительном типе нервной анорексии девушки используют только диеты и физические нагрузки, при очистительном типе в ход идут клизмы, слабительные, мочегонные препараты и другая фармакология. Очистительный тип анорексии выглядит хуже в плане прогноза развития и рецидивирования болезни.
Более склонными к нервной анорексии были девушки с акцентуациями характера истероидного, эмоционально неустойчивого и ананкастного типов.
Благоприятными исходами нервной анорексии у девочек — подростков и молодых женщин являются нормализация индекса массы тела и веса, нормализация пищевого поведения, нормализация менструального цикла, восстановление психоэмоциональной сферы, повышение стрессоустойчивости, отсутствие формирования других зависимостей.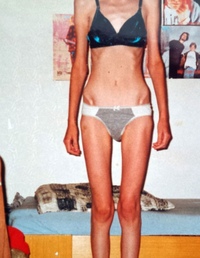
Полного восстановления удается добиться не более, чем у половины пациенток с нервной анорексией при условии быстрого обращения за помощью, выполнения всех врачебных рекомендаций, отсутствия тяжелых соматических и сопутствующих психических расстройств, вовлечения в лечебный процесс всех членов нашей семьи, нормализации конфликтов в семье. Существуют и неблагоприятные исходы нервной анорексии у девочек-подростков и молодых женщин, особенно при рецидивировании. Уровень смертности является одним из самых высоких в психиатрии и составляет около 6% от всех пациенток (Klump K.L, et. al. 2009) Основными причинами смерти являются соматические заболевания (больше половины случаев). К ним относятся крайние варианты истощения, заболевания желудочно-кишечного тракта и сердца. Около трети случаев смертности связано с самоубийствами. Нередко самоповреждения имели аффективно- анорексические мотивы. Пациентки пытались уменьшить степень напряжения, наказывали себя за то, что не могли сдержаться и съели слишком много, выражали таким образом ненависть к телу, отдельным его частям, собственному безволию. Редко встречаются демонстративно-шантажные попытки у этой когорты пациенток. Истинные мотивы свести счеты с неудавшейся жизнью встречаются также нечасто. Примерно у трети пациенток с нервной анорексией (Пичиков А.А., Попов Ю.В., 2018) встречаются пассивные суицидальные мысли без суицидальных попыток. Существуют наблюдения говорящие, что чем больше нутрентофобии, тем больше дисморфофобии и депрессивных состояний, тем больше суицидальный риск.
Редко встречаются демонстративно-шантажные попытки у этой когорты пациенток. Истинные мотивы свести счеты с неудавшейся жизнью встречаются также нечасто. Примерно у трети пациенток с нервной анорексией (Пичиков А.А., Попов Ю.В., 2018) встречаются пассивные суицидальные мысли без суицидальных попыток. Существуют наблюдения говорящие, что чем больше нутрентофобии, тем больше дисморфофобии и депрессивных состояний, тем больше суицидальный риск.
Навязчивые страхи перед едой, калориями и набором веса демонстрирует пример диеты Кристины, лечившейся у нас в связи с нервной анорексией. Мы видим как девушка вдумчива и щепетильна в отношении меню. Порции рассчитываются в граммах, а калории до десятых значений. После принятой пищи девушка ходила по несколько часов, чтобы сжечь «возможный избыток калорий».
Профессиональное лечение анорексии в клинике «Елизар-Мед» ведется с применением комплексного подхода. Специалистами разрабатывается персональное питание при анорексии, составляется программа коррекционных мероприятий для восстановления личности.
 Не опускайте руки, если родной вам человек находится в опасности. Позвоните нам, чтобы узнать, как действовать в этой ситуации, не теряя времени на пустые размышления.
Не опускайте руки, если родной вам человек находится в опасности. Позвоните нам, чтобы узнать, как действовать в этой ситуации, не теряя времени на пустые размышления.Существуют противопоказания, необходима консультация специалиста.
Расписание приема: Обязательно уточняйте время приема по тел: 8 908 905 8 335. Если оказалось, что баланс на Вашем телефоне пуст и это препятствует записаться на прием или задать вопрос, просто отправьте Маячок и мы обязательно перезвоним!
Мышечная слабость — симптомы, лечение
Недостаток мышечной силы — состояние, при котором максимальные усилия не приводят к нормальному сокращению мышц. Кратковременная мышечная слабость может случаться у полностью здоровых людей. Например, она может развиваться после тяжелых физических нагрузок. Однако постоянная мышечная слабость без видимой причины говорит о проблемах со здоровьем.
Патологическая слабость мышц может указывать на развитие различных заболеваний скелетных мышц, например, болезни Помпе. Это редкое генетическое заболевание, которое может проявляться в любом возрасте, в том числе и у взрослых людей. Первый его признак — поражение скелетных мышц, которое на начальных стадиях может проявляться слабостью мышц и сложностью с совершением привычных движений1.
Это редкое генетическое заболевание, которое может проявляться в любом возрасте, в том числе и у взрослых людей. Первый его признак — поражение скелетных мышц, которое на начальных стадиях может проявляться слабостью мышц и сложностью с совершением привычных движений1.
Нередко болезнь Помпе дает о себе знать трудностями при вставании с корточек, удерживании поясницы при наклоне вперед, сложностями при подъеме по лестнице, приседаниях, вставании со стула. Постепенно из-за слабости мышц у больного меняется походка — она становится «утиной». Примечательно, что мышечная слабость рук, ног при болезни Помпе постепенно нарастает, поражаются все новые группы мышц. Из-за слабости мышц диафрагмы могут появиться проблемы с дыханием — одышка даже при незначительной физической нагрузке1.
В таких случаях важно как можно раньше обратиться к врачу, чтобы вовремя диагностировать заболевание и начать лечение. Наряду с болезнью Помпе, миастения может развиваться при ряде других заболеваний. Рассмотрим причины мышечной слабости более подробно.
Рассмотрим причины мышечной слабости более подробно.
К числу наиболее вероятных причин мышечной слабости относятся:
- синдром хронической усталости — патологическое состояние, при котором усталость не проходит после полноценного отдыха2;
- мышечные дистрофии — группа редких наследственных заболеваний, при которых происходят дистрофические процессы в мышцах ног, рук, спины и др. Одним из первых симптомов мышечных дистрофий становится прогрессирующая, постоянно возрастающая слабость различных групп мышц;
- миастения (миастения Гравис) — аутоиммунное заболевание, при котором организм вырабатывает особые антитела, из-за чего нарушается нервно-мышечная передача3;
- периферическая нейропатия — поражение периферических нервов, как правило, на фоне хронического заболевания, такого как сахарный диабет;
- воспалительная миопатия — ревматическое заболевание, при котором поражается скелетная мускулатура4;
- заболевания щитовидной железы — нервно-мышечные осложнения развиваются как при снижении функции щитовидной железы (гипотиреоз), так и при повышении (тиреотоксикоз)5;
- полиомиелит — острое инфекционное заболевание, при котором поражается нервная система;
- слишком высокий уровень кальция в крови;
- длительный постельный режим и некоторые другие.
Следует учитывать и возможность появления мышечной слабости при неотложных состояниях: внезапно возникающая слабость мышц может быть признаком острого нарушения мозгового кровообращения — инсульта.
Как проявляется мышечная слабость?Клиническая картина зависит от заболевания. Например, синдром хронической усталости сопровождается нарушением памяти, концентрации внимания, болезненностью суставов2. Для мышечных дистрофий характерна постоянная прогрессия, включение в патологический процесс все новых групп мышц, увеличение слабости со временем.
Миастения Гравис может иметь несколько форм. Глазная форма манифестирует с глазных симптомов — у больного человека возникает птоз (опущение) век, постепенно поражаются мышцы конечностей, дыхательные мышцы3.
При мышечных дистрофиях может нарушаться работа различных мышц, причем тяжесть и распространенность поражения зависит от вида заболевания. Например, при врожденной мышечной дистрофии поражаются скелетные мышцы6, при дистрофии Эмери-Дрейфусса в патологический процесс вовлекаются мышцы плече-лопаточной области, спины и так далее7.
При периферической нейропатии изменяется чувствительность пораженной области, появляется покалывание, жжение в конечностях, отеки, непроизвольные подергивания мышц и другие симптомы.
Диагностика заболеванияПри появлении мышечной слабости лучше обращаться к врачу-терапевту или педиатру, которые при необходимости направляют пациента к невропатологу и другим узким специалистам. В любом случае постановка диагноза — комплексный процесс, который включает осмотр, сбор анамнеза, лабораторные и инструментальные обследования.
При подозрениях на наследственные дистрофические заболевания назначают генетическое исследование. Для оценки функции мышц применяется электромиография, определяющая электрическую активность мышечного волокна. При необходимости проводят мышечную биопсию. Иногда для уточнения диагноза требуются ультразвуковое исследование, компьютерная томография или магнитно-резонансная томография. При подозрениях на воспалительно-инфекционное поражение доктор назначает анализы крови, мочи.
Как лечить мышечную слабость?Курс лечения назначается после постановки диагноза. Терапия зависит от того, какое заболевание было выявлено. Она может основываться на приеме лекарственных препаратов, физиотерапевтических методах, хирургических способах лечения, а также представлять собой комбинацию нескольких методик.
Справочная литература- Никитин С. С. и др. Клинические рекомендации по оказанию медицинской помощи пациентам с болезнью Помпе //Нервно-мышечные болезни – 2016. – Т. 6. – № 1.
- Воробьева О. В. Синдром хронической усталости (от симптома к диагнозу) //Трудный пациент – 2010. – Т. 8. – № 10.
- Агафонов Б. В., Котов С. В., Сидорова О. П. Миастения и врожденные миастенические синдромы – 2013.
- Антелава О. А. и др. Особенности дебюта и течения антисинтетазного синдрома как наиболее тяжелого подтипа полимиозита/дерматомиозита //РМЖ – 2009. – Т. 17. – № 21. – С. 1443-1447.
- Муравьева Г. Б., Девликамова Ф. И. Нервно-мышечные осложнения при заболеваниях щитовидной железы //Практическая медицина – 2013. – № 1. С. 66.
- Rivier F. et al. Врожденные мышечные дистрофии: классификация и диагностика //Нервно-мышечные болезни – 2014. – № 1. – С.7-18.
- Белозеров Ю. М. и др. Прогрессирующая мышечная дистрофия Эмери-Дрейфусса //Альманах клинической медицины – 2001. – № 4. – С.66-71.
GZEA.PD.18.09.0435g
Разбираемся в проблеме ожирения вместе с эндокринологом ЕвроМед
По оценкам Всемирной организации здравоохранения (ВОЗ), во всем мире лишний вес имеют более миллиарда человека. Проблема ожирения актуальна для различных социальных слоев общества, людей различных профессий, пола, возраста, образа жизни. В России, в среднем, 30% трудоспособного населения страдают ожирением и 25% — избыточную массу тела. К сожалению, даже детей эта проблема не обошла стороной. Повсеместно наблюдается увеличение частоты случаев ожирения у детей и подростков: данные исследований свидетельствуют о том, что избыточную массу тела имеют около 12% российских детей, а ожирение — 8,5% детей, проживающих в городах, и 5,5% — в сельской местности. С помощью эндокринолога, диетолога «ЕвроМед клиники» Натальи Владимировны Мичуриной мы попытались разобраться в этой проблеме.
Принято считать, что полный человек является жертвой своего неуемного аппетита и малоподвижного образа жизни, а значит и лечение — это его личное дело. Как правило, окружающие относятся к тучным людям с пренебрежением и иронией, что может нанести им психологическую травму, особенно от этого страдают дети и подростки. Ироничные высказывания сверстников и взрослых негативно влияют на самооценку человека, приводят к формированию комплексов, еще больше усугубляя проблему.
На самом деле, ожирение – это хроническое многофакторное разнородное заболевание, причина которого кроется в сложных метаболических нарушениях в организме, которые приводят к накоплению и отложению избыточного количества жира.
Об ожирении мы говорим, когда процент избыточной жировой ткани по отношению к массе тела составляет более 20% у мужчин и более 25% у женщин, а индекс массы тела (ИМТ) – больше 25-30.
Индекс массы тела — это показатель соответствия роста человека его весу. Рассчитать его можно по формуле: ИМТ = масса тела (кг) / [рост (м)]2
Например, если ваш рост — 170 см, а вес 70 кг, то ваш ИМТ = 70 / 1,7 * 1,7 = 24,2. Для данного роста вес является нормальным.
Классификация ожирения по ИМТ (ВОЗ, 1997)
| Типы массы тела |
ИМТ (вес в кг / рост в м) |
Риск сопутствующих заболеваний |
| Дефицит массы тела |
<18,5 |
Низкий (повышен риск других заболеваний) |
| Нормальная масса тела |
18,5—24,9 |
Обычный |
| Избыточная масса тела (предожирение) |
25,0—29,9 |
Повышенный |
| Ожирение I степени |
30,0—34,9 |
Высокий |
| Ожирение II степени |
35,0—39,9 |
Очень высокий |
| Ожирение III степени (патологическое) |
>= 40 |
Чрезвычайно высокий |
Однако, при определении ИМТ не учитывается характер распределения жировой ткани. Для этого используются антропометрические измерения: в качестве критерия выступает показатель соотношения объема талии к объему бедер. По характеру распределения жировой ткани выделяют следующие типы ожирения:
- Андроидный (висцеральное, верхнее, «яблоковидное», абдоминальное ожирение), для которого характерна гипертрофия жировых клеток. Этот тип распределения жировой ткани наиболее неблагоприятен, так как связан с развитием сердечно-сосудистых заболеваний, таких, как ишемическая болезнь сердца, артериальная гипертензия, атеросклероз, сахарный диабет. Если объем талии у женщин превышает 80 см, а у мужчин 94 см, это говорит о наличии у пациента абдоминального ожирения. Если отношение окружности талии / окружности бедер у женщин больше 0,8, а у мужчин более 0,9, можно также сделать вывод о наличии андроидного ожирения.
- Гиноидный (периферическое, нижнее, «грушевидное» ожирение), для которого характерна гиперплазия жировых клеток. Этот тип ожирения больше связан с риском патологии суставов и сосудов нижних конечностей.
Негативные последствия ожирения
Есть мнение, что ожирение – это проблема сугубо эстетическая. На самом деле, это далеко не так.
По данным статистики, ожирение увеличивает риск развития сахарного диабета до 10 раз. Среди пациентов с ожирением на 50% больше больных артериальной гипертензией (повышением артериального давления). При этом снижение массы тела на 10% от исходной приводит к снижению риска смерти на те же 10%.
Существует достаточно длинный список заболеваний, причинно связанных с избыточным весом (то есть в основе этих болезней лежит ожирение). Сюда относятся:
- атеросклероз,
- ишемическая болезнь сердца,
- гипертоническая болезнь,
- сахарный диабет,
- холецистит и желчнокаменная болезнь,
- панкреатит,
- жировая дистрофия печени,
- подагра,
- остеохондроз,
- обменно-дистрофический полиартрит,
- злокачественные опухоли,
- нарушения менструально-овариального цикла и бесплодие,
- косметические проблемы.
И это далеко не полный перечень.
Как избавиться от ожирения
Ожирение редко является самостоятельным заболеванием. При лечении необходимо включать в программу обследования выявление нарушений липидного профиля, углеводного обмена, патологии печени, маркеров сердечно-сосудистой, эндокринной патологии и т. д. Соответственно, при лечении заболевания необходимо действовать в нескольких направлениях: обратиться к врачу-эндокринологу и проверить состояние своего организма – весьма вероятно, что без медицинской помощи с проблемой лишнего веса вам не справиться. И второе направление: образ жизни. То есть надо наладить правильное питание и обеспечить достаточную физическую нагрузку.
Мы ежедневно получаем энергию из еды и тратим ее на поддержание жизнедеятельности организма и физическую активность. Если энергии потребляется больше, чем расходуется – она откладывается в виде жировых запасов. Если наоборот – энергия черпается из имеющихся жировых запасов, то есть человек сбрасывает вес. Чем больше дисбаланс между потреблением и расходом энергии, тем интенсивнее идет процесс накопления или избавления от жира.
Основы здорового питания
Для начала заведите пищевой дневник – в который вы будете записывать всё, что съедаете за день. Кстати, существует множество программ, которые можно установить на телефон или на компьютер, — с их помощью очень удобно записывать все, что вы съели и выпили и считать калорийность вашего рациона, а также отслеживать баланс жиров, белков и углеводов. С помощью пищевого дневника проанализируйте свой рацион, ваша цель – чтобы количество потребляемых калорий было меньше, чем количество расходуемых. Не менее важен и качественный состав вашей пищи.
Большая часть потребляемых нами продуктов должна быть растительного происхождения (злаковые, фрукты и овощи), так как только в этом случае вы можете быть уверенными, что ваш организм получает достаточное количество балластных веществ, витаминов, минералов и вторичных растительных веществ. В отличие от многих фруктов овощи содержат меньше калорий. Поэтому при правильном питании, прежде всего, в небольших количествах, нужно употреблять фрукты. Картофель богат крахмалом и балластными веществами и надолго обеспечивает чувство сытости. При употреблении злаковых отдавайте предпочтение продуктам с отрубями, так как в муке высшего сорта уже не содержатся, например, балластные вещества. Попробуйте отрубной хлеб или макароны из муки грубого помола. Эти продукты подверглись меньшей обработке и поэтому содержат много важных питательных элементов, таких как минеральные вещества и витамины.
Молоко и молочные продукты важны для костей и зубов, так как они снабжают наш организм кальцием. Важно, что сыр и молоко содержат много насыщенных жиров, которые помимо того, что калорийны, так еще неблагоприятно действуют на уровень холестерина. Выбирайте молоко и творог с низким содержанием жира.
Для сбалансированного рациона важны и продукты животного происхождения, такие как мясо и рыба. Мясо снабжает наш организм полноценными белками, железом и витаминами, рыба поставляет йод, кальций, фосфор. Необходимо 1–2 раза в неделю есть морскую рыбу и морепродукты.
Жиры должны составлять очень небольшую долю в нашей пище. Растительные масла, такие, как рапсовое или оливковое, снабжают организм важными жирными кислотами, такими как омега-3-кислоты, которые необходимы для работы мозга. Кроме этого, жиры делают возможным прием жирорастворимых витаминов (поэтому овощи всегда нужно есть с небольшим количеством масла).
Питание должно быть дробным, в день рекомендуется не менее 5-6 приемов пищи: так вы разгоните метаболизм и процесс похудения будет более успешным.
При этом важно много пить. Вода необходима, чтобы балластные вещества размягчались в кишечнике и могли в полной мере проявлять свое полезное воздействие. Если организму не хватает жидкости, это может привести к запорам. В качестве утолителя жажды подходит, прежде всего, вода, несладкий чай и сок с минеральной водой.
Физическая нагрузка
Помимо правильного питания для избавления от лишнего веса и получения красивой фигуры необходимы физические нагрузки. Образ жизни современного человека таков, что мы очень мало двигаемся. Гиподинамия – это болезнь XXI века. На работу мы едем на машине или на автобусе, на работе, в основном, сидим, по вечерам лежим перед телевизором или сидим за компьютером, а в выходные предпочитаем отдыхать на диване, а не совершая кросс. В результате – энергии расходуется значительно меньше, чем потребляется, да и для организма такой образ жизни не полезен и приводит к проблемам с сердечно-сосудистой системой, заболеваниям опорно-двигательного аппарата, остеохондрозу, головным болям и пр. Движение регулирует кровяное давление, усиливает обмен веществ, помогает сбросить лишний вес, уменьшает нежелательные жировые отложения в области живота и влияет на действие инсулина. Также нельзя недооценивать влияние движения на иммунную систему и психологическое самочувствие. Физическая активность сокращает риск сердечно-сосудистых заболеваний и диабета. Если вы будете больше двигаться, вы будете лучше себя чувствовать.
Начинать заниматься физическими упражнениями следует постепенно, с умеренных нагрузок. Если вы начинаете заниматься с «нуля», то безопасно начинать с 5–10 минут, например, ходьбы в комфортном темпе. Если во время выполнения упражнений вам трудно разговаривать или задерживать дыхание, необходимо снизить темп. Занятия не должны провоцировать одышку, обильное потоотделение, общую слабость, боли в сердце. При выполнении любых упражнений дышите глубоко и старайтесь делать упражнения так, чтобы в них участвовало все тело. Например, при ходьбе двигайте верхней частью тела и руками. Хороший пример такой активности — «скандинавская ходьба» или занятия на эллиптическом тренажере. Удивительно, что самым эффективным, а самое главное, простым и доступным способом «сжечь» лишние калории является ходьба в тренирующем режиме (100-120 шагов минуту). Сейчас очень популярны «шагомеры» — их можно связывать с аккаунтом в смартфоне и отслеживать ваши ежедневные успехи. Оптимальной ежедневной нагрузкой считается пройти 10 000 шагов.
Важна также регулярность физических нагрузок. Длительные перерывы снижают эффективность занятий и сводят к нулю предыдущие успехи.
Есть еще много способов без особых усилий сделать физическую активность частью своей повседневной жизни. Попробуйте:
- выходить на одну остановку раньше, чем вам нужно;
- подниматься по лестнице пешком;
- потанцевать под энергичную музыку;
- выполнять работу по дому и в саду, связанную с мышечной нагрузкой (пылесосить и мыть полы, копать грядки, сгребать листья, мыть машину вручную и т. д.).
Привлекайте к совместному отдыху друзей и семью. Сыграйте в теннис, бадминтон, волейбол, футбол. Вместе отправьтесь на велосипедную или лыжную прогулку. Такие занятия не только помогут снизить вес, но и дадут возможность чаще общаться с друзьями, стать положительным примером для ваших детей.
Похудение с помощью сна — похудеть без диеты и таблеток Киев
Похудеть без диеты с помощью сна
Проблема похудения стара как мир. И как мир многогранна. Сегодня уже никого не убедишь, что после употребления чудодейственного чая или какой-то особой диеты ваш лишний вес сойдет, как снег в мае. Чудес не бывает, но есть наука, творящая чудеса. Давайте разбираться бывает ли похудение без диет и начнем с конкретного клинического случая.
За год и 4 месяца женщина с весом 267 кг похудела на 94 кг! Безусловно, она на спецдиете, принимает физиотерапию, посещает бассейн, для нее разработан комплекс физических упражнений. Но, прежде всего, был нормализован сон, исчез храп, синдром апноэ (остановки дыхания во сне), она начала высыпаться и первые 38 кг потеряла за 2 месяца.
Эффективное похудение при помощи нормализации сна
Как связаны сон и похудение объясним ещё на одном примере. В нашу лабораторию обратилась женщина 42 лет с жалобой на храп, стремительный набор веса, депрессию и совершенную апатию к жизни. Бывшая спортсменка рассказала, что за короткий период набрала 45 кг! В порыве откровения женщина призналась, что для нее это катастрофа, даже появились мысли о суициде, а оптимизма все меньше и меньше. Ко всем этим бедам участились приступы гипертонии, показатели сахара в крови нестабильны, плохо спит, часто встает в туалет.
Пациентка приехала к нам в сопровождении мужа, потому что боялась самостоятельно передвигаться. Глядя на мужа, легко было догадаться, что и у него похожие проблемы. В разговоре выяснилось, что к нам на обследование они обратились не по рекомендации врача, а по личной инициативе, хотя и не связывали напрямую расстройство сна и хроническое недосыпание со своими проблемами, не знали насколько важен сон для похудения, особенно, что он связан с набором лишнего веса. Убедились в этом они, что называется, на практике.
Пройдя обследование и получив рекомендации, наша пациентка на фоне СИПАП терапии узнала, что такое реальное похудение без жестких диет. Она сбросила 27 кг! Причем первые 15 кг она сбросила в течение двух месяцев. Вернувшись к физическим нагрузкам, нормализовав свой сон, даже без соблюдения диеты, ее физическое состояние постепенно пришло в норму. Причем, как она сама призналась, бодрость и активность появились на первое же утро. От СИПАП аппарата она не отказалась, и в моменты стрессовых ситуаций использует его. А муж с гордостью сообщил, что счастлив вдвойне: и за жену и за свое здоровье. Они оба узнали «как похудеть во сне».
Отзыв счастливой пациентки
Так какая же существует связь между храпом и ожирением?
Современная диетология, лечение проблемы лишнего веса, начинает с нормализации сна. Наш организм можно сравнить с тонким механизмом, если выходит из строя одна шестеренка — страдает весь механизм. Так и у человека: нарушается дыхание во сне, глубина сна и пошел сбой в метаболических процессах, от которых напрямую зависит наш вес. У большинства людей c лишним весом при проведении полисомнографии была зафиксирована средняя и тяжелая степень храпа и синдром обструктивного апноэ. Только вдумайтесь в эти цифры: суммарно от 2 до 5 часов за ночь пациенты не дышали, так как только в течение одного часа зафиксировано от 15 до 30 пауз дыхания! И это все на фоне сильного ночного храпа.
Естественно, в таком режиме сон поверхностный (1-2 фаза). А жизненно необходимый гормон мелатонин вырабатывается только при 3-4 фазах сна. Какова роль мелатонина, вырабатываемого в эпифизе? Он отвечает за синхронизацию, гармонизацию всей эндокринной системы, а значит и всех основных систем организма. Сомотропный гормон контролирует жировой и углеводный обмен. Теперь понятна зависимость эндокринной системы от качества сна.
Неглубокий, прерывистый сон, сопровождаемый храпом приводит к гипоксии (кислородному голоданию), разбалансирует метаболические процессы и вес растет как на дрожжах, независимо от количества потребляемой пищи, а значит диета ни в коем случае не будет способствовать снижению веса и вы не сможете похудеть без диеты.
Программа похудения с нормализацией сна
Теперь вы знаете, насколько важен здоровый сон. Но как его нормализовать? Какие факторы исключить, а что наоборот привнести в свою жизнь?
Прежде всего, необходимо повышать культуру сна. Вас удивляет сам термин «культура сна»? Это определенные традиции и ритуалы подготовки ко сну, правильное обустройство спального места, спокойные цветовые решения комнаты, обязательно приглушенный свет и никакой громкой музыки или телевизора. Очень важно ложиться в одно и то же время, не перегружать себя на ночь чрезмерными впечатлениями от фильмов, резвых игр, шумных компаний.
Не способствует здоровому сну вахтовый метод работы, частые джетлаги (перелеты), ночные и суточные дежурства. Естественно, имея маленьких детей или тяжело больных родствеников тоже не удается нормально высыпаться.
Но особенно страдают от эмоциональных перегрузок жители крупных городов с высоким световым и шумовым фоном. У них чаще фиксируется синдром хронической усталости, стрессы, депрессии, страхи, фобии, панические атаки, раздражительность, конфликтность в семье и на работе, головные боли, мигрени, вялость, усталость. Эти и другие факторы приводят к сбоям в организме, а конкретно с метаболизмом. Отсюда и повышение веса. В таком случае сложно, так сказать, худеть во сне. Нужно нормализовать ночной отдых.
Уснуть все труднее, сон все поверхностней и короче, а результат:
- Невыспавшийся водитель ловит себя на том, что засыпает за рулем.
- Гипертоник замечает, что кризы повторяются все чаще.
- Вам докучает ночная потливость, изжоги.
- Сексуальная потенция снижается.
Очень влияют на наш сон социальные и экономические проблемы, безработица, невозможность достойно содержать семью на мизерную зарплату. Все это тяжелым грузом ложится на наши плечи, и отвлечься от грустных мыслей не удается. Работа в офисе, за компьютером, отсутствие физических нагрузок, малоподвижный образ жизни также не способствуют здоровому сну. Как правильно худеть в таком случае?
Приведу конкретный пример, как вышеперечисленные факторы могут вызывать ожирение.
У нас в лаборатории проходил обследование пациент, много лет, проработавший в ночную смену. Из его рассказа было понятно, что ночью он не мог удержаться от перекусов, дневной сон был непродолжительным, обед и ужин он не пропускал и за 6 лет увеличил свой вес на 107 кг! Он установил рекорд по похудению, сбросил 70 кг за полтора года. Он точно знает как реально похудеть, согласитесь.
Но прежде он сменил работу, занялся физкультурой, посещал бассейн, спал по 8 часов с аппаратом СИПАП. Исчез храп, он перестал просыпаться ночью, начал «ловить свой мелатонин» уже с 10-12 часов ночи. Это замечательный результат для того, чтобы заработала щитовидка и подключился метаболизм.
Спустя 5 лет с 2012 по 2017 год этот пациент обновил рекорд похудения, он сбросил целых 119 кг!
«Я ем мало, а вес растет» — часто слышим эту фразу от тучных людей. И они говорят правду, ведь только что мы доказали, как эффективно похудеть без изнурительной диеты, а лишь нормализацией сна в комплексе с физическими нагрузками, режимом труда и отдыха, минимизацией факторов, провоцирующих стрессы и недосыпания.
В последнее время популярным стало одевание колец на желудок. Проводится оно только после полисомнографического обследования и исключения храпа, апноэ и центрального апноэ. При обнаружении этих синдромов проводится пробная СИПАП терапия в течении 2-3 недель, пациент получает рекомендации по культуре сна и, как правило, начинает терять вес (от 8 до 15 кг за месяц)! Очень важно, чтобы хирурги, предлагающие такие операции, четко выполняли протокол и рекомендовали посещение лаборатории сна.
Хотим предостеречь! Не пытайтесь избавиться от храпа и апноэ при помощи лор операций (подрезание мягкого неба, удаление язычка, лазерная и криопластика, выравнивание носовой перегородки). Допустимо лишь удаления гипертрофированных гланд и аденоидов и, только после полисомнографического обследования в лаборатории сна.
Итак, мы знаем как похудеть без диет. И поверьте, что похудение не чудо и не произойдет само по себе. Теперь и вы это точно знаете!
Мышечная слабость — лечение, симптомы, причины, диагностика
Причин слабости мышц много и существует широкий круг состояний, которые могут вызвать мышечную слабость. Это могут быть как общеизвестные заболевания, так и достаточно редкие состояния. Мышечная слабость может быть обратимой и стойкой. Тем не менее, в большинстве случаев удается лечить мышечную слабость с помощью физических упражнений, физиотерапии, иглотерапии.
Мышечная слабость является довольно распространенной жалобой, но слово слабость имеет широкий спектр значений, в том числе усталость, пониженная сила мышц и неспособность мышц работать вообще. Существует еще более широкий спектр возможных причин.
Термин слабость мышц может быть использован для описания нескольких разных состоянии.
Первичная или истинная мышечная слабость
Эта мышечная слабость проявляется, как неспособность выполнить то движение, которое человек хочет выполнить с помощью мышц с первого раза. Существует объективное снижение мышечной силы и сила не увеличивается независимо от стараний.То есть мышца не работает должным образом -это является ненормальным.
Когда возникает этот вид мышечной слабости, то мышцы выглядят спавшими, меньшими в объеме. Такое может произойти, например, после перенесенного инсульта. Такая же визуальная картина возникает при мышечной дистрофии. Оба состояния приводят к ослаблению мышц, которые не могут выполнять обычную нагрузку.И это реальное изменение мышечной силы.
Усталость мышц
Усталость иногда называют астенией. Это чувство усталости или истощения, которые чувствует человек, когда используются мышцы. Мышцы не становятся действительно слабее, они все еще могут выполнять свою работу, но выполнение мышечной работы требует больших усилий. Этот тип мышечной слабости часто наблюдается у людей с синдромом хронической усталости, при расстройствах сна, депрессии и хронических заболеваниях сердца, легких и почек. Это может быть связано с уменьшением скорости, с которой мышцы могут получать необходимое количество энергии.
Мышечная утомляемость
В некоторых случаях усталость мышц в основном имеет повышенную утомляемость — мышца начинается работать, но быстро устает и требует больше времени для восстановления функции. Утомляемость часто сочетается с мышечной усталостью, но наиболее это заметно при редких состояниях, таких как миастения и миотоническая дистрофия.
Разница между этими тремя типами мышечной слабости часто является не очевидной и у пациента может быть сразу более одного вида слабости. Также один вид слабости может чередоваться с другим видом слабости. Но при внимательном подходе к диагностике врачу удается определить основной тип мышечной слабости,так как для определенных заболеваний характерен тот или иной вид мышечной слабости.
Основные причины мышечной слабости
Отсутствие адекватной физической нагрузки — неактивный (сидячий) образ жизни.
Отсутствие мышечной нагрузки является одной из наиболее распространенных причин мышечной слабости. Если мышцы не используются, то мышечные волокна в мышцах частично заменяются жиром. И со временем мышцы ослабляются: мышцы становятся менее плотными и более дряблыми. И хотя мышечные волокна не теряют свою силу, но их количество уменьшается, и они не так эффективно сокращаются. И человек чувствует, что они стали меньше в объеме. При попытке выполнения определенных движений быстрее наступает усталость. Состояние обратимо при подключении разумных регулярных физических упражнений. Но по мере старения это состояние становится все более выраженным.
Максимум мышечной силы и короткий период восстановления после нагрузок наблюдается в возрасте 20-30 лет. Именно поэтому большинство великих спортсменов добиваются высоких результатов в этом возрасте. Тем не менее, укрепление мышц с помощью регулярных физических упражнений можно проводить в любом возрасте. Многие успешные бегуны на длинные дистанции находились в возрасте старше 40 лет. Толерантность мышц при длительной деятельности, такой как марафон, остается высокой дольше, чем при мощном, коротком всплеске деятельности, таком как спринт.
Это всегда хорошо, когда человек имеет достаточные физические нагрузки в любом возрасте. Однако восстановление после травм мышц и сухожилий с возрастом происходит медленнее. В каком бы возрасте человек не решил улучшить свою физическую форму, важное значение имеет разумный режим тренировок. И тренировки лучше согласовывать со специалистом (инструктором или врачом ЛФК).
Старение
По мере старения мышцы теряют силу и массу, и они становятся слабее. В то время как большинство людей принимают это как естественное следствие возраста — особенно если возраст приличный, тем не менее, невозможность делать то, что было возможно в более молодом возрасте часто приносит дискомфорт. Тем не менее, физические упражнения в любом случае полезны и в пожилом возрасте и безопасные тренировки позволяют увеличить силу мышц. Но время восстановления после травмы гораздо больше в пожилом возрасте,так как происходят инволюционные изменения обмена веществ и увеличивается ломкость костей.
Инфекции
Инфекции и болезни являются одними из самых распространенных причин появления временной мышечной усталости. Это возникает вследствие воспалительных процессов в мышцах. И иногда даже если инфекционное заболевание регрессировало, восстановление мышечной силы может растянуться на продолжительный промежуток времени. Иногда это может вызвать синдром хронической усталости. Любая болезнь с повышением температуры и воспаление мышц может быть триггером синдрома хронической усталости. Однако некоторые заболевания в большей степени могут вызвать этот синдром. Они включают в себя грипп, вирус Эпштейна-Барр, ВИЧ, болезнь Лайма и гепатит С. Другие менее распространенные причины это — туберкулез, малярия, сифилис, полиомиелит и лихорадка Денге.
Беременность
Во время и сразу после беременности, высокий уровень стероидов в крови, в сочетании с дефицитом железа могут вызывать чувство мышечной усталости. Это вполне нормальная реакция мышц на беременность, тем не менее, определенную гимнастику можно и нужно проводить, но значительные физические нагрузки должны быть исключены. Кроме того, у беременных вследствие нарушения биомеханики нередко возникают боли в пояснице.
Хронические заболевания
Многие хронические заболевания вызывают мышечную слабость. В некоторых случаях это связано с сокращением поступления крови и питательных веществ к мышцам.
Заболевания периферических сосудов вызваны сужением артерий, как правило, в связи с отложениями холестерина и провоцируются плохой диетой и курением. Снабжение мышц кровью снижается, и это становится особенно заметно при выполнении физических упражнений, когда кровоток не справляется с потребностями мышц. Боль часто более характерна для заболеваний периферических сосудов, чем мышечная слабость.
Диабет — это заболевание может привести к мышечной слабости и потере физической формы. Высокий уровень сахара в крови ставит мышцы в невыгодное положение, их функционирование нарушается. Кроме того, по мере развития диабета происходит нарушение в структуре периферических нервов (полинейропатия), что в свою очередь ухудшает нормальную иннервацию мышц и приводит к мышечной слабости. Кроме нервов при сахарном диабете происходит повреждение артерий, что также приводит к плохому кровоснабжению мышц и слабости. Заболевания сердца, особенно сердечная недостаточность, могут приводить к нарушению кровоснабжения мышц из-за снижения сократительной способности миокарда и активно работающие мышцы не получают достаточно крови (кислорода и питательных веществ) на пике нагрузки и это может приводить к быстрой утомляемости мышц.
Хронические заболевания легких, такие как хроническая обструктивная болезнь легких (ХОБЛ), приводят к снижению способности организма потреблять кислород. Мышцы требуют быстрой подачи кислорода из крови, особенно при физических нагрузках. Снижение потребления кислорода приводит к мышечной усталости. Со временем хроническое заболевание легких может привести к атрофии мышц, хотя это в основном бывает в запущенных случаях, когда уровень кислорода в крови начинает падать.
Хронические болезни почек могут приводить к нарушению баланса минералов и солей в организме, а также возможно влияние на уровень кальция и витамина D. Болезни почек также вызывают накопление ядовитых веществ (токсинов) в крови, так как нарушение выделительной функции почек уменьшает выделение их из организма. Эти изменения могут приводить как к истинной мышечной слабости, так и мышечной усталости.
Анемия — это недостаток красных кровяных клеток. Причин анемии много, в том числе, плохое питание, потеря крови, беременность, генетические заболевания, инфекции и рак. Это снижает способность крови переносить кислород к мышцам, для того, чтобы мышцы сокращались полноценно. Анемия часто развивается довольно медленно, так что к моменту диагностики уже отмечается мышечная слабость и одышка.
Заболевания центральной нервной системы
Тревога: общая усталость может быть вызвана тревогой. Это связано с повышенной активностью системы адреналина в организме.
Депрессия: общая усталость также может быть вызвана депрессией.
Тревога и депрессия являются состояниями, которые, как правило, вызывают чувство усталости и «утомляемость», а не истинную слабость.
Хроническая боль — общее влияние на энергетические уровни может привести к мышечной слабости. Как и при тревоге, хроническая боль стимулирует выработку химических веществ (гормонов) в организме, которые реагируют на боль и травмы. Эти химические вещества приводят к возникновению чувства усталости или утомления. При хронической боли может возникнуть и мышечная слабость, так как мышцы не могут быть использованы из-за боли и дискомфорта.
Повреждения мышц при травмах
Существует много факторов, приводящих к непосредственному повреждению мышц. Наиболее очевидными являются ранения или травмы, такие как спортивные травмы, растяжения и вывихи. Выполнение упражнений без «разогрева» и растяжения мышц является частой причиной повреждения мышц. При любой травме мышц возникает кровотечение из поврежденных мышечных волокон внутри мышцы, а затем отек и воспаление. Это делает мышцы менее сильными, а также болезненными при выполнении движений. Основным симптомом является локальная боль,но в дальнейшем может появиться и слабость.
Медикаменты
Многие лекарства могут вызвать мышечную слабость и повреждение мышц, в результате побочного эффекта или аллергической реакции. Обычно это начинается, как усталость. Но повреждение может прогрессировать, если прием лекарств не прекращается. Чаще всего,такие эффекты дает прием таких лекарств: статины, некоторые антибиотики (включая ципрофлоксацин и пенициллин ) и противовоспалительные обезболивающие (например, напроксен и диклофенак ).
Длительное применение оральных стероидов также вызывает мышечную слабость и атрофию. Это ожидаемый побочный эффект стероидов при длительном применение и поэтому врачи стараются сократить длительность приема стероидов., Менее часто используемые лекарства, которые могут вызвать мышечную слабость и повреждение мышц включают в себя:
- Некоторые кардиологические препараты (например, амиодарон).
- Препараты для химиотерапии.
- Препараты против ВИЧ.
- Интерфероны.
- Лекарства, используемые для лечения повышенной активности щитовидной железы.
Другие вещества.
Длительное употребление алкоголя может привести к слабости мышц плеча и мышц бедра.
Курение может косвенно ослабить мышцы. Курение вызывает сужение артерий, что приводит к болезни периферических сосудов.
Злоупотребление кокаином вызывает заметную мышечную слабость, также как и другие наркотики.
Нарушения сна
Проблемы, которые нарушают или уменьшают длительность сна, приводят к мышечной усталости, мышечной утомляемости. Эти нарушения могут включать: бессонница, беспокойство, депрессия, хронические боли, синдром беспокойных ног, сменная работа и наличие маленьких детей, которые не спят ночью.
Другие причины мышечной слабости
Синдром хронической усталости
Это состояние иногда связывают с некоторыми вирусными инфекциями, такими как вирус Эпштейна-Барр и гриппа, но до конца генез этого состояния не изучен. Мышцы не воспаленные, но устают очень быстро. Пациенты часто чувствуют необходимость больших усилий для выполнения мышечной деятельности, которые они ранее выполняли легко.
При синдроме хронической усталости мышцы, не спавшиеся и могут иметь нормальную силу при тестировании. Это обнадеживает, так как это означает, что шансы на выздоровление и полное восстановление функций очень высокие. СХУ также вызывает психологическую усталость при выполнении интеллектуальной деятельности, например, длительное чтение и общение также становится утомительно. У пациентов часто могут проявляться признаки депрессии и нарушения сна.
Фибромиалгия
Это заболевание напоминает по симптоматике синдром хронической усталости. Тем не менее, при фибромиалгии мышцы становятся болезненными при пальпации и очень быстро устают. Мышцы при фибромиалгии не спадаются и сохраняют силу при формальном мышечном тестировании. Пациенты, как правило, больше жалуются на боли, чем усталость или слабость.
Нарушение функции щитовидной железы (гипотиреоз)
При этом состоянии нехватка гормонов щитовидной железы приводит к общей усталости. И если лечение гипотиреоза не проводится, то со временем может развиваться дегенерация мышц и гипотрофия. Такие изменения могут быть серьезными и в некоторых случаях необратимыми. Гипотиреоз является общим заболеванием, но, как правило, при своевременном подборе лечения удается избежать проблем с мышцами.
Недостаток жидкости в организме (дегидратация) и расстройства электролитного баланса.
Проблемы с нормальным балансом солей в организме, в том числе в результате обезвоживания могут вызвать мышечную усталость. Проблемы в мышцах могут быть очень серьезными только в крайних случаях, таких как обезвоживание во время марафона. Мышцы работают хуже, когда существует дисбаланс электролитов в крови.
Заболевания, сопровождающиеся мышечным воспалением
Воспалительные заболевания мышц, как правило, развиваются у пожилых людей и включают в себя как полимиалгию, а также, полимиозит и дерматомиозит. Некоторые из этих состояний хорошо корректируются приемом стероидов ( которые приходится принимать в течение многих месяцев прежде, чем появится лечебный эффект ). К сожалению, уже сами стероиды могут при длительном приеме вызвать потерю мышечной массы и слабость.
Системные воспалительные заболевания, такие СКВ и ревматоидный артрит, нередко являются причиной мышечной слабости. В небольшом проценте случаев ревматоидный артрит, мышечная слабость и усталость могут быть единственными симптомами заболевания в течение значительного времени.
Онкологические заболевания
Рак и другие онкологические заболевания могут привести к прямому повреждению мышц, но наличие рака в любой части тела может также вызвать общую мышечную усталость. В поздних стадиях онкологического заболевания потеря веса тела также приводит к истинной мышечной слабости. Мышечная слабость обычно не первый признак рака и возникает чаще на поздних стадиях онкологии.
Неврологические состояния, приводящие к повреждению мышц.
Заболевания, влияющие на нервы, как правило, приводят к истинной мышечной слабости. Это происходит потому, что если нерв мышечного волокна перестает полноценно работать, мышечное волокно не может сокращаться и в результате отсутствия движений мышца атрофируется. Неврологические заболевания : мышечная слабость может быть вызвана цереброваскулярными заболеваниями, такими как инсульт и кровоизлияния в мозг или повреждениями спинного мозга. Мышцы, которые становятся частично или полностью парализованы, теряют нормальную силу и, в конечном счете, атрофируются.В некоторых случаях изменения в мышцах значительные и восстановление очень медленное или же функции не удается восстановить.
Заболевания позвоночника: когда нервы повреждены (компримированы на выходе из позвоночника грыжей, протрузией или остеофитом) может появиться мышечная слабость. При компрессии нерва происходит нарушение проводимости и моторные нарушения в зоне иннервации корешка, и мышечная слабость развивается только в мышцах, иннервируемых определенными нервами, которые подверглись компрессии
Другие нервные болезни:
Рассеянный склероз — вызван повреждением нервов в головном и спинном мозге и может приводить к внезапному параличу. При рассеянном склерозе возможно частичное восстановление функций при проведении адекватного лечения.
Синдром Гийена-Барре — это острая аутоиммунная воспалительная полирадикулоневропатия, проявляющаяся вялыми парезами, нарушениями чувствительности, вегетативными расстройствами, вызванная вирусной инфекцией
Болезнь Паркинсона: это прогрессирующее заболевание центральной нервной системы, как двигательной сферы, так и интеллектуальной и эмоциональной сферы. В основном, поражает людей в возрасте старше 60 лет и в дополнение к мышечной слабости пациенты с болезнью Паркинсона испытывают тремор и скованность в мышцах. Они часто испытывают трудности в начале движений и при остановке движения, и часто находятся в состоянии депрессии.
Редкие причины мышечной слабости
Генетические заболевания, влияющие на мышцы
Мышечные дистрофии — наследственные заболевания, при которых страдают мышцы, достаточно редко встречаются. Наиболее известным таким заболеванием является мышечная дистрофия Дюшенна. Это заболевание возникает у детей и приводит к постепенной потере мышечной силы.
Некоторые редкие мышечные дистрофии могут дебютировать в зрелом возрасте, в том числе синдром Шарко-Мари — Тута, и синдром Facioscapulohumeral дистрофии. Они также вызывают постепенную потерю мышечной силы и нередко эти состояния могут приводить к инвалидности и прикованности к инвалидной коляске.
Саркоидоз — это редкое заболевание, при котором образуются скопления клеток (гранулемы) в коже, легких и мягких тканях, включая мышцы. Состояние может самостоятельно излечиваться через несколько лет.
Амилоидоз — также редкое заболевание, при котором происходит накопление (депозиты) аномального белка (амилоида) по всему телу, в том числе в мышцах и почках.
Другие редкие причины: прямое повреждение мышц может произойти при редких наследственных заболеваниях обмена веществ. Примеры включают: болезни накопления гликогена и, еще реже, митохондриальные заболевания, которые встречаются, когда энергетические системы внутри мышечных клеток не работают должным образом.
Миотоническая дистрофия — это редкое генетическое заболевание мышц, при котором мышцы быстро устают. Миотоническая дистрофия передаются из поколения в поколение, и, как правило, с каждым следующим поколением проявления заболевания становятся более выраженными.
Болезнь моторных нейронов — это прогрессирующее заболевание нервов, которая затрагивает все части тела. Большинство форм болезни мотонейронов начинается с дистальных отделов конечностей, постепенно охватывая все мышцы тела. Заболевание прогрессирует месяцами или годами и у пациентов быстро развиваются выраженная мышечная слабость и атрофия мышц.
Болезнь мотонейронов, чаще всего, проявляется у мужчин старше 50 лет, но было много заметных исключений из этого правила, в том числе примером может служить известный астрофизик Стивен Хокинг. Существует много различных форм болезни мотонейронов, но успешного лечения пока не удалось разработать.
Миастения: — это редкое заболевание мышц, при котором мышцы быстро устают и требуют длительного времени для восстановления сократительной функции. Нарушение мышечной функции может быть настолько выраженным, что пациенты не могут удерживать даже веки глаз и речь становится невнятной.
Яды — ядовитые вещества также нередко вызывают мышечную слабость и паралич из-за воздействия на нервы. Примерами являются фосфаты и ботулинический токсин. В случае воздействия фосфатов, слабость и паралич могут оказаться стойкими.
Болезнь Аддисона
Болезнь Аддисона это редкое заболевание, проявляющееся гипоактивностью надпочечников, что приводит к нехватке стероидов в крови и нарушению баланса электролитов крови. Заболевание, как правило, развивается постепенно. Пациенты могут обратить внимание на изменение цвета кожи (загара) из-за пигментации кожи. Может быть потеря веса. Мышечная усталость может быть умеренной и часто является ранним симптомом. Болезнь нередко трудно диагностировать и требуются специальные обследования для диагностики этого заболевания. Другие редкие гормональные причины мышечной слабости включают акромегалию ( чрезмерная выработка гормона роста ), гипоактивность гипофиза ( гипопитуитаризм ) и тяжелый дефицит витамина D.
Диагностика мышечной слабости и лечение
При наличии мышечной слабости необходимо обратиться к врачу, которого в первую очередь будут интересовать ответы на следующие вопросы:
- Как появилась слабость в мышцах и когда?
- Есть ли динамика мышечной слабости, как увеличение, так и снижение?
- Если ли изменение общего самочувствия, потеря веса или были ли поездки за границу в последнее время?
- Какие лекарства принимает пациент и были ли проблемы мышцами у кого – то в семье пациента?
Врачу также будет необходимо осмотреть пациента, чтобы определить, какие мышцы подвержены слабости и есть ли у пациента истинная или предполагаемая мышечная слабость. Врач проверит, есть ли признаки того, чтобы мышцы стали более мягкими на ощупь (что может быть признаком наличия воспаления) или мышцы устают слишком быстро.
Затем врач должен проверить нервную проводимость для того, чтобы определить наличие нарушений проводимости по нервам в мышцы. Кроме того, врачу может потребоваться проверить центральную нервную систему, в том числе баланс и координацию, и, возможно, назначить лабораторные исследования для определения изменения уровня гормонов, электролитов и других показателей.
Если это не позволяет определить причину мышечной слабости, то могут быть назначены и другие методы диагностики:
- Нейрофизиологические исследования (ЭНМГ, ЭМГ).
- Биопсия мышц для определения наличия морфологических изменений в мышцах
- Сканирование тканей с использованием КТ (МСКТ) или МРТ в тех частях тела, которые могут оказывать влияние на мышечную силу и функции.
Совокупность данных истории болезни, симптомов, данных объективного обследования и результатов лабораторных и инструментальных методов исследования позволяет в большинстве случаев выяснить истинную причину мышечной слабости и определить необходимую тактику лечения. В зависимости от того, какой генез мышечной слабости (инфекционный, травматический, неврологический, обменный медикаментозный и т.д.) лечение должно быть патогенетическим. Лечение может быть как консервативным, так и оперативным.
Диета и питание — Muscular Dystrophy News
Мышечная дистрофия — это название группы генетических заболеваний, характеризующихся мышечной слабостью и истощением.
В настоящее время нет лекарства от мышечной дистрофии, но доступные методы лечения могут помочь справиться с симптомами и улучшить качество жизни пациентов.
Сбалансированная диета важна для здоровья людей с мышечной дистрофией.
Выбор правильной диеты
Получение достаточного питания может быть проблемой для людей с мышечной дистрофией.Многие испытывают трудности с жеванием и глотанием или чувствуют усталость, которая снижает аппетит и затрудняет прием пищи. Ограниченное потребление калорий может быстрее разрушить мышцы, что может ускорить прогрессирование заболевания.
В состав бригады по уходу за пациентами должен входить дипломированный диетолог. Диетолог может помочь составить соответствующий план питания, чтобы пациенты получали необходимое питание в удобной для употребления и глотательной форме. Это может означать замену твердой пищи коктейлем, заменяющим прием пищи, или переход на более мягкую пищу.Многим пациентам также может быть полезен прием витаминных добавок, но при этом следует проконсультироваться с врачом. Диетологи также могут порекомендовать рецепты и стратегии приготовления еды.
Очень важна хорошо сбалансированная диета с высоким содержанием белка и нежирным мясом, таким как рыба или птица. Поскольку многие пациенты борются с запорами из-за слабых мышц живота и ограниченной подвижности, многие диетологи также рекомендуют диету с высоким содержанием клетчатки.
Стратегии приема пищи
Несколько стратегий могут помочь облегчить прием пищи для людей с мышечной дистрофией:
- Не торопитесь с едой, давая время поесть; спешка увеличивает риск удушья
- Избегайте сухих продуктов с рассыпчатыми крошками, таких как дневной хлеб, крекеры или чипсы
- Небольшие кусочки могут облегчить жевание и глотание
- Минимизируйте отвлекающие факторы во время еды, например радио или телевизор, чтобы сосредоточиться на еде и снизить риск удушья
- Сидение в вертикальном положении может помочь при глотании
Логопед
Логопеды могут работать с пациентами, чтобы улучшить силу и диапазон движений в мышцах, которые контролируют жевание и глотание.Они также могут помочь научить более безопасным методам глотания, чтобы снизить риск удушья.
Лекарство
Избыток слюны часто встречается у пациентов с ослабленными мышцами языка и горла, но для уменьшения выработки слюны можно использовать определенные лекарства.
Питание через зонд
В крайних случаях врачи могут порекомендовать зонд для кормления для нутритивной поддержки. Это трубка, хирургически подсоединенная непосредственно к желудку, минуя рот и пищевод, чтобы пациенты получали достаточное количество питательных веществ.
***
Muscular Dystrophy News — это исключительно новостной и информационный веб-сайт об этом заболевании. Он не предоставляет медицинских консультаций, диагностики или лечения. Этот контент не предназначен для замены профессиональных медицинских консультаций, диагностики или лечения. Всегда обращайтесь за советом к своему врачу или другому квалифицированному поставщику медицинских услуг по любым вопросам, которые могут у вас возникнуть относительно состояния здоровья. Никогда не пренебрегайте профессиональным медицинским советом и не откладывайте его обращение из-за того, что вы прочитали на этом веб-сайте.
Мышечная дистрофия: симптомы, причины, лечение
Обзор
Что такое мышечная дистрофия?
Мышечная дистрофия относится к группе из более чем 30 наследственных (генетических) заболеваний, вызывающих мышечную слабость. Эти состояния являются разновидностью миопатии, заболевания скелетных мышц. Со временем мышцы сжимаются и ослабевают, что влияет на вашу способность ходить и выполнять повседневные действия, например чистить зубы. Заболевание также может поразить ваше сердце и легкие.
Некоторые формы мышечной дистрофии проявляются при рождении или развиваются в детстве. Некоторые формы развиваются позже, в зрелом возрасте. В настоящее время лекарства нет.
Насколько распространена мышечная дистрофия?
Мышечная дистрофия — редкое заболевание.
Кто может получить мышечную дистрофию?
Мышечная дистрофия часто передается по наследству. Ребенок, у которого есть родитель с мышечной дистрофией, может унаследовать мутировавший (измененный) ген, вызывающий мышечную дистрофию. У некоторых людей есть мутировавший ген, но нет мышечной дистрофии.Эти здоровые взрослые (носители) могут передать мутировавший ген своему ребенку, у которого может развиться болезнь.
Какие виды мышечной дистрофии?
Существует более 30 различных типов мышечной дистрофии. Некоторые из наиболее распространенных форм включают:
- Мышечная дистрофия Дюшенна (МДД): Это заболевание, как правило, поражает мальчиков в возрасте от 2 до 5 лет, но могут заболеть и девочки. Вы можете заметить, что вашему малышу трудно бегать, ходить или прыгать.По мере прогрессирования заболевания оно может поражать сердце и легкие ребенка. МДД — наиболее распространенная форма мышечной дистрофии. От него страдают примерно шесть из 100 000 детей в Северной Америке и Европе.
- Мышечная дистрофия Беккера (МПК): МПК — вторая по распространенности мышечная дистрофия. Симптомы МПК могут появиться в любое время в возрасте от 5 до 60 лет, но обычно появляются в подростковом возрасте. Мужчины чаще заболевают МПК. Заболевание поражает мышцы бедра, бедра и плеча, а в конечном итоге и сердце.Приблизительно у одного из 18 000–30 000 мальчиков в США развивается МПК.
- Facioscapulohumeral мышечная дистрофия (FSHD): FSHD является третьей по распространенности мышечной дистрофией. Заболевание поражает мышцы лица, лопаток и предплечий. Симптомы обычно появляются в возрасте до 20 лет. Около четырех из 100 000 человек в США имеют эту форму.
- Врожденные мышечные дистрофии (ВМД): Врожденные состояния, такие как ВМД, присутствуют при рождении. У младенца могут быть слабые мышцы, искривленный позвоночник и слишком жесткие или расшатанные суставы.У детей с ВМД могут быть проблемы с обучением, судороги и проблемы со зрением.
- Мышечная дистрофия Эмери-Драйффа (EDMD): Это заболевание, как правило, поражает детей. К 10 годам появляются такие симптомы, как слабость плеч, предплечий и икроножных мышц. EDMD также влияет на сердце.
- Конечностно-поясная мышечная дистрофия (LGMD): Это заболевание поражает мышцы, расположенные ближе всего к телу, включая плечи и бедра. От него страдают люди любого возраста. Примерно двое из 100 000 жителей США.С. у ЛГМД.
- Миотоническая дистрофия: У людей с миотонией возникают проблемы с расслаблением мышц. Например, вам может быть трудно отпустить руку любимого человека. Заболевание поражает также сердце и легкие. Это заболевание, как правило, встречается у взрослых европейского происхождения и встречается примерно у 10 из 100 000 человек.
- Окулофарингеальная мышечная дистрофия (OPMD): Эта редкая форма мышечной дистрофии ослабляет мышцы век и горла.Такие симптомы, как опущение век (птоз) и затрудненное глотание (дисфагия), часто появляются между 40 и 60 годами. Примерно один из 100 000 человек имеет OPMD.
Симптомы и причины
Что вызывает мышечную дистрофию?
Генетические мутации или изменения вызывают большинство форм мышечной дистрофии. Один или оба родителя могут передать дефектный ген своему ребенку, даже если у родителя нет этого заболевания. В редких случаях мышечная дистрофия развивается спонтанно, то есть причина неизвестна.
Каковы симптомы мышечной дистрофии?
Мышечная слабость — первичный симптом мышечной дистрофии. В зависимости от вида заболевание поражает разные мышцы и части тела. Другие признаки мышечной дистрофии включают:
- Увеличенные икроножные мышцы.
- Затруднения при ходьбе или беге.
- Необычная походка при ходьбе (например, при ходьбе вразвалку).
- Проблемы с глотанием.
- Проблемы с сердцем, такие как аритмия и сердечная недостаточность (кардиомиопатия).
- Нарушения обучаемости.
- Жесткие или свободные суставы.
- Мышечная боль.
- Искривление позвоночника (сколиоз).
- Проблемы с дыханием.
Диагностика и тесты
Как диагностируется мышечная дистрофия?
Если ваш лечащий врач подозревает мышечную дистрофию, вы или ваш ребенок можете пройти один или несколько из следующих диагностических тестов:
- Анализ крови на фермент и белок проверяет повышенный уровень фермента, называемого креатинкиназой.Высокий уровень может указывать на повреждение мышц, вызванное мышечной дистрофией.
- Электромиография (ЭМГ) измеряет электрическую активность мышц и нервов.
- Биопсия мышцы ищет клеточные изменения в мышечной ткани.
- Генетические тесты выявляют генные мутации, связанные с мышечной дистрофией.
Ведение и лечение
Как лечится или лечится мышечная дистрофия?
Исследователи все еще ищут способ вылечить мышечную дистрофию.Симптомы заболевания со временем ухудшаются, но эти методы лечения могут помочь:
- Лечебные процедуры и лечебные процедуры укрепляют и растягивают мышцы. Эти методы лечения могут помочь вам сохранить функцию и диапазон движений.
- Логопед помогает тем, у кого проблемы с глотанием.
- Кортикостероиды, такие как преднизон и дефлазакорт, могут замедлять прогрессирование заболевания.
- Хирургия снимает напряжение сокращенных мышц и исправляет искривление позвоночника (сколиоз).
- Сердечные устройства, например, кардиостимуляторы, используются для лечения нарушений сердечного ритма и сердечной недостаточности.
- Медицинские устройства, такие как ходунки и инвалидные коляски, могут улучшить подвижность и предотвратить падения.
- Средства защиты органов дыхания, такие как средства от кашля и респираторы, способствующие дыханию.
Какие осложнения мышечной дистрофии?
Мышечная дистрофия поражает мышцы, сердце и легкие. По мере прогрессирования болезни вы можете быть более подвержены:
- Проблемы с сердцем, такие как аритмия и сердечная недостаточность.
- Респираторные инфекции, включая пневмонию.
- Проблемы с дыханием.
- Удушье.
Как мышечная дистрофия влияет на беременность?
Женщины с мышечной дистрофией могут иметь здоровую беременность. Поскольку мышечная дистрофия передается по наследству, вы можете поговорить с генетическим консультантом до зачатия. Во время беременности ваш лечащий врач будет внимательно следить за вашим здоровьем, чтобы помочь вам избежать следующих осложнений:
- Повышенная мышечная слабость и ограниченная подвижность из-за увеличения веса.
- Проблемы с дыханием из-за дополнительного давления на легкие.
- Напряжение сердца.
- Выкидыш (прерывание беременности до полного развития ребенка).
- Преждевременные роды до 37 недели беременности.
- Ребенок с низким весом при рождении, весом менее 5 фунтов 8 унций.
Профилактика
Как предотвратить мышечную дистрофию?
К сожалению, вы ничего не можете сделать, чтобы предотвратить мышечную дистрофию.Если у вас есть заболевание, эти шаги помогут вам улучшить качество жизни:
- Соблюдайте здоровую диету, чтобы предотвратить недоедание.
- Пейте много воды, чтобы избежать обезвоживания и запора.
- Делайте как можно больше упражнений.
- Поддерживайте здоровый вес, чтобы предотвратить ожирение.
- Бросьте курить, чтобы защитить свои легкие и сердце.
- Сделайте прививки от гриппа и пневмонии.
Перспективы / Прогноз
Каков прогноз (перспективы) для людей с мышечной дистрофией?
Мышечная дистрофия — заболевание прогрессирующее.Симптомы со временем ухудшаются. Лечебная физкультура и трудотерапия, а также медицинские устройства, такие как ходунки, помогут сохранить подвижность и независимость как можно дольше. Медицинские специалисты проводят лечение и могут дать рекомендации по защите сердца и легких.
Жить с
Когда мне позвонить врачу?
Вам следует позвонить своему врачу, если у вас мышечная дистрофия и вы испытываете:
- Признаки респираторной инфекции.
- Затрудненное глотание или удушье.
- Учащенное сердцебиение или боль в груди.
- Мышечная боль.
Какие вопросы я должен задать своему врачу?
Если у вас мышечная дистрофия, вы можете спросить своего врача:
- Есть ли у моих детей риск мышечной дистрофии?
- Какие шаги я могу предпринять, чтобы предотвратить передачу гена мышечной дистрофии моим детям?
- Следует ли мне пройти генетическое тестирование?
- Как мышечная дистрофия повлияет на качество моей жизни?
- Сократит ли моя жизнь мышечная дистрофия?
- Какие шаги я могу предпринять, чтобы замедлить прогрессирование болезни?
- Какие изменения я могу ожидать по мере прогрессирования болезни?
- Если у близкого человека мышечная дистрофия, следует ли мне пройти генетическое тестирование, чтобы узнать, несу ли я мутацию гена?
- Стоит ли обращать внимание на признаки осложнений?
Записка из клиники Кливленда
Трудно жить с таким заболеванием, как мышечная дистрофия, которое медленно ограничивает вашу способность двигаться и функционировать.Утрата независимости может быть эмоционально тяжелой для вас и ваших близких. Не бойтесь сообщить своему врачу, если вас не устраивает ваша ситуация. Антидепрессанты, консультации и группы поддержки предлагают помощь и надежду. Ваш лечащий врач также может порекомендовать методы лечения и медицинские устройства, которые помогут вам как можно дольше сохранять независимость.
Кормление цианидином препятствует прогрессированию мышечной дистрофии
Производство кукурузы
Генотипы кукурузы изначально находились на фоне W22, гомозиготном доминантном для a1 , a2 , c1 , c2 , bz2 , гомозиготный рецессивный по гену r1 и другой конституции b1 pl1 .Для получения кукурузы с высоким содержанием цианидина и без цианидина с изогенным фоном был использован гибрид кукурузы с высоким содержанием цианидина, несущий аллели B1 и Pl1 (Red Diet, RD), которые придают пурпурную пигментацию околоплоднику семян и всем растениям. ткани 41,42,43,44 . Ткани растений и семян, несущие аллели b1 pl1 , не содержат цианидин (Yellow Diet, YD). Для получения початков с высокой продуктивностью ядер гомозиготную инбредную линию B1 Pl1 W22 и инбредную линию b1 pl1 W22 скрестили с инбредной линией b1 pl1 B73, а потомство F1 использовали для получения двух синтетических семян. популяции, различающиеся только по конституции b1 pl1 21 .
Модель мыши
Всех мышей содержали в условиях, свободных от патогенов, с 12–12-часовым циклом свет-темнота. Все процедуры в отношении животных соответствовали итальянскому законодательству (D. Lgs n 2014/26, реализация 2010/63 / UE) и одобрены Организацией защиты животных Миланского университета и Министерством здравоохранения Италии. Стратегии генотипирования опубликованы в справочнике по животным. Sgca нулевых мышей были ранее описаны Duclos et al. 22 . В возрасте 3 недель мышей Sgca , не имеющих значения, были случайным образом разделены на две группы: одну получали контрольную диету, не содержащую цианидина (YD), а другую — диету, обогащенную цианидином (RD).Диеты предоставлялись ad libitum в течение 5 или 25 недель. Использовались как самцы, так и самки мышей без разбора. Чтобы проверить влияние диеты, обогащенной цианидином, на мышей в зрелом возрасте, мы также предоставили диеты Sgca нулевым животным в возрасте 5 недель в течение 15 недель.
Гематоксилин и эозин и трихром Миллигана
Окрашивание гематоксилином и эозином проводили на криосреях толщиной 7 мкм, фиксированных 4% параформальдегидом в течение 10 минут при 4 ° C. Окрашивание проводили по стандартным протоколам.Для окрашивания трихромом по Миллигану срезы фиксировали в течение 1 часа фиксатором Буэна (Sigma-Aldrich) и промывали в течение 1 часа под проточной водой. Затем срезы быстро дегидратировали до 95% этанола в растворах градуированного этанола, последовательно пропускали в 3% дихромате калия (Sigma-Aldrich) в течение 5 минут, быстро промывали дистиллированной водой, окрашивали 0,1% кислым фуксином (Sigma-Aldrich) для 30 с, снова промывают дистиллированной водой, пропускают в 1% фосфорномолибденовой кислоте (Sigma-Aldrich) в течение 3 минут, окрашивают Orange G (2% в 1% фосфомолибденовой кислоте) (Sigma-Aldrich) в течение 5 минут, промывают дистиллированной водой , пропускали в 1% уксусной кислоте (VWR) в течение 2 минут, окрашивали 1% Fast Green в течение 5 минут (Sigma-Aldrich), пропускали в 1% уксусной кислоте в течение 3 минут, быстро дегидратировали до 100% EtOH и перед этим пропускали в ксилол. монтаж с помощью Eukitt (Bio-Optica).
Окрашивание SDH
Для окрашивания SDH использовали свежесрезанные криосрезы толщиной 7 мкм Tibialis anterior . Срезы инкубировали в инкубационном растворе SDH (1 таблетка нитросинего тетразолия, растворенного в 0,1 М сукцинат натрия-0,1 М фосфатном буфере pH 7,4, все от Sigma-Aldrich) в течение 1 ч при 37 ° C, промывали в дистиллированной воде, быстро проходили через 30%, 60%, 30% ацетона (VWR) и снова промыть дистиллированной водой. Затем срезы быстро дегидратировали в растворах градуированного EtOH, очищали в ксилоле и наносили на монтажную среду Eukitt.
Тест на беговой дорожке
Для функционального анализа теста на беговой дорожке трехнедельных мышей Sgca нулевых кормили в течение 5 недель с диетой RD или YD и WT с диетой YD в качестве контроля. Перед записью производительности мышей тренировали три раза в неделю. Поэтому тест на беговой дорожке проводился, начиная с 8-недельных мышей, один раз в неделю в течение 15 недель. Тест проводился на беговой дорожке (Bioseb) с наклоном 10%, начиная со скорости 6 см / с и увеличивая ее на 2 см / с каждые 2 минуты.Для каждого теста измеряли время до истощения каждой мыши.
Экстракция белка и вестерн-блот
Вестерн-блот проводился на экстрактах белков из мышц, гомогенизированных в тканевом буфере (150 мМ трис-HCl, pH 7,5; 1 мМ ЭДТА, 1% тритон, 150 мМ NaCl, все от Sigma-Aldrich) в течение 30 с с последующим лизисом на льду в течение 30 минут и центрифугированием при 10000 об / мин при 4 ° C для осаждения остатков клеток. Супернатант количественно определяли с помощью DC Protein Assay (Biorad), и для каждого образца загружали 30–50 мкг экстрактов общего белка.Изображения были получены с использованием программного обеспечения Chemidoc ImageLab (Biorad). Были использованы следующие антитела и разведения: кроличьи анти-VDAC1 (1: 10 000, Cell Signaling), мышиные анти-винкулин (1: 2500, Sigma-Aldrich).
Содержание карбонилирования белка (PCC)
Уровень окислительного стресса в экстрактах белка четырехглавой мышцы определяли количественно путем измерения карбонилирования белка. Карбонильные группы были преобразованы в их аддукты DNP с использованием 2,4-динитрофенилгидразина (DNP) 25 . Мышцы четырехглавой мышцы гомогенизировали в тканевом буфере с добавлением 1 мМ DTT.После количественного определения белка 50 мкг белка дериватизировали с тем же объемом DNPH (10 мМ в 2 M HCl, Sigma-Aldrich) в течение 1 ч в темноте при комнатной температуре. После этого для осаждения карбонилированного белка и остановки реакции дериватизации добавляли раствор 30% трихлоруксусной кислоты (TCA, Sigma-Aldrich) и образец инкубировали в течение 15 мин на льду. Затем образцы центрифугировали при 15000 × g в течение 15 мин при 4 ° C. После удаления супернатанта каждый осадок трижды промывали раствором этанол-этилацетат (1: 1) для удаления избытка ДНФГ, затем осадок солюбилизировали в 1 мл гуанидина (6 М, Sigma-Aldrich) и инкубируют 30 мин при 37 ° С.Содержание карбонилированного белка измеряли на спектрофотометре при 370 нм (Janway).
Иммунофлуоресценция
Иммунофлуоресценцию проводили на криосрезов 7 мкм. Срезы фиксировали в течение 10 мин при 4 ° C с 4% PFA, дважды промывали PBS и повышали проницаемость раствором, содержащим 1% BSA (Sigma-Aldrich) и 0,2% Triton X-100 (Sigma-Aldrich) в PBS, в течение 30 минут. мин при комнатной температуре. После блокирования в течение 30 минут 10% ослиной сывороткой срезы инкубировали O / N с первичными антителами в PBS-1.5% ослиная сыворотка. На следующий день были выполнены две промывки в PBS-1% BSA-0,2% Triton X-100, и образцы инкубировались в течение 45 минут при комнатной температуре со вторичными антителами и Hoechst (1: 500, Sigma-Aldrich). Избыток антитела дважды промывали в PBS-0,2% Triton X-100 перед нанесением на среду для фиксации флуоресценции (Dako). Были использованы следующие антитела и разведения: козий анти-коллаген I (1: 200, Southern Biotech), ослиный анти-козий 488 (1: 250, Jackson Lab).
Иммунофлуоресценция F4 / 80 была проведена на криосрезе передней большеберцовой кости.Образцы подвергали проницаемости в течение 10 мин при комнатной температуре в растворе PBS-0,5% Triton X-100 (Sigma-Aldrich), затем трижды промывали в PBS. После блокирования в течение 30 мин раствором PBS-3% BSA (Sigma-Aldrich) срезы дважды промывали PBS и инкубировали O / N с первичными антителами анти-F4 / 80 (крыса, 1: 400, Novus) и антибиотиками. -ламинин (кролик, 1: 300 Sigma-Aldrich) в PBS. На следующий день были выполнены три промывания в PBS, и образцы инкубировали в течение 45 минут при комнатной температуре со вторичными антителами и Hoechst (1: 500, Sigma-Aldrich).Избыток антитела промывали пять раз PBS перед нанесением на среду для фиксации флуоресценции (Dako). Положительные клетки F4 / 80 были нормализованы по общему количеству волокон на картинке.
Для иммуноокрашивания медленной тяжелой цепи миозина (MyHC I) криосрезы извлекали в растворе Na-цитрата (10 мМ, pH 6) в течение 30 минут в паровой машине. После уравновешивания среза при комнатной температуре срезы дважды промывали PBS в течение 10 мин, а затем инкубировали с первичным антителом мыши против MyHC I 1: 1000 (Sigma-Aldrich) и кроличьим антителом против ламинина 1: 300 (Sigma-Aldrich) O / N при 4 ° C.Волокна, положительные по MyHC I, были нормализованы по общему количеству миофибрилл.
Просвечивающая электронная микроскопия (ПЭМ)
Для ПЭМ мышцы EDL были вырезаны у умерщвленных животных, прикреплены к чашке Sylgard, зафиксированы при комнатной температуре 3,5% глутаровым альдегидом в 0,1 М буфере NaCaCO (pH 7,4) и сохранены в фиксаторе. при 4 ° C. Затем фиксированные мышцы подвергали последующей фиксации в смеси 2% OsO 4 и 0,8% K 3 Fe (CN) 6 в течение 1-2 часов, промывали 0,1 М натрий-какодилатным буфером с 75 мМ CaCl 2. , en-block, окрашенный насыщенным уранилацетатом, и залитый для EM в эпоксидную смолу (Epon 812), как в исх. 45 . Ультратонкие срезы (~ 40 нм) вырезали на микротоме Leica Ultracut R (Leica Microsystem, Австрия) с использованием алмазного ножа Diatome (DiatomeLtd. CH-2501 Biel, Швейцария) и исследовали при 60 кВ после двойной обработки уранилацетатом и цитратом свинца. , с электронным микроскопом FP 505 Morgagni Series 268D (компания FEI, Брно, Чехия), оснащенным цифровой камерой Megaview III (Мюнстер, Германия) и Soft Imaging System (Германия).
Выделение макрофагов из скелетных мышц
Скелетные мышцы, собранные с задних конечностей, измельчали и переваривали ферментативно и механически в суспензии отдельных клеток с 0.2% коллагеназы B (Roche) в среде RPMI (Lonza) в течение 1 ч и 30 мин на водяной бане при 37 ° C при перемешивании. После фильтрации клеточными сетчатыми фильтрами (70 и 40 мкм, Grainer) и центрифугирования при 272 × g в течение 10 минут при 4 ° C суспензию отдельных клеток ресуспендировали в стерильном PBS-0,5% BSA (Genespin) -2 мМ EDTA ( Sigma-Aldrich) и инкубировали с антителом к CD45, конъюгированным с магнитными шариками (Miltenyi Biotech), в течение 30 мин при 4 ° C. Затем клетки промывали PBS-0,5% BSA (Genespin) -2 мМ EDTA (Sigma-Aldrich), и изоляцию клеток CD45 + проводили с использованием магнитных колонок (Miltenyi, Biotech) в соответствии с инструкциями производителя.После блокирования Fc (Fc Buffer, Miltenyi Biotech) фракцию клеток CD45 + инкубировали с антителом Ly6C-PE (eBioscence), чтобы отличить провоспалительные (Ly6C + ) от противовоспалительных макрофагов (Ly6C — ) и с антителом к CD64-APC (BD Bioscience), чтобы отличить нейтрофилы от макрофагов. Затем проводили эксперименты по сортировке клеток с использованием FACSAria II (BD Bioscience). Программное обеспечение Diva (BD Pharmingen, San Diego, CA) использовалось для сбора и анализа данных.
Получение изображения
Изображения были получены с помощью инвертированного микроскопа (Leica-DMI6000B), оснащенного камерами Leica DFC365FX и DFC400. Программное обеспечение Leica Application Suite использовалось для получения изображений, а Photoshop — для создания объединенных изображений.
Измерение CSA миофибры и количественное определение коллагена I.
Измерение CSA миофибрилл проводили на срезах передней большеберцовой мышцы с использованием программного обеспечения Image J. Количественную оценку коллагена I проводили с использованием макроса в ImageJ для идентификации и количественной оценки областей, положительных по коллагену I.
Статистика
Все данные, показанные на графиках, выражены как среднее ± стандартное отклонение, за исключением графиков, показывающих распределения CSA, которые выражены как среднее ± усы от минимума до максимума. Статистический анализ между двумя колонками выполняли с использованием двустороннего непарного теста Стьюдента t , тогда как данные, содержащие более двух экспериментальных групп, анализировали с помощью однофакторного дисперсионного анализа с последующим тестом Бонферрони. * P <0,05; ** P <0,01; *** П <0.001; доверительные интервалы 95%, уровень альфа 0,05.
Проглатывание зерна пшеницы защищает от прогрессирования мышечной слабости у мышей MDX, модель мышечной дистрофии Дюшенна на животных
Энгель А.Г., Ямамото М., Фишбек К.Х. 1994 Дистрофинопатии. В: Engel AG, Franzini-Armstrong C (eds) Myology, 2nd Ed, Vol II. McGraw-Hill, New York, pp 1133–1187
Hoffman EP, Brown RH Jr, Kunkel LM 1987 Dystrophin: белковый продукт локуса мышечной дистрофии Дюшенна. Ячейка 51 : 919–928
CAS Google ученый
Ahn AH, Kunkel LM 1993 Структурное и функциональное разнообразие дистрофина. Nat Genet 3 : 283–291
CAS PubMed Google ученый
Bulfield G, Siller WG, Wight PAL, Moore KJ 1984 Хромосомно-связанная дистрофия ( mdx ) у мышей. Proc Natl Acad Sci USA 81 : 1189–1192
CAS Google ученый
McArdle A, Edwards RH, Jackson MJ 1995 Как дефицит дистрофина приводит к дегенерации мышц? Доказательства с мыши mdx . Нервно-мышечное расстройство 5 : 445–456
CAS PubMed Google ученый
Sicinski P, Gang Y, Ryder-Cook AS, Barnard EA, Darlison MG, Barnard PJ 1989 Молекулярные основы мышечной дистрофии у мышей mdx : точечная мутация. Наука 244 : 1578–1580
CAS Google ученый
Cox GA, Phelps SF, Chapman VM, Chamberlain JS 1993 Новая мутация mdx нарушает экспрессию мышечной и немышечной изоформы дистрофина. Nat Genet 4 : 87–93
CAS PubMed Google ученый
Pastoret C, Sebille A 1993 Дополнительные аспекты мышечной дистрофии у мышей mdx . Нервно-мышечное расстройство 3 : 471–475
CAS PubMed Google ученый
Pastoret C, Sebille A 1995 Mdx Мыши демонстрируют прогрессирующую слабость и ухудшение мышечной массы с возрастом. J Neurol Sci 129 : 97–105
CAS PubMed Google ученый
Tanabe Y, Esaki K, Nomura T. 1986 Патология скелетных мышц у мышей с мышечной дистрофией, связанной с X-хромосомой ( mdx ). Acta Neuropathol 69 : 91–95
CAS PubMed Google ученый
Coulton GR, Morgan JE, Partridge TA, Sloper JC 1988 Миопатия скелетных мышц мыши mdx : I. Гистологическое, морфометрическое и биохимическое исследование. Neuropathol Appl Neurobiol 14 : 53–70
CAS PubMed Google ученый
Lefaucheur JP, Pastoret C, Sebille A 1995 Фенотип дистрофинопатии у старых мышей MDX . Anat Rec 242 : 70–76
CAS PubMed Google ученый
Карнват Дж. У., Шоттон Д. М. 1987 Мышечная дистрофия у мышей mdx : гистопатология камбаловидной мышцы и длинного разгибателя пальцев. J Neurol Sci 80 : 39–54
CAS PubMed Google ученый
Torres LFB, Duchen LW 1987 Мутант mdx: унаследовал миопатию у мышей. Мозг 110 : 269–299
PubMed Google ученый
Макейюс Р.В., Патель В.К., Кришна Г., Дирдорф С.Ф., Бонсетт С. 1991. Влияние аденилосукцината на силу мышц, лишенных дистрофина, у мышей MDX. Biochem Arch 7 : 95–103
CAS Google ученый
Muntoni F, Mateddu A, Marchei F, Clerk A, Serra G 1993 Мышечная слабость у мыши mdx . J Neurol Sci 120 : 71–77
CAS PubMed Google ученый
Carter GT, Wineinger MA, Walsh SA, Horasek SJ, Abresch RT, Fowler WM Jr 1995 Влияние произвольного бега на колесе на мышцы мыши mdx . Нервно-мышечное расстройство 5 : 323–332
CAS PubMed Google ученый
Sheppard AJ, Pennington AT, Weihrauch JL 1993 Анализ и распределение витамина E в растительных маслах и пищевых продуктах.В: Packer L, Fuchs J (eds) Vitamin E in Health and Disease. Марсель Декер, Нью-Йорк, стр. 9–31
Бикнелл Ф. 1940 Витамин Е в лечении мышечных дистрофий и нервных заболеваний. Ланцет 1 : 10–13
Google ученый
Fenichel GM, Brooke MH, Griggs RC, Mendell JR, Miller JP, Moxley RT III, Park JH, Provine MA, Florence J, Kaiser KK, King WM, Pandya S, Robison J, Signore L 1988 Клиническое исследование при мышечной дистрофии Дюшенна: пеницилламин и витамин Е. Мышечный нерв 11 : 1164–1168
CAS PubMed Google ученый
Sies H 1993 Эффективность витамина Е у человека . ВЕРИС, Лагранж, II
Google ученый
Folch J, Lees M, Sloane Stanley GH 1957 Простой метод выделения и очистки общих липидов из тканей животных. J Biol Chem 226 : 497–509
CAS PubMed Central Google ученый
Kontush A, Hübner C, Finckh B, Kohlschütter A, Beisiegel U 1994 Окисляемость липопротеинов низкой плотности медью коррелирует с его исходным содержанием убихинола-10 и полиненасыщенных жирных кислот. FEBS Lett 341 : 69–73
CAS PubMed Google ученый
Rath M, Niendorf A, Redlin T, Dietel M, Krebber HJ, Beisiegel U 1989 Обнаружение и количественное определение липопротеинов ( a ) в стенке артерии у 107 пациентов с коронарным шунтированием. Артериосклероз 9 : 579–592
CAS PubMed Google ученый
Найду Р., Кнапп М.Л. 1992 Исследования продуктов перекисного окисления липидов в спинномозговой жидкости и сыворотке при рассеянном склерозе и других состояниях. CLin Chem 38 : 2449–2454
CAS PubMed Google ученый
Марклунд С.Л., Вестман Н.Г., Роос Дж., Карлссон Дж. 1984 Радиационная стойкость и активность супероксиддисмутазы CuZn, супероксиддисмутазы Mn, каталазы и глутатионпероксидазы семи линий клеток человека. Radiat Res 100 : 115–123
CAS PubMed Google ученый
Marklund SL 1985 Прямой анализ супероксиддисмутазы с супероксидом калия.В: Гринвальд Р.А. (ред.) Справочник по методам исследования кислородных радикалов. CRC Press, Boca Raton, FL, pp 249–255
Bradford MM 1976 Быстрый и чувствительный метод количественного определения белка, использующий принцип связывания белок-краситель. Ann Biochem 72 : 248–254
CAS Google ученый
Lombeck I, Menzel H 1988 Селен у новорожденных и детей. В: Favier A (ed) Selenium in Medicine and Biology.Вальтер де Грюйтер, Берлин, стр. 197–206
Google ученый
SAS Institute 1988 Руководство пользователя SAS / STAT, версия 6.03. Институт SAS, Inc, Кэри, Северная Каролина
Вайленд С., Рендон А., Мисслин Р., Унгерер А. 1995 Влияние мутации гена дистрофина на поведение мышей mdx . 1. Дефицит удержания при длительной задержке спонтанного чередования заданий и жима штанги. Behav Genet 25 : 569–579
CAS PubMed Google ученый
Muntoni F, Mateddu A, Serra G 1991 Дефицит поведения пассивного избегания у мышей mdx . Нервно-мышечное расстройство 1 : 121–123
CAS PubMed Google ученый
Лидов HGW, Байерс Т.Дж., Уоткинс С.К., Кункель Л.М. 1990 Локализация дистрофина в постсинаптических областях корковых нейронов центральной нервной системы. Nature 348 : 725–728
CAS PubMed Google ученый
Evans HM, Burr GO 1928 Развитие паралича у грудных детей матерей, лишенных витамина E. J Biol Chem 76 : 273–297
CAS Google ученый
Verzar F 1939 Der Kreatin-Stoffwechsel bei der Muskeldystrophie durch E-Vitamin-Mangel und seine Beeinflussung durch Tocopherol. Z Vitaminforschung 9 : 242–251
CAS Google ученый
Эрвасти Дж. М., Олендик К., Каль С. Д., Гавер М. Г., Кэмпбелл К. П. 1990 Дефицит гликопротеинового компонента дистрофинового комплекса в дистрофической мышце. Nature 345 : 315–319
CAS PubMed Google ученый
Brenman JE, Chao DS, Xia H, Aldape K, Bredt DS 1995 Синтаза оксида азота в комплексе с дистрофином и отсутствует в сарколемме скелетных мышц при мышечной дистрофии Дюшенна. Ячейка 82 : 743–752
CAS Google ученый
Mokhtarian A, Lefaucheur JP, Even PC, Sebille A 1995 Влияние упражнений на беговой дорожке и кормления с высоким содержанием жира на мышечную дегенерацию у мышей mdx во время отлучения от груди. Clin Sci 89 : 447–452
CAS PubMed Google ученый
Halliwell B, Gutteridge JMC 1989 Свободные радикалы в биологии и медицине, 2-е изд. Clarendon Press, Oxford
Foxley A, Edwards RHT, Jackson MJ 1991 Повышенное перекисное окисление липидов в мышцах с дистрофией Дюшенна может быть вторичным по отношению к повреждению мышц. Biochem Soc Trans 19 (доп.): 180S.
CAS PubMed Google ученый
Brown, RH 1995 Свободные радикалы, запрограммированная гибель клеток и мышечная дистрофия. Curr Opin Neurol 8 : 373–378
CAS Google ученый
Остин Л., де Низе М., МакГрегор А., Артур Х., Гурузинге А., Гулд М.К. 1992 Потенциальное оксирадикальное повреждение и энергетический статус отдельных мышечных волокон в результате дегенерирующих мышечных заболеваний. Нервно-мышечное расстройство 2 : 27–33
CAS Google ученый
Асаяма К., Хаясибе Х, Добаши К., Като К. 1989 Перекись липидов и антиоксидантные ферменты в мышцах и немышечных мышцах дистрофической мыши. Мышечный нерв 12 : 742–748
CAS Google ученый
Джонсон П., Хаммер Дж. Л. 1994 Влияние кальпаина на активность антиоксидантных ферментов. Free Radic Res 21 : 27–33
CAS PubMed Google ученый
Nagy B, Samaha FJ 1986 Дефекты мембраны при дистрофии Дюшенна: протеаза, влияющая на саркоплазматический ретикулум. Ann Neurol 20 : 50–56
CAS PubMed Google ученый
Спенсер MJ, Croall DE, Tidball JG 1995 Кальпаины активируются в некротических волокнах мышей с дистрофией MDX. J Biol Chem 270 : 10909–10914
CAS PubMed Google ученый
Микетти М., Саламино Ф., Меллони Э., Понтремоли С. 1995 г. Обратимая инактивация изоформ кальпаина оксидом азота. Biochem Biophys Res Commun 207 : 1009–1014
CAS PubMed Google ученый
Lee KH, Back MY, Moon KY, Song WK, Chung CH, Ha DB, Kang M-S 1994 Оксид азота как молекула-посредник для слияния миобластов. J Biol Chem 269 : 14371–14374
CAS Google ученый
Schmalbruch H 1984 Регенерированные мышечные волокна при мышечной дистрофии Дюшенна: исследование серийных секций. Неврология 34 : 60–65
CAS Google ученый
Полноценное питание для больных Дюшенном
Питание по Дюшенну
6, 7Питание — это акт или процесс питания или получения питания. Исследования показали, что правильное питание — это один из компонентов, который может улучшить общее качество жизни человека, страдающего мышечной дистрофией Дюшенна. Хотя есть несколько соображений относительно потребления калорий, в том числе: физическая активность, способность передвигаться и использование стероидов, специалисты в этой области предполагают, что ежедневное потребление калорий должно составлять 80% от того, что потребляют люди без мышечной дистрофии Дюшенна.В целом рекомендуется избегать чрезмерного потребления, потребление соли не более 1500 мг в день и адекватное потребление кальция.
Имейте в виду, начать никогда не поздно! Планирование питания часто эффективное средство для вовлечения всех членов семьи. Заручитесь поддержкой вашего медицинского персонала, в том числе зарегистрированного диетолог-диетолог или зарегистрированный диетолог для разработки плана адаптированы к вашим индивидуальным потребностям.
Витамины и пищевые добавки
5Суточные потребности в кальции основаны на фактическом потреблении.Первый шаг — это собирать информацию о том, что поступает с пищей, а затем определить, достаточно ли. Когда количество меньше идеального, добавки могут быть добавленным. Важно определить фактическое количество еды, а затем решить, нужны ли дополнительные. Организм может получать слишком много кальция, поэтому он обязательно работать с вашей медицинской командой, чтобы определить план лучше всего адаптировано к потребностям вашего ребенка.
Рекомендуется ежедневно принимать поливитамины, содержащие минеральные вещества. добавки.Примеры включают: для мальчиков жевательные таблетки, такие как Flintstones и для подростков — поливитамины для мужчин.
Дополнительные ресурсы
Ниже приведены дополнительные ресурсы, которые могут вам пригодиться.
Ссылки на источники
1 Bushby K, et al. (2009). Диагностика и лечение мышечной дистрофии Дюшенна, часть 1: внедрение многопрофильной помощи. The Lancet Neurology, 73-93.
2 Bushby, K. et al. (2009). Диагностика и лечение мышечной дистрофии Дюшенна, часть 2: внедрение многопрофильной помощи.The Lancet Neurology, 177–189.
3 Оцените размеры сервировки с предметами домашнего обихода (или своими руками…). (2012, 7 февраля). Получено с TopsyTasty: http://topsytasty.com
4 Из книги «Диагностика и лечение мышечной дистрофии Дюшенна: руководство для семей». (2010).
5 Глосс, Д., Моксли, Р. Т., Ашвал, С., & Оскуи, М. (2016). Краткое изложение обновленного практического руководства: Кортикостероидное лечение мышечной дистрофии Дюшенна. Неврология, 465–472.
6 Годшалл, LD, CCHMC, B. (нет данных).
7 Рамос-Платт, невролог, Л. (нет данных).
8 Симона, С., Франческа, М., Маурицио, М., Софи, Г., Шакко, М., и Сусанна, Э. (2017). Проблемы питания при мышечной дистрофии Дюшенна. Питательные вещества.
9 Система здравоохранения Университета Вирджинии: Центр здоровья пищеварительной системы. (2014, октябрь). Диета с низким содержанием FODMAP. Получено с www.GInutrition.virginia.edu
10 Система здравоохранения Университета Вирджинии: Центр здоровья пищеварительной системы.(2015, октябрь). Высокое содержание клетчатки. Получено с www.GInutrition.virginia.edu
Обратите внимание, что содержание сайта CureDuchenne включает в себя подборку статей, рекомендаций и ссылок из сообщества. Этот общий контент предназначен для использования в качестве ориентира в информационных целях. Пожалуйста, обратитесь к своему поставщику медицинских услуг за вашими индивидуальными потребностями в управлении медицинским обслуживанием.
Веб-сайт CureDuchenne может содержать ссылки на внешние веб-сайты, которые не предоставляются и / или не поддерживаются или каким-либо образом связаны с CureDuchenne.Обратите внимание, что CureDuchenne не гарантирует точность, актуальность, своевременность или полноту любой информации на этих внешних веб-сайтах.
Облегчение последствий мышечной дистрофии
Мышечная дистрофия — это истощающее мышечное заболевание, которое вызывает постепенное ослабление мышц у больных во всем мире. Облегчение неблагоприятных последствий заболевания вызывает озабоченность у исследователей и специалистов здравоохранения во всем мире.
Изображение предоставлено: Freedom Studio / Shutterstock.com
Что такое мышечная дистрофия?
Мышечная дистрофия встречается примерно у 1 из 3 500 новорожденных мальчиков. Случаи заболевания задокументированы, хотя и редко у женщин. Он обычно диагностируется в возрасте от 3 до 6 лет и является дегенеративным, вызывая слабость в проксимальных мускулах ног и области таза, что приводит к атрофии.
По мере прогрессирования болезни у пациентов поражаются мышцы туловища, предплечий и других областей.
Существует целый спектр мышечных дистрофий различной степени тяжести.Каждый из них имеет определенные характеристики аномалий, и все они вызваны изменениями в генах, которые кодируют дистрофин, необходимый белок для здорового роста и целостности мышц. Аномалии включают некроз мышечных волокон, изменение размера мышечных волокон и воспаление.
В самом тяжелом конце спектра находится мышечная дистрофия Дюшенна, которая характеризуется полным отсутствием белка дистрофина. Менее тяжелая форма мышечной дистрофии известна как мышечная дистрофия Беккера, при которой наблюдается уменьшение или усечение дистрофина.
Генетическая основа состояния
Мышечные дистрофии вызваны изменениями в генах, сцепленных с Х-хромосомой (в частности, гена DMD на коротком плече), поэтому в большинстве случаев это мужчины. Большинство женщин являются носителями болезни и протекают бессимптомно, поскольку они наследуют 2 X-хромосомы, только одна из которых несет дефектный ген.
Мужчина с этим заболеванием, если он сможет воспроизводить потомство, передаст ген всем своим дочерям, которые станут носителями.Женщины-носители имеют 25% шанс иметь дочь-носительницу или не-носительницу, а также здорового или больного сына.
Однако не все случаи мышечной дистрофии передаются по наследству. По неизвестной причине некоторые экземпляры могут возникать спорадически из-за мутаций.
Признаки и симптомы мышечной дистрофии
Мышечная дистрофия прогрессирует с одинаковой скоростью у всех пациентов. Однако могут возникать индивидуальные вариации с разными признаками и симптомами, возникающими на разных этапах развития.
Ранние симптомы и признаки у детей могут включать задержку в достижении вех в развитии, например, сидение или стояние без посторонней помощи, необычную походку вразвалку и знак Гауэрса, когда пациенту приходится использовать свои руки и руки, чтобы подняться из положения сидя или. положение на корточках из-за недостаточной силы мышц бедра и бедра.
У детей младшего возраста и маленьких детей может наблюдаться псевдогипертрофия (аномально увеличенные икры из-за рубцевания мышц), они могут быть неуклюжими или неуклюжими.Симптомы могут улучшиться в возрасте от 3 до 5 лет; однако это может быть связано с нормальным ростом и развитием.
Развитие и развитие
По мере прогрессирования заболевания у пациентов может развиваться сколиоз или лордоз, что приводит к аномальному искривлению позвоночника. Контрактуры, когда утолщение и укорочение тканей вызывают ограничение движений, а также ненормальная фиксация, особенно вокруг суставов, также часто развиваются у больных.
Кредит изображения: Альбина Глизич / Shutterstock.com
В крайних случаях могут быть поражены мышцы кишечника, сердца и дыхательной системы. Без физиотерапии ортезы для ног обычно необходимы большинству пациентов к 8 или 9 годам, а к подростковому возрасту они прикованы к инвалидной коляске.
Осложнения, поражающие легкие и сердце, могут привести к сердечным приступам и дыхательной недостаточности. Воздействие на мышцы кишечника может привести к запору и диарее.
Не существует известного лекарства от мышечной дистрофии; однако существуют методы лечения и терапии, которые могут иметь разную степень успеха, и исследователи изучают способы их улучшения и находят новые.
Лечение и облегчение последствий мышечных дистрофий
Терапия, включая упражнения с малой нагрузкой, физиотерапию и трудотерапию, может помочь облегчить проблемы с подвижностью и дыханием. Однако, когда проблемы с дыханием становятся слишком серьезными, необходимо использовать машины, чтобы регулировать дыхание и кашель, что особенно важно во время сна.
Также полезно отметить, что MD может вызывать как эмоциональные, так и физические страдания, и по этой причине существует множество групп поддержки.
Проблемы с глотанием, которые могут привести к дисфагии, увеличивают риск удушья и инфекций грудной клетки, если пища и жидкость попадают в легкие. Методы решения этих проблем могут включать помощь диетологов, логопедов и лингвистов. Также можно использовать хирургическое вмешательство, в том числе расширение пищевода путем надувания в него небольшого баллона.
Осложнения сердца можно лечить путем мониторинга состояния, и в некоторых случаях пациентам могут быть прописаны такие лекарства, как бета-блокаторы (которые контролируют нерегулярное сердцебиение) или ингибиторы АПФ (которые расслабляют артерии).Кардиостимуляторы также могут использоваться для регулирования сердцебиения.
Было показано, что несколько лекарств смягчают эффекты MD. В случае Дюшенна лечение кортикостероидами может улучшить мышечную силу и функцию на длительные периоды времени, замедляя дегенеративное мышечное истощение.
Однако есть побочные эффекты, такие как увеличение веса и усиленный рост волос. Недавно было обнаружено, что креатиновые добавки помогают улучшить мышечную силу у некоторых пациентов.
Последние разработки
Аталурен — это недавно разработанный препарат, который можно использовать для лечения MD.Он работает, заставляя клетку «игнорировать» сигнал преждевременной остановки, который вызывает преждевременное прекращение выработки дистрофина. Это вызвано бессмысленной мутацией, от которой страдают около 13 процентов больных. По сути, это «терапия восстановления белка», которая способствует выработке дистрофина у больных.
Недавние испытания новых и новых методов лечения, основанных на генной терапии, являются еще одним многообещающим путем к лечению MD. Одним из возможных методов лечения является «пропуск экзонов», который позволяет эффективно пропускать экзоны (участки ДНК, содержащие информацию о белках), которые отсутствуют или дублируются у некоторых больных.
Это может привести к выработке большего количества дистрофина, поскольку он обычно кодируется, таким образом, смягчая эффекты MD. Еще одно потенциальное лечение, которое исследуется, — это терапия стволовыми клетками. Испытания этой терапии продолжаются, чтобы увидеть, можно ли ее использовать для восстановления поврежденной мышечной ткани.
Заключение
Мышечные дистрофии — это изнуряющий набор состояний, вызывающих страдания и ряд осложнений со здоровьем, от которых нет лекарства.
Текущие и разрабатываемые методы лечения дают некоторую надежду больным во всем мире и являются предметом особого внимания исследователей в области медицинских исследований.
Дополнительная литература
Понимание процесса фиброза при мышечной дистрофии Дюшенна
Фиброз — это аберрантное отложение компонентов внеклеточного матрикса (ВКМ) во время заживления ткани, ведущее к потере ее архитектуры и функции. Фиброзные заболевания часто связаны с хроническими патологиями и возникают в большом количестве жизненно важных органов и тканей, включая скелетные мышцы. В мышцах человека фиброз наиболее легко связан с тяжелым мышечным истощением мышечной дистрофии Дюшенна (МДД), вызванным потерей функции гена дистрофина.При МДД скелетные мышцы дегенерируют и инфильтрируются воспалительными клетками, а функции мышечных стволовых клеток (сателлитных клеток) затрудняются, а фиброгенные клетки гиперпролиферируют и гиперактивируются, что приводит к замещению скелетных мышц нефункциональной фиброзной тканью. Здесь мы рассматриваем новые достижения в нашем понимании механизмов, ведущих к фиброзу при МДД, и несколько недавних достижений в направлении его обращения в качестве потенциальных методов лечения, замедляющих прогрессирование заболевания.
1. Введение
Мышечная дистрофия Дюшенна (МДД) — это фатальное, Х-сцепленное рецессивное заболевание, характеризующееся прогрессирующей потерей мышечной массы и функции [1]. МДД встречается примерно у 1 из 3500 живорожденных мальчиков и вызвана мутациями в гене дистрофина, которые препятствуют синтезу полноразмерного и / или полностью функционального белка. Сам дистрофин представляет собой крупный структурный белок, стабилизирующий сарколемму мышечных волокон. В его отсутствие волокна становятся уязвимыми для повреждения, вызванного сокращением, и подвергаются циклам некроза и восстановления, пока мышечная масса не заменяется жировой и фиброзной тканью.Больные мальчики прикованы к инвалидной коляске и обычно доживают до позднего подросткового возраста или до двадцати пяти лет. В настоящее время нет лекарства, и пациенты получают только паллиативную помощь. Следовательно, были предприняты значительные и постоянные усилия по раскрытию механизмов заболевания и разработке новых возможностей лечения [2, 3]. Попытки обеспечить первичное лечение МДД, среди прочего, включают заместительную вирусную терапию, плазмид-опосредованную невирусную экспрессию, трансплантацию стволовых клеток, индуцированный антисмысловыми олигонуклеотидами пропуск экзонов и подавление нонсенс-мутаций лекарствами, хотя они остаются безуспешными [4–7].
Однако в последнее время внимание также стало сосредотачиваться на понимании и изменении патологического фона заболевания, в настоящее время хорошо установлено, что многие патологические особенности МДД вызваны не только недостатком дистрофина и / или его недостаточностью. мышечных стволовых клеток (также называемых сателлитными клетками), но они также связаны со сложным взаимодействием этих клеток с окружающей средой. Изменения в этой среде могут замедлить восстановление и регенерацию мышц и усилить воспаление, что приведет к обострению заболевания и развитию фиброза.Важные факторы, способствующие патогенезу МДД и потенциальные препятствия или цели для достижения лучших терапевтических результатов, включают воспалительные компоненты поврежденной и регенерирующей мышцы и вспомогательные клеточные медиаторы, такие как фибробласты, которые поддерживают сателлитные и воспалительные клетки, а также среду растворимых факторов. производятся ими. В частности, недавние исследования подчеркнули важность всех этих клеток и факторов в развитии не только фиброза, возникающего во время аберрантной регенерации и прогрессирования МДД, но и при других заболеваниях, таких как диабет и старение (обзор в [8]).
Фиброз определяется как чрезмерное или нерегулируемое отложение компонентов внеклеточного матрикса (ЕСМ) и является особым признаком МДД и аномальных процессов восстановления в некоторых других тканях при повреждении, включая печень, легкие, почки и поджелудочную железу. Контролируемое отложение компонентов ВКМ во время роста и восстановления имеет решающее значение для обеспечения основы для построения и структурирования новой ткани, но изменения во времени, интенсивности и / или компонентах этого процесса могут привести к чрезмерному отложению ВКМ (фиброзу) и потере. функции тканей.Фиброз имеет двойные отрицательные последствия для потенциального лечения МДД, поскольку он не только изменяет функцию мышц, но также уменьшает количество целевой мышцы, доступной для лечения и восстановления. Следовательно, лучшее понимание компонентов и процессов, ведущих к развитию фиброза, важно для нашей способности улучшать восстановление мышц, лечить МДД и потенциально восстанавливать мышечную функцию. Хотя в этом обзоре основное внимание уделяется МДД, существуют доказательства других миопатий, что дисрегулируемый и / или нарушенный ВКМ также может способствовать прогрессированию заболевания [9, 10].
Обзор всех факторов, способствующих фиброзу, выходит за рамки этого отчета, хотя доступно несколько недавних обзоров [11, 12]. Вместо этого мы сосредоточимся здесь на некоторых недавних разработках, которые раскрывают новые или неожиданные роли некоторых из этих типов клеток и молекулярных эффекторов фиброза скелетных мышц, уделяя особое внимание фиброзу у пациентов с МДД, а также на животных моделях, таких как обычно используемые дистрофическая мышь MDX. В частности, мы выделяем некоторые новые достижения в понимании сигнального пути TGF β , возможно, наиболее критического эффектора фиброза, и, в частности, его взаимодействия с фактором роста соединительной ткани (CTGF) и ренин-ангиотензиновой системой (RAS).Мы также рассматриваем недавние усилия по выявлению клеточных источников продукции ECM и оцениваем новую фиброгенную роль, приписываемую другим типам несателлитных клеток, которые были идентифицированы в мышцах. Наконец, мы также опишем некоторые из недавних достижений в разработке и характеристике животных моделей для изучения фиброза in vivo и некоторых потенциальных терапевтических подходов к борьбе и уменьшению фиброза при МДД.
2. Факторы роста при развитии фиброза
2.1. Сигнальный путь TGF
βОдин из наиболее мощных описанных профиброгенных факторов in vivo — это трансформирующий фактор роста-бета (TGF β ), как описано в [13]. TGF β первоначально образуется как латентный предшественник одной из трех изоформ TGF β 1, TGF β 2 и TGF β 3 [14]. Скрытый TGF β хранится в ECM, где он активируется при повреждении ткани или специфических сигналах роста (см. Обзор [15]).Активированный TGF β связывается с гетеродимерным комплексом, состоящим из одной молекулы рецептора TGF β типа I, также называемой активин-связанной киназой 5 (ALK5), и одного рецептора TGF β типа II. Важно отметить, что TGF β экспрессируется в регенерирующих мышцах после травм, а также в дистрофических мышцах пациентов с МДД и мышей MDX [14, 16, 17], где он стимулирует фибробласты к производству белков ЕСМ, таких как коллаген и фибронектин. Кроме того, TGF β и другие профиброгенные полипептиды могут продуцироваться путем проникновения в иммунные, воспалительные, мезенхимальные и тканеспецифические клетки (обзор в [18]).
Когда TGF β высвобождается, он может передавать сигнал через канонический путь TGF β (см. Ниже) или через несколько альтернативных путей (рис. 1). Важно отметить, что было показано, что изменения в уровне передачи сигнала по этим различным путям модулируют фиброзные эффекты, и, следовательно, их различные медиаторы передачи сигналов являются потенциальными мишенями для антифибротической терапии. В нормальных фибробластах канонический путь проходит через ALK5, который фосфорилирует факторы транскрипции Smad2 и 3.Эти сигнальные преобразователи затем связываются с Smad4 с образованием комплекса, который перемещается в ядро, чтобы активировать транскрипцию профибротических генов (обзор в [19, 20]). Альтернативно, TGF β может также передавать сигналы через дополнительные внутриклеточные преобразователи, такие как путь Ras / MEK / ERK, путь p38 MAPK, путь c-abl и JNK в качестве дополнительных внутриклеточных медиаторов [21]. Передача сигналов через эти альтернативные пути способна изменять экспрессию генов избирательно к промоторам. ERK, например, обычно необходим для экспрессии коллагена типа I, тогда как другие сигнальные молекулы, такие как FAK, JNK и TAK1, необходимы для дивергентных процессов, таких как сокращение ECM и дифференцировка миофибробластов [22].
Недавно было сообщено о нескольких косвенных взаимодействиях между передачей сигналов TGF β и другими путями. Например, снижение передачи сигналов инсулиноподобного фактора роста (IGF) у гетерозиготных мышей по IGF-1R (+/-) удалено для рецептора IGF-1 в скелетных мышцах с использованием специфичного для мышц драйвера MyoD-Cre, что приводит к нарушению регенерации, подавлению экспрессии MyoD и миогенин, а также повышенная экспрессия TGF β 1, α -SMA, а также коллагена I и фиброза [23].Дальнейшие механистические исследования показали, что в миобластах обработка IGF-1 может ингибировать стимулированное TGF β 1 фосфорилирование Smad3 и увеличивать взаимодействия фосфорилированного-AKT- (P-AKT-) Smad3, тем самым препятствуя ядерной транслокации Smad3 и тем самым снижая экспрессию фиброзные гены. Напротив, уменьшенное количество IGF-1R снижает уровни P-AKT, делая возможным диссоциацию и ядерную транслокацию Smad3 и усиление сигнального пути TGF β 1 и фиброза [23].
TGF β может также снижать продукцию ферментов, которые разрушают ECM, одновременно увеличивая продукцию белков, таких как тканевые ингибиторы металлопротеиназ (TIMP) и ингибитор активатора плазминогена типа 1 (PAI-1, см. Ниже), которые ингибируют ECM. -разлагающие ферменты. В соответствии с этим инъекция рекомбинантного TGF β в скелетную мышцу in vivo имеет два эффекта. Во-первых, он аутокринным образом стимулирует экспрессию TGF β в миогенных клетках (среди других клеток), а во-вторых, индуцирует продукцию соединительной ткани в области инъекции (обзор см. В [24]).В том же исследовании было показано, что миогенные клетки C2C12, сверхэкспрессирующие TGF β , могут дифференцироваться в миофибробластные клетки после внутримышечной трансплантации [25]. Этот процесс может быть ингибирован небольшим богатым лейцином протеогликановым декорином, который связывается и ингибирует TGF β [26]. Подобные исследования на трансгенных мышах, сверхэкспрессирующих TGF β 1 мышечно-специфическим образом, показали мышечное истощение и эндомизиальный фиброз [27]. Наконец, недавно было показано, что латентный TGF β -связывающий белок 4 (LTBP4), который регулирует высвобождение и биодоступность TGF β из ECM, модулирует фиброз у мышей mdx, хотя его роль в DMD человека, если таковая имеется, имеет еще не установлено [28].
2.2. Перекрестное взаимодействие между TGF
β и другими факторами роста: CTGF и системой ренин-ангиотензинФактор роста соединительной ткани (CTGF) — это неструктурный регуляторный белок, присутствующий в ECM, который играет важную роль в развитии фиброза. В скелетных мышцах пациентов с МДД, собак с дистрофией и мышей MDX обнаружены повышенные уровни CTGF [29]. Развитие фиброза можно уменьшить у мышей MDX путем системного введения нейтрализующего антитела против CTGF [30]. Функционально CTGF обладает способностью воспроизводить или усиливать эффекты TGF β на фиброз.Например, он может индуцировать коллаген 1 типа, α 5 интегрин и фибронектин гораздо сильнее, чем TGF β в фибробластах [31]. Более того, сверхэкспрессия CTGF в мышцах мышей WT с аденовирусным вектором, несущим последовательность кДНК CTGF, вызывает сильный фиброз [32]. Как и TGF β , декорин также может отрицательно регулировать активность CTGF. Даже если точный механизм неизвестен, было показано, что ингибирующее действие декорина на активность CTGF зависит от его способности напрямую связываться с CTGF [33].Интересно, что то же исследование показало, что CTGF индуцирует экспрессию декорина, указывая на потенциальный механизм ауторегуляции. Вместе эти результаты предполагают отрицательную роль как TGF β , так и CTGF в мышечных дистрофиях, непосредственно индуцируя фиброзные процессы и ингибируя миогенез [34]. Возможная новая роль CTGF в фиброзе была недавно обнаружена в результате наблюдения, что экспрессия CTGF снижается в дистрофических мышцах, когда ангиотензин-превращающий фермент (ACE) ингибируется эналаприлом [35].АПФ — важный фермент ренин-ангиотензиновой системы (РАС), регулирующий кровяное давление. Ангиотензиноген в основном вырабатывается печенью, а затем превращается в ангиотензин 1 (Ang 1) ферментом ренина (также известным как ангиотензиногеназа), который секретируется зернистыми клетками почек. Ang 1 впоследствии превращается в ангиотензин 2 (Ang 2) под действием ACE (рис. 1). Ангиотензин 2 оказывает свое биологическое действие, передавая сигналы через рецептор Ang 2 типа 1 (AT1) и рецептор Ang 2 типа 2 (AT2).За последнее десятилетие различные исследования показали, что Ang 2 участвует в развитии фиброза при различных патогенных состояниях и органах [36]. Интересно, что было показано, что РАС активируется при различных мышечных дистрофиях, таких как МДД или врожденная мышечная дистрофия (ВМД) [37], и что дистрофическая мышца у людей имеет повышенные уровни АПФ, что может объяснять повышенные уровни CTGF, но это остается быть доказанным. Хотя роль системы RAS в фиброзе не совсем ясна, несколько исследований показали, что Ang 2 также индуцирует экспрессию фиброзных маркеров в миобластах [38].Недавно было показано, что обработка миобластов C2C12 TGF β значительно увеличивает экспрессию AT2 [39], тем самым обеспечивая предполагаемую связь между передачей сигналов TGF β и экспрессией CTGF. Интересно, что хотя Ang 2 кажется профибротическим, недавние данные показывают, что ангиотензин 1-7 (Ang 1-7), эндогенный биоактивный пептид, полученный из Ang 2, имеет эффект, противоположный Ang 2. Действительно, было показано, что Ang 1 –7 ингибирует передачу сигналов TGF β -Smad in vivo , что, в свою очередь, приводит к снижению профибротической микроРНК- (miR-) 21, значительно уменьшая развитие фиброза в дистрофических мышцах мышей mdx [40].
3. Ремоделирование ВКМ матриксными протеазами
В дополнение к таким молекулам, как TGF β и CTGF, которые способствуют отложению ВКМ, нормальное восстановление мышц также требует факторов, которые регулируют протеолитическую деградацию ВКМ, например, для облегчения сателлитных клеток и миграция миобластов для удаления временного каркаса, отложившегося во время регенерации, и для обеспечения роста волокон. Ясно, что если эти факторы становятся нерегулируемыми, это может привести к отложению ВКМ, фиброзу и потере мышечной функции.Мы будем рассматривать здесь только недавние разработки этой группы молекул, которые включают сериновые протеазы системы активации плазминогена (PA), широкое семейство матричных металлопротеиназ (MMP) и их ингибиторы, PAI-1 и TIMP, соответственно (обзор в [41, 42]). Несколько других публикаций охватывают более общие аспекты их роли в скелетных мышцах и фиброзе [43]. ММП представляют собой большое семейство цинк-зависимых протеолитических ферментов, которое включает в себя различные коллагеназы (ММП-1, ММП-8 и ММП-13), желатиназы (ММП-2 и ММП-9), стромелизины (ММП-3, ММП-3). 7, MMP-10 и MMP-11), металлопротеиназы мембранного типа (MMP-14, MMP-15, MMP-16, MMP-17, MMP-24 и MMP-25) и металлоэластаза (MMP-12) [41].ММП способствуют воспалению и миграции миогенных, воспалительных, сосудистых и фибробластических клеток в поврежденную ткань, разрушая ECM. ММП высвобождаются из поврежденных мышц и инфильтрирующих клеток, но их функция контролируется не только простой экспрессией и высвобождением, но также чистой активностью ММП, которая отражает относительное количество активированного фермента. Активация MMP требует протеолитического расщепления неактивного предшественника либо матричной металлопротеиназой 1 мембранного типа (MT1-MMP) [44], либо плазмином, и расщепления их соответствующих ингибиторов [45].
Таким образом, регуляция MMPs сложна и включает не только экспрессию, но и активацию. Кроме того, в некоторых случаях активность ММП может усиливаться или синергетически с сериновыми протеазами системы активации плазминогена, опосредуя ремоделирование ВКМ во время восстановления ткани. Основная функция системы PA заключается в разложении фибрина, и в ее основе лежит зимоген плазминоген, который превращается в активный фермент, плазмин, двумя активаторами плазминогена (PA): активатором плазминогена тканевого типа (tPA) и плазминогеном урокиназного типа. активатор (uPA).Существует несколько ингибиторов системы PA, включая ингибитор активатора плазминогена 1 (PAI-1) и альфа2-антиплазмин, которые действуют на уровне PA или плазмина соответственно [42]. Система PA играет важную роль при мышечной дистрофии. Исследования на мышах mdx выявили повышенную экспрессию uPA в скелетных мышцах, в то время как генетическая потеря uPA усугубила дистрофию и нарушение мышечной функции у мышей mdx, поскольку uPA требуется для предотвращения чрезмерного отложения фибрина [46]. Совсем недавно было показано, что внеклеточный баланс PAI-1 / uPA является важным регулятором биогенеза miR-21, контролируя ассоциированный с возрастом мышечный фиброз и тяжесть заболевания при мышечной дистрофии [17].Было показано, что генетическая потеря PAI-1 у мышей mdx способствует фиброзу мышц посредством нескольких механизмов. Во-первых, он изменял метаболизм коллагена за счет увеличения uPA-опосредованного протеолитического процессинга TGF β в мышечных фибробластах. Во-вторых, он также активировал экспрессию miR-21, которая, в свою очередь, ингибировала PTEN и усиливала передачу сигналов через путь AKT, который контролирует пролиферацию и выживание клеток, тем самым наделяя TGF β замечательной способностью стимулировать пролиферацию клеток. Однако связанный с возрастом фиброгенез и разрушение мышц у мышей mdx, а также развитый фиброз мышц у молодых мышей mdx, лишенных PAI-1, можно предотвратить прямым вмешательством с miR-21 или uPA субстрата PAI-1.В соответствии с этим, принудительная сверхэкспрессия miR-21 в мышцах mdx ускоряла фиброз и увеличивала тяжесть заболевания, тогда как лечение старых мышей mdx ингибитором miR-21 улучшало гомеостаз мышц и уменьшало фиброз. Это важное наблюдение, поскольку фиброз обычно считается необратимым в пожилом возрасте. Необходимы дальнейшие исследования, чтобы уточнить наше понимание роли фиброгенной оси PAI-1 / miR-21 в фиброзе скелетных мышц и течении болезни у пациентов с МДД, но по мере того, как полностью раскрывается роль оси, появятся и новые терапевтические цели. .Из всех этих открытий кажется, что выраженный фиброз в дистрофических мышцах человека, по крайней мере, частично связан с измененной протеолитической активностью в дистрофических мышцах из-за дисбаланса в экспрессии и активности компонентов системы PA / MMP [47].
4. Фиброз, вызванный воспалением
Одним из отличительных признаков МДД являются хронические циклы некроза и восстановления миофибрилл, которые гистологически проявляются как длительная инфильтрация мононуклеарных клеток в мышечную ткань. Следовательно, значительные усилия были направлены на характеристику этих воспалительных клеток, чтобы определить их функции и различия между различными острыми и хроническими (трансгенными / генетическими) моделями повреждения скелетных мышц.Одним из первых событий после повреждения тканей является вторжение воспалительных клеток в место повреждения. В ответ на острое повреждение первыми клетками, инфильтрирующими мышцу, являются в основном лейкоциты, принадлежащие к миелоидной линии, в основном нейтрофилы и моноциты / макрофаги ([48], обзор [49]). Любое нарушение скоординированного инициирования, прогрессирования и разрешения воспаления может привести к стойкому повреждению мышц и нарушению регенерации, что во многих случаях также характеризуется развитием фиброза, наблюдаемого при мышечных дистрофиях (см. Обзор [18]).
Действительно, хорошо известно, что фиброзу предшествует воспаление и влияет на него при некоторых патологиях. В контексте мышечной дистрофии предыдущие исследования показали, что воспалительные макрофаги являются важным источником TGF β в мышце диафрагмы MDX, предполагая, что они могут вносить важный вклад в развитие фиброза [14]. Однако эксперименты по истощению макрофагов или исследование моделей мышей с нарушенным рекрутированием макрофагов продемонстрировали более сложную роль макрофагов в восстановлении мышц и фенотипе mdx, которая либо вредна [50], либо полезна для развития фиброза [46], в зависимости от используемой модели. для учебы.Все больше данных подтверждают ключевую роль «альтернативно активируемых» макрофагов M2 в развитии фиброзных состояний, таких как астма и идиопатический фиброз легких, в отличие от «классически активированных» провоспалительных макрофагов M1 [51]. Эти макрофаги M2 активируются цитокинами, производными Th3, такими как IL-13, и могут быть идентифицированы с помощью специфических маркеров клеточной поверхности, таких как CD206 (также известный как рецептор маннозы). Они также экспрессируют высокие уровни TIMP-1 и хитиназоподобных секреторных лектинов Ym1 и Ym2.Интересно, что TGF β в сочетании с IL-13 может усиливать экспрессию аргиназы I в альтернативно активированных макрофагах, которая является ключевым ферментом в инициации синтеза коллагена фибробластами. Действительно, аргиназа I продуцирует аминокислоту пролин, необходимую для синтеза коллагена [52]. Следует отметить, что диафрагма мышей mdx содержит CD206-положительные макрофаги, экспрессирующие аргиназу I и TGF β , экспрессия которых увеличивается с возрастом, что коррелирует с повышенными уровнями IL-13 [16], что указывает на потенциальное значение активации Th3 / альтернативных макрофагов в дистрофических мышцах. фиброз.Интересно, что в мышцах пациентов с МДД также наблюдается корреляция между количеством альтернативно активированных макрофагов и отложением коллагена [53]. Другие исследования подтвердили наличие субпопуляции альтернативно активированных макрофагов, макрофагов M2c, типа альтернативно активированных макрофагов, индуцируемых противовоспалительным цитокином IL-10 и экспрессирующих аргиназу, наряду с классически активированными макрофагами M1 в дистрофической мышце mdx мышей [54]. Действительно, было показано, что метаболизм аргинина альтернативно активированными макрофагами способствует сердечному и мышечному фиброзу при мышечной дистрофии MDX [55].Однако необходимы дальнейшие исследования, чтобы выяснить точную роль альтернативно активируемых макрофагов в развитии фиброза при мышечных дистрофиях.
Хотя макрофаги M1 важны для пролиферации сателлитных клеток (рассмотрено в [49]), они потенциально могут быть профибротическими в патогенных состояниях, поддерживая хроническое воспаление. Это иллюстрируется провоспалительной ролью фибриногена при мышечных дистрофиях. Фибриноген накапливается в дистрофических мышцах мышей MDX и пациентов с МДД [16, 46], а его генетическое и фармакологическое истощение у мышей MDX может значительно снизить развитие фиброза в диафрагме [16].Интересно, что фибриноген модулирует воспаление, передавая сигнал через интегрин β 2 (Mac-1), который экспрессируется на миелоидных клетках, и индуцирует экспрессию провоспалительных цитокинов и хемокинов ([16] и обзор [56]), тем самым потенциально способствуя дегенерации мышц. Действительно, у мышей, экспрессирующих молекулу фибриногена, мутировавшую в своем β 2 -связывающем мотиве [16, 57], развивается меньший фиброз в диафрагме одновременно со сниженной инфильтрацией макрофагов и сниженной экспрессией провоспалительных цитокинов, что коррелирует с улучшенной регенерацией мышц.
Было показано, что наряду с миелоидными клетками лимфоциты также играют роль в мышечных дистрофиях. Среди этого семейства недавно была повышена потенциальная роль Т-хелперов (Th) и цитотоксических Т-клеток (CTL) в развитии фиброза. Одной из наиболее интересных моделей на животных, по крайней мере частично раскрывающей роль этих клеток в регенерации и фиброзе, является модель мыши scid / mdx. У этих мышей наблюдается дефицит функциональных лимфоцитов (как В-, так и Т-клеток), что позволяет изучать функцию этих клеток при прогрессировании заболевания.Интересно, что у мышей scid / mdx развивается меньший фиброз диафрагмы в возрасте одного года, что коррелирует со снижением белка TGF β в дистрофической мышце [58]. Кроме того, доказательства патогенной роли Т-клеток в прогрессировании мышечных дистрофий получены из исследования с использованием другой модели иммунодефицита на мышах, мышей nu / nu / mdx, у которых отсутствуют только функциональные Т-клетки, но не В-клетки [59]. , и показывая, что Т-клетки способствуют прогрессированию фиброза. Хотя эти модели поддерживают функцию Т-клеток при восстановлении мышц и мышечной дистрофии, они, к сожалению, не различают патологический эффект CTL и Th-клеток, поскольку обе субпопуляции отсутствуют у мышей scid / mdx и nu / nu / mdx.Используя истощающие антитела против антигена CD4 (истощение Th) или антигена CD8 (истощение CTL), было показано, что оба типа клеток способствуют усугублению патологии в контексте мышей mdx [60]. При анализе популяций лейкоцитов, инфильтрирующих дистрофическую мышцу мышей MDX, Vetrone et al. охарактеризовали субпопуляцию Т-хелперных клеток, несущих V β 8.1 / 8.2 TCR (Т-клеточный рецептор) и экспрессирующих высокие уровни белка ЕСМ остеопонтина ([61] и обзор [62]).Используя мышей mdx с дефицитом остеопонтина, авторы показали, что у этих мышей наблюдается меньший фиброз в мышцах диафрагмы, коррелирующий со сниженной инфильтрацией NKT-клеток и нейтрофилов. Эти данные предполагают, что Th-клетки могут опосредовать свои патогенные эффекты, контролируя миграцию и / или выживание этих воспалительных популяций посредством секреции остеопонтина.
Th-клетки могут дифференцироваться на разные функциональные типы, каждый из которых продуцирует различный профиль цитокинов.Их роль в развитии фиброза в тканях, отличных от скелетных мышц, была рассмотрена в других работах [52, 63]. К сожалению, поскольку мыши scid / mdx, nu / nu / mdx или мыши mdx с истощенным CD4 полностью лишены Th-клеток, эти модели не могут выявить роли их различных поляризаций (Th2, Th3, Th27 и Tregs), которые, вероятно, играют неизбыточную и даже противоположную роль в прогрессировании фиброза [64].
5. Фиброипогенные клетки-предшественники при фиброзе
Недавно было обнаружено существование клеток-предшественников, имеющих общие характеристики мезенхимальных стволовых клеток (МСК) в скелетных мышцах [65, 66].Эти клетки были впервые названы FAP для фибро / адипогенных предшественников из-за их способности вступать в жировую и фибробластную дифференцировку in vitro и in vivo [65] и были охарактеризованы как негематопоэтические (CD45 — ), неэндотелиальные (CD31 ). — ) и несателлитные клетки ( α 7 интегрин или SM / C2.6- в зависимости от исследования), но они действительно экспрессировали маркеры клеток-предшественников, такие как CD34 или Sca-1 [65], или маркер фибробластов PDGFR α [66].Хотя нет уверенности в том, что эти два исследования описывают в точности одну и ту же популяцию клеток, вполне вероятно, что они, по крайней мере, тесно связаны или частично совпадают. Существуют разногласия относительно их функции в миогенезе и нормальной регенерации мышц [67, 68], и они недавно были рассмотрены и обсуждены в другом месте [69], но похоже, что эти клетки могут играть патогенную роль в мышечных дистрофиях. Действительно, Uezumi et al. показали, что фиброз происходит почти исключительно от предшественников PDGFR α + в дистрофических мышцах мышей mdx [70].
Интересно, что недавнее исследование охарактеризовало субпопуляцию клеток, экспрессирующих PDGFR α +, Sca1 + и gp38 +, которые также временно экспрессируют Adam12 при остром повреждении [71]. Используя систему отслеживания клонов, было показано, что клетки, экспрессирующие Adam12, легко дифференцируются в миофибробласты in vitro и in vivo . Эти результаты предполагают, что фракция Adam12 + может быть субпопуляцией FAPS, описанной Joe et al., Которая будет более склонной к превращению в настоящие фибробласты.Действительно, истощение фракции MSC Adam12 + снижает накопление ECM, вызванное инъекцией кардиотоксина. Хотя это исследование было выполнено на модели острого повреждения, эти результаты согласуются с тем фактом, что избыточная экспрессия Adam12 у мышей mdx усугубляет фиброз [72] и предполагает, что эта популяция клеток может быть основным фактором развития фиброза в дистрофических мышцах.
В отличие от органов, таких как почки или сердце, где было показано, что различные типы клеток способствуют развитию фиброза [73, 74], в скелетных мышцах очень мало известно о роли других клеточных линий в развитии фиброза и их потенциальном вкладе в развитие фиброза. пул фибробластов.Однако, хотя МСК, вероятно, являются основным источником фибробластов в дистрофической мышце, дополнительные исследования показывают, что другие клетки также могут вносить вклад в фиброз в патологическом контексте. Напр., У старых мышей сателлитные клетки имеют тенденцию превращаться из миогенного в фиброгенный клон в ответ на сигналы окружающей среды, особенно в ответ на передачу сигналов Wnt [75]. Совсем недавно Зордан и его коллеги показали, что инфильтрация макрофагов после острого повреждения необходима для поддержания правильной дифференцировки предшественников, происходящих из эндотелия.Действительно, истощение макрофагов после повреждения привело к переходу эндотелиальных клеток в мезенхимальные [76].
6. Экспериментальные мышиные модели фиброза скелетных мышц
По мере того, как становится все более очевидным, что фиброз является ключевым компонентом патогенеза МДД, потребность в подходящих мышиных моделях, отражающих болезнь человека, становится все более и более насущной, поскольку болезнь у мышей MDX прогрессирование менее тяжелое, чем у людей. У мышей mdx фиброз развивается экстенсивно и исключительно в мышцах диафрагмы в зрелом возрасте [77], тогда как в более доступных мышцах конечностей для развития фиброза требуется почти два года, и он никогда не достигает степени тяжести заболевания человека [17].И это несмотря на то, что мышцы конечностей демонстрируют другие гистологические признаки заболевания человека, такие как воспалительная инфильтрация, центральное зародышеобразование, а также гипертрофированные волокна и волокна малого калибра. Более того, у мышей mdx несколько других клинических проявлений слабо выражены по сравнению с болезнью человека [78].
Для обострения или ускорения фиброза были созданы различные генетические модели мышей. Утрофин — это большой сарколеммальный белок со многими структурными и функциональными особенностями, подобными дистрофину, который активируется в мышцах пациентов с МДД и может частично функционально компенсировать потерю дистрофина.Были получены трансгенные мыши mdx / utrn +/- (мыши mdx с гаплонедостаточностью атрофина), у которых было обнаружено усиление воспаления мышц задних конечностей через 3 и 6 месяцев и только через 3 месяца в диафрагме [79]. Однако к 6 месяцам фиброз был сильным в диафрагме, а в мышцах задних конечностей — незначительным. Желая изучить вопрос о том, являются ли различия в потенциале мышечных стволовых клеток (сателлитных клеток) между мышами и людьми ответственными за прогрессирующий фенотип МДД, Блау и его сотрудники создали дистрофных мышей, лишенных теломеразной активности, путем скрещивания мышей C57Bl6 mdx с мышами C57Bl6, гетерозиготными по теломеразе. Компонент РНК Terc (mTR) [80].Помимо повышенного фиброзного фенотипа, эти мыши также имели несколько других фенотипических характеристик МДД человека, включая глубокую потерю мышечной силы, выносливость (работоспособность на беговой дорожке), повышенные уровни креатинкиназы (КК) в сыворотке крови, накопление отложений кальция в мышцах. тканей и сокращенной продолжительности жизни [81]. Другое исследование изучило различия между мышами и людьми, сосредоточив внимание на составе сиаловой кислоты гликопротеинов и гликолипидов. У людей есть инактивирующая делеция в гене CMAH (цитидинмонофосфат-гидроксилаза сиаловой кислоты), которая предотвращает биосинтез сиаловой кислоты, N-гликолилнейраминовой кислоты во всех человеческих клетках, хотя у мышей эта способность не теряется, и, что не менее важно, Было показано, что гликозилирование является модификатором многих болезненных состояний, включая мышей mdx и мышей с дефицитом α -саркогликана [82, 83].Действительно, генно-инженерные мыши CMAH / mdx показали усиление фиброза, некротических очагов и большее центральное зародышеобразование, чем мыши mdx в возрасте 6 недель, тогда как к 8 месяцам мыши теряли способность передвигаться и демонстрировали снижение выработки силы. Исследования Ardite и соавторов [17] показали, что генетическая потеря ингибитора uPA PAI-1 у мышей с дистрофией mdx усиливала фиброз мышц с помощью нескольких различных механизмов: во-первых, он изменял метаболизм коллагена за счет протеолитического процессинга TGF β , опосредованного uPA в мышцах. фибробласты; потеря PAI-1 также активировала экспрессию miR-21 (через негеномную активность Smad, индуцированную TGF β ), которая, в свою очередь, ингибировала PTEN (фосфатазу и гомолог тензина) и усиливала передачу сигналов AKT, тем самым обеспечивая TGF β замечательным потенциал стимулирования пролиферации клеток на фибробластах.
В соответствии с представлением о том, что метаболизм аргинина аргиназой-2 в макрофагах M2 может приводить к фиброзу, и что количество макрофагов M2, экспрессирующих аргиназу-2, увеличивается в мышцах и сердцах дистрофических мышей, удаление аргиназы-2 в mdx у мышей значительно уменьшился фиброз в мышцах конечностей и диафрагмы [54]. Напротив, добавление L-аргинина молодым мышам mdx способствовало более тяжелому фиброзу мышц, чем мышам MDX, получавшим D-аргинин, подтверждая роль аргиназы в патогенезе фиброза и заболевания [54].Следует отметить, что L-аргинин, но не D-аргинин, является естественным субстратом для синтазы оксида азота (NOS). Таким образом, следует проявлять осторожность, поскольку многим пациентам с МДД часто назначают добавки аргинина, и необходимо провести дополнительные исследования, чтобы проанализировать его влияние на болезнь.
Исследование Fukada et al. показали, что мыши на фоне DBA / 2 демонстрируют слабый процесс регенерации после повторного повреждения. Более того, мыши mdx на фоне DBA / 2 (D2-mdx) демонстрируют серьезную потерю веса скелетных мышц и более высокую мышечную слабость, в то время как фиброз и накопление жира значительно увеличиваются по сравнению с мышами mdx на фоне C57Bl10 [84].
Тем не менее, ни одна из этих моделей mdxmouse не имитирует в точности патофизиологию дистрофического заболевания человека, и это одна из причин, почему трудно изучить методы лечения, позволяющие остановить прогрессирование фиброза при МДД.
В дополнение к генетическим моделям стремление преодолеть наше плохое понимание молекулярных механизмов, лежащих в основе фиброгенеза при МДД, побудило к разработке новых экспериментальных процедур, которые можно использовать для эффективного усиления или ускорения фиброза у молодых мышей mdx обеих задних конечностей без дождаться его естественного физиологического начала.
Было продемонстрировано, что механическое повреждение мышц в результате ежедневных повторных микромульпункций в течение 14 дней вызывает фиброзные поражения в мышцах задних конечностей mdx, которые, следовательно, имеют сходную картину с мышцами диафрагмы [85]. В этой модели пункции выполняются случайным образом на всей поверхности передней большеберцовой мышцы. В отличие от инъекции токсина, которая вызывает повреждение всей мышцы, микрошпильки вызывали несколько локальных повреждений миофибрилл, которые при ежедневном повторении вызывают хроническое повреждение.Более физиологичным методом было использование физических упражнений, которые, как известно, усугубляют процесс дегенерации / регенерации мышц за счет усиления некроза волокон и усиления воспалительных реакций [86]. После одного месяца тренировок в мышцах задних конечностей индуцируется фиброгенез, который еще больше усугубляется длительным режимом физических упражнений. Альтернативные и более быстрые способы вызвать фиброз в мышцах конечностей мышей MDX основаны на хирургических и химических повреждениях, таких как разрыв или денервация.Разрыв состоит в глубоком разрезе мышцы [87], который вызывает задержку процесса заживления, в то время как модель денервации включает разрезание седалищного нерва, вызывая атрофию денервированных миофибрилл [88]. Это два эффективных метода индукции стойкого фиброза, недостатком которых является ограниченная площадь пораженной мышцы и, следовательно, доступная для отбора проб, или количество пораженных мышц, соответственно.
7. Лечение фиброза и клинические перспективы при МДД
Развитие фиброза является следствием хронической дегенерации и нарушения регенерации дистрофической мышцы, что само по себе вызвано потерей гена дистрофина.В то время как основной целью генной или клеточной терапии остается замена отсутствующего гена и, таким образом, излечение корней болезни путем воздействия на причину дегенерации мышц, предотвращение прогрессирования фиброза следует рассматривать как дополнительную терапию по нескольким причинам. Во-первых, развитие фиброза может негативно повлиять на клеточную и генную терапию за счет уменьшения количества ткани-мишени, доступной для восстановления. Во-вторых, предотвращение фиброза само по себе потенциально может улучшить качество жизни и продолжительность жизни пациентов с дистрофией.Несколько фармакологических методов лечения, нацеленных на фиброзные клетки или молекулы, в настоящее время проходят испытания, и некоторые из них демонстрируют многообещающие эффекты на моделях человека и животных [89].
Одним из сигнальных путей, участвующих в развитии фиброза, является система RAS (как обсуждалось выше). Некоторые компоненты этой системы использовались в качестве мишеней для уменьшения дистрофического мышечного фиброза на животных моделях. Было показано, что введение антагониста рецепторов ангиотензина 2 типа 1 лозартана, который обычно используется для лечения высокого кровяного давления, улучшает мышечную силу и уменьшает фиброз у мышей dy (2J) / dy (2J) с ламинином- α 2- недостаточная врожденная мышечная дистрофия [90].Другие исследования также показали улучшение мышечной функции и уменьшение фиброза у мышей после лечения лозартаном, связанного с кардиотоксиновым повреждением и саркопенией, вызванной иммобилизацией задних конечностей [91], уменьшением мышечного фиброза после разрыва [92] и уменьшением сердечного фиброза у мышей MDX [93].
Другие молекулы нацелены на РАС, ингибируя АПФ. Например, лизиноприл является ингибитором АПФ, который, как было показано, сохраняет целостность сердечных и скелетных мышц у мышей MDX [94]. Действительно, из-за положительных доклинических эффектов, продемонстрированных для лозартана и лизиноприла, недавнее двойное слепое рандомизированное клиническое исследование было начато для сравнения лизиноприла с лозартаном для лечения кардиомиопатии у пациентов с МДД [95].Оба препарата уже доказали свою эффективность для лечения дилатационной кардиомиопатии. Как и лизиноприл, введение ингибитора АПФ эналаприла мышам MDX снижает фиброз скелетных мышц [35]. Интересно, что лечение мышей mdx пептидом ангиотензин-1-7 (Ang 1-7) имело эффект, противоположный эффекту ангиотензина 2, в том смысле, что оно улучшало мышечный фиброз за счет ингибирования передачи сигналов TGF β и одновременного уменьшения количества фибробластов. [40].Взятые вместе, эти результаты предполагают, что нацеливание на РАС может быть многообещающим способом задержки прогрессирования фиброза при МДД.
Нацеливание на профибротические факторы роста или цитокины для замедления развития фиброза также дало многообещающие результаты. Введение антитела FG-3019, которое нейтрализует CTGF, или введение нейтрализующего антитела против TGF β улучшает фенотип мышей mdx, задерживая развитие фиброза [96]. Однако, поскольку TGF β и CTGF являются плейотропными молекулами, нацеливание на них часто вызывает нежелательные побочные эффекты, такие как увеличение количества провоспалительных CD4 + Т-клеток, инфильтрирующих мышцу [96].
Иматиниб является ингибитором рецепторов тирозинкиназы, включая PDGFR α , который первоначально использовался для лечения рака у человека. Было показано, что его введение полезно при мышечной дистрофии у мышей MDX [97]. Интересно, что иматиниб, по-видимому, специфически нацелен на мезенхимальные предшественники, ингибируя как их пролиферацию, так и экспрессию маркеров фиброза in vitro [98]. Другие молекулы, которые, как известно, обладают противовоспалительным действием, также показали положительные эффекты, задерживая прогрессирование фиброза в мышцах mdx, включая галофугинон, синтетическое галогенированное производное природной молекулы фебрифугина [99].Было показано, что галофугинон значительно улучшает гистопатологию мышц и фиброз на модели мышей с дефицитом дисферлина [100]. Интересно, что галофугинон, как известно, специфически ингибирует дифференцировку клеток Th27 [101], предполагая, что эта молекула может действовать, модулируя воспаление в дистрофической мышце. Действительно, недавно завершившееся клиническое испытание (ссылка NCT01847573, http://clinicaltrials.gov/show/NCT01847573) оценило безопасность и переносимость галофугинона у пациентов с МДД, но в течение некоторого времени данных об эффективности не будет.Однако, несмотря на то, что несколько лекарств показали многообещающие результаты на животных моделях, лишь немногие из них прошли клинические испытания на пациентах с МДД.
8. Заключительные замечания и перспективы
Фиброз — это чрезмерное отложение компонентов ECM, которое иногда возникает в результате нерегулируемых или хронических процессов повреждения и восстановления. Пациенты с МДД имеют характерные признаки некроза и восстановления мышц со стойким фиброзом в мышцах в молодом возрасте, что играет важную роль в прогрессирующем характере заболевания и сокращении продолжительности жизни.Однако модель МДД на мышах mdx обычно не вызывает обширного фиброза конечностей, особенно в молодом возрасте, и имеет несколько других отличий от болезни человека. Здесь мы рассмотрели некоторую недавнюю литературу, в которой пытались преодолеть различия между этими видами, чтобы разработать лучшие модели для изучения состояния человека, улучшить существующие методы лечения и открыть дверь для новых. Было показано, что недавние животные модели являются лучшими инструментами для выяснения роли новых клеточных медиаторов в репарации и фиброзе, включая субпопуляции воспалительных и мезенхимальных клеток, но идентичность реальных клеток, продуцирующих ЕСМ, в скелетных мышцах остается неуловимой.Более того, методы сортировки клеток у мышей часто сложно воспроизвести у пациентов-людей из-за различий в маркерах клеточной поверхности и отсутствия материала образца, достаточного для извлечения значительного количества клеток. Были достигнуты успехи в идентификации новых факторов роста и цитокинов, а также их компонентов передачи сигналов, которые также являются важными мишенями для улучшения фиброза. Наряду с новыми достижениями в нацеливании на TGF β с помощью антител, недавнее влияние системы RAS на фиброз также может оказаться важным механизмом, поскольку на рынке уже есть много одобренных препаратов, которые способны модулировать эту систему и потенциально производить полезные эффекты.Однако, несмотря на все обещания, полученные при лечении мышей, на сегодняшний день было проведено несколько клинических испытаний. Хотя это расстраивает пациентов и их семьи, необходимо также проявлять осторожность при слишком быстром продвижении, поскольку все еще существует много неизвестных и много явных различий в мышечной патологии и развитии фиброза между пациентами с МДД и мышами MDX, которые могут неожиданно реагировать на лечение.

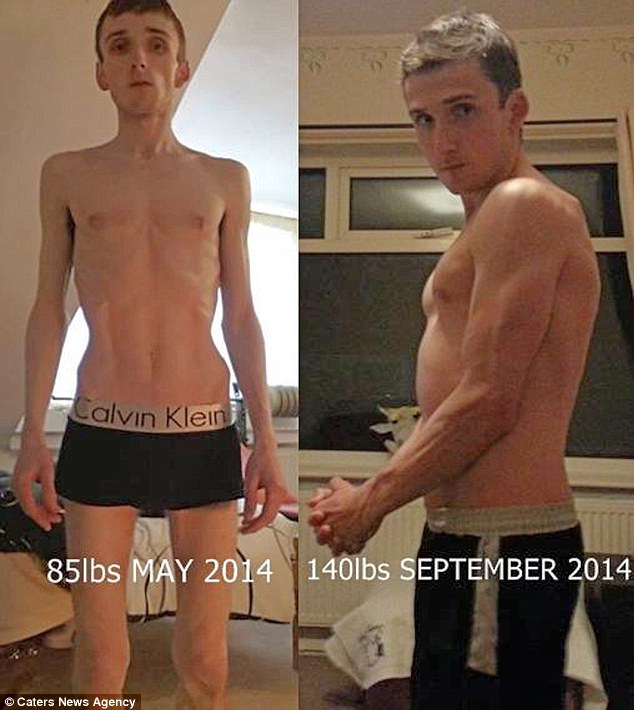
 Глубоко корят себя за мнимый лишний вес.
Глубоко корят себя за мнимый лишний вес.